HAL Id: tel-00814990
https://tel.archives-ouvertes.fr/tel-00814990
Submitted on 18 Apr 2013
HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est
Rôle des lipoprotéines associées au virus de l’hépatite C
et des microtubules dans l’entrée du virus dans la cellule
et l’établissement de l’infection
Marine Walic
To cite this version:
Marine Walic. Rôle des lipoprotéines associées au virus de l’hépatite C et des microtubules dans l’entrée du virus dans la cellule et l’établissement de l’infection. Virologie. Université Pierre et Marie Curie - Paris VI, 2010. Français. �NNT : 2010PA066101�. �tel-00814990�
Université Pierre & Marie Curie - Paris 6 Unité HEPACIVIRUS ET IMMUNITE INNEE
15, rue de l’école de médecine Institut Pasteur
75270-PARIS Cedex 06 28, rue du Docteur Roux
75015 PARIS Ecole Doctorale B2M / B3MI
Bâtiment Lamarck – 35, rue Hélène Brion 75013 PARIS
Thèse de Doctorat de l Université Paris 6 Pierre et Marie Curie
Ecole Doctorale B2M – Biochimie et Biologie Moléculaire
Spécialité
Virologie Fondamentale
Présentée par
Marine WALIC
Pour obtenir le titre de Docteur de l’Université Paris 6
Sujet de la thèse
ROLE DES LIPOPROTEINES ASSOCIEES AU VIRUS DE L HEPATITE C ET DES MICROTUBULES DANS L ENTREE DU VIRUS DANS LA CELLULE ET
L ETABLISSEMENT DE L INFECTION
Soutenue le 18 Février 2010, devant le jury composé de
Pr. Vincent Maréchal : Président du jury
Pr. Patrice André : Rapporteur
Pr. Philippe Roingeard : Rapporteur
Dr. Thierry Huby : Examinateur
Dr.Florence Colbère-Garapin : Examinateur
RESUME
L’hépatite C reste un problème majeur de santé publique. Malgré la mise au point d’un modèle de réplication du virus de l’hépatite C (VHC) in vitro, les mécanismes conduisant à l’infection restent encore mal connus. Le VHC est sécrété et circule dans le sérum associé à des lipoprotéines. L’importance des lipoprotéines pour le cycle viral nous a conduits à étudier le rôle de la lipoprotéine lipase (LPL), une enzyme lipolytique, dans l’infection de la cellule par le VHC.
Nous avons montré que la LPL potentialise l’attachement et l’internalisation du virus par un mécanisme similaire à la clearance hépatique des lipoprotéines. La LPL dimérique forme un pont entre les lipoprotéines associées au virus et les HSPG à la surface des cellules. Néanmoins son action conduit à une inhibition de l’infection par les souches virales JFH-1 et J6/JFH-1 produites en culture cellulaire et dans les hépatocytes humains greffés à des souris chimériques uPA-SCID. L’analyse par ultracentrifugation en gradient d’iodixanol des virus produits in vitro et in vivo a montré la présence de deux populations virales : la première, de densité très faible, est beaucoup plus infectieuse que la seconde, de densité plus élevée. L’infection in vitro par ces deux populations virales est inhibée par la LPL. La LPL représente donc un nouvel inhibiteur de l’infection par le VHC.
Nous avons également démontré que la présence d’un réseau de microtubules intact et dynamique est cruciale pour l’entrée du VHC et les étapes post-fusion qui mènent à l’infection. Enfin, nous avons mis en évidence une interaction de la protéine de capside avec les tubulines α et β, conduisant à une augmentation de la polymérisation des microtubules. Ces observations suggèrent que le VHC pourrait utiliser les mécanismes de polymérisation des microtubules pour établir l’infection, et la protéine de capside jouer un rôle essentiel dans ce processus.
Les nouvelles approches antivirales pourraient donc cibler les éléments du cytosquelette et/ou des lipoprotéines associées aux particules virales.
ABSTRACT
Hepatitis C virus (HCV) infection remains a major health problem. Despite of the development of a cell culture system permitting HCV replication in vitro, the mechanisms leading to infection are still not well understood. HCV is secreted and circulates in the patient serum in association with lipoproteins. The importance of lipoproteins for the virus life cycle led us to investigate a role of lipoprotein lipase (LPL), a lipolytic enzyme, in the cell infection with HCV.
We showed that LPL increases virus attachment and internalisation by mechanisms similar to the hepatic uptake of lipoproteins. Dimeric LPL forms a bridge between virus-associated lipoproteins and HSPG at the cell surface. Nevertheless, LPL inhibits cell infection with two virus strains: JFH-1 and J6/JFH-1, produced either in cell culture, or in chimeric uPA-SCID mice with transplanted human hepatocytes.
Analyses of the viruses produced in vitro and in vivo in iodixanol gradients showed the presence of two virus populations banding at very low and higher density, the first population being much more infectious than the latter one. Cell infection with low and higher density viruses was inhibited by LPL. Thus, LPL represents a novel inhibitor of HCV infectivity.
We showed that the intact and dynamic microtubules are crucial for HCV cell entry and early post-fusion steps, leading to productive infection. In addition, we provided evidence that HCV core protein directly interacts with α/β tubulin, increasing polymerisation of microtubules. These observations suggest that HCV could use microtubule polymerisation mechanisms to establish infection, in which virus core protein might play an important role.
New anti-viral approaches may thus target the elements of the cytoskeleton and/or lipoproteins associated with virus particles.
« La science consiste à passer d'un étonnement à un autre. »
Aristote
« Savoir s'étonner à propos est le premier pas fait sur la route de la découverte. »
A Mamy
Serrez vos grands-parents dans vos bras et dites : "Merci d'avoir fait ce que tu as fait pour que je puisse exister !"
Alex Haley
La vie n'a pas d'âge. La vraie jeunesse ne s'use pas.
On a beau l'appeler souvenir, On a beau dire qu'elle disparaît,
On a beau dire et vouloir dire que tout s'en va, Tout ce qui est vrai reste là.
Quand la vérité est laide, c'est une bien fâcheuse histoire, Quand la vérité est belle, rien ne ternit son miroir.
Les gens très âgés remontent en enfance Et leur cœur bat
Là ou il n'y a pas d'autrefois.
REMERCIEMENTS
Je tiens tout d’abord à remercier le Dr Agata Budkowska pour m’avoir accueillie dans son groupe et initiée au monde du virus de l’hépatite C. Merci de m’avoir encadrée durant ces années de thèse, d’avoir dirigé mon travail avec attention et optimisme, de m’avoir toujours poussée à dépasser mes limites : cela a parfois été dur mais toujours extrêmement formateur et, ensemble, nous avons réussi. Un immense merci également pour ta confiance sans laquelle je n’aurais sans doute jamais eu la chance, en tant qu’étudiante, de présenter mes résultats lors d’un prestigieux congrès international.
Je remercie également chaleureusement le Dr Eliane Meurs pour m’avoir accueillie au sein de son Unité, avoir appuyé mes demandes de financements, ainsi que pour ses conseils précieux durant ces trois années.
Je tiens à remercier le Pr Vincent Maréchal pour avoir accepté de présider mon jury de thèse ainsi que pour sa disponibilité, sa gentillesse et son immense soutien. Je remercie le Pr Patrice André et le Pr Philippe Roingeard pour avoir gentiment accepté de lire mon manuscrit, apporté leur avis sur ce travail et d’en être juges. Merci également aux Dr Thierry Huby et Dr Florence Colbère-Garapin pour avoir accepté de participer à mon jury de thèse en tant qu’examinateurs.
Un immense merci au Dr Patrick Maillard pour sa patience infinie en me formant depuis mon arrivée au laboratoire à quelques-unes des nombreuses techniques qu’il maitrise parfaitement. Merci pour les explications détaillées, l’aide apportée et pour le soutien, autant technique que moral, il m’a été précieux, surtout les derniers mois. Merci également d’avoir supporté, en tant que voisin de bureau, toutes mes « divagations philosophiques ». Pour que cela ne te manque pas trop, je le répète encore une fois : la vie est belle donc profitons-en au maximum !
Merci également au Dr Ursula Andréo pour sa disponibilité et sa patience lors de mon arrivée, ses conseils avisés avant de me « passer le bébé ». Un immense merci au Dr Farzin Roohvand pour son optimisme sans limite, sa devise “Don’t worry, be happy” me suis maintenant partout, ainsi que pour son soutien permanent, sa gentillesse et ses nombreux conseils et coups de main à tout instant. Je remercie également Andrea Cerutti (l’accent du Sud, c’est du soleil dans le labo) et le Dr Olga Kalinina (avoir fait ta connaissance a été un plaisir, même si tu es restée peu de temps) pour leur gentillesse et leur soutien. Merci aussi à tous les membres de l’Unité HII, présents et passés : Stéphanie (pour moi un des piliers du labo), Noëlla (ta joie de vivre et ton slogan « Force et
Espoir » illuminent le labo), Damien (toujours présent, un réel soutien), Malek (because of our friendship, you gave me self-confidence and I’m now speaking fluent english), Myriam, Noémie, Emilie, Erwan, Marie : vous avez tous été présents à un moment ou à un autre en cas de besoin, que ce soit pour les coups durs ou pour de bonnes crises de fou rire ! Merci à Josiane pour sa patience et son aide précieuse dans les méandres du monde administratif.
Un énorme merci aux petites Vamps de l’étage Chantal et Momo, ainsi qu’à Katie, toujours présentes, toujours le mot qu’il faut quand il faut, et plus que tout, gardez à l’esprit que sans vous, les labos ne tourneraient plus, ce qui est malheureusement trop souvent oublié. Votre aide a été infiniment précieuse.
Merci à tous les membres du 3ème étage du bâtiment Lwoff, que ce soit pour leur aide et leur amitié : Yves Rivière et Florence Buseyne pour m’avoir initiée à la recherche en P3, Louise-Marie pour son soutien et nos conversations au détour d’un couloir, Monica, Valentina et Céline, Yann, Shirine et Delphine : tant de soirées et weekends au labo avec vous, de belles amitiés et une grande solidarité entre thésards.
Je tiens aussi à remercier toutes les personnes de Lwoff qui m’ont soutenue toutes ces années : Philippe, Sylviane, Bosco, Jocelyne, Simona, Manu, Isma, Greg, Minerva, Myrtille, Monica, Marie, Rodolphe, Florence et tous les autres.
Merci à tous ceux avec qui j’ai eu la chance de collaborer : Emmanuelle Perret de la Plateforme d’Imagerie, qui m’a ouvert les portes du monde de la microscopie, les Dr Patrick Maurel et Dr Claire Gondeau à Montpellier, pour m’avoir initiée aux mystères de la culture d’hépatocytes humains primaires.
Je ne saurais suffisamment remercier le Dr Christophe Préhaud, Françoise Mégret, le Dr Monique Lafon et le Dr Caroline Demeret pour l’énorme soutien qu’ils m’ont apporté, d’une façon ou d’une autre, durant toutes ces années. Chris, merci de tes conseils avisés et de m’avoir, par ce stage de Master 1, permis de démarrer ces années Pasteuriennes extrêmement enrichissantes.
Merci aux nombreuses personnes sur le campus pour les différents services apportés et aux personnes rencontrées lors de pauses devant le bâtiment pour des conversations toujours passionnantes. Merci Christine pour m’avoir initié à l’art du Tay Son Vo Dao à Pasteur.
Merci également à toutes les personnes qui, dans mon parcours universitaire, ont participé de près ou de loin à mon plan de carrière : Nicole Perret, Vincent Maréchal, Noël Tordo, Simona Ozden, Uriel Hazan.
Un immense merci à tous mes amis, entre confidences, fous-rires, moments de détente bien mérités, vous m’avez une fois de plus prouvé que l’on est riche de ses amis. Merci à la joyeuse bande du
Master 2 : Raph (ton oreille toujours attentive et tes conseils avisés dans tous les domaines), Rom (tout n’a pas été facile, mais tu m’as soutenue dans des moments durs et je t’en remercie), Yann (ta légendaire réserve de gâteaux et bonbons en tout genre, mais pas que…), Audrey (toujours à l’écoute et de bon conseil, même depuis les lointaines contrées canadiennes), Nadia (la joie de vivre incarnée, revisitée par l’esprit gabonais), Jean (tes allers-retours Paris/HK et tes anecdotes ont rythmé ces années), et tous les autres (je ne peux tous vous citer mais vous vous reconnaitrez), aux amis rencontrés grâce aux hasards de la vie, à Eric (best friend forever) et toute la fameuse bande des anciens de P1, 10 ans d’amitié déjà, et de nombreuses années d’amitié encore en perspective !
Merci à Saint-Malo pour m’avoir fait découvrir ce que « havre de paix » voulait dire… (Ce fut court mais intense !).
Je ne saurais jamais assez remercier ma famille, Maman et Pierrette (Tata Pépette), pour m’avoir toujours soutenue dans mon parcours, et plus particulièrement durant ces années de thèse, merci mille fois pour votre confiance, pour tout ce que vous avez fait pour moi… En toute sincérité le mot merci n’est pas assez fort, donc faute de mieux voici cette citation : « L'amour d'une maman, c'est la conviction que ses poussins sont des cygnes, ce qui est la meilleure façon de donner du moral à des enfants qui sont convaincus d'être de vilains petits canards », Pam Brown. Pour répondre à notre « Private Joke » : non, je ne serai pas fleuriste !!! :-)
Mamy, tu me manques chaque jour qui passe… J’aurais tant aimé que tu vois mes rêves se réaliser. Merci à l’infini, c’est grâce à toi que je suis devenue ce que je suis maintenant, merci de me protéger et de m’aider à tout instant ! A vous trois, je vous aime !!!
Je ne peux manquer également de remercier ma ménagerie de compèt’ : Géro, Max, Lao, Nuts, Douchka, Tigrou, vous aussi par votre compagnie et même vos bêtises, vous m’avez aidée tout ce temps.
Enfin, un énorme merci à mon Nico pour être auprès de moi chaque jour, de me soutenir, me comprendre, d’être attentif, doux et protecteur comme tu sais si bien l’être et surtout de m’avoir supportée ces derniers temps, le stress m’a rendu atroce, j’en suis sincèrement désolée ! Merci de me faire sentir qu’à tes côtés, notre amour nous rend fort et que rien n’est impossible. « Aimer, ce n'est pas regarder l'un l'autre, c'est regarder ensemble dans la même direction. » Saint-Exupery. Nous le prouvons en permanence !
Cette thèse a été réalisée avec le soutien financier de l’ANRS et de la Fondation
TABLE DES MATIERES
LISTE DES ABREVIATIONS ... 19
LISTE DES FIGURES ET TABLEAUX ... 21
AVANT-PROPOS ... 23 INTRODUCTION ... 29 HEPATITECETVHC ... 31 I. Hépatite C ... 31 1. Epidémiologie ... 31 2. Mode de transmission ... 31 3. Diagnostic ... 33
4. Symptômes et Evolution de la maladie ... 35
5. Rôle de la réponse immunitaire contre le VHC dans l’évolution de l’infection ... 37
6. Traitement ... 39
II. Le virus de l’hépatite C ... 41
1. Caractéristiques générales ... 41
1.1. Organisation génomique ... 43
1.2. Variabilité génétique ... 43
2. Formes naturelles du VHC ... 45
2.1. Les particules virales de faible densité ... 47
2.2. Les exosomes ... 47
2.3. Les nucléocapsides ... 49
2.4. Les virus enveloppés ... 49
3. Cycle viral ... 49
3.1. Récepteurs putatifs, attachement et entrée virale ... 51
3.2. Traduction et maturation ... 59
3.3. Réplication ... 59
3.4. Morphogénèse et sécrétion ... 61
3.5. Transmission intercellulaire de l’infection ... 63
4. Protéines virales ... 65
4.1. Protéines structurales... 65
4.2. Protéines non structurales ... 73
III. Modèles expérimentaux ... 77
1. Modèles d’étude du VHC in vitro ... 77
1.1. Modèle réplicon ... 79
1.2. Pseudo particules virales ... 79
1.3. Modèles de culture cellulaire ... 81
2. Modèles d’étude du VHC in vivo ... 83
2.1. Chimpanzés ... 83
2.2. Tupaïas ... 83
2.3. Tamarins ... 85
2.4. Souris transgéniques uPA-SCID avec greffe d’hépatocytes humains ... 85
LE VHC ET LE METABOLISME DES LIPOPROTEINES ... 89
I. Les différentes classes de lipoprotéines ... 89
1. Formation des VLDL ... 91
2. Formation des chylomicrons ... 91
3. Les récepteurs aux lipoprotéines ... 93
3.1. La famille des récepteurs aux LDL ... 93
3.2. Le récepteur scavenger SR-B1 ... 93
3.3. Les HSPG ... 95
II. Les enzymes lipolytiques... 95
1. La lipoprotéine lipase (LPL) ... 95
1.1. Structure ... 97
1.2. Fonctions ... 97
2.1. Structure ... 101
2.2. Fonctions ... 101
III. Transport des lipoprotéines ... 103
1. Voie des lipides exogènes ... 103
2. Voie des lipides endogènes ... 105
3. Voie du transport reverse du cholestérol ... 105
IV. Interaction VHC - lipoprotéines ... 105
LE VHC ET LE TRANSPORT PAR LES MICROTUBULES ... 111
I. Les microtubules ... 111
1. Structure ... 111
2. Protéines moteurs ... 113
2.1. La kinésine ... 113
2.2. La dynéine ... 115
3. Fonctions dans une cellule normale ... 115
4. Fonctions dans une cellule infectée ... 115
II. Cytosquelette et VHC ... 117
OBJECTIFS DE THESE ... 121
RESULTATS ... 125
PARTIE I :ROLE DE LA LIPOPROTEINE LIPASE ET DES LIPOPROTEINES ASSOCIEES AU VIRUS DANS L ENTREE ET L INFECTION DE LA CELLULE PAR LE VHC... 129
Article 1 ... 141
Article 2 ... 161
PARTIE II : ROLE DU RESEAU DE MICROTUBULES DANS L ENTREE DU VHC ET LES ETAPES PRECOCES DE L INFECTION ... 197 Article 3 ... 209 DISCUSSION ET PERSPECTIVES ... 225 CONCLUSION GENERALE ... 247 BIBLIOGRAPHIE ... 251 ANNEXES ... 263 NOTES ... 275
LISTE DES ABREVIATIONS
aa : Acide Aminé
ADRP : Adipocyte Differentiation-Related Protein
AG : Acides Gras
ALAT : Alanine AminoTransférases Apo : Apolipoprotéine
ARFP : Alternative Reading Frame Protein ASAT : Aspartate AminoTransférases CETP : Cholesterol Ester Transfer Protein CHO : Chinese Hamster Ovary
CLDN : Claudine
CRE : Cis-acting Replication Element Ct : C-terminal
DC-SIGN : Dendritic Cell- Specific Intracellular adhesion molecule-3-Grabbing Non-integrin
ECMV : Virus de l’encéphalomyocardite EIA : Enzyme linked ImmunoAssay ELISA : Enzyme linked Immunosorbent Assay
FFA : Free Fatty Acid
FXR : Farnesoide X Receptor GAG : Glycosaminoglycanes HCC : HépatoCarcinome Cellulaire HCVcc : HCV cell culture
HCVpp : HCV pseudoparticle HDL : High Density Lipoprotein HL : Hepatic Lipase
HSPG : Héparanes Sulfates Protéoglycanes hVAP-A : human Vesicle-Associated Membrane Protein-Associated Protein HVR : Hyper Variable Region
IDL : Intermediar Density Lipoprotein IFN : Interféron
Ig : Immunoglobuline IL : Interleukine
IRES : Internal Ribosomal Entry Site JFH : Japanese Fulminant Hepatitis LD : Lipid Droplets
LDL : Low Density Lipoprotein LPL : Lipoprotéine Lipase
LRP : LDL-receptor Related Protein L-SIGN : Liver- Specific Intracellular adhesion molecule-3-Grabbing Non-integrin
LVP : Lipo-Viro-Particules
MLV : Virus de la leucémie murine MP : Membrane plasmique
MTOC : Microtubules-Organizing Center MTP : Microsomal Transfer Protein NC : Non codant
NK : Natural killer cell NO : Nitric oxyde Nt : N-terminal
NTR : Non-Translated Region
OMS : Organisation Mondiale de la Santé PEG : Polyéthylèneglycol
PPAR : Peroxisome Profiferator-Activated Receptor
PTB : Polypyrimidine Tract Binding protein
RAP : Receptor Associated Protein RE : Reticulum Endoplasmique
RIBA : Recombinant ImmunoBlot Assay RVS : Réponse Virologique Soutenue RT-PCR : Reverse Transcription-Polymerase Chain Reaction RXR : Retinoic Acid Receptor SCID : Severe Combined Immuno Deficiency
siRNA : small interference ARN SR-B1 : Scavenger Receptor Classe B Type 1
STAT-C : Specifically Targeted Antiviral Therapy for hepatitis C
TG : Triglycéride
THL : Tétrahydrolipstatine TM : Transmembranaire TNF : Tumor Necrosis Factor
TRL : Triglyceride Rich ApoB-containing Lipoprotein
VHC : Virus de l’Hépatite C
VIH : Virus de l’Immunodéficience Humaine
VLDL : Very Low Density Lipoprotein VLP : Virus Like Particles
LISTE DES FIGURES ET TABLEAUX
Figure 1 : Prévalence mondiale de l’infection par le VHC ... 32 Figure 2 : Evolution de l’infection par le VHC ... 34 Figure 3 : Profil d’une hépatite C évoluant vers la chronicité ... 36 Figure 4 : Organisation génomique du VHC et maturation de la polyprotéine ... 42 Figure 5 : Représentation schématique de la répartition des différentes formes virales sériques visualisées en microscopie électronique en fonction de leur densité ... 44 Figure 6 : Cycle viral du VHC ... 48 Figure 7 : Représentation schématique des récepteurs putatifs du VHC ... 50 Figure 8 : Modèle d’entrée virale du VHC ... 56 Figure 9 : Modèle d’inhibition de l’entrée virale par EWI-2wint ... 58 Figure 10 : Modèle de morphogénèse du VHC ... 62 Figure 11 : Structure et association membranaire des protéines du VHC ... 64 Tableau 1 : Protéines virales et leur fonction dans le cycle viral du VHC ... 66 Figure 12 : Représentation des domaines linéaires de la protéine de capside ... 68 Figure 13 : Schéma de la protéine de capside du VHC ... 70 Figure 14 : Association de la protéine de capside du VHC aux gouttelettes lipidiques ou lipid droplets (LD) ... 72 Figure 15 : Fonctions connues de la protéine de capside du VHC ... 74 Figure 16 : Modèles in vitro d’étude du VHC ... 78 Figure 17 : Virus produit en culture cellulaire (HCVcc) ... 80 Figure 18 : Modèle de souris transgéniques « humanisées » ... 84 Figure 19 : Schéma d’une lipoprotéine ... 88 Tableau 2 : Composition en lipides et protéines des lipoprotéines majeures ... 90 Tableau 3 : Liste des diverses lipases humaines ... 94 Figure 20 : Structure de la LPL ... 96 Figure 21 : Fonctions de la lipoprotéine lipase (LPL) ... 98 Figure 22 : Voie des lipides exogènes ... 102 Figure 23 : Voie des lipides endogènes ... 104 Figure 24 : Voie du transport reverse du cholestérol ... 106 Figure 25 : Modèle de cosynthèse du VHC avec les ApoB ... 108 Figure 26 : Structure d’un microtubule ... 110 Figure 27 : Modèles de polymérisation dynamique ... 112 Figure 28 : Organisation des microtubules dans une cellule épithéliale hépatique polarisée 114 Figure 29 : Représentation schématique des protéines moteurs et protéines associées ... 116 Figure 30 : Transport dans la cellule ... 118 Figure 31 : Modèle décrivant le rôle putatif de l’association protéine de capside/LD dans le cycle viral du VHC ... 120 Figure 32 : Mécanisme d’entrée virale médiée par la LPL ... 122 Figure 33 : Approche expérimentale pour l’étude du rôle de la LPL sur l’infection par le VHC, in vitro et in vivo ... 154 Figure 34 : Rôle de SR-B1 dans l’entrée du VHC naturel ... 228 Figure 35 : mécanisme d’action de la LPL sur l’entrée du VHC ... 230 Figure 36 : Modèle d’entrée du VHC dans la cellule médiée par la LPL ... 236
Le virus de l’hépatite C (VHC) représente le premier virus de l’histoire de la virologie moderne à avoir été identifié par les techniques de biologie moléculaire (Choo et al. 1989). Cependant, après 20 ans de recherches, plusieurs aspects majeurs concernant l’hépatite C ne sont toujours pas résolus.
D’une part, celle-ci reste un problème majeur de santé publique avec près de 3% de la population mondiale infectée (site internet OMS, 2007). Le passage à la chronicité est très élevé, avec évolution vers une cirrhose et à terme un hépatocarcinome cellulaire, et les traitements actuels restent peu efficaces, et associés à de nombreux effets secondaires indésirables.
D’autre part, en dépit des progrès rapides en biologie moléculaire, nos connaissances sur certaines étapes du cycle viral, notamment l’entrée virale et la morphogénèse, et sur la nature même des particules virales restent limitées. Leur compréhension demeure actuellement un objectif majeur de la recherche fondamentale sur le VHC.
La mise au point en 2005 par Wakita et al d’un modèle cellulaire permettant une infection productive avec sécrétion de particules infectieuses a constitué une avancée majeure dans la recherche sur le VHC (Wakita et al. 2005; Zhong et al. 2005; Lindenbach et al. 2006). En dépit de ses limites intrinsèques, ce système représente actuellement le modèle de référence pour l’étude du VHC en culture cellulaire.
En outre, ce virus possède certaines particularités : plusieurs formes virales circulent dans le sérum de patients et présentent un profil de densité très hétérogène, du fait de leur association à des lipoprotéines et que ces particules soient recouvertes d’anticorps (Thomssen al. 1992; Hijikata et al. 1993; Prince et al. 1996). Les particules de plus faible densité correspondent aux densités de l’apolipoprotéine B (ApoB) et sont les plus infectieuses chez le chimpanzé et en culture cellulaire (Bradley et al. 1991; Agnello et al. 1999; Andre et al. 2002 et 2005; Lindenbach et al. 2006). Ces observations incitent à poser la question du rôle des lipides dans le cycle viral. L’équipe de Patrice André a montré en 2002 que ces particules de faible densité correspondaient aux lipo-viro-particules (LVPs), constituées par l’ARN viral, la protéine de capside, les glycoprotéines d’enveloppe E1 et E2 et les apolipoprotéines ApoB et E (Andre et al. 2002).
Au vu de l importance des lipoprotéines dans le cycle viral, en particulier dans l entrée virale, nous nous sommes intéressés au rôle d une enzyme clé du métabolisme lipidique, la lipoprotéine lipase (LPL), dans les mécanismes d entrée et d infection du VHC.
Notre équipe étudie depuis de nombreuses années les propriétés de la protéine de capside (Maillard et al. 2001; Maillard et al. 2004). La présence de nucléocapsides non-enveloppées dans le sérum de patients infectés a été démontrée (Maillard et al. 2001). La protéine de capside a de nombreux effets sur les fonctions cellulaires de l’hôte et dans les mécanismes d’échappements à la réponse immunitaire de l’hôte. Ceci nous a conduits à rechercher de nouveaux partenaires cellulaires de la protéine de capside. D’autre part, les microtubules ayant des fonctions cruciales dans le cycle viral de nombreux virus (Dohner et al. 2005; Leopold 2006), nous avons voulu étudier le rôle de ce réseau dans l’entrée virale et l’infection par le VHC. En outre, une autre particularité du VHC est la présence chez les patients infectés d’une stéatose hépatique, correspondant à l’accumulation de gouttelettes lipidiques ou lipid droplets (LD) dans les hépatocytes. Ces LD sont des organelles intracellulaires contenant des réserves lipidiques, composées d’un cœur de triacylglycérol et d’esters cholestérol, entouré par une seule couche de phospholipides, elle-même entourée d’une couche de protéines. Plus récemment, il a été montré que la protéine de capside du VHC s’associait aux LD et que ces dernières étaient impliquées dans de nombreuses voies cellulaires incluant un engagement avec les microtubules. Il existe donc un lien direct entre le réseau de microtubules et le cycle viral du VHC, lui-même étroitement lié au métabolisme lipidique.
Partant de ces observations et dans le contexte de nos travaux sur l entrée virale, nous avons cherché à élucider le rôle des microtubules dans ces mécanismes d entrée et d infection de la cellule par le VHC.
HEPATITE C ET VHC
En 1989, l’identification du virus nommé virus de l’hépatite C (VHC) est effectuée par l’équipe de Houghton (entreprise Chiron) par biologie moléculaire (Choo et al. 1989). La stratégie de découverte du VHC est alors novatrice puisqu’elle fait appel à la réalisation d’une banque d’expression dans un bactériophage. Cette découverte a permis le développement rapide de tests sérologiques et par la suite le clonage de la séquence complète du génome viral (Houghton 2009).
I. Hépatite C
1. Epidémiologie
D’après l’OMS (2007), la prévalence de l’infection par le VHC est de 170 millions de porteurs chroniques et 3 à 4 millions de personnes infectées par an dans le monde, soit près de 3% de la population mondiale (5 fois le taux d’infection par le virus de l’immunodéficience humaine VIH-1). Cela constitue donc un problème majeur de santé publique, puisqu’en effet, l’infection chronique par le VHC est la principale cause de cirrhose, cancer du foie et indication de transplantation hépatique dans les pays occidentaux.
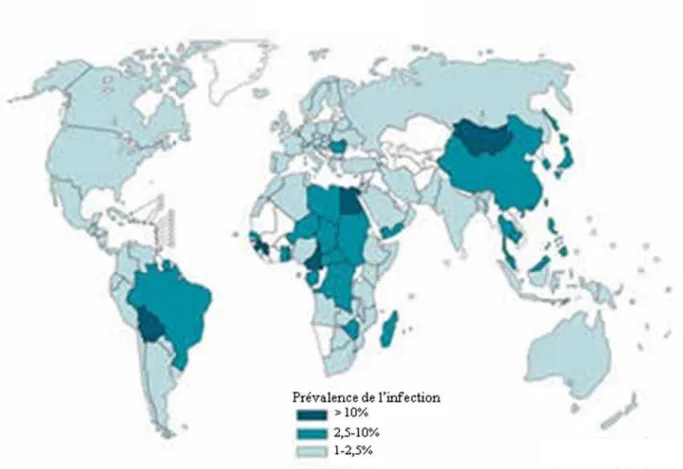
Cette prévalence varie suivant les zones géographiques. En France, 600 000 personnes seraient infectées. Les estimations de la prévalence selon les régions sont représentées sur la carte Figure 1.
Il faut cependant noter que l’évaluation de la prévalence est certainement sous-estimée car les études sont menées auprès des donneurs de sang, constituant une population sélectionnée probablement différente de la population générale (Sy 2006).
2. Mode de transmission
Le VHC est un virus hépatotrope mais diverses données indiquent également sa présence dans des cellules mononuclées du sang périphérique (lymphocytes B, monocytes/macrophages, cellules dendritiques). Il est doué d’une forte spécificité d’espèce et de type cellulaire. En l’absence de réservoir animal, l’infection se transmet de manière interhumaine directe.
Figure 1 : Prévalence mondiale de l infection par le VHC (Source : OMS)
Cette carte représente la prévalence du VHC en 2007 au niveau mondial, exprimée en pourcentage de la population infectée par pays. Les régions les plus fortement touchées sont l’Afrique (Egypte en particulier – 22%), l’Amérique Latine et l’Asie du Sud-Est.
La contamination s’effectue quasi exclusivement par voie sanguine (utilisation de drogues par voie intraveineuse, actes médicaux invasifs tels que transfusion sanguine ou transplantation) (Sy 2006).
Les transmissions du VHC de la mère à l’enfant, comme par voie sexuelle, sont rares et très controversées (Roberts 2002). Il faut cependant noter que la coinfection avec le VIH augmente ces taux de transmission. Pour 30% des cas d’infection, il n’existe aucun facteur de risque identifié (Lauer 2001).
3. Diagnostic
Il existe 2 types de tests diagnostiques : sérologiques et moléculaires (Lauer 2001; Chevaliez 2009).
Les tests sérologiques sont basés sur la recherche d’anticorps anti-VHC dirigés contre les protéines virales. L’EIA (Enzyme linked ImmunoAssay) est un titrage immunoenzymatique permettant de détecter le virus chez plus de 95% des porteurs chroniques, le taux de détection étant de l’ordre de 50 à 70% pendant la phase aigue. Un test RIBA (Recombinant ImmunoBlot Assay) est souvent réalisé pour confirmer un résultat positif obtenu par titrage EIA et met en évidence les anticorps réagissant avec certains antigènes du VHC (Chevaliez 2009).
Un test moléculaire sur l’ARN du VHC, par une technique d’amplification de l’ARN viral (RT-PCR pour Reverse Transcription-Polymerase Chain Reaction) peut aussi être réalisé pour confirmer les résultats des tests sérologiques. Cette technique est également utilisée depuis peu pour le diagnostic et le suivi des patients du fait de ses nombreux avantages (simplicité, rapidité) aidant à la mise en place d’une meilleure prise en charge thérapeutique des patients infectés.
Enfin, le génotypage permet d’adapter au mieux le traitement (durée et dose). Son principe repose sur un séquençage direct de la région 5’ non codante de l’ARN viral. La spécificité du test est très bonne pour déterminer les génotypes (cf chapitre I.1.2.) mais légèrement plus faible pour les sous-types (Forns 2006).
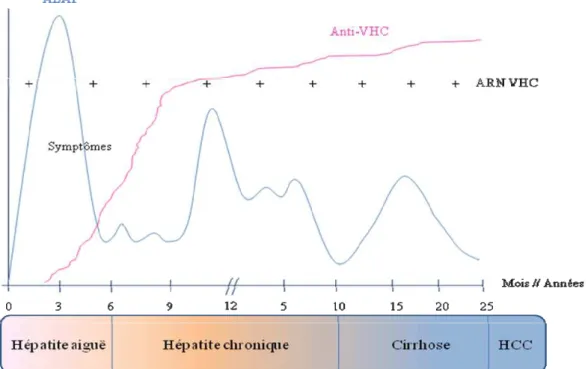
Figure 2 : Evolution de l infection par le VHC. D après Zoulim, Reviews in Medical Virology (Zoulim et al. 2003)
L’infection par le VHC, le plus souvent asymptômatique, conduit majoritairement à une hépatite chronique, susceptible d’évoluer vers une cirrhose et à terme un HCC.
D’autres paramètres, importants mais non spécifiques à l’hépatite C, sont également utilisés pour le diagnostic, notamment dans le suivi des pathologies associées. Ils seront développés dans le chapitre I.4.
4. Symptômes et Evolution de la maladie
4.1. Hépatite aiguë
La caractéristique première de l’infection par le VHC est d’être le plus souvent asymptomatique dans sa phase aigue, qui survient 4 à 12 semaines après la contamination (Figure 2).
Près de 20% des individus infectés parviennent à éliminer spontanément le virus, étape souvent associée à une hépatite dite aigue mais silencieuse, qui se traduit par un ictère (25% des cas seulement) accompagné de symptômes non spécifiques (fatigue, malaises, nausées). Des cas d’hépatite fulminante ont été rapportés mais ils sont rarissimes.
Les anticorps anti-VHC n’apparaissent que dans 50 à 70% des cas dans la phase aigüe et seulement plusieurs semaines après la contamination.
L’ARN viral est détectable 1 à 3 semaines après la contamination, souvent en même temps qu’une élévation du taux de transaminases sériques, 10 fois supérieure à la normale. Ces transaminases, ALAT (Alanine AminoTransférases) et ASAT (Aspartate AminoTransférases) participent à la synthèse et la dégradation des acides aminés dans l’hépatocyte et leur élévation est synonyme d’une atteinte hépatique.
La guérison de l’hépatite C correspond à une absence de détection d’ARN viral et à un retour à un taux basal de transaminase. Le taux d’anticorps anti-VHC diminue progressivement mais reste détectable pendant plusieurs années chez les patients ayant spontanément éliminé le virus (Santantonio et al. 2008).
4.2. Hépatite chronique
Si au bout de 6 mois, le virus n’est toujours pas éliminé, on parle alors d’hépatite chronique (70 à 85% des cas).
Les symptômes sont le plus souvent absents ou modérés et peu spécifiques (fatigue, troubles digestifs, douleurs diffuses…). Le taux de transaminase peut fluctuer au cours de l’infection chronique. C’est néanmoins un marqueur de l’évolution de l’atteinte hépatique. La présence constante d’anticorps anti-VHC est constatée. L’ARN viral est détecté à des taux importants
Figure 3 : Profil d une hépatite C évoluant vers la chronicité. D après Zoulim ; Reviews in Medical Virology (Zoulim et al. 2003)
L’hépatite aiguë peut être accompagnée de symptômes non spécifiques. L’ARN viral et le pic de transaminases apparaissent simultanément et les anticorps anti-VHC plus tardivement. La chronicité se traduit par la présence persistante d’ARN viral, d’anticorps anti-VHC et des taux variables de transaminases.
chez les malades (Figure 3). Cette persistance virale est liée à une réponse immunitaire défective, conséquence d’un échappement viral (Ishii 2008).
Bien que des méthodes non invasives alternatives à la biopsie hépatique, telles que la détection de marqueurs biochimiques de fibrose hépatique ou FibroTest (Imbert-Bismut et al. 2001; Poynard et al. 2004) soient en cours de validation, le meilleur outil pour suivre la progression de la maladie dans le foie reste l’analyse histologique après biopsie hépatique. L’hépatite chronique se traduit par une dégradation des cellules du foie, la formation de tissus cicatriciels pathologiques ou fibrose. La fibrose est susceptible d’évoluer vers une cirrhose (20% des cas) généralement une dizaine d’années après la contamination (Figure 2). A ce stade, 1 à 4% des patients développent un hépatocarcinome cellulaire (HCC) et une insuffisance hépatique pouvant être à l’origine du décès (espérance de vie à 5 ans : 50%). La cirrhose liée au VHC est une des premières indications de transplantation hépatique en France.
De plus, il existe d’autres manifestations extra hépatiques en relation avec l’infection ainsi que divers types de lésions non spécifiques souvent rencontrées dans l’hépatite chronique. Différents facteurs influencent la progression de la maladie ainsi que son traitement : facteurs dépendant de l’hôte (âge, sexe, poids), environnementaux (alcool, tabac, coinfection), mais leur rôle reste encore mal défini (Schutte et al. 2009; Tang 2009).
5. Rôle de la réponse immunitaire contre le VHC dans l évolution de l infection Une réponse innée est mise en place très rapidement par sécrétion d’interféron de type I IFN / par les cellules infectées et par la stimulation des cellules NK. Par ailleurs, des chimiokines seraient sécrétées au cours de l’infection précoce par le VHC (Meurs 2007). Une réponse adaptative humorale apparait très tôt au cours de la phase aigue, mais échoue à contrôler l’infection et est donc responsable en partie du phénomène de persistance virale. L’élimination spontanée du VHC est corrélée à l’apparition d’une réponse adaptative cellulaire T CD4+ et CD8+, puissante et polyspécifique, c’est-à-dire dirigée contre de multiples épitopes du virus, avec infiltration du foie par ces cellules. Les T CD4+ sécrètent des cytokines antivirales et activent les T CD8+ ainsi que les lymphocytes B spécifiques du virus. La persistance virale est associée à une réponse cellulaire trop faible ou inapte à l’élimination totale du virus. Elle pourrait aussi être liée à l’interférence du VHC avec la réponse immunitaire innée (Rehermann 2009).
La réponse immune joue également un rôle dans la pathogénèse hépatique, notamment par la destruction des hépatocytes par les cellules T cytotoxiques et les cellules NK et par la production de cytokines inflammatoires que sont l’IFN et le TNF (réaction inflammatoire provoquant des dommages tissulaires) (von Hahn et al. 2007; Ishii 2008; Myrmel et al. 2009; Tang 2009).
6. Traitement
6.1. Traitement actuel
Actuellement, le traitement consiste en l’administration une fois par semaine en intraveineuse d’IFN pégylé (PEG-IFN- ), la présence du polyéthylèneglycol (PEG) prolongeant la durée de vie et renforçant l’action biologique de l’IFN , en association à une prise quotidienne de ribavirine, pendant une durée de 6 mois à un an. L’IFN est une cytokine antivirale capable de déclencher une réaction immunitaire efficace, d’inhiber la réplication du virus et ayant des effets immunomodulateurs. La ribavirine quant à elle est un analogue nucléosidique de la guanosine permettant de favoriser les erreurs de réplication par son incorporation à l’ARN viral et donc d’inhiber faiblement l’ARN polymérase (Pawlotsky 2003; Chevaliez 2009). Ce traitement permet de limiter l’émergence de quasi-espèces virales (cf chapitre I.1.2.). On parle de guérison ou plus précisément de réponse virologique soutenue (RVS) lorsque le taux de transaminases revient à la normale et que l’ARN viral est indétectable 24 semaines après arrêt du traitement.
Le taux de réponse varie néanmoins considérablement en fonction des génotypes (80% pour les génotypes 2 et 3 contre 40-50% pour le génotype 1). Chez certains patients, dits non répondeurs, aucune activation de la réponse antivirale n’est observée : le système immunitaire semble réfractaire à toute stimulation (Sarasin-Filipowicz et al. 2008).
Ce traitement présente toutefois des inconvénients majeurs : de nombreux effets secondaires indésirables de type grippaux, cytopénie (leucocytes, plaquettes) et état dépressif pour l’IFN, nausées et anémie pour la ribavirine, ainsi que le développement de résistance à ce traitement. Il est donc primordial de mettre au point un vaccin et/ou de nouvelles molécules permettant d’agir sur les différentes étapes du cycle viral.
6.2. Perspectives
Outre les recherches visant à améliorer la tolérance au traitement standard, de nouvelles molécules spécialement dirigées contre le VHC (STAT-C : Specifically Targeted Antiviral Therapy for hepatitis C) sont en cours d’étude (certaines sont actuellement en phase I, II ou III d’essais cliniques). L’Albuferon (Human Genome Sciences), molécule dérivée de l’IFN (albumine couplée à l’IFN ) semble permettre une diminution de la réplication avec seulement 1 à 2 injections par mois et l’Isatoribine, « interféron inducteur » par voie orale, semble également être prometteur. Des inhibiteurs spécifiques des protéines virales (protéines décrites au chapitre I.2.2) sont actuellement développés, ciblant plus ou moins efficacement toutes les étapes du cycle viral. Ainsi, la protéase NS3/4A est la cible de peptides mimant ses substrats. Des inhibiteurs de l’ARN polymérase NS5B, un inhibiteur de l’action des cyclophilines A et B (cofacteurs indispensables à l’action de NS5B) semblent capables de réduire la charge virale, seuls ou en association avec l’IFN . Il ressort également d’une étude avec DEBIO-025 que celui-ci inhibe le VHC indépendamment du génotype (Pawlotsky et al. 2007; Flisiak et al. 2008; de Bruijne et al. 2009; Sakamoto 2009; Webster et al. 2009). Bien que des effets toxiques soient là encore présents, ces différentes molécules demeurent tout de même les candidats les plus prometteurs actuellement, car lors de trithérapie, leur effet antiviral s’additionne à celui de l’IFN pégylé et de la ribavirine.
II. Le virus de l hépatite C
1. Caractéristiques générales
Le séquençage complet du génome du VHC a permis de le classer dans la famille des
Flaviviridae, qui comprend les genres Flavivirus (ex : virus de la fièvre jaune) et Pestivirus
(ex : virus de la diarrhée bovine). Son organisation génomique, proche du genre Pestivirus, mais présentant néanmoins une faible identité de séquence, a entrainé son classement dans un genre nouveau, Hepacivirus, qui comprend également les virus GB (Beames et al. 2000). Le VHC est un virus enveloppé, à ARN simple brin positif et non segmenté contenu dans une capside protéique icosaédrique.
L’isolement de virions et leur observation en microscopie électronique se sont avérés très difficiles du fait des faibles titres viraux dans les échantillons biologiques et de leur association avec les lipoprotéines. Des particules virales de 50 à 65nm de diamètre, localisées
Génome 9,6kb Protéines Proté e de cap de Sérine protéase Protéase Hélicase Glycoprotéines d’enveloppe Cofacteur sérine protéase Réseau membranaire ? ARN polymérase ARN-dépendante Maturation de la polyprotéine in si
Poly rotéinep Transcription médiée par l’IRES
S NS
Sites de cliva ge de la polyprotéine pa r une signa l peptida se du RE
Ma tura tion de la pa rtie Ct de la protéine de ca pside pa r une signa l peptide peptida se
Sites de cliva ge pa r les protéa ses NS2/NS3 et NS3/4A
Sites de glycosyla tion des glycoprotéines d’enveloppe
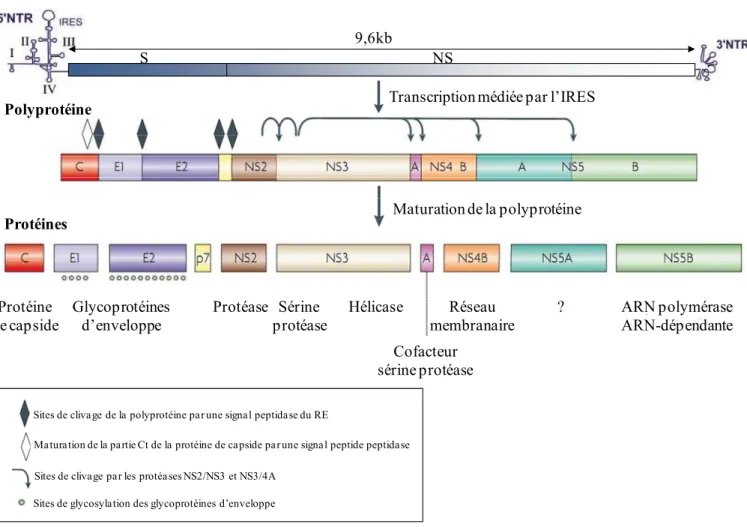
Figure 4 : Organisation génomique du VHC et maturation de la polyprotéine. D après Pénin, Hepatology et Moradpour, Nature (Penin et al. 2004; Moradpour et al. 2007)
L’ARN génomique est schématiquement représenté ici, ainsi que la polyprotéine précurseur dont la traduction est médiée par l’IRES. La maturation de la polyprotéine conduit, après clivage par des protéases cellulaires et virales, à la formation des protéines structurales et non structurales. Les protéines structurales sont les premières à être maturées par les signal peptide peptidase et signal peptidase du RE. Les protéines non structurales sont quant à elles issues des clivages par NS2/NS3 et NS3/4A.
au sein de vésicules cytoplasmiques, ont cependant pu être visualisées dans différents organes et lignées cellulaires (Shimizu et al. 1996; Wakita et al. 2005; Kaito et al. 2006), mais ces observations restent à confirmer.
1.1. Organisation génomique
Le génome du VHC est composé d’un ARN simple brin de polarité positive, d’environ 9600 nucléotides constituant un cadre ouvert de lecture, bordé en 5’ et 3’ par deux régions non codantes (5’NC et 3’NC) (Figure 4).
La région 5’NC, très structurée et hautement conservée, contient un site interne d’entrée du ribosome ou IRES (Internal Ribosomal Entry Site), essentiel à la traduction de l’ARN viral. Quatre domaines constituent l’IRES, les domaines II, III et IV étant requis pour la traduction et les domaines I et II essentiels pour la réplication de l’ARN viral.
La région 3’NC, également très structurée, est composée d’une courte région variable non traduite de 30 nucléotides, d’une séquence poly(U/UC) conservée d’environ 80 nucléotides essentielle à la réplication, et d’une région 3’ terminale très conservée, la région X, de 98 nucléotides repliée en trois structures tige-boucle.
Le génome du VHC comporte également une séquence importante pour la réplication, la région CRE (Cis-acting Replication Element), codant la région C terminale de la protéine NS5B. Une structure tige-boucle de cette séquence a été identifiée comme étant capable d’interagir avec une séquence tige-boucle de la région X, ce qui jouerait un rôle important dans l’initiation de la synthèse du brin de polarité négative au cours de la réplication.
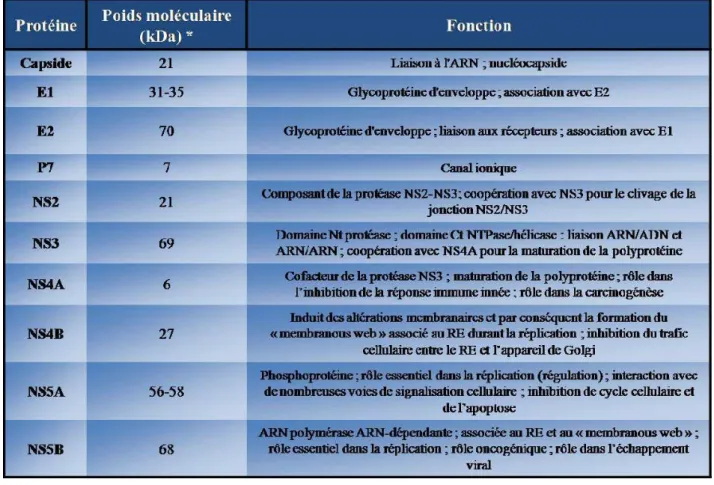
La traduction du génome viral aboutit à la synthèse d’une polyprotéine virale de 3000 acides aminés (aa), clivée par des protéases cellulaires et virales pour former les protéines structurales que sont la protéine de capside C, la protéine F et les glycoprotéines d’enveloppe E1 et E2, la viroporine P7, et les protéines non structurales que sont NS2, NS3, NS4A et B, et NS5A et B (Figure 4) (Moradpour et al. 2007).
1.2. Variabilité génétique
Comme c’est généralement le cas pour les virus à ARN, le VHC présente une grande variabilité génétique due à un taux de réplication très élevé (1010 à 1012 virions produits par jour) et à l’absence d’activité 3’-5’ exonucléase correctrice de son ARN polymérase ARN-
Figure 5 : Représentation schématique de la répartition des différentes formes virales sériques visualisées en microscopie électronique en fonction de leur densité (d après
dépendante, ce qui entraine un taux de mutation important (1,5 à 2.10-3 mutations par nucléotide copié par an) (Bukh et al. 1995).
Si la majorité des séquences ainsi générées sont défectueuses, les mutations non létales sont transmises au cours de l’évolution et confèrent des avantages ou des désavantages sélectifs qui aboutissent à l’émergence de génotypes viraux particuliers au sein d’une population dans une zone géographique donnée et sont également responsables de l’apparition de quasi-espèces virales chez les individus. Les quasi-quasi-espèces sont des variants viraux génétiquement distincts mais apparentés chez un même individu au cours d’une infection.
L’évolution du génome viral se fait en fonction de pressions de sélection exercées par des contraintes conformationnelles au niveau de la structure de l’ARN et la nécessité de conserver la fonctionnalité des protéines virales, ainsi que par des pressions liées à la réponse immunitaire de l’hôte et à son environnement (infections, traitements).
La variabilité génétique n’affecte cependant pas les différentes parties du génome de façon homogène, les séquences des protéines d’enveloppe étant les plus variables et celles de la région 5’NC et de la capside étant notamment très conservées.
L’analyse phylogénétique des séquences partielles ou complètes du génome a conduit au classement des variants en six génotypes (différant d’environ 30%), eux-mêmes subdivisés en une centaine de sous-types (divergeant d’environ 25%) (Simmonds et al. 2005). La répartition des différents génotypes varie selon les régions du globe, avec une forte prévalence des génotypes 1a et 1b aux USA (80%) et en Europe (60%), des génotypes 1 et 2 en Afrique et du génotype 1 en Asie. Une prévalence particulière du génotype 4a est observée en Egypte et en Afrique Centrale. Le génotype 5a est exclusivement présent en Afrique du Sud et le 6a en Chine (Sy 2006).
D’un point de vue biologique, le génotype semble influer sur la sévérité de la maladie et la réponse au traitement (Abraham et al. 2009). Le génotype 1 serait associé à une pathologie plus sévère et le génotype 3 à une plus grande fréquence de stéatose hépatique (accumulation de vésicules graisseuses dans les hépatocytes) (Pawlotsky et al. 1999; Soler et al. 2002).
2. Formes naturelles du VHC
Plusieurs formes virales ont été isolées à partir du sérum de patients infectés et présentent un profil de densités très hétérogène (1,06 à 1,34g/ml) (Bradley et al. 1991; Maillard et al. 2001; Andre et al. 2002; Masciopinto et al. 2004; Petit et al. 2005; Lindenbach et al. 2006; Nielsen et al. 2006) (Figure 5).
2.1. Les particules virales de faible densité
Après centrifugation du sérum sur gradient de densité, le VHC est majoritairement retrouvé dans les fractions légères (1,06 à 1,17g/ml), du fait de son association aux lipoprotéines (Thomssen et al. 1992; Prince et al. 1996; Agnello et al. 1999; Andre et al. 2002 et 2005). Cette association se fait au cours de la formation des particules virales (cf chapitre I.3.4.). Les fractions de densités les plus faibles sont également les plus infectieuses, à la fois in vitro en culture cellulaire (Agnello et al. 1999; Andre et al. 2002 et 2005; Lindenbach et al. 2006) et in
vivo chez le chimpanzé (Bradley et al. 1991). De plus, ces particules virales associées aux
lipoprotéines sont aussi infectieuses chez l’homme, comme l’a montré une étude comparant les séquences d’isolats provenant de patients infectés en phase aiguë ou chronique : les séquences des quasi-espèces virales provenant des patients en phase aiguë se superposant avec la séquence consensus (isolat phase chronique) sont retrouvées dans les fractions de faible densité (Diaz et al. 2008). Ces résultats suggèrent que l’association de ces particules virales avec des lipoprotéines est un facteur déterminant de leur infectiosité in vivo (Figure 5). Plusieurs travaux ont été effectués dans le but d’analyser la structure de ces particules virales sériques associées aux lipoprotéines. Il a été montré que chez les patients immunocompétents, ces particules sont recouvertes d’anticorps, ce qui pourrait contribuer à leur hétérogénéité (Hijikata et al. 1993). Cette propriété a été utilisée pour purifier une population de particules virales de faible densité (associées aux LDL et VLDL), nommées les lipo-viro-particules (LVP) (Andre et al. 2002). Les LVP contiennent l’ARN viral, la protéine de capside, les protéines d’enveloppe E1 et E2 et les apolipoprotéines B et E. Elles ont un diamètre de 100nm et possèdent une structure dense (Figure 5). Leur délipidation laisse apparaitre les nucléocapsides du VHC (30 à 50nm). Les LVP ne représentent probablement pas la totalité de la fraction légère mais sont actuellement les seules à y avoir été caractérisées.
2.2. Les exosomes
Des travaux suggèrent qu’une majeure partie de l’ARN viral circulant dans le sérum de patient est retrouvée dans les exosomes (Masciopinto et al. 2004). Ceux-ci sont de petites vésicules membranaires de 60 à 100nm de diamètre formées à partir de la fusion de plusieurs vésicules endosomales et sécrétées par les cellules. Elles contiennent, chez les patients infectés, de l’ARN viral, les glycoprotéines d’enveloppe ainsi que la tétraspanine CD81 (mais
Figure 6 : Cycle viral du VHC D après Moradpour, Nature (Moradpour et al. 2007)
a. Liaison et internalisation
b. Libération cytoplasmique et décapsidation c. Traduction et maturation de la polyprotéine d. Réplication de l’ARN
e. Assemblage
f. Maturation et libération du virion
La réplication a lieu dans un endroit particulier, le réseau membranaire ou « membranous web ». La morphogénèse et la sécrétion du VHC requièrent
l’association du virus aux lipoprotéines.
pas la protéine de capside). Leur densité exacte n’est pas connue mais les exosomes sont généralement retrouvés à des densités comprises entre 1,08 et 1,22g/ml.
2.3. Les nucléocapsides
Certaines études suggéraient la présence dans le sérum de patients d’une fraction immuno-précipitable par des anticorps anti-capside (Takahashi et al. 1992). La présence de nucléocapsides non-enveloppées dans le sérum de patients a pu être mise en évidence par notre équipe (Maillard et al. 2001). Leur densité est comprise entre 1,27 et 1,34g/ml (gradient de chlorure de césium). D’après l’observation en microscopie électronique, elles mesureraient entre 38 et 62nm. Ces résultats confortent donc l’existence de nucléocapsides circulant dans le sérum de patients, qui seraient soit sécrétées par la cellule infectée, soit libérées après lyse hépatique, et montrent également pour la première fois leurs propriétés physico-chimiques.
2.4. Les virus enveloppés
Des structures ressemblant à des particules ont pu être visualisées en microscopie électronique dans des hépatocytes de chimpanzés en phase aiguë de l’infection (De Vos et al. 2002). Ces particules mesurent environ 50nm de diamètre et sont reconnues par des anticorps anti-capside et anti-enveloppe. Les auteurs soulignent néanmoins la difficulté d’une telle observation. Aucune particule n’a pu être observée dans des biopsies de foie humain infecté. A partir de sérum de patients, des particules « flavivirus-like » ont pu être isolées par ultracentrifugation (Petit et al. 2005). Parmi celles-ci, deux populations contenant la capside et l’ARN viral ont pu être caractérisées : l’une correspond à des particules ne contenant pas d’enveloppe (densités de 1,06 à 1,08g/ml), l’autre à des particules contenant les protéines E1 et E2 (densités de 1,17 à 1,21g/ml).
3. Cycle viral
Durant plusieurs années, du fait de l’absence de modèles cellulaires permettant une réplication efficace et stable du VHC, la compréhension du cycle viral a été fortement ralentie. En 2005, la mise au point d’un modèle de culture in vitro a permis une avancée considérable des connaissances (Wakita et al. 2005; Zhong et al. 2005; Lindenbach et al. 2006), permettant de proposer le modèle présenté Figure 6.
Figure 7 : Représentation schématique des récepteurs putatifs du VHC (D après Helle, Cellular and Molecular Sciences et Ploss, Nature (Helle 2008; Ploss et al. 2009)
HSPG : héparane sulfate protéoglycane ; LDL-R : low density lipoprotein-receptor ; DC-SIGN : dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin ; L-SIGN : liver endothelial cell lectin ; OCLD : occludine ; SR-B1 : scavenger receptor B1 ; CD81 : tétraspanine CD81 ; CLDN1 : claudine 1.
3.1. Récepteurs putatifs, attachement et entrée virale
Par analogie avec les autres membres de la famille des Flaviviridae et les propriétés fonctionnelles connues des glycoprotéines d’enveloppe, le cycle viral du VHC débuterait par l’adsorption de la particule virale sur la cellule cible, par la fixation probable sur un ou plusieurs récepteurs membranaires, permettant l’entrée du virus (Dubuisson et al. 2008). Les lipoprotéines associées au VHC jouent un rôle majeur dans ce phénomène.
- Récepteurs putatifs :
Plusieurs molécules de surface cellulaire sont considérées comme récepteurs ou corécepteurs essentiels pour l’entrée virale (CD81, SR-B1, CLDN-1, occludine). De plus, les lectines DC-SIGN (Dendritic Cell-Specific Intracellular adhesion molecule-3-Grabbing Non-integrin) et L-SIGN (spécifique du foie mais non de l’hépatocyte) sont impliquées dans l’attachement, et les glycosaminoglycanes (comme les héparanes sulfates) et les récepteurs aux LDL (LDL-R) sont impliqués dans l’attachement à la cellule et l’entrée virale. Nous reviendrons sur certains d’entre eux au chapitre II (Figure 7).
CD81 :
Membre de la famille des tétraspanines, CD81 est une protéine membranaire non glycosylée de 236aa (26kDa), exprimée de façon ubiquitaire et impliquée dans de nombreuses fonctions cellulaires (adhésion cellulaire, mobilité, activation cellulaire, transduction du signal). Elle comporte 4 domaines transmembranaires (TM), 2 boucles extracellulaires (une petite, Small Extracellular Loop ou SEL, et une grande, Large Extracellular Loop ou LEL), la LEL étant responsable de l’interaction avec E2, ainsi que des domaines Ct (C-terminal) et Nt (N-terminal) intracellulaires (Pileri et al. 1998). La liaison CD81 LEL/sE2 semble spécifique de l’espèce (Flint et al. 2006). Plusieurs études suggèrent une action post-attachement de CD81 (Cormier et al. 2004). En effet, cette molécule induirait une relocalisation actine-dépendante du complexe E2/CD81 au niveau des contacts cellule-cellule, ce qui déclencherait une cascade de signalisation importante pour l’entrée virale (Brazzoli et al. 2008). Enfin, en 2008, Meuleman a pu démontrer pour la première fois le rôle indispensable de CD81 dans l’infection par le VHC in vivo à l’aide du modèle de souris transgéniques uPA-SCID (Meuleman et al. 2008).
SR-B1/Cla1 :
Exprimé dans de nombreuses cellules de mammifères et plus particulièrement dans le foie et les tissus stéroïdogènes, le récepteur « scavenger » SR-B1 (Cla1 pour la forme humaine) est une glycoprotéine de 509aa (60kDa), appartenant à la superfamille CD36, comportant 2 domaines cytoplasmiques, 2 domaines TM et 1 large boucle extracellulaire hautement glycosylée. C’est un récepteur multi-ligand pour de nombreuses classes de lipoprotéines (HDL, LDL, VLDL, LDL oxydée, LDL acétylée) (Trigatti et al. 2000) et pour le VHC (Scarselli et al. 2002). Il contient en effet des sites distincts de liaison pouvant interagir indépendamment avec leurs ligands respectifs. SR-B1 a une fonction essentielle dans l’entrée du cholestérol provenant des HDL et VLDL dans le foie. Notre équipe a montré le caractère essentiel des lipoprotéines riches en ApoB telles que les VLDL dans l’interaction du VHC avec le récepteur SR-B1. En outre, cela nous a menés à envisager l’existence d’une voie dépendante des lipoprotéines pour l’entrée virale, en présence même d’anticorps neutralisants tels que des anti-E2 (Maillard et al. 2006). De plus, des études ont démontré la possibilité d’une liaison E2/SR-B1 (espèce spécifique) par l’intermédiaire du HVR-1 (Hyper Variable Region) d’E2, ainsi que l’existence d’une coopération entre SR-B1 et CD81 dans l’entrée virale (Dreux et al. 2009).
Protéines de jonctions serrées (CLDN et Occludine) :
Les jonctions serrées sont des composants majeurs des complexes d’adhésion cellule/cellule. CLDN-1, membre de la famille des Claudines, est exprimée dans tous les tissus épithéliaux, mais plus particulièrement dans le foie. Cette protéine de 211aa comporte 2 boucles extracellulaires, 4 segments TM et 3 domaines intracellulaires. Un domaine hautement conservé dans la première boucle extracellulaire (EL1) semble impliqué dans l’entrée du VHC (Evans et al. 2007). L’interaction du virus avec CLDN-1 a lieu après migration du complexe SR-B1/CD81 au niveau des jonctions serrées. Il a récemment été montré que 2 autres membres de la famille des Claudines médient aussi l’entrée virale : CLDN-6 et 9 (Zheng et al. 2007).
L’occludine est une protéine de 60kDa comprenant 2 boucles extracellulaires, avec des domaines Ct et Nt cytoplasmiques. Elle participe à la fois à l’adhésion cellule/cellule et à l’ancrage du complexe de jonction au cytosquelette. Des études récentes ont démontré l’interaction directe de l’occludine avec E2, facilitant ainsi l’entrée virale par les jonctions serrées des hépatocytes (Liu et al. 2009; Ploss et al. 2009).
Glycosaminoglycanes (GAGs) :
Les GAGs sont des chaines de polysaccharides linéaires sulfatés exprimés en grand nombre à la surface de la cellule. Ce sont les principaux composants des héparanes sulfates protéoglycanes (HSPG). Des expériences ont été effectuées in vitro : la séparation de surnageants de cultures cellulaires infectées sur colonne d’héparine a montré que les particules virales se lient à l’héparine, un homologue des HSPG. De plus, des expériences de pré-incubation de cellules avec de l’héparine ou de l’héparinase I, qui dégrade l’héparine et les domaines hautement sulfatés des HSPG, ont démontré que ces molécules permettent la liaison du VHC aux cellules. Les HSPG présentent une faible affinité pour le virus mais leur nombre en fait un point d’ancrage majeur à la surface cellulaire. Les héparanes sulfates agissent probablement comme récepteur primaire concentrant le virus à proximité du ou des récepteurs plus spécifiques de forte affinité ou facilitent l’interaction du virus avec d’autres molécules impliquées dans son entrée dans la cellule (Morikawa et al. 2007).
Lectines de type C :
Ce sont des protéines de membrane de type II, homotétramériques, de la famille des lectines de type C, contenant un domaine de reconnaissance des carbohydrates dans leur région Ct extracellulaire. Ce domaine se lie aux carbohydrates des virus de manière calcium dépendante. SIGN et L-SIGN ne sont pas exprimées à la surface des hépatocytes : DC-SIGN est exprimée dans les cellules de Küppfer, les cellules dendritiques et les lymphocytes, et L-SIGN dans les cellules endothéliales sinusoïdales du foie. Ces molécules peuvent avoir une fonction de récepteurs de capture, capables de concentrer et transmettre le virus aux cellules permissives et peuvent ainsi jouer un rôle dans l’infection et le tropisme cellulaire (Cormier et al. 2004).
Le récepteur aux asialoglycoprotéines, présent principalement dans le foie, a également été évoqué comme candidat possible dans l’entrée du VHC dans la cellule (Saunier et al. 2003) mais son rôle n’a pas été confirmé sur le modèle HCVcc (Cocquerel et al. 2006).
Récepteur aux lipoprotéines de faibles densités (LDL-R) :
C’est une glycoprotéine de 839aa (120kDa), majoritairement exprimée dans le foie, reconnaissant notamment les apolipoprotéines B100 et E et permettant l’entrée des lipoprotéines de faible densité (LDL, VLDL) dans la cellule. Le LDL-R est ainsi responsable de l’assimilation des lipoprotéines par le foie. L’interaction virus/LDL-R s’effectuerait par
Figure 8 : Modèle d entrée virale du VHC. D après Budkowska, Polish Journal of Microbiology (Budkowska 2009)
l’intermédiaire des LDL et des VLDL associées au VHC, ce qui conduirait à l’internalisation du virus par le LDL-R (Agnello et al. 1999; Andre et al. 2002; Molina et al. 2007).
- Attachement et entrée virale :
Le VHC existe sous différentes formes chez les patients : associé ou non à des lipoprotéines de faible densité, enveloppé ou non enveloppé (Figure 5). Les données actuelles suggèrent que les évènements conduisant à l’entrée virale et à une infection productive suivent un processus multi-étapes impliquant à la fois des facteurs viraux et cellulaires. Les principales molécules médiant l’entrée virale dans les hépatocytes sont CD81, SR-B1 et les protéines de jonctions serrées Claudine et Occludine (Budkowska 2009). A celles-ci s’ajoutent les HSPG et/ou le LDL-R comme facteurs potentiels pouvant jouer un rôle dans l’attachement du virus à la cellule. L’entrée du virus dans la cellule est probablement initiée par l’interaction entre les lipoprotéines associées au VHC (principalement les VLDL) et des récepteurs ou molécules de liaison aux lipoprotéines : LDL-R, SR-B1, HSPG. Le VHC interagit ensuite avec CD81, un récepteur « post-entrée », formant un complexe avec SR-B1. L’équipe de Kapadia a montré dans le système de culture cellulaire HCVcc qu’il est impératif que CD81 et SR-B1 fonctionnent de manière coopérative pour initier l’infection par le VHC. De plus, l’entrée cellulaire médiée par CD81 est en partie dépendante du cholestérol membranaire (Kapadia et al. 2007). CD81 déclenche des cascades de signaux essentiels à l’entrée virale. Le virus est ensuite transféré aux protéines de jonctions serrées Claudine 1, 6 ou 9 et occludine (Figure 8) (Budkowska 2009). Bien que toutes les molécules médiant l’entrée et l’infection de la cellule par le VHC soient ubiquitaires et qu’aucune d’entre elles ne soit spécifique des cellules hépatiques, seuls les hépatocytes humains ont la capacité d’exprimer tous les facteurs cellulaires requis pour l’accomplissement du cycle viral.
Il semble donc que d’autres facteurs permettant l’entrée virale et déterminant l’hépatotropisme restent à découvrir. Un exemple de régulateur négatif est la protéine récemment mise en évidence EWI-2wint (Figure 9). Cette dernière est une protéine de type immunoglobuline capable d’interagir avec CD81. Elle est exprimée dans tous les types cellulaires à l’exception des hépatocytes. Cette mobilisation de CD81 l’empêche de lier des glycoprotéines d’enveloppe et donc d’initier l’entrée virale (Rocha-Perugini et al. 2008; Schuster 2009).
De façon similaire aux autres Flaviviridae, il a été montré (modèles HCVpp et HCVcc) que le VHC entre dans la cellule via une endocytose clathrine-dépendante. Les glycoprotéines d’enveloppe médient la fusion pH-dépendante de la particule virale avec la membrane des
Figure 9 : Modèle d inhibition de l entrée virale par EWI-2wint. D après Schuster, Journal of Hepatology (Schuster 2009)
A. Entrée du VHC dans une cellule permissive (hépatocyte)
B. Inhibition de l’entrée du VHC dans des cellules non-permissives par 2wint. EWI-2wint est généré par le clivage de EWI-2 par une protéase cellulaire et va inhiber l’interaction entre les glycoprotéines d’enveloppe du VHC et CD81.
Cependant, il est essentiel de noter que le modèle utilisé dans cette étude est HCVpp et ne prend donc pas en compte les lipoprotéines.
endosomes précoces (pH optimal : 5,5). La nucléocapside est libérée dans le cytoplasme et le virus échappe donc à la voie de dégradation des lipoprotéines (Blanchard et al. 2006; Meertens et al. 2006; Perrault 2009). Notre équipe a montré que le VHC naturel peut reconnaitre de façon directe SR-B1 et entrer dans la cellule via ce dernier. Nous avons également mis en évidence l’interaction du VHC avec le récepteur via les lipoprotéines associées aux particules virales (Maillard et al. 2006). Les lipoprotéines ont donc un impact majeur sur l’attachement et l’entrée du VHC dans la cellule.
3.2. Traduction et maturation
Suite à la libération de l’ARN viral dans le cytoplasme de la cellule, la traduction coiffe-indépendante est réalisée par la machinerie de traduction cellulaire. L’IRES de la région 5’NC, à travers ses domaines II et III, permet le positionnement de la sous unité 40S du ribosome directement au niveau du codon initiateur inclus dans sa structure. La synthèse protéique, qui a lieu au niveau de la membrane du réticulum endoplasmique (RE), est ensuite réalisée grâce au recrutement de multiples protéines cellulaires. La polyprotéine, pendant et après sa synthèse, est la cible de clivages effectués par des protéases soit cellulaires, soit virales. Les protéines virales structurales sont les premières à être maturées par les signal peptide peptidase et signal peptidase du RE. La protéine de capside est retrouvée au niveau des gouttelettes lipidiques et les glycoprotéines d’enveloppe E1 et E2 sont ancrées à la membrane du RE. Les protéines non structurales, issues des clivages par NS2/NS3 et NS3/4A vont, quant à elles, à l’exception de NS2, former le complexe de réplication (Suzuki et al. 2007; Gastaminza et al. 2008). Nos travaux ont montré le caractère crucial du réseau de microtubules dans le cycle viral du VHC dans les étapes post-entrée du virus dans la cellule. Ces données seront discutées dans l’article 3 de la partie résultats (Roohvand et al. 2009).
3.3. Réplication
Le mécanisme exact de la réplication du VHC n’est pas connu en détail, mais un modèle a pu être proposé du fait des connaissances sur la réplication d’autres virus à ARN (alpha-, picorna-, flavi-, arteri-, rubi- ou bromovirus) (Mackenzie 2005). Elle se déroulerait à la membrane du RE, au niveau d’un compartiment membranaire particulier nommé « Membranous Web », et serait réalisée par le complexe de réplication viral constitué de NS5B, NS5A, NS4B et NS3/4A (Moradpour et al. 2007).