FACULTE DE MEDECINE ET DE PHARMACIE -RABAT- ANNEE: 200 THESE N°:
C
C
a
a
n
n
c
c
e
e
r
r
g
g
a
a
s
s
t
t
r
r
i
i
q
q
u
u
e
e
l
l
o
o
c
c
a
a
l
l
e
e
m
m
e
e
n
n
t
t
a
a
v
v
a
a
n
n
c
c
e
e
A A pprrooppooss ddee 7755 ccaassTHESE
Présentée et soutenue publiquement le :………..
PAR
Mr. Mounir BEN NEZHA Né le 11 Aôut 1981 à El Jadida
Pour l'Obtention du Doctorat en
Médecine
MOTS CLES Cancer – Estomac – Localement avancé – Traitement - Survie. JURY
Mr. M. AHALLAT PRESIDENT Professeur de Chirurgie Générale
Mr. M. RAISS RAPPORTEUR
Professeur de Chirurgie Générale
Mr. A. HRORA
Professeur de Chirurgie Générale
Mr. R. MOHSINE
Professeur de Chirurgie Générale
Mr. L. IFRINE
Professeur de Chirurgie Générale
A la mémoire de mon défunt père
Tu as été pour moi la source à laquelle j’ai toujours puisé
patience, courage et volonté. Ta tendresse et ton dévouement
sont tels qu’aucune dédicace ne saurait traduire la
reconnaissance et la profonde affection que je te porte.
En choisissant cette voie, j’ai réalisé un rêve que tu as
longtemps caressé.
J’aurais bien aimé ta présence le jour de ma soutenance de
thèse, mais hélas, Dieu a voulu autrement.
A ma très chère mère
Rien au monde ne pourrait compenser les sacrifices que tu as
consentis pour mon éducation et mon bien être.
Durant des années, tu as fait preuve de courage et de
générosité, prête à tous les sacrifices pour faire de moi ce que je
suis.
Tu m’as élevé dans l’honneur, la droiture et la dignité.
A toi maman, ma lumière dans les sentiers ténébreux, je te
dédie ce travail en gage de mon amour sans bornes, en
espérant que tu sois toujours fière de moi.
Puisse dieu le tout puissant, te procure santé, bonheur et
longue vie afin que je puisse te combler à mon tour.
ma petite sœur LAILA
Je vous souhaite une vie pleine de bonheur, prospérité et
réussite.
Que ce travail soit l’expression de mon attachement et ma
profonde affection.
A ma grand-mère
Que dieu vous comble de santé et vous apporte longue vie.
A la mémoire de mes défunts grands
parents
cousines
Que ce travail soit le témoignage de l’estime et la profonde
affection que j’ai pour vous.
A mes amis et amies
Je garde toujours les souvenirs de vos soutiens et vos
encouragements.
En gage de ma profonde amitié.
A tous mes patients et confrères
A tous ceux qui me sont chers
Veuillez trouver dans ce travail l’expression de mes
sentiments les plus sincères.
A notre maître et président de thèse
Monsieur le professeur M. AHALLAT
Professeur de Chirurgie Générale
Nous vous sommes infiniment reconnaissants du
grand honneur que vous nous faites en acceptant de
présider le jury de cette thèse.
Votre grand savoir, votre rigueur dans le travail et
votre générosité constituent à nos yeux, l’exemple
suprême à suivre pour tout praticien.
Veuillez trouver ici cher maitre, le témoignage de
notre vive gratitude, haute considération et profond
respect.
A notre maître et Rapporteur de thèse
Monsieur le professeur M. RAISS
Professeur de Chirurgie Générale
Vous nous avez confié ce travail et nous souhaitons
être digne de votre confiance.
Nous avons été touché par la gentillesse avec laquelle
vous nous avez toujours reçu et l’intérêt que vous avez
donné à ce travail.
Vos qualités humaines et professionnelles nous
inspirent une grande estimation.
Veuillez trouver ici cher maitre, le témoignage de
notre gratitude et de notre profond respect.
A notre maître et Juge de thèse
Monsieur le professeur A.HRORA
Professeur de Chirurgie Générale
Vous avez accepté avec amabilité de juger ce modeste
travail.
C’est pour nous un grand honneur de vous compter
parmi les membres du jury.
Que ce travail soit le témoignage de nos sincères
remerciements et notre profonde gratitude.
A notre maître et Juge de thèse
Monsieur le professeur R.MOHSINE
Professeur de Chirurgie Générale
Vous nous avez honoré en acceptant de juger ce
travail et de l’enrichir de vos remarques.
Veuillez trouver ici cher maitre, l’assurance de notre
profond respect et de notre gratitude.
A notre maître et Juge de thèse
Monsieur le professeur L.IFRINE
Professeur de Chirurgie Générale
Nous sommes très sensibles à l’honneur que vous
nous faites en acceptant de juger ce travail.
Veillez trouver ici cher maitre, l’expression de nos
remerciements les plus sincères.
MATERIELS ET METHODES D’ETUDES ... 3
I. Matériels ... 4
II. Méthodes ... 6
RESULTATS ... 7
I. Etude épidémiologique ... 8
II. Les signes fonctionnels ... 12
III. Les signes physiques ... 13
IV. La biologie ... 14
V. L‟exploration para clinique ... 14
VI. Traitement ... 18
A. Chirurgie ... 18
1. Opérabilité ... 18
2. résécabilité ... 19
B. Traitements adjuvants ... 21
VII. Données du CRO ... 21
VIII. Les résultats anatomo-pathologiques ... 23
IX. Les suites opératoires ... 24
A. Mortalité postopératoire ... 24 B. Morbidité postopératoire ... 24 C. Recul ... 24 D. Survie ... 25 ANALYSE ... 27 I. Etude épidémiologique ... 28
II. Les signes fonctionnels ... 31
III. Les signes physiques ... 32
IV. La biologie ... 33
1. Opérabilité ... 36
2. Résécabilité... 36
B. Traitements adjuvants ... 39
VII. Données du CRO ... 39
VIII. Les résultats anatomo-pathologiques ... 40
IX. Les suites opératoires ... 41
A. Mortalité postopératoire ... 41 B. Morbidité postopératoire ... 41 C. Recul ... 41 D. Survie ... 41 DISCUSSION ... 47 I. Etude épidémiologique ... 48 A. Epidémiologie descriptive ... 48 B. Epidémiologie analytique ... 49
II. Etude anatomopathologique ... 52
III. Etude Clinique ... 53
A. La symptomatologie fonctionnelle ... 53
B. Délai entre le premier symptôme clinique et le diagnostic ... 55
C. Signes physiques... 56
IV. Bilan diagnostique et d‟extension ... 56
A. Bilan diagnostique ... 56
1. F.O.G.D couplée aux biopsies ... 56
2. T.O.G.D ... 57
B. Bilan d‟extension ... 58
1. L‟intérêt du bilan préopératoire ... 58
2. Les moyens du bilan d‟extension ... 58
V. Traitement ... 62
A. Chirurgie ... 62
1. Chirurgie radicale ... 64
c. Conclusion ... 69
2. Chirurgie palliative ... 79
a. Résection palliative ... 79
b. Dérivation ou chirurgie sans exérèse ... 80
B. Traitements complémentaires ... 81
1. Chimiothérapie néo-adjuvante ... 81
2. Chimiothérapie post-opératoire ... 83
3. Chimiothérapie dans les formes métastatiques ... 84
4. Radio-chimiothérapie pré-opératoire ... 84
5. Radio-chimiothérapie post-opératoire ... 86
6. Radiothérapie ... 87
7. Chimiothérapie hyperthermique intra-péritonéale ... 87
8. . Immunothérapie ... 87 VI. Complications-pronostic ... 88 A. Complications ... 88 1. Mortalité post-opératoire ... 88 2. Morbidité post-opératoire ... 88 B. Pronostic ... 91 CONCLUSION ... 96 RESUME ... 100 BIBLIOGRAPHIE ... 110
- CGLA : cancer gastrique localement avancé - ATCD : antécédent
- FDR : facteur de risque - RAS : rien à signaler
- HTA : hypertension artérielle - RGO : reflux gastro-œsophagien - HMG : hépatomégalie
- Hb : hémoglobine
- FOGD : fibroscopie oeso-gastro-duodénale - ADK : adénocarcinome
- TOGD : transit oeso-gastro-duodénale - ADP : adénopathie
- VB : vésicule biliaire - TDM : tomodensitométrie
- Rx Pulm : radiographie pulmonaire - Abd : abdominal
- MEE : mise en évidence - Echo : échographie - E.E : écho-endoscopie - MEG : mauvais état général
- GPI : gastrectomie polaire inférieure - GT : gastrectomie totale
- GE : gastrectomie élargie
- CRO : compte rendu opératoire - Gg : ganglion
- Nbre : nombre - UI : ulcéro-infiltrant
- OMS : organisation mondiale de la santé - AEG : altération de l‟état général
- TNM : tumor-nodes-métastases
- S : splénectomie - P : pancréatectomie
- GST : gastrectomie subtotale
- ECF : Epirubicine-Cisplatine-5 Fluorouracile - RCP : réunion de concertation pluridisciplinaire
- CHIP : Chimiothérapie hyperthermique intra-péritonéale - FUFOL : 5 Fluorouracile + acide folinique.
En dépit de la légère diminution de son incidence dans le monde, le cancer de l‟estomac représente toujours un problème de santé publique, du fait du stade tardif de son diagnostic et de la faible survie des cas traités. En effet, 59,8% de cancers gastriques sont découverts à un stade avancé [1].
Le cancer gastrique localement avancé qui fait l‟objet de notre étude se définit comme un cancer au stade dépassant la séreuse de l‟estomac et envahissant au moins un organe de voisinage (rate, pancréas, colon transverse, lobe gauche du foie, méso côlon transverse, diaphragmes et autres…) en présence ou en absence de métastases.
Le traitement curatif du cancer gastrique localement avancé est essentiellement chirurgical, cependant plusieurs questions se posent :
- Quel bilan diagnostique et d‟extension réaliser ? l‟amélioration des moyens diagnostiques a-t-elle permis de mieux préciser la résécabilité et la stadification tumorale en pré-opératoire ?
- Faut-il faire des résections élargies dans les cancers gastriques localement avancés ? Quelle doit être l‟étendue de la lymphadénectomie ? Quel était l‟impact de la résection sur la survie de nos malades ?
- Et enfin, quelle est la place des traitements complémentaires ?
Nous nous proposons de faire une étude rétrospective d‟une série consécutive de 75 cas présentant un cancer gastrique localement avancé sur une période étalée de janvier 2001 à Décembre 2006 au sein de la clinique de chirurgie « C » à l‟hôpital IBN SINA de Rabat.
L‟objectif de notre travail est de :
- Décrire les caractéristiques épidémiologiques et,
- Préciser les modalités de la prise en charge diagnostique et thérapeutique ainsi que les résultats en matière de mortalité, de morbidité et de survie, à cours et à moyen terme.
Matériels et
I. Matériels
A. Période et lieu d’étude
Il s‟agit d‟une étude rétrospective effectuée à la clinique chirurgicale C à l‟hôpital IBN SINA de Rabat et étendue sur une période de 6 ans allant de janvier 2001 à décembre 2006.
B. Documents consultés
Pour réaliser ce travail, nous avons eu recours aux documents suivants : Les registres des entrants et des sortants
Les dossiers des malades
Les comptes-rendus opératoires et anatomopathologiques.
Le suivi des malades réalisé par les professeurs du service de chirurgie C. Les appels téléphoniques des patients ou de leurs proches.
C. Critères d’inclusion
Les tumeurs gastriques stade III et IV envahissant la séreuse et au moins un organe de voisinage (la rate, le pancréas, le colon transverse, le lobe gauche du foie, le méso côlon transverse, le diaphragme et autres…), mises en évidence à partir des données para-cliniques et /ou per-opératoires.
D. Critères d’exclusion
Tumeurs gastriques superficielles (stade I et II) Cancer du cardia
E. Taille de l’échantillon
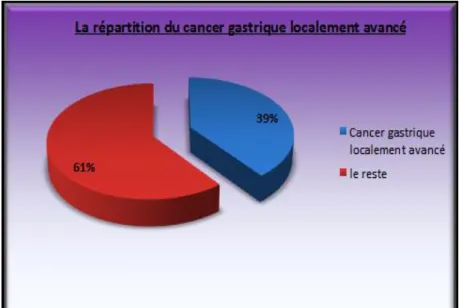
Durant cette période, parmi 190 cas de cancer de l‟estomac exploités, 75 cas de cancer gastrique localement avancé ont été recensés, ce qui représente 39%.
Diagramme n°1 : la répartition du cancer gastrique localement avancé
F. Les paramètres étudiés
Nous avons étudié : Le recrutement annuel L‟âge
Le sexe
L‟origine géographique
Les aspects diagnostiques cliniques et para cliniques Les modalités thérapeutiques
Les résultats anatomopathologiques et, Le suivi postopératoire.
G. Les modalités du suivie :
Le suivie des malades a été réalisé grâce à des consultations régulières au service et aux appels téléphoniques des patients ou de leurs proches. Les malades perdus de vue ont été contactés, ceux qui n‟ont pas
répondu étaient considérés pour l‟analyse statistique vivants à la date de leur dernière consultation.
La dernière mise à jour remonte à Mars 2008. II. Méthodes
La saisie et le traitement des informations ont été faits par SPSS 13.0 et Excel 2007.
I. Etude épidémiologique
A. Recrutement annuel
La moyenne de recrutement annuel des cancers gastriques : 31 ,66 cas/an.
La moyenne de recrutement annuel des cancers gastriques localement avancés : 12,5 cas/an.
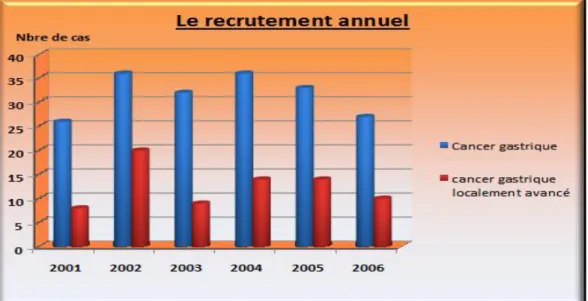
Tableau n°1 : Récapitulatif du recrutement annuel
2001 2002 2003 2004 2005 2006
Cancer gastrique 26 36 32 36 33 27
Localement avancé 8 20 9 14 14 10
B. Sexe
- 71% de nos patients étaient des hommes. - 29% étaient des femmes.
- Le sexe ratio est évalué à : 2,41
Tableau n°2 : La répartition selon le sexe
Nombre de cas pourcentage
Homme 53 71%
femme 22 29%
C. Age
L‟âge moyen est estimé à 57 ans.
La tranche d‟âge la plus touchée est de 50 ans à 70 ans, avec des extrêmes d‟âge de 29 ans à 80 ans.
Tranche d‟âge 20-30 30-40 40-50 50-60 60-70 70-80
Nombre de cas 2 3 11 24 24 11
D. Répartition géographique
La carte géographique suivante représente l‟incidence selon les régions de notre pays :
E. ATCD et tares associées :
1. FDR et lésions pré-disposantes
Tableau n°4 : récapitulatif des FDR et des lésions pré-disposantes FDR et lésions pré disposantes Nombre de cas
Tabac 16
Ulcère 3
RAS 50
Inconnus 6
2. Tares associées
Tableau n°5 : récapitulatif des tares associées
Tares associées Nombre de cas
HTA 3
Diabète 4
3. ATCDs chirurgicaux
Tableau n°6 : récapitulatif des ATCDs chirurgicaux
ATCD chirurgicaux Nombre de cas
Pas d‟ATCD 56 Cholécystectomie 7 Hernie 1 Néphrectomie 1 Autres chirurgies 7 Inconnus 3 F. Motif de consultation
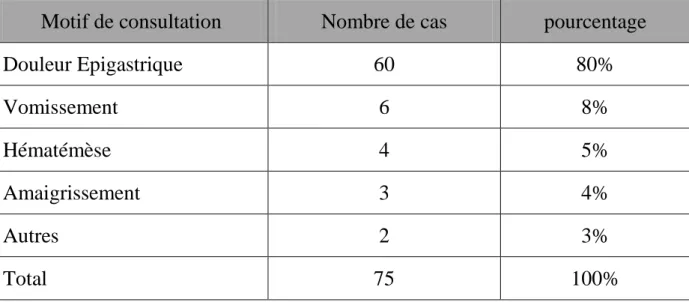
Tableau n°7 : récapitulatif des motifs de consultation
Motif de consultation Nombre de cas pourcentage
Douleur Epigastrique 60 80% Vomissement 6 8% Hématémèse 4 5% Amaigrissement 3 4% Autres 2 3% Total 75 100%
G. Début de la symptomatologie
La moyenne du délai entre le début des symptômes et l‟hospitalisation est de : 9,4 mois.
II. Les signes fonctionnels
A. La douleur
62 patients présentaient des douleurs abdominales à prédominance épigastrique (88,57%)
8 patients ne se plaignaient pas de douleurs abdominales. 5 patients non précisés
B. Amaigrissement
47 patients présentaient un amaigrissement (62%)
C. Vomissements
31 patients avaient des vomissements (49,20%) 32 patients ne présentaient pas de vomissements 12 non précisés
D. Hémorragies digestives
23 patients avaient des hémorragies digestives (30,66%), dont 35% sont représentées par l‟association d‟hématémèse et de méléna, 35% par des hématémèses seules, et 30% par des mélénas seules.
E. Troubles du transit (16%)
1 patient avait une alternance diarrhée-constipation. 2 patients avaient une diarrhée
F. Dysphagie (8%)
6 patients avaient une dysphagie
G. Autres :
- 4 patients avaient une pâleur cutanée - 2 patients avaient un RGO
- 1 patient avait un hoquet
- 1 patient avait un syndrome de Koenig III. Les signes physiques
A. Masse abdominale
49 patients n‟avaient pas de masse abdominale 14 patients avaient une masse abdominale (22,22%) 12 non précisés
B. Ascite
3 patients présentaient une ascite à l‟examen physique (4%)
C. Hépatomégalie
2 patients avaient une HMG à l‟examen physique. (2,66%)
D. Ictère
1 patient était ictérique. (1,33%)
E. Ganglion de troisier
IV. Biologie
A. Hémoglobine
40 patients avaient Hb ≥ 10 g/dl
26 patients avaient Hb < 10 g/dl (34,66%) 9 cas non précisés
B. Protidémie
24 patients avaient une protidémie ≥ 60 g/l 9 patients avaient une protidémie < 60g/l (12%) 42 cas non précisés
C. Albuminémie
5 patients avaient une albuminémie ≥ 35 g/l
23 patients avaient une albuminémie < 35 g/l (30 ,66%) 47 cas non précisés
D. groupe sanguin
35 patients avaient un groupe sanguin O+ 21 patients avaient un groupe sanguin A+ 15 patients avaient un groupe sanguin B+ 2 patients avaient un groupe sanguin A- 2 patients avaient un groupe sanguin AB - V. L’exploration para clinique
A. FOGD et résultats des biopsies
1. Aspect tumoral
Tous les patients ont bénéficié de la FOGD (100%) avec des aspects macroscopiques variés :
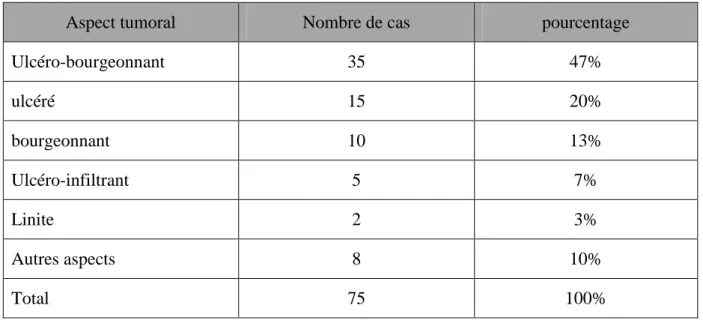
Tableau n°8 : récapitulatif des aspects macroscopiques
Aspect tumoral Nombre de cas pourcentage
Ulcéro-bourgeonnant 35 47% ulcéré 15 20% bourgeonnant 10 13% Ulcéro-infiltrant 5 7% Linite 2 3% Autres aspects 8 10% Total 75 100%
2. Résultats des biopsies
Tableau n°9 : Résultats des biopsies
Type histologique Nombre de cas pourcentage
ADK moyennement différencié 24 32%
ADK à cellules dissociées 21 28%
ADK bien différencié 18 24%
ADK peu différencié 10 13%
Colloïde muqueux 2 3%
3. Localisation tumorale
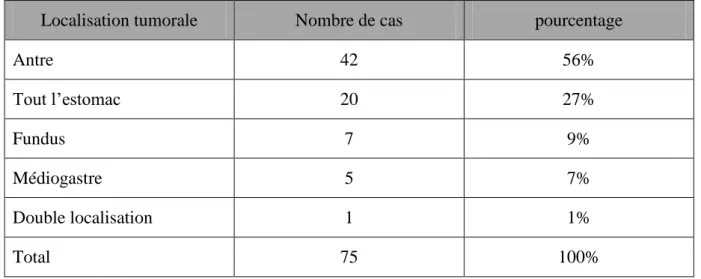
Tableau n°10 : la répartition selon la localisation tumorale
Localisation tumorale Nombre de cas pourcentage
Antre 42 56% Tout l‟estomac 20 27% Fundus 7 9% Médiogastre 5 7% Double localisation 1 1% Total 75 100% B. TOGD
30 patients ont bénéficié du TOGD (40%) qui a objectivé les aspects suivants :
8 cas sous forme de sténose
5 tumeurs avaient un aspect ulcéro-bourgeonnant 5 tumeurs avaient un aspect bourgeonnant
5 cas sous forme d‟épaississement des plis 4 cas sous forme de lacune
2 tumeurs avaient l‟aspect de linite 1 estomac de stase
C. Echographie abdominale
58 patients ont bénéficié de l‟échographie abdominale (77%) L‟échographie n‟a rien montré chez 23 de nos patients 22 cas sous forme d‟épaississement pariétal
4 cas sous forme d‟épaississement + ADP 4 cas d‟ADP
2 cas de métastases hépatiques 2 cas de carcinose et ascite 1 cas de VB scléro-atrophique
D. TDM abdominale
Seulement 25 patients ont bénéficié d‟une TDM abdominale (33%) dont : 7 TDM ont objectivé une tumeur gastrique.
6 TDM ont objectivé un épaississement pariétal.
6 TDM ont mentionné l‟envahissement des organes de voisinage par la tumeur :
Surrénale, pancréas, duodénum…
2 TDM n‟ont montré que des ADP. 2 TDM n‟ont rien signalé.
1 TDM a objectivé un aspect de linite gastrique. 1 TDM a objectivé une sténose gastrique.
E. Echo-endoscopie
F. Radiographie pulmonaire
Tous les patients ont bénéficié d‟une Rx Pulm. 2 cas avaient des images séquellaires
Conclusion :
Le bilan d‟extension a objectivé l‟envahissement à un ou plusieurs organes de voisinage chez seulement 8% des cas.
Tableau n°11 : la sensibilité diagnostique des examens para-cliniques
Examens para- cliniques FOGD TDM .abd. TOGD.abd Echo.abd E.E
Réalisation (nbre) 75 25 30 58 0
MEE de la tumeur (nbre) 75 21 16 26 --
Sensibilité diagnostique 100% 84% 53% 44% --
VI. Traitement
A. Chirurgie
1. Opérabilité
2 patients étaient inopérables : (3%)
- 1 patient pour MEG + métastases à distance
- 1 patient pour MEG + tumeur non résécable sur les données radiologiques pré-opératoires.
2. Résécabilité
Parmi les 73 patients qui ont été opérés : 48 n‟ont pas été réséqués (66%) et 25 ont été réséqués (34%) dont :
11 à visée curative et 14 à visée palliative
a. Les réséqués :
Type de gastrectomie
Pour les 25 patients réséqués : les types de gastrectomie étaient: 10 GPI.
4 GT.
11 GE à un ou plusieurs organes de voisinage dont : - 7 GPIE
- 4 GTE
Extension de l’exérèse aux organes de voisinage
11 patients ont eu une extension de l‟exérèse aux organes de voisinage dont :
4 cas ont eu une extension au mésocolon 2 cas au colon
2 cas au foie 1 cas à la VB
1 cas au mésocolon + rate
Type d’anastomose
16 anastomoses gastro-jéjunales 8 anastomoses oeso-jéjunales 1 anastomose gastro-duodénale Curage ganglionnaire
12 patients ont subi une D1 7 patients ont subi une D1.5 3 patients ont subi une D2 3 patients ont subi une D0
b. Les non réséqués :
Pour les 48 patients non réséquées on a effectué : 26 laparotomies exploratrices
22 dérivations dont : - 16 gastro-jéjunostomies - 5 jéjunostomies
- 1 gastrostomie
voici les raisons de l‟abstention à l‟exérèse : 27 cas pour carcinose péritonéale
14 cas pour tumeurs non résécables pour envahissement du pancréas, envahissement du pédicule hépatique…
3 cas pour métastases hépatiques non résécables. 3 cas pour ADP distales.
B. Traitement adjuvant
5 patients ont bénéficié d‟une chimiothérapie :
2 cas ont bénéficié d‟une chimiothérapie adjuvante 1 cas a bénéficié d‟une chimiothérapie néo-adjuvante 2 cas ont bénéficié d‟une chimiothérapie exclusive :
1 cas non opéré
1 cas opéré mais non réséqué VII. Données des C.R.O
A. Organes envahis:
D‟après les CRO on a pu mettre en évidence l‟envahissement des organes suivants :
Tableau n°12 : les organes envahis :
L‟organe(s) envahi(s) Nbre de cas pourcentage
Pancréas 19 25% Mésocolon 17 23% Tronc coeliaque 5 7% Foie 5 7% Pédicule hépatique 4 5% Foie + pancréas 4 5% Colon 3 4% Duodénum 2 3% Pancréas + colon 1 1% Colon + VB 1 1%
Pancréas + pédicule hépatique + duodénum 1 1%
Mésocolon + colon 1 1%
Surrénale + diaphragme 1 1%
Mésocolon + duodénum + surrénale + diaphragme 1 1%
VB 1 1%
Non précisé 9 14%
B. Métastases viscérales
31 patients étaient déjà au stade métastatique ce qui représente 41% :
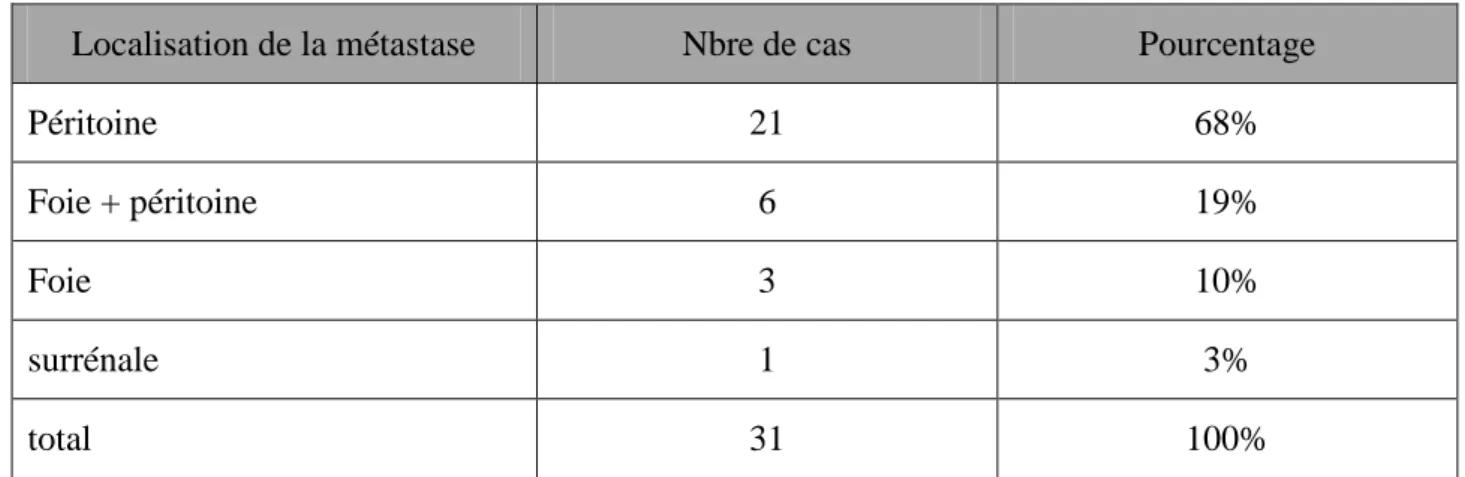
Tableau n°13 : récapitulatif des métastases :
Localisation de la métastase Nbre de cas Pourcentage
Péritoine 21 68%
Foie + péritoine 6 19%
Foie 3 10%
surrénale 1 3%
total 31 100%
C. Stade tumoral et résécabilité :
Stade III :
Parmi les 22 patients qui avaient un stade III : 15 d‟entre eux ont été réséqués et
7 n‟ont pas été réséqués
Stade IV :
Parmi les 51 patients qui avaient un stade IV : 10 d‟entre eux ont été réséqués et
VIII. Les résultats anatomo-pathologiques
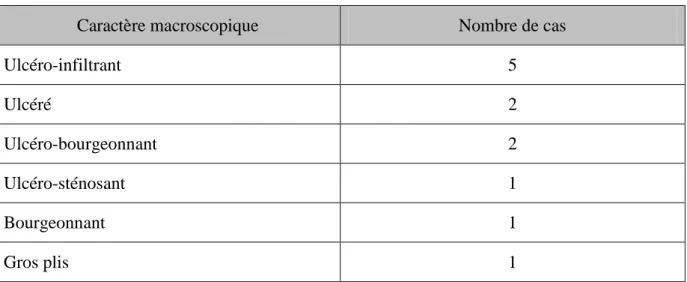
A. Caractères macroscopiques de la tumeur
Nous n‟avons obtenu que 12 résultats concernant le caractère macroscopique des tumeurs :
Tableau n°14 : résultats des aspects macroscopiques des pièces opératoires
Caractère macroscopique Nombre de cas
Ulcéro-infiltrant 5 Ulcéré 2 Ulcéro-bourgeonnant 2 Ulcéro-sténosant 1 Bourgeonnant 1 Gros plis 1 B. Taille de la tumeur
La taille des tumeurs varient de 4cm à 24cm. La taille moyenne des tumeurs est de 8,6 cm.
C. Type de résection : R0, R1, R2.
Parmi les 25 patients réséqués :
17 patients ont bénéficié d‟une résection „‟à limites saines‟‟ (R0) :68%. 6 patients ont bénéficié d‟une résection à limites envahis (R1 ou R2) : 24%.
D. Résultats du curage ganglionnaire
L‟envahissement ganglionnaire était retrouvé chez : 78% des patients réséqués (25 patients) et,
63% des patients réséqués à visée curative (11 patients) IX. Les suites opératoires
A. Mortalité postopératoire
3patients opéréssont décédés en post-opératoire (4%)
B. Morbidité postopératoire
7 patients ont présenté des complications en post-opératoire :
1. Morbidité spécifique
1 cas de reprise d‟hémorragie 1 cas de lâchage oeso-jéjunal
1 cas de lâchage du moignon duodénal 1 cas de fistule de l‟anastomose oeso-jéjunal 1 cas de fistule duodénal
2. Morbidité non spécifique
1 cas de pneumopathie
1 cas d‟ischémie aigue des membres inférieurs.
Ce qui représente une morbidité postopératoire de 9 ,5% des patients opérés.
C. Recul
Le recul moyen dans notre série : 9,6 mois. Les perdus de vue étaient au nombre de 11.
D. Survie
1. La survie globale :
- 8 patients ont survit 1 an, ce qui représente une survie à 1 an de 22% - 3 patients ont survit 3 ans, ce qui représente une survie à 3 ans de 5% - 1 seul patient a survit 5 ans, ce qui représente une survie à 5 ans de
1,5%
2. La survie médiane:
Elle est estimée à 9,6 mois.
Nous avons analysé la survie médiane selon les paramètres suivants :
Tableau n°15 : La survie médiane selon la résécabilité :
La résécabilité Survie médiane
Les réséqués 15 mois
Les non réséqués 7 mois
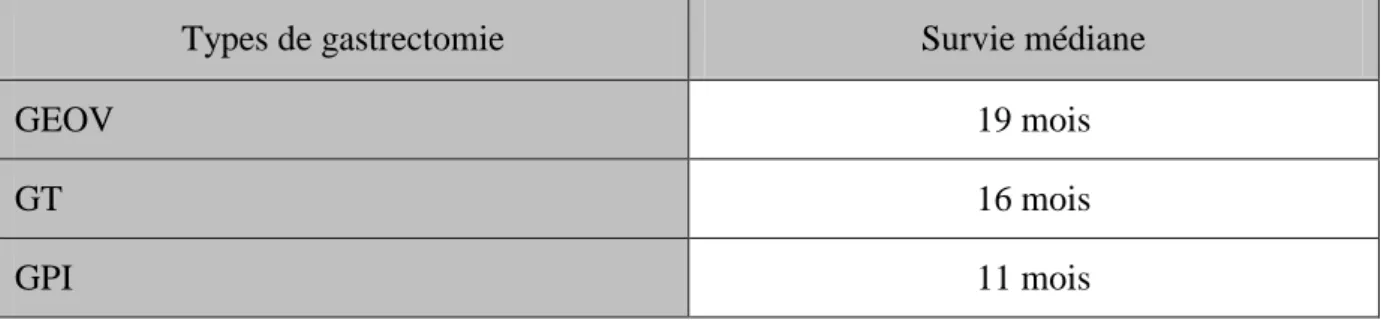
Tableau n°16 : La survie médiane selon le type d‟exérèse :
Types de gastrectomie Survie médiane
GEOV 19 mois
GT 16 mois
Tableau n°17 : La survie médiane selon le type de curage ganglionnaire
Type de curage ganglionnaire Survie médiane
D1 17,6mois
D1.5 16mois
D2 5mois
D0 5mois
Tableau n°18 : La survie médiane selon les types de chimiothérapie :
Type de chimiothérapie Survie médiane
Chimiothérapie adjuvante 38 mois
Chimiothérapie néo-adjuvante 19 mois
I. Etude épidémiologique
A. Recrutement annuel
D‟après le diagramme ci-dessous on constate:
- Une fluctuation du recrutement annuel durant la période s‟étalant de 2001 à 2005 avec deux pics en 2002 et 2004.
- Une diminution régulière du recrutement annuel à partir de 2004. - Un net pic concernant le recrutement annuel du CGLA en 2002.
B. Sexe
On note une prédominance masculine avec un sexe ratio : 2,41 Diagramme N°3 : la répartition du CGLA selon le sexe
C. Age
- L‟âge moyen est estimé à 57 ans.
- L‟âge de nos patients est entre 20 ans et 80 ans avec des extrémités entre 29 et 80 ans.
- La tranche d‟âge la plus touchée est entre 50 et 70 ans
Diagramme N°4 : la répartition selon les tranches d‟âge
- Nos patients provenaient des différentes régions du pays sauf la région de Casablanca et Fès-Boulmane.
- La majorité des patients provenaient de la région de Rabat-Salé-Zemmour-Zair et Souss-Massa-Derâa (33%).
E. ATCD et tares associées :
1. FDR et lésions prédisposantes
- 3 patients avaient un ulcère et - 16 patients étaient tabagiques.
2. Tares associées
- 3 patients avaient une HTA. - 4 patients étaient diabétiques.
- 1 patient avec ATCD de tuberculose pulmonaire.
3. ATCD chirurgicaux
La majorité des patients n‟avaient pas des ATCD chirurgicaux.
F. Motif de consultation
Le motif de consultation était dominé par : l‟épigastralgie. (80%)
G. Début de la symptomatologie
La moyenne du délai entre le début des symptômes et l‟hospitalisation est de : 9,4 mois.
II. Les signes fonctionnels
La douleur épigastrique représente le signe fonctionnel prédominant dans 88,57%.
62% des patients présentaient un amaigrissement. 49,20% des patients avaient des vomissements.
30,66% des patients avaient des hémorragies digestives dont 35% sont représentées par l‟association d‟hématémèse et de méléna, 35% par des hématémèses seules, et 30% par des mélénas seules.
16% des patients avaient des troubles du transit. 8% des patients avaient une dysphagie
Conclusion :
Les signes fonctionnels sont dominés par l‟épigastralgies (88%) et l‟amaigrissement (62%)
III. Les signes physiques
La masse abdominale représente le signe physique prédominant (22,22%)
4% des patients présentaient une ascite 2,66% des patients avaient une HMG 1 patient était ictérique.
Le ganglion de troisier n‟a pas retrouvé. Conclusion :
22% de nos patients présentaient une masse abdominale à l‟examen physique par contre le ganglion de troisier n‟a pas été retrouvé.
IV. Biologie
Hémoglobine : 34,66% des patients étaient anémiques Protidémie : 12% des patients avaient une hypo-protidémie.
Albuminémie : 30 ,66% des patients avaient une hypo-albuminémie. groupe sanguin : Le groupe sanguin prédominant est O+ (47%).
Diagramme N°7 : répartition des groupes sanguins
V. L’exploration para clinique
A. FOGD et résultats des biopsies
1. Aspect tumoral
Tous les patients ont bénéficié de la FOGD (100%) avec la mise en évidence d‟aspects macroscopiques variés et prédominance des tumeurs ulcéro-bourgeonnantes (47%).
2. Résultats des biopsies
L‟ADK moyennement différencié représente le type histologique prédominant (32%), suivi des ADK à cellules dissociées (28%).
Diagramme N°8 : le type histologique
3. Localisation tumorale
L‟antre représente la localisation prédominante (56%) suivi de l‟atteinte étendue à tout l‟estomac (27%)
B. TOGD
40% des patients ont bénéficié du TOGD qui a objectivé plusieurs aspects avec une sensibilité diagnostique de 53%.
C. Echographie abdominale
77% des patients ont bénéficié de l‟échographie abdominale mais avec une sensibilité diagnostique qui ne dépasse pas les 44%.
D. TDM abdominale
Seulement 33% des patients ont bénéficié d‟une TDM abdominale avec une sensibilité diagnostique de 84%.
E. Echo-endoscopie : n‟a pas été faite F. Radiographie pulmonaire
Tous les patients ont bénéficié d‟une radiographie pulmonaire dont : 73 cas n‟avaient rien à signaler et 2 cas avaient des images séquellaires Notons que le bilan d‟extension loco-régional a objectivé l‟envahissement aux organes de voisinage dans seulement 8% des cas.
VI. Traitement
A. chirurgie
1. Opérabilité : On note un taux d‟opérabilité important dépassant les 97%
Diagramme N°10 : l‟opérabilité dans notre série
2. Résécabilité
La résection a été effectué chez un 1/3 des patients (34%) dont : 11 cas à visée curative (15%) et,
14 cas à visée palliative (19%)
Les 2/3 des patients n‟ont pas été réséqués. (66%) Diagramme N°11 : la résécabilité dans notre série
a. Les réséqués :
Type de gastrectomie
La GEOV était pratiquée chez 11 cas (44%) dont : 7 GPIE
4 GTE
La GPI était pratiquée chez 10 cas (40%) et, La GT était pratiquée chez 4 cas (16%)
Diagramme N°12 : les types de gastrectomie dans notre série
Extension de l’exérèse aux organes de voisinage
11 patients ont eu une extension de l‟exérèse aux organes de voisinage : 4 cas ont eu une extension au mésocolon
2 cas au colon 2 cas au foie 1 cas à la VB
1 cas au mésocolon + rate
Type d’anastomose
64% étaient des anastomoses gastro-jéjunales 32% étaient des anastomoses oeso-jéjunales 4% étaient des anastomoses gastroduodénales
Curage ganglionnaire
48% des patients réséqués ont subi une D1 28% des patients réséqués ont subi une D1.5 12% ont subi une D2et,
12% ont subi une D0
Diagramme N°13 : le curage ganglionnaire dans notre série
b. Les non réséqués :
Les 2/3 des patients n‟ont pas été réséqués dont : 54% ont subi une laparotomie exploratrice
Voici les raisons de l‟abstention à l‟exérèse :
27 cas pour carcinose dont 2 cas diagnostiqués en pré-opératoire grâce à l‟écho. abd.
14 cas pour tumeurs non résécables (envahissement du pancréas, envahissement du pédicule hépatique…) sur des données per-opératoires.
3 cas pour métastases hépatiques non résécables dont 2 mises en évidence par l‟échographie abdominale.
3 cas pour ADP distales
1 cas pour MEG avec geste nécessaire trop lourd.
B. Traitement adjuvant
Seulement 5 patients ont bénéficié d‟une chimiothérapie dont: 2 chimiothérapies adjuvantes
2 chimiothérapies exclusives et, 1 chimiothérapie néo-adjuvante VII. Données des CRO
A. Organes envahis:
Plus de 25% des organes envahis sont représentés par l‟envahissement du pancréas (la localisation précise n‟a pas été identifiée) suivi de L‟envahissement du mésocolon dans 22% des cas.
Diagramme N°14 : la répartition selon les organes envahis
A. Métastases viscérales
41% des patients étaient déjà au stade métastatique avec prédominance des carcinoses péritonéales (67%) , suivi des métastases au niveau du foie + péritoine (20%), les métastases hépatiques (10%), et une métastase surrénalienne (3%).
B. Stade tumoral et résécabilité:
La majorité des patients qui avaient un stade III ont bénéficié d‟une résection, alors que la plupart des patients qui avaient un stade IV n‟ont pas été réséqués.
VIII. Les résultats anatomo-pathologiques
A. Caractères macroscopiques de la tumeur
L‟aspect UI était l‟aspect macroscopique prédominant des pièces opératoires.
B. Taille de la tumeur
Les tailles des tumeurs varient entre 4cm et 24cm avec une taille moyenne de 8,6 cm.
C. Type de résection : R0, R1, R2.
Chez les patients réséqués, la résection R0 était la plus utilisée : 68% pour R0 versus 24% pour R1 et R2.
D. Résultats du curage ganglionnaire
L‟envahissement ganglionnaire était objectivé chez 78% des patients réséqués (25 patients) et chez 63% des patients réséqués à visée curative (11 patients).
IX. Les suites opératoires
B. Mortalité postopératoire
4% des patients opérés sont décédés dans le premier mois suivant l‟opération.
C. Morbidité postopératoire
9 ,5%des patients opérés ont eu une morbidité en post-opératoire.
D. Recul
Le recul moyen dans notre série est: 9,6 mois.
E. Survie
1. La survie globale :
a. Chez tous les patients :
D‟après la courbe de survie globale de nos patients on note :
Une chute importante du taux de la survie globale, en effet 50% de nos patients sont décédés dans les 6 premiers mois suivant leur hospitalisation.
La survie globale dans notre série est estimée à :
- 22% à 1 an
- 5% à 3 ans - 1,5% à 5 ans
Comment peut-on décrire donc le pronostic du CGLA dans notre série ?
b. La survie globale selon la résécabilité :
D‟après l‟analyse de la courbe de survie selon la résécabilité on constate : - Un taux de survie plus important chez les réséqués par rapport aux non
réséqués durant les 18 premiers mois suivant l‟intervention chirurgicale. - Une baisse plus aigue du taux de survie des réséqués après les 18
premiers mois qui tend vers celui des non réséqués.
- A partir du 27 ème mois, les taux de survie de nos patients deviennent pratiquement identiques qu‟ils soient réséqués ou non.
La résection a-t-elle donc un impact sur la survie ?
Diagramme N°16 : La survie globale selon la résécabilité :
2. La survie médiane: est estimée à 9,6 mois.
Nous avons essayé d‟analyser la survie médiane des patients selon plusieurs paramètres, indépendamment des autres facteurs qui peuvent influencer la survie.
Voici les résultats :
a. La survie médiane selon la résécabilité :
On note que la survie médiane des réséqués est meilleure que celle des non réséqués. (15 mois versus 7 mois).
b. La survie médiane selon le type de gastrectomie :
La survie médiane des patients qui ont subi une GEOV est meilleure que celle des GT et des GPI.
(19 mois versus 16 mois et 11 mois respectivement)
Faut-il faire donc des résections élargies dans les cancers gastriques localement avancés ?
c. La survie médiane selon le type de curage ganglionnaire :
La survie médiane des patients qui ont subi un curage D1 ou D1, 5 est nettement meilleure que celle des curages D0 et D2.
Quel type de curage réaliser ?
d. La survie médiane selon les types de chimiothérapie :
La survie médiane des patients qui ont eu une chimiothérapie adjuvante est meilleure que celle de la chimiothérapie néoadjuvante alors que la survie des patients ayant eu une chimiothérapie exclusive est médiocre.
Quel traitement complémentaire choisir ?
I. Etude épidémiologique
A. Epidémiologie descriptive :
1. Incidence et répartition géographique :
Le cancer de l‟estomac reste au 2 ème rang des cancers dans le monde après le cancer du poumon avec une incidence qui atteint approximativement 875.000 nouveaux cas par an. Les taux d‟incidence pour 100.000 habitants standardisés selon la population mondiale de référence sont de 18 pour le sexe masculin et 7 pour le sexe féminin. [2]
L‟incidence du cancer de l‟estomac est l‟objet de grande variation géographique, c‟est au japon qu‟elle est la plus élevée (80 cas pour 100.000 habitants), suivie de la chine, de l‟Amérique du sud, de l‟Europe de l‟est et du sud notamment le Portugal. L‟Europe occidentale et l‟Amérique du nord sont des régions à risque moyen alors que l‟Afrique est considérée à risque faible (4 cas pour 100.000 habitants). [2]
En France, l‟incidence était estimée en 2000 à 9,3/100.000 habitants chez l‟homme et 3,4/100.000 habitants chez la femme (taux standardisés à la population mondiale) [3]. Le nombre de nouveaux cas est estimé à environ 7.000 par an. [4].
Au Maroc, selon le premier rapport du registre des cancers du grand Casablanca, l‟incidence du cancer gastrique est moins importante, elle est de 4,13/ 100.000/an chez l‟homme et 3,03 /100.000/an chez la femme, il occupe ainsi la 8ème place parmi les autres cancers. [5]
Dans notre série la majorité des patients provenaient de la région de Rabat-salé-zemmour-zair et le recrutement annuel hospitalier est de 12 ,5 cas/an.
Cette répartition géographique n‟est pas fiable, vu la proximité de la clinique aux patients habitants la région de Rabat-Salé-Zemmour-Zair et vu que notre série ne traite pas des résultats à l‟échelle nationale.
Si le cancer gastrique localement avancé qui fait l‟objet de notre étude représente d‟après la littérature 59,8%, dans notre série il représente 39%, alors qu‟en France, 50 à 65% des adénocarcinomes de l‟estomac sont de stade III ou IV de la classification TNM. [3].
2. L’âge et le sexe : [6]
Le cancer de l‟estomac est un cancer rare avant 50 ans pour les deux sexes, il s‟élève très rapidement après 50 ans.
Ce paramètre a été respecté puisque dans notre série la moyenne d‟âge était 57ans et la tranche d‟âge la plus touchée est entre 50 et 70 ans.
Le sexe ratio dans le monde varie entre 1,24 et 3,81.
Dans notre série le sexe ratio est : 2,4 avec une nette prédominance masculine.
B. Epidémiologie analytique : [2]
1. Facteurs endogènes :
a. conditions précancéreuses
L‟OMS a définit les notions de conditions et de lésions pré cancéreuses permettant de définir une population à haut risque justiciable d‟une surveillance régulière à l‟âge de survenue du cancer. Cependant ces états précancéreux ne sont retrouvés que dans 15 à 20 %.
Ulcère chronique de l’estomac :
Le risque relatif de cancer gastrique est de 1,5 à 2 fois plus élevé chez les sujets présentant un ulcère gastrique par rapport à une population témoin.
Dans notre série 3 patients avaient un ulcère de l’estomac. La maladie de Biermer :
L‟incidence annuelle du cancer serait de 1 %. La maladie de Ménétrier :
L‟incidence est estimée à 14% dans la gastrite hypertrophique de ménétrier. Les polypes gastriques :
Dans 85% des cas ils correspondent à des polypes hyperplasiques non susceptible de transformation maligne.
Moignon de gastrectomie partielle : [7]
Le risque de survenue de cancer gastrique sur moignon de gastrectomie s‟élève après 15 ans. Il peut être 2 à 8 fois plus élevé que dans la population générale.
Gastrite chronique atrophique :
L‟origine de la gastrite chronique atrophique est multifactorielle.
Au cours de la gastrite chronique atrophique avec métaplasie intestinale, 11% des patients développeront un cancer gastrique.
b. Lésions Précancéreuses
La dysplasie de la muqueuse :
Une étude italienne suggère que si la dysplasie peut régresser, elle peut également progresser vers le cancer : dans 7% des cas de dysplasie moyenne et dans 55% des cas en cas de dysplasie sévère.
La métaplasie intestinale : [8]
Elle est souvent associée au cancer de l‟estomac. Les études histochimiques suggèrent qu‟une forme particulière, la métaplasie intestinale incomplète de type 3, est un indicateur élevé de cancer gastrique.
2. Facteurs exogènes :
a. Facteurs alimentaires à risque
Rôle du sel :
La consommation élevée de sel jouerait un rôle dans les stades initiaux de la cancérogénèse.
Rôle des nitrates et nitrosamines :
La consommation d‟eau chargée en nitrate, l‟utilisation d‟engrais nitrités constituent une exposition aux nitrites et donc au risque de cancer gastrique.
b. Facteurs alimentaires protecteurs
Les légumes et les fruits pourraient jouer un rôle protecteur par le biais de la vitamine C et du β-carotène.
3. Infection par l’helicobacter pylori [9]
Il est actuellement reconnu comme facteur déterminant de la cancérogénèse gastrique en raison d‟études physiopathologiques et épidémiologiques concordantes.
Plusieurs méta-analyses regroupent de vastes études épidémiologiques ont établi que le risque relatif de cancer gastrique est de 2 à 6 fois plus élevé chez les sujets infectés par helicobacter pylori par rapport à une population non infectée.
L’infection par l’helicobacter pylori n’a pas été évaluée dans notre série par manque de documentation.
4. Tabac et alcool
Le tabac et l‟alcool ne sont pas des facteurs étiologiques essentiels, mais plusieurs études cas-témoins, ou de cohortes, suggèrent qu‟une forte consommation augmente le risque de cancer gastrique.
Dans notre série 16 patients étaient tabagiques. II. Etude anatomopathologique [2]
L‟anatomie pathologique joue un rôle important dans la prise en charge des cancers de l‟estomac, rôle diagnostique par l‟examen des prélèvements biopsiques et rôle pronostique par la détermination du degré d‟extension tumorale sur la pièce opératoire qui est l‟un des éléments importants du pronostic et donc de la décision d‟éventuels traitements complémentaires.
Les cancers de l‟estomac sont dans 90% des adénocarcinomes développés aux dépens de l‟épithélium gastrique. Les autres tumeurs sont des lymphomes (5%), des tumeurs neuroendocrines (3%) et des tumeurs stromales. Un diagnostic histologique précis est nécessaire pour adapter le traitement et apprécier le pronostic de ces tumeurs.
Les types histologiques autres que les ADK n’ont pas été inclus dans notre étude, vu leurs pronostics différents.
En effet, l’ADK moyennement différencié représente le type histologique prédominant (32%).
III. Etude Clinique [1][10][11]
Les manifestations cliniques du cancer gastrique sont très variées, rarement évocatrices, souvent très banales parfois trompeuses et presque toujours déjà en retard sur les lésions anatomiques.
A. La symptomatologie fonctionnelle :
Les maîtres symptômes du cancer antro-pylorique sont représentés par la douleur épigastrique et les vomissements, alors que la dysphagie constitue le signe le plus fréquent retrouvé dans le cancer proximal.
1. La douleur épigastrique :
C‟est le motif le plus fréquent de la consultation observée dans 50% à 80% des cas.
Souvent d‟apparition récente, elle peut être une simple pesanteur ou gêne épigastrique ou peut prendre le masque d‟un syndrome ulcéreux typique répondant au traitement médical. Parfois cette douleur est remplacée par de simples troubles dyspeptiques : type éructation, nausées, ballonnements postprandial…
Dans notre série, la douleur épigastrique s’est manifestée chez 88 % des patients.
Par conséquent, tout patient âgé de plus de 50ans se plaignant d’une douleur épigastrique doit bénéficier d’une FOGD.
2. L’amaigrissement :
La perte de poids est retrouvée dans toutes les séries avec une incidence moyenne de 60-80%, son importance est souvent corrélée au stade de la tumeur. Il s‟associe à une AEG, une asthénie et une anorexie.
Il est cependant un élément aspécifique et tardif.
Notre série a retrouvé l’amaigrissement chez 62% des patients.
3. Les vomissements :
Les vomissements postprandiaux sont fréquents en cas de sténose de la région antro-pylorique.
49,20% de nos patients avaient des vomissements
4. La dysphagie :
Est le signe le plus souvent retrouvé dans le cancer proximal, vu la situation anatomique particulière du cardia.
La dysphagie a été retrouvée chez 8% de nos patients
5. L’hémorragie digestive :
Le plus souvent, il s‟agit d‟un saignement occulte responsable d‟une anémie microcytaire hypochrome, rarement elle peut s‟extérioriser sous forme d‟hématémèse, de méléna ou de rectorragies.
30,66% de nos patients avaient des hémorragies digestives
6. Les troubles du transit :
Il s‟agit surtout de diarrhée, plus rarement de constipation. 16% de nos patients présentaient des troubles du transit
7. Les complications révélatrices :
Dans certains cas, le cancer gastrique est découvert à la suite d‟un accident aigu :
- Une perforation en péritoine libre
- Une hémorragie digestive cataclysmique - Un syndrome de sténose pylorique aigu.
Aucun patient n’a présenté l’une de ces complications révélatrices.
8. Le syndrome paranéoplasique :
Sous forme de fièvre isolée, de phlébites récidivantes, d‟acanthosis nigricans, de neuropathie périphérique…
Aucun patient n’a présenté un syndrome paranéoplasique.
Ailleurs, le sujet peut être asymptomatique et la découverte du cancer se fait fortuitement lors d‟une endoscopie.
B. Délai entre le premier symptôme clinique et le diagnostic :
D‟après la littérature un délai de plus de 6 mois, dans la plupart des cas s‟écoule entre les premiers symptômes cliniques et le diagnostic.
Le délai moyen entre le début des symptômes et l’hospitalisation dans notre série est de 9,4 mois.
Ceci peut être expliqué par la banalisation des symptômes qui n’inquiètent pas les patients, au recours aux thérapeutiques traditionnelles et au manque de structures sanitaires.
C. Signes physiques :
Le plus souvent l‟examen clinique est strictement normal, mais dès que les signes physiques se manifestent, cela correspond déjà à un cancer avancé.
Cependant, il reste fondamental pour apprécier le bilan d‟extension.
La tumeur gastrique peut être perçue sous forme d‟un empâtement ou d‟une masse épigastrique dure, peut être fixe par rapport au plan profond et/ou plan superficiel, elle traduit une tumeur avancée ayant envahi la séreuse et parfois un ou plusieurs organes de voisinage.
L‟examen clinique recherche aussi une hépatomégalie métastatique par la palpation de l‟aire hépatique, un ganglion de troisier, plus rarement une ascite retrouvée à la palpation, la percussion abdominale et les touchers pelviens, traduisant des métastases péritonéales.
Les signes physiques de nos malades sont représentés essentiellement par : la masse abdominale (22%).
IV. Bilan diagnostique et d’extension :
A. Bilan diagnostique :
1. F.O.G.D couplée aux biopsies: [1] [12]
La fibroscopie couplée aux biopsies multiples est la clé du diagnostic du cancer gastrique : permettant ainsi de voir la lésion, de préciser son siège et d‟avoir une certitude histologique du cancer. Elle constitue le fondement de l‟approche diagnostique pour les lésions dont le développement est muqueux, elle est moins performante dans les extensions sous muqueuses ou le transit gastroduodénal garde un réel intérêt même s‟il est à tort moins utilisé.
La fibroscopie permet en outre le diagnostic différentiel notamment : Ulcère gastrique
Tumeur gastrique bénigne
Envahissement gastrique de contigüité Bézoards ou corps étrangers
Localisation gastrique de maladies hématologiques La F.O.G.D est actuellement systématiquement utilisée.
Dans notre série, tous les patients ont bénéficié de la FOGD avec une sensibilité diagnostique de 100% et une prédominance des tumeurs ulcéro-bourgeonnantes (46,66%).
L’ADK moyennement différencié représente le type histologique prédominant (32%), suivi des ADK à cellules dissociées (28%) et 56% des tumeurs siégeaient au niveau de l’antre et 27% occupaient tout l’estomac.
2. T.O.G.D : [1] [12]
Le T.O.G.D peut être utile pour aider au diagnostic macroscopique d‟une linite gastrique ou préciser les données de l‟endoscopie sur l‟étendue de la lésion, il a également un intérêt dans l‟approche des lésions sous muqueuses à partir d‟une technique en double contraste très rigoureuse. [13]
Il peut identifier à la fois des ulcères malins et des lésions infiltrantes avec une sensibilité de 99% et une spécifité de 96% mais la fréquence des faux négatifs évaluée de façon prospective peut atteindre 50%. [14]
40% de nos patients ont bénéficié du TOGD avec une sensibilité diagnostique de 53%.
B. Bilan d’extension
1. L’intérêt du bilan préopératoire : [15]
L‟intérêt du bilan préopératoire est double, d‟une part pour la stratégie thérapeutique, d‟autre part pour le pronostic.
Sur le plan chirurgical, la connaissance du siège, de l‟aspect macroscopique, du type histologique et de l‟extension locorégionale pariétale et ganglionnaire et à distance, l‟appréciation de l‟état général et de l‟âge permettent de prévoir l‟opérabilité et la résécabilité du cancer de l‟estomac, et de choisir le type de gastrectomie et le mode de curage ganglionnaire.
Pourtant dans notre série, l’extension des tumeurs était fréquemment sous évaluée par le bilan préopératoire conventionnel et par conséquent l’intension et la décision de l’opérateur de réséquer ne se concevait qu’après l’exploration opératoire d’autant plus que l’E.E et la laparoscopie n’étaient pas pratiquées.
En effet, dans le cas de cancer gastrique avancé, l’E.E et la laparoscopie peuvent éviter une laparotomie inutile et parfois morbide et conduire à une éventuelle inclusion du malade dans un protocole de traitement complémentaire adjuvant (radiothérapie, chimiothérapie), ou néo-adjuvant.
2. Les moyens du bilan d’extension :
a. La radiographie pulmonaire : [16]
Elle permet la détection des métastases pulmonaires mais avec une sensibilité inférieure à celle du scanner thoracique.
Chez les patients ayant une radiographie pulmonaire normale, un ou plusieurs nodules pulmonaires sont détectés au scanner thoracique dans 30% des cas mais correspondent histologiquement à des métastases dans moins de 10% des cas.
Dans notre série, la radiographie pulmonaire a été réalisée systématiquement chez tous les patients et a objectivé 2 cas de séquelles.
b. L’échographie abdominale: [16]
Elle peut mettre en évidence un épaississement pathologique tumoral de la paroi gastrique, une ascite témoin d‟une carcinose péritonéale ou une distension liquidienne de la lumière digestive en amont d‟une sténose. Les ADPs sont bien repérées dans la région coelio-mésentérique, tandis que les autres territoires peuvent échapper à l‟exploration échographique.
Pourtant seulement 77% de nos patients ont bénéficié d’une échographie abdominale avec une sensibilité diagnostique qui ne dépasse pas les 44%.
Très sensible pour le diagnostic des métastases hépatiques, l’échographie doit être systématique dans le bilan préopératoire.
c. La TDM abdominale: [17]
Cet examen a tendance à sous estimer l‟extension loco-régionale. Selon les séries, la concordance avec le tumor-nodes-métastases (TNM) est pour le T de 51% à 67%, pour le N de 51% à 73%, pour les métastases hépatiques de 57% à 87% et pour la carcinose péritonéale de 30% à 70%.
Le scanner avec ingestion d‟eau augmente la sensibilité de l‟examen en permettant une meilleure étude de la paroi gastrique.
L‟envahissement des organes de voisinage est suspecté en cas de perte de liseré graisseux et les ganglions sont considérés comme envahis s‟ils mesurent plus de 15 mm.
Dans notre série, seulement 33% des patients ont bénéficié d’une TDM abdominale avec une sensibilité diagnostique de 84%.
La TDM abdominale doit donc être indiquée d’avantage dans le cadre du bilan pré-opératoire pour mieux préciser l’extension loco-régionale et à distance.
d. L’écho-endoscopie [1] [15]
L‟E.E est d‟une précision diagnostique d‟environ 80% pour la pénétration pariétale (T), en particulier pour les cancers superficiels où elle peut différencier les lésions intra muqueuses et les lésions atteignant la sous muqueuse dont le risque ganglionnaire est plus élevé.
La précision diagnostique pour l‟envahissement ganglionnaire (N) est moins bonne, autour de 60%, en particulier dans le cas de ganglions de petite taille.
En effet, dans une étude de Mortensen [15] portant sur 44 patients, il a été montré que l‟E.E avait une excellente précision diagnostic pour prédire la résécabilité des cancers de l‟estomac :
- Précision de 100% pour les tumeurs résécables - Et de 88% pour les tumeurs non résécables.
Concernant l‟envahissement des organes de voisinage : L‟E.E a une précision diagnostic de 80%.
En comparaison avec la TDM, l‟E.E est considérée comme donnant des résultats plus précis concernant notamment la distinction entre une adhérence inflammatoire de la tumeur à un organe de voisinage versus l‟envahissement histologique de cet organe.
Dans notre série l’E.E n’a été pratiquée chez aucun patient, car non disponible durant la période de l’étude.
Pourtant, L’E.E est devenu l’examen de référence dans le bilan d’extension loco-régionale, elle s’avère plus performante que la TDM pour la classification TNM pré thérapeutique, elle doit donc avoir une place dans le bilan d’extension car elle permet de mieux stadifier la tumeur en pré-opératoire et d’avoir ainsi une idée sur sa résécabilité.
e. La laparoscopie [15]
La réalisation d‟une laparoscopie préopératoire permet de récuser 37 à 41% des malades, chez qui des métastases hépatiques, péritonéales superficielles, ou ganglionnaires distales n‟ont pas été détectées par les examens morphologiques préopératoires.
Une étude du Mémorial-Sloan kettering Cancer Center [15] portant sur 111 malades atteints d‟ADK gastrique, ayant eu un examen clinique, une fibroscopie gastrique, une échographie abdominale et un scanner spiralé abdomino-pelvien préopératoire ; la laparoscopie a été possible dans 110 cas :
La laparoscopie a permis la précision du staging laparoscopique dans 94% avec une sensibilité de 84% et une spécifité de 100% pour le diagnostic de maladie métastatique.
La laparoscopie permet en outre la réalisation d‟une cytologie péritonéale et peut être utilisée en second look après une chimiothérapie néo-adjuvante.
La laparoscopie n’a pas été faite dans notre série.
Cependant, elle doit faire partie du bilan d’extension car elle permet d’éviter dans certains cas au malade une laparotomie inutile et parfois morbide et permettre éventuellement d’inclure le malade dans un protocole de traitement néoadjuvant.
f. L’exploration per-opératoire : [15]
Elle vient compléter le bilan d‟extension préopératoire et va permettre le choix de la technique d‟exérèse gastrique et ganglionnaire.
L‟exploration consiste à vérifier l‟absence de métastases hépatiques ou ganglionnaires à distance en particulier pré-aortique ou rétro-pancréatique, à explorer minutieusement le péritoine à la recherche de lésions de carcinose au niveau du grand épiploon, de l‟arrière cavité, de l‟étage sous-méso colique y compris le pelvis et les ovaires avec une possibilité en cas de cancer gastrique avancé, à expression séreuse, ou de doute sur une carcinose péritonéale, de réaliser un examen extemporané ou une cytologie péritonéale.
Dans notre série, l’exploration per-opératoire était un temps primordial pour la décision de la stratégie thérapeutique à suivre, car le bilan pré-opératoire sous estimait dans la majorité des cas l’extension tumorale loco-régionale et à distance.
V. Traitement :
A. Chirurgie :
Bien que l‟incidence des cancers de l‟estomac diminue dans la population générale, son pronostic n‟a guère été amélioré au cours des dernières décennies, il reste sombre et redoutable. Le taux de survie à 5 ans est de 15% tous stades confondus. [18]
En l‟absence d‟un traitement adjuvant faisant preuve de son efficacité, une exérèse chirurgicale élargie aux organes adjacents à visée curative associée à un curage ganglionnaire peut encore être justifiée dans le cancer gastrique localement avancé.
Le but du traitement chirurgical radical du cancer gastrique est d‟aboutir à une exérèse ne laissant en place aucun résidu tumoral (R0), en effet, l‟union internationale contre le cancer (UICC) utilise une certaine dénomination pour caractériser la résection chirurgicale : la lettre R, ainsi on distingue :
R0 : Absence de résidu tumoral microscopique R1 : Présence d‟un résidu tumoral microscopique R2 : Présence d‟un résidu tumoral macroscopique.
La technique de résection devra répondre aux principes oncologiques et tenir compte du siège de la tumeur, de son type histologique et de son extension aux organes de voisinage qui détermineront l‟étendue de l‟exérèse gastrique et du curage ganglionnaire qui reste encore discutée.
Une exérèse n‟est considérée à visée curative que lorsqu‟il n‟y a pas de métastases viscérales ou péritonéales et que les ganglions distaux de la pièce de résection sont sains d‟où l‟importance d‟un bilan pré et per-opératoire minutieux, il s‟agit d‟une exérèse macroscopiquement complètes quelque soit l‟étendue de la tumeur.
A noter que l‟extension d‟un cancer gastrique peut prendre 5 directions :[19]
Une extension horizontale : dans la paroi gastrique. Une extension verticale : vers les organes de voisinage. Une extension lymphatique.