HAL Id: tel-01124299
https://tel.archives-ouvertes.fr/tel-01124299
Submitted on 6 Mar 2015HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Étude comportementale de la spadine et de ses
analogues : un nouveau concept d’antidépresseur
Julie Veyssiere
To cite this version:
Julie Veyssiere. Étude comportementale de la spadine et de ses analogues : un nouveau concept d’antidépresseur. Sciences agricoles. Université Nice Sophia Antipolis, 2014. Français. �NNT : 2014NICE4004�. �tel-01124299�
Université de Nice – Sophia Antipolis
Ecole Doctorale des Sciences de la Vie et de la Santé
THESE
Présentée pour obtenir le titre de
Docteur en Sciences de la Vie
De l’Université Nice – Sophia Antipolis
Mention Interactions Moléculaires et Cellulaires
Présentée et soutenue le 28 Février 2014 par :
Julie VEYSSIERE
Etude comportementale de la spadine et de ses
analogues : un nouveau concept d'antidépresseur.
Jury
Dr. Florence NOBLE
Présidente du jury
Pr. Jean-Marie VAUGEOIS
Rapporteur
Dr. El Chérif IBRAHIM
Rapporteur
Dr. Georges GAUDRIAULT
Examinateur
Dr. Marc BORSOTTO
Directeur de thèse
Remerciements
Je tiens tout d’abord à remercier tous les membres du jury d’avoir accepté de lire et de juger mon travail de thèse. Merci au Dr Florence Noble d’avoir
accepté de présider le jury, merci aux rapporteurs, le Pr Jean-Marie Vaugeois
et le Dr El Cherif Ibrahim.
Catherine, un grand merci pour m’avoir accueillie dans votre équipe. A mon arrivée vous m’avez dit que la porte de votre bureau serait toujours ouverte, et ce fût le cas. Vous êtes toujours d’une grande franchise et c’est grâce à cela que j’ai pu avancer.
Marc, je vous suis très reconnaissante de l’enseignement que vous m’avez apporté. Ces 3 ans passés en votre compagnie m’ont (comme vous le répétez souvent) fait prendre confiance en moi. Au lieu de me morfondre sur les erreurs commises j’ai appris à chercher (et à trouver !) des solutions. En revanche, pour le calcul mental vous avez encore du pain sur la planche pour que je réponde du tac au tac…
Un grand merci à toute l’équipe de MedinCell. Anh qui m’a acceuillie dans son entreprise et dont l’enthousiasme est communicatif, Georges qui a suivi le projet de très près pendant ces 3 années et qui m’a encadrée depuis Montpellier, et enfin je remercie Anthony qui m’a initiée aux études in vitro des polymères.
Fabien, tu as été le premier à devoir me supporter au travail. Grâce à ces moments passés ensemble à Animex on a développé une vraie complicité qui persiste même si tu es parti du labo. Les moments « Water Maze » seront gravés dans ma mémoire !! Tu m’as aidée à tenir le coup la première année lorsque je ne connaissais personne. Je te remercie pour tous ces moments passés avec toi et pour le Pedrolito que tu m’as offert.
A mon Chibani, merci d’avoir partagé mon bureau pendant ces 3 années. T’entendre râler au quotidien devant ton ordinateur fût un réel bonheur…
Hamid, tu as été présent pendant presque toute ma thèse, et je suis sûre que tu as obtenu ce poste de Maître de Conférence pour fuir et éviter d’avoir à me supporter pendant les derniers mois… Tu as eu raison parce que le chocolat ne suffisait plus à me destresser… Merci de m’avoir écoutée pendant 3 ans, et d’avoir continué de m’apporter ton aide à distance.
Merci également à tous mes collègues du 401 :
Cathy, tes leçons de statistiques m’auront été bien utiles,
A Carine, pour les moments « artistiques », le partage de nos dessins, A Nicolas et Carole pour les longues discussions du vendredi soir, A Julia, Agnès, Elsa et Jérémy pour votre bonne humeur quotidienne.
Et ceux du 409 :
Joe, ta franchise est une qualité que j’apprécie beaucoup chez toi. Merci pour les longues discussions que nous avons eu au sujet de ma thèse.
Alice, ton calme m’impressionne, tu trouves toujours les mots pour dédramatiser toutes les situations.
Thomas L, tu as enrichi mon vocabulaire pendant nos pauses repas. Même si quelques fois je ne comprenais rien à ce que tu disais...
Merci à toute l’équipe Mazella, plus particulièrement à Jean pour sa bonne humeur et Christelle pour tous ces moments à l’animalerie à faire des injections et à passer tous les potins en revue.
Merci à Franck, ton aide apportée pour la réalisation des schémas rend ma thèse beaucoup plus agréable.
Ophélia, tu as été à l’écoute plus d’une fois, et je t’en remercie. Miled, le pro du mime ! Tu m’as fait beaucoup rire… Mais une anémone c’est une plante ! Merci à vous deux pour les bons moments partagés au labo mais également au dehors.
Thomas, qui aurait cru que je rencontre quelqu’un capable de râler plus que moi ? C’était mission impossible. Et pourtant tu as relevé le défi. Merci de ton « implication » durant ces mois de rédaction… et surtout merci pour tous les bons moments passés ensemble.
Emilie M, mon bouchon, tu es un rayon de soleil dans le labo ! Sauf quand tu décides de me jeter des confettis dessus… J’attends toujours le Brunch…
Kévin, merci d’avoir été présent tout au long de cette dernière année ! Ces derniers mois nous ont sans aucun doute rapprochés et ont donné naissance à une « franche » amitié !
Emilie P, on a traversé l’épreuve de la thèse ensemble. Nos pauses me manquent. A très bientôt sur Orléans.
Elsa, depuis toutes ces années (22 ans quand même !) tu as toujours été présente malgré tous les kilomètres qui ont pu nous séparer. Merci à toi d’être toujours disponible et à mon écoute.
Marylou, une belle amitié qui a débuté en Ecosse. Cette année passée avec toi à Aberdeen reste un de mes meilleurs souvenirs. Et l’aventure continue pour toi… à Boston… Je viendrais te voir sans faute !
Jennifer, les révisions avec toi m’ont marquée ! Tu m’as toujours « forcée » à travailler et tu as toujours cru en moi. Merci d’être restée durant toutes ces années.
Laure, on s’est rencontrée pendant mon master 2 à Lyon, et avec toi j’ai compris que la thèse ce n’était pas facile tous les jours mais que ça en valait la peine ! Merci d’avoir été présente cette année là et de l’être toujours depuis.
Et enfin, à mes parents sans qui rien de tout cela n’aurait été possible. Vous m’avez permis de toujours faire ce que je voulais vraiment, et vous m’avez fait confiance lorsque j’ai décidé de partir étudier en Ecosse. Merci d’être là pour moi.
Une pensée particulière à Nicole et à nos moments de papotage à l’animalerie et dans son bureau.
Abréviations
5-HIAA : Acide 5-HydroxyIndolAcétique 5-HT : 5-HydroxyTryptamine, sérotonine AA : Acide Arachidonique
AC : Adénylate Cyclase
ACTH : AdrénoCorticoTropic Hormone (corticotrophine) ADN : Acide DésoxyriboNucléique
AGPI : Acides Gras PolyInsaturés AKAP150 : A-Kinase Anchoring Protein ALA : Acide α-Linolénique
AMPA : α-Amino-3-hydroxy-5-Méthylisoazol-4-Propionate AMPc : Adénosine MonoPhosphate cyclique
ARNm : Acide RiboNucléique messager ATP : Adénosine TriPhosphate
ATV : Aire Tegmentale Ventrale
BDNF : Brain Derived Neurotrophic Factor (facteur neurotrophique cerebral) BHE : Barrière Hémato-Encéphalique
BrdU : 5-Bromo-2’-deoxyUridine
CHIMES : CHinese Medicine MLC601 Efficacy on Stroke recovery CMST : Conditioned Motility Suppression Test
COMT : Catéchol-O-MéthylTransferase CPF : Cortex PréFrontal
CREB : cAMP Response Element Binding protein CRF : Corticotropin Releasing Factor (corticolibérine) DA : Dopamine
DAG : DiAcylGlycérol
DAT : Transporteur de la dopamine
DBS : Deep Brain Stimulation (stimulation cérébrale profonde) DCX : Doublecortine
DHA : Acide DocosaHexaénoïque DOPA : L-DihydrOxyPhénylAlanine
DRN : Dorsal Raphe Nucleus (Noyau du raphé dorsal)
DSM : Diagnostic and Statistical Manual of Mental Disorders (manuel diagnostique et statistique des troubles mentaux)
FST : Forced Swimming Test (test de la nage forcée) GABA : Acide γ-AminoButyrique
GCL : Granular Cells layer (Couche granulaire) Glu : Glutamate
H/Rouen : Helpless/Rouen (souris résignées) HDAC : Histone DéACétylase
HDRS : Hamilton Rating Scale for Depression (échelle de dépression de Hamilton) HPA : Hypothalamic-Pituitary-Adrenal (axe hypothalamo-hypophyso-surrénalien)
HPLC : High-Performance Liquid Chromatography (Chromatographie en phase liquide à haute performance)
HSPA2 : Heat Shock Protein 2A
HTR1B : 5-HydroxyTryptamine Receptor 1B (gène du récepteur 5-HT1B) HTR2A : 5-HydroxyTryptamine Receptor 2A (gène du récepteur 5-HT2A) i.p. : intra-péritonéal
i.v. : intra-veineux IL10 : Interleukine 10
IMAO : Inhibiteurs de la MonoAmine Oxydase IP3 : Inositol triPhosphate
IRM : Imagerie par Résonnance Magnétique K2P : Canaux potassiques à deux domaines pore KRT: Tampon Krebs-Ringer-Tris
LH : Learned Helplessness (test de la résignation apprise) LPL : LysoPhosphoLipides
MAO : MonoAmine Oxydase
MCAO : Middle Cerebral Artery Occlusion (occlusion de l’artère cérébrale moyenne) MDD : Major Depressive Disorder
Mtap2 : Microtubule-associated protein MTC : Médecine Traditionnelle Chinoise NA : Noradrénaline
NeuN: Neuronal Nuclei (marqueur des neurons matures) NGF : Nerve Growth Factor (facteur de croissance neuronale) NH/Rouen : Non Helpless/Rouen (souris non résignées) NMDA : N-Méthyl-D-Aspartate
NRG1 : NeuRéGuline 1
NSF : Novelty Suppressed Feeding (test de la suppression de nourriture) OGD : Oxygen Glucose Deprivation (privation d’oxygène et de glucose) OMS : Organisation Mondiale de la Santé
PBS : Phosphate Buffered Saline PE : Propeptide
PEG :PolyEthylène Glycol PFA : ParaFormAldéhyde PKA : Protéine Kinase A PKC : Protéine Kinase C PLA : Acide PolyLactique PLC : PhosphoLipase C PTZ : PentyleneTetraZole PVN : Noyau ParaVentriculaire RAP : Receptor Associated Protein
RCPG : Récepteurs Couplés aux Protéines G s.c. : sous-cutané
SEM : Standard Error of the Mean (Erreur standard à la moyenne) SERT : SERotonin Transporter (Transporteur de la sérotonine) SGZ : SubGranular Zone (Zone sous-granulaire)
SLC6A4 : Solute Carrier Family 6 Member 4 (gène du transporteur de la sérotonine) SNC : Système Nerveux Central
SNc : Substance Noire compacte SNP : Single Nucleotide Polymorphism
SNRI : Serotonin/Noradrenaline Reuptake Inhibitors SSRI : Specific Serotonin Reuptake Inhibitor
SVZ : SubVentricular Zone (Zone sous-ventriculaire) TALK : TWIK-related Alkaline pH activated K+ channel
TASK : TWIK-related Acid Sensing K+ channel
TCAs : TriCyclic Antidepressants (antidépresseurs tricycliques) TEP : Tomographie par Emission de Positons
THIK : Tandem pore domain Halothane-Inhibited K+ channel
TNF : Tumor Necrosis Factor TPH : Tryptophane Hydroxylase
TRAAK : TWIK-Related Arachidonic Acid activated K+ channel
TREK : Twik RElated K+ channel
TRESK : TWIK-RElated Spinal cord K+ channel
TrkB : Tyrosine receptor kinase B
TST : Tail Suspension Test (test de la suspension par la queue) TWIK : Weak Inwardly rectifying channel
Liste des figures
Figure 1 : Coût des différentes pathologies du système nerveux central ... - 1 -
Figure 2 : Neuroanatomie et projections des monoamines ... - 5 -
Figure 3 : Schéma de la synthèse des catécholamines ... - 10 -
Figure 4 : Schéma de la synthèse de la sérotonine ... - 15 -
Figure 5 : Régulation de l'humeur, importance des monoamines ... - 19 -
Figure 6 : Régulation de l’axe hypothalamo-hypophyso-surrénalien ... - 21 -
Figure 7 : La neurogenèse hippocampique ... - 22 -
Figure 8 : Voies de signalisation du BDNF via son récepteur TrkB ... - 25 -
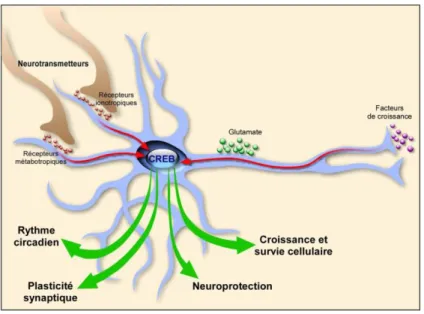
Figure 9 : Les différentes fonctions de CREB dans le système nerveux ... - 27 -
Figure 10 : Mécanismes d’action des antidépresseurs classiques ... - 31 -
Figure 11 : Représentation schématique du test de la nage forcée ... - 44 -
Figure 12 : Photo du dispositif du test de la suspension par la queue ... - 44 -
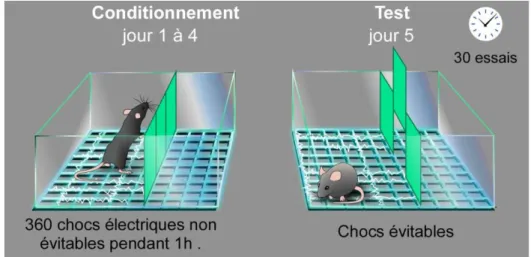
Figure 13 : Représentation schématique du test de la résignation apprise ... - 45 -
Figure 14 : Structure des trois familles des canaux potassiques ... - 50 -
Figure 15 : Arbre phyllogénique des canaux potassiques de type K2P ... - 51 -
Figure 16 : Schéma des différents effecteurs du canal TREK-1 ... - 56 -
Figure 17 : Interactions entre la sortiline et TREK-1 ... - 58 -
Figure 18 : La famille des récepteurs de type I, homologues à la protéine Vps10p ... - 59 -
Figure 19 : Maturation de la sortiline ... - 60 -
Figure 20 : Effets de la spadine sur l'activité du canal TREK-1 ... - 63 -
Figure 21 : Effet d'un traitement de 4 jours avec la spadine dans le FST et le TST ... - 63 -
Figure 22 : Effet de la spadine sur la neurogenèse hippocampique. ... - 65 -
Figure 23 : Augmentation de la transmission 5-HT avec un traitement spadine ... - 66 -
Figure 24 : Protocole du traitement à la corticostérone ... - 70 -
Figure 25 : Méthode rétro-inverso ... - 72 -
Figure 26 : Quantité de peptide libéré pour chaque formulation ... - 73 -
Figure 27 : Représentation schématique du test de la suppression de nourriture ... - 75 -
Figure 28 : Modèle d'ischémie focale chez la souris ... - 76 -
Figure 29 : Coupe transversale d’un cerveau de souris ... - 78 -
Figure 30 : Electrocardiogramme ... - 81 -
Figure 31 : Effet des traitements aigu et semi-chronique chez les souris Rouen dans le test de la nage forcée. ... - 87 -
Figure 32 : Effet de la spadine sur les souris H/Rouen dans le TST ... - 88 -
Figure 33 : Effet de la spadine dans le FST après un traitement à la corticostérone ... - 89 -
Figure 34 : Effet de la spadine dans le NSF après un traitement dans le modèle de dépression induit à la corticostérone ... - 89 -
Figure 35 : Etude de la neurogenèse sur les souris traitées à la corticostérone ... - 90 -
Figure 36 : Effets de la spadine libérée par différentes formulations durant 1 à 3 semaines, mesurés par le FST et le TST. ... - 103 -
Figure 37 : Schéma du dosage alpha screen™ ... - 106 -
Figure 38 : Protection neuronale du MLC601 et MLC901 sur des neurones corticaux en culture ... - 112 -
Figure 39 : Etude d'un traitement MLC601 et MLC901 sur la protection cérébrale ... - 114 -
Figure 40 : Amélioration des déficits fonctionnels après ischémie ... - 114 -
Figure 41 : Effet du MLC901 sur la neurogenèse ... - 115 -
Figure 42 : Marquage DCX après traitement avec le MLC 601 et MLC 901 ... - 115 -
Figure 43 : Marquage avec la synaptotagmine après traitement avec le MLC601 et le MLC901 ... - 116 -
Figure 44 : Effets de traitements avec le MLC601 ou le MLC901 sur la formation de "rosettes' de cellules souches humaines ... - 116 -
Liste des tableaux
Tableau 1 : Les récepteurs glutamatergiques ... - 8 -
Tableau 2 : Fonctions et localisation des récepteurs adrénergiques ... - 12 -
Tableau 3 : Les récepteurs dopaminergiques et leurs principales fonctions ... - 13 -
Tableau 4 : Exemples d'antidépresseurs tricycliques ... - 33 -
Tableau 5 : Inhibiteurs de la monoamine oxydase ... - 34 -
Tableau 6 : Inhibiteurs spécifiques de la recapture de la sérotonine ... - 35 -
Tableau 7 : Exemples d'antidépresseurs ayant une action sur les neurotransmetteurs ... - 35 -
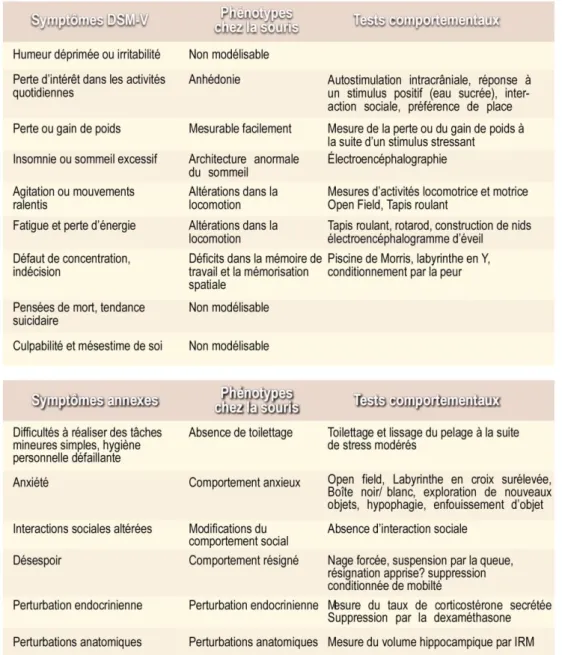
Tableau 8: Les modèles animaux caractéristiques des symptômes dépressifs humains ... - 42 -
Sommaire
Remerciements
Abréviations
Liste des figures
Liste des tableaux
Sommaire
Préambule
Introduction ... 1
-I. Les troubles de l’humeur ... - 2 -
a. Le trouble bipolaire ... 2
-b. La cyclothymie ... 2
-c. La dysthymie ... 2
-II. La dépression majeure ... - 2 -
a. Epidémiologie ... 3
-b. Etiologie ... 4
-III. La physiopathologie de la dépression majeure ... - 4 -
a. La neuroanatomie ... 4
-b. La neurotransmission ... 7
-i. Le glutamate ... 7
-ii. La théorie monoaminergique de la dépression ... 9
- Les catécholamines ... 10 - La transmission noradrénergique ... 11 - La transmission dopaminergique ... 12 - La transmission sérotoninergique ... 14 -c. L’axe hypothalamohypophysosurrénalien ... 20 -i. La neurogenèse ... 22
-ii. L’hypothèse neurotrophique ... 24
-d. L’hypothèse inflammatoire ... 28
-e. Génétique et épigénétique ... 29
-i. Dépression et génétique ... 29
-IV. Les traitements antidépresseurs ... - 31 -
a. Les traitements pharmacologiques ... 32
-i. Les antidépresseurs tricycliques ... 32
-ii. Les inhibiteurs de la monoamine oxydase ... 33
-iv. Les inhibiteurs de la recapture de la sérotonine ou de la noradrénaline ... 35
-v. Les triples inhibiteurs ... 36
-vi. Les antidépresseurs atypiques ... 36
-b. Les traitements non pharmacologiques... 38
-i. La psychothérapie ... 38 - La thérapie cognitivocomportementale ... 38 -ii. La luminothérapie ... 38 -iii. L’électroconvulsivothérapie ... 38 -iv. La neurochirurgie ... 39 - La neurochirurgie lésionnelle ... 39
- La stimulation du nerf vague ... 39
- La stimulation cérébrale profonde ... 40
- La stimulation magnétique transcrânienne ... 40
-c. Conclusion ... 41
-V. Les modèles animaux ... - 41 -
a. Les animaux peuventils être déprimés ? ... 41
-b. Les critères de validité ... 42
-c. Les tests comportementaux ... 43
-i. Stress aigu ... 43
- L’épreuve de la nage forcée ... 43
- Le test de la suspension par la queue ... 44
- La résignation apprise ... 45
-ii. Stress chronique ... 45
- Le modèle de stress chronique léger ... 45
-d. Les modèles animaux des troubles de l’humeur ... 46
-i. Les modèles génétiques ... 46
- Souris Rouen ... 46
- Souris C57BL/6NTac ... 46
-ii. Le modèle induit ... 47
- Exemple de modèle pharmacologique : la corticostérone... 47
- Exemple de modèle chirurgical : la bulbectomie ... 47
- Exemple de modèle comportemental : la séparation maternelle ... 47
-VI. Les canaux ioniques et la dépression ... - 48 -
a. Les canaux potassiques ... 49
-b. Les canaux potassiques à deux domaines P : K2P ... 51
-i. Les canaux à rectification entrante ... 52
-ii. Les canaux sensibles à l’acidification extracellulaire ... 53
-iii. Les canaux activés par l’alcalinisation extracellulaire ... 53
-v. Les canaux inhibés par l’halothane ... 54
-vi. Les canaux mécanosensibles ... 54
- Le canal TREK1 ... 54
- Le canal TREK2 ... 54
- Le canal TRAAK ... 55
-VII. Le canal TREK-1 ... - 55 -
a. Protéines partenaires de TREK1 ... 57
-b. La sortiline ... 58
-i. Ligands de la sortiline ... 61
-ii. Les fonctions de la sortiline ... 62
-c. La spadine ... 62
-i. Inhibiteur du canal TREK1 ... 62
-ii. Effet antidépresseur in vivo ... 63
-iii. Neurogenèse et activation de CREB ... 65
-iv. Transmission 5HT ... 65
Objectif ... 67
Matériel et Méthodes ... 69
-I. Animaux ... - 69 -
II. Les traitements pharmacologiques ... - 69 -
a. Corticostérone ... 69
-b. Fluoxétine ... 70
-c. Spadine ... 71
-d. Les analogues de la spadine ... 71
-e. La technique rétroinverso ... 71
-f. MedinGel™ ... 72
-III. Les tests comportementaux ... - 73 -
a. Test de la nage forcée ... 73
-b. Test de la suspension par la queue ... 74
-c. Test de résignation apprise ... 74
-d. Test de la suppression de nourriture ... 75
-e. Douleur : test de l’immersion de la queue ... 75
-f. Epilepsie ... 76
-g. Ischémie focale ... 76
-IV. Etude de la neurogenèse par immunohistochimie ... - 77 -
V. Analyses statistiques ... - 78 -
Etude expérimentale... 80
a. Introduction ... 80
-b. Résultats ... 80
-i. Spécificité de la spadine pour le canal TREK1 ... 80
-ii. Effets secondaires de la spadine ... 81
-c. Article 1 ... 85
-II. Etude des effets de la spadine sur des modèles de dépression ... - 86 -
a. Introduction ... 86
-b. Résultats ... 87
-i. Modèle génétique de dépression : Souris Rouen ... 87
- Effet de la spadine sur les souris Rouen dans un modèle de dépression, le FST. ... 87
- Effet de la spadine sur les souris Rouen dans le TST. ... 88
-ii. Modèle de dépression induit par la corticostérone ... 89
-c. Conclusion ... 91
-III. Identification d’analogues de la spadine. ... - 92 -
a. Création d’une lignée stable exprimant TREK1 ... 92
-b. Criblage d’analogues de la spadine ... 93
-c. Article 2 ... 95
-d. Article 3 ... 96
-e. Brevet ... 97
-IV. Etude des mécanismes d’action de la spadine ... - 98 -
a. Article 4 ... 100
Discussion et Conclusion ... 101
Perspectives ... 107
Annexes ... 109
-I. Médecine chinoise et Pathologies Cérébrovasculaires ... - 110 -
a. Introduction ... 110
-b. Les accidents ischémiques cérébraux... 110
-i. Etude des effets des MLC601 et MLC901 sur l’ischémie focale ... 111
- Le modèle animal de l’ischémie focale ... 111
-ii. Etude des effets neuroprotecteurs et neurogénératifs de MLC601 et MLC901 ... 111
-iii. Les effets du MLC601 et du MLC901 sur l’ischémie focale ... 112
-iv. Etude des effets du MLC901 sur l’ischémie globale ... 117
-v. Effet neuroprotecteur du MLC901 ... 117
-c. Article 5 ... 120
-d. Article 6 ... 121
Préambule
La dépression est une pathologie psychiatrique très répandue, on estime qu’environ 20% de la population souffre de cette maladie. Différents traitements sont utilisés, cependant environ un patient sur trois ne répond pas à ces traitements. De plus, les antidépresseurs commercialisés, à ce jour, possèdent des effets secondaires et ne sont efficaces qu’après trois semaines de traitement. Il est donc nécessaire de développer de nouveaux médicaments ayant un délai d’action plus court et moins d’effets secondaires, tout en étant aussi efficaces.
En 2006, mon équipe d’accueil a montré l’efficacité d’un peptide comme antidépresseur chez la souris, ce peptide a été appelé spadine. Mon travail de thèse a consisté à étudier les effets secondaires potentiels de la spadine et à valider les effets antidépresseurs de la spadine dans deux modèles de dépression développés chez la souris.
La spadine présente de nombreux avantages par rapport aux antidépresseurs classiques notamment sa rapidité d’action et son absence d’effets secondaires, tout en conservant les propriétés importantes des antidépresseurs que sont l’induction de la neurogenèse hippocampique et l’augmentation de la transmission sérotoninergique. Le principal inconvénient de la spadine est sa faible stabilité in vivo. C’est la raison pour laquelle nous avons recherché, en collaboration avec la société MedinCell, des analogues de la spadine, plus efficaces et plus stables que la spadine. Le but ultime de nos travaux est de transformer la spadine ou ses analogues en médicament utilisable chez l’homme et qui apportera un avantage thérapeutique au regard des antidépresseurs utilisés aujourd’hui.
- 1 -
Introduction
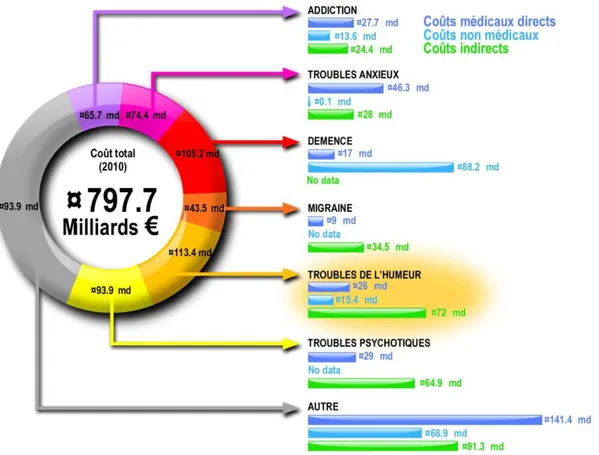
Les pathologies mentales représentent un coût important pour la société, environ 800 milliards d’euros en Europe (Smith, 2011). Ce coût est plus élevé que ceux engendrés par l’ensemble des pathologies aussi courantes que le cancer, les maladies cardio-vasculaires ou le diabète. Les maladies du système nerveux sont très diverses et regroupent des pathologies comme l’addiction, les troubles anxieux, la démence, la migraine, les psychoses, les troubles de l’humeur et bien d’autres (Figure 1).
Figure 1 : Coût des différentes pathologies du système nerveux central
En Europe, six catégories de pathologies représentent plus de la moitié des coûts engendrés par les maladies du cerveau. D’après (Smith, 2011)
Dans le DSM IV, la dépression était classée dans les troubles de l’humeur. Depuis la sortie du DSM V, elle fait l’objet d’un chapitre spécifique. Pour faciliter la compréhension par le lecteur, je décrirai très rapidement les troubles de l’humeur décrits dans le DSM V puis le reste du manuscrit sera consacré à la dépression.
- 2 -
I. Les troubles de l’humeur
Les troubles de l’humeur sont des désordres émotionnels caractérisés par la présence de sentiments inappropriés et exacerbés (fatigue, pleurs, tendances suicidaires…). Ces troubles ne doivent pas être confondus avec un « coup de blues » ou « une déprime » qui apparaissent lors de moments difficiles et qui sont normaux. Des critères bien spécifiques sont établis dans le manuel diagnostique et statistique des troubles mentaux (Diagnostic and Statistical Manual of Mental Disorders V, DSM IV).
a. Le trouble bipolaire
Le trouble bipolaire est caractérisé par l’alternance de phases de manie et de phases de dépression, d’où le nom couramment utilisé de « maniaco-dépression », l’intervalle entre deux phases maniaque et hypomaniaque pouvant être de plusieurs années. Les symptômes de la phase dépressive sont une diminution de l’estime de soi, des perturbations du sommeil, des tendances suicidaires. Les phases de manie sont, quant à elles, caractérisées par une augmentation de la transmission des neuromédiateurs tels que la sérotonine, la noradrénaline ou la dopamine, une euphorie, une diminution de besoin de sommeil (insomnie) et une sociabilité exacerbée.
b. La cyclothymie
La cyclothymie est une pathologie caractérisée par des épisodes successifs d’euphorie et de baisse d’humeur. La baisse d’humeur est similaire à des symptômes dépressifs présentant une sévérité moindre. Cette pathologie est apparentée à une forme légère de troubles bipolaires.
c. La dysthymie
C’est une forme de dépression chronique qui dure au minimum deux ans. Pour qu’un patient soit diagnostiqué dysthymique il faut qu’il présente au moins deux symptômes typiques des troubles de l’humeur. Généralement les adultes souffrant de cette pathologie rapportent un sentiment de tristesse et de dépression, les enfants sont, quant à eux, irritables (Kalia, 2005).
II. La dépression majeure (Major Depressive Disorder ou
dépression unipolaire)
Bien que la dépression soit appelée dans le langage courant la « maladie du siècle » ou la « maladie du monde moderne », elle a pourtant été décrite par Hippocrate dès 400 ans
- 3 - avant Jésus-Christ sous le terme de « mélancolie ». Le mot dépression vient du mot latin depressio qui signifie enfoncement.
La dépression est une affection psychiatrique caractérisée par divers symptômes, décrits dans le DSM IV, dont les principaux sont :
- La tristesse
- La faible estime de soi
- L’anhédonie (incapacité à ressentir du plaisir, ainsi qu’une diminution de l’intérêt à rechercher du plaisir)
- Les perturbations du poids ou de l’appétit - Le sentiment de culpabilité
- La diminution d’énergie
- La diminution de la concentration
- Les perturbations du sommeil : insomnie ou hypersomnie - Les tendances suicidaires / pensées récurrentes de mort
Pour être diagnostiqué dépressif il faut que le patient présente, depuis au moins deux semaines, 1 des 2 symptômes suivant : la tristesse et/ou l’anhédonie, et quatre symptômes parmi les 7 autres décrits dans le DSM IV et listés ci-dessus.
Depuis la sortie du DSM V (mai 2013), la dépression majeure n’est plus classée dans les troubles de l’humeur, elle fait dorénavant l’objet d’un chapitre spécifique.
a. Epidémiologie
Parmi les troubles de l’humeur, la dépression majeure est la pathologie la plus fréquente, elle touche près de 24% de la population en France, et atteint les femmes (32%) deux fois plus que les hommes (16%) (Lepine et al., 2005). D’après l’Organisation Mondiale de la Santé (OMS) la dépression deviendra, en 2020, la deuxième cause d’invalidité à travers le monde, après les troubles cardio-vasculaires. L’OMS estime qu’environ 350 millions de personnes souffrent de troubles de l’humeur dans le monde. Cette pathologie atteint physiquement et psychologiquement les individus et les rend, dans la plupart des cas, incapables de poursuivre leur activité professionnelle ou d’avoir une vie sociale satisfaisante. La dépression est une charge économique sociale importante non seulement en coût de « médicaments » (prescription d’antidépresseurs, séjour d’hospitalisation) mais aussi en terme de perte de journées de travail et en terme de suicides (Figure 1).
- 4 - Malgré son impact important sur la vie des patients atteints et son coût exorbitant pour notre société, et bien que de nombreuses études aient été et sont encore menées sur la dépression, son étiologie et sa physiopathologie restent peu connues.
b. Etiologie
La dépression est une pathologie multifactorielle dont l’étiologie est encore floue. Elle est influencée par des facteurs environnementaux tels que la perte d’un travail, le décès d’un proche, mais également par des facteurs génétiques, comme cela a été démontré par plusieurs études réalisées sur des familles. Elle est également fortement influencée par le stress aigu ou chronique (implication de l’axe hypothalamo-hypophyso-surrénalien) (Manji et al., 2001). Ainsi, plus de la moitié des patients (environ 60%) souffrant de la maladie de Cushing (hypercortisolémie constitutionnelle) sont également atteints de dépression (Starkman et al., 1981).
Le peu qui est connu concernant l’étiologie de la dépression sera développé plus en détail dans le chapitre suivant.
III. La physiopathologie de la dépression majeure
Plusieurs structures du système nerveux central ont été montrées comme importantes pour la dépression. Ces structures sont régulées par des neuromodulateurs qui projettent sur l'axe hypothalamo-hypophyso-surrénalien.
a. La neuroanatomie
Le cerveau est l’organe qui reçoit et interprète les informations afin de donner une réponse physiologique ou comportementale adaptée à chaque situation. Des études post-mortem sur des cerveaux de patients dépressifs ont permis d’incriminer différentes régions du cerveau, telles que le cortex préfrontal, l’amygdale, l’hippocampe ou encore le striatum, dans la pathologie dépressive. Ces résultats sont confirmés par des études d’imagerie fonctionnelle basée sur la mesure du débit sanguin cérébral chez des patients atteints de dépression majeure (Drevets, 2001). Le principe sur lequel est basé l’IRM fonctionnelle (Imagerie par Résonnance Magnétique) est que les neurones impliqués dans une tâche psychomotrice augmentent leur niveau d’activité lors de sa réalisation, cela nécessite d’augmenter à la fois l’apport énergétique et l’apport en oxygène. La vascularisation cérébrale est capable de répondre à cette demande en augmentant localement le débit sanguin (Gosseries et al., 2008).
De plus, des études chez l’animal à partir de lésions effectuées sur le cerveau (pour induire un phénotype dépressif), ont identifié le cortex préfrontal (orbital et médian), le cortex
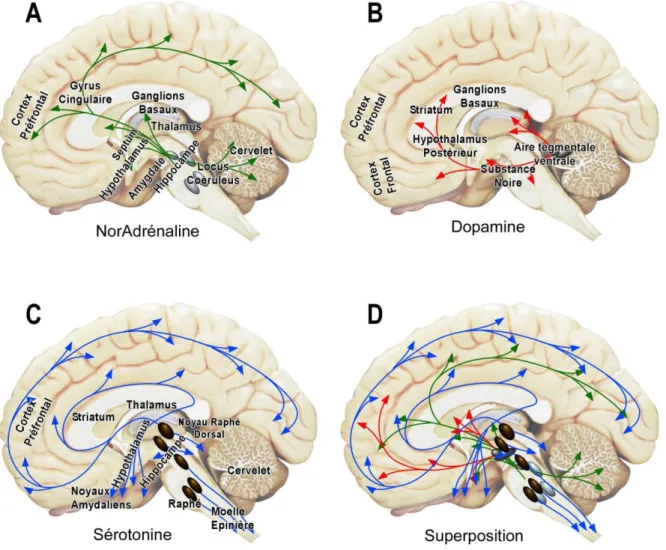
- 5 - cingulaire, l'amygdale, l'hippocampe, le striatum ventromédian, le thalamus (noyaux médiodorsal et médian) et le pallidum ventral comme des structures fortement impliquées dans le processus dépressif. Ces études neuroanatomiques de la dépression permettent de mieux comprendre les interactions entre les anomalies structurelles du système nerveux central et la pathologie dépressive (Figure 2).
Figure 2 : Neuroanatomie et projections des monoamines
Projections cérébrales des monoamines impliquées dans la dépression. A) la noradrénaline ; B) la
dopamine ; C) la sérotonine ; D) superposition des 3 circuits.
Le cortex préfrontal (CPF) est la partie antérieure du cerveau située dans le lobe frontal. Il
assure des fonctions cognitives telles que le langage et le raisonnement, mais il participe également à l’intégration des comportements émotionnels et de motivation. Ces dernières fonctions sont assurées grâce aux projections entre le CPF et les régions limbiques et sensorimotrices. Il existe une corrélation entre les symptômes des patients dépressifs et ceux ayant subi un traumatisme au niveau du cortex préfrontal (Rajkowska, 2000). Dans la
- 6 - pathologie dépressive, on observe une altération au niveau de la transmission monoaminergique (Krishnan and Nestler, 2008). Or le cortex préfrontal est une cible importante pour les projections monoaminergiques (Figure 2) ce qui valide son implication dans cette maladie. Le CPF orbitomédian comporte une forte concentration de récepteur aux glucocorticoïdes, ce qui le rend potentiellement vulnérable au stress (Sheline, 2003). Grâce aux techniques d’imagerie in vivo, une altération du métabolisme du glucose ainsi qu’une diminution du flux sanguin dans cette région du cortex ont pu être observées, révélant une baisse d’activité lors de l’apparition des phases dépressives (Drevets et al., 2008; Sheline, 2003).
L’amygdale est une structure localisée dans la région interne du lobe temporal, en avant de
l’hippocampe. Elle fait partie du système limbique et est impliquée dans les émotions et la réponse au stress. Son hyperactivation est observée chez les patients dépressifs comme d’autres régions impliquées dans la modulation de l’expression des émotions (telles que le cortex orbital postérieur). En revanche, les aires responsables de l’attention et de la perception des sens (cortex cingulaire antérieur) sont désactivées chez ces patients (Drevets, 2001). L'amygdale étant une structure dont l’activité est difficile à mesurer, peu de résultats sont disponibles concernant cette région. Toutefois, les antidépresseurs permettant de traiter les symptômes, et de maintenir la rémission, induisent une diminution du débit sanguin cérébral dans l’amygdale. Ces résultats confirment que l’utilisation chronique d’antidépresseurs a un effet inhibiteur sur les fonctions de cette structure. L’ensemble de ces données est en accord avec les expériences réalisées sur les animaux (Drevets, 2000).
L’hippocampe est une structure responsable des aspects cognitifs de la dépression incluant
les problèmes de mémorisation, la sensation de culpabilité et les tendances suicidaires (Nestler et al., 2002). De nombreuses études ont consisté à examiner le volume hippocampique des patients dépressifs. Une réduction significative est observée chez les personnes souffrant de dépression en comparaison aux patients sains. Grâce aux techniques utilisées en clinique (IRM, Imagerie par Résonnance Magnétique) une atrophie hippocampique comprise entre 8 et 19% du volume a été rapportée. Une étude en 1998 (Shah et al., 1998) a montré que les patients atteints de dépression chronique ont une diminution du volume hippocampique, alors que ceux en rémission ne présentent plus cette atrophie.
Le striatum, et plus particulièrement le noyau accumbens et le striatum ventral, sont des
zones importantes dans la mémoire émotionnelle et peuvent être responsables des symptômes tels que l’anhédonie, la perte de motivation ou l’anxiété (Nestler et al., 2002). De
- 7 - ce fait une hypoactivité de cette aire cérébrale peut être responsable de certains symptômes dépressifs. Le striatum est impliqué dans la régulation des comportements motivés, comme dans des processus de récompense (Berton and Nestler, 2006).
Le thalamus est une structure située de part et d’autre du 3ème ventricule, entre le tronc cérébral et le cortex. Elle a pour principale fonction le relai des informations, sensorielles et motrices, à destination du cortex. Cette région présente selon certains auteurs une diminution de volume chez les patients dépressifs (Dupont et al., 1995); (Nugent et al., 2013). De plus, il a été observé une augmentation du métabolisme du glucose ainsi que du flux sanguin dans le thalamus médian (Drevets et al., 1992). Ces résultats sont controversés. En effet en 2001 une étude a montré que le volume thalamique des patients souffrant de dépression majeure était inchangé par rapport aux patients contrôles (Caetano et al., 2001).
Ensemble, ces régions du cerveau forment un circuit impliqué dans la dépression (Manji et al., 2001). La connaissance des fonctions des différentes aires cérébrales, en condition physiologique, permet de déduire quelles sont les régions pouvant contribuer aux symptômes dépressifs. Le CPF et l’hippocampe sont des régions qui pourraient être responsables des aspects cognitifs de la dépression (problèmes mnésiques, sentiment de dévalorisation, culpabilité, suicide).
En plus des anomalies dans le fonctionnement de certaines aires cérébrales, une diminution du volume de l’hippocampe, de l’amygdale et des cortex cingulaire antérieur et préfrontal ventromédian a été observée par IRM. Il a également été observé une diminution du volume du striatum et un élargissement du troisième ventricule chez les patients dépressifs en comparaison avec des sujets sains (Drevets et al., 2008; Sheline, 2003). Des études post-mortem ont mis en évidence une réduction du volume cortical, une diminution du nombre de cellules gliales et de la taille des neurones du CPF et de l’amygdale (Manji et al., 2001).
L’ensemble des structures décrites ci-dessus sont sous le contrôle de différents neuromodulateurs brièvement décrits ci-dessous. Le neurotransmetteur excitateur majoritaire responsable de la transmission dans ces structures est le glutamate (Glu).
b. La neurotransmission
i.
Le glutamate
Le glutamate qui est un acide aminé est également le neurotransmetteur le plus représenté dans le système nerveux central. Le glutamate est synthétisé dans les cellules gliales à partir principalement de glutamine bien qu’il puisse aussi être synthétisé à partir d’α-cétoglutarate
- 8 - et d’aspartate. Il est impliqué dans les mécanismes de neuroplasticité, d’apprentissage et de mémoire (Orrego and Villanueva, 1993). Son mode d’action se fait via l’activation de récepteurs de différents types (Tableau 1) :
- Les récepteurs ionotropiques : AMPA (α-amino-3-hydroxy-5-méthylisoazol-4-propionate), NMDA (N-méthyl-D-aspartate) et kaïnates.
- Les récepteurs métabotropiques divisés en trois groupes, I, II et III.
Récepteur Ligands Action
Réc ept eurs i on otr op iq ues AMPA LY392098 Modification allostérique Aniracetam Modification allostérique NMDA Kétamine Antagoniste Mémantine Antagoniste
Récepteur Ligands Action
Réc ept eurs m ét ab otr op iq ues
Groupe I mGluR1 EMQMCM Antagoniste
mGluR5 MPEP; MTEP Antagoniste Groupe II mGluR2 LY341495 MGS0039 Antagonistes mGluR2/3
mGluR3
Groupe III
mGluR4 LSPI-2111 Modification allostérique mGluR6 ACPT-I Agoniste mGluR groupe III
mGluR7 AMN082 Agoniste
mGluR8 RS-PPG Agoniste
Tableau 1 : Les récepteurs glutamatergiques
Récapitulatif des deux familles de récepteurs glutamatergiques, avec des exemples de ligands ciblant une sous-famille de récepteur et leurs effets. D’après (Lapidus et al., 2013).
- 9 - Le glutamate, une fois libéré, est en partie dégradé au niveau extracellulaire, l’autre partie étant transportée (via le transporteur des acides aminés excitateurs) dans les cellules gliales. Les cellules gliales, les neurones pré- et post-synaptiques forment ce que l’on appelle une synapse tripartite. Cette synapse permet la régulation des taux de glutamate synaptique et extra-synaptique (Lapidus et al., 2013).
Une augmentation du taux de glutamate au niveau du cortex a été observée post-mortem chez des patients atteints de dépression majeure (Hashimoto et al., 2007; Sanacora et al., 2004). De plus, des études sur le sang et le liquide cérébrospinal de patients dépressifs, indiquent cette augmentation du taux de glutamate (Hashimoto, 2009). Ces résultats confirment l’implication du glutamate dans la dépression et font des récepteurs glutamatergiques des cibles intéressantes pour les antidépresseurs. Différents agonistes et antagonistes des récepteurs glutamatergiques ont permis d’obtenir un effet antidépresseur dans les modèles comportementaux de dépression (Tableau 1). La kétamine qui est un antagoniste des récepteurs NMDA a d’ailleurs des propriétés antidépressives certaines (voir chapitre sur les antidépresseurs atypiques) (Lapidus et al., 2013).
ii.
La théorie monoaminergique de la dépression
Différentes monoamines sont impliquées dans l’étiologie de la dépression, les principales étant : la sérotonine (5-hydroxytryptamine, 5-HT), la noradrénaline (NA) également appelée norépinéphrine, la dopamine (DA).
Après leur synthèse, les monoamines (noradrénaline, sérotonine, dopamine) sont acheminées vers l’extrémité axonale où elles sont stockées dans des vésicules pré-synaptiques. La sécrétion de ces monoamines, sous l’effet de l’influx nerveux, se fait par une exocytose dépendante du calcium (Elhwuegi, 2004). Les monoamines, ainsi libérées dans la fente synaptique, se fixent sur des récepteurs spécifiques localisés sur les membranes pré- et post-synaptiques. La plupart des récepteurs spécifiques des monoamines sont des récepteurs couplés aux protéines G, leur activation entraîne l’ouverture de canaux ioniques ou module l’activité d’enzymes membranaires. L’action des monoamines se termine par leur recapture et leur dégradation dans le neurone pré-synaptique ou dans les cellules gliales. Deux enzymes sont primordiales dans la dégradation des monoamines, la catéchol-O-méthyltransférase (COMT) et les monoamines oxydases (MAO).
La principale théorie de la dépression repose sur l’hypothèse monoaminergique. Cette théorie stipule que la dépression serait due à un déficit de certaines monoamines (noradrénaline, sérotonine, dopamine), et que la dépression pourrait être traitée par des molécules permettant d’augmenter l’activité monoaminergique.
- 10 -
Les catécholamines
Synthèse des catécholamines
Plus spécifiquement, les catécholamines dont fait partie la noradrénaline mais aussi l’adrénaline et la dopamine sont synthétisées à partir d’un acide aminé précurseur, la tyrosine (Figure 3).
Figure 3 : Schéma de la synthèse des catécholamines (Dopamine, Noradrénaline et Adrénaline)
La tyrosine est transformée en L-Dihydroxyphénylalanine (DOPA) grâce à une enzyme appelée tyrosine hydroxylase (Figure 3). La DOPA est ensuite convertie en dopamine par la DOPA décarboxylase (Figure 3). L’enzyme dopamine β-hydroxylase transforme la dopamine en noradrénaline. L’adrénaline, est obtenue après méthylation de l’amine primaire de la noradrénaline par la phentolamine méthyltransférase (Figure 3).
- 11 -
La transmission noradrénergique
Localisation
La noradrénaline est un neurotransmetteur présent dans la plupart des régions du cerveau. Le locus cœruleus est la structure du système nerveux central qui possède le plus de neurones noradrénergiques (Figure 2A) (Elhwuegi, 2004); (Samuels and Szabadi, 2008). Ces neurones projettent principalement au niveau du thalamus, de l’hypothalamus, de l’hippocampe et du cortex cérébral. La diminution de la synthèse de la noradrénaline induit fréquemment un état dépressif (Anand and Charney, 2000).
Les récepteurs adrénergiques
Les récepteurs adrénergiques sont classés en trois familles distinctes : α1 (alpha 1), α2 (alpha 2) et β (bêta). Ils ont tous la particularité d’être des récepteurs couplés aux protéines G (RCPG). Les RCPG sont des récepteurs à 7 domaines transmembranaires appelés récepteurs métabotropiques. Les récepteurs α2 et β-adrénergiques sont parmi les principales cibles pour la recherche de nouveaux antidépresseurs.
Les récepteurs α-adrénergiques sont divisés en deux sous-groupes α1 et α2.
Les récepteurs α1 sont couplés à une protéine Gq dont l’activation provoque la stimulation de la phospholipase C (PLC), ce qui induit la formation de seconds messagers tels que l’inositol triphosphate (IP3) et le diacylglycérol (DAG). Dans les neurones, l’activation des récepteurs α1 produit une diminution du transport des ions potassiques, ce qui entraîne une dépolarisation de la cellule, une augmentation de l’excitabilité et par conséquent une stimulation de la transmission de l’influx nerveux.
Les récepteurs α2-adrénergiques sont, lorsqu’ils sont activés, à l’inverse des récepteurs α1, responsables de l’hyperpolarisation des neurones. Ils sont liés à l’inhibition de l’adénylate cyclase (AC) via une protéine Gi. L’activation des récepteurs α2 induit la diminution de la libération de noradrénaline et inhibe la transmission sérotoninergique des neurones du noyau du raphé dorsal (Elhwuegi, 2004). La principale fonction des récepteurs α2-adrénergiques est la régulation de la libération de neurotransmetteurs par les terminaisons nerveuses (Elhwuegi, 2004). Les autorécepteurs et les hétérorécepteurs α2 sont hypersensibles dans la pathologie de la dépression, ce qui induit une diminution de l’activité adrénergique (Cottingham and Wang, 2012). Les antidépresseurs ciblant les récepteurs adrénergiques agissent en désensibilisant les récepteurs α2 et en augmentant la sensibilité des récepteurs α1. Ces deux actions conjuguées ont pour effet d’augmenter la quantité de noradrénaline au niveau synaptique (Cottingham and Wang, 2012).
- 12 - Les récepteurs β-adrénergiques existent sous trois sous-types β1, β2 et β3. Les récepteurs β sont couplés à une protéine Gs qui active l’adénylate cyclase et, par conséquent, la formation d’un second messager : l’Adénosine MonoPhosphate cyclique (AMPc) à partir de l’adénosine triphosphate (ATP). Ce couplage provoque la phosphorylation du récepteur par des protéines kinases A. Les recherches concernant les récepteurs β-adrénergiques sont controversées. L’administration chronique d’antidépresseurs, de même que l’électroconvulsivothérapie, induiraient une désensibilisation de ceux-ci (Hosoda and Duman, 1993). En revanche, une étude sur l’administration d’antidépresseurs SSRIs (Specific Serotonin Reuptake Inhibitors) réfute cette hypothèse et montre une sensibilisation de ces récepteurs (Palvimaki et al., 1994)(Tableau 2).
Protéine
G associée Localisation Effets centraux et périphériques
α
α1 Gq Cœur CNS Muscles lisses
Vasoconstriction Contrôle des muscles lisses
α2 Gi Pancréas CNS Muscles lisses
Vasoconstriction Relaxation du tractus gastro-intestinal
β
β1
Gs
CNS
Cœur Augmentation de la fréquence cardiaque β3 Poumons CNS
Muscles squelettiques Vasodilatation, bronchorelaxation β2 Cœur CNS Stimulation des cellules effectrices post-synaptiques
Tableau 2 : Fonctions et localisation des récepteurs adrénergiques
Le transporteur de la noradrénaline
Ce transporteur régule la concentration en noradrénaline, au niveau de la fente synaptique. Les antidépresseurs en inhibant la recapture de la noradrénaline (seule ou en association avec la sérotonine) qui augmente la concentration du neurotransmetteur.
La transmission dopaminergique
La dopamine (DA) est un neurotransmetteur obtenu par la même voie de synthèse que la noradrénaline (Figure 3). Différentes études montrent que la dépression pourrait avoir un lien avec une diminution de de la libération de dopamine dans le système nerveux central
- 13 - (Papakostas, 2006). L’acide homovanillique est un métabolite des catécholamines qui reflète le taux de dopamine présent dans le cerveau. Dans le liquide céphalorachidien (LCR) de patients dépressifs une diminution de ce métabolite a été observée (Roy et al., 1985). De plus, ce métabolite est retrouvé en plus faible concentration dans les urines des patients dépressifs ayant fait une tentative de suicide en comparaison des patients contrôles (Roy et al., 1992). L’analyse des récepteurs dopaminergiques a également mis en évidence un dysfonctionnement. En effet, chez les patients souffrant de dépression majeure il a été observé une hypersensibilité des récepteurs D2 et D3 (Verbeeck et al., 2001) (Klimek et al., 2002), ainsi qu’une diminution de l’activité du transporteur de la dopamine (DAT) (Meyer et al., 2001) (Neumeister et al., 2001). Une étude d’imagerie (TEP, Tomographie par émission de positons) a montré une diminution de l’expression des récepteurs D1 au niveau du striatum chez les patients dépressifs (Savitz and Drevets, 2013). Ces observations pourraient aider à trouver de nouvelles cibles pour les antidépresseurs, particulièrement pour les patients montrant une résistance aux antidépresseurs actuels.
Localisation
Les corps cellulaires des neurones dopaminergiques sont localisés dans la substance noire compacte (SNc) et l’aire tegmentale ventrale (ATV). Les neurones DA projettent vers différentes régions du cerveau (noyau caudé, noyau accumbens, le tubercule olfactif, l’éminence médiane, amygdale, et dans le cortex frontal) (Figure 2B).
Récepteurs dopaminergiques
Les récepteurs dopaminergiques sont des récepteurs couplés aux protéines G, divisés en deux groupes D1-like et D2-like. Le groupe D1 est composé des récepteurs D1 et D5 alors que le groupe D2 est composé des récepteurs D2, D3 et D4 (Tableau 3).
Protéine G
associée Effets centraux D1-like D1 Gs dépolarisation, activation du potentiel d'action D5 D2-like D2 Gi hyperpolarisation, diminution du potentiel d'action D3 D4
- 14 -
Le transporteur de la dopamine
Le transporteur VMAT (Vesicular Monoamine Transporter), permet la recapture de la dopamine après libération de celle-ci dans la fente synaptique. Il régule la transmission dopaminergique. Certains antidépresseurs, comme le bupropion, bloquent ce transporteur et augmentent ainsi la quantité de neurotransmetteur au niveau synaptique (Dunlop and Nemeroff, 2007).
La transmission sérotoninergique
L’hypothèse sérotoninergique de la dépression stipule qu’une diminution de la sécrétion de sérotonine (5-HT) dans le cortex et l’hippocampe serait principalement due à un gain de fonction des auto-récepteurs 5HT1A localisés dans les neurones sérotoninergiques du noyau du raphé. Le lien entre la dépression et la transmission sérotoninergique est étudié par de nombreuses équipes depuis plusieurs décennies. En 1976, une étude a montré que l’utilisation d’un inhibiteur de la synthèse de 5-HT, la parachlorophenylalanine, induit une rechute avec apparition de symptômes dépressifs chez les patients ainsi traités (Shopsin et al., 1976).
Synthèse
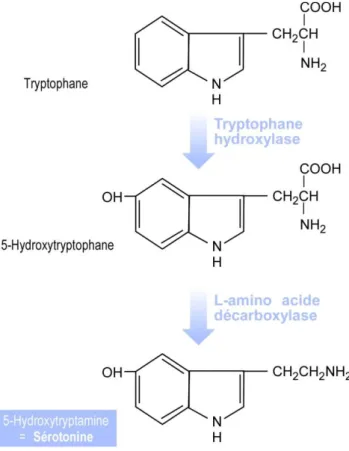
La sérotonine a été découverte dans le milieu des années 50, son implication dans différentes pathologies mentales fait depuis l’objet de nombreuses études. La sérotonine est un neurotransmetteur synthétisé à partir du tryptophane, acide aminé essentiel puisqu’il provient exclusivement de l’alimentation (Figure 4).
La sérotonine ne peut pas franchir la barrière hémato-encéphalique, contrairement au tryptophane. Le tryptophane, une fois dans le cerveau, est hydroxylé en 5-hydroxytryptophane par une enzyme appelée la tryptophane hydroxylase (TPH) (Figure 4). La disponibilité en tryptophane dans les neurones est un facteur limitant pour la synthèse de la sérotonine (Hammond, 1990).
Localisation
Le noyau du raphé dorsal est connu pour être la région du cerveau la plus riche en neurones sérotoninergiques (environ 60 % de neurones 5-HT) (Elhwuegi, 2004). Les neurones 5-HT sont également localisés dans le tronc cérébral. Ces neurones projettent dans de nombreuses régions de l’encéphale, ainsi que dans la moëlle épinière (Figure 2C). Le système sérotoninergique est impliqué dans de nombreuses fonctions physiologiques, telles
- 15 - que le contrôle de la pression sanguine, l’appétit, la température, la libération de certaines hormones (prolactine), la perception de la douleur et les émotions (Fink and Gothert, 2007).
Figure 4 : Schéma de la synthèse de la sérotonine
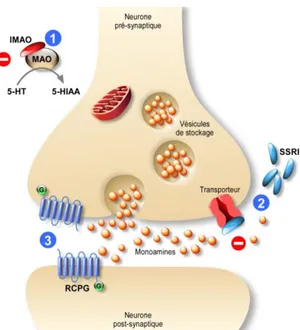
La sérotonine module l’axe hypothalamo-hypophyso-surrénalien (HPA, hypothalamic-pituitary-adrenal) en activant la production de la corticolibérine (CRF, Corticotropin Releasing Factor) dans le noyau paraventriculaire et ainsi augmente la libération de l’hormone corticotrope (ACTH, Adrenocorticotropin Hormone) (Leonard, 2010). Au niveau de la synapse, la sérotonine est recaptée dans le neurone pré-synaptique pour être en partie dégradée par la MAO en acide 5-hydroxyindolacétique (5-HIAA), métabolite présent dans les urines et le liquide céphalo-rachidien, servant en clinique d’indice d’activité des neurones sérotoninergiques.
Les récepteurs sérotoninergiques
Ce neurotransmetteur influence l’activité neuronale à travers ses différents récepteurs qui sont regroupés en sept familles distinctes : 5-HT1 à 5-HT7. Ces récepteurs sérotoninergiques sont tous des récepteurs métabotropiques (couplés à une protéine G) à l’exception du
- 16 - récepteur 5-HT3 qui est un récepteur ionotropique (dont l’activation conduit à l’ouverture d’un canal ionique) (Hoyer et al., 1994).
L’implication de ces récepteurs dans la dépression a été particulièrement bien étudiée pour certains d’entre eux, notamment grâce à l’existence de ligands spécifiques. C’est le cas par exemple des récepteurs 5-HT1, 5-HT4 et 5-HT7. D’autres ont été impliqués dans la dépression de façon « indirecte » par l’utilisation d’antidépresseurs (5-HT2, 5-HT3 et 5-HT6). D’autre enfin n’ont pas, à ce jour, été reliés à la dépression comme les récepteurs 5-HT5.
Implication directe par ligands pharmacologiques
Les récepteurs 5-HT1 représentent la famille la plus importante des récepteurs sérotoninergiques (5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E et 5-HT1F). Ce sont des récepteurs couplés à une protéine Gi (inhibition de l’adénylate cyclase ce qui conduit à la diminution de l’AMPc). Le récepteur 5-HT1C constitue désormais la sous famille 5-HT2C. Les récepteurs 5-HT1A sont, en raison de l’hypothèse sérotoninergique, les plus étudiés. Ils sont largement distribués dans le système nerveux central et il existe de nombreux ligands de ces récepteurs (agonistes : 8-OH-DPAT, buspirone ; antagoniste : WAY-100635). Les récepteurs pré-synaptiques sont localisés dans le corps cellulaire et les dendrites des neurones et sont impliqués dans la régulation négative des neurones sérotoninergiques. Les récepteurs post-synaptiques sont, quant à eux, localisés dans les régions du cerveau recevant les projections du noyau du raphé dorsal (cortex préfrontal, amygdale, hippocampe, hypothalamus) (Savitz et al., 2009). L’activation des récepteurs somatodendritiques (pré-synaptiques) induit une diminution de la fréquence de décharge des neurones 5-HT et, ainsi, réduit la transmission sérotoninergique (Herman M.van Praag, 2004). L’activation des récepteurs 5-HT1A provoque une hyperpolarisation des neurones et donc leur inhibition. Une altération des récepteurs 5-HT1A chez les patients atteints de dépression majeure a été reportée, se traduisant par une augmentation de la densité des autorécepteurs et par la diminution des récepteurs post-synaptiques (Bhagwagar et al., 2004; Boldrini et al., 2008). L’administration d’antidépresseurs permet de désensibiliser les récepteurs somatodendritiques 5-HT1A, et d’augmenter la transmission sérotoninergique via les récepteurs 5-HT1A post-synaptiques.
Les récepteurs 5-HT1B sont, tout comme les 5-HT1A, pré- et post-synaptiques. En revanche, ils sont situés sur les axones des neurones sérotoninergiques. Les récepteurs post-synaptiques (hétérorécepteurs) sont présents dans les ganglions de la base et contrôlent la transmission synaptique 5-HT (Sari, 2004). Ces récepteurs sont également impliqués dans la pathologie dépressive. En 2008, une étude a montré que l’activation des hétérorécepteurs
5-- 17 5-- HT1B permet d’obtenir un phénotype antidépresseur chez la souris (Chenu et al., 2008). De plus, des études réalisées sur la protéine p11, qui colocalise avec le récepteur 5-HT1B et qui joue un rôle crucial dans la modulation de la fonction du récepteur, ont montré que son expression est altérée non seulement dans des modèles murins de dépression mais également dans des tissus de patients dépressifs (Svenningsson et al., 2006).
Les 5-HT1D, 5-HT1E et 5-HT1F sont beaucoup moins étudiés dans la pathologie de la dépression. En 2001, une étude a cependant montré une altération de la sensibilité des récepteurs 5-HT1D chez les patients dépressifs (Whale et al., 2001).
Les récepteurs 5-HT4 sont principalement localisés dans le putamen, le noyau caudé, l’hippocampe, le noyau accumbens et la substance noire (Artigas, 2013). Ces récepteurs ont une implication dans l’expression des gènes responsables de la plasticité synaptique (Vidal et al., 2011). Une étude préclinique suggère une implication des récepteurs 5-HT4 dans la dépression, puisque l’administration d’un agoniste de ce récepteur (RS 67333) diminue l’immobilité des souris dans le test de la nage forcée (Lucas et al., 2007).
Les récepteurs 5-HT7 sont exprimés dans le thalamus, l’hypothalamus, l’hippocampe et le cortex (Hedlund and Sutcliffe, 2004). Leur principale fonction physiologique est la régulation du rythme circadien, mais ils jouent également un rôle dans la régulation de l’humeur (Hedlund, 2009). Tout comme pour le récepteur 5-HT6, les antidépresseurs ont une forte affinité pour les récepteurs 5-HT7. L’administration préclinique d’un antagoniste (ritanserine) de ces récepteurs induit un effet antidépresseur chez la souris, avec désensibilisation des récepteurs 5-HT7 (Mullins et al., 1999).
Implication indirecte par utilisation d’antidépresseurs
Les récepteurs 5-HT2 sont divisés en trois classes: 5-HT2A, 5-HT2B et 5-HT2C. Les récepteurs
5-HT2A sont, dans le cortex, localisés sur des interneurones GABAergiques (Santana et al., 2004). Différentes études cliniques ont montré que l’administration d’antidépresseurs atypiques ayant une affinité pour les récepteurs 5-HT2A, comme la mirtazapine, augmente la réponse des patients traités par des antidépresseurs de types SSRI (inhibiteurs de la recapture de la 5-HT) (Shelton et al., 2001); (Artigas, 2013). Largement exprimés dans les tissus périphériques mais peu dans le cerveau des mammifères, le rôle des récepteurs 5-HT2B est peu connu dans ladépression. Les récepteurs 5-HT2C sont généralement localisés au niveau somatodendritique des neurones 5-HT mais, dans certaines régions du cerveau, ils sont également présents au niveau de l’axone. Ces récepteurs sont exprimés principalement dans les plexus choroïdes, le cortex cérébral, l’hippocampe, la substance
- 18 - noire et le cervelet et une altération de l’acide ribonucléique messager (ARNm) des récepteurs 5-HT2C a été observée dans le cortex préfrontal des patients dépressifs s’étant suicidés (Gurevich et al., 2002). De plus, l’agomélatine qui est un antagoniste spécifique des récepteurs 5-HT2C possède des propriétés antidépressives (Srinivasan et al., 2012b).
L’activité des neurones sérotoninergiques est régulée par les interneurones inhibiteurs GABAergiques et les afférences activatrices glutamatergiques. De plus, les neurones GABAergiques expriment des récepteurs 5-HT2A et 5-HT2C. La libération de sérotonine inhibe les neurones 5-HT selon deux mécanismes : soit la stimulation des autorécepteurs 5-HT1A somatidendritiques et/ou la stimulation des récepteurs 5-HT2A et 5-HT2C localisés sur les neurones GABAergiques.
Les récepteurs 5-HT3 représentent la seule classe de récepteurs sérotoninergiques ionotropiques. Ils sont localisés dans tous les neurones, périphériques et centraux. Ils jouent un rôle primordial dans le déclenchement du réflexe émétique (Angel et al., 1993). L’administration chronique de fluoxétine désensibilise les récepteurs 5-HT3, et la délétion du transporteur de la sérotonine (SERT, Serotonin Transporter, 5-HTT, SLC6A4) chez la souris induit une augmentation de la densité de ces récepteurs en comparaison des souris sauvages (Fan, 1994); (Mossner et al., 2004).
Les récepteurs 5-HT6 sont des récepteurs post-synaptiques largement exprimés dans le striatum, le noyau accumbens, le bulbe olfactif et le cortex. Ils sont également localisés, en plus faible quantité, dans l’amygdale, l’hippocampe, l’hypothalamus, le thalamus et le cervelet (Branchek and Blackburn, 2000). Ils jouent un rôle important dans l’apprentissage, la mémoire et la prise alimentaire (Rosse and Schaffhauser, 2010); (Heal et al., 2008). L’amitriptyline (antidépresseur tricyclique, TCA) et certains antidépresseurs atypiques tels que la miansérine ont une action de type antagoniste sur les récepteurs 5-HT6. De par leur localisation dans le cerveau ainsi que par les effets observés avec les antidépresseurs, les récepteurs 5-HT6 joueraient un rôle dans la pathologie de la dépression, notamment dans les effets de certains antidépresseurs, comme les TCAs (Artigas, 2013; Monsma et al., 1993).
Les récepteurs 5-HT5 sont, quant à eux, impliqués dans le développement cérébral. Ils sont constitués de deux classes : 5-HT5A et 5-HT5B. Aucun lien avec la dépression n’a été démontré à ce jour.
- 19 -
Le transporteur de la sérotonine
La sérotonine, une fois libérée dans la fente synaptique, peut être transportée vers les neurones pré-synaptiques par le SERT. Diverses études ont permis d’établir une implication entre ce transporteur et la pathologie dépressive. Une augmentation de liaison entre la 5-HT et le SERT a été observée chez des patients souffrants de dépression majeure (Savitz and Drevets, 2013). Ce transporteur est l’une des cibles d’action des antidépresseurs. Son blocage induit une augmentation de la concentration de sérotonine synaptique.
Dégradation des monoamines
Les monoamines présentes dans la fente synaptique sont en grande partie recaptées par les neurones pré-synaptiques. Dans les neurones, elles sont ensuite « recyclées » dans des vésicules, ou alors dégradées par des enzymes spécifiques : la catéchol-O-méthyltransférase (COMT) ou les monoamines oxydases (MAO-A, MAO-B). La COMT permet la dégradation des catécholamines directement dans la fente synaptique. Certains antidépresseurs sont capables de bloquer ces enzymes de dégradation. C’est le cas par exemple, des inhibiteurs de la monoamine oxydase qui augmentent la concentration des neurotransmetteurs au niveau de la fente synaptique.
Les 3 monoamines, décrites ci-dessus, sont étroitement liées. Leur perturbation a un impact important sur notre humeur et de notre comportement (Figure 5).
Figure 5 : Régulation de l'humeur, importance des monoamines