INTRODUCTION
▪ Les leishmanioses sont des parasitoses communes à l’homme et à l’animal (anthropozoonoses), dues à des protozoaires flagellés genre Leishmania (dont il existe plusieurs espèces et sous-espèces), transmises par la piqûre d’un vecteur représenté par la femelle hématophage d’un insecte diptère dénommé phlébotome
(dont il existe plusieurs espèces). Les réservoirs du parasite sont multiples : les rongeurs sauvages, les mammifères, l’homme et le chien.
▪ La zone d’endémie de l’affection couvre le bassin méditerranéen, le Moyen orient, l’Afrique tropicale, l’Afrique du Nord, le sud de l’Europe (ensemble désigné sous le terme de l’Ancien monde), et une partie de l’Amérique du Nord, Centrale, et du Sud (zone connue sous le nom de Nouveau monde).
▪ Après une période d’incubation s’étendant sur quelques semaines à quelques mois et en fonction de la souche du parasite infestant el de l’état immunitaire de l’hôte apparaissent les différentes manifestations cliniques définissant ainsi les trois variétés de Leishmaniose :
- La leishmaniose viscérale qui affecte la totalité des cellules histiomonocytaires encore appelée fièvre de Dumdum ou le Kala-azar.
- La leishmaniose cutanéo-muqueuse désignée également sous les noms de L. espundia, le Pian-bois, l’uta, ou encore
l’ulcère de chicléros.
- La leishmaniose cutanée pure qui nous intéresse particulièrement dans sa forme infantile.
▪ La Leishmaniose cutanée dans sa forme commune et localisée est principalement due à deux espèces de Leishmanies qui sont la L. tropica, la L. major, alors que certaines formes diffuses d’ailleurs particulières et assez rares peuvent être imputables à d’autres genres qui sont essentiellement la L. aethiopica et la L. amazonensis. Au Maroc les souches impliquées sont L. tropica, L. major, et L. infantum variété dermotrope. Cliniquement elle réalise le classique Bouton d’orient soit à forme sèche croûteuse et indolente soit à forme humide et ulcérée.
▪ Outre la manifestation clinique classique (Bouton d’orient), l’affection semble revêtir de plus en plus des aspects cliniques divers simulant d’autres dermatoses, polymorphisme qui serait
majoré chez les patients immunodéprimés notamment les sujets porteurs du VIH, d’autant plus que la co-infection Leishmaniose/VIH est une maladie émergente (33 cas signalés dans 88 pays ou la maladie est endémique).
▪ Les complications habituelles de cette pathologie sont principalement la surinfection microbienne et la lymphangite compromettant toute activité productive et exposant à un risque de séquelles inesthétiques indélébiles.
▪ On recense chaque année environ 1.500.000 cas de Leishmaniose cutanée dont 90% en (Afghanistan, Algérie, Arabie Saoudite, au Brésil, au Pérou, en Iran et au Soudan), l’augmentation progressive du nombre des cas s’explique en grande partie par l’accroissement progressif de la transmission dans les villes, du déplacement des populations, de l’exposition des sujets non immuns, de la détérioration des conditions socio-économiques et de la malnutrition sans omettre le rôle que joue la co-infection par le VIH.
▪ Noter que le traitement de la Leishmaniose reste relativement cher compte tenu du niveau socio-économique généralement bas
des tranches sociales fréquemment touchées par cette maladie et qu’il comporte un risque non négligeable d’effets secondaires (parfois fatals) et qu’il souffre d’une pharmacorésistance croissante d’où l’intérêt de déployer tous les moyens en matière d’information, d’éducation et de prévention.
▪ La leishmaniose cutanée est relativement fréquente chez l’enfant en particulier au cours de la deuxième décennie.
Elle est caractérisée par son évolution relativement favorable et l’absence de particularités cliniques par rapport à l’adulte. L’abstention thérapeutique, quand elle trouve son indication, est recommandée de manière plus large chez l’enfant vu le caractère contraignant du traitement.
RAPPEL
II/ Rappel Embryologique:
II.1/ Généralités:Les structures embryonnaires impliquées dans la morphogenèse de la peau sont essentiellement de l’ordre de deux: [1]
• L’ectoblaste qui est à l’origine: De l’épiblaste.
Des kératinocytes. Des cellules de Merkel. Des annexes.
Des crêtes neurales, elles mêmes donnant naissance aux mélanocytes et nerfs.
• Le mésoblaste à l’origine des cellules de Langerhans, du derme, et de l’hypoderme.
Le développement de la peau obéît principalement à deux gradients: [5]
• Un gradient antéro-postérieur avec en premier
développement du cuir chevelu puis du reste du corps ( décalage de 3 à 7 jours), gradient régit par plusieurs protéines dont la protéine Bicoïd fortement exprimée au niveau de la région
céphalique et responsable de la formation de la tête et la protéine
• Un gradient dorso-ventral avec développement de la peau d’abord au niveau du dos puis de l’abdomen, cette régulation serait le fruit d’action des cellules folliculaires qui émettent un signal responsable de l’activation d’une protéine qu’est la
-Proteine Dorsal- élément clé de la mise en place de l’axe dorso-ventral.
II.2/ Particularités des différentes structures:
II.2.1/ L’épiderme:
Plusieurs étapes se succèdent en fonction du stade de développement de l’embryon : [1] [3] [6]
• Entre la 4ème et 5ème SD, l’embryon est délimité par
l’épiblaste fait d’une seule assise cellulaire.
• Vers la 7ème SD, le futur épiderme comporte deux assises
cellulaires, avec une couche superficielle faite de cellules aplaties et formant le périderme (persiste jusqu’à la 23ème SD puis sera éliminé) et une couche basale. A ce stade du développement, la jonction dermo-épidermique est plate.
• Vers la 10ème SD, la jonction dermo-épidermique devient ondulée avec début de formation des crêtes épidermiques et des papilles dermiques.
• Entre la 12ème et la 13ème SD, le futur épiderme est formé de trois assises faites des couches, superficielle (périderme) et basale précédemment décrites avec l’apparition d’une couche intermédiaire qui va s’épaissir par la suite pour atteindre 4 à 5 assises à la fin de la 24ème SD.
• A la 23ème SD, le périderme est remplacé par la couche
cornée.
• A la 24ème SD, on a un épithélium pavimenteux stratifié
muni de jonctions matures. II.2.2/ Les mélanocytes:
Les mélanocytes proviennent des crêtes neurales (dès la 3ème SD),
ce sont des cellules dotées de mélanosomes qui synthétisent la mélanine, ces derniers représentent l’aboutissement d’un
processus de formation faisant intervenir l’appareil de Golgi, le réticulum endoplasmique… (CF Histologie). [2] [4]
• Vers la 7ème SD, les mélanocytes colonisent l’épiderme.
• En approchant la 21ème SD, les mélanosomes I, II, III sont bien développés.
• Entre la 23ème et la 30ème SD, les mélanocytes transfèrent les mélanosomes aux épidermocytes (couleur de la peau) et aux cellules matricielles du bulbe pileux (couleur des poils).
II.2.3/ Les cellules de Langerhans:
Les cellules de Langerhans proviennent des différents sites d’hématopoïèse fœtale pour coloniser l’épiderme, la
prépondérance d’un site ou d’un autre varie en fonction du stade de développement: [3]
• Avant la 9ème SD, c’est la vésicule vitelline.
• Entre la 9ème et 16ème SD, c’est le foie.
• Au-delà de la 16ème SD, commence l’hématopoïèse
médullaire.
II. 2.4/ Les cellules de Merkel:
Les cellules de Merkel dérivent des kératinocytes basaux, elles apparaissent en même temps que la troisième couche de l’épiderme. [1]
II.2.5/ Les annexes cutanées:
♣ Les glandes sudoripares:
• Vers la 20ème SD, apparaissent les premières ébauches
épithéliales avec émergence de bourgeons.
• Vers la 23ème SD, les bourgeons solides s’allongent et
plongent dans le derme.
• Entre la 24ème et la 28ème SD, les extrémités s’enroulent
pour former la portion excrétrice, une lumière apparaît au sein du canal glandulaire ainsi qu’un pore ouvert à l’épiderme. [5][6]
♣ Les follicules pilo-sébacés:
• C’est vers la 10/11ème SD que les premiers bourgeons
folliculaires apparaissent et ce au niveau du cuir chevelu et du visage.
• Ensuite les bourgeons forment des cordons entre la 14ème et 21ème SD, les cellules externes de ces cordons sont
cellules centrales sont en continuité avec les cellules de la couche intermédiaire. [5][6]
▪ Remarque : les premiers poils visibles sont ceux des sourcils, de la lèvre supérieure et du menton, ils apparaissent vers la 22ème SD
RAPPEL
III/ Rappel histologique de la peau normale :
La peau est un organe complexe morphologiquement et biochimiquement, recouvrant l’ensemble de l’organisme et assurant trois fonctions principales: rôle de barrière, de
protection, et organe de perception. Grossièrement elle comprend trois régions distinctes qui sont de la superficie vers la profondeur du corps :
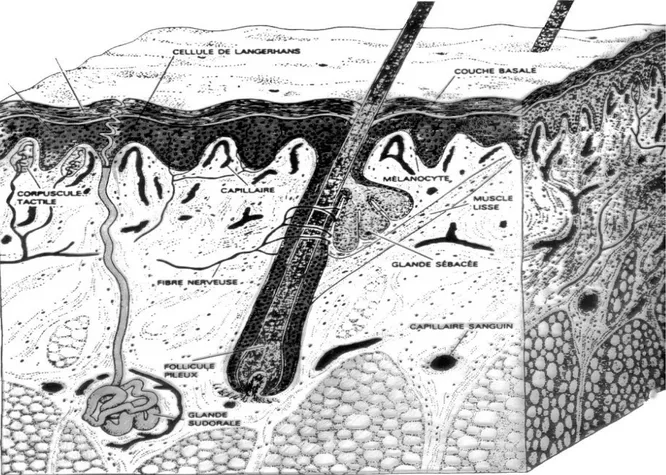
• L’épiderme. • Le derme. • L’hypoderme.
A ces trois éléments s’ajoutent les annexes cutanées. [7]
III.1/ L’épiderme:
- L’épiderme est la couche la plus superficielle de la peau, c’est un épithélium pavimenteux stratifié kératinisé dans la constitution duquel entrent quatre populations cellulaires différentes :
• Les kératinocytes. • Les mélanocytes.
• Les cellules de Langerhans. • Les cellules de Merkel.
- L’épiderme ne contient aucun vaisseau sanguin ni
lymphatique, mais il renferme de nombreuses terminaisons nerveuses libres. [7]
III.1.1/ Les kératinocytes:
- Les molécules des filaments intermédiaires des kératinocytes sont des kératines (appelées aussi cytokératines ou
alpha-kératines), actuellement on est arrivé à individualiser chez
l’homme une vingtaine de ces kératines différentes les unes des autres.
- Certaines kératines sont dites dures et sont spécifiquement retrouvées dans les ongles et les cheveux.
- D’un point de vue biochimique, on distingue les kératines de type 1 (ou kératines acides) et les kératines de type 2 (ou kératines neutres/basiques).
- L’assemblage des kératines se fait par hétérodimères formés entre une kératine 1 et une kératine 2. Seuls ces hétérodimères sont capables de se polymériser en filament intermédiaire. Tous les épithéliums contiennent des filaments intermédiaires de kératine (notamment K5 et K14), mais l’épiderme contient en plus plusieurs kératines différentes quasi- spécifiques de certaines
couches [K1, K2, K10 et K11 sont quasi-spécifiques des couches supra-basales] et/ou de certaines régions [K9 est spécifique des paumes et des plantes]. Les filaments de kératine sont attachés aux desmosomes et aux hémidesmosomes. Ainsi, les filaments intermédiaires de cellules adjacentes sont en contact par
l’intermédiaire des desmosomes.
- Cette disposition indique un rôle de cohésion intercellulaire pour ces structures. Un tel rôle a été démontré par la découverte de mutations affectant des gènes codant pour des kératines dans des maladies de la peau caractérisées par une épidermolyse. [7] [8] [9]
- Les kératinocytes subissent en permanence une évolution morphologique témoignant de leur kératinisation sous-tendant ainsi le rôle de barrière protectrice (mécanique et chimique) de l’épiderme. Cette évolution se fait de la profondeur vers la superficie et permet de distinguer sur une coupe d’épiderme quatre couches superposées de la profondeur vers la superficie : la couche germinative (ou basale) → la couche à épines (ou
spineuse) → la couche granuleuse → la couche cornée (compacte puis desquamante). [7] [8] [9]
♣ La couche germinative:
La couche germinative assure par les mitoses de ses cellules le renouvellement de l’épiderme, ses cellules cubiques ou
prismatiques, contiennent de nombreux grains de mélanine phagocytés qui permettent à l’épiderme d’assurer son rôle de protection de la lumière et qui sous-tendent le rôle de régulation de la pigmentation cutanée qu’ont les kératinocytes.
♣ La couche à épines:
Dans la couche à épines, les cellules commencent à s’aplatir, mais le noyau et les organites cytoplasmiques sont intacts, les
filaments intermédiaires de kératine groupés en faisceaux denses, les desmosomes normaux. [8]
♣ La couche granuleuse:
- Dans la couche granuleuse, la cellule est très aplatie, le noyau commence à dégénérer et surtout apparaissent au sein des trousseaux de filaments de kératine de nombreux grains de kératohyaline et des kératinosomes.
- La molécule constituant les grains de kératohyaline est la
profilagrine, qui, dans la couche cornée, se transforme en filagrine
qui est la matrice du cytoplasme des cornéocytes.
- Les kératinosomes (ou corps d’Oadland) sont de petits organites ovalaires, entourés d’une membrane et présentant un aspect lamellaire ou strié périodique (d’où leur nom de granules lamellaires). Ils synthétisent dans les cellules de la couche granuleuse une substance déversée par exocytose dans les
espaces intercellulaires de la couche cornée qui apparaissent ainsi remplis d’une sorte de cément intercellulaire fait du matériel
lamellaire qui était contenu dans les kératinosomes
(phospholipides et glycolipides, qui se tranforment en céramides, cholestérol et acides gras libres).
♣ La couche cornée:
- Enfin, dans la couche cornée, le kératinocyte (qui prend maintenant le nom de cornéocyte) est complètement aplati, le noyau et les organites cytoplasmiques ont totalement disparu et le cytoplasme est rempli de trousseaux fibrillaires formés à partir des filaments de kératine et des grains de kératohyaline.
- Les membranes plasmiques sont devenues très denses et épaisses et les desmosomes (qui prennent alors le nom de
cornéodesmosomes) sont profondément modifiés, avec une ligne dense extra-cellulaire très épaisse. En superficie de la couche cornée, les cornéocytes se détachent de l’épiderme
(desquamation) après la lyse du cément intercellulaire et des cornéodesmosomes (principalement sous l’action d’une enzyme sécrétée par les kératinosomes, la stéroïde-sulfatase).
III.1.2/ Les mélanocytes:
- Dans l’épiderme, les mélanocytes sont situés principalement dans la couche basale. Ils ont un aspect étoilé et leurs
prolongements cytoplasmiques s’insinuent entre les kératinocytes. - Ils sont dépourvus de système de jonction inter-cellulaire avec les cellules voisines. En microscopie optique, les mélanocytes ne sont identifiables qu’avec des colorations argentiques ou par des techniques immunocytochimiques (HMB 45, anticorps
anti-protéine S100, par exemple). [8] [9] [10]
- La mélanine est le pigment produit par les mélanocytes au niveau d’organites cytoplasmiques denommés les mélanosomes,
ovoïdes mesurant 0,2 à 0,6 μm. Ces derniers résultent de la fusion entre des vésicules, contenant de la tyrosinase, de la dopachrome tautomérase (ou TRP2) et de la DHICA oxydase, dérivées de l’appareil de Golgi d’une part et des vésicules
contenant les composants structurels des mélanosomes produites par le réticulum endoplasmique granulaire d’autre part. Ces
organites contiennent un matériel fibrillaire ou lamellaire présentant une périodicité caractéristique.
- Quatre stades de différenciation sont classiquement décrits pour les mélanosomes. Les stades I et II correspondent à des
organites non mélanisés (parfois appelés prémélanosomes). Les mélanosomes de stade I ont un contenu dont la structure
filamentaire est encore assez mal définie. Au contraire, les
mélanosomes de stade II se remplissent d’une structure interne filamenteuse. La mélanine commence à s’accumuler dans les mélanosomes de type III, alors que dans les mélanosomes de type IV, l’accumulation de pigments est telle que la structure interne n’y est plus visible. Les mélanosomes sont des vésicules apparentées aux lysosomes. [8] [9] [10]
- La biochimie de la synthèse de la mélanine n’est pas encore parfaitement connue. On décrit deux types de pigments
qui est jaune orangée. Ces pigments sont produits à partir de la L-tyrosine qui est hydroxylée en L-Dopa par la tyrosinase.
La L-Dopa est oxydée en dopaquinone par cette même enzyme. La dopaquinone réagit avec la cystéine entrant dans la voie de synthèse de la phémélanine. Si la quantité de cystéine est faible dans la cellule, la dopaquinone s’oxyde spontanément en
dopachrome et suit la voie de la synthèse de l’eumélanine. La tyrosinase est l’enzyme clé de la synthèse de la mélanine. [8] [9] [10]
- La synthèse de la mélanine est soumise à des régulations complexes, en particulier par des hormones et des cytokines (alpha-MSH, FGF basique, HGF, insuline) ainsi que par certaines prostaglandines.
Les mélanocytes synthétisent de nombreuses cytokines (IL1alpha, IL1-bêta, IL3, IL6, TNF alpha, GM-CSF) ; en période néo-natale, ils synthétisent également des leucotriènes dont l’action n’est pas connue.
- Les mécanismes intimes du transfert des mélanosomes des mélanocytes aux kératinocytes sont incomplètement compris. La mélanine est, en grande partie, responsable de la couleur de la peau et des phanères. [8] [9] [10]
- Le nombre de mélanocytes varie selon la localisation des régions cutanées chez un même individu. Ainsi, leur densité est de
2000/mm2 pour la peau de la face et de 1000/mm2 pour celle du corps.
- Par contre, leur nombre est sensiblement identique dans toutes les populations humaines (caucasiennes, négroïdes et
mongoloïdes), la différence de couleur s’expliquant par la qualité et la quantité de pigments que ces cellules produisent. Chez les populations noires, les mélanosomes produits sont plus larges, leur contenu mélanique plus dense, ils restent isolés pendant tout le cycle de leur maturation. Au contraire, chez les populations blanches, les mélanosomes dont les caractères s’opposent
à ceux des précédents, sont associés dans des vésicules limitées par une membrane.
- Ainsi chaque mélanocyte contient 5 fois plus de mélanosomes chez un sujet asiatique que chez un individu de race blanche et 8 à 10 fois plus de mélanosomes chez un sujet noir que chez un blanc. [8] [9] [10]
- L’exposition solaire entraîne une stimulation de la mélanogénèse et une augmentation du nombre des mélanocytes soit par
différenciation de mélanoblastes quiescents, soit par division cellulaire de la cellule mature. Les mécanismes d’action des
rayonnements ultra-violets (UV) ne sont pas exactement connus. [8] [9] [10]
III.1.3/ Les cellules de Langerhans:
- Les cellules de Langerhans font partie du groupe des cellules dendritiques. Elles dérivent des cellules souches hématopoïétiques situées dans la moelle osseuse et sont présentes dans tous les épithéliums pavimenteux stratifiés des mammifères. Elles sont en particulier dispersées entre les kératinocytes de la couche à
épines de l’épiderme, [l’E-cadhérine jouant un rôle probablement important dans leur adhérence aux kératinocytes]. La microscopie électronique permet de distinguer les cellules de Langerhans des mélanocytes, en mettant en évidence dans leur cytoplasme d’une part, l’absence de prémélanosomes et mélanosomes et d’autre part, la présence de petits organites discoïdes pathognomoniques (granules de Birbeck). [7] [11]
- Les cellules de Langerhans initient et propagent les réponses immunes dirigées contre les antigènes appliqués sur la peau. Elles sont capables d’ingérer des particules étrangères, y compris des microorganismes, après avoir capté l’antigène, les cellules de
Langerhans activées quittent l’épiderme et gagnent les ganglions lymphatiques satellites où elles présentent les déterminants antigéniques aux lymphocytes T.
- Le GM-CSF induit la prolifération et la différenciation des
précurseurs des cellules de Langerhans ainsi que leur activation. Plusieurs marqueurs immunocytochimiques permettent de les identifier (CD1a par exemple). [7] [11]
III.1.4/ Les cellules de Merkel:
- Situées, de façon dispersée, dans la couche germinative, entre les kératinocytes basaux, au contact d’une terminaison nerveuse libre, les cellules de Merkel sont caractérisées en microscopie électronique, par la présence dans leur cytoplasme de très
nombreuses vésicules à centre dense entouré d’un halo clair. Les cellules de Merkel sont des cellules neuro-endocrines qui
expriment des marqueurs neuronaux (chromogranine,
synaptophysine, nombreux neuropeptides) et des marqueurs épithéliaux [nombreuses kératines, notamment la K20 qui, au niveau de la peau et de ses annexes serait spécifique des cellules de Merkel]. [8] [9]
- Les cellules de Merkel sont des mécanorécepteurs qui auraient également des fonctions inductives et trophiques sur les
terminaisons nerveuses de l’épiderme et sur les annexes cutanées. [8] [9]
III.2/ Le derme:
Le derme est un tissu conjonctif habituellement lâche en
périphérie et plus dense (fibreux) en profondeur. Il contient de nombreux vaisseaux sanguins et lymphatiques, des nerfs et des terminaisons nerveuses sensitives libres et corpusculaires, ainsi que diverses annexes cutanées dérivées de l’épiderme et
plongeant dans le derme. [7]
III.3/ L’hypoderme:
Continuant le derme vers la profondeur, l’hypoderme est un tissu conjonctif lâche richement vascularisé qui selon les conditions de nutrition et les régions de la peau, contient plus ou moins du tissu adipeux. [7]
III.4.1/Les glandes sudoripares:
Ce sont des glandes exocrines, tubuleuses simples pelotonnées, sécrétant la sueur. Leur portion sécrétrice (épithélium cubique simple) entourée de cellules myoépithéliales, siège dans le derme profond. Leur canal excréteur (épithélium cubique bi-stratifié) gagne la surface de l’épiderme par un trajet hélicoïdal.
L’innervation des glandes sudoripares est sympathique, segmentaire. [12]
III.4.2/Les follicules pilo-sébacés:
♣ Les poils:
- Les poils proviennent d’une invagination tubulaire de l’épiderme qui s’enfonce dans le derme. Cette invagination épidermique, constituant la gaine épithéliale du poil, se renfle à son extrémité profonde et constitue là un amas de cellules matricielles coiffant une papille de tissu conjonctif très vascularisé dépendant du
derme. Ces cellules matricielles prolifèrent et donnent naissance à des cellules épithéliales qui se kératinisent et dont la progression
se fait vers la surface cutanée, ainsi la tige du poil se constitue dans l’axe de la gaine épithéliale, la quantité et la qualité du pigment contenu dans ces cellules rendent compte de la couleur du poil. La gaine épithéliale est entourée par le « sac fibreux du poil », gaine conjonctive formée par le derme et renfermant des vaisseaux et des terminaisons nerveuses sensitives. Selon leur localisation, les poils portent des noms différents : cheveux, barbe, moustache, sourcils, cils. [12]
- La coloration des poils et des cheveux est due à l’incorporation de mélanosomes aux cellules épithéliales destinées à former la kératine des phanères. Elle s’explique à la fois par la quantité de mélanosomes présents et par la qualité du pigment (eumélanine noire ou phémélanine jaune orangée). [12]
En fait, il n’existe que trois couleurs des cheveux : noire, marron et jaune. Poils et cheveux sont des formations complexes
composées par une partie visible à la surface du tégument: la tige. Celle-ci s’invagine dans le derme au niveau de la racine logée à l’intérieur du follicule pileux (épiderme invaginé). La base du follicule est renflée et forme le bulbe pileux dont la base
constitue la papille dermique. Les mélanocytes responsables de la coloration des poils sont situés dans la partie profonde
- On a montré qu’il existe un polymorphisme du récepteur de l’alpha-MSH… Chez les individus roux, le récepteur est tel que sous l’action de l’hormone il ne permet pas la synthèse
d’eumélanine mais de phémélanine. Or, cette dernière ne résiste pas aux rayons ultraviolets (et de ce fait n’est pas un bon
photoprotecteur). Sous leur action (les UV), elle se détruit et donne naissance à des radicaux libres qui vont produire des lésions cellulaires (expliquant la fréquence de survenue de cancers cutanés chez de tels individus surtout s’ils sont exposés de façon chronique au soleil). [12]
- Au cours du vieillissement physiologique, les poils et les cheveux ont tendance à blanchir. Il n’y a pas d’explication univoque pour rendre compte de ce phénomène. Plusieurs hypothèses ont été proposées :
• (1) Une diminution du nombre des récepteurs de l’alpha-MSH pourrait rendre les poils moins sensibles à la
stimulation de la mélanogenèse.
• (2) Une destruction des mélanocytes par un virus. • (3) Une susceptibilité génétique (par exemple : le produit du gène bcl-2 est indispensable pour la survie des
♣ Les glandes sébacées:
- Les glandes sébacées, exocrines, alvéolaires simples, holocrines et sécrétant un produit lipidique = le sébum, sont annexées aux poils. Leur portion sécrétrice est formée d’un ou de plusieurs alvéoles dilatées en sacs dont la paroi est faite d’une couche de cellules cubiques. En dedans, se trouvent des cellules
polyédriques, plus volumineuses, progressivement chargées de gouttelettes lipidiques et dont le noyau se pycnose et finit par disparaître. La cellule est entièrement éliminée avec son contenu. - Le canal excréteur, unique et très court, débouche au niveau de la gaine épithéliale du poil. [12]
♣ Le muscle arrecteur du poil:
Le muscle arrecteur( redresseur) du poil est un petit muscle lisse à innervation sympathique segmentaire dont la contraction (sous l’effet du froid, de la peur, etc.) déclenche le redressement du poil (chair de poule). [12]
III.4.3/Les ongles:
Faits de cellules épithéliales kératinisées, tassées les unes contre les autres et issues par prolifération tangentielle de la matrice
unguéale, les ongles ont une croissance ininterrompue du fait de l’absence de desquamation. [7]
III.5/ Peau « fine » et peau « épaisse »:
III.5.1/ Peau fine:
- Elle comprend l’ensemble de la peau à l’exception de celle de la face palmaire des mains et des doigts et de la face plantaire des pieds et des orteils.
- C’est en raison de la faible épaisseur de l’épiderme (l’épaisseur du derme et de l’hypoderme peut par contre être plus ou moins grande), les glandes sudoripares s’y trouvent en nombre faible ou modéré, elle contient des follicules pilo-sébacés (en plus ou moins grand nombre selon les régions). [7] [8]
- Sa surface ne présente ni crêtes ni sillons, mais un simple quadrillage de lignes reliant les orifices légèrement déprimés des follicules pilo-sébacés, certaines régions de la peau dite « fine » se singularisent soit par la densité et/ou le calibre et la longueur des poils (cuir chevelu, sourcils, moustache, barbe, régions
génitales externes, etc.), soit par la présence de glandes sébacées non annexées à des poils ainsi que par l’absence de glandes
sudoripares (lèvres, gland, face interne du prépuce, petites lèvres, etc.), soit par la présence de glandes sudoripares « apocrines ». Ces dernières diffèrent des glandes sudoripares habituelles (dites « eccrines ») par leur répartition topographique limitée à
certaines régions du corps (creux axillaire, pubis, pourtour de l’anus, aréole et mamelon, prépuce et scrotum, petites lèvres, etc.), par la nature de leur produit de sécrétion (plus épais, plus odorant et plus riche en lipides et en pigments que la sueur
banale), ainsi que par leur fonctionnement lié aux étapes de la vie génitale.
- Les glandes cérumineuses du conduit auditif externe
représentent une variété particulière de glandes sudoripares apocrines. [7] [8]
III.5.2/ Peau épaisse:
- Elle s’oppose point par point aux caractéristiques de la peau dite fine. L’épaisseur de l’épiderme est considérable. Les glandes
sudoripares y sont très abondantes, il ne s’y trouve aucun follicule pilo-sébacé. Enfin, sa surface est le siège de crêtes et de sillons visibles à l’oeil nu (empreintes digitales ou dermatoglyphes ) et déterminés par des élevures du derme (papilles dermiques)
soulevant l’épiderme en crêtes séparées par des sillons. Les orifices des canaux des glandes sudoripares débouchent au
sommet de ces crêtes. Les dessins formés par ces crêtes et sillons sont caractéristiques de chaque individu et immuables (d’où leur utilisation à des fins d’identité judiciaire).
- Rappelons aussi que cette peau épaisse contient dans son derme et son hypoderme de nombreuses anastomoses artério-veineuses. [7] [8]
HISTOLOGIE (ANNEXE)
Fig. 1 : Vue tridimensionnelle d’un segment de peau humaine montrant ses principaux constituants.
Fig.2b : Epiderme vu en microscopie électronique:
IV/ Epidémiologie:
IV.1/ Historique des leishmanioses:
- Parmi toutes les parasitoses, les leishmanioses sont l’une des premières décrites au moins dans leur forme cutanée, comme en témoigne le nom sanscrit (relatif à la langue indienne) de Kala-azar (fièvre noire) qui désigne la leishmaniose viscérale indienne. En effet, la constatation des lésions cutanées remonte à la plus haute antiquité aussi bien dans l’ancien que dans le nouveau monde, alors que l’individualisation des formes viscérales et la mise en évidence des agents pathogènes n’ont pu se faire qu’au XIXème siècle. D’autre part, l’omniprésence de ces affections, en rapport avec des parasites, vecteurs, et réservoirs, a interpellé de nombreux observateurs, ce qui explique la fréquence des
descriptions de cette parasitose. [13]
- Ainsi, les leishmanioses tégumentaires de l’ancien monde, sont des affections dermatologiques connues depuis très longtemps. En effet, une tablette d’argile du palais de Ninive (700-600 av. J.-C.) qui est une transcription d’un écrit akkadien du deuxième ou
troisième millénaire avant notre ère, étudiée par Boissier dès 1894 évoque une ulcération indolore de la face. [13]
- Al Boukhari, médecin arabe du Xème siècle décrivit
incontestablement cette affection cutanée, et Avicenne (décédé en 1034) l’attribuait à une piqûre de moustique. [13]
- La première description clinique moderne est celle de McNaught en 1882 et c’est Cunnigham en 1885 qui découvrit les parasites dans un prélèvement de « bouton d’Orient ». [13]
- En 1898, en Ouzbékistan, le médecin militaire Borovsky
mentionna un protozoaire dans des prélèvements d’ulcère, sans en déterminer le statut taxonomique. Ce même parasite fut étudié en 1903 par Wright chez un enfant Arménien vivant à Boston, il fut considéré comme une microsporidie et reçut le nom de
Helcosoma tropicum. La même année les leishmanies sont également mises en évidence par Marchand dans la rate d’un sujet mort de kala-azar, La première culture fut obtenue par Nicolle et Sicre en 1908, ils comparèrent les organismes de la peau avec ceux de la rate découverts en 1903, et conclurent :
« La presque similitude au point de vue morphologique du parasite de Leishman-Donovan et de celui de Wright » [13] - La même année, Nicolle et Comte découvrent les mêmes
protozoaires chez le chien, puis chez le cheval et le chat. Ils font ainsi de cette affection une maladie commune à l’homme et aux autres mammifères et ouvrent la voie aux recherches
épidémiologiques. [13]
- En 1921, les frères Sergent et leurs collaborateurs établissent le rôle de vecteurs (phlébotomes) en réussissant à prouver la
transmission du « Bouton d’Orient » par application de broyats de ces insectes sur des scarifications cutanées, mais la transmission par la piqûre ne fut prouvée qu’en 1941 par Adler et Ber.
Knowles, en 1924, l’établit pour le kala-azar, Parrot et Donatien le font pour la leishmaniose canine en 1930. [13]
- Quant à elle, l’école soviétique, avec Latyshew et Kriukova, attire l’attention sur le rôle des rongeurs en tant que réservoirs sauvages des leishmanioses. Tous ces travaux, et les découvertes qui ont suivies ont permis de se faire une idée de ce qu’est le cycle épidémiologique de ces protozooses transmissibles. [13]
- Il est admis que le premier cas français authentifié de bouton leishmanien fut signalé en 1920 par Ravaut, à Baixas en
Roussillon, chez une fillette ayant une lésion de la narine gauche et une autre de la paupière droite. Un doute subsistait sur
l’identité de l’agent causal, il fallut attendre 1980 pour que la responsabilité de Leishmania infantum fût reconnue. En effet, reprenant les techniques biochimiques mises au point par Chance en 1970, Rioux identifia le parasite du Midi de la France, grâce à l’analyse isoenzymatique. [13]
IV.2/ Répartition géographique : IV.2.1/ Dans le Monde:
- On distingue actuellement deux zones: l’ancien et le nouveau monde (CF Introduction). [39]
Fig.4 : Distribution géographique de la leishmaniose cutanée dans le monde.
IV.2.2/ Au Maroc:
- La carte ci-jointe montre les principales zones de notre pays touchées par la leishmaniose: [18]
- On distingue principalement quatre zones: La zone du Rif ( El hoceima, Nador…). Ouazzane, Taounat.
Le Sud du Maroc ( Taroudant, Tafilalt…). Oujda, Taza, Fes, Meknes, Casablanca.
IV.3/ Les protagonistes des leishmanioses: IV.3.1/ Le parasite:
IV.3.1.1/ Classification: - Position taxonomique: [14]
Sous règne : Protozoa.
Embranchement : Sarcomastigophora. Sous-embranchement : Mastigophora. Classe : Zoomastigophorea. Ordre : Kinétoplastida. Sous-ordre : Trypanosomatina. Famille : Trypanosomatidae. Genre : Leishmania.
- Il existe plusieurs espèces et sous-espèces qu’on peut regrouper dans les tableaux ci-dessous: [14]
(Tiré de Roberts et Janovy, 2000)
Parasite/sous-espèce Localité
Complexe L. donovani Inde, Chine, Bangladesh L. donovani (Laveran et
Mesnil, 1903) Soudan, Éthiopie
L. archibaldi (Castellani et
Chalmers, 1919)
Complexe L. infantum Centre nord de l’Asie, nord-ouest de la Chine, Moyen-Orient, sud de l’Europe, nord-ouest de l’Afrique
L. infantum (Nicolle, 1908) Amérique du Sud et Centrale
L. chagasi (Cunha et
Chagas, 1937)
Complexe L. tropica Milieux urbains du Moyen-Orient et de l’Inde L. tropica (Wright, 1903) Tunisie
L. killicki (Rioux, Lanotte et
Pratlong, 1986)
Complexe L. major Afrique, Moyen-Orient, Asie soviétique
L. major
Complexe L. gerbilli Chine, Mongolie
L.gerbilli (Wang, Qu et
Complexe L. arabica Arabie Saoudite
L. arabica (Peters, Elbihari
et Evans, 1986)
Complexe L. aethiopica Éthiopie, Kenya L. aethiopica (Bray,
Ashford et Bray, 1973)
Complexe L. mexicana Mexique, Belize, Guatemala, centre sud des États-Unis L. mexicana (Biagi, 1953) Bassin Amazonien, Brésil
L. amazonensis (Lainson et
Shaw,1972) Venezuela
L. venezuelensis
(Bonfante-Garrido,1980)
Complexe L. enrietti Brésil
L. enrietti (Muniz et
Medina, 1948)
Complexe L. hertigi Panama, Costa Rica
L hertigi (Herrer, 1971) Brésil
L. deanei (Lainson et
Shaw, 1977)
Sous-genre Viannia
(Lainson et Shaw, 1987)
Complexe L. braziliensis Brésil L. braziliensis (Viannia,
1911) Ouest des Andes
Complexe L. guyanensis Guyane Française, Guyane, Surinam L. guyanensis (Floch,
1954) Panama, Costa Rica
L. panamensis (Lainson et Shaw, 1972)
- Il faut noter que l’ensemble de ces espèces sus- citées peuvent induire les trois variétés de leishmaniose, on porte surtout l’intérêt sur les variétés responsables de leishmaniose cutanée au Maroc [18] qui sont pour rappel:
• L.Tropica. • L.Major.
• L.Infantum variété dermotrope.
IV.3.1.2/ Les différentes formes et leur localisation: - Le parasite se présente chez l’hôte essentiellement selon deux formes: [15]
♠ La forme promastigote:
Ce sont des parasites extracellulaires mobiles vivant dans le tube digestif des diptères hématophages piqueurs, connus sous le terme générique de phlébotomes. Ils présentent un corps plus ou moins fuselé de 5 à 20μm de longueur et de 1 à 4μm de
largeur prolongé par un flagelle qui peut atteindre jusqu’à 20μm de longueur et qui émerge de leur pôle antérieur.
Dans ces formes parasitaires, le kinétoplaste, une partie spécialisée du compartiment mitochondrial qui contient l’ADN de cet organite, est situé entre le noyau et la base du flagelle.
Fig.5 : Forme promastigote, photo issue d’un prélèvement du TD.
♠ La forme amastigote:
Ces formes nichent à l’intérieur des macrophages des mammifères, au sein de vacuoles dites parasitophores, à ce stade les Leishmanies présentent un corps beaucoup plus ramassé de 4um de long et de 2μm de large. Contrairement à ce que leur nom pourrait conduire à penser, les formes
est très court et ne dépasse pas le corps cellulaire. Le
kinétoplaste de ces formes est le plus souvent juxtanucléaire.
Fig.6 : Forme amastigote,
photo issue d’un frottis Fig.7 :Ultrastructure d’une formeamastigote
♠ Un troisième type: connu sous le terme de
paramastigote:
Ce type a été identifié principalement au niveau du pharynx, mais aussi au niveau de l’intestin postérieur et rarement dans l’intestin médian des
phlébotomes infectés. Ces types sont ramassés, munis d’un flagelle court et montrent un kinétoplaste juxtanucléaire. La
position de ce morphotype dans le cycle biologique des
Leishmanies n’est pas claire.
Est-il l’aboutissement d’une voie de différenciation abortive des promastigotes n’aboutissant pas à la formation de promastigotes infectieux pour les mammifères ? ou bien participe-t-il à l’infection des mammifères ? Cela reste pour le moment sans réponse, bien que des expériences in vitro semblent indiquer que les
paramatigotes ne sont pas un stade nécessaire à l’obtention des formes virulentes (On arrive en effet à générer des promastigotes très infectieux, sans passer par le stade paramastigote.)
IV.3.1.3/ Biologie:
- Comme la plupart des parasites, les Leishmanies sont
étonnantes par leurs capacités adaptatives qui, au cours du cycle biologique, leur permettent de coloniser des habitats variés. La morphologie de ces parasites, notamment celle de leur stade promastigote, et leur métabolisme sont d’ailleurs très sensibles aux paramètres environnementaux et à leurs variations. La
température, le pH, l’osmolarité du milieu, la pression en O2 et en CO2 ont été décrits comme influençant la forme parasitaire et les métabolismes du glucose et de certains acides aminés. [14] [15]
- Deux paramètres subissant de grandes variations au cours du cycle, à savoir le pH et la température semblent plus
particulièrement importants et pourraient commander la mise en route de programme de différenciation : lorsque les Leishmanies
passent des insectes vecteurs à sang froid à leurs hôtes
mammaliens, elles subissent tout d’abord une augmentation de température d’environ 10°C puis, après internalisation par les macrophages, une chute du pH externe d’environ 2 unités. [14] [15] IV.3.2/ Le vecteur: IV.3.2.1/ Classification: - Position taxonomique: [16] Ordre : Diptera. Sous-ordre : Nematocera. Famille : Psychodidae. Sous-famille : Phlebotominae. Genres : Phlebotomus ; Lutzomyia.
- Il existe plus de 600 espèces réparties de par le monde dont environ 70 espèces sont suspectes de vectrices et uniquement 20 espèces sont des vecteurs prouvés anthropotropiques de
- Au Maroc, 22 espèces de phlébotomes inventoriés regroupés en deux genres : Phlebotomus et Sergentomyia, seuls cinq espèces sont impliquées dans la transmission: [18]
• Ph. Papatasi. • Ph. Sergenti. • Ph. Ariasi. • Ph. Longicuspis. • Ph. Perniciosus. IV.3.2.2/ Morphologie:
- Les phlébotomes sont des diptères hématophages présentant un corps grêle et allongé (2 à 5mm.), recouvert, ainsi que les ailes, d’une fine pilosité.
- Il existe une base de données d’identification des phlébotomes du Nouveau Monde (CIPA : Computer aided Identification of Phlebotomine sandlies of America). [17]
Fig.8 Dessin de phlébotome, aspect général. D’après CIPA. IV.3.2.3/ Biologie:
- Les phlébotomes ont un cycle de vie holométabole, le stimulus qui provoque l’oviposition est le contact avec une surface humide, leurs oeufs se développeront ensuite en larves sur le sol, dans les terriers, les nids, la poussière des anfractuosités de rochers ou de vieux murs, les tas de débris végétaux, puis on pourra observer une pupe et enfin un imago. [18]
- De moeurs nocturnes, les phlébotomes adultes gîtent durant la journée dans des endroits retirés sombres et relativement
humides (terriers, étables, clapiers, niches, et même dans les maisons), les horaires de sortie et de rentrée varient avec les espèces.
- Comparés aux moustiques les phlébotomes sont de mauvais voiliers, ils se déplacent par vols courts avec des arrêts fréquents, leur rayon maximum de déplacement, variable selon les espèces (et sans doute les observateurs !) est d’environ 1km. Ils ne commencent à s’agiter qu’à la tombée du jour si la
température est suffisamment élevée (19-20°C), s’il n’y a pas de vent (limite : 1m/sec.) et si le degré hygrométrique est élevé. Certaines espèces sont attirées par la lumière, le plus souvent de faible intensité, d’autres ne manifestent que peu ou pas de
phototropisme. De plus certaines espèces sont nettement endophiles, et d’autres préfèrent l’extérieur. [17] [18] - Seule la femelle est hématophage, elle se nourrit sur les
mammifères, les oiseaux, les reptiles, ou les batraciens. Certaines espèces sont très éclectiques, d’autres plus ou moins spécialisées dans l’exploitation d’un ou de plusieurs hôtes. Les espèces qui piquent l’homme sont généralement également zoophiles, ce qui explique le rôle des phlébotomes dans la transmission de la leishmaniose.
- Lorsque l’on pratique des analyses de contenus stomacaux, il n’est pas rare de trouver du sang de diverses origines. En effet, lorsqu’un phlébotome est dérangé au cours de son repas, il peut le compléter soit en piquant aussitôt le même hôte (ce qui
explique certaines lésions multiples de leishmanioses cutanées) soit en piquant un autre hôte. Il faut 30 secondes à 5 minutes pour que l’estomac d’un phlébotome soit rempli, ce qui l’expose à de fréquents dérangements !! [17] [18]
- Chez l’homme ce sont les parties découvertes qui sont exposées aux piqûres (visage, cou, mains, pieds), chez les animaux ce sont les zones les moins velues (museau, oreilles). La piqûre est
douloureuse, mais l’intensité des réactions de l’hôte varie selon l’espèce de phlébotomes en cause (douleur, apparition d’une papule ou d’une tache hémorragique). [17] [18]
IV.3.3/ Les hôtes réservoirs:
- Avant de dénombrer les différents hôtes en cause, il s’avère utile de comprendre les modalités de transmission humaine et les
interactions hôtes/vecteurs, grosso modo on a trois cas de figure: [13]
▪ Le réservoir sauvage et un vecteur spécifique du parasite sont dans une même « niche écologique » intégrant un réservoir secondaire péridomestique et non l’homme par défaut d’anthropophilie de la part du vecteur, la
transmission humaine ne pourra alors se faire que par l’intermédiaire d’un autre vecteur qui présentera une anthropophilie plus marquée.
▪ Le réservoir sauvage et le vecteur sont seuls en syntopie. L’homme ne pourra dès lors se contaminer qu’à l’occasion de contacts épisodiques avec le milieu naturel, lors
▪ Le réservoir sauvage, le vecteur et l’homme sont en
syntopie au sein de la même « niche écologique ». Il existe deux cas de figure:
Le parasite passera du réservoir primaire à l’homme. Ces cas peuvent correspondre aux contaminations survenant à l’occasion de contacts permanents avec un milieu récemment « anthropisé » ou « urbanisé », comme en périphérie des grandes villes proches des forêts primaires d’Amazonie ou dans les villages récemment implantés en zones défrichées…
Le cycle est amplifié par la présence d’un potentiel réservoir secondaire constitué par les animaux
péridomestiques qui peuvent assurer ainsi un rôle de relais au sein du complexe pathogène, deux sources d’infestation sont alors possibles : le réservoir primaire et secondaire.
- Seuls les mammifères ont été à ce jour trouvés porteurs de protozoaires appartenant au genre Leishmania pathogènes ou non pour l’homme. Ils peuvent être réservoirs ou hôtes
accidentels pour le parasite, et diffèrent selon les régions. En fonction de l’hôte il est admis de distinguer des cycles primaire et secondaire, zoonotiques, dans lesquels respectivement des
mammifères sauvages et domestiques interviennent en tant que réservoirs.
De même, l’homme peut dans certains complexes jouer un rôle de réservoir du parasite, constituant alors avec le vecteur un cycle anthroponotique ou tertiaire, dans ce cas l’affection humaine peut prendre un caractère endémoépidémiologique. [13]
- Dans l’Ancien Monde, Musser et Carleton on décompté en 1993, 42 espèces appartenant à 25 genres, 9 familles et 4 ordres
infestés par des Leishmanies appartenant à huit complexes leishmaniens.
- Au Maroc: [18]
▪ La leishmaniose cutanée à L. major est une zoonose dont le réservoir est le Mériones Shawi (rongeur).
▪ La leishmaniose cutanée à L. tropica est une anthroponose dont le réservoir est strictement humain (L. tropica Mon-102).
▪ La leishmaniose cutanée à L. infantum (variété dermotrope) est une zoonose dont le réservoir est représenté par le chien.
- Le tableau ci-dessous regroupe les principaux hôtes ainsi que les différentes espèces abritées par chacun d’entre eux: [13]
Mammifères considérés comme réservoirs ou trouvés occasionnellement porteurs de Leishmania dans l’Ancien Monde
IV.4/ Le cycle du parasite:
- Le cycle des leishmanioses est un cycle hétéroxène présentant deux hôtes, un hôte invertébré (phlébotome) et un hôte vertébré (Homme, chien, renard...).
- C’est au cours du repas sanguin pris sur un animal ou un sujet infecté que le phlébotome absorbe les leishmanies sous la forme amastigote , parasite intracellulaire du système
réticulo-histiocytaire du sang et de la peau des vertébrés. La rupture des cellules hôtes intervient au cours de l’ingestion et les
amastigotes sont libérées. [19] [20]
- Chez les insectes, le repas sanguin est rapidement entouré par la membrane péritrophique sécrétée par les cellules intestinales abdominales, en effet, au cours des 24 à 48 heures qui suivent le repas sanguin, les leishmanies se multiplient une ou deux fois dans l’intestin du phlébotome sous la forme amastigote. Il
semblerait qu’il existe dans le sang de l’hôte vertébré un facteur inhibant leur transformation en forme promastigote
caractéristique de la phase hôte-invertébré, qui ne pourrait intervenir qu’après destruction de ce facteur par les enzymes protéolytiques sécrétées par l’insecte. Ainsi, ce n’est qu’après ce
temps de latence que les formes promastigotes apparaissent et se multiplient, au bout de 3 à 4 jours, elles s’échappent de la
membrane péritrophique qui est déchirée et gagnent leur lieu de multiplication qui varie en fonction de l’espèce des Leishmanies. Ce critère a permis la mise en place d’une classification
des Leishmanies en : Hypolaria (au niveau de l’intestin
postérieur), Péripylaria (de part et d’autre du pylore), Suprapylaria (au niveau de l’intestin antérieur et moyen.), ces deux derniers types concernent des espèces de leishmanies des mammifères. [20]
- Les leishmanies gagnent ensuite les pièces buccales. La durée du cycle chez le phlébotome est de 4 à 7 jours suivant la
température. Le vecteur peut alors transmettre le parasite à un autre animal ou à l’homme. Les promastigotes «injectés» seront transformés en amastigotes lors de leur passage en
phagolysosomes, dans lesquels ils se multiplieront entraînant la lyse cellulaire successive des macrophages du sang ou de la peau de l’hôte vertébré .
- Les phlébotomes infectés ont des difficultés à prendre leur repas sanguin ce qui peut être un facteur de multiplication des piqûres et donc d’augmentation de transmission. [19] [20]
V/ Etiopathogénie:
- La salive du phlébotome favorise les premières étapes de l’infection car elle contient des substances pharmacologiques actives qui produisent une vasodilatation et une
immunodépression locales. [19]
- L’interaction primaire des leishmanies et des macrophages repose sur la reconnaissance, sur la face externe du parasite, de molécules de liaison par divers récepteurs présents sur la
membrane des macrophages. L’infection dépend d’une phagocytose rapide des formes promastigotes et de leur transformation en formes amastigotes, qui, dans une vacuole parasitophore, résistent aux différents mécanismes de défense cellulaire. [19]
- Le parasitisme entraîne dans le macrophage une baisse de la capacité de production des dérivés oxygénés et nitrogénés
complétant ainsi les mécanismes d’échappement des leishmanies à la digestion cellulaire. [19]
- Les phénomènes de coopération entre macrophages et lymphocytes T CD4+ et TCD8+ jouent un rôle important dans l’évolution de la maladie, dans un bon nombre de cas, l’infection reste asymptomatique mais des amastigotes intracellulaires peuvent rester quiescents des années, expliquant les
leishmanioses opportunistes des sujets immunodéprimés. [19] - Lorsque la multiplication cellulaire reste localisée aux
macrophages et aux cellules dendritiques du site d’inoculation les réactions cellulaires générées et les diverses cytokines produites entraînent le développement d’une lésion cutanée localisée. [19] - Les parasites peuvent être également transportés aux ganglions lymphatiques, diffusant à d’autres sites cutanés comme dans la leishmaniose cutanée diffuse, ou aux muqueuses de la face comme dans le cas des leishmanioses cutanéo-muqueuses. Dans d’autres cas, une extension vers tous les organes du système des phagocytes mononuclés est possible provoquant ainsi la leishmaniose viscérale, et donc possibilité de formes
VI/ Clinique:
- Il faut savoir que les leishmanioses cutanées siègent
préférentiellement aux zones accessibles donc découvertes, on abordera la clinique de la leishmaniose cutanée selon deux grands axes en rapport avec les zones géographiques ou sévit la maladie, représentés par l’Ancien et le Nouveau Mondes (CF Introduction).
VI.1/ La leishmaniose cutanée de l’Ancien Monde:
- Selon les différentes régions touchées, plusieurs appellations sont attribuées à cette forme de leishmaniose, entre autres : le Bouton d’Orient, le bouton d’Alep, de Delhi, le Clou de Briska, le clou de Jéricho.
VI.1.1/ La leishmaniose anthroponotique ou urbaine ou forme sèche:
- Cette forme est la plus courante en milieu méditerranéen, l’incubation, silencieuse, dure en moyenne deux à quatre mois, parfois plus. La lésion est unique ou multiple et se trouve sur une
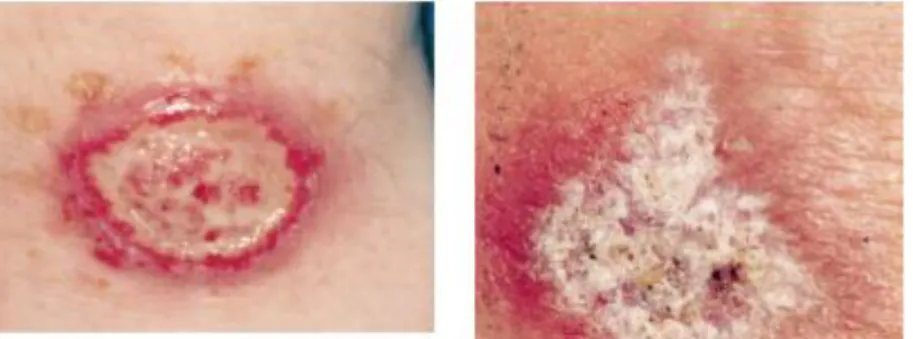
zone découverte (visage +++, membres). Il s’agit initialement d’une papule rouge carmin qui s’étend progressivement en surface et s’infiltre en profondeur, après quelques semaines d’évolution, une ulcération centrale recouverte d’une croûte
apparaît, à ce stade est réalisée la lésion leishmanienne typique : ulcération croûteuse reposant sur un nodule inflammatoire, mal limité de deux à trois centimètres de diamètre. Classiquement la croûte émet des prolongements « en stalactites » dans la
profondeur de l’ulcère. La lésion est parfois prurigineuse, jamais douloureuse. Elle évolue en plusieurs mois, voire plus d’un an, vers le comblement de l’ulcère et l’apparition d’une cicatrice souvent inesthétique. Elle est due à Leishmania Tropica. [26]
VI.1.2/ La leishmaniose zoonotique ou rurale ou forme humide:
- Elle est causée par leishmania Major, elle se distingue de la forme sèche par son évolution plus rapide, sa plus grande taille, le caractère plus creusant de l’ulcère, sa cicatrice plus importante. Les formes humides se rencontrent surtout en zone rurale, notamment en Asie centrale mais aussi sur le littoral
méditerranéen et en Afrique. Elle revêt habituellement une forme lipoïde initiale, ou bien le plus souvent, survient un à huit ans
après guérison apparente de celle-ci, son site de prédilection est le visage, la lésion est beaucoup moins inflammatoire et le
bourrelet périphérique est moins important, la croûte est plus squameuse, noter que les leishmanies sont fréquemment absentes sur les prélèvements et sur les coupes. [26]
VI.1.3/ La forme impétiginoïde:
- Cette forme réalise une lésion sous forme de plaque arrondie pouvant atteindre plusieurs centimètres de diamètre, squamo-crôuteuse avec un centre granuleux et irrégulier, la saillie
écailleuse blanchâtre des bords est très évocatrice, les squames reposent sur un épiderme rouge non érodé ou couvert
d’ulcération très superficielle, la plaque peut être unique ou multiple et dans ce dernier cas les plaques sont isolées et le plus souvent distantes les unes des autres ou parfois regroupées sur une région donnée du tégument. [21] [22]
VI.1.4/ La forme tubéreuse:
- Non ulcérée et lisse ou kératosique, elle a été décrite par MONCELLI.
Cette forme existe sur des bouchons cornés intrafolliculaires. Ce type se confond souvent avec les formes lipoïdes. [21] [22]
VI.1.5/ La forme verruqueuse:
- Elle siège électivement sur les membres et intéresse souvent les membres inférieurs, plus rarement à la face. La lésion est faite d’une plaque unique ou multiple, elle est plus ou moins saillante en macaron, la surface est papillonnante, hyperkératosique. Elle peut être fissurée, intacte ou même ulcérée. Cette forme résiste aux traitements généraux. Elle réalise le plus souvent une forme sèche. [21] [22]
VI.1.6/ La forme végétante:
- Condylomateuse, humide, croûteuse, unique ou multiple, peut simuler un pianome. Cette forme a été décrite par RABELLEE, elle est aussi appelée forme framboesoïde. [24]
VI.1.7/ La forme nodulaire:
- Elle est observée dans certains pays (Egypte). Elle siège au niveau de l’hypoderme ou bien elle est dermo-hypodermique, elle est constituée par plusieurs modules cutanés, durs et non ulcérés, elle persiste plusieurs années. [24]
VI.1.8/ La forme lipoïde:
- Elle a un grand intérêt du fait de sa fréquence et des erreurs diagnostiques qu’elle induit du fait de la difficulté de la distinguer du lupus, de la lèpre et surtout de la maladie de Schauman. L’aspect habituel est celui angio-lipoïde sous forme d’une plaque nodulaire rouge jaune et lisse, la consistance est élastique avec infiltration lipoïde à la vitro pression. Ce type simule exactement l’angio-lipoïde de la maladie de Schauman avec localisation
élective au visage. Certains auteurs pensent que ce type survient chez les sujets incomplètement immunisés. [20]
VI.1.9/ La forme infiltrée en nappe:
- Elle rejoint la forme lipoïde, cette forme est diffuse, squameuse ou verruqueuse, rarement ulcéro-croûteuse. Elle est constituée par une vaste plaque ou parfois se présente en placards. Elle est causée par Leishmania major Mon-74. [23]
VI.1.10/ La forme nécrotique:
- Elle est formée de croûtes noirâtres, parfois extensives, elle peut même réaliser des formes phagédéniques avec infiltration
oedémateuse du voisinage. [21]
VI.1.11/ La forme lymphangitique:
- Elle est rare dans l’Ancien Monde, elle revêt les mêmes aspects que les leishmanioses américaines. [21]
VI.1.12/ Les formes récidivantes:
- Sont l’apanage des enfants et des adolescents. Contrairement à l’opinion classique, les leishmanioses cutanées ne laissent
souvent qu’une immunité partielle et temporaire. Un sujet,
antérieurement atteint, peut présenter à l’occasion d’une nouvelle contamination, une forme typique (s’il n’est plus immunisé).Si par contre il conserve une immunité partielle il risque de développer une forme lipoïde. La lésion lipoïde s’observe essentiellement au visage, elle peut siéger près de la cicatrice d’une lésion antérieure ou en peau saine. [21]
VI.2/ La leishmaniose cutanée du Nouveau Monde:
- Elle est endémique au Brésil, en Argentine, au Pérou, en Bolivie et en Amérique centrale. L’infection est fréquente dans les régions humides forestières. Elle est désignée sous des noms variés.
L’agent pathogène est Leishmania braziliensis.
- Les lésions sont superposables à celles des leishmanioses de l’Ancien Monde, sauf qu’elles sont plus graves et plus durables. - Certaines formes cliniques que nous allons citer sont en fait des leishmanioses cutanéo-muqueuses, mais dans la majorité des cas
les lésions cutanées précédent de quelques mois celles des muqueuses d’où la nécessité de les signaler. [40]
VI.2.1/ L’ulcère de Barru ou bouba:
- L’agent vecteur est un phlébotome du genre (Phlébotomus longigalpis, Phlébotomus migonei, Phlébotomus argentipes, et Phlébotomus davasi). Elle est causée par Leishmania braziliensis braziliensis, les ulcères sont similaires à ceux produits par
Leishmania braziliensis panamensis. Ils sont parfois plus douloureux et extensifs.
- Les cas cliniques aberrants peuvent ressembler à de
nombreuses autres maladies de la peau. La guérison spontanée est rare et demande habituellement plus d’une année. Le
réservoir est imparfaitement connu et on a incriminé des rongeurs sauvages, le chien, le paca, l’écureuil, le hamster et même des oiseaux et des reptiles.
- Les lésions muqueuses peuvent se développer en même temps que les lésions cutanées mais le plus souvent, les lésions
muqueuses peuvent apparaître plusieurs années après la disparition des ulcères cutanées. L’ulcération muqueuse progressive s’accompagne d’une hyperplasie des tissus
environnants, elle détruit lentement la paroi nasale, le palais, les cordes vocales ainsi que d’autres structures de l’oropharynx et du rhinopharynx et produit des graves mutilations faciales. La mort est souvent due à une broncho- pneumonie secondaire. [40]
VI.2.2/ L’ulcère de Chicléros:
- Dû à Leishmania mexicana mexicana, il est souvent unique et siège en général à l’oreille. La guérison spontanée est la règle mais l’évolution peut être chronique et destructrice. [40]
VI.2.3/ Le pian-bois:
- Il est dû à leishmania Braziliensis guyanensis, la lésion est généralement unique, sèche et indolore. Il se caractérise par sa chronicité et l’atteinte des voies lymphatiques sous forme de nodules étagés.
La guérison spontanée survient souvent après environ neuf mois d’évolution. [40]
VI.2.4/ L’Uta:
- Il est dû à Leishmania peruviana, et atteint principalement les enfants.
L’ulcération est unique, ou en nombre réduit, guérit en quelques mois ou prend un aspect humide, extensif creusant, parfois végétant avec surinfection et lymphangite.
Lorsque l’uta siège à la face, une extension mutilante aux muqueuses buccales ou nasales est possible. [40]
VI.2.5/ La leishmaniose cutanée eczématiforme:
- Elle est déroutante car elle prend un aspect eczématiforme qui souligne la nécessité d’évoquer systématiquement cette
parasitose chez les patients provenant des zones d’endémie, même devant des lésions cutanées atypiques. [27]
VI.2.6/ La leishmaniose cutanée de présentation atypique:
- Un exemple type en est la leishmaniose cutanée endémique en Guyane française, qui peut revêtir l’aspect d’un panaris dans sa forme initiale. La mauvaise orientation initiale dans un service non sensibilisé à la pathologie tropicale entraîne souvent des
problèmes de prise en charge. [27]
VI.2.7/ La leishmaniose cutanée diffuse:
- Elle est rare, réalise une atteinte nodulaire généralisée des téguments, notamment des membres et du visage, simulant une lèpre lépromateuse. Il n’y a ni ulcération, ni lésion muqueuse, en l’absence de traitement, l’évolution est fatale. Elle survient le plus souvent chez les sujets immunodéprimés. [25]
• Dans les zones montagneuses d’Ethiopie, du Kenya, de Tanzanie et de Namibie elle est due à Leishmania
aethiopica.
• Dans les zones forestières du Mexique, le Brésil, le Venezuela, l’agent responsable des formes diffuses est
• On a aussi une leishmaniose cutanée diffuse due à
leishmania major dont les lésions évoquent une lèpre lépromateuse en zone d’endémie lépreuse. Il y a des rechutes après un traitement par Glucantime*.
• La leishmaniose cutanée diffuse à Leishmania infantum
CLINIQUE ( annexe)
Fig1 : Forme impétiginoïde de l’enfant à L. infantum.
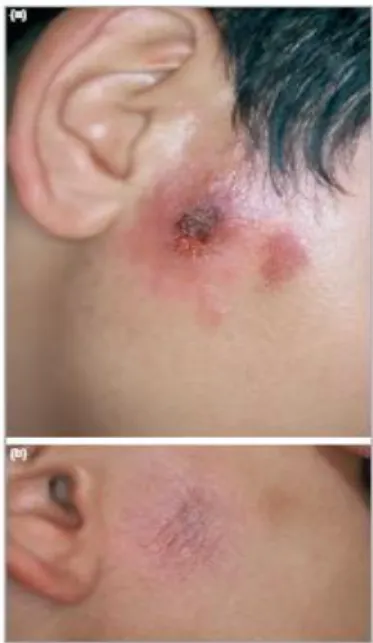
Fig 2 : (a) Lésion ulcéro-croûteuse de la joue.
Fig 3 : Forme ulcéro-croûteuse localisée à la pommette.
Fig 5 : A gauche : Ulcère causé par L.brasiliensis. A droite : la même lésion en voie de guérison.
Fig 6 : Papule érythèmateuse recouverte d’une croûte noirâtre au niveau de la pommette gauche.
Fig 7 : Deux papules érythèmato-squameuses de la joue gauche chez une petite fille de 2 ans.
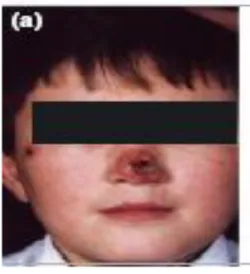
Fig 8 : Lésion ulcéro-croûteuse du nez.
Fig 9 : Lésion érysipéloïde de la face Chez un enfant Saoudien (forme érysipéloïde de la leishmaniose).
VII/ Diagnostic:
VII.1/ Diagnostic clinique:
- La description clinique détaillée des différentes formes cliniques a été traitée dans le chapitre Clinique (CF), cependant, pour résumer et être le plus pratique possible, on retient que le diagnostic repose essentiellement sur la notion d’un séjour en pays d’endémie et sur l’évolution chronique d’une ou plusieurs lésion (s) ulcérée (s).La symptomatologie commence par
l’apparition d’une papule rouge indolore sur la peau au niveau des zones découvertes (visage, cou, bras et jambes) qui sont les plus couramment atteintes, ensuite la papule s’indure puis s’ulcère en se recouvrant d’une croûte. Il existe trois types de lésions:
▪ Sèche ou nodulaire : l’ulcération est croûteuse mal limitée, avec une
évolution lente vers la guérison spontanée.
▪ Humide ou creusante : l’ulcération est plus profonde, plus grande, avec une évolution plus rapide.
▪ Lipoïde : nodule rouge-jaunâtre ferme et lisse qui en le pressant un peu, laisse apparaître des grains lipoïdes
jaunâtres. Généralement, il est de petite taille et se localise volontiers au visage.
- Le diagnostic de certitude ne pourra être confirmé que par le laboratoire qui permettra aussi de faire la différence avec d’autres lésions tels qu’un furoncle, un impétigo, un ulcère vasculaire ou lépreux surtout lors des formes de présentation atypique.
VII.2/ Diagnostic biologique:
VII.2.1/ Mise en évidence du parasite:
♣ Par examen direct après coloration:
- Il se fera sur les frottis de raclage de la lésion : en bordure, la face interne de l’ulcération et sur sa périphérie, par ponction du nodule à la seringue, sur des coupes histologiques, par la suite les frottis seront colorés par Giemsa après fixation par May Grünwald puis examinés à l’immersion à l’objectif 100.
- Les corps des leishmanies se trouvent groupés à l’intérieur des macrophages ou en apparence libre. Ce sont des capsules ovoïdes de deux à six microns de diamètre, leur cytoplasme est bleu, il contient un noyau teinté en rouge violacé et pourvu d’un gros
caryosome central. A côté du noyau, on distingue un appareil flagellaire rudimentaire composé d’un blépharoplaste et d’un rhizoplaste. On note que les lésions récentes contiennent plus de leishmanies que les lésions anciennes. [28] [29]