Bara LO
M2 Biochimie Structurale
Protéomique - Métabolomique
Qualité technologique du foie gras :
Incidence de l’évolution du métabolisme
hépatique au cours du gavage.
Encadrants :
Cécile BONNEFONT
Michel BOUILLIER-OUDOT
Nathalie MARTY-GASSET
Cécile CANLET
Abréviations :
ACP : Analyse en Composantes Principales APS : Ammonium persulfate
ANOVA : Analyse Of Variances
BLAST : Basic Local Alignment Search Tool BSA : Bovine serum albumine
CHAPS: 3-[(3-cholamidopropyl)diméthylammonio]-1-propanesulfonate CID: Collision Induced Dissociation
CPMG: Carr-Purcell-Meiboom-Gill D2O : deutérium oxyde : eau deutérée
DTT: dithiothréitol FAS: Fatty Acid Synthase FDR : False Discorvery Rate GC: Gaz Chromatography HDL : High Density Lipoprotein
HPLC: High Performance Liquid Chromatography IPA : Ingenuity Pathway Analysis
KEGG: Kyoto Encyclopedia of Genes and Genomes KH2PO4 : Dihydrogénophosphate de potassium
Na2HPO4 : Hydrogénophosphate de sodium
NOESY: Nuclear Overhauser Effect SpectroscopY PDH : Pyruvate Deshydrogenase
PLS-DA: Partial Least Squares – Discriminant Analysis PPM : Partie par million
Q-T OF : Quadrupole – Time Of Flight RMN: Résonance Magnétique Nucléaire SCA : Simultaneous Component Analysis SDS : dodécylsulfate de sodium
SDS-PAGE : Sodium Dodecyl Sulfate - PolyAcrylamide Gel Electrophoresis TEMED : Tetramethylethylenediamine
TMSP : Triméthylsilylpropanoate de sodium deutéré VLDL: Very Low Density Lipoprotein
RÉSUMÉ
Comprendre et maîtriser la variabilité du rendement technologique est un objectif important pour améliorer la qualité technologique du foie gras donc une meilleure valorisation du produit final. Dans cette optique, ce projet vise à étudier les mécanismes biologiques mis en place lors du développement de la stéatose hépatique au cours du gavage et leurs variabilités en relation avec le rendement technologique des foies à la cuisson. Pour cela, d’abord, 210 canards ont été séparés en deux groupes et ont été gavés pendant 12 jours avec des quantités d’aliment différentes. Après chaque abattage, les foies ont été prélevés. Ensuite, par une approche de RMN du proton, une analyse des métabolites polaires a été effectuée et par spectrométrie de masse, une étude du protéome a été menée. Elle a permis d’abord de voir l’évolution des métabolites associés à la stéatose hépatique comme le glucose qui est le précurseur de la lipogenèse. Ce métabolite diminue au cours du temps à cause de l’activation des voies de stockage des glucides ou de transformation des glucides en lipides de réserve. L’étude a montré aussi la diminution de métabolites permettant de maîtriser le stress oxydatif, l’augmentation des métabolites en relation avec la synthèse des membranes et des acides aminés stimulant la synthèse de protéines impliquées dans la stéatose hépatique. En parallèle, les études en protéomique ont démontré aussi la même évolution du métabolisme hépatique avec une activation de la voie de synthèse des acides gras favorisant ainsi la stéatose hépatique. Il a été mis en évidence aussi que la quantité de lactate était plus importante chez les foies avec un rendement faible. Ainsi le lactate hépatique semble être un bon marqueur prédictif de la fonte lipidique.
TABLE DES MATIERES
INTRODUCTION ... 4
1-
STEATOSE HEPATIQUE ... 5
De l’amidon au Glucose ... 5
Du Glucose aux Acides gras ... 5
Régulation de la stéatose ... 6
2-
OPTIMISATION DES FACTEURS ZOOTECHNIQUES ET
TECHNOLOGIQUES ... 6
3-
APPROCHES EN « OMIQUE » ... 7
a- Lipidomique ... 7 b- Protéomique ... 7 c- Métabolomique ... 8BUT DU STAGE ... 9
MATERIEL ET METHODES ... 10
1-
Protocole d’élevage, de gavage et de prélèvement des foies ... 10
2-
Choix des échantillons ... 10
3-
Métabolomique ... 12
a- Extraction des métabolites polaires ... 12
b- Analyses par R.M.N (Résonance Magnétique Nucléaire) ... 12
c- Analyse statistiques ... 13
4-
Protéomique ... 14
a- Extraction des protéines ... 14
b- Analyse LC-MS/MS ... 15
c- Quantification et Identification... 16
d- Analyses statistiques ... 17
5-
Bio-informatique ... 17
RESULTATS ET DISCUSSIONS ... 18
1-
Evolution du métabolome et du protéome au cours du gavage ... 18
2-
Recherche de marqueurs prédictifs de la fonte lipidique ... 22
CONCLUSION ET PERSPECTIVES ... 25
INTRODUCTION :
Le foie gras est l’un des produits phare de la cuisine française. Environ 75 à 80 % du foie gras mondial est produit en France (Comité Interprofessionnel des Palmipèdes à Foie Gras), les français sont aussi les premiers consommateurs de foie gras puisque 72 % prétendent en
consommer régulièrement. Cette production est représentée à 96% par du foie gras de canard,
le reste correspondant à du foie gras d’oie. Ce n’est pas surprenant donc de voir que ce produit est entré dans le patrimoine culturel et gastronomique français (Loi n° 2006-11 du 5 janvier
2006 d'orientation agricole ajoutée à l'article L654-27-1 au code rural français). Sa
composition, très riche en matières grasses, fait du foie gras un produit très déséquilibré sur le plan nutritionnel, mais cette particularité lui donne des qualités organoleptiques uniques. Ce produit présente donc des enjeux économiques forts. Sa valeur commerciale dépend du mode de transformation (foie gras entier ou bloc de foie gras). Pour pouvoir être transformé en foie gras entier (plus rentable), deux critères sont importants : l’apparence externe du foie lors du prélèvement (absence de défauts, de pétéchies,…), mais aussi le rendement technologique correspondant essentiellement à la capacité du foie à limiter l’exsudation lipidique. Ce second critère est réglementé par un décret gouvernemental qui fixe l’exsudation maximale à 30% de la proportion de graisse du produit fini lors de la cuisson (Décret n°93-999 du 9 août 1993
relatif aux préparations à base de foie gras). Contrôler ces critères est donc gage de haute
qualité. Pour obtenir du foie gras, un régime riche en glucides est distribué aux canards lors du gavage. Environ 75% du glucose entrant dans les hépatocytes est transformé en acides gras par la voie de la lipogenèse de novo alors que cette proportion tombe à 15% pour les adipocytes chez les mammifères 1.
Plusieurs études ont permis de définir des facteurs ante mortem (conditions d’élevage) péri et
post mortem (conditions d’abattage, d’éviscération et mode de transformation) permettant de
mieux contrôler les critères de qualité des foies gras à la fin du gavage. Le rendement technologique est notamment corrélé négativement au poids des foies 2,3, ainsi des foies plus lourds ont tendance à fondre plus. Cependant, dans la gamme de foies transformés en foie gras entier, le poids de foie n’explique que 14 % de la variabilité de la fonte lipidique 4; ainsi pour
des foies de poids identiques, il existe une variabilité de fonte de ces foies gras qui s’explique en partie par la composition biochimique et le métabolisme des foies 5,6.
Dans cette étude bibliographique, nous allons donc commencer par expliquer certains mécanismes mis en place lors de la stéatose hépatique puis montrer certains facteurs zootechniques importants qui ont permis d’améliorer la qualité du foie et enfin présenter les
résultats d’études faites en amont par des approches de lipidomique, protéomique et métabolomique en relation avec la qualité technologique du foie gras.
1- STEATOSE HEPATIQUE :
Le foie gras est le produit d’une stéatose hépatique due à une suralimentation des canards par gavage. On voit que cette capacité est naturelle et totalement réversible chez les palmipèdes 7,8. C’est même nécessaire chez les espèces de palmipèdes migratrices car c’est un lieu de stockage des réserves énergétiques sous forme de lipides avant la migration 9. Les éleveurs utilisent donc cette aptitude naturelle de certaines espèces pour produire du foie gras par gavage. La stéatose hépatique est un processus de stockage d’une grande quantité de gras au niveau du foie. Elle peut être ou pas de nature pathologique. Chez l’Homme, elle peut être de nature alcoolique due à une consommation excessive d’alcool. Elle peut être aussi de cause non alcoolique, due à une résistance à l’insuline, des substances toxiques ou à des maladies chroniques du foie, comme l'hépatite C 10. La conséquence majeure est un dysfonctionnement des fonctions hépatiques
engendré par des modifications dans le métabolisme lipidique hépatique. Par contre chez certaines espèces ou souches palmipèdes, c’est une réponse métabolique naturelle. Elle est le résultat d’une augmentation de la synthèse d’acides gras grâce au processus de lipogenèse de
novo à partir de précurseurs glucidiques issus de la dégradation de l’amidon contenu dans le
maïs (64 % du maïs est constitué de glucide 29).
De l’amidon au Glucose
Cet amidon va être transformé en maltose par les alpha-amylases du tube digestif puis en glucose par les maltases et transporté vers le foie grâce au système porte. Le glucose est ensuite soit stocké sous forme de glycogène (glycogénogenèse), soit utilisé pour la production d’énergie (glycolyse et cycle de Krebs).
Du Glucose aux Acides gras
En empruntant la seconde voie, le glucose est d’abord transformé en pyruvate (glycolyse). Ce dernier traverse la membrane mitochondriale puis est converti par la PDH (pyruvate déshydrogénase) en acétyl-CoA, précurseur du cycle de Krebs. C’est l’acétyl-CoA qui va pouvoir aussi alimenter la lipogenèse de novo. L’acétyl-CoA va être converti en citrate pour pouvoir franchir la membrane mitochondriale et se retrouver dans le cytosol avant d’être régénéré pour alimenter la lipogenèse de novo. L’acétyl-CoA est ensuite transformé en malonyl-CoA. Enfin grâce à l’action de la F.A.S (fatty acid synthase), on obtient du palmitate, le premier acide gras obtenu lors de la lipogenèse de novo. Enfin, grâce aux élongases et aux désaturases, on a la formation des autres acides gras à partir de l’acide palmitique et des acides
gras essentiels. Au final, pour obtenir des triglycérides, on a une estérification du glycérol avec ces acides gras au niveau du réticulum endoplasmique.
Régulation de la stéatose
Lors du gavage, le déséquilibre entre la néosynthèse des lipides et leur exportation entraîne une accumulation de lipides dans les hépatocytes, conduisant à une stéatose hépatique. Dans le cadre de la stéatose d’origine alimentaire, il y’a plusieurs facteurs de régulations. D’abord on a la suralimentation qui la stimule, raison pour laquelle, la diminution de la quantité de nourriture arrête la stéatose et les palmipèdes retrouvent en quelques jours leur état initial7, 8. Ensuite, il existe aussi un mécanisme d’exportation des triglycérides néoformés vers les tissus périphériques pour un stockage ou une production d’énergie. Ce processus est médié par les VLDL (Very Low Density Lipoprotein) 11. Ces transporteurs permettent la répartition du gras entre le foie et les tissus périphériques tels que les tissus abdominaux ou sous-cutanés. Enfin on a un retour d’une partie des triglycérides vers le foie via les HDL (High Density Lipoprotein).
Il existe aussi une régulation de la stéatose hépatique de façon hormonale grâce à l’insuline qui active l’acétyl-CoA carboxylase donc la lipogenèse 11,12.
2- OPTIMISATION DES FACTEURS
ZOOTECHNIQUES ET TECHNOLOGIQUES :
Des facteurs zootechniques ont une grande influence sur la qualité technologique du foie, c’est pourquoi plusieurs études ont été menées pour les optimiser. Le canard mulard issu du croisement interspécifique entre des mâles Cairina Moschata (canard de Barbarie) et des femelles Anas Platyrhynchos (canard de Pékin) est le plus utilisé car ayant la meilleure aptitude à la stéatose hépatique 13. Puis, l’âge de mise en gavage peut avoir une influence car si elle est trop précoce, on a une compétition entre l’anabolisme protéique du foie lors de la stéatose hépatique et la croissance musculaire des filets 14. Une alimentation soutenue dès le début
permet aussi d’améliorer la qualité du foie 5. La durée du jeûne avant l’abattage est importante
aussi car si elle est courte (< 8h), il y a un risque de contamination microbienne lors de l’éviscération due aux restes non digérés dans le système digestif et si elle dure trop longtemps
(> 24h), le poids du foie diminue 15 et le rendement technologique aussi. Pour notre projet, elle a été fixée aux alentours de 11 heures pour pallier ces deux problèmes. Après l’abattage, l’éviscération joue aussi un rôle sur la qualité des foies. En effet, des études ont montré que si elle se faisait à chaud, environ 20 minutes après l’abattage, on a un meilleur rendement que si elle était faite à froid c’est à dire après 24 heures de refroidissement de la carcasse 16,17. Chez le canard, il existe aussi une corrélation positive entre le poids de foie et le rendement
technologique à la cuisson 2,3 notamment au-delà de 600g. Ceci entraine une diminution du
rendement technologique lorsque le poids des foies augmente couplé à une plus grande
variabilité de ce paramètre. De même, le taux de lipides est corrélé avec la fonte à la cuisson18, sur une gamme de poids de foie. Donc plus le foie est riche en lipides, plus il est susceptible de fondre lors de la cuisson. Enfin, le mode de transformation influe aussi sur le taux de fonte car il a été démontré qu’une stérilisation entrainait une fonte plus élevée qu’une pasteurisation19.
La maîtrise de l’ensemble de ces facteurs ante, péri et post-mortem ne permet pas de contrôler totalement la fonte, il existe toujours une variabilité individuelle des foies. Ainsi des études biochimiques et post-génomiques des foies ont été menées pour mieux comprendre cette variabilité de fonte lors de la cuisson.
3- APPROCHES EN « OMIQUE » :
a- Lipidomique
Le foie gras comme son nom l’indique est composé d’une grande quantité de lipides. Donc, naturellement, les premières analyses ont été faites sur la fraction lipidique. Toutefois, l’étude de la composition en lipides de réserve (profil des acides gras, des lipides neutres en G.C et des triglycérides en H.P.L.C) n’a montré aucune influence de celle-ci sur la fonte lipidique 5,19. Une autre hypothèse, portant sur la fragilité de la membrane plasmique des hépatocytes qui entrainerait une fonte plus élevée, a été étudiée. Le ratio cholestérol/phospholipide, indice de fluidité des membranes, a été analysé, mais bien qu’une corrélation avec la fonte lipidique a été démontrée chez l’oie, elle n’a pas été vérifiée chez le canard 20.
b- Protéomique
L’analyse de la fraction protéique a permis aux chercheurs de pouvoir distinguer certaines familles de protéines qui pourraient expliquer cette différence de fonte lipidique. Certaines de ces protéines sont impliquées dans le métabolisme énergétique et la structure des hépatocytes. Ainsi, par des méthodes d’analyse par spectrométrie de masse, il a été observé au moment de l’abattage chez les foies avec une fonte élevée, des mécanismes de protection cellulaire. Cela se manifeste par l’expression de protéines de réponse à un stress cellulaire notamment oxydatif alors que chez les foies avec une fonte faible, il a été observé l’expression de protéines intervenant dans le métabolisme énergétique6. Enfin, la qualité technologique du foie gras a été
mise en relation avec la protéolyse hépatique30, 31. Ceci a permis de voir que contrairement à la stéatose hépatique d’origine pathologique qui augmente l’activité protéolytique, on observe une constance du catabolisme protéique hépatique lors de la stéatose d’origine alimentaire voire une diminution. Ceci est probablement dans le but de faciliter l’adaptation cellulaire due à
l’augmentation de l’activité anabolique (synthèse lipidique) causée par le gavage 21. Par contre,
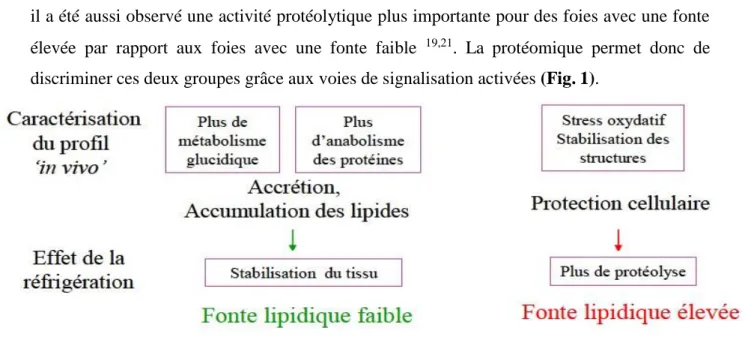
il a été aussi observé une activité protéolytique plus importante pour des foies avec une fonte élevée par rapport aux foies avec une fonte faible 19,21. La protéomique permet donc de discriminer ces deux groupes grâce aux voies de signalisation activées (Fig. 1).
Figure 1.
Proposition de mécanismes à l’origine de la variabilité de la fonte lipidique du foie gras de canard par des études en protéomique 19.c- Métabolomique
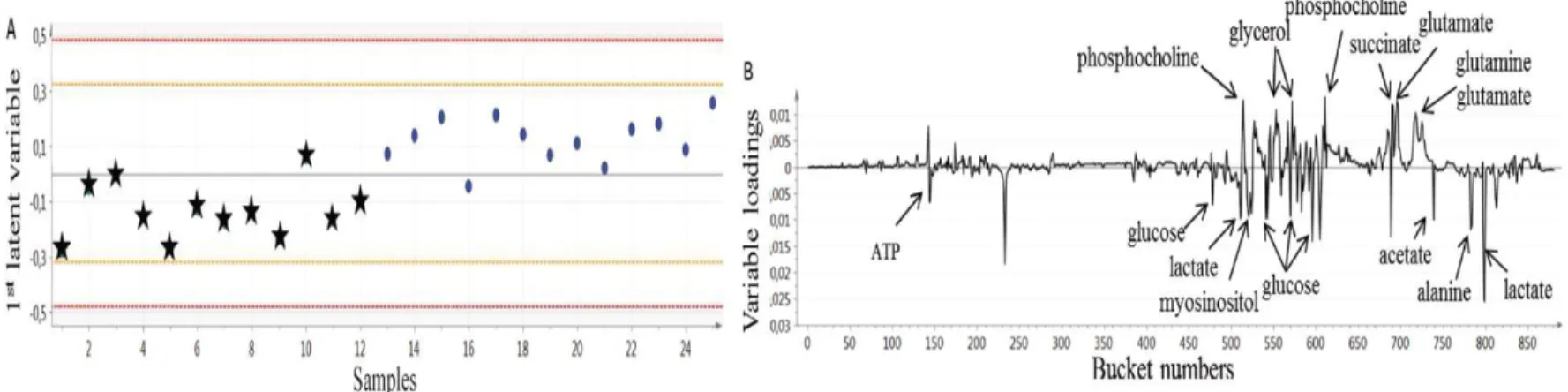
Les études en métabolomique, ont permis de confirmer beaucoup de résultats obtenus en protéomique sur des voies de signalisation permettant de distinguer les foies gras à fonte élevée de ceux à fonte faible grâce à des approches de RMN (résonance magnétique nucléaire) 1D et 2D23. Cette méthode a été choisie pour sa robustesse. La phase hydrophile a été analysée. Une liste de métabolites a été détectée par RMN 1D puis analysée par des outils statistiques comme ACP (Analyse de Composantes Principales) et par PLS-DA (Partial Least Squares – Discriminant Analysis) (Fig.2). La choline, la phosphocholine, le glycérophosphocholine, le succinate, le myo-inositol, le glycérol et le glutamate ou un composé de sa famille ont une concentration plus élevée dans les foies gras à fonte faible alors que des métabolites comme le glucose, le lactate, l’alanine, l’ATP, l’acétate et un acide aminé (la taurine ou la bétaïne) ont une concentration plus élevée dans les foies gras à fonte faible 23,24. Alors qu’il a été vu que
l’alanine est l’un des précurseurs de la néoglucogenèse 25 et que associé à une diminution du
glutamate, on a un profil de catabolisme des protéines dans le muscle de porc 26, ce résultat suggère donc une activité protéolytique plus importante chez les foies gras à fonte élevée 6,19. Une augmentation du succinate révèle aussi une augmentation du stress oxydatif lors de la stéatose des foies de souris 27. Enfin, la choline, la phosphocholine et la glycérophosphocholine
sont impliquées dans la synthèse des membranes donc aident à maintenir l’intégrité de ces membranes 24. En somme, les résultats obtenus avec les métabolites vont dans le sens des
résultats obtenus en protéomique et permettent donc de discriminer les foies gras à fonte faible des foies gras à fonte élevée.
Figure 2.
PLS-DA avec la 1ère variable latente. Score plot 2.A – Fonte faible (cercle) etFonte élevé (étoile). Loading plot annoté du modèle (2.B). R2Y = 0.681 et Q2 = 0.467 23
BUT DU STAGE :
Jusqu'à présent, les études réalisées se focalisaient sur des foies en fin du gavage. Pour cette étude, on va essayer de déterminer l’incidence de l’évolution du métabolisme hépatique au cours du gavage sur la fonte lipidique. Le but est de voir s’il y a des marqueurs précoces qui peuvent être révélés et qui pourront nous renseigner sur le rendement technologique du foie gras lors de la cuisson. Pour cela, après avoir élevé des canards pendant douze semaines, une cinétique d’abattage au cours du gavage est réalisée, avec un abattage tous les deux jours de J0, date d’entrée en gavage jusqu’à J12, date de la fin du gavage. Par ailleurs, le gavage a été réalisé suivant deux modalités : témoin (objectif 600g de foie gras) et intensif (objectif 800g de foie gras). Après l’abattage et l’éviscération à chaud des foies, des échantillons de foie ont été prélevés et conservés à -80°C. Sur ces échantillons, une extraction avec de l’eau, du méthanol et du dichlorométhane sera réalisée et la phase supérieure polaire sera analysée par RMN22. Une extraction des protéines sera réalisée aussi, et par une approche de shot-gun, les peptides seront analysés par spectrométrie de masse 6,19. Après une analyse des résultats par des méthodes statistiques, nous donnerons un sens biologique aux résultats et essaierons de déterminer à quel moment s’installe les différences au niveau du métabolisme hépatique qui sont responsables des variations de la fonte lipidique des foies à la cuisson. Une interprétation globale sera réalisée avec une confrontation des données (métabolomique et protéomique) avec les performances zootechniques enregistrées sur l’ensemble de la période d’élevage et les données de fonte à la cuisson pour ainsi déterminer ce qui entraine la variabilité de la qualité technologique du foie gras au moment de la cuisson.
MATERIEL ET METHODES :
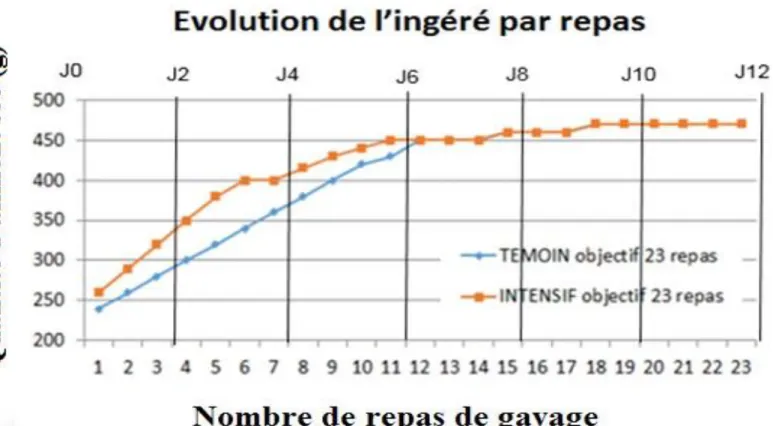
1- Protocole d’élevage, de gavage et de prélèvement des foies :
210 canards ont été élevés pendant 12 semaines. Ils ont ensuite été divisés en deux groupes et ont été gavés pendant 12 jours suivant deux courbes de gavage différentes. Le premier groupe a été gavé suivant la courbe de gavage témoin et le second groupe a suivi la courbe de gavage plus intensive avec une augmentation plus rapide des quantités d’aliments distribuées suivi d’un pallier (Figure 3). Comme l’évolution du métabolisme veut être observée, une cinétique d’abattage au cours du gavage est réalisée. Tous les deux jours, 15 canards de chaque groupe sont abattus soit 30 canards par date à l’exception de J0 (date d’entrée en gavage) où seulement 15 canards ont été abattus. Après chaque abattage, le foie est prélevé et l’échantillon est plongé dans un bain d’azote liquide à -180°C.
2- Choix des échantillons :
En métabolomique, 111 échantillons ont été analysés soit les 15 échantillons de J0 et 16 pour les six autres dates (dont 8 témoins et 8 intensifs). Lorsque le poids de foie dépasse 300g, le foie est transformé, donc son rendement technologie est déterminé, ce qui est le cas pour les foies des canards abattus de J6 à J12. Pour ces groupes donc, les échantillons ont été choisis de façon à créer deux groupes pour chaque date avec des rendements élevés ou des rendements faibles. Dans la mesure du possible, la variabilité du poids de foie a été conservée aussi au niveau de ces deux groupes. Lorsque le rendement technologique n’a pas été déterminé (de J0 à J4), les échantillons pour la métabolomique ont été sélectionnés de façon à conserver la variabilité du poids de foie à chaque date.
En protéomique, 84 échantillons parmi les 111 échantillons choisis en métabolomique ont été analysés. Pour J0, 10 échantillons ont été choisis, de façon à conserver la variabilité du poids de foie. Pour les autres dates, 6 échantillons ont été choisis par groupe (jour d’abattage et courbe de gavage) soit 12 par date plus 2 échantillons considérés comme extrêmes (l’un à J2 et l’autre à J8). Les 6 échantillons ont été sélectionnés parmi les 8 en métabolomique de façon à garder un plan expérimental équilibré (3 échantillons avec un rendement élevé et 3 avec un rendement faible) et à conserver la variabilité de poids de foie. Les deux échantillons extrêmes ont été conservés car ils peuvent apporter des informations intéressantes pour comprendre comment des foies ont pu avoir un poids aussi élevé à ces étapes du gavage.
Cette sélection permet d’avoir un plan équilibré entre les dates d’abattage, les modalités de gavage et les bons et moins bons rendements.
3- Métabolomique :
a- Extraction des métabolites polaires :
D’abord, chaque échantillon est mis dans une cellule de broyage inox et est plongé une à deux minutes dans un bain d’azote liquide pour mettre sa température à -180°C. Il s’en suit un broyage avec un broyeur à bille pendant 30 secondes. Si tout est en poudre et homogène, le contenu est versé dans des pots en plastique stériles. Enfin les pots sont conservés au congélateur à -80°C.
Un protocole modifié de la méthode de Beckonert22 est utilisé pour l’extraction. Les solvants (Eau, méthanol, dichlorométhane) sont d’abord placés dans la glace ou au frigo à 4°C au moins une heure avant de commencer l’extraction. Un prélèvement de 250 mg de foie broyé par pot est effectué puis 1 ml de méthanol est rajouté pour « quencher » le métabolisme. Ensuite 0,213 ml d’eau est rajouté. Le tout est homogénéisé au Fast-Prep à 6 mouvements/seconde pendant 40 secondes ce qui permet de libérer le contenu cytoplasmique. Les tubes sont vortexés pendant 10 secondes. 0,5 ml de dichlorométhane sont rajouté puis le tube est vortexé pendant 5 secondes puis cette étape est répétée. 0,5 ml d’eau sont rajouté et le tube est encore vortexé pendant 10 secondes puis est laissé pour décanter pendant 15 minutes dans la glace. Ensuite, une centrifugation à 1000 g à 4°C pendant 15 minutes est réalisée. Un prélèvement de 1,3 ml dans la phase supérieure contenant les métabolites polaires est opéré puis le contenu est versé dans un autre tube de polypropylène. Les tubes sont évaporés à sec au « speed-vac » pendant environ 3 heures.
Enfin, l’échantillon est repris dans 650 µl de tampon RMN (pH 7) composé de 2,885 g de Na2HPO4, 0,595 g de KH2PO4 anhydre et 17,2 g de TMSP dans 100 ml de D2O. Le tube est
vortexé puis centrifugé pendant 15 minutes à 5350 g. Enfin, 600 µl du surnageant est prélevé et mis dans un tube RMN de 5 mm.
b- Analyses par R.M.N (Résonance Magnétique Nucléaire) :
Les analyses RMN sont réalisées sur la plateforme RMN de MétaToul-AXIOM. Elle est équipée d’un appareil RMN Bruker Avance III HD opérant à la fréquence de résonance du proton à 600 MHz. L’appareil dispose d’un passeur automatique SampleJet.. Deux séquences d’impulsion sont testées : C.P.M.G (pour atténuer les signaux des protéines) 22 et NOESYPR1D
et finalement c’est cette dernière qui a été choisi car donnant les meilleurs spectres avec une bonne résolution en atténuant le mieux le signal de l’eau. Les paramètres (Time Domain : 32k, dummy scan : 16, nombre de scan : 512, gain : 114, o1p (porteuse de l’eau) : 4,669 ppm, p1 (pulse à 90°) : 12,62 µs) sont réglés et l’acquisition est lancée. Après la transformée de Fourier,
les spectres sont phasés, la ligne de base est corrigée, et les déplacements chimiques sont calibrés par rapport au signal du T.M.S.P (0 ppm). L’étape suivante consiste à l’identification des métabolites. Pour cela, deux méthodes sont utilisées. La première consiste à faire une superposition de nos spectres avec un spectre de composé de référence enregistré dans le même tampon. Elle a permis de trouver la grande majorité des métabolites présents dans notre échantillon. Pour le reste des pics non identifiés, les banques de données (HMBD, BMRDB) sont utilisées. La présence d’un métabolite n’est validée que si tous les pics correspondant à ses protons sont retrouvés dans le spectre. La dernière étape est le bucketting ou découpage spectrale et intégration des buckets. Elle va permettre de réduire les données en découpant le spectre en segments (buckets). Ainsi, le spectre passe de 32000 points à 853 buckets. Une étape de normalisation est faite par rapport à l’aire totale sous le spectre pour s’affranchir de la prise d’essai. Un découpage avec des pas fixes de 0,01 ppm est réalisé. La taille des bornes est de 9,5 à 0,6 ppm et les zones d’exclusion sont le signal de l’eau (5-4,7 ppm), du dichlorométhane (5,5- 5,44 ppm) et du méthanol (3,38-3,34 ppm). Pour finir, le jeu de données est converti en un tableau à 2 entrées (matrice X : Ligne Xi : échantillons ; Colonne Xj : variables (Buckets) ; intersection des deux Xij : intensité j pour l’échantillon i)
c- Analyses statistiques :
Avant chaque traitement, une standardisation du jeu de données peut être effectuée. Cette étape va permettre la comparabilité des variables car les valeurs des buckets n’ont pas le même ordre de grandeur donc certains auront une grande influence (métabolites naturellement très présents) sans être très important pour discriminer nos échantillons. Les deux méthodes que l’on va appliquer sont :
La standardisation centrée : On soustrait la moyenne à chacune des valeurs.
La standardisation Pareto : On soustrait la moyenne à chacune des valeurs ensuite on le divise par la racine carrée de l’écart-type.
Pour le traitement statistique de nos données, le logiciel SIMCA13.0.2 est utilisé. Des analyses multivariées comme l’ACP (Analyse de Composantes Principales) et la PLS-DA (Régression linéaire des moindres carrés partiels – Analyse discriminante) sont réalisées.
L'ACP est méthode descriptive qui fournit les outils pour visualiser et résumer l’information contenu dans la matrice et de comprendre la structure des données. Elle consiste à réduire nos variables en associant les variables corrélées en composantes principales indépendantes. Elle va essayer de classer les individus en groupes homogènes, sans rajout d’information d’appartenance à un groupe (analyse multivariée non supervisée). Quand l’information d’appartenance à un groupe (variable réponse Y) est utilisée dans le modèle, une analyse
multivariée supervisée comme la PLS-DA va permettre de discriminer les échantillons. Si la variabilité biologique est trop importante et masque les différences liées au facteur d’intérêt, la méthode OSC (Orthogonal Signal Correlation) peut être appliquée. Cette étape va permettre d’éliminer la variabilité contenue dans la matrice X qui n’explique pas Y (variabilité expérimentale, instrumentale, …). Pour valider un modèle PLS, deux critères utilisés :
Q2cum : c’est la capacité prédictive cumulée du modèle. Elle doit être supérieure à 0,4.
Test de permutation : une randomisation des classes est faite. La valeur des buckets est fixée et les échantillons sont changés de groupe pour voir si cela va conduire à des modèles de classification mauvais, incapable de distinguer les groupes. Cette étape est répétée 200 fois. Si l’ordonnée à l’origine de la droite de régression qui passe par le nuage de point est inférieure à 0 et que les modèles très permutés ont un Q2 inférieurs à
0,4 alors le modèle est valide.
Si un modèle est valide, les VIP (Variable Importance in the Projection) sont extraites Un bucket n’est important que si son VIP est supérieur à 0,8. Un test de Kruskal-Wallis sous R est réalisé pour tester si ces buckets sont significativement différents entre les groupes. Enfin, l’identification des métabolites correspondants à ces buckets significatifs est réalisée.
Une autre technique d’analyses statistiques a été utilisée : l’A-SCA. Elle combine les avantages de l’ANOVA (Analyse Of Variances) et la SCA (Analyses en Composantes Simultanées). L’ANOVA va déterminer la variabilité des données selon les différents facteurs du plan expérimental (temps, Rythme alimentaire et interaction entre les 2). Ensuite, une ACP est effectuée pour déterminer les buckets importants pour séparer les échantillons selon le ou les facteurs choisis. Un seuil arbitraire est choisi pour sélectionner les buckets (loading absolue > 0.01). Une fois cette 1ère sélection faite, le test de Kruskal Wallis est réalisé pour déterminer les
buckets significativement différents entre au moins deux mesures différentes, parmi les buckets dont le loading était supérieur au seuil. Pour tous les buckets significativement différents, les comparaisons 2 à 2 sont effectuées pour savoir quelles sont les paires qui sont effectivement différents.
4- Protéomique :
a- Extraction des protéines :
Afin d’éviter toute dégradation des protéines, les échantillons seront maintenus à 4°C ou dans la glace. 1,2 ml de tampon d’extraction Urée/Thiourée/CHAPS (à forte force ionique) sont rajoutés à 300 mg de foie broyé puis le tout est homogénéisé au Retsch pendant 1h. Ensuite, une centrifugation pendant 10 minutes à 10 000 g à 4°C est effectuée. Le « fat-cake » c'est-à-
dire la couche de gras sur la phase supérieure du tube, est enlevé. La centrifugation est répétée dans les mêmes conditions et le surnageant est prélevé puis on l’aliquote dans 3 tubes.
Dosage par la méthode de Bradford
L’un des 3 tubes va permettre de doser la quantité de protéine totale par la méthode de Bradford. La courbe (droite) de la concentration en BSA (bovine serum albumine) de 1,5 g.L-1 à 0,125g.L-
1 va servir de gamme étalon. Après avoir calculé la concentration en protéine totale dans chaque
échantillons, les 2 tubes restants vont permettre de prélever 75 µg de protéine dans chaque échantillon pour les mettre dans un volume final de 20 µl (Echantillon dans tampon d’extraction / Tampon de Laemmli 4X 3 : 1) pour les déposer sur un gel SDS-PAGE.
Electrophorèse sur gel de polyacrylamide en présence de dodécylsulfate de sodium (SDS- PAGE)
Cette étape va permettre de concentrer les protéines. La migration est stoppée juste après l’entrée au niveau du gel de séparation (ce qui correspond au moment où la bande de protéines est la plus fine). Les bandes sont découpées à l’aide d’un scalpel stérile. Ensuite, une étape de réduction des ponts disulfures est réalisée grâce au DTT puis une alkylation par l’iodoacétamide est faite pour empêcher ces ponts de se reformer. Cette étape va permettre d’empêcher les protéines de se replier, ce qui va faciliter leur digestion par la trypsine. Les bandes sont ensuite décolorées et déshydratées grâce à des incubations successives dans des tampons Bicarbonate d’Ammonium 25mM/ Acétonitrile de concentration croissante en acétonitrile (5%, 50%, 100%). Elles sont ensuite passées au Speed-vac afin d’éliminer l’acétonitrile résiduel et de compléter la déshydratation du gel. Puis les bandes sont conservées à -20°C jusqu’à ce qu’elles soient expédiées à la plateforme d’Exploration du Métabolisme à l’INRA de Clermont-Ferrand / Theix pour la digestion à la trypsine et l’analyse en spectrométrie de masse (Q-TOF).
Traitement des échantillons
Le jour de l’analyse, les bandes ont été décongelées et hydrolysées à la trypsine (Promega) durant la nuit avec 600 ng d’enzyme par bande, soit 60 µl d’une solution à 10 ng/µl. L’extraction des peptides a été réalisée sous ultrasons (15 min) avec 50 µL d’acétonitrile puis les hydrolysats ont été transférés dans des flacons HPLC et mis au speed-vac 60 minutes. Les extraits peptidiques ont ensuite été repris par 25 µl d’une solution aqueuse (99, 9% H2O, 0,1% TFA).
b- Analyse LC-MS/MS
D’abord, 6,5 µL d’hydrolysat sont injectés dans la chaine nano HPLC (Ultimate 3000, Dionex) sur une colonne de concentration permettant de retenir les peptides et d’éliminer les contaminants qui pourraient être perturbateurs dans l’analyse par spectrométrie de masse. Ensuite, après 6 min, une vanne permet de mettre cette colonne de concentration en ligne avec
une colonne analytique nano-débit fonctionnant à 0.4 µl/min. Les peptides vont alors être séparés selon leur hydrophobicité (colonne C18, longueur 25 cm, diamètre 75 µm), grâce à un gradient d’une solution d’acétonitrile (99.5% ACN, 0.5% Acide Formique) de 0 à 35% en 90 min.
La nano-HPLC est couplée via une source nano-CaptiveSpray (BRUKER) à un appareil de masse de type QTOF (QTOF, IMPACTII, Bruker). Les molécules qui sortent de la source sont en phase gazeuse, chargées (ions) et sont séparées en fonction de leur masse/charge. Cet appareil va permettre de caractériser et d’identifier les peptides. L’appareil fonctionne en mode CID, chaque analyse MS est succédée par un maximum d’analyses MS/MS durant 3 secondes.
c- Quantification et Identification
Les runs ont été ensuite analysés dans le moteur de recherche Mascot (V. 2.5, en version licence en interne) permettant à la fois la quantification en « label-free » (par un comptage du nombre de fragments (MS/MS) de tous les ions parents et leur identification après un export de la liste des ions quantifiés.
Ce moteur de recherche spécifique permet de faire le lien entre les spectres acquis durant l’ensemble de l’analyse et les protéines présentes dans la banque de données utilisée. Dans le cadre de notre analyse, la banque interrogée a été ref_Anas (extraite d’Uniprot) (16,378 séquences, 05/2016).
Paramètres de recherche :
Type de recherche : MS/MS Ion search Enzyme : Trypsine
Modification fixe : Carbamidomethylation (Cys)
Modifications labiles : Oxydation (Met) ; Déamydation (Asn, Gln) Valeur des masses : Isotopique
Tolérance de masse du peptide : ± 20 ppm Tolérance de masse fragment : ± 0,1 Da Maximum de clivage manqué : 2
Instrument : ESI-QUAD-TOF Paramètres de validation
La validation d’un peptide a été acceptée quand son score permettait d’avoir moins de 1% de faux positif. Dans le cas de cette analyse, le score Mascot peptidique validable était > 35, équivalent à une expect value > à 0.01035. Ensuite, si un peptide identifié est commun à plusieurs protéines, il est éliminé (conflit de réglage). Enfin, on ne considère pour le moment, dans nos analyses, que les protéines identifiées avec au moins deux peptides spécifiques.
d- Analyses statistiques :
Une analyse ANOVA est effectuée pour voir les protéines significativement différentes entre les différentes modalités (Cinétique ou Rendement). Une ACP est aussi effectuée pour voir la représentation des échantillons selon les composantes principales formées à partir des protéines significativement différentes entre ces modalités.
5- Bio-informatique :
Elle va nous aider à donner un sens biologique aux résultats. KEGG (Kyoto Encyclopedia of Genes and Genomes) et MetExplore vont être utilisés en métabolomique pour voir les différentes voies métaboliques associées à nos métabolites discriminants entre les différentes analyses. Pour la partie protéomique, l’annotation fonctionnelle des protéines significatives ainsi que l’exploration des liens entre elles se feront grâce à IPA (Ingenuity Pathway Analysis).
RESULTATS ET DISCUSSIONS:
1- Identification des buckets
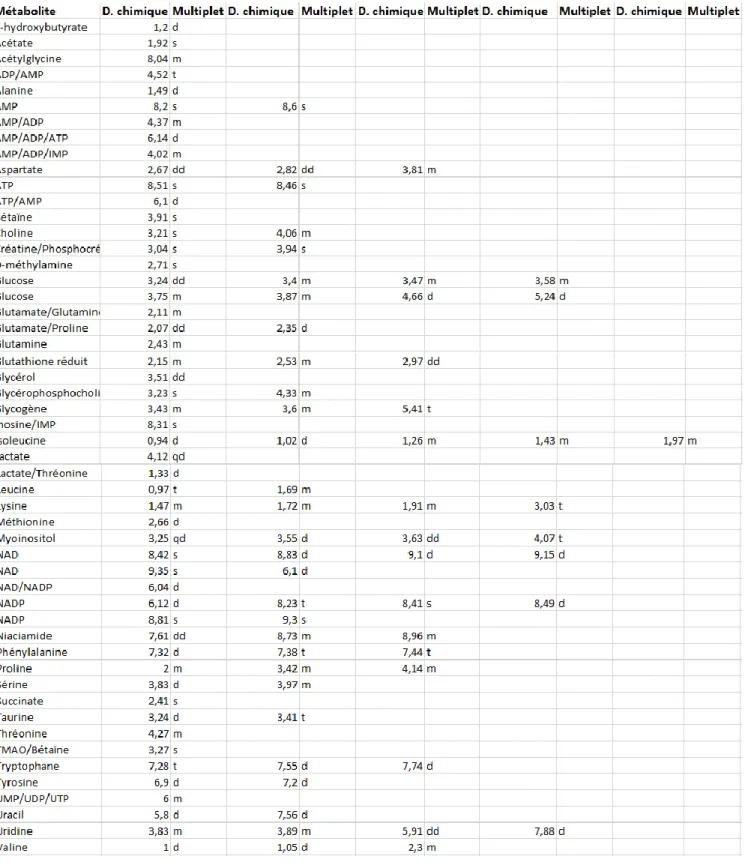
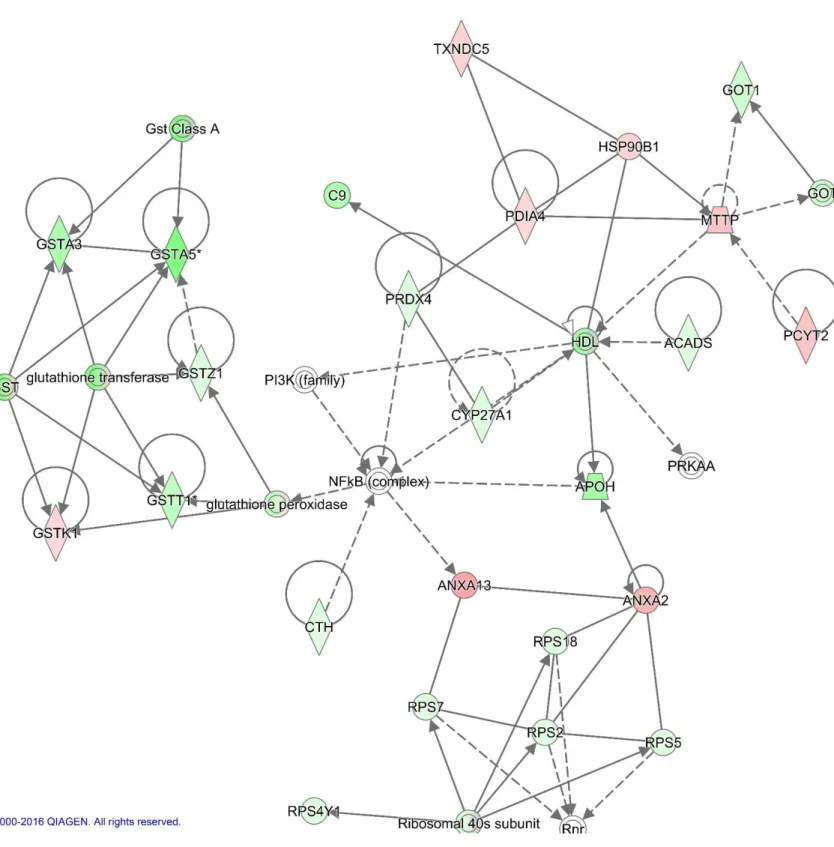
Grâce à l’utilisation des spectres témoins et des banques de données, une cinquantaine de metabolites a été identifiée (Figure 4). On y retrouve ainsi des metabolites issus de l’alimentation stockés dans le foie comme le glucose (alimentation riche en amidon), ceux liés à l’utilisation de cet excès de glucose via la glycogénogenèse (le glycogène), la glycolyse et le cycle de krebs (le lactate et succinate) et la lipogénèse de novo (glycerol, glyérophosphocholine) … Enfin, on y retrouve aussi beaucoup d’acides amines comme le glutamate, la glutamine, l’alanine, la serine,…On retrouve dans cette liste de metabolites, des cofacteurs comme le NAD, NADP, la famille des nucleotides phosphates (ATP, ADP, AMP, UMP, UDP, UTP, IMP). D’autres molécules ont été identifiées aussi comme le glutathione réduit, myoinositol, créatine, betaine, TMAO, taurine, …
2- Evolution du métabolome et du protéome au cours du
gavage:
Pour l’analyse de l’évolution du métabolome au cours du gavage, une A-SCA a été utilisée. Le traitement statistique est appliqué sur les 853 buckets obtenus après le découpage du spectre. Au début, une première analyse ANOVA avec tous les facteurs du plan expérimental Jour, Rythme alimentaire (R.A) et leur interaction (Y = µ0 + Jour + R.A + Jour x R.A + ε) a été
effectuée. Elle a démontré que seul le facteur Jour était significatif (p_value < 0.001). Donc un autre modèle ne prenant en compte que ce facteur (Y = µ0 + Jour + ε) a été appliqué. L’ANOVA
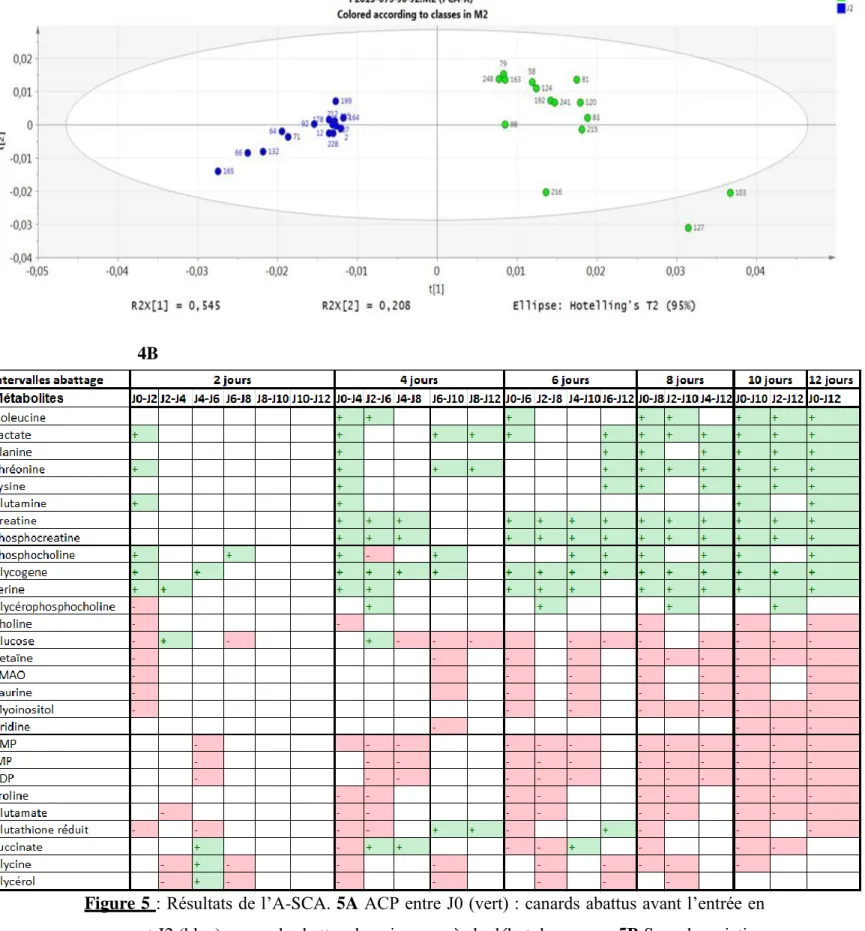
a montré 112 buckets significativement différents entre les différentes dates (p_value < 0.05). La seconde étape est l’application d’une ACP entre deux dates successives pour représenter les données. Sur la Figure 5A, les données à J0 et J2 sont projetées. Il y a une bonne séparation entre les 2 groupes. Un test de Kruskall-wallis a été fait pour déterminer les buckets significativement discriminants. Cette étape est répétée pour les échantillons avec des dates d’abattage successives (séparés de 2 jours), séparés de 4 jours, 6 jours, 8 jours, 10 jours, 12 jours. Pour interpréter les résultats, seuls les buckets représentant un unique métabolite ont été utilisés pour s’assurer de leur identification. Ce tableau complet est représenté dans la Figure
5.
Une augmentation du glycogène durant les premiers jours a été observée. Ceci montre une glycogénogenèse active qui est la première voie de stockage de l’excès de glucose hépatique généré par une alimentation riche en amidon. Une diminution du glucose au-delà du Jour 4 a été observée aussi en relation avec l’activation de la lipogenèse.
4A
4B
Figure 5 : Résultats de l’A-SCA. 5A ACP entre J0 (vert) : canards abattus avant l’entrée en
gavage et J2 (bleu) : canards abattus deux jours après le début du gavage. 5B Sens de variation des métabolites entre 2 dates d’abattage. Vert : augmente entre la première et la deuxième date ;
glycérophosphocholine, qui sont impliqués dans la synthèse des membranes 23,24.
Il y a aussi beaucoup d’acides aminés qui évoluent au cours du temps et beaucoup d’entre eux stimulent la synthèse de protéines 36 impliquées dans le maintien des triglycérides dans le foie, la synthèse des lipides 37 et l’inhibition des mécanismes de dégradation cellulaire (Annexe 4).
Ainsi, avec une meilleure compréhension du rôle de la quantité des acides aminés, une alimentation riche en certains acides aminés pourrait favoriser une amélioration de la qualité technologique et diminuer la variabilité. Entre J0 et J12, une diminution du glutathion réduit a été remarquée. Il est impliqué dans la réponse au stress oxydatif 35 en contrôlant la quantité d’espèces oxygénées activées donc au maintien de l’homéostasie cellulaire. Ce résultat va dans le même sens que ce qui a été observé chez l’homme car le niveau de stress oxydatif est supérieur chez un humain obèse 36 que chez un humain sain (Annexe 5).
Pour la partie protéomique, 963 protéines ont pu être identifiées et quantifiées grâce aux peptides. A partir d’une ACP, les échantillons « outliers » ont été retirés de l’analyse. Au final, seulement 72 échantillons participent au design de l’étude et donc à la quantification des protéines. Le fait de retirer les runs extrêmes permet de centrer les points de l’ACP (Annexe
6). Seulement 25% de la variabilité des données sont expliquées par les deux premières
composantes principales. Pour les animaux non gavés (J0), la variabilité intra groupe est plus. Au cours du gavage, cette variabilité diminue, montrant l’effet prépondérant du gavage sur la variabilité individuelle.
En ne prenant en compte que les protéines identifiées avec au moins 2 peptides spécifiques, le nombre de protéines analysées passe de 963 à 599. Les analyses suivantes ne porteront que sur ces 599 protéines.
Le même plan expérimental qu’en métabolomique est appliqué c'est-à-dire l’analyse commence par une ANOVA selon le facteur Jour, Rythme alimentaire et l’interaction entre les deux. Comme lors de l’analyse en métabolomique, seul le facteur Jour est significatif. Une autre ANOVA selon le facteur jour est réalisée et 312 protéines ont été déterminées comme significativement différentes entre les dates avec une p-value < 0.01 (Annexe 7).
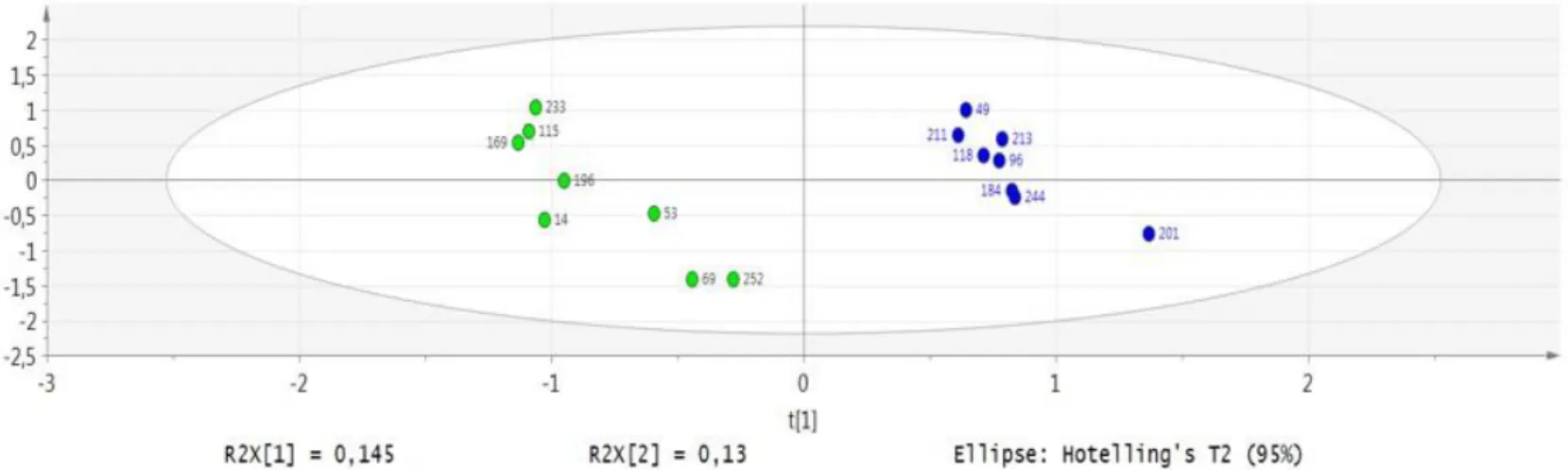
Le logiciel IPA n’utilisant que des identifiants de protéines humaines, de rats et de souris, des BLAST sont d’abord réalisés contre la banque Swiss-Prot pour avoir les identifiants de nos protéines de canard analogues chez l’humain, le rat ou la souris. Au cours de mon stage, l’étude s’est focalisé sur des échantillons entre J0 et J12 c'est-à-dire de faire la comparaison entre le début et la fin de gavage. Grâce à IPA, on observe une augmentation des protéines associées au métabolisme des acides gras mais aussi à leur accumulation. Une augmentation des protéines impliquées dans la formation du cytosquelette et de celles impliquées dans la réponse au stress
oxydatif a été aussi constatée. On constate aussi une plus grande prépondérance des protéines impliquées dans la mort cellulaire (Exemple en Figure 6).
Ces résultats suggèrent donc que le gavage constitue une grande période de stress pour les hépatocytes. La voie de réponse au stress oxydatif est très active. La glycogénèse qui est la première voie activée pour diminuer la quantité de glucose durant les premiers jours est vite relayée par la voie de lipogenèse de novo ce qui entraine une grande augmentation de la quantité de lipides dans la cellule. Afin d’accumuler des lipides, une plus grande synthèse de lipides membranaires et de protéines du cytosquelette est initiée. Ceci n’est pas sans risque car une quantité de cellule ne pouvant pas maintenir cette activité de stress vont entrer en apoptose. Les résultats obtenus en protéomique vont dans le même sens de ce qui a été observé en métabolomique.
Figure 6 : Réseau de protéines impliquées dans la déplétion du glutathion dans le foie entre J0
et J12. On peut y observer aussi des protéines impliquées dans l’apoptose (Annexines, HSP, …) ou dans le transport des lipides (MTTP, HDL...) Vert = augmente entre J0 et J12. Rouge= diminue entre J0 et J12.
3- Recherche de marqueurs prédictifs de la fonte lipidique
Le second objectif consiste à rechercher des marqueurs prédictifs de la fonte lipidique à travers l’analyse du métabolome et du protéome.
Pour les foies de plus de 300g, le rendement technologique à la cuisson a été déterminé. A chaque date d’abattage, les échantillons ont été séparés en deux groupes avec des rendements extrêmes : faibles ou élevés. Pour chacune des dates de J6 à J10, aucun modèle PLS-DA n’a permis de séparer ces deux groupes. Ceci est dû à la faible variabilité des rendements (Moyenne: 93,6 % ; Ecart-type : 6,37) car quel que soit leur groupe (rendement faible ou élevé), tous ces échantillons ont globalement un rendement très élevé.
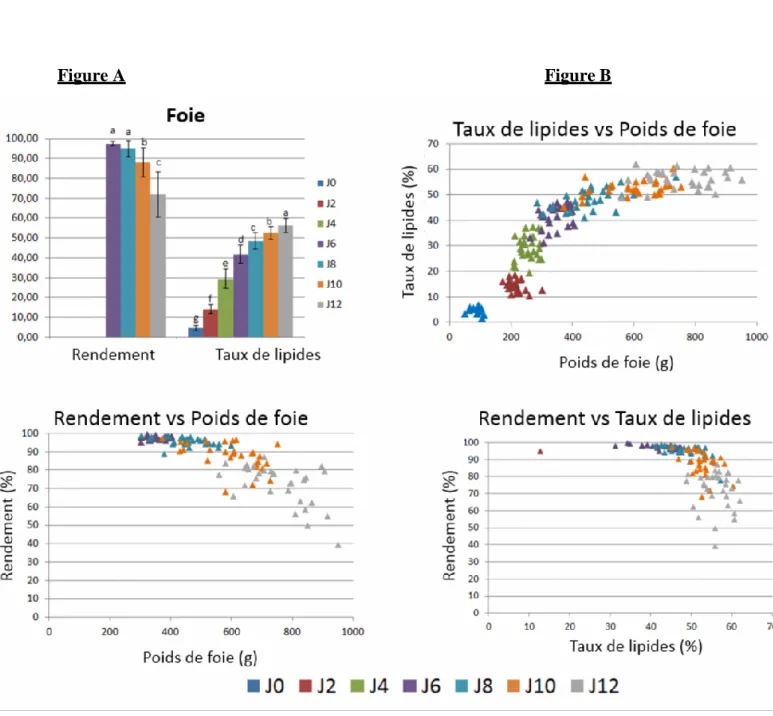
Par contre, à J12, pour des foies gras de 500 à 900g, les rendements s’étalent de 49% à 87% (Moyenne : 72,06 % ; Ecart-type : 11,38). Cette grande variabilité du rendement a permis de définir deux groupes d’animaux avec des rendements supérieurs ou inférieurs à 70% (Figure
8). Une PLS-DA entre ces 2 groupes a été réalisée. Un modèle valide permet la séparation des
échantillons en fonction de la variable réponse rendement (Q2cum = 0,821) (Figure 7). Un test
de Kruskall-Wallis est appliqué sur les buckets qui forment les variables latentes et a montré que ceux avec une p_value fdr (corrigée pour les tests multiples) < 0.05 avaient des déplacements chimiques de 4,135 ; 4,125 ; 4,115 ; 4,095 ; 1,335 et 1,325 ppm. Ils correspondent aux deux pics du lactate. Ainsi la concentration de lactate semble plus élevée chez les foies avec un rendement faible que chez les foies avec un rendement élevé (Figure 8). Ce résultat est en cours de validation par un dosage biochimique. La différenciation entre ces deux groupes de foies est un processus qui semble se faire qu’en fin de gavage et le lactate en serait l’un des acteurs majeurs. L’accumulation du lactate est le résultat soit d’une production excessive, soit d’une élimination insuffisante, soit d’une association des deux. Cette hyperlactatémie est un signe de métabolisme anaérobie 38, d’insuffisance hépatique voire d’une anomalie métabolique. La quantité de lactate hépatique peut donc être considérée comme un marqueur prédictif du rendement technologique. La méthode utilisée permettant de ne mesurer que les métabolites les plus majoritaires, une autre méthode ou un appareil RMN plus sensible pourrait aider dans le futur à trouver d’autres marqueurs.
En protéomique, on retrouve une plus grande synthèse des protéines liées à l’anabolisme des acides gras chez les foies avec un rendement élevé ce qui confirme les résultats de Théron et al
6. Les protéines impliquées dans l’angiogenèse sont de quantité plus importante aussi chez les
d’oxygène pour maintenir un métabolisme aérobie. On a aussi une augmentation de 20 % de la quantité de pyruvate déshydrogénase entre les foies avec un rendement élevée et les foies avec un rendement faible donc la voie de décarboxylation du lactate en Acétyl-CoA semble plus active. L’effort intense dû au gavage peut entrainer un manque d’oxygène au niveau des muscle donc une accumulation du lactate qui va aller vers le foie pour une activation du cycle de Cori. Ces deux voies semblent traduire une plus grande accumulation du lactate chez les foies avec un rendement faible ce qui va dans le même sens des résultats de la métabolomique avec une plus grande concentration de lactate chez les foies avec un rendement faible. Lors du gavage, le poids de foie évolue de 50 jusqu’à plus de 500 g ce qui représente un moment de stress intense pour les foies. Les foies avec un rendement élevé donc sont plus apte à maintenir une homéostasie malgré le gavage.
Figure 6 : PLS-DA avec deux variables latentes des échantillons de foie à J12 avec des
rendements technologiques extrêmes. Rendement faible (vert) et Rendement élevé (bleu) ; R2Xcum = 0.451 ; R2Ycum = 0.993 ; Q2cum = 0.821
Figure 8 : Choix des échantillons à J12. Rendement faible (entouré en vert), Rendement
élevé (entouré en bleu). Lactate – (quantité de lactate faible) ; Lactate + (quantité de lactate élevée)
CONCLUSION ET PERSPECTIVES :
Cette étude avait pour objectif d’étudier l’évolution du métabolisme du foie au cours du gavage ainsi que l’influence de ce métabolisme sur le rendement technologique des foies à la cuisson. Pour l’étude de la cinétique de gavage, les premiers résultats obtenus grâce à l’analyse des métabolites polaires sont prometteurs. Ils ont permis de confirmer certains mécanismes au niveau hépatique impliqués dans le développement de la stéatose au cours du gavage qui avaient été mis en évidence auparavant. Au niveau de l’évolution du protéome aussi, ils ont pu être confirmés. Cependant, les résultats présentés ici doivent être approfondis car en protéomique seuls les principaux changements entre le début et la fin de gavage ont été étudiés. Alors que de nombreux changements sont mis en place au niveau de la cellule entre ces deux dates, leurs exploitations vont permettre de mieux comprendre la variabilité du rendement observé à J12. Ce projet a permis aussi l’identification d’un marqueur hépatique de la fonte lipidique à savoir le lactate. Sa concentration plus importante chez les foies avec un rendement faible nous donne quelques pistes de plus pour la compréhension de la différence entre les foies avec un rendement faible et ceux avec un rendement élevé. La suite sera de déterminer ce seuil qui permet de différencier ces deux types de foies par une mesure de la quantité de lactate dans les foies par des méthodes biochimiques (en cours). Il serait aussi intéressant de mesurer le lactate dans le plasma et d’étudier sa corrélation avec le rendement technologique des foies. Ceci permettrait d’avoir un marqueur prédictif du rendement des foies à la cuisson avant l’abattage des animaux. Ceci pourrait donner lieu à des tests rapides pour classer les canards en fonction de ceux qui donneront un foie dirigé vers la transformation de foie gras entier à haute valeur ajoutée ou vers une voie moins valorisante.
Un stage de M2 (Rim B. H. YAHIA) a été effectué en parallèle dans le laboratoire sur la mise en relation entre l’apoptose et le rendement technologique par des analyses histochimiques et des dosages de caspases. Les résultats de ce travail pourront être agrégés au travail présenté ici. Une intégration de l’ensemble des données en métabolomique et protéomique avec les performances zootechniques (ex : poids de foie, poids des magrets) et les caractéristiques biochimiques des foies (ex : taux de lipides, taux de glucose) et les phénomènes apoptotiques pourraient apporter la grande majorité des informations nécessaires pour comprendre la variabilité du rendement technologique. Dans un futur proche, des appareils plus performants permettront aussi d’augmenter la sensibilité surtout en métabolomique pour pouvoir distinguer plus finement la différence entre nos métabolites et ainsi améliorer l’interprétation biologique des résultats.
BIBLIOGRAPHIE:
1. Evans A. J. 1972. «In vitro lipogenesis in the liver and adipose tissues of the female
Aylesbury duck at different ages ». British Poultry Science 13 (6) (novembre): 595-602. 2. Blum, J. C., Labie, C., Raynaud, P. 1990. Influence du poids et de la composition
chimique du foie gras d’oie sur la fonte mesurée après stérilisation à 104°C. Science des Aliments. 10 : 543-554.
3. Poujardieu, B., Guichard, F., Laventure, P. 1994. Paramètres génétiques de
croissance et de gavage de la cane commune. Genetics Selection Evolution. 26 : 468- 472.
4. Theron, L., Cullere, M., Bouillier-Oudot, M., Manse, H., Dalle Zotte, A., Molette, C., Fernandez, X., Vitezica, Z. G. 2012. Modeling the relationships between quality
and biochemical composition of fatty liver in mule ducks. J. Anim. Sci. 90, 3312–3317. 5. Baudonnet, C. 1993. Facteurs de variation de la composition biochimique et de la
qualité technologique des foies gras de canards. Thèse de Doctorat, Institut National Polytechnique de Toulouse.
6. Theron L, Fernandez X, Marty-Gasset N, Pichereaux C, Rossignol M, Chambon C, Viala D, Astruc T, Molette C. 2011. Identification by proteomic analysis of early
post-mortem markers involved in the variability in fat loss during cooking of mule duck "foie gras".
7. Babilé R., Auvergne A., Andrade V., Héraut F., Bénard G., et Bouillier-Oudot M. 1996. « Réversibilité de la stéatose hépatique chez le canard mulard ». In 2èmes
Journées de la Recherche sur les Palmipèdes à Foie Gras, 107-110. Bordeaux, France.
8. Babilé R., Auvergne A., Dubois J. P., Bénard G., et Manse H. 1998. « Réversibilité
de la stéatose hépatique chez l’oie ». In 3èmes Journées de la Recherche sur les
Palmipèdes à Foie Gras, 45-48. Bordeaux, France.
9. Bairlein F. 1987. The migratory strategy of the Garden Warbler: A survey of field and
laboratory data, Ringing & Migration, 8:2, 59-72, DOI:10.1080/03078698.1987.9673903.
10. Corey, K. E. & Cohen, D. E. 2000. Lipid and Lipoprotein Metabolism in Liver Disease.
Endotext (eds. De Groot, L. J. et al.) (MDText.com, Inc., 2000).
11. Goodridge, A.G. 1987. Dietary regulation of gene expression: enzymes involved in
carbohydrates and lipid metabolism. Annual Review of Nutrition. 7 : 157-185.
12. Han, C., Wang. J., Li, L., Zhang, Z., Wang, L., Pan, Z., .2009. The role of insulin
and glucose in goose primary hepatocyte triglyceride accumulation. J. Exp. Biol. 212, 1553–1558. DOI: 10.1242/jeb.022210
13. Baeza E., Rideau N., Chartrin P., Davail S., Hoo-Paris R., Mourot J., Guy G., Bernadet M.-D., Juin H., Meteau K., Hermier D. 2005 « Canards de Barbarie, Pékin
et leurs hybrides : aptitude à l’engraissement ». INRA Prod. Anim., 18(2), 131-141. 14. Auvergne, A. 1992. Facteurs de variation de la composition corporelle et tissulaire des
canards avant et après gavage. Thèse Docteur Etat, Institut National Polytechnique de Toulouse, 252p
15. Auvergne, A. 1993. Digestibilité du maïs en gavage. Eléments de prédiction du gain de
poids. In: 1ères Journées de la Recherche sur les Palmipèdes à Foie Gras. Bordeaux, France. 75-89
16. Bouillier-Oudot M., Leprettre S., Dubois J.P., Babilé R. 2004. Evolution de la
composition hépatique lors du refroidissement post-mortem de foies gras d'oies dans la carcasse. In: Actes des 6èmes Journées de la Recherche sur les Palmipèdes à Foie Gras (p. 203-206)
17. Castaing, J., Robin, N. 1990. Alimentation énergétique du canard mulard. Revue
d’Alimentation Animale. 440 : 22-25
18. Rousselot-Pailley, D., Guy, G., Gourichon, D., Sellier, N. & Blum, J. C. 1992.
Influence des conditions d’abattage et de réfrigération sur la qualité des foies gras d’oie. INRA Prod. Anim.5, 167–172.
19. Théron, L.2011. Déterminisme biologique de la variabilité de la fonte lipidique à la
cuisson du foie gras de canard. (Sciences Ecologiques, Vétérinaires, Agronomiques et Bioingénieries (SEVAB).
20. Cazeils, J. L., Bouillier-Oudot, M., Auvergne, A., Babilé, R. 1999. Influence de la
composition biochimique de la membrane plasmique des hépatocytes sur le rendement après stérilisation des foies gras d’oies. Revue de Médecine Vétérinaire. 150 (7) : 651- 654.
21. Awde, S. 2014. Relation entre proteolyse hepatique et qualites technologiques et
sensorielles du foie gras de canard. (Sciences Ecologiques, Vétérinaires, Agronomiques et Bioingénieries (SEVAB)).
22. Beckonert O., Nicholson J. K., et al. 2007. Metabolomic profiling, metabolomic and
metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Vol 2. N°11; doi:10.1038/nprot.2007.376
23. Bonnefont, C. M., Guerra A, Théron L, Molette C, Canlet C, Fernandez X. 2014.
Metabolomic study of fatty livers in ducks: Identification by 1H-NMR of metabolic markers associated with technological quality. Poult. Sci. 93, 1542–1552 (2014). 24. Bonnefont C., Guerra A., Théron L., Molette C., Canlet C., Fernandez X. 2013.
Approche métabolomique pour la recherche de marqueurs métaboliques de la qualité technologique de foie gras. « Dixièmes Journées de la Recherche Avicole et Palmipèdes à Foie Gras » Page 1–5.
25. Yamamoto, H., Aikawa, T., Matsutaka, H., Okuda, T. & Ishikawa, E. 1974.
Interorganal relationships of amino acid metabolism in fed rats. Am. J. Physiol. 226, 1428–1433.
26. Lopez-Bote, C. J., Toldrá, F., Daza, A., Ferrer, J. M., Menoyo, D., Silió, L., Rodríguez, M. C. 2008. Effect of exercise on skeletal muscle proteolytic enzyme
activity and meat quality characteristics in Iberian pigs. Meat Sci. 79, 71–76
27. Evans, Z. P., Mandavilli, B. S., Ellett, J. D., Rodwell, D., Fariss, M. W., Fiorini, R. N., Schnellmann, R. G., Schmidt, M. G., Chavin, K. 2009. Vitamin E Succinate
Enhances Steatotic Liver Energy Status and Prevents Oxidative Damage Following Ischemia/Reperfusion. Transplant. Proc. 41, 4094–4098.
28. Bax, M. L., Chambon C, Marty-Gasset N, Remignon H, Fernandez X, Molette C. 2012. Proteomic profile evolution during steatosis development in ducks. Poult. Sci. 91,
112–120.
29. Souci, S. W., Fachmann, W., Kraut, H. 2000. La composition des aliments. Tableau
des valeurs nutritives. 6ème édition, revue et complétée par Heimo Scherz und Friedrich Senser. Medpharm Scientific Publishers Stuttgart 2000.
30. Awde, S., Marty-Gasset, N., Wilkesman J., Rémignon H. 2013. Proteolytic activity
alterations resulting from force-feeding in Muscovy and Pekin ducks. Poult. Sci.
(2013) 92 (11): 2997-3002.
31. Awde, S., Marty-Gasset, N., Prahkarnkaeo K., Rémignon H. 2014. Relationship
between Proteolytic Activities and Cooking Loss Variability in Liver Issued from Force-Fed Mule Ducks. Journal of Agricultural and Food Chemistry
32. Comité Interprofessionnel des Palmipèdes à Foie Gras, année
33. Loi n° 2006-11 du 5 janvier 2006 d'orientation agricole ajoutée à l'article L654-27-1 au code rural français
34. Décret n°93-999 du 9 août 1993 relatif aux préparations à base de foie gras
35. Haleng J., Pincemail J., Defraigne J. J., Charlier C., Chapelle J. P. 2007. Le stress
oxidant. Rev Med Liege 2007; 62 : 10 : 628-638
36. Vincent H.K., Taylor A.G. 2005. Biomarkers and potential mechanisms of obesity-
induced oxidant stress in humans. International Journal of Obesity (2006)30,400–418. doi:10.1038/sj.ijo.0803177
36. Wullschleger S., Loewith R., Hall M. N. 2006. TOR signaling in growth and
metabolism.Cell. Volume 124, Issue 3, 10 February 2006, Pages 471–484. doi:10.1016/j.cell.2006.01.016.
37. Laplante M., Sabatini D. M., 2009. An emerging role of mTOR in lipid biosynthesis.
Curr Biol. 2009 December 1; 19(22): R1046–R1052. doi:10.1016/j.cub.2009.09.058. 38. James J. H., Luchette A. Fred., McCarter F.D., Fischer J. E. 1999. Lactate is an
unreliable indicator of tissue hypoxia in injury or sepsis. Lancet 1999 ; 354 : 505–08
39. Baeza E., Marie-Etancelin C., Davail S., Diot C. 2013. La stéatose hépatique chez
Annexe 2 : Evolution du rendement et du taux de lipides en fonction des dates d’abattage
(Figure A). Evolution du taux de lipides en fonction du poids de foie (Figure B). Evolution du rendement technologique en fonction du poids de foie (Figure C). Evolution du rendement technologique en fonction du taux de lipides (Figure D).
Figure A Figure B
Annexe 4 : Réseau de signalisation de mTOR composé de deux grandes voies. mTORC1,
sensible à la rapamycine, contrôle plusieurs voies qui permettent de déterminer la taille de la cellule. mTORC2, insensible à la rapamycine, contrôle le cytosquelette d’actine et détermine ainsi la forme de la cellule. mTORC1 et éventuellement mTORC2 réagissent avec des facteurs de croissance (insuline / IGF), le statut énergétique de la cellulaire, des nutriments (acides aminés), et le stress. mTORC1 (et probablement mTORC2) sont multimériques, bien qu'elles soient dessinée en tant que monomères. Les flèches représentent l'activation, tandis que les barres représentent l'inhibition 36.
Annexe 5: Influence des pro-oxydants et anti-oxydants dans l’obésité sur le stress oxydatif. (+
augmentation stress oxydatif ; - diminution du stress oxydatif ; LOOH : lipid hydroperoxides)
Annexe 6 : Analyse en composantes principales formées par toutes les protéines de
l’évolution des échantillons en fonction de la date d’abattage en enlevant les échantillons aberrants.
Annexe 7 : Diagramme de Venn du résultat obtenu par ANOVA. All au – 2 pept = Toutes les
protéines identifiées avec au moins 2 peptides spécifiques ; p < 0.01 = liste des protéines avec une p_value inférieur à 0.01 ; FC > 2 = protéines avec un fold-change > 2 ; FC < 2 = protéines