UNIVERSITE MOHAMMED V- SOUISSI FACULTE DE MEDECINE ET DE PHARMACIE -RABAT-
ANNEE : 2008 THESE N° : 95
Place de l’anti-CCP dans le diagnostic de
la Polyarthrite rhumatoïde
THESE
Présentée et soutenue publiquement le 05/12/2008
PAR
Mr. LAWAL Abdelaziz Olakédji
Né le 11 MAi 1981 à Bopa (Bénin)
Pour l'obtention du Doctorat en Pharmacie
MOTS CLES : Anti-CCP -Diagnostic - PR.
JURY
Mr. Y. CHERRAH PRESIDENT
Professeur de Pharmacologie
Mme. C. BENABDALLAH RAPPORTEUR
Professeur d’Hématologie
Mr. M. ADNAOUI
Professeur de Médecine interne
Mme. K. BENBOUAZZA JURY
Professeur de Rhumatologie
Mme. K. ESSAKALLI
Dédicaces
Je
dédie
cette thèse :
A l’éternel mon Créateur, mon Dieu
Pour tout ce qu’il a fait dans ma vie. Les mots ne pourront
jamais suffir pour remercier Dieu et lui montrer toute ma
gratitude.
A ma très chère maman
Que ce travail soit pour vous le fruit de la première semence. Et que
l’éternel Dieu des armés vous garde et vous accorde la longévité afin
que vous puissiez récolter les fruits des semences à venir. J’ai cherché
un peu partout minmin, j’ai creusé sous la terre, j’ai nagé sous
l’océan, j’ai volé dans l’air tout ça à la recherche de quelqu’un qui
pourrait juste, je dis bien juste ne serait ce qu’un petit peu vous
ressemblez, mais personne sur cette terre n’a été trouvé. Seulement
Dieu.
A toute ma famille
A mon grand frère Anastase pour tous ces bienfaits, pour toutes ses
nombreuses sacrifices que l’éternel notre Dieu vous bénisse, vous et
toute votre famille. Sisa, trouve ici le sentiment du travail accomplit
au souvenir de toutes tes punitions qui ont aujourd’hui porté leurs
fruits, que l’éternel que nous adorons tous te bénisse et te comble toi
et ton enfant de tous ses bienfaits. China, que Dieu te bénisse
également et te rends heureux et épanoui dans cette vie.
A tous mes amis
En l’occurrence, Sangaré, benjamin, bobo, Sardou, que Dieu vous
bénisse.
Spécial dédicace à toute la promotion
Nouhoum sangaré (Mali),Ndayirajigé benjamin (Burundie),
Taminou younoussa (Niger) Abdoulaye baye (Niger), Hadiza
(Niger), AG issa (Mali), Mac N’gor faye (Sénégal), Fouad
(Djiboutie), Tata Adama (Caméroun), gabrielle (Caméroune),
Maiga Djeneba (burkina-Faso), Ouedraogo Paulette
(Burkina-Faso), Ouedraogo samiratou (Burkina-(Burkina-Faso), Yara Sandrine
Remerciements
J’adresse mes sincères remerciements :
A notre Maître et Rapporteur de thèse
Madame C. Benabdellah
Professeur d’hématologie
Je suis très heureux de pouvoir vous exprimer ma reconnaissance et ma
profonde gratitude pour tous les efforts que vous avez déployés afin que ce
travail puisse aboutir. Vos précieux conseils ont grandement contribué à
l’élaboration de ce travail. Que Dieu vous bénisse.
A notre Maître et Président de thèse
Monsieur Y. Cherrah
Professeur de pharmacologie
Vous m’accordez un immense honneur en acceptant de présider le Jury de ma
soutenance de thèse
.Je vous en remercie. Je profite aussi de l’occasion pour
vous remercier d’avoir grandement contribué par votre enseignement de la
Pharmacologie, à l’épanouissement de mes collègues et moi. Veuillez agréer
A notre Maître et Juge de thèse,
Madame K. Benbouazza
Professeur de rhumatologie
Vous m’accordez un immense honneur en acceptant de siéger dans le Jury de
ma soutenance de thèse
.Je vous en remercie. Je profite aussi de l’occasion pour
vous remercier d’avoir accepté nous aider pour l’élaboration de ce travail.
Veuillez agréer mon plus profond respect et ma sincère reconnaissance.
A notre Maître et Juge de thèse,
Monsieur Adnaoui
Professeur de Médecine interne
Vous m’accordez un immense honneur en acceptant de siéger dans le Jury de
ma soutenance de thèse
.Je vous en remercie. Je profite aussi de l’occasion pour
vous remercier d’avoir grandement contribué par votre enseignement de la
sémiologie, à mon épanouissement. Veuillez agréer mon plus profond respect et
A notre Maître et Juge de thèse,
Madame Essakalli
Professeur d’immunologie
Vous m’accordez un immense honneur en acceptant de siéger dans le Jury de
ma soutenance de thèse
.Je vous en remercie. Je profite aussi de l’occasion pour
vous remercier d’avoir grandement contribué par votre enseignement
d’immunologie, à l’épanouissement de mes collègues et moi. Veuillez agréer
mon plus profond respect et ma sincère reconnaissance.
A Madame TAHIRI. Votre disponibilité et vos conseils m’ont été d’une
grande aide dans la réalisation de ce travail. Je ne trouve pas les mots pour
vous témoigner ma reconnaissance. Je demande à DIEU de vous bénir avec
toute votre famille. Merci.
A Monsieurs Benjamin N’dayiragijé, Taminou Younoussa et tout ceux qui
ont de près ou de loin contribué à l’élaboration de ce travail. Je vous remercie
pour tout que Dieu vous bénisse.
A Monsieur, le responsable de Masterlab pour avoir bien
voulu nous aider, en nous offrant les réactifs utilisés au cours de cette étude.
A Monsieur Nourredine et à toute l’équipe du laboratoire d’hématologie de
l’hôpital Cheikh Zayed. Je vous remercie très sincèrement de m’avoir accueilli
dans votre laboratoire. Veuillez agréer mon profond respect et ma sincère
reconnaissance.
A tous mes Frères et Sœurs MAROCAINS qui m’ont soutenu pendant
toutes ces années de formation au Maroc. Je vous remercie pour votre
hospitalité.
A toute la Communauté béninoise au Maroc. Je vous remercie tous pour votre
soutien.
A l’Ambassade du BENIN au Maroc. Je vous remercie tous pour votre
soutien.
A tous mes Frères et Sœurs ETRANGERS au Maroc. Je vous remercie
pour votre soutien pendant toutes ces années de formation au Maroc.
A l’Agence Marocaine de Coopération Internationale. Je vous remercie de
LISTE DES ABREVIATIONS
PR : Polyarthrite rhumatoïde FR : Facteur rhumatoïde
Anti-TNF-α: Anticorps du tumor necrosis factor α IL: Interleukin
Anti-CCP: Anticorps antipeptides cycliques citrullinés HLA: Human leukocyte antigen
CMH: Complexe majeur d’histocompatiblité MCP : Métacarpophalangienne
IPP : Interphalagienne MTP:Métatarsophalangienne
Ig (M,A, G) : Immunoglobine type M,A,G Fc: Fragment c des immunoglobines SGS: Syndrome de gougerot sjögren
Liste des figures
Figure 1: Diagramme sectoriel de la population selon le sexe. ...31
Figure 2 : Répartition de la population en fonction de la tranche d’âge ...32
Figure 3: Répartition de la population de PR selon la durée d’évolution de la maladie ...33
Figure 4: Sensibilité et spécificité du test de deuxième génération AxSYM Anti-CCP® et des tests de détection du FR ...37
Liste des Tableaux Tableau 1 : Tableau des résultats ...27
Tableau 2 : Répartition en fonction du sexe de la population de PR ...31
Tableau 3 : Répartition en fonction de la tranche d’âge ...32
Tableau 4: Répartition en fonction de la durée de la maladie ...33
Tableau 5: Comparaison des taux de positivité ou de négativité de l’Anti-CCP et du FR entre les patients et les témoins. ...34
Tableau 6: Comparaison des valeurs de l’Anti-CCP entre patients et témoins ...35
Tableau 7 : Tableau récapitulatif des résultats en termes de sensibilité, spécificité, VPP, VPN ...36
Tableau 8 : Comparaison des valeurs obtenues par rapport aux valeurs de la littérature ...38
Tableau 9 : Valeurs évaluées par rapport à des sujets témoins...41
Tableau 10 : Valeurs de l’Anti-CCP évaluées chez les patients atteints de PR évoluant depuis moins de 6 ans et depuis plus de 6mois. ...42
Tableau 11 : Anti-CCP et Pronostic de la PR débutante: Détérioration structurale……….52
Sommaire
Introduction générale ... 1
Chapitre I : Matériel et méthodes ... 6
I-POPULATION ETUDIEE ... 7
1-Patients ... 7
2-Témoins ... 7
II- METHODES D’ETUDE... 8
1.Recrutement ... 8 2. Echantillonnage et Conservation ...10 3. Analyses biologiques ...11 3.1- Paramètres dosées ... 11 3.2- Techniques de dosages ... 11 3.2.1-Dosage de l’anti-CCP ...11
3.2.1.1-Mode opératoire du dosage ...11
3.2.2-Dosage des facteurs rhumatoïdes (FR) ...13
3.2.2.1-Test au latex sur lame ...14
3.2.2.2-REACTION TYPE Waaler-Rose ...16
4. Analyse Statistique……….22
4.1-Rappels de quelques notions de biostatistique utilisés au cours de l'étude……….23
Chapitre II : Résultats et Discussion ...26
2 - DESCRIPTION DE LA POPULATION ETUDIEE ... 31
2.1-Caractéristiques épidémiologiques ...31
2.1.1-Sexe ...31
2.1.2-Age ………32
2.1.3- Durée de la pathologie (PR) ...33
3.1-Comparaison des pourcentages de présence ou d’absence des marqueurs entre les
patients et les témoins ... 34
3.2-Test de Mann-Whitney ...35
4-COMPARAISON DE LA SENSIBLITE, SPCECIFICITE, VALEUR PREDICTIVE POSITIVE ET VALEUR PREDICTIVE NEGATIVE DES DIFFERENTS MARQUEURS ... 36
4.1-Entre l’Anti-CCP et FR ...36
4.2-Comparaison des courbes ROC (Receiver Operator Characteristic.) des deux marqueurs……39
5-Etude des performances de l’Anti-CCP ... 40
Chapitre III : DISCUSSION ...43
1-Du point de vue épidémiologique ...44
1.1-Sexe ... 44
1.2- Age ... 44
2-Du point de vue biologique ... 45
3-Limites méthodologiques………..55 4-Perspectives………55 CONCLUSION GENERALE ...56 RESUME ...58 Références bibliographiques……….62 ANNEXES ………68
Introduction
La polyarthrite rhumatoïde (PR), chef de file des rhumatismes inflammatoires chroniques [1] est une maladie qui se caractérise par une atteinte inflammatoire à la fois systémique et articulaire et qui évolue par poussées successives. Autrefois appelée « Polyarthrite chronique évolutive », elle est classée parmi les maladies dites systémiques (en raison de l’existence de manifestions extra-articulaires) et les maladies auto-immunes (en raison de la présence d’auto-anticorps comme le facteur rhumatoïde). A terme, elle provoque une atteinte structurale du cartilage et de l’os sous jacent aboutissant finalement à la destruction articulaire [2]. La PR est une maladie invalidante, notamment dans les formes sévères, et qui peut également mettre en jeu le pronostic vital. Certes la PR cause une altération des capacités physiques, mais elle est aussi responsable de grandes pertes économiques tant pour le malade que pour son entourage et la société. Au Maroc, les pertes économiques sont estimées en moyenne à 510 DIRHAMS par mois rien que pour les coûts directs [3]. L’impact socioéconomique de la PR, requiert de plus en plus l’attention de l’ensemble des recherches et explique par la même occasion la tendance actuelle des études et travaux scientifiques menés à ce sujet.
Son expression clinique est polymorphe pouvant associer à n’importe quel stade des signes articulaires et des signes extra-articulaires (d’où l’appellation parfois de « maladie rhumatoïde») [4]. La PR est une maladie relativement fréquente puisque sa prévalence est estimée à 1% de la population générale ; en France elle est estimée entre 0,25 et 0,50% ; au Maroc, la prévalence est estimée à 1% de la population. Elle est 3 à 4 fois plus fréquente chez la femme que l’homme. Toutefois, lorsqu’elle débute tardivement (après 60 à 65 ans), le sex-ratio a
tendance à se rapprocher de 1. La PR débute le plus souvent entre 35 et 55 ans (périménopausique). Elle peut s’observer à tous les âges [4].
La PR est une maladie d’étiologie inconnue et comme beaucoup de maladies auto-immunes, c’est une affection polyfactorielle relevant de facteurs psychologiques, endocriniens, d’environnements (intervention d’antigènes dont la nature est inconnue), génétiques et immunologiques. Les facteurs génétiques de susceptibilité n’ont pas d’intérêt pour le diagnostic mais semblent être le marqueur de formes plus sévères.
Le diagnostic doit donc être aussi précoce que possible afin de mettre en œuvre le traitement. De récents travaux montrent que l’efficacité thérapeutique est d’autant meilleure que le traitement est institué tôt [5]. Au stade de début, où il n’existe aucune déformation, le diagnostic est difficile. IL repose avant tout sur les données de l’interrogatoire et de l’examen clinique. A ce stade, les examens complémentaires radiologiques ou même biologiques apportent rarement des éléments permettant d’affirmer sans réserve le diagnostic. En revanche, à la phase de début, il faut éliminer de nombreuses affections d’origine infectieuse, inflammatoire ou microcristalline.
Depuis quelques années, les progrès faits dans la connaissance de l’immunopathologie de la polyarthrite rhumatoïde et des facteurs pronostiques permettent de mieux fixer la stratégie thérapeutique [5]. En effet, il importe d’adapter le traitement proposé à la sévérité actuelle et éventuellement prévisible de la polyarthrite rhumatoïde, c’est dire l’importance des facteurs pronostiques cliniques, biologiques, radiologiques dont on peut disposer d’emblée. La prise en compte de ces facteurs est essentielle dans la mise en place d’une véritable
stratégie thérapeutique gérée, dans les formes sévères, par une équipe soignante pluridisciplinaire dans le cadre d’une prise en charge globale.
Le traitement de la PR est assez complexe et doit être institué très tôt au début de la pathologie. IL nécessite bien entendu une information détaillée du malade, une approche médico-psychologique particulièrement importante dans cette maladie chronique, des traitements médicamenteux généraux et locaux, une réadaptation fonctionnelle appropriée et parfois des traitements chirurgicaux.
L’éventail des possibilités thérapeutiques s’est considérablement élargi ces dernières années, avec l’arrivée non seulement des biothérapies (anti-TNFα, antagoniste du récepteur de l’IL-1, molécule CTLA-4 chimérique…) mais aussi de nouveaux immunosuppresseurs (comme le léflunomide) aux actions beaucoup plus ciblées et, en conséquence, aux effets indésirables bien mieux contrôlés. Le problème actuel n’est donc plus la prise en charge thérapeutique de la PR, mais un diagnostic précoce. Il n’est plus permis d’attendre l’apparition des érosions osseuses radiographiques (pourtant un des signes cardinaux de la PR) pour étiqueter la maladie et envisager un traitement. Les critères biologiques ont donc naturellement pris une place prépondérante pour aider le clinicien dans la mise en place diagnostique de la PR.
L’objectif de notre travail est donc, de définir la place des Anticorps antipeptides cycliques citrullinés (Anti-CCP) pour le diagnostic de la PR.
Pour ce faire, une étude comparative de spécificité et de sensibilité des marqueurs sérologiques s’avère indispensable.
I-POPULATION ETUDIEE
1-Patients
Il s’agit d’une étude prospective débutée au mois de mai 2008. La population étudiée était composée d’une cohorte de 40 patients hospitalisés ou suivis en consultation à l’hôpital de rhumatologie El Ayachi de Rabat-Salé pour PR (diagnostic retenu selon les critères de l’ACR 1987). Pour chacun de ces patients, des prélèvements veineux ont été réalisés sur place et directement envoyés au laboratoire d’hématologie de l’hôpital Cheikh Zayed de Rabat pour le dosage de l’Anti-CCP et du FR.
2-Témoins
Pour la comparaison de nos résultats, nous avons recruté une série de témoins. Les témoins peuvent être classés en deux groupes :
1- Groupe de 26 patients dont la symptomatologie présentée est variable mais généralement orientée vers des pathologies connues pour être fréquemment accompagnées de FR : affections rhumatismales (inflammatoires ou non), hématologiques ou infectieuses chroniques.
Dans le cadre des rhumatismes inflammatoires (n=11), on trouve six lupus, un SGS (syndrome de Gougerot Sjogren) primitif, une vascularite, une polymiosite, une connectivite mixte, une sclérodermie.
Parmi les affections non rhumatismales (n=15), certaines sont connues pour être volontiers accompagnées de facteurs rhumatoïdes. Ce sont essentiellement les infections telles que la tuberculose et l’hépatite C, mais aussi le diabète, la
goutte, la thyroïdite, la fibrose pulmonaire, l’insuffisance rénale, l’hypercholestérolémie encéphalopathie et enfin la coronaropathie.
2- Groupe de sujets sains ou normaux (n=14).
Le groupe de sujets sains est constitué essentiellement de techniciens du laboratoire d’hématologie de l’hôpital Cheikh zayed, mais aussi d’étudiants.
II- METHODES D’ETUDE
II.1-Recrutement
Patients
Le recrutement des patients atteints de la PR a été réalisé après étude de leurs dossiers médicaux. Ceci est réalisé à l’aide d’une fiche dite de renseignements cliniques établie à cet effet. (Fiche de renseignements cliniques ci-dessous).
ETUDE COMPARATIVE DE LA SPECIFICITE ET DE LA SENSIBILITE DES FACTEURS RHUMATOIDES ET DES ACCP POUR LE DIAGNOSTIC DE LA PR AU SEIN DE LA POPULATION MAROCAINE
FICHE DE RECUEIL DES DONNEES CLINIQUES
Nom et prénom du patient :………Dossier N° :………. A-CARACTERISTIQUES SOCIO-DEMOGRAPHIQUES DU PATIENT :
Sexe Homme Femme Age : B-CARACTERISTIQUES DE LA PR :
- Date de début de la maladie :
- Raideur matinale > 30mns : oui non - Arthrite touchant au moins 3 articulations oui non
- Arthrite touchant les poignets ou les métacarpophalangiennes (MCP) et les interphalangiennes proximales (IPP) des mains - Atteinte symétrique : oui non
C- BILAN BIOLOGIQUE : - Anti-CCP : U/ml - FR : * Latex : UI/ml *Walérose : UI/ml -VS………....mm/1hr -Protéine C réactive………..mg/l D-BILAN D’IMAGERIE :
-Destruction articulaire : oui non E-AUTRES DONNEES CLINIQUES :
- Manifestations extra-articulaires oui non si oui, préciser : -NAG (nombre d’articulations gonflées)/ 28 articulations :………..
-NAD (nombre d’articulations douloureuses)/ 28 articulations :………….. -DAS 28 :……….. …………
Témoins
La cohorte de sujets témoins comportant des sujets atteints d’une maladie autre que la PR, et des sujets sains. Pour les premiers, il est important de souligner que leur recrutement a été fait sur la base de l’étude de leurs dossiers médicaux. Par contre, les sujets sains ont été recrutés sur la base de l’interrogatoire.
II.2-Echantillonnage et Conservation
Patients
Les prélèvements des sujets atteints de la PR ont été réalisés à l’hôpital de rhumatologie EL AYACHI de Rabat Salé. Aussitôt prélevés, ils ont été convoyés au laboratoire d’hématologie de l’hôpital Cheikh Zayed. Au laboratoire, ces prises de sang veineux recueillis sur tube sec ont été centrifugées à 3000 tours par minute pendant 10 minutes. Par la suite et après réalisation des dosages, les sérums ont été aliquotés, puis conservés à -20°C pour un éventuel contrôle.
Témoins
Les prélèvements des témoins ont été réalisés sur place au laboratoire d’hématologie de l’hôpital Cheick Zayed. Ils ont ensuite été traités et les sérums ont été congelés selon le même protocole.
3- Analyses biologiques 3.1- Paramètres dosées
Compte tenu de l’objectif de notre étude, nous nous sommes intéressés aux dosages de l’anti-CCP et des FR. Le dosage de l’anti-CCP est de type immuno-enzymatique micro-particulaire (MEIA), réalisé sur l’autoanalyseur AxSYM. Celui des FR, est basé sur des réactions d’agglutination et est réalisé manuellement via l’usage de deux tests à savoir, le test au Latex et le test de Waaler-Rose.
3.2- Techniques de dosages 3.2.1-Dosage de l’anti-CCP
Le test employé pour la recherche des anticorps antipeptides cycliques citrullinés est la trousse commercialisée AxSYM Anti-CCP® de la société Axis-Shield Diagnostics Ltd et distribué par Abbott Laboratories. Il repose sur la technologie immuno-enzymatique microparticulaire (MEIA). La trousse est étalonnée à l’aide d’un pool de plasmas humains positifs pour les anti-CCP. Etant donné qu’il n’existe pas d’étalon international pour exprimer les titres en anti-CCP, les résultats du dosage sont exprimés en unités arbitraires. La gamme d’étalonnage va de 0 à 200 unités/ml. Le cut-off est fixé à 5U/ml.
3.2.1.1-Mode opératoire du dosage
Unité d’échantillonnage
L’échantillon et tous les réactifs AxSYM Anti-CCP nécessaires pour un dosage sont pipetés par l’aiguille d’échantillonnage dans les différents puits de la cartouche de réaction (CR).
Le diluant AxSYM et l’échantillon sont pipetés dans le puits d’incubation de la CR.
Le diluant échantillon AxSYM Anti-CCP et l’échantillon dilué sont pipetés dans le puits-échantillon de la CR.
Le bloqueur de matrice AxSYM Anti-CCP est pipeté dans le puits-tampon de la CR.
Le conjugué d’anticorps anti-IgG humaines (souris) AxSYM Anti-CCP : phosphatase alcaline est pipetée dans le puits- réactifs 3 de la CR.
Le diluant AxSYM et les microparticules diluées recouvertes de CCP sont pipetés dans le puits- réactifs 2 de la CR.
Un mélange réactionnel se forme lors de la mise en présence de l’échantillon dilué et des microparticules diluées recouvertes de CCP dans le puits-réactifs 1 de la CR.
Si l’anticorps anti-CCP est présent dans l’échantillon, il se lie aux microparticules recouvertes de CCP pour former des complexes antigène-anticorps sur les microparticules.
La CR est immédiatement transférée dans l’unité de traitement, où le pipetage continue à l’aide de l’aiguille de traitement
Unité de traitement
Une partie aliquote du bloqueur de matrice est transférée sur la matrice. Une partie aliquote du mélange réactionnel contenant des complexes
antigènes-anticorps liés aux microparticules est transférée sur la matrice. Les microparticules se lient irréversiblement à la matrice en fibres de verre.
Le conjugué d’anticorps anti-IgG humaines (souris) AxSYM anti-CCP : phosphatase alcaline est distribué sur la matrice et se lie aux complexes antigènes-anticorps.
La matrice est lavée afin d’éliminer le conjugué non lié aux microparticules. Le substrat, du phosphate de méthyl-4-ombelliféryl, est ajouté sur la matrice.
Le conjugué marqué à la phosphatase alcaline catalyse la séparation d’un groupement phosphate du substrat, conduisant à l’obtention d’un produit fluorescent, le méthyl-4-ombelliférone. Ce dernier est mesuré par le système optique MEIA. Les résultats sont obtenus à l’aide de la courbe de calibration.
3.2.2-Dosage des facteurs rhumatoïdes (FR)
La recherche des facteurs rhumatoïdes repose sur l’utilisation conjointe d’une technique d’agglutination de billes de latex sensibilisées par des immunoglobulines humaines (Rhumalatex® de Fumouze) et d’une technique d’hémagglutination d’hématies sensibilisées par des IgG animales (Polyart-test® et Polyartitre® de Fumouze).
Il est indispensable de souligner ici que seuls les FR de types IgM ont fait l’objet de notre étude. Les isotypes IgA, IgG, IgD, IgE n’ont pas été traités.
3.2.2.1-Test au latex sur lame
Principe : Est basé sur les propriétés agglutinantes spécifiques du Facteur
Rhumatoïde qui réagit avec les particules de latex sensibilisées par des gammaglobulines humaines.
La présence du FR sérique entraîne l’apparition d’une agglutination massive, visible à l’œil nu, des particules de latex. En l’absence de Facteur Rhumatoïde, on n’observe aucune agglutination.
La manipulation est simple et rapide. Les résultats sont obtenus en 2 minutes. Mode opératoire :
Avant toute utilisation des réactifs et sérums à analyser, il est impératif de veiller à ce que leur température revienne à la température ambiante.
Technique qualitative
Dans un premier temps, on procède à une dilution au 1/21 du sérum à analyser en distribuant et en mélangeant 50µl de sérum et 1ml de tampon de glycocolle. Puis, à l’aide d’une micropipette, on dépose 50µl du sérum dilué sur une des cases de la lame.
Ensuite, on agite soigneusement le réactif latex et on en dépose une goutte à l’aide du compte-gouttes fourni dans le coffret.
Après, on mélange les deux gouttes à l’aide d’un agitateur à usage unique.
Enfin, on applique un lent mouvement de rotation, pendant deux minutes, et on observe la présence ou l’absence d’agglutination.
Technique semi-quantitative
En cas de résultat positif sur sérum dilué au 1/21, il est possible d’évaluer le taux de FR en testant des dilutions croissantes du sérum à analyser en tampon glycocolle, jusqu’à obtention d’une réaction négative.
Préparations de dilutions croissantes
Tube 1 50µL
d’échantillon
1mL de tampon glycocolle Dilution1/21
Tube 2 0,5mL du Tube 1 0,5mL de tampon glycocolle Dilution1/42 Tube 3 0,5mL du Tube 2 0,5mL de tampon glycocolle Dilution1/84 Tube 4 0,5ml du Tube 3 0,5mL de tampon glycocolle Dilution1/168.
Après cette préparation de dilutions croissantes, on effectue un test sur lame avec chaque dilution en suivant le protocole décrit au paragraphe « Technique Qualitative ».
Interprétation des résultats
Réaction positive : agglutination visible à l’œil nu avec éclaircissement du
milieu : présence du FR
Réaction négative : pas d’agglutination : absence du FR.
Remarque : Le titre est donné par la plus haute dilution donnant une
agglutination nette, visible à l’œil nu. Le titre en UI/mL est égal à l’inverse de cette dilution limite multiplié par le seuil de sensibilité du réactif indiqué sur le coffret. Le seuil de sensibilité du réactif utilisé est de 1UI/mL ; par conséquent si
un sérum est positif jusqu’à la dilution 1/84, le titre de ce sérum sera alors de 84X 1= 84 UI/mL.
3.2.2.2-REACTION TYPE Waaler-Rose
Test d’hémagglutination sur lame pour la détection du FR sérique
(POLYARTEST FUMOUZE®)
But du test : Il s’agit d’un test d’hémagglutination sur lame permettant la
détection rapide du FR de type IgM présent dans la plupart des sérums de malades atteints de PR.
Principe : Le principe est basé sur les propriétés hémagglutinantes spécifiques
du FR, utilisées dans les réactions type Waaler-Rose.
Le réactif révélateur est constitué d’hématies de mouton sensibilisées par une fraction de gamma-globulines d’un sérum de lapin anti-hématies de mouton. Le réactif témoin, constitué d’une suspension d’hématies de mouton non sensibilisées, assure la spécificité de la réaction et permet d’éliminer les interférences dues aux agglutinines naturelles anti-mouton (hétéroanticorps de Forssman, anticorps de la mononucléose infectieuse et autres macroglobulines). En France, une variante de ce test utilise des hématies humaines O Rhésus négatif sensibilisées par un sérum de lapin antiglobules rouges humaines O Rhésus négatif [6].
Mode opératoire :
a. On laisse les réactifs et les sérums à analyser revenir à température ambiante avant utilisation.
b. A l’aide d’une micropipette, on dépose 50µL du sérum à analyser sur les cases « T » et « R ».
c. Ensuite, on agite soigneusement les suspensions d’hématies.
d. Puis on dépose une goutte de réactif témoin sur la case « T » et une goutte de réactif révélateur sur la case « R » (flacons distributeurs).
e. Enfin, sur chaque case, on mélange les deux gouttes (sérum+ réactif) à l’aide d’un agitateur à usage unique.
Interprétation des résultats : CASE « T » CASE «R » INTERPRETATION _ _ REACTIONN NEGATIVE ABSENCE de Facteur Rhumatoïde.
_ +
REACTION POSITIVE
PRESENCE de Facteur Rhumatoïde.
+ _ REACTION NEGATIVE
PRESENCE d’agglutinines naturelles anti-mouton.
+ +/_
+ +
Dans la grande majorité des cas, REACTION NEGATIVE due à des agglutinines naturelles anti-mouton. Pour s’en assurer, on effectue un nouvel examen en diluant le sérum au ¼.
Légende : + : Présence d’hémagglutination visible à l’œil nu avec
éclaircissement du milieu.
- : Absence d’hémagglutination.
En cas de réaction positive, autrement dit en cas de présence de FR, on passe à la détermination quantitative du FR sérique par test d’hémagglutination indirecte.
Détermination quantitative du FR sérique par hémagglutination
indirecte (POLYARTITRE FUMOUZE®) But du test :
C’est la détermination du titre ou du taux des FR sériques de type IgM par hémagglutination indirecte à l’aide de POLYARTITRE FUMOUZE®.
Principe :
POLYARTITRE FUMOUZE® est basé sur les propriétés hémagglutinantes
spécifiques du FR, utilisées dans les réactions type Waaler-Rose. Le réactif révélateur est constitué d’hématies de mouton sensibilisées par une fraction de gammaglobulines d’un sérum de lapin anti-hématies de mouton.
La présence de FR sérique entraîne une hémagglutination du réactif révélateur qui se traduit par un voile rouge/ marron tapissant la cupule. En l’absence du FR, ces hématies sédimentent au fond de la cupule sous forme d’un bouton punctiforme.
Le réactif témoin, constitué d’une suspension d’hématies de mouton non sensibilisées, assure la spécificité anticorps de la mononucléose infectieuse et autres macroglobulines).
La réaction s’effectue en microplaque à fond en V.
La manipulation est simple et rapide. Les résultats sont obtenus en 2 heures.
Mode opératoire :
Toujours laisser, les réactifs et sérums revenir à température ambiante avant manipulation.
1. Préparation d’une dilution mère du sérum à analyser (1/20)
50µL de sérum à analyser ; 950µL de tampon phosphate.
2. Réalisation du test sur microplaque
a. A l’aide d’une micropipette multicanaux, on distribue 50µL de tampon
phosphate dans 12 cupules de la microplaque.
b. On mélange avec le tampon et on reporte, de préférence à l’aide d’une
micropipette, 50µL de la 1ère cupule dans la 2ème dans la 3ème, et ainsi de suite jusqu’à la 10ème
cupule, en rejetant 50µL de la 10ème cupule. On obtient les dilutions suivantes :
N° cupule 1ème cupule 2ème cupule 3ème cupule 4ème cupule 5ème cupule Dilution 1/40 1/80 1/160 1/320 1/640 N° cupule 6ème cupule 7ème cupule 8ème cupule 9ème cupule 10ème cupule Dilution 1/1280 1/2560 1/5120 1/10240 1/20480
c. Puis, on distribue 50µL de la solution mère du sérum dans la 11ème cupule. On mélange avec le tampon et on rejète 50µL.
Cette dilution (1/40) constitue le témoin sérum, dont le rôle est de détecter les agglutinines naturelles anti-mouton que peuvent contenir certains sérums.
d. On agite soigneusement les suspensions d’hématies.
Dépôt d’une goutte de réactif révélateur dans les 10 premières cupules.
Dépôt d’une goutte de réactif témoin dans la 11ème
cupule (témoin sérum).
Dépôt d’une goutte de réactif révélateur dans la 12ème
cupule (témoin réactif) dont le rôle est de contrôler la validité du tampon et du réactif révélateur.
Remarque : on ne réalise qu’un seul témoin réactif par série de tests. e. Très soigneusement, on homogénéise manuellement le contenu des cupules
par tapotements latéraux sur les cotés de la microplaque, posée à plat. Puis on laissera la plaque immobile, à l’abri de toute vibration.
f. En fin, la réaction est lue deux heures plus tard.
3-Interprétation des résultats :
Remarque : Le titre est donné par la dernière dilution présentant une
hémagglutination.
Le titre en UI/mL est égal à l’inverse de cette dilution limite multiplié par le seuil de sensibilité du réactif indiqué sur le coffret.
Absence d’hémagglutination
Présence d’un bouton punctiforme au fond de
la cupule
REACTION NEGATIVE
Absence du FR
Présence d’hémagglutination
Présence d’un voile rouge/ marron tapissant la cupule
REACTION POSITIVE
II.4- ANALYSE STATISTIQUE
Afin de bien mener notre étude, nous avons adopté une démarche en plusieurs étapes :
Nous avons commencé par une étude descriptive de la population à étudier.
Puis nous avons déterminé le pourcentage des marqueurs respectivement par rapport aux malades atteints de PR et par rapport aux témoins.
Ensuite nous avons étudié la comparaison de la moyenne des différents marqueurs sérologiques (Anti-CCP et FR) entre patients et témoins.
Par la suite, à fin de déterminer les performances des tests, on a comparé les deux marqueurs (Anti-CCP et FR) en termes de sensibilité, spécificité, valeur prédictive positive (VPP), valeur prédictive négative (VPN) et les courbes ROC respectives.
Pour l’évaluation des données, nous avons utilisé l’analyse de la variance, le test de Mann Whitney et l’analyse de la courbe ROC. Les différences ont été considérées comme statistiquement significatives lorsque les valeurs de p étaient inférieures à 0,005.
Tous les tests statistiques ont été réalisés à l’aide du logiciel SPSS 10.0.
II.4.1-Rappels de quelques notions de biostatistique utilisés au cours de l’étude
L’objectif de notre étude est de définir la place de certains marqueurs sérologiques (Anti-CCP et FR) dans le diagnostic de la polyarthrite. Pour cela une étude des performances respectives de ces derniers s’avère indispensable.
Il nous semble par conséquent important de définir et d’expliquer le mode de calcul des indices utilisés pour cette étude ; à savoir la sensibilité, la spécificité, les VPP et VPN.
Sensibilité :
Ou encore la fréquence des vrais positifs, est définie comme étant le nombre des malades ayant un test positif.
Sensibilité =a /a+c Spécificité :
Ou encore la fréquence des vrais négatifs, est définie comme étant le nombre des témoins ayant un test négatif.
Spécificité =d/ b+d
PR Présente PR Absente TOTAL
Anti-CCP Ou FR Positifs A Vrais positifs B Faux positifs a+b
Tous les tests positifs
Négatifs C Faux négatifs
D
Vrais négatifs
c+d
Tous les tests négatifs
TOTAL
a+c
Tous les patients (PR)
b+d
Tous les témoins
a+b+c+d
Toutes les personnes Testées
Valeur prédictive positive (VPP):
Est le nombre des tests vrais positifs sur tous les positifs. VPP = a/a+b
Valeur prédictive négative (VPN) :
Est le nombre des tests vrais négatifs sur tous les négatifs. VPN =d/c+d
Courbe ROC et ses caractéristiques
Courbe ROC ou Receiver Operator Characteristic permet de déterminer de façon fiable le seuil de positivité d’un test. Ces courbes, qui indiquent le taux de vrais positifs en fonction de la proportion de faux positifs pour une gamme de valeurs seuils, offrent le meilleur compromis entre sensibilité et spécificité.
Liste des résultats de toutes les analyses réalisées au cours de notre étude Tableau des résultats des analyses/ Tableau 1
Age(ans) Sexe Durée Maladie(ans) Anti-CCP FR - Latex(UI/ml) FR-Waaler/Rose(UI/mL) Pathologie 1 43 F >6ans 200 21 <8 PR 2 50 F >6ans 35,2 21 <8 PR 3 50 F <6ans 9,7 84 <8 PR 4 45 F >6ans >200 <21 <8 PR 5 26 F >6ans >200 84 <8 PR 6 65 M <6ans 167,2 168 8 PR 7 32 F >6ans 0,2 <21 <8 PR 8 55 F >6ans 5,6 84 8 PR 9 65 F <6ans 59,4 <21 <8 PR 10 53 F >6ans 148,6 672 <8 PR 11 55 F >6ans 1,8 84 8 PR 12 38 F ≥6ans >200 1344 16 PR 13 80 F >6ans 10,6 168 <8 PR 14 38 F <6ans 4,8 <21 <8 PR 15 56 F >6ans >200 168 <8 PR 16 24 F <6ans 6,7 168 <8 PR 17 73 F <6ans 30,3 168 <8 PR 18 48 F <2ans 1,1 <21 <8 PR 19 48 M 22ans 0,5 <21 <8 PR 20 28 F <6ans 12,4 <21 <8 PR 21 31 F <6ans 137,1 168 <8 PR 22 60 F <6ans 7 336 8 PR
23 42 F <6ans 0,9 <21 <8 PR 24 49 F ≥6ans 0,2 <21 <8 PR 25 52 F <2ans 112,9 168 8 PR 26 50 F <6ans 114,6 672 16 PR 27 68 F <6ans 0,5 <21 <8 PR 28 54 F ≥6ans 177,6 21 <8 PR 29 57 F >2ans 13,3 21 <8 PR 30 32 F <2ans 1,8 <21 <8 PR 31 65 M 4ans 2 <21 <8 PR 32 70 M 13ans 100 84 <8 PR 33 44 F 9ans 100 168 64 PR 34 35 F 2ans 100 <21 <8 PR 35 57 F >2ans >200 84 16 PR 36 50 M >2ans 57,5 21 <8 PR 37 45 M >6ans >200 42 <8 PR 38 60 M >6ans >200 42 <8 PR 39 40 F >2ans 11 42 <8 PR 40 50 F >2ans >200 672 16 PR 1 53 F 0,8 336 256 connectivites mixtes 2 35 M 5,8 <21 <8 Polymiosite 3 45 F 0,8 168 32 Vascularite 4 50 M 100 42 <8 SGS + PR 5 45 F 2,5 <21 <8 Lupus 6 60 F 1,6 <21 <8 Lupus 7 35 F 9,8 <21 <8 Lupus+PR 8 65 M 0,4 <21 <8 Lupus 9 70 F 0,4 21 <8 Lupus
10 72 F 0,5 <21 <8 Diabète 11 46 F 1,1 <21 <8 Encéphalopathie 12 63 F 1 84 <8 Fibrose pulmonaire 13 50 F 0,4 21 <8 Sclérodermie 14 60 F 0,9 21 <8 Thyroidite 15 57 F 0,2 <21 <8 Hypercholestérolémie 16 70 F 0,5 84 <8 embolie pulmonaire et Alzhaimer 17 67 F 0,4 84 <8 Goutte 18 53 M 0,6 42 <8 HTA et insf rénal
19 68 M >200 672 8 Coronaropathie 20 60 F 0,9 <21 <8 Lupus 21 48 F 0,5 <21 <8 Carcinone vésiculaire de la thyroide 22 81 M 2,6 5376 <8 Hépatite C 23 86 M 0,5 42 <8 Altération de l'état général 24 59 M 0,5 336 <8 Tuberculose 25 73 M 0,3 336 8 Cancer de la prostate 26 43 F 0,4 42 <8 Cancer du sein 27 36 F 0,4 <21 <8 sujet sain 28 26 M 0,5 <21 <8 sujet sain 29 24 M 0,2 <21 <8 sujet sain 30 26 M 0 <21 <8 sujet sain 31 45 F 0,6 42 <8 sujet sain 32 46 F 0,2 664 <8 sujet sain
33 31 F 0,1 <21 <8 sujet sain 34 62 F 0,2 42 <8 sujet sain 35 58 F 0,1 21 <8 sujet sain 36 23 F 3,6 <21 <8 sujet sain 37 33 F 0,3 <21 <8 sujet sain 38 68 F 0,1 332 <8 sujet sain 39 14 M 0,1 <21 <8 sujet sain 40 32 F 0,8 <21 <8 sujet sain
2- DESCRIPTION DE LA POPULATION ETUDIEE 2.1-Caractéristiques épidémiologiques
2.1.1-Sexe
Les sujets étudiés sont en majorités des femmes, puisque sur les 40 individus ou patients inclus, seulement 7 sont des hommes, soit 18% de la population de PR étudiée. Le tableau 2 représente la répartition de la population en fonction du sexe.
Tableau 2 : Répartition selon le sexe de la population de PR.
Sexe Effectif (n) %
Féminin 33 82
Masculin 7 18
Figure 1 : Diagramme sectoriel de la population selon le sexe.
82% 18%
Répartition de la population selon le sexe
sexe féminin sexe masculin
2.1.2-Age
La moyenne d’âge des patients recrutés est de 49,58 ans (13,24) [24-80]. (Patients recrutés se situent dans la fourchette d’âge allant de 24 ans à 80 ans avec un écart type de 13,24) (Cf. Tableau 1). La répartition de la population de PR étudiée en fonction de la tranche d’âge est détaillée dans le tableau ci-après.
Tableau 3 : Répartition en fonction de la tranche d’âge
Figure 2 : Répartition de la population suivant la tranche d’âge.
15% 62,50% 22,50%
Effectifs
[10-34] [35-59] [60-85]Tranches d'âge (ans) Effectif (n) Pourcentage (%)
[10-34] 6 15
[35-59] 25 62,5
2.1.3- Durée de la pathologie (PR)
Parmi les 40 patients souffrant de PR, 15 individus avaient une maladie qui évoluait depuis plus de 6ans au moment du prélèvement sanguin, alors que pour 21 autres, la maladie évoluait depuis moins de 6ans, voire moins de 2ans pour 4 d’entre eux.
Tableau 4: Répartition selon la durée de la maladie.
PR Effectif (n) pourcentage (n)
PR>6ans 15 37,50%
PR]2 ,6[ 21 52,50%
PR≤ 2 ans 4 10%
Figure 3: Répartition de la population de PR selon la durée d’évolution de la maladie 37,50% 52,50% 10% PR> 6ans PR ]2, 6] PR≤ 2ans
3-COMPARAISON DES MARQUEURS ENTRE PATIENTS ET TEMOINS
3.1-Comparaison des taux de positivité ou de négativité des marqueurs entre les patients et les témoins
Tableau 5: Comparaison des taux de positivité ou de négativité de l’Anti-CCP et du FR entre les patients et les témoins.
Remarque : Lorsque p est inférieur à 0,005, la différence statistique entre les
deux groupes sont considérées comme étant significative.
La comparaison des taux de positivité et de négativité des marqueurs sérologiques dosés, a montré une différence statistiquement significative entre
PR Témoins Significations asymptotiques Anti CCP Présence 75% 10,00% P<0,0001 Absence 25% 90,00% FR Présence 67,50% 52,50% P=0,70 Absence 32,50% 47,50% FR-LATEX Présence 67,50% 52,50% p=0,171 Absence 32,50% 47,50% FR-WALEER-ROSE Présence 25% 10,00% p=0,77 Absence 75% 90,00%
patients et témoins, seulement pour l’Anti-CCP. Pour le reste, la différence n’est pas significative ; puisque p est largement supérieur à 0,005.Au vue de ces résultats, le premier constat fait porte sur l’excellente spécificité des anti-CPP et du FR détecté par le test de Waaler-Rose (absents chez 90% des témoins).
3.2-Test de Mann-Whitney
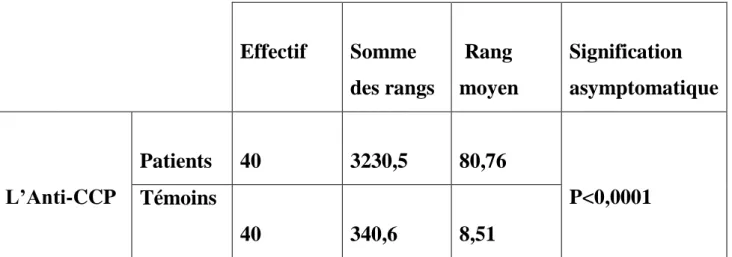
Tableau 6: Comparaison des valeurs de l’Anti-CCP entre patients et témoins Effectif Somme des rangs Rang moyen Signification asymptomatique L’Anti-CCP Patients 40 3230,5 80,76 P<0,0001 Témoins 40 340,6 8,51
Ici, on aurait bien souhaité comparer tous les marqueurs entre patients et témoins via le test de Mann-Whitney. Seulement, les tests utilisés pour la détection des FR, ne nous offrent pas cette possibilité. Car tout résultat négatif pour ces tests, n’est pas quantifié (Tableau des résultats).
On a p<0,0001très loin de la valeur seuil (0,005) au dessous de laquelle la différence entre PR et témoins pour l’anti-CCP sera considérée comme significative, ce qui confirme l’excellente performance (spécificité) de ce test pour le diagnostic de la PR.
4-COMPARAISON DE LA SENSIBLITE, SPCECIFICITE, VALEUR PREDICTIVE POSITIVE ET VALEUR PREDICTIVE NEGATIVE DES DIFFERENTS MARQUEURS
4.1-Entre l’Anti-CCP et FR
Tableau 7 : Tableau récapitulatif des résultats en termes de sensibilité, spécificité, VPP, VPN
Toute la cohorte de patients atteints de PR
Marqueurs Sensibilité Spécificité VPP VPN
L’Anti-CCP 75% 90% 88% 78,26% FR-IgM 67,5% 47,5% 59% 61,8% Anti-CCP et IgM-FR 65% 95% 92% 73%
Figure 4: Sensibilité et spécificité du test de deuxième génération AxSYM Anti-CCP® et des tests de détection du FR
Ce diagramme traduit la comparaison de la spécificité et de la sensibilité entre les deux marqueurs. Les sensibilités des deux tests sont presque comparables, par contre la spécificité du test à l’anti-CCP est largement supérieure à celui des tests recherchant les FR (Latex et Waaler/Rose).
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% Sensibilité Spécificité Anti-CCP FR
Tableau 8 : Comparaison des valeurs obtenues par rapport aux valeurs de la littérature
Valeurs obtenues Valeurs de la littérature
Anti-CCP Sensibilité 75% >70% Spécificité 90% (95-98)% VPP 88% (84-99)% VPN 79% (81-98)% FR Sensibilité 65% 75% Spécificité 47,5% (85-90)% VPP 59% (64-74)% VPN 62% (81-96)%
Remarques : Les remarques faites concernent surtout les FR. Il est également
important de souligner ici que les valeurs de VPP et de VPN sont d’après la littérature variable selon la région ou le type de population considéré.
Les valeurs des indices de sensibilité, de spécificité, de VPP et de VPN que nous avons obtenus au cours de notre étude pour les FR sont inférieures aux valeurs décrites dans la littérature. Les valeurs de sensibilité et de VPP obtenues pour les tests recherchant les FR sont inférieures à celles décrites dans la littérature
(75%). Ceci pourrait s’expliquer soit par la nature de la population de PR recrutée (PR séronégative) ou soit par le type de réaction utilisée (test d’agglutination) ; avec possibilité de phénomène de zone qui se produit en cas de titre très élevé en FR ; ou encore par le traitement de fond auquel sont soumis ces patients.
Les valeurs de la spécificité et de VPN obtenues s’expliquent par la nature de la cohorte témoin recrutée pour l’étude. On a noté chez ces témoins, un pourcentage non négligeable de faux positifs qui pourrait s’expliquer par l’existence de réactions croisées.
4.2-Comparaison des courbes ROC (Receiver Operator Characteristic.) des deux marqueurs
1. Anti-CCP 2. FR
Variable de résultats des tests : Anti-CCP Variable des résultats des tests : FR Courbe ROC
Les segments diagonaux sont générés par des liaisons. 1 - Spécificité 1,00 ,75 ,50 ,25 0,00 S e n si t i vi t é 1,00 ,75 ,50 ,25 0,00 Courbe ROC
Les segments diagonaux sont générés par des liaisons.
1 - Spécificité 1,00 ,75 ,50 ,25 0,00 S e n si t i vi t é 1,00 ,75 ,50 ,25 0,00
Remarque : Seule, la courbe ROC de FR- latex a été tracée, car parmi les deux
tests utilisés (Latex-Waaler/Rose) dans notre étude pour la recherche des facteurs rhumatoïdes de type IgM, seul le test au latex nous offre des possibilités de tracés. Tout simplement à cause de son taux de positivité très élevés (60%) ; les valeurs correspondantes aux autres 40% restants ont été modélisées de telles sortes à avoir des variables. Par contre le taux de positivité des FR-Waaler/Rose est très faible, de l’ordre de 17%. L’analyse des courbes ROC figurant ci-dessus ont déterminé que l’air sous les courbes (AUC) des dosages AxSYM Anti-CCP et Rhumalatex® de Fumouze est respectivement 0,879 et 0,625. Cette analyse indique que les deux dosages ne sont pas comparables en ce qui concerne leurs valeurs de sensibilité et de spécificité.
Zone P value Intervalle de confiance 95% asymptotique Borne inférieur Borne supérieur 87,9% <0,0001 0,799 0,959 Zone P value Intervalle de confiance 95% asymptotique Borne inférieur Borne supérieur 62,5% 0,054 0,50 0,75
5-Etude des performances de l’Anti-CCP
5.1-Valeurs de sensibilité, spécificité, VPP, VPN de l’Anti-CCP Tableau 9 : Valeurs évaluées par rapport à des sujets témoins
Anti-CCP Sensibilité Spécificité VPP VPN
Sujets sains 75% 100% 100% 58,8%
Sujets atteints de maladies autres que PR
75% 84,61% 88,23% 68,75%
La sensibilité du test AxSyM anti-CCP déterminée par rapport aux deux cohortes de sujets (sujets sains et sujets atteints de maladies autres que PR) est la même. Ceci se comprend aisément d’autant plus que la sensibilité est définie comme étant le nombre de malades ayant un test positif. Il va donc de soit que cette valeur reste inchangée. Par contre les valeurs de spécificité, de VPP et de VPN varient en fonction du groupe de sujets par rapport auquel elles ont été déterminées. Ainsi donc, la spécificité, la VPP et la VPN ont respectivement été évaluées à 100%, 100%, 58,8% par rapport aux sujets sains et à 84,61%, 88,23%, 68,75% par rapport aux sujets atteints de maladies autres que la PR. La
baisse des valeurs de spécificité et de VPP notée chez les sujets atteints de pathologie autres que la PR s’expliquerait par l’existence d’un faible pourcentage de faux positifs . Les faibles valeurs de VPN obtenues s’expliquent surtout par la taille des échantillons considérée (tableaux des résultats).
Tableau 10 : Valeurs de l’Anti-CCP évaluées chez les patients atteints de PR évoluant depuis moins de 6 ans et depuis plus de 6mois.
Sensibilité Spécificité VPP VPN Anti-CCP PR>6 ans 80% 90% 75% 92,3% Anti-CCP PR<6 ans 72% 90% 90% 83%
Au vue de ces résultats, il n’existe pas de différence notable entre les performances de notre test pour la détermination de l’anti-CCP pour les deux populations définies de PR (PR>6ans et PR<6ans). On aurait surtout souhaité inclure d’avantage de PR récentes, de durée inférieure à 3 mois afin de déterminer les performances du test AxSYM anti-CCP dans le cadre d’un diagnostic précoce de la PR.
L’augmentation de la sensibilité du test anti-CCP suivant la durée d’évolution de la maladie est compatible avec le rôle des lymphocytes B qui secrètent des immunoglobines IgG de type anti-CCP qui s’accumulent avec le
temps, ce qui par la même occasion augmente le seuil de détection de ces auto-anticorps.
III.1-Du point de vue épidémiologique III.1.1-Sexe
Dans notre étude, les sujets de sexe féminin représentent 82% de notre population de patients contre seulement 18% pour les sujets de sexe masculin. Le sex-ratio est donc de 4,5 en faveur des femmes (Figure 16).
Différentes études réalisées montrent la même tendance à la prédominance féminine. Notre étude vient donc de ce fait confirmer cette valeur du sex-ratio décrit dans la littérature variant entre 3 et 4 [7].
III.1.2- Age
L’âge moyen des patients est de 49,58 ans (13,24) [24-80]. 62,5% des patients recrutés pour notre étude, se trouvent dans la tranche d’âge de 35 à 59 ans. D’après la littérature, la PR débute principalement entre 35 et 55 ans (périménopausique) [8]; or la majorité des patients recrutés selon un mode tout à faire aléatoire mais bien sûr fondé sur l’étude de leurs dossiers médicaux se retrouve dans cette fourchette d’âge.
Notre étude est donc en accord avec ces résultats publiés. Le reste de la répartition est détaillée dans le diagramme sectoriel ci-dessous.
15% 62,50% 22,50%
Effectifs
[10-34] [35-59] [60-85]III.2-Du point de vue biologique
Les outils généralement utilisés pour le diagnostic biologique de la PR ne sont pas parfaits:
*les facteurs rhumatoïdes sont présents dans le sérum de seulement 80%
des patients ayant une PR (67,5% pour notre étude réalisée) tableau 5. Ils sont généralement absents au début de la maladie et il existe d’authentique PR évoluées « séronégatives » même si celles-ci sont plutôt moins agressives sur le plan articulaire [9].
D’un autre côté, des FR sont retrouvés dans les connectivites [10] (tableau
des résultats) et particulièrement celles avec atteinte articulaire ce qui peut
poser des problèmes de diagnostic différentiel. En dehors des pathologies rhumatismales, les FR peuvent aussi apparaître au cours de certaines maladies infectieuses ou inflammatoires (tableau 6). Les titres sont généralement faibles et la réactivité se manifeste surtout par le test au latex. La spécificité des FR est très variable et leur hétérogénéité est grande. Certains sont hétérospécifiques et réagissent avec des IgG animales (par exemple lapin dans la réaction de Waaler-Rose), d’autres sont homospécifiques réagissant avec des IgG humaines (test de latex) ou autospécifiques réagissant alors avec les allotypes des IgG du malade lui-même. La spécificité des FR pour la PR est augmentée si les deux techniques sont positives et montrent des titres élevés.
En revanche, chez les patients ayant des arthropathies non inflammatoires, la séroprévalence des FR n’excède pas celle de la population générale à savoir 2% ;
*les anticorps antistratum corneum (antikératine) quoique très spécifique
de la maladie, sont caractérisés par une assez faible sensibilité de l’ordre de 40% ;
*la recherche des facteurs antipérinucléaires est réservée aux laboratoires
spécialisés car de réalisation et d’interprétation délicates ;
*d’autres techniques (recherche des anticorps antifilaggrine par Elisa ou immunotransfert) ne sont pas de réalisation courante.
Or si l’on considère le potentiel évolutif de la PR et la difficulté diagnostique des formes débutantes (ne répondant pas aux critères de l’ACR) (critères ACR cf. annexe), de nouveaux outils diagnostiques s’avèrent indispensables d’autant plus que des nouvelles thérapeutiques (Biothérapies) sont désormais accessibles au patient. En ce sens, de solides espoirs sont fondés sur la recherche des anticorps dirigés contre les peptides cycliques citrullinés. La citrulline est un acide aminé non standard, puisqu’elle n’est pas incorporée dans les protéines durant la synthèse protéique. Elle résulte d’une transformation post-traductionnelle de l’arginine, médiée par la peptidylarginine désiminase (PAD) dont l’activité est fortement dépendante de Ca2+
[10].
Figure10: La citrullination, processus médié par les peptidyl-arginine désiminases (PAD) [10].
Ce test est apparu dans sa première version à la fin des années 1990. Les premières évaluations ont mis en avant ses meilleures spécificités (>90%) [11] et VPP (84%) par rapport à celles des FR (respectivement 85% et 75%). En revanche une des limites de ce test était sa sensibilité relativement faible puisque comprise entre 40 et 65% [12]. Cela a conduit le fabricant à optimiser ses réactifs pour commercialiser un test de 2ème génération (CCP2) qui comprenaient non plus un mais plusieurs peptides citrullinés, utilisé pour notre étude. Actuellement, on dispose des tests ELISA de troisième génération (CCP3 Inova) de sensibilité meilleure que les tests de deuxième génération.
Dans notre population, la sensibilité du test AxSYM Anti-CCP® est évaluée à
75%, meilleure que celle des FR (67,5%) (Figure 4 ou tableau 7). La
modification du choix des peptides synthétiques utilisés pour le test semble effectivement avoir amélioré les performances de détection des anticorps. Van Venrooij a sur une série de 390 polyarthrites rhumatoïdes, évalué la sensibilité de ce test à 80% environ et constaté que près de 35% des PR sans FR avaient des anti-CCP [13]. Plusieurs études publiées lors de ces dernières années confirment cette sensibilité supérieure à 70%.
Une des difficultés dans la prise en charge des PR vient du diagnostic souvent difficile des formes débutantes, variables dans leur présentation et leur modalité de survenue. Une caractéristique des anti-CCP est d’être présents à un stade très précoce de la maladie. Ils peuvent précéder l’installation clinique de la PR de plusieurs années [13,14] .En effet, Nielen et coll ont réalisé des séries de dosages de FR et anti-CCP chez 79 patients qui présentaient une PR mais surtout qui étaient des donneurs de sang réguliers. Ils ont ainsi détecté des anticorps anti-CCP chez 41% de ces patients jusqu’à 14 ans avant l’apparition
des premiers symptômes (temps moyen : 4,8 ans). Les FR eux, étaient détectés chez 28% des patients 10 ans (temps moyen : 2 ans) avant l’apparition des symptômes. En d’autres termes, près de la moitié des malades avaient un FR positif et/ou des anticorps anti-CCP détectables 3 ans avant la première apparition des symptômes [14]. Un patient de notre étude souffrant de coronaropathie a des anticorps anti-CCP à un titre très significatif (>200 U/ml) sans aucune symptomatologie articulaire (Tableau 1, ligne19). Ce résultat doit inciter le clinicien à faire preuve de vigilance vis-à-vis de l’apparition de douleurs chez ce patient notamment au niveau des mains.
S’il est important d’établir un diagnostic suffisamment tôt de façon à instaurer un traitement précoce, il est nécessaire que le test biologique utilisé soit suffisamment spécifique. Or il semble que ce soit un atout majeur de la recherche des anticorps antipeptides cycliques citrullinés.
La spécificité du test de première génération est supérieure à 90%. Celle de la deuxième génération est estimée à 98% [11,15]. Elle est de 90% pour le test de deuxième génération utilisée pour notre étude (AxSYM anti-CCP®). Ceci s’explique par un faible pourcentage de faux positifs obtenu, qui serait dû à l’état pathologique de ces patients. Ces patients pour la plupart (2/4) sont atteints d’un syndrome de chevauchement (PR+SGS, PR+Lupus), les deux autres restants sont atteints de polymiosite et de coronaropathie (tableau des résultats). Donc si on reconsidère ce paramètre, la spécificité du test pourrait être estimée à 99%. D’autres études plus vastes ont mis en évidence l’existence de réactions faussement positives parmi les sujets présentant des connectivites mais celles-ci restent très rares (<3%) [13]. Ces auteurs ont estimé la spécificité du test de 2ème génération à 98% (88% pour les FR-IgM). A travers donc ces
résultats, il apparait donc claire que ces auto-anticorps (Anti-CCP) ne sont donc pas pathognomoniques de la PR. Une attention particulière doit toutefois être réservée au syndrome de Sjögren primitif et au rhumatisme psoriasique ou la positivité des anti-CCP (due à l’existence d’épitope partagé) ne doit pas exclure le diagnostic [16]. D’autres faux positifs peuvent se voir au cours des thyroïdites, maladie de Lyme, gammapathie monoclonale et hépatite C [17]. Mais parfois on ne peut exclure l’association à une PR. Les cas d’hépatite C, et de thyroïdites inclus dans l’étude n’ont pas donné de résultats positifs pour le test à l’anti-CCP (Tableau 1).
Dans notre étude, la spécificité du test AxSYM anti-CCP® obtenue (90%) est largement supérieure à celle des facteurs rhumatoïdes de type IgM déterminés par les tests d’agglutination (47,5%) (Figure 4 ou tableau 7). Cette spécificité remarquable s’accompagne d’une bonne valeur prédictive positive à 88%
(Tableau 7). Si l’on considère uniquement les sujets atteints de pathologies
rhumatismales inflammatoires ou non (26), la valeur de VPP est évaluée à
88,23%, voire même 100% si l’on considère uniquement les sujets sains (n=14)
(Tableau 9), contre 59% pour les FR en Latex et Waaler-Rose (Tableau 7). L’excellente VPP de la recherche des anti-CCP constitue une aide pour le clinicien confronté parfois à des diagnostics différentiels difficiles. En effet, ceux-ci sont nombreux qu’il s’agisse d’une forme débutante polyarticulaire (rhumatisme articulaire aigu, polyarthrite virale…), d’une forme monoarticulaire (goutte, chondrocalcinose…) ou enfin d’une polyarthrite évoluée (syndrome de sjögren, lupus, rhumatisme psoriasique…).
Tout récemment, Raza et coll. [18] ont étudié la valeur prédictive des anti-CCP chez 124 patients qui présentaient une arthrite inflammatoire très précoce
(d’une durée <3mois). Ils ont ainsi démontré que la combinaison des anti-CCP et du FR avait chez ces malades une spécificité, une valeur prédictive positive (VPP), une sensibilité et une valeur prédictive négative (VPN) pour le diagnostic de la PR de 100%, 100%, 58%,88%. La présence d’anti-CCP seuls donnait les valeurs suivantes : 99%,94%,63% et 63% respectivement.
La recherche des anti-CCP peut parfois redresser un diagnostic. En effet, parmi les 16 sujets présentant un test positif au latex, la recherche des anti-CCP s’est avérée négative chez 14 (connectivites mixtes, vascularite, lupus, fibrose pulmonaire, sclérodermie, thyroïdite, embolie pulmonaire, Goutte, Insuffisance rénale, hépatite C, Tuberculose, Cancer du sein, Cancer de la prostate, Altération de l’état général). Ceci pourrait plaider en faveur de réactions faussement positives pour la technique Latex comme cela a été décrit [19](tableau 1).
Ces dernières années ont été riches en travaux visant à définir la valeur pronostique des anticorps anti-CCP dans la PR [20, 21,22]. Ces études démontrent une corrélation entre la présence des anti-CCP et la sévérité des érosions osseuses, ainsi qu’avec une activité de la maladie plus importante.
La première étude a été réalisée en 2000 par deux équipes de l’université de Nimègue et de l’université de Groningue (Pays-Bas) [23]. Elle a démontré que, chez des sujets atteints d’une PR depuis moins d’un an, les anticorps anti-CCP1 sont associés à une évolution vers une atteinte structurale marquée au bout de six ans, mais que la valeur prédictive de ce critère est moindre que celle d’un facteur rhumatoïde de type IgM [24].
En 2005, le groupe d’Elisabet Lindqvist (Département de rhumatologie, hôpital universitaire de lund, suède) a mis en évidence quatre paramètres pronostiques








![Tableau 11: Anti-CCP et Pronostic de la PR débutante : Détérioration structurale [30]](https://thumb-eu.123doks.com/thumbv2/123doknet/15065225.699935/62.892.17.866.164.761/tableau-anti-ccp-pronostic-pr-débutante-détérioration-structurale.webp)