MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 - 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION :
Doyen
Professeur Mohamed ADNAOUI
Vice-Doyen chargé des Affaires Académiques et estudiantines
Professeur Brahim LEKEHAL
1 - ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :
DECEMBRE 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif Pathologie Chirurgicale
NOVEMBRE ET DECEMBRE 1985
Pr. BENSAID Younes Pathologie Chirurgicale
JANVIER, FEVRIER ET DECEMBRE 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
DECEMBRE 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
JANVIER ET NOVEMBRE 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. TAZI Saoud Anas Anesthésie Réanimation
FEVRIER AVRIL JUILLET ET DECEMBRE 1991
Pr. AZZOUZI Abderrahim Anesthésie Réanimation- Doyen de FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale
Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZAD Rachid Gynécologie Obstétrique Méd. Chef Maternité des
Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie- Dir. du Centre National PV Rabat
Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir. du CEDOC +
DECEMBRE 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
MARS 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid
Endocrinologie et Maladies Métaboliques Doyen de la
FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale – Directeur du CHIS-Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
MARS 1994
Pr. ABBAR Mohamed* Urologie Directeur Hôpital My Ismail Meknès
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BARGACH Samir Gynécologie Obstétrique Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale
Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie Inspecteur du Service de Santé des FAR
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
DECEMBRE 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie
Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie DirecteurHôp.Mil. d’Instruction Med V Rabat
NOVEMBRE 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TOUFIQ Jallal Psychiatrie Directeur Hôp.Ar-razi Salé
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
NOVEMBRE 1998
Pr. BENOMAR ALI Neurologie Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
JANVIER 2000
Pr. ABID Ahmed* Pneumo-phtisiologie
Pr. AIT OUAMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hôp. My Youssef Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale
Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
NOVEMBRE 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie - Directeur Hôp.Cheikh Zaid
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
DECEMBRE 2000
Pr.ZOHAIR ABDELLAH * ORL
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique
Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie - Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique
Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
DECEMBRE 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL Fellous Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumo-phtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
JANVIER 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre * Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
JANVIER 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique
Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie Directeur Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina * Microbiologie
AVRIL 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire.
Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
DECEMBRE 2006
Pr SAIR Khalid Chirurgie générale Dir. Hôp.Av.Marrakech
OCTOBRE 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi * Chirurgie cardio vasculaire
Pr. AMHAJJI Larbi * Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed * Anesthésie réanimation Directeur ERSSM
Pr. BALOUCH Lhousaine * Biochimie-chimie
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. CHERKAOUI Naoual * Pharmacie galénique
Pr. EHIRCHIOU Abdelkader * Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire
Pr. EL ABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid * Radiothérapie
Pr. ICHOU Mohamed * Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar * Anesthésie réanimation
Pr. LOUZI Lhoussain * Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed * Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad * Virologie
Pr. OUZZIF Ez zohra * Biochimie-chimie
Pr. RABHI Monsef * Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine * Microbiologie
Pr. SIFAT Hassan * Radiothérapie
Pr. TABERKANET Mustafa * Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour * Traumatologie-orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
DECEMBRE 2008
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae * Biochimie-chimie
Pr. BOUI Mohammed * Dermatologie
Pr. BOUNAIM Ahmed * Chirurgie Générale
Pr. BOUSSOUGA Mostapha * Traumatologie-orthopédie
Pr. CHTATA Hassan Toufik * Chirurgie Vasculaire Périphérique
Pr. DOGHMI Kamal * Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid * Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal * Chimie Thérapeutique
Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie OCTOBRE 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine Interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique
Pr. DAMI Abdellah* Biochimie- Chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie Pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie Plastique et Réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro-Entérologie
Pr. LAMALMI Najat Anatomie Pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie Générale
Pr. NAZIH Mouna* Hématologie
DECEMBRE 2010
Pr.ZNATI Kaoutar Anatomie Pathologique
MAI 2012
Pr. AMRANI Abdelouahed Chirurgie pédiatrique
Pr. ABOUELALAA Khalil * Anesthésie Réanimation
Pr. BENCHEBBA Driss * Traumatologie-orthopédie
Pr. DRISSI Mohamed * Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale
Pr. EL KHATTABI Abdessadek * Médecine Interne
Pr. EL OUAZZANI Hanane * Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie Pathologique
Pr. MEHSSANI Jamal * Psychiatrie
Pr. RAISSOUNI Maha * Cardiologie
* Enseignants Militaires FEVRIER 2013
Pr.AHID Samir Pharmacologie
Pr.AIT EL CADI Mina Toxicologie
Pr.AMRANI HANCHI Laila Gastro-Entérologie
Pr.AMOR Mourad Anesthésie Réanimation
Pr.AWAB Almahdi Anesthésie Réanimation
Pr.BELAYACHI Jihane Réanimation Médicale
Pr.BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr.BENCHEKROUN Laila Biochimie-Chimie
Pr.BENKIRANE Souad Hématologie
Pr.BENNANA Ahmed* Informatique Pharmaceutique
Pr.BENSGHIR Mustapha * Anesthésie Réanimation
Pr.BENYAHIA Mohammed * Néphrologie
Pr.BOUATIA Mustapha Chimie Analytique et Bromatologie
Pr.EL JAOUDI Rachid * Toxicologie
Pr.EL KABABRI Maria Pédiatrie
Pr.EL KHANNOUSSI Basma Anatomie Pathologique
Pr.EL KHLOUFI Samir Anatomie
Pr.EL KORAICHI Alae Anesthésie Réanimation
Pr.EN-NOUALI Hassane * Radiologie
Pr.ERRGUIG Laila Physiologie
Pr.FIKRI Meryem Radiologie
Pr.GHFIR Imade Médecine Nucléaire
Pr.IMANE Zineb Pédiatrie
Pr.IRAQI Hind Endocrinologie et maladies métaboliques
Pr.KABBAJ Hakima Microbiologie
Pr.KADIRI Mohamed * Psychiatrie
Pr.MAAMAR Mouna Fatima Zahra Médecine Interne
Pr.MEDDAH Bouchra Pharmacologie
Pr.MELHAOUI Adyl Neuro-chirurgie
Pr.MRABTI Hind Oncologie Médicale
Pr.NEJJARI Rachid Pharmacognosie
Pr.OUBEJJA Houda Chirugie Pédiatrique
Pr.OUKABLI Mohamed * Anatomie Pathologique
Pr.RAHALI Younes Pharmacie Galénique
Pr.RATBI Ilham Génétique
Pr.RAHMANI Mounia Neurologie
Pr.REDA Karim * Ophtalmologie
Pr.REGRAGUI Wafa Neurologie
Pr.RKAIN Hanan Physiologie
Pr.ROSTOM Samira Rhumatologie
Pr.ROUAS Lamiaa Anatomie Pathologique
Pr.ROUIBAA Fedoua * Gastro-Entérologie
Pr SALIHOUN Mouna Gastro-Entérologie
Pr.SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr.SEDDIK Hassan * Gastro-Entérologie
Pr.ZERHOUNI Hicham Chirurgie Pédiatrique
AVRIL 2013
Pr.EL KHATIB MOHAMED KARIM * Stomatologie et Chirurgie Maxillo-faciale MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique
Pr.BENCHAKROUN Mohammed * Traumatologie- Orthopédie
Pr.BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah * Urologie
Pr. JEAIDI Anass * Hématologie Biologique
Pr. KOUACH Jaouad* Gynécologie-Obstétrique
Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique
Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie
Pr. SEKKACH Youssef* Médecine Interne
Pr. TAZI MOUKHA Zakia Gynécologie-Obstétrique
AVRIL 2014
PROFESSEURS AGREGES : DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation
Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale
Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr. BOUCHRIK Mourad* Parasitologie
Pr. DERRAJI Soufiane* Pharmacie Clinique
Pr. DOBLALI Taoufik* Microbiologie
Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation
Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI NEZHA Anesthésie-Réanimation
Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg.
AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie
Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale
Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg.
Pr. ZRARA Abdelhamid* Immunologie
2 - ENSEIGNANTS-CHERCHEURS SCIENTIFIQUES
PROFESSEURS/Prs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie-chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr .BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie-chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
Toutes les lettres ne sauraient trouver les mots qu’il faut…
Tous les mots ne sauraient exprimer la gratitude,
le respect, la reconnaissance…
En tout premier lieu, je remercie ALLAH, tout puissant, de m’avoir donné l’audace pour dépasser toutes les difficultés et d’avoir eu la bonté de m’entourer de personnes formidables qui ont, chacune à sa façon, et ce, à différentes étapes de mon cheminement, contribué, d’une manière ou d’une
A ma mère et à mon père
Pour leur soutien fort sans faille, vous avez été des piliers durant ces
années d’études, vos encouragements ont été bénéfiques et m’ont permis
d’aller de l’avant, vous trouvez ici le résultat de vos efforts.
A mes frères, Hachim et Ali,
Pour votre présence pendant les moments difficiles, pour votre
générosité infinie et vos soutiens. Je vous dédie cette thèse et je vous
souhaite une vie pleine de joie, de bonheur et de succès.
A tous mes amis,
Qui ont été présents et compréhensifs, leurs appels et leurs mots de
soutien m’ont beaucoup apporté. Que cette thèse soit le témoignage de
A notre maître et Président de thèse
Monsieur le professeur Mimoun ZOUHDI
Professeur de Bactériologie
C’est avec une profonde gratitude et une joie immense que nous avons reçu votre acceptation de présider le jury de notre thèse en plaçant votre confiance en notre
travail. C’est un grand honneur que vous nous faites et nous en sommes très sensibles. Nous nous inclinons avec un grand respect devant vos qualités humaines, votre disponibilité et surtout devant vos compétences professionnelles.
Veuillez agréer, l’expression de notre vive reconnaissance, cher Maître, ainsi que notre profonde et respectueuse considération.
A notre maître et Rapporteur de thèse
Monsieur le professeur Yassine SEKHSOKH
Professeur de Microbiologie
Je ne saurais exprimer ma reconnaissance et ma gratitude pour votre implication personnelle dans ce travail. Tous mes remerciements à vous pour votre confiance en
moi en m’octroyant ce sujet de thèse, pour votre constante disponibilité, votre patience et surtout vos conseils précieux qui m’ont été extrêmement utile tout au
long de ce travail. Malgré vos obligations professionnelles et familiales vous m’avez toujours réservé un accueil chaleureux. C’est avec une joie et un plaisir
immense que j’exprime ma gratitude pour tous vos efforts déployés pour la réalisation de ce travail.
A notre Maître et Juge de thèse
Monsieur le professeur Ahmed GAOUZI
Professeur de Pédiatrie
Je vous remercie pour l’honneur que vous nous avez fait d’accepter de faire partie de notre jury de thèse. Merci pour toute la gentillesse et la simplicité avec laquelle
vous nous avez accueillis. Merci également de l’intérêt que vous accordé à ce travail. Permettez-nous de vous témoigner cher maître, l’expression de nos
A notre Maître et Juge de thèse
Madame le professeur Saida TELLAL
Professeur de Biochimie
C’est un grand privilège et honneur pour nous de vous avoir dans notre jury de thèse. Votre amabilité et votre accueil chaleureux n’ont pas manqué de nous toucher. Recevez l’expression de notre reconnaissance et de nos respects, ainsi que
nos sincères et humbles remerciements. .
A notre Maître et Juge de thèse
Madame le professeur Sakina ELHAMZAOUI
Professeur de Microbiologie
C’est pour nous un grand privilège de vous avoir dans notre jury pour juger ce travail. Merci de votre serviabilité dont vous nous avez témoigné en acceptant de
siéger dans notre jury de thèse. Recevez à travers ce travail notre gratitude et notre grande estime.
Liste
Liste des abréviations : AcN : Anticorps neutralisants
ALT : Alanine aminotransférase Apo : Apolipoprotéines
AST : Aspartate aminotransférase
BVDV : Virus de la diarrhée virale bovine CHC : Carcinome hépatocellulaire CLDN1 : Claudin 1
CMH : Complexe majeur d’histocompatibilité CSE : Cellules stromales endométriales CSFV : Virus de la peste porcine
CTB : Cytotrophoblastes DC : Cellules dendritiques DENV : Virus de la Dengue
EGFR : Epidemal growth factor receptor EVT : Trophoblastes extravilleux GSIs : Gènes stimulés par l’interferon
IMF : Interface materno-foetale
JEV : Virus de l’encéphalite japonaise
KIR : Killer-cell immunoglobulin-like receptor LB : Lymphocyte B
LDL : Low density lipoprotein LDL-R : Récepteur des LDL LT : Lymphocytes T
MEC : Matrice extracellulaire MMP : Métalloprotéinases
NPC1L1 : Niemann-Pick C1-like 1 cholesterol absorption receptor OCLN : Occludin
OMS : Organisation mondiale de la santé PBMC : Peripheral blood mononuclear cells RE : Réticulum endoplasmique
REr : RE rugueux
SLN : Signal de localisation nucléaire
SRB1 : Scavenger receptor class B member 1 STB : Syncytiotrophoblastes
TfR1 : Transferrin receptor 1 Tregs : Cellules T régulatrices TV : Transmission verticale
uNK : Cellules NK utérines VHA : Virus de l’hépatite A VHB : Virus de l’hépatite B VHC : Virus de l’hépatite C
VIH : Virus de l’immunodéficience humaine VLDL : Very low density lipoprotein
WNV : Virus du nil occidental YFV : Virus de la fièvre jaune
Liste
Liste des figures :
Figure 1: Réplication, assemblage et relâche du VHC. ... 12
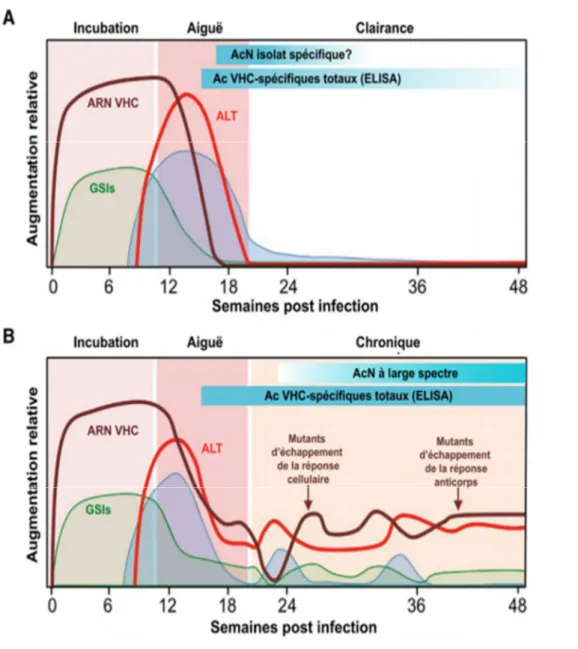
Figure 2: Caractéristiques cliniques, virologiques et immunologiques d’une infection par le VHC. A. Infection aiguë suivie d’une clairance spontanée. B. Infection aiguë avec progression vers une infection chronique. Tirée et traduite de Park et al. ... 17
Figure 3: Cinétique des marqueurs d’infection au cours de l’infection aiguë (A) et chronique (B). .. 59
Liste des tableaux
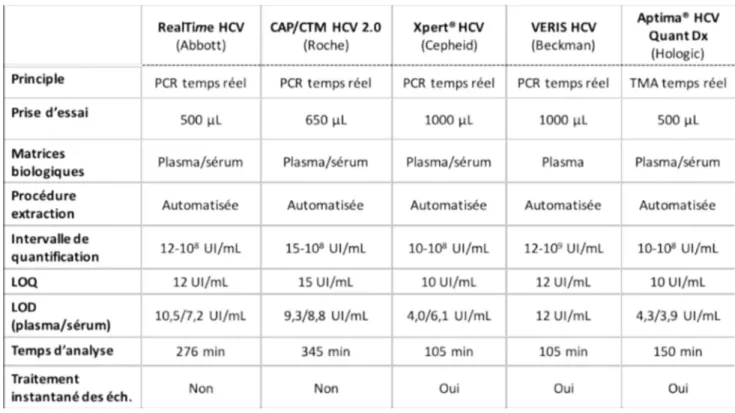
Tableau I: Estimation de la prévelance de l’infection par le VHC dans le monde par région, en 2010. ... 15 Tableau II: Principales caractéristiques des trousses commerciales de détectionquantification de l’ARN du VHC (LOQ : limite de quantification ; LOD : limite de détection ; CAP/CTM : Cobas AmpliPrep/Cobas TaqMan). ... 61
Introduction ...1 Chapitre 1 : Le virus de l’hépatite C ...4 I. Historique :...5 II. Épidémiologie : ...5 1. Agent pathogène : ...6 1.1. Caractères virologiques : ...6 1.2. Cycle virale du VHC : ...8 1.2.1.Attachement, internalisation et fusion ...8 1.2.2.Traduction, maturation des protéines virales et réplication ... 10 1.2.3.Assemblage et relâche ... 11 2. Modes de transmission : ... 13 3. Facteurs favorisants : ... 13 4. Répartition géographique : ... 14 III. Physiopathologie : ... 16 IV. Étude clinique : ... 19 V. Diagnostic : ... 20 1. Détection de l'antigène de base viral ... 25 VI. Traitement : ... 31
3. Placentation ... 45 4. Tolérance materno-foetale... 46 5. Progression de la grossesse et environnement pro- ou antiinflammatoire ... 49 II. Pathogénèse chez la femme enceinte et l’enfant : ... 50 III. Transmission verticale : ... 51 IV. Diagnostic clinique et biologique chez la femme enceinte et l’enfant : ... 54 1. Outils diagnostiques ... 54 1.1. Enzymes hépatiques ... 54 1.2. Evaluation de la fibrose hépatique ... 55 1.3. Outils virologiques ... 56 1.4. Nouveaux outils virologiques ... 62 2. Utilisation pratique des tests virologiques pour le dépistage de l’hépatite C ... 64 2.1. Utilisation pratique des tests sérologiques standards ... 64 2.2. Utilisation pratique des tests rapides d’orientation diagnostique (TRODs) ... 65 3. Utilisation pratique des outils virologiques pour le diagnostic et le suivi des infections
virales C ... 66 3.1. Diagnostic de l’hépatite aiguë... 66 3.2. Diagnostic de l’hépatite chronique ... 67 V. Traitement de l’hépatite C chez l’enfant et la femme enceinte :... 68 Conclusion ... 69 Résumés ... 72 Bibliographie et webographie ... 76
2
Le virus de l’hépatite C (VHC) est un virus très hétérogène génétiquement, qui se transmet principalement par contact sanguin, mais aussi de la mère à l’enfant pendant la grossesse ou pendant l’accouchement, et par rapport sexuel. Actuellement, il n’existe aucun moyen de prévention de la transmission verticale du VHC.
Le nombre de d’individus infectés par le VHC est estimé à entre 130 et 170 millions de personnes dans le monde, représentant 2% à 3% de la population mondiale.
La pathogénèse du VHC pendant la grossesse est mal élucidée. Pendant la grossesse, le système immunitaire maternel s’adapte en augmentant sa tolérance aux allo-antigènes paternels afin de protéger le fœtus d’agressions immunitaires, et en même temps, maintient une immunité efficace pour protéger le fœtus et la mère d’agressions infectieuses. Ces modulations du système immunitaires changent dépendamment de la phase de grossesse.
L’objectif général de cette thèse est de mieux comprendre l’influence de la réponse neutralisante sur la composition et l’évolution des populations virales présentes chez la femme enceinte et l’enfant infecté verticalement, et d’évaluer s’il existe un lien avec les différentes manifestations cliniques observées chez ces patientes (charge virale VHC; inflammation hépatique; survenue de la transmission verticale (TV)).
1) Caractérisation du goulot d’étranglement dans la transmission verticale du VHC. Dans cette deuxième partie de la thèse, le but est de déterminer l’identité et la quantité de variantes transmises de la mère à l’enfant, estimer le moment de la TV et évaluer l’influence des réponses neutralisantes spécifiques au VHC de la mère et de l’enfant sur ce processus.
2) Étude de la quasiespèce du VHC pendant la grossesse
Plusieurs évidences suggèrent que l’environnement immunitaire particulier qu’est la grossesse influence le cours de l’infection par le VHC. À ce jour, aucune étude à grande échelle de la composition de la quasiespèce du VHC chez la femme enceinte n’a été effectuée.
Pourtant, l’étude de la dynamique des populations virales basée sur les variantes des régions hypervariables 1 (HVR1) a souvent révélé des informations importantes, notamment sur l’issue de l’infection aigue, l’intensité des dommages hépatiques et la réponse au traitement. De plus, deux études précédemment publiées par notre groupe suggèrent l’implication de la réponse humorale maternelle dans l’évolution de la quasiespèce du VHC.
4
Chapitre 1 :
Le virus
I. Historique :
Au début du XXème siècle, pendant la première et deuxième guerres mondiales, fut créées et développées les premières structures appelées “banques de sang” [1]. En 1943, le premier cas d’hépatite post-transfusionnelle fut enregistré et décrit par Paul Beeson. En 1947, les hépatites infectieuse et sérique, découvertes en 1944 et 1945, seront renommées hépatite A et B respectivement [2,3,4]. En 1975, à l’aide de test sérologiques, on a pu déterminer que la plupart des hépatites post-transfusionnelles n’étaient causées ni par l’hépatite A, ni par l’hépatite B, et donc on a pu déduire qu’un autre agent était en cause, identifié comme l’agent de l’hépatite non-A-non-B. Il fut renommé “virus de l’hépatite C” en 1989 par l’équipe du Dr Michael Houghton, qui a pu isoler et caractériser un clone dérivé du génome du virus suite au criblage de librairie d’ADNc dérivée de sérum de chimpanzés infectés par le sérum de patients atteints d’hépatite C [5].
II. Épidémiologie :
L’organisation mondiale de la santé (OMS) estime à 130-150 millions le nombre d’individus chroniquement infectés par le VHC dans le monde [6]. Cette prévalence varie à l’échelle mondiale, avec les régions les plus touchées étant l’Afrique du nord, l’Asie de l’Est et l’Asie centrale [7]. L’incidence annuelle du VHC est estimée à 3-4 millions par an [8]. La mortalité annuelle causée par le
6
Chez l’enfant, la prévalence est estimée entre 0,05% et 5% [10].
1. Agent pathogène :
1.1. Caractères virologiques :
Le VHC est un petit virus hépatotrophique enveloppé mesurant 50 à 80 nanomètres de diamètre et appartenant à la famille des Flaviviridae [15]. Cette famille comporte quatre genres :
le genre Flavivirus, comprenant des espèces telles que le virus de la Dengue (DENV), le virus du Nil occidental (WNV), le virus de l’encéphalite japonaise (JEV) et le virus de la fièvre jaune (YFV), les Pestivirus (virus de la diarrhée virale bovine (BVDV)), virus de
la peste porcine classique (CSFV), les Pegivirus,
et, finalement, le genre Hepacivirus, auquel appartient le VHC. Le VHC est lui-même subdivisé en 7 génotypes majeurs et plus de 67 sous-types. Comme tous les membres des Flaviviridae, il possède un génome constitué d’ARN monocaténaire non segmenté de polarité positive qui est directement traduit par la machinerie cellulaire pour ainsi produire les différentes protéines virales [16-17].
Le génome du VHC est constitué d’environ 9600 bases. Il comporte un long cadre de lecture ouvert dont la traduction résulte en une unique polyprotéine de plus de 3000 acides aminés qui sera subséquemment clivée avec l’aide des protéases virales et cellulaires pour former les dix principales protéines virales soit Core, E1, E2, p7, NS2, NS3, NS4A, NS4B, NS5A et NS5B [63]. Les protéines présentes en N-terminal sont dites « structurelles »
puisqu’elles entrent dans la composition du virion. Celles en C-terminal sont dites « non structurelles » et participent de différentes façons au cycle de réplication du VHC. À chacune des extrémités de la région codante se trouvent des régions non traduites (5’UTR et 3’UTR) hautement structurées et contenant des éléments essentiels à la traduction et à la réplication du génome viral [19].
Les particules virales sont constituées d’une nucléocapside (capside + génome viral) enrobée d’une couche bilipidique dérivée de la membrane du Réticulum Endoplasmique, dans laquelle sont enchâssées les deux glycoprotéines d’enveloppe (E1 et E2) sous forme de trimères d’hétérodimères [15, 20]. La capside, de forme icosaédrique, est constituée de plusieurs monomères de la protéine Core et contient une seule copie du génome viral. Les virions se présentent sous la forme de particules lipovirales car ils sont associés à des lipoprotéines. Leur contenu lipidique ressemble à celui des VLDL (very low density lipoprotein) et LDL (low density lipoprotein) et inclut plusieurs apolipoprotéines (apo) notamment apoB, apoC1 et apoE [21]. Cette caractéristique leur donne une densité très faible comparativement aux autres virus enveloppés à génome d’ARN. Leur densité est en général située entre 1.03 et 1.20 g/cm3 et est associée à leur infectivité [22]. On retrouve les virions les plus infectieux dans les fractions de moindre densité, possiblement parce que l’association aux lipoprotéines module l’attachement du VHC à ses récepteurs lors de l’entrée et protège le virus de la neutralisation par les anticorps en
8 1.2. Cycle virale du VHC :
1.2.1. Attachement, internalisation et fusion
Le processus d’entrée du VHC à l’intérieur des hépatocytes est complexe et implique des interactions avec plusieurs facteurs d’attachement et récepteurs. Le virus interagirait d’abord avec les sulfates d’héparane associés aux protéoglycanes (HSPG) présents à la surface des hépatocytes. Cette liaison initiale de faible affinité impliquerait des résidus chargés positivement dans HVR1 ainsi que la protéine apoE présente à la surface des virions [24, 25]. Le récepteur des LDL (LDL-R) pourrait aussi agir en tant que facteur d’attachement via la liaison à apoE [26]. Entrent ensuite en jeu cinq récepteurs : le Scavenger receptor class B member 1 (SRB1), la tétraspannine CD81, les protéines de jonctions serrées Claudin-1 (CLDN1) et Occludin (OCLN) et le Niemann-Pick C1-like 1 cholesterol absorption receptor (NPC1L1) [21].
SRB1 est fortement exprimé à la surface des hépatocytes, où il joue un rôle essentiel dans le métabolisme du cholestérol [27]. Il serait impliqué dans l’attachement et l’entrée du VHC de trois façons : il permettrait d’abord l’attachement du virus à la cellule hôte en liant des composantes des lipoprotéines associées aux virions. Suite à l’attachement, la fonction de transfert des lipides de SRB1 serait requise pour l’entrée suivant un mécanisme encore non élucidé mais qui pourrait servir à libérer les virions de leur association aux lipoprotéines et/ou à transférer le VHC vers CD81. Finalement, SRB1 interagirait de manière directe et indirecte avec la région HVR1 de l’enveloppe virale, possiblement via l’interaction avec apoA [15, 28] ce qui rendrait accessibles des résidus d’E2 impliqués dans la liaison à CD81 [29-31]. L’engagement de CD81 et d’E2 provoquerait ensuite la relocalisation du
complexe VHC-CD81 vers les jonctions serrées par un mécanisme de réarrangement de l’actine induit via la signalisation par le epidemal growth factor receptor (EGFR) et permettant ainsi le contact avec les protéines CLDN1 et OCLN [103]. L’interaction avec CLDN1 induirait alors l’endocytose dépendante des clathrines du complexe VHC-CD81. On croit que la protéine de jonction OCLN ainsi que le transferrin receptor 1 (TfR1) seraient aussi impliqués dans l’internalisation [31].
Suite à son internalisation, le VHC est dirigé vers les endosomes précoces où l’acidification permet la fusion de l’enveloppe virale avec la membrane cellulaire et la relâche du génome du VHC dans le cytoplasme [31]. Les molécules ainsi que le mécanisme exact menant à la fusion des membranes virale et cellulaire n’ont pas encore été élucidés. Par contre, l’interaction entre CD81 et E2 semble conditionner le virion à répondre au changement de pH nécessaire à la fusion, probablement via un changement de conformation du complexe E1/E2 [33]. Le contenu en apolipoprotéines, notamment apoE et apoC1, serait modulé par HVR1 et jouerait un rôle clé dans le processus de fusion [34, 35]. Certains résidus d’E1 et la capacité de dimérisation d’E1/E2 seraient aussi importants [36].
Finalement, en 2012, le récepteur NPC1L1 a été identifié comme un facteur cellulaire impliqué dans l’entrée du VHC. On le retrouve sur la membrane cellulaire du côté apical des hépatocytes au niveau des canaux biliaires où il est
10
1.2.2. Traduction, maturation des protéines virales et réplication Suite à la fusion des membranes virale et cellulaire, l’ARN du VHC est libéré dans le cytoplasme. Il est alors directement traduit par les ribosomes au niveau du Réticulum Endoplasmique rugueux (REr) grâce à un IRES (internal ribosome entry site) situé à son extrémité 5’. La polyprotéine ainsi produite est immédiatement prise en charge par les protéases cellulaires et virales. Les protéines de structure ainsi que p7 sont clivées par des peptidases cellulaires alors que les fonctions protéases de NS2 et du complexe NS3-4A prennent en charge le clivage des autres protéines non structurelles. Au final, toutes les protéines virales se retrouvent directement ou indirectement associées aux membranes [21].
La réplication du génome et l’assemblage des virions se produisent au niveau du RM, où se forment les complexes de réplication. Le RM est constitué de vésicules à simples et doubles membranes. L’initiation du réarrangement membranaire serait médiée par la protéine NS4B. Cependant, il a été démontré que NS3-4A, NS5A et NS5B étaient aussi impliquées dans la formation du réseau membraneux, et que leur expression concomitante était requise pour l’édification d’un RM complet. L’utilisation de structures membranaires comme site de réplication a été observée pour tous les virus à ARN de polarité positive étudiés jusqu’à maintenant. On croit qu’une de ses fonctions est de séquestrer l’ARN viral à l’écart des molécules de reconnaissance de motifs associés aux pathogènes telles que RIG-I par l’utilisation de signaux de localisation nucléaire (SLN) contenus dans les protéines virales et leur permettant d’être recrutées aux membranes du réseau membranaire via des nucléoporines présentes à leur surface, empêchant ainsi la reconnaissance du génome viral et l’initiation de réponses immunitaires innées [38, 39-41].
Les protéines virales impliquées dans la réplication du génome du VHC, appelées réplicases, sont les mêmes protéines que celles impliquées dans la
formation du réseau membranaire, soit NS3-4A, NS4B, NS5A et NS5B. Le recrutement des réplicases et leur organisation en complexe de réplication serait effectués avec l’aide de certains facteurs cellulaires tels que l’Annexin A2, impliqué dans l’assemblage de microdomaines membranaires comme les radeaux lipidiques, et hVAP33, une protéine associée aux vésicules [42]. Les régions non traduites en 3’ et 5’ de l’ARN viral agissent à titre de régulateurs de la synthèse par la polymérase NS5B des brins négatif et positif respectivement [43].
1.2.3. Assemblage et relâche
L’assemblage des particules virales permet l’encapsidation du génome du VHC à l’intérieur de la capside constituée de plusieurs monomères de la protéine Core ainsi que l’enveloppement des virions qui bourgeonnent dans la lumière du réticulum endoplasmique [44]. Il se déroule à proximité de gouttelettes lipidiques cytosoliques à la surface desquelles sont localisées les protéines Core et NS5A et requiert une coordination spatio-temporelle avec les complexes de réplication, situés dans le réseau membranaire. La protéine NS5A, avec l’aide de NS3-4A, serait responsable du transport du brin positif du complexe de réplication vers Core associé aux gouttelettes lipidiques. Le complexe p7-NS2 recrute le complexe NS3-4A et leur interaction induit le transport de Core des gouttelettes lipidiques vers les sites de bourgeonnement où l’encapsidation du génome est effectuée. NS3 serait aussi impliquée dans l’encapsidation.
Les glycoprotéines d’enveloppe sont aussi recrutées aux lieux d’assemblage par NS2 [21].
12
Figure 1: Réplication, assemblage et relâche du VHC.
A. Traduction des protéines virales et formation du complexe de réplication. B. Transfert du génome viral vers le site d’assemblage et assemblage des virions. C. Sécrétion vésiculaire chez une cellule saine et chez une cellule infectée par le VHC.
Tirée et traduite avec permissions de Macmillan Publishers Ltd : Nature Reviews Microbiology, Lindenbach & Rice [21]
2. Modes de transmission :
Le VHC est un virus transmissible par le sang. Son incidence a rapidement augmenté suite à l’augmentation du nombre de transfusions sanguines, de procédures médicales, et d’injections après la deuxième guerre mondiale, et ceci dû à l’inadéquate stérilisation des instruments et à l’absence de dépistage du sang et de ses dérivés [11, 12]. Ainsi, depuis l’instauration de méthodes de dépistage systématique des produits sanguins et dérivés, et avec l’amélioration des méthodes de stérilisation, la propagation du VHC par voie sanguine a baissé de façon consistante, jusqu’à ce qu’on ait plus recensé de cas de transmission de VHC par voie sanguine dans les pays développés depuis 1994. [12, 13]
Le VHC peut aussi être transmis de la mère à l’enfant. C’est un mode de transmission est peu efficace, avec un taux de moins de 10%.
D’autres mode de transmission du VHC ont été décrits, tel que l’acupuncture, les tatouages, et les piercings.
La transmission par voie sexuelle reste controversée car la plupart des cas reportés ne peuvent exclure de façon définitive l’implication d’autres mode de transmission. [14]
3. Facteurs favorisants :
14 4) les soins de santé à l’étranger;
5) les expositions accidentelles au travail;
6) les relations sexuelles avec une personne infectée.
On documentait aussi des éléments contextuels qui augmentent la probabilité d’une personne d’être infectée, à savoir le fait d’avoir séjourné en milieu carcéral, d’avoir des antécédents d’infection transmissible sexuellement ou pas le sang (ITSS) et d’avoir partagé le domicile d’une personne porteuse du virus. Avant 1992, la transmission du virus lors de transfusion sanguine était le risque principal connu pour l’infection par le VHC. L’introduction des tests universels de dépistage du matériel sanguin, depuis les recommandations de la commission Krever70 est venue réduire à moins de 1/100 000 le risque résiduel de transmission du VHC lors des transfusions sanguines. Depuis lors, le partage de matériel de consommation de drogues est devenu la principale voie connue de transmission du virus
4. Répartition géographique :
Selon l’Organisation mondiale de la santé (OMS), on estime à 130-150 millions le nombre d’individus chroniquement infectés par le VHC dans le monde [45], ce qui représente environ 2% de la population planétaire. Cette prévalence varie grandement à l’échelle mondiale, les régions les plus touchées étant l’Asie centrale, l’Asie de l’est, l’Afrique du nord et l’Afrique moyen-orientale, avec des taux d’infection dépassant les 3.5% [46]. Les pays ayant les séroprévalences (présence d’anticorps anti-VHC) les plus élevées sont l’Égypte (14.7%), le Cameroun (11.6%), l’Ouzbékistan (11.3%), le Gabon (11.2%) et la Mongolie (10.8%) [47].
Tableau I: Estimation de la prévelance de l’infection par le VHC dans le monde par région, en 2010. [224].
16
III. Physiopathologie :
L’hépatite C se présente en deux phases : aiguë et chronique. Les six premiers mois suivant l’infection initiale correspondent à la phase aiguë de la maladie. Elle est très souvent non diagnostiquée, car à cette étape, seulement 15 à 30% des patients présenteront des symptômes [48]. Ces derniers apparaissent habituellement de 5 à 12 semaines après l’infection [49] et s’apparenteront à des symptômes grippaux dans une grande majorité de cas, bien que des manifestations plus spécifiques du VHC tels qu’un ictère et des urines foncées aient été observées chez une minorité de patients en phase aiguë [50]. Le virus est détectable 2 à 14 jours suivant l’inoculation [49]. Après en moyenne 9 jours post infection, il entre dans une phase de croissance exponentielle, concomitante à l’expression des gènes stimulés par l’interféron (GSIs), qui sera suivie d’une phase plateau pendant laquelle la charge virale élevée atteinte sera maintenue en moyenne 56 jours [51, 52]. Environ 8 à 12 semaines post infection, les réponses CD4+ et CD8+ spécifiques au VHC sont enclenchées et coïncident avec l’élévation du niveau des aminotransférases (alanine aminotransférase (ALT) et aspartate aminotransférase (AST)), marqueurs de l’inflammation hépatique, résultant de la destruction des hépatocytes infectés par les lymphocytes T cytotoxiques, ce qui entraine une baisse de la virémie [52, 53].
Figure 2: Caractéristiques cliniques, virologiques et immunologiques d’une infection par le VHC. A. Infection aiguë suivie d’une clairance spontanée. B. Infection aiguë avec
18
Les anticorps spécifiques au VHC apparaissent après la réponse à médiation cellulaire, en général de 20 à 150 jours suivant l’infection [49].
La baisse de virémie marque la fin de la phase aiguë. Suite à cela, on observe soit une résolution spontanée de l’infection (environ 25% des cas), soit une progression vers une atteinte chronique [54]. On ne connait pas les mécanismes exacts faisant en sorte que certains patients arrivent à éliminer le virus par eux même alors que d’autres non. Cependant, certains facteurs reliés à l’hôte et d’autres liés au virus ont été associés à la probabilité de clairance spontanée.
Parmi les facteurs de l’hôte, le sexe féminin [55], le développement rapide d’une réponse TCD4+ VHC-spécifique soutenue [52, 56], une infection préexistante par le virus de lhépatite B (VHB) ou le virus de l’hépatite A (VHA) [57], l’absence d’infection par le virus de l’immunodéficience humaine (VIH-1), certaines origines ethniques [58], et plus particulièrement le polymorphisme favorable (allèle CC) en amont du gène IL28B [59] ont été positivement associés à la clairance spontanée. L’apparition d’une réponse T CD8+ VHC spécifique vigoureuse et ciblant un spectre étendu d’épitopes du VHC, et l’expansion de cellules T VHC-spécifiques polyfonctionnelles, ont aussi été associé au contrôle de l’infection aigue primaire et à la protection contre la réinfection respectivement [53, 60, 61]. De plus, on pense que l’expression prolongée des GSIs entraverait le développement d’une réponse immunitaire adaptative adéquate et le contrôle de l’infection [52]. L’implication de la réponse humorale reste quant à elle controversée. Alors que certaines études tendent à démontrer qu’elle n’est pas nécessaire pour éradiquer l’infection, comme chez des individus déficients en production d’anticorps [62], l’apparition
précoce d’anticorps neutralisants a forte réactivité croisée [63-65] ou dirigés contre la première région hypervariable (HVR1) de la protéine d’enveloppe E2 du VHC a été plus souvent observée chez les patients qui éliminent le virus que chez ceux qui progressent vers une infection chronique [66].
L’infection chronique par le VHC évolue lentement. Cependant, si elle n’est pas traitée, elle mène à la cirrhose chez environs 10 à 20% des patients après 20 à 30 ans. Une fois la cirrhose établie, le risque annuel de développer un carcinome hépatocellulaire (CHC) ou des signes de décompensation hépatique, deux conditions pouvant justifier le recours à la transplantation du foie, sont de 1 à 5% et de 3 à 6% respectivement [50, 67].
L’infection chronique est caractérisée par une inflammation persistante [54], un épuisement clonal des cellules T CD4+ et CD8+ [52, 68], l’apparition rapide de mutants d’échappement [69, 70], l’induction de cellules T et de cytokines régulatrices [71, 72] et la production d’anticorps neutralisants (AcN) qui, malgré leur réactivité croisée, n’arrivent pas à contenir l’infection [73].
IV. Étude clinique :
La plupart des patients atteints du VHC chronique sont asymptomatiques ou peuvent présenter des symptômes non spécifiques (asthénie, malaise). Certains d'entre eux peuvent présenter des arthralgies et/ou la myalgies. Les patients atteints d'une maladie décompensée peuvent présenter des
20
niveau viral du VHC, qui est habituellement de l'ordre de 0,2 à 5 millions d'UI ml-1 . Des tests de laboratoire de base comme des tests de fonction hépatique, le temps de prothrombine et l'hépatite B ainsi que des sérologies du virus de l’immunodéficience humaine (VIH) devraient être effectués. La biopsie du foie est souvent utile pour établir le bon diagnostic et déterminer la gravité de l'inflammation et le stade de la fibrose
V. Diagnostic :
Le diagnostic d'infection virale a pour but de permettre l'identification et le traitement des personnes infectées. Ainsi, le diagnostic d'une infection virale est important pour prévenir la progression de la maladie et la propagation virale. La majorité des patients primo-infectés par le VHC sont asymptomatiques; par conséquent, les symptômes ne peuvent pas être utilisés comme indicateurs spécifiques de l'infection par le VHC. La virémie du VHC pourrait toujours exister malgré un taux normal d'alanine aminotransférase (ALT) sérique. Par conséquent, les méthodes virologiques plutôt que les niveaux d'ALT sont utilisées pour diagnostiquer une infection par le VHC [69].
En général, les méthodes virologiques d’examen des infections virales comprennent des tests indirects et directs. Les tests indirects consistent à détecter les anticorps induits par une infection virale, notamment les IgM pour une infection récente et les IgG pour une infection récente ou passée. Les tests directs incluent l'isolement du virus, la détection des antigènes viraux et des acides nucléiques viraux.
À l'heure actuelle, il est difficile d'isoler et de cultiver le VHC en utilisant des échantillons cliniques. De plus, les IgM anti-VHC pourraient être détectés non seulement chez 50% à 93% des patients atteints d'hépatite C aiguë, mais
également chez 50% à 70% des patients atteints de CHC. Par conséquent, les IgM anti-VHC ne peuvent pas être utilisés comme marqueur fiable de l'infection aiguë par le VHC, et les dosages d'IgM n'ont pas été utilisés en pratique clinique [91,92]. À l'heure actuelle, les tests de diagnostic de l'anticorps total anti-VHC, de l'antigène noyau viral et de l'ARN génomique viral sont utilisés en pratique clinique [74,69,75-80].
Les tests de détection des anticorps anti-virus de l'hépatite C, de l'antigène principal viral et de l'ARN génomique viral sont utilisés pour diagnostiquer l'infection par le VHC en pratique clinique.
Détection de la production d'anticorps
En général, les tests sérologiques de détection des anticorps anti-VHC comprennent des tests de dépistage et de confirmation. Les tests de dépistage servent tout d’abord à sélectionner les échantillons positifs pour l’anticorps, puis des tests de confirmation permettent de vérifier les échantillons positifs.
Test de dépistage : Enzyme-linked Immunosorbent Assay : À l'heure actuelle, le test ELISA de troisième génération destiné à la détection des anticorps anti-VHC est couramment utilisé dans les laboratoires de diagnostic [81]. Les antigènes conservés du cœur du VHC (HCV core), les régions NS3, NS4 et NS5 sont utilisés dans ces tests pour détecter les anticorps anti-VHC. La sensibilité des ELISA de troisième génération a été estimée à 98,9% et la
22
test ne doit pas être utilisé chez les nourrissons de moins de 18 mois en raison de la possibilité de réactivité avec les anticorps maternels [83]. Cependant, le temps écoulé entre l’infection par le VHC et l’apparition d’anticorps détectables (période sérologique) est généralement supérieur à 40 jours avec les ELISA de troisième génération [84]. En 2008, un test ELISA de quatrième génération est devenue disponible, permettant de détecter l'anticorps anti-VHC nettement plus tôt que les autres tests [226]. Les antigènes utilisés dans le test anti-VHC de quatrième génération sont dérivés des régions centrales (deux groupes d'épitopes différents), NS3, NS4A, NS4B, ainsi que des régions NS5A. Les antigènes NS3 et NS4 sont dérivés des génotypes 1a, 1b, 2 et 3.
Test de dépistage : Test rapide [23,49]: Les tests rapides sont utilisés directement sur le site des soins, en dehors du laboratoire de diagnostic. Plusieurs tests rapides ont été mis au point pour détecter les anticorps anti-VHC présentant une sensibilité et une spécificité relativement élevées [87,88]. Le test actuellement approuvé par la Food and Drugs Administration (FDA) aux états-unis en 2010 est le test OraQuick HCV Rapid Antibody (OraSure Technologies, Bethlehem, PA). Il est approuvé pour une utilisation chez les patients de plus de 15 ans, pour le dépistage des personnes considérées à risque d'infection par le VHC. Ce test détecte les anticorps anti-VHC dans différents échantillons, par exemple le sang total au bout du doigt et la ponction veineuse, le sérum, le plasma ou la salive. Les protéines recombinantes ou les peptides synthétiques des antigènes centraux, NS3 et NS4 sont immobilisés sur une membrane de nitrocellulose pour effectuer un immunodosage à flux latéral indirect. Les résultats sont directement visualisés à l’aide de la protéine A marquée à l’or colloïdal, générant une ligne rouge-violette dans les 20 à 40 minutes en présence
d'anticorps anti-VHC dans les échantillons. Ces tests rapides conviennent aux environnements limités en ressources car ils sont peu coûteux, simples à réaliser et rapides [89].
Tests de confirmation : Essais d'immunoblot recombinants [85]:
Recombinant immunoblot assays (RIBA) peuvent être utilisés pour confirmer la présence d'anticorps anti-HCV chez les individus qui ont montré une réactivité positive au test ELISA. Cette analyse est très spécifique, car la présence d'anticorps contre chacune des différentes protéines du VHC est évaluée sous forme de bandes individuelles sur une bandelette membranaire [90]. Ce test comprend des protéines recombinantes et des peptides synthétiques des régions hypervariables E2, de l'hélicase NS3, des régions NS4A, NS4B et NS5A.
En raison de la sensibilité et de la spécificité élevées des ELISA anti-VHC, RIBA n'est plus nécessaire dans les laboratoires de diagnostic pour la vérification [19, 45]. De plus, les tests d'acide nucléique pour l'ARN viral plutôt que pour RIBA sont utilisés comme test de confirmation d'infection par le VHC [74].
L'infection par le VHC peut être facilement détectée à l'aide des tests ELISA de troisième génération actuellement disponibles [81]. De plus, l’utilisation de tests rapides peut faciliter le dépistage du VHC. Cependant, ces tests virologiques indirects permettant de détecter les anticorps anti-VHC ne
24
Détection d'ARN viral
Selon les éléments utilisés pour l'amplification, les tests d'amplification d'acide nucléique sont divisés en méthodes d'amplification de cible, d'amplification de signal et d'amplification par sonde [93]. Les méthodes d'amplification cibles (par exemple, la réaction en chaîne par polymérase par transcription inverse (RT-PCR) et l'amplification médiée par la transcription (TMA)) et les méthodes d'amplification du signal (par exemple, l'ADN ramifié (ADNc)) étaient couramment utilisées pour détecter la présence d'ARN du VHC [74,83,85,94]. La présence d'ARN du VHC dans le sérum est un marqueur fiable de la virémie.
L’Organisation mondiale de la santé (OMS) a établi une norme internationale pour les unités de quantification d’ARN du VHC [95], c’est-à-dire une unité internationale (UI) d’ARN du VHC, qui est actuellement utilisée dans tous les tests quantitatifs commerciaux d’ARN du VHC, quelles que soient les techniques utilisées.[69,96].
Détection qualitative d’ARN du VHC [83] : Les tests de détection qualitative reposent sur le principe de l’amplification de la cible par RT-PCR ou TMA. L'ARN du VHC est extrait et converti en ADN complémentaire (ADNc) en utilisant la transcriptase inverse. L'ADNc est ensuite traité via des réactions enzymatiques cycliques conduisant à la génération d'un grand nombre d'ADN double brin dans des tests basés sur la PCR ou d'ARN simple brin dans la TMA. La détection de ces produits amplifiés est obtenue par hybridation des amplicons produits sur des sondes spécifiques. En général, la région hautement conservée 5’UTR est la cible de choix pour la détection de l’ARN génomique du VHC à travers différents génotypes [85].
Détection quantitative de l'ARN du VHC [83] : l'ARN du VHC peut être quantifié à l'aide de techniques d'amplification de cible (RT-PCR ou TMA en temps réel) ou d'amplification de signal (dosage de l'ADN b). La RT-PCR en temps réel est la méthode de choix pour la quantification des niveaux d'ARN du VHC en pratique clinique. Cette analyse est très sensible avec une large gamme dynamique de quantification.
L'ARN du VHC dans le sérum est probablement le premier marqueur détectable d'infection aiguë par le VHC, précédant de plusieurs semaines l'apparition des anticorps anti-VHC [69]. L’infection par l’hépatite C chronique se définit comme la présence d’ARN du VHC plus de 6 mois. Les taux d'ARN du VHC restent relativement stables au fil du temps chez les patients CHC. Par conséquent, après une réaction positive recherchée par le test des anticorps anti-VHC, les NAT pour détecter l'ARN du VHC sont souvent utilisés comme outil de confirmation pour diagnostiquer une infection par CHC [97]. La détection de l'ARN du VHC est également utilisée pour déterminer la charge virale avant et pendant les traitements antiviraux. D'autre part, le niveau d'ARN du VHC n'a aucune valeur pronostique [98]. Le niveau d'ARN génomique du VHC, qui reflète la réplication du VHC, n'est pas en corrélation avec la gravité de la maladie du foie, ni avec le risque de progression de la maladie du foie vers la cirrhose ou le CHC.
26
le VHC, il a été démontré que le niveau d'antigène central du VHC est fortement corrélé au niveau d'ARN du VHC pour différents génotypes [99]. Ainsi, en raison de son coût peu élevé et de sa facilité de réalisation, l’essai de quantification de l’antigène central du VHC peut être utilisé comme méthode alternative aux NAT pour détecter l’ARN du VHC [80]. Actuellement, la détection de l'antigène central au moyen d'un dosage immunologique par chimiluminescence de microparticules peut être entièrement automatisée dans le test d'antigène de base Architect HCV (Abbott Laboratories) [100]. Le test Architect HCV Ag avait une spécificité de 100%, une limite inférieure de détection de 3 fmol / L correspondant à environ 1000 UI / mL d’ARN du VHC [62]. Alors que les tests actuels d'ARN du VHC ont un niveau de détection inférieur, compris entre 5 et 15 UI / mL [80]. En général, environ 90% des échantillons positifs pour l'ARN du VHC sont positifs avec une charge virale supérieure à 10 000 UI / mL [101], bien dans la plage de sensibilité du dosage de l'antigène central du VHC [80]. Par conséquent, la détection de l'antigène du VHC pourrait être la prochaine étape après un test de dépistage des anticorps positif. Plusieurs analyses combinant la détection des anticorps anti-VHC et de l'antigène principal du VHC ont été développées [102].
À l'heure actuelle, l'ELISA pour détecter l'antigène principal du VHC est trop insensible pour remplacer les NAT afin de détecter l'ARN du VHC dans le cadre d'une banque de sang [103] et dans la surveillance du traitement conformément aux directives de pratique clinique en vigueur. Cependant, il pourrait être utilisé comme test supplémentaire dans les environnements à ressources limitées [104]. Le test Architect HCV Ag a été suggéré comme meilleur outil de surveillance à l’ère des nouveaux traitements antiviraux entièrement oraux, sans interféron, ne nécessitant pas une grande sensibilité analytique [99].