Université de Nice Sophia-Antipolis
UFR Sciences
Ecole Doctorale des Sciences de la Vie et de la Santé
THÈSE
préparée au sein de l’Institut Sophia-Agrobiotech, UMR INRA 1355/UNS/CNRS 7254 présentée publiquement à l’INRA de Sophia-Antipolis
pour obtenir le titre de
Docteur en Sciences
de l’Université de Nice Sophia-Antipolis Discipline : BiologieMention : Biologie des interactions et écologie
Bases génétiques de la résistance
vis-à-vis des nématodes du genre
Meloidogyne chez le piment
par
Arnaud Barbary
Soutenue le 10 Décembre 2014 devant le jury composé de :
Eric Grenier Chargé de Recherche, INRA de Rennes Rapporteur Didier Merdinoglu Directeur de Recherche, INRA de Colmar Rapporteur Jean-Luc Regnard Professeur, Montpellier SupAgro Examinateur Philippe Castagnone Directeur de Recherche, INRA Sophia-Antipolis Directeur de thèse Alain Palloix Directeur de Recherches, INRA Avignon Co-Directeur de thèse Caroline Caporalino Ingénieur de Recherche, INRA Sophia-Antipolis Co-Encadrante
Résumé
Les nématodes à galles du genre Meloidogyne sont des parasites obligatoires du sol extrêmement polyphages. Ils sont considérés comme l’un des pathogènes les plus dévastateurs au monde. La méthode la plus simple et la plus efficace pour lutter contre les nématodes à galles était la lutte chimique. Cependant, la législation sur les produits phytosanitaires interdit désormais l’utilisation des nématicides classiquement utilisés jusqu’ici. Ceci a contribué à la recrudescence des problèmes liés à la gestion des nématodes à galles. L’une des alternatives envisagée afin de protéger les cultures vis-à-vis de ces pathogènes repose sur l’utilisation des résistances naturelles des plantes. Cependant, des populations de nématodes à galles sont capables de contourner ces résistances. De plus, les ressources génétiques en termes de gènes majeurs de résistance (gènes R) sont limitées. Une gestion qui permette de pérenniser l’utilisation de ces ressources d’intérêt agronomique est donc primordiale.
Dans ce contexte, cette thèse visait à déterminer quels sont les facteurs génétiques de la plante qui conditionnent l’efficacité, et par extrapolation la durabilité, des gènes R vis-à-vis des nématodes à galles. Le modèle retenu était le pathosytème Piment/Nématodes à galles. Outre le fait d’être une culture d’intérêt agronomique, le piment possède un nombre relativement important de gènes R, aux caractéristiques bien distinctes. Deux d’entre eux,
Me1 et Me3, ont été retenus dans cette étude. L’hypothèse principale était qu’il existe des
facteurs de résistance partielle, au sein de certains fonds génétiques de plantes, qui jouent un rôle important sur l’efficacité des gènes R vis-à-vis des nématodes à galles et qui évitent que ces derniers soient contournés rapidement par le pathogène.
Ce travail a tout d’abord consisté à étudier l’impact de fonds génétiques de piment aux caractéristiques différentes vis-à-vis des attaques de nématodes à galles de plante sur l’efficacité des gènes Me1 et Me3. Dans ce but, ils ont été introgressés dans un fond génétique soit sensible, soit partiellement résistant, à l’état soit homozygote, soit hétérozygote. Les différents génotypes ainsi créés ont ensuite été soumis à une forte pression d’inoculation de
Meloidogyne incognita, l’espèce de nématode à galles la plus répandue. Il s’est avéré que
l’efficacité des gènes Me1 et Me3 sur le potentiel reproducteur de ces nématodes à galles était fortement affectée par le fond génétique de la plante. D’autre part, il est apparu que l’état allélique de ces gènes n’influençait pas la reproduction du pathogène.
Suite aux résultats précédents, le but a été d’identifier et de localiser des facteurs de résistance partielle vis-à-vis de M. incognita, susceptibles d’expliquer les différences observées entre les différents fonds génétiques. Dans cette perspective, une population F2:3 en
ségrégation vis-à-vis de la résistance partielle à M. incognita a été étudiée. Une nouvelle carte génétique du piment, issue du croisement intraspécifique entre Yolo Wonder (YW), un cultivar partiellement résistant à M. incognita, et Doux Long des Landes (DLL), un cultivar sensible à cette même espèce, a été générée à partir de 326 marqueurs ayant servis à génotyper 130 individus. Cette carte comprend 12 groupes de liaisons, en accord avec le nombre de chromosomes chez le piment, pour une longueur de 1436 cM. La confrontation des données de génotypage aux données de phénotypage de cette population F2:3 vis-à-vis de trois
espèces de Meloidogyne, à savoir M. incognita, M. arenaria et M. javanica a mis en évidence quatre nouveaux loci à caractère quantitatif (QTL) localisés dans deux clusters. Ils sont tous regroupés sur le chromosome P1 du piment, sauf un, efficace vis-à-vis de M. javanica, qui se trouve sur le chromosome P9. Ce cluster, sur le chromosome P1, est décrit pour la première fois vis-à-vis de la résistance aux nématodes à galles.
Au final, cette thèse a permis d’établir un certain nombre de recommandations quant aux génotypes les plus à même de lutter efficacement contre les nématodes à galles, sans que soit remis en cause leur intégrité à plus long terme. Il est ressorti de cette étude l’identification de nouveaux facteurs de résistance (gènes R et QTL) utilisables en sélection. Ce travail ouvre de nouvelles perspectives quant à la sélection de nouvelles variétés avec un potentiel accru en termes de durabilité des gènes majeurs de résistance vis-à-vis des nématodes à galles.
Abstract
Root-knot nematodes (RKNs), Meloidogyne spp., are extremely polyphagous plant soil parasites. They are considered as one of the most damaging pathogen worldwide. A reliable way of controlling these endoparasitic worms is the use of chemical nematicides. However, the use of such compounds was drastically restricted in past years because of environmental and public health issues, which added new constraints with respect to RKN management. Nowadays, one of the best alternatives to cope with nematode infestations relies on the deployment of resistance genes (R-genes). However, some nematode populations proved able to breakdown plant resistance and genetic resources in terms of R-genes are limited. Sustainable management of these valuable resources is thus a key point of R-gene durability.
In this context, the aim of this project was to identify the plant genetic factors that play a role on the efficiency of R-genes against RKNs, and potentially on their durability. For that purpose, the pathosystem Pepper/RKNs was chosen. Pepper is a crop of interest which bears a relatively large number of R-genes with distinct characteristics. Two of them, Me1 and Me3 were studied. The main hypothesis was there are partial resistance factors, within some plant genetic backgrounds, that have a key role on Me1 and Me3 efficiency against RKNs and that prevent them being breakdown quickly.
First, this work evaluated the influence of different pepper genetic backgrounds on the expression of the resistance to RKNs conferred by the Me1 and Me3 R-genes. Accordingly, they were introgressed into either a susceptible or a partially resistant genetic background, in either homozygous or heterozygous allelic status. These genotypes were challenged with a high inoculation pressure of M. incognita, the most spread RKN species. Results showed that the efficiency of Me1 and Me3 in reducing the reproductive potential of RKNs was strongly affected by the plant genetic background. On the other hand, the allelic status of the R-genes has no effect on nematode reproduction (i.e., no dosage allele was detected).
According to these results, our further goal was to identify and to localize partial resistance factors against RKNs which could explain the differences observed between the genetic backgrounds. In this way, they were investigated using a F2:3 population from the
cross between Yolo Wonder (YW), a partially resistant to resistant cultivar (depending on the RKN species considered), and Doux Long des Landes (DLL), a susceptible one. From this cross, a new pepper genetic linkage map was constructed with 326 markers using 130 F2
individuals. This map comprises 12 linkage groups (LGs), in agreement with the number of chromosomes of pepper, and has an overall length of 1436 cM. Focussing on the three main RKNs species, M. incognita, M. arenaria and M. javanica, four new major QTLs were localized on two clusters. They are all regrouped on pepper chromosome P1 except one QTL efficient against M. javanica, which was located on pepper chromosome P9. The cluster on chromosome P1, regrouping most of the newly discovered resistance factors, is described for the first time with respect to RKN resistance.
As a conclusion, four new resistance factors were localized in the pepper genome and are now available for breeding. In addition, recommendations were established in order to use pepper genetic backgrounds able to reinforce R-genes efficiency and to lower the risk of breakdown by RKNs. Therefore, this work should contribute to the breeding of new pepper varieties with a high level of resistance against RKNs.
Remerciements
Ca y est, nous y sommes… On ne le répètera jamais assez mais trois ans (voire un peu plus !) ça passe vite, très vite !!!
Mes premières pensées vont à Caroline, Philippe et Alain. Merci à vous trois pour tout ce que vous m’avez apporté durant ma thèse. Vos différents domaines de prédilection ont été une vraie force pour mon projet de thèse. Merci à toi, Caroline, de m’avoir impliqué dans tes projets et fait découvrir les joies du terrain. Merci à toi, Philippe, de m’avoir fait partager tes connaissances en nématologie. Merci également à toi, en tant que directeur de thèse, de t’être occupé d’une grande partie de la paperasse administrative, surtout avec la malchance qui m’a caractérisé dans ce domaine depuis que cette thèse a commencé. Merci à toi, Alain, pour nos échanges sur le piment et l’importance de la diversité. Vous étiez toujours à l’écoute et disponibles quand j’avais besoin de vous. Chose appréciable, vous étiez également toujours sur la même longueur d’onde. Avoir un « chef » ça peut être compliqué, alors trois !!! Mais ces trois responsables là, je les recommande sans hésitation. La dernière ligne droite a été un peu tortueuse, mais j’espère avoir été à la hauteur de vos attentes.
Je remercie les entreprises privées qui ont accepté de financer ce projet : Gautier semences, Rijk Zwaan, Sakata, Syngenta, Takii semences et Vilmorin & Cie.
Je tiens à remercier particulièrement M. Eric Grenier, M. Didier Merdinoglu et M. Jean-Luc Regnard d’avoir accepté de faire partie de mon jury de thèse.
Merci également aux personnes qui ont assisté à mon comité de thèse : Mme Régine Delourme, M. Nicolas Pauly, M. Didier Merdinoglu et M. Marc Villevieille.
Cette thèse n’aurait pas été ce qu’elle a été sans « La semera », « La inoculera », « La lavagera » (ne cherchez pas, ce sont des barbarismes !), je veux parler de Nath bien sûr ! Merci pour ton investissement sans faille dans mon projet de thèse. Tu as toujours été là quand il le fallait et c’est en partie grâce à toi si je ne suis pas encore dans le hangar HV04 en train de laver des racines (nous y reviendrons…). J’espère que tu considères que ton troisième accouchement s’est bien passé.
Merci également à Ariane pour l’aspect labo. Tes conseils m’auront été précieux et si mes gels d’acrylamide sont aussi beaux, c’est en partie grâce à toi. Et c’est sans compter sur le fait que nous étions faits pour être dans le même bureau, préférant la chaleur estivale au froid de la climatisation.
Un petit saut dans le bureau d’à côté, afin de remercier Laurent Lapeyre, ma ficanasse préférée. Ce fut un réel plaisir de partager le labo avec toi. Ta bonne humeur et tes petites blagounettes vont me manquer.
Je tiens également à remercier très chaleureusement Delphine, Chami, Christina et Pierre pour leur aide inestimable. Compter des masses d’œufs sur des milliers de racines n’est pas ce qu’il y a de plus passionnant, mais vous l’avez fait sans rechigner, dans la joie et la bonne humeur.
Merci à tous les membres de l’équipe IPN pour tous les échanges que j’ai pu avoir avec eux. Merci pour votre implication lors des séances de lavage de racines (nous y revoilà !). Cela ne valait pas une bonne oursinade ou un bon pan bagnat, mais j’espère que vous garderez de bons souvenirs de ces semaines passées dans le hangar HV04.
Restons dans l’équipe IPN. Merci à Chantal pour avoir passé mes commandes de dernière minute (comment ça je fais toujours tout au dernier moment ?!). Surtout, surtout, pense à garder les procédures de « comment renvoyer trois fois un congélateur avant d’avoir le bon ?» et « comment se faire des amis au SAV des vendeurs de loupe ?».
J’ai une pensée spéciale pour Sophie, ma « petite sœur de thèse ». Si je t’ai laissée soutenir la première, c’est par pure courtoisie ;-) Merci de ton soutien, quand j’en avais besoin, de tes gâteaux, quand j’en avais besoin, de tes infos, quand j’en avais besoin, etc. J’ai été ravi de partager cette expérience qu’est la thèse en ta compagnie.
Un petit tour dans l’équipe SPIBOC pour remercier tout particulièrement Martine Da Rocha. Ah les formats de fichier !!! En plus, tu m’as presque convaincu que Linux, c’est bien !
Merci également aux personnes d’Avignon. Je pense notamment à Anne-Marie, Ghislaine, Bruno, Anne, Alexandre, Véronique et Bernard. Merci pour votre accueil toujours aussi chaleureux lors de mes petites escapades échantillonnage et extraction.
J’ai également fait d’autres belles rencontres lors de ces quelques années. Merci à Isa, Karine, Jo et Mika pour m’avoir fait découvrir cette belle région que sont les Alpes-Maritimes. Je retiendrai surtout qu’il y a beaucoup d’araignées dans le Daluis ;-)
Je ne me risquerai pas à citer tous les noms, mais merci à toutes les personnes du beach volley, des soirées karaoké et des soirées Sangate pour tous ces moments de convivialité.
Merci à vous, doctorants et post-doctorants, pour votre implication dans le Journal Club. J’espère que ce petit moment « à nous » va perdurer.
Merci à toutes les personnes que j’ai côtoyées durant mon passage à l’institut, mais qui sont trop nombreuses pour que je les cite toutes. Je ne garde que des bons souvenirs.
J’ai une pensée particulière pour mes parents, qui m’ont toujours laissé libre dans mes choix et qui m’ont toujours soutenu dans tout ce que j’ai entrepris jusqu’à maintenant.
Enfin, comme il est de coutume de garder le meilleur pour la fin, je tiens à remercier du fond du cœur ma douce et tendre, Aurélie, pour m’avoir suivi à l’autre bout de la France, mais également pour m’avoir supporté et soutenu durant ma thèse. Mais surtout, surtout, je te remercie d’avoir accepté que je t’abandonne si souvent pour une autre belle plante … le piment.
Liste des abréviations
ADN : Acide DésoxyriboNucléique
AMM : Autorisations de Mise sur le Marché ANOVA : Analyse de Variance
ANRT : Association Nationale Recherche Technologie
BC1-S1 : une génération de backcross suivie d’une génération d’autofécondation BC2-S1 : deux générations de backcross suivies d’une génération d’autofécondation BYDV : Barley Yellow Dwarf Virus
CIFRE : Conventions Industrielles de Formation par la REcherche CIM : Composite Interval Mapping
cM : centiMorgan
CM334 : Criollo de Morelos CMV : Cucumber Mosaic Virus
CRB : Centre de Ressources Biologiques DAMP : Damage-Associated Molecular Pattern DLL : Doux Long des Landes
ETI : Effector-Triggered Immunity ETS : Effector-Triggered Susceptibility FAO : Food and Agriculture Organization
GAFL : Génétique et Amélioration des Fruits et Légumes H2O2 : peroxyde d’hydrogène
HD : haploïde doublé
HR : Hypersensitive Response
INRA : Institut National de la Recherche Agronomique IPN : Interactions Plantes-Nématodes
ISA : Institut Sophia Agrobiotech
J2 : larves juvéniles au stade pré-parasitaire jai : jours après inoculation
LOD score : Logarithme of the odds : logarithme des probabilités MAMP : Microbe-Associated Molecular Pattern
NBS - LRR : Nucleotide Binding Site - Leucine Rich Repeat NIL : Near Isogenic Line
O2- : ion superoxyde
O3 : ozone
OCDE : Organisation de Coopération et de Développement Économiques PAMP : Pathogen-Associated Molecular Pattern
pb : paires de base
PCR : Polymerase Chain Reaction PRR : Pattern-Recognition Receptor PTI : PAMP-Triggered Immunity PVY : Potato Virus Y
QRL : Quantitative Resistance Loci QTL : Quantitative Trait Loci
SAM : Sélection Assistée par Marqueurs
SCAR : Sequence Characterized Amplified Region SNP : Single Nucleotide Polymorphism
SIM : Simple Interval Mapping
SSCP : Single Strand Conformation Polymorphism SSR : Simple Sequence Repeat
TMV : Tobacco Mosaic Virus TSWV : Tobacco Spot Wilt Virus
UIPP : Union des Industries de la Protection des Plantes UMR : Unité Mixte de Recherche
UR : Unité de Recherche YW : Yolo Wonder
Table des matières
INTRODUCTION GENERALE……….….14
CHAPITRE I : SYNTHESE BIBLIOGRAPHIQUE……….………..17
1. Evolution des pratiques agricoles ... 18
2. Les mécanismes de défense des plantes : caractéristiques et limites ... 20
2.1 Concepts liés aux interactions plante-pathogène ... 20
2.2 Les mécanismes de défense basale des plantes ... 22
2.2.1 Les mécanismes de défense basale pré-infectieux ... 22
2.2.2 Mécanismes de défense basale post-infectieux ... 23
2.3 Les mécanismes de défense spécifique des plantes ... 25
2.3.1 L’interaction « gène pour gène » ou modèle de Flor ... 25
2.3.2 Le cas des gènes de résistance récessifs ... 30
2.3.3 La résistance variétale quantitative ... 31
2.4 Limites à l’utilisation des résistances chez les plantes ... 34
3. Durabilité des résistances chez les plantes ... 37
3.1 Définition ... 37
3.2 Lien entre durabilité et type de résistance ... 38
3.3 Stratégies de gestion des résistances ... 39
4. Le pathosystème piment / nématodes à galles ... 40
4.1 Le piment ... 40
4.1.1 Origine et répartition ... 40
4.1.2 Diversité et importance économique ... 41
4.1.3 Biologie et caractéristiques génétiques ... 43
4.1.4 Les agents pathogènes du piment ... 45
4.2 Les nématodes à galles ... 46
4.2.1 Caractéristiques générales ... 46 4.2.2 Importance économique ... 49 4.2.3 Biologie ... 49 4.2.4 Méthodes de lutte ... 51 4.2.4.1 La lutte chimique ... 51 4.2.4.2 La lutte physique ... 52 4.2.4.3 La lutte culturale ... 52 4.2.4.4 La lutte biologique ... 53 4.2.4.5 La lutte génétique ... 56
4.3 Les résistances aux nématodes à galles chez le piment ... 56
CHAPITRE II: MATERIEL ET METHODES………...……….64
1. Matériel végétal ... 65
1.1 Lignées parentales utilisées dans cette étude. ... 65
1.2 Populations utilisées pour l’étude de l’effet du fond génétique de la plante sur les gènes majeurs ... 66
1.3 Populations utilisées pour l’étude des résistances partielles ... 68
2. Nématodes utilisés dans cette étude ... 68
2.1 Utilisation de souches issues d’une collection internationale de Meloidogyne ... 68
2.2 Utilisation d’une lignée virulente vis-à-vis de Me3 ... 69
3. Expérimentations ... 69
3.1 Dispositifs expérimentaux ... 69
3.1.1 Etude de l’effet du fond génétique de la plante sur les gènes majeurs ... 69
3.1.2 Etude de la résistance partielle ... 70
3.2 Conditions expérimentales ... 70
3.3 Système de notation ... 71
4. Etudes moléculaires ... 72
4.1 Extraction d’ADN génomique ... 72
4.1.1 Extraction d’ADN génomique de plante ... 72
4.1.2 Extraction d’ADN génomique de Meloidogyne à partir d’une femelle ... 72
4.2 Marquage moléculaire ... 73
4.2.1 Détermination du statut allélique d’une plante aux locus Me3 et Me1 ... 73
4.2.2 Génotypage de la population F2 [YW x DLL] ... 73
4.2.3 Identification d’espèces de Meloidogyne ... 74
5. Utilisation de logiciels scientifiques ... 75
5.1 Analyses statistiques ... 75
5.2 Construction d’une carte génétique à partir du croisement [YW x DLL] ... 75
5.3 Localisation de nouveaux facteurs de résistance ... 76
CHAPITRE III: RESULTATS………..………...77
1. Etude des effets du fond génétique de la plante et du dosage d’allèles sur le gène majeur Me3 ... 78
1.1 Phénotype des génotypes témoins de l’expérimentation ... 80
1.2 Effet de l’augmentation d’un fond génétique sensible sur l’efficacité de Me3 ... 81
1.3 Effet de l’augmentation d’un fond génétique partiellement résistant sur l’efficacité de Me3 ... 81
1.4 Comparaison d’un fond génétique sensible et d’un fond génétique partiellement résistant sur l’efficacité de Me3 ... 82
1.5 Effet du fond génétique en l’absence d’allèle résistant au locus Me3 ... 82
2. Etude de l’effet du fond génétique de la plante sur le gène majeur Me1 ... 83
2.1 Phénotype des génotypes témoins de l’expérimentation ... 85
2.2 Effet de l’augmentation d’un fond génétique sensible sur l’efficacité de Me1 ... 86
2.3 Effet de l’augmentation d’un fond génétique partiellement résistant sur l’efficacité de Me1 ... 86
2.4 Comparaison d’un fond génétique sensible et d’un fond génétique partiellement résistant sur l’efficacité de Me1 ... 86
2.5 Effet du fond génétique en l’absence d’allèle résistant au locus Me1 ... 87
2.6 Effet du dosage d’allèles sur l’efficacité de Me1... 87
3. Etude de l’effet d’une souche virulente Me3 sur différents génotypes de piment en fonction du fond génétique ... 88
4. Identification et localisation de nouveaux facteurs de résistance vis-à-vis des nématodes à galles ... 89
4.1 Réalisation d’une carte génétique du croisement entre [YW x DLL] ... 89
4.1.1 Construction de la carte avec Mapmaker ... 89
4.1.2 Vérification de la qualité de la carte génétique et optimisation avec R/qtl ... 92
4.2 Etude des ségrégations des familles F2:3 vis-à-vis de leur résistance à différentes espèces de nématodes à galles ... 93
4.2.1 Cas de l’espèce M. incognita ... 94
4.2.2 Cas de l’espèce M. arenaria ... 95
4.2.3 Cas de l’espèce M. javanica ... 95
4.3 Localisation de nouveaux facteurs de résistance vis-à-vis de différentesespèces de nématodes à galles. ... 96
4.3.1 M. incognita ... 97
4.3.2 M. arenaria ... 99
4.3.3 M. javanica ... 99
CHAPITRE IV: DISCUSSION………..………103
1. Facteurs génétiques qui influencent l’efficacité des gènes de résistance ... 104
1.1 Impact de l’effet du dosage d’allèles ... 104
1.2 Impact du fond génétique des lignées receveuses sur l’efficacité des gènes majeurs ... 105
1.3 Considération du fond génétique de la plante dans les schémas de sélection ... 107
2. Construction d’une nouvelle carte génétique à partir du croisement [YW x DLL] : intérêts et contraintes ... 108
3. Phénotypage de la résistance aux nématodes à galles par comptage du nombre de masses d’œufs par plante : un choix réfléchi. ... 110
4. Identification et localisation de nouveaux facteurs de résistance vis-à-vis de Meloidogyne spp. ... 111
4.1.1 Minc-P1 : un QTL majeur sur le chromosome P1 du piment ... 111
4.1.2 QTL mineurs vis-à-vis de M. incognita ... 112
4.2 Mare-P1 : nouveau facteur de résistance vis-à-vis de M. arenaria ... 112
4.3 Nouveaux facteurs de résistance vis-à-vis de M. javanica ... 113
4.3.1 Mjav-P9 : QTL majeur sur le chromosome P9 du piment ... 113
4.3.2 Mjav-P1 : QTL majeur sur le chromosome P1 du piment ... 114
4.4 Minc-P1, Mare-P1 et Mjav-P1 forment-ils un nouveau cluster sur le chromosome P1 du piment ? ... 114
5. Intérêt de l’apport de nouveaux facteurs de résistance vis-à-vis des nématodes à galles dans les programmes de sélection ... 116
CHAPITRE V: CONCLUSION GENERALE ET PERSPECTIVE………..119
REFERENCES BIBLIOGRAPHIQUES………124
14
Introduction générale
Cette thèse CIFRE, intitulée « Bases génétiques de la durabilité de la résistance aux nématodes du genre Meloidogyne chez le piment », est le résultat d’un partenariat entre de nombreux partenaires du secteur public et du secteur privé. Deux unités de recherche de l’INRA sont impliquées dans ce projet. D’une part, l’UMR Institut Sophia Agrobiotech (ISA) de Sophia Antipolis, et plus précisément l’équipe Interactions Plantes-Nématodes (IPN), possède, en termes de nématologie, tout le matériel et toutes les infrastructures nécessaires au bon déroulement de ce projet. De plus, elle est reconnue au niveau mondial pour ses travaux. D’autre part, l’UR Génétique et Amélioration des Fruits et Légumes (GAFL) d’Avignon a largement participé à ce projet par l’apport de matériel de piment original. Cette unité héberge notamment un Centre de Ressources Biologiques (CRB) pour le piment, et est en mesure de répondre à des demandes particulières en termes de création de nouveau matériel végétal. De cette manière, il est notamment possible d’étudier de nouvelles sources de résistance vis-à-vis des pathogènes des plantes, en particulier les résistances quantitatives. Cette thèse est en partie financée par un consortium de six entreprises privées (Gautier semences, Rijk Zwaan, Sakata, Syngenta, Takii semences et Vilmorin & Cie), intéressées par le sujet qui s’inscrit dans leurs stratégies de sélection et dont les résultats auront des répercussions directes sur leurs futurs choix. L’autre partie du financement provient de l’Association Nationale Recherche Technologie (ANRT), qui, à travers le dispositif CIFRE, encourage les partenariats Doctorant/Laboratoire public/Entreprise privée sur des sujets aux enjeux scientifiques et socio-économiques importants comme c’est le cas de ce projet.
Les nématodes du genre Meloidogyne sont des parasites obligatoires du sol que l’on retrouve partout dans le monde. Ils provoquent chaque année des pertes vis-à-vis des agriculteurs qui atteignent plusieurs dizaines de milliard de dollars et peuvent provoquer jusqu’à 40% de pertes de rendement (Sasser et Freckman, 1987). Ces vers extrêmement polyphages sont capables d’infester plus de 5500 espèces végétales dont la majorité des espèces cultivées, que ce soit les grandes cultures ou les cultures maraîchères, florales et fruitières. Ils sont considérés comme l’un des pathogènes les plus importants au monde (Trudgill et Blok, 2001). La méthode la plus simple et la plus efficace pour lutter contre les nématodes à galles était la lutte chimique. Cependant, aujourd’hui, quasiment tous les
15 nématicides chimiques sont interdits. Ceci a contribué à la recrudescence des problèmes liés aux nématodes, notamment pour les maraîchers dont les cultures couramment utilisées dans les rotations culturales (tomate, poivron, laitues, melon, courgette…) sont toutes attaquées par les populations de nématodes présentes dans le sol. Plusieurs méthodes de lutte alternatives existent : des méthodes de luttes dites « physiques », d’une part, telles la désinfection à la vapeur et la solarisation et des méthodes de lutte biologique, d’autre part, avec l’utilisation d’auxiliaires naturels (champignons nématophages, bactéries parasites, etc.) ou de toxines de plantes nématicides. Cependant, toutes ces méthodes restent largement insatisfaisantes (Djian-Caporalino et al., 2009). L’une des alternatives qui paraît la plus prometteuse est l’emploi de gènes de résistance aux Meloidogyne. Cette solution a notamment été retenue par les semenciers qui ont mis en place des programmes de sélection de variétés et/ou porte-greffe résistants d’espèces maraîchères. Cependant, les ressources en gènes de résistance vis-à-vis des nématodes à galles sont limitées et l’introgression de tels gènes dans une variété d’intérêt agronomique prend du temps. De plus, les nématodes à galles sont capables de contourner ces gènes de résistance avec le temps. Il est donc primordial d’utiliser les ressources génétiques à bon escient et de gérer les gènes majeurs disponibles dans un objectif de résistance durable. L’exemple du gène Mi-1 de la tomate abonde dans ce sens. Les cultivars de tomate résistants disponibles à l'heure actuelle à l’échelle mondiale sont tous porteurs de ce gène, introgressé à partir d'une seule plante hybride interspécifique. Ceci explique en partie l'extension des populations virulentes vis-à-vis de ce dernier (Castagnone-Sereno, 2002). Cette tendance semble s'amplifier aujourd’hui, et par conséquent pourrait réduire significativement la durée d'exploitation des variétés résistantes commercialisées. Outre l’utilisation des mêmes sources de résistance pour la sélection variétale, le rôle du fond génétique dans lequel est introgressé le gène de résistance semble également être primordial. En effet, plusieurs études sur des pathosystèmes très différents tels que virus-piment (Palloix et al., 2009), phoma-colza (Brun et al., 2010) ou encore nématode à kyste-pomme de terre (Fournet et al., 2013) ont montré que le fond génétique joue un rôle important sur le risque de contournement d’un gène majeur ou d’un QTL (Quantitative Trait Locus) à effet fort de résistance au pathogène. L’exploitation des ressources génétiques doit donc être accompagnée pour optimiser la durabilité des gènes majeurs de résistance aux nématodes à galles utilisés à mettre en relation avec les fonds génétiques dans lesquels ils sont introgressés, ceci afin de conférer aux plantes une protection efficace, de haut niveau de résistance et qui agisse sur un spectre large d’espèces de
16 Le modèle d’étude retenu pour cette thèse est le couple Nématodes à galles (Meloidogyne spp.)/Piment (Capsicum annuum). La problématique générale est de déterminer quels sont les facteurs génétiques de l’hôte (de la plante) qui conditionnent l’efficacité des résistances majeures. La thèse se focalise plus particulièrement sur l’importance du fond génétique dans cette efficacité. La première question à résoudre est de savoir quel est l’impact du fond génétique de la plante sur l’efficacité des gènes majeurs. Le premier objectif de cette thèse est donc de comparer les pressions de sélection opérées par différents génotypes (test de différents gènes majeurs de résistance, dans divers fonds génétiques, à différents états alléliques) de piment sur les nématodes à galles. Suite aux différences observées, la question suivante a été de déterminer quels sont les facteurs qui permettent d’expliquer ces différences entre fonds génétiques. L’objectif suivant a donc été d’identifier et de localiser les facteurs génétiques qui expliquent ces différences et de déterminer quels sont ceux qui permettent effectivement de prolonger la durabilité des résistances majeures.
Au final, cette thèse devrait apporter des réponses sur le type de cultivar à adopter en création variétale, à savoir quel gène majeur employer, dans quel fond génétique, et plus généralement quelles sont les conditions génétiques à favoriser ou à éviter pour une résistance efficace vis-à-vis des attaques de Meloidogyne.
Ce manuscrit se compose de cinq chapitres. Le chapitre I est une synthèse bibliographique qui resitue ce projet dans son contexte. Tout d’abord il dresse un rapide état des lieux de l’évolution des pratiques agricoles ces dernières années. Ensuite, il décrit les différents types de défense que l’on peut rencontrer chez les plantes, et leurs limites. Enfin, il décrit le pathosystème nématode à galles/piment et expose en quoi il constitue un bon modèle pour l’étude de l’efficacité des résistances chez les plantes. Le chapitre II expose les matériels et méthodes utilisés au cours de cette thèse, qui ont permis de répondre aux questions posées. Le chapitre III présente les résultats obtenus et apporte des réponses sur l’origine des différences observées sur l’efficacité des résistances des plantes. Ces résultats sont discutés plus largement dans le chapitre IV. Enfin, le chapitre V résume les principaux enseignements à tirer de ce travail et expose les perspectives qu’il procure.
17
CHAPITRE I :
SYNTHESE
18
1. Evolution des pratiques agricoles
Depuis les années 60 jusqu’à aujourd’hui, les pratiques agricoles ont considérablement changé. En particulier, on a assisté à l’emploi massif de pesticides chimiques (herbicides, fongicides, insecticides, nématicides, etc.), ce qui a largement participé à augmenter la productivité des cultures au niveau mondial. En 2011, en France, la consommation de pesticides était de 62700 tonnes (dont 48800 tonnes de produits de synthèse) pour un marché estimé à 1,9 milliard d’euros (source : UIPP, consulté le 12/03/2014). La France est le plus gros consommateur de pesticides en Europe et le deuxième des pays de l’Organisation de Coopération et de Développement Economiques après les Etats-Unis (source : OCDE, consulté le 12/03/2014). Cet engouement pour les pesticides s’explique du fait que c’est un moyen économiquement viable de lutter contre les ravageurs des cultures (Cooper et Dobson, 2007). On estime au quadruple le retour sur investissement de l’usage de pesticides dans la lutte contre les ravageurs (Pimentel, 1997). Sans eux, on estime que 30 à 40 % des récoltes seraient détruites par les maladies et les insectes dans le monde (source : IUPP, consulté le 12/03/2014). Cependant, une prise de conscience de leur dangerosité, à la fois pour la santé humaine et l’environnement, a conduit à totalement repenser leur usage. Dans certains pays, des mesures drastiques ont été prises pour limiter leur emploi. Par exemple, la directive européenne 91-414 a encouragé les états membres de l’Union Européenne à réétudier les Autorisations de Mise sur le Marché (AMM) des produits phytosanitaires. Cela a conduit au retrait d’environ 2/3 des matières actives, en particulier les plus anciennes (Pinochet et al., 2013). En France, suite au Grenelle de l’Environnement de 2008 a été mis en place le plan Ecophyto 2018. Sa mesure phare est de réduire de moitié en 10 ans l’utilisation des produits phytosanitaires en France tout en maintenant une agriculture économiquement performante. La tâche est de taille lorsqu’on sait qu’en France les terres arables ont diminué de moitié en 50 ans, que la population mondiale ne cesse d’augmenter et que la demande en denrées alimentaires est croissante. Les agriculteurs se retrouvent donc dans une situation délicate où ils doivent produire autant (voire plus) tout en modifiant leurs pratiques. C’est pourquoi il a fallu trouver des alternatives aux pesticides.
La monoculture, qui consiste à cultiver la même espèce (voire la même variété) sur les mêmes parcelles au fil des ans, est très pratiquée en agriculture, surtout pour les grandes cultures. Elle permet d’avoir une culture homogène, et facilite, entre autres, la récolte. Or, ce mode de gestion offre un terrain favorable à l’émergence et la propagation des maladies (Zhu et al., 2000). Afin de limiter au maximum les problèmes liés aux pathogènes, il est important
19 d’alterner les cultures. L’objectif des rotations culturales n’est pas d’éradiquer complètement les populations de bioagresseurs mais de freiner leur développement afin de les maintenir sous un seuil de nuisibilité acceptable. Cette méthode implique une réflexion au niveau des espèces cultivées, de leur ordre de succession et de leur fréquence de retour (Bailey et Lazarovits, 2003). En plus de casser le cycle du pathogène, elle peut s’avérer bénéfique à la régénération des sols. C’est par exemple le cas des légumineuses qui apportent des matières azotées naturelles et évitent l’ajout massif de nitrates synthétiques. Cependant, cette pratique est peu mise en application, notamment en maraîchage, car les systèmes de culture sont devenus de plus en plus spécialisés et sont sous la contrainte d’impératifs économiques et commerciaux (Navarrete et al., 2006). De plus, elle n’est efficace que sur les pathogènes peu polyphages qui sont inféodés à une ou quelques espèces végétales et pour lesquels il est facile de trouver des cultures non hôtes. Par exemple, les infestations liées à Gaeumannomyces graminis et
Ramulispora herpotrichoides chez le blé sont particulièrement bien contrôlées. Un an de
coupure avec une culture non hôte, en remplacement de la monoculture de céréale d’hiver habituelle, suffit à endiguer la maladie (Innocenti et al., 2000; Colbach et al., 1995; Wiese, 1987). En revanche, les bénéfices de la rotation culturale sont moins évidents vis-à-vis de maladies liées à des espèces de champignons polyphages telles que les fusarioses (Fusarium spp.) ou les rhizoctones (Rhizoctonia spp.). En effet, ces champignons ont un large spectre d’hôtes, et même en présence d’une espèce non hôte, ils possèdent des formes de survie qui leur permettent de subsister plusieurs années dans le sol. Cela explique en partie la raison pour laquelle l’alternance d’une culture de blé avec d’autres cultures ne permet pas de réduire significativement l’impact de la maladie liée à ces champignons (Innocenti et al., 2000).
En prenant en compte le fait que les pathogènes des plantes s’inscrivent dans une chaîne trophique, et qu’ils sont eux-mêmes source de nourriture pour d’autres êtres vivants, s’est développée une autre forme de protection des cultures utilisée depuis le XIXe siècle et en
plein essor aujourd’hui : la lutte biologique (Malausa, 2000). L’un des exemples les plus connus de cette pratique est l’utilisation de coccinelles (Obrycki et Kring, 1998), notamment vis-à-vis de la lutte contre les pucerons. Cette technique offre l’avantage d’être respectueuse de l’environnement et de la santé humaine, si elle est couronnée de succès ! En effet, une fois lâchés dans la nature, les auxiliaires utilisés sont difficilement contrôlables. Il ne faut donc pas se tromper car les conséquences peuvent être dramatiques si les espèces introduites en lutte biologique ont des effets non intentionnels sur des espèces autres que le pathogène ciblé. Heureusement, cet évènement reste relativement rare (van Lenteren et al., 2006).
20 Même si certains bioagresseurs sont capables d’attaquer plusieurs centaines d’espèces de plantes, comme le puceron Aphis gossypii par exemple (Inaizumi, 1980), fort heureusement, les plantes ne sont pas affectées par l’ensemble des pathogènes qu’elles rencontrent. Des liens plus ou moins étroits se sont établis entre eux. Ainsi, le puceron cendré du pommier (Dysaphis plantaginea) n’infecte que cette espèce (Malus domestica) (Lathrop, 1928). En effet, dans la majorité des cas, les agents pathogènes sont inféodés à un nombre restreint d’espèces végétales. De très nombreux auteurs (par exemple, cités par Lucas, 1998 et Hammond-Kosack et Jones, 2000) ont étudié les mécanismes de résistance des plantes, et de très nombreux articles indiquent qu’elles utilisent des réponses physiques et biochimiques pour lutter contre les pathogènes. L’exploitation des résistances naturelles des plantes s’avère être une des meilleures alternatives à l’emploi de pesticides chimiques car elles sont sans danger pour l’environnement et la santé humaine et leur utilisation est économiquement viable. Elles sont des éléments clés pour le contrôle des agents pathogènes et le développement de systèmes de rotation efficaces (Starr et al., 2002). Par conséquent, la sélection pour la résistance aux maladies est devenue un sujet important dans la plupart des programmes d’amélioration des cultures.
2. Les mécanismes de défense des plantes : caractéristiques et
limites
2.1 Concepts liés aux interactions plante-pathogène
Le concept de résistance, qui s’oppose à celui de sensibilité, repose uniquement sur l’effet qu’a une plante sur la reproduction d’un pathogène. On parle de résistance totale lorsqu’un pathogène est incapable de se reproduire sur une plante et que sa descendance n’est pas assurée. Une plante sensible, quant à elle, permet au pathogène de réaliser son cycle de développement normalement et assure sa survie. On rencontre une situation intermédiaire où un bioagresseur est capable de se reproduire sur certaines plantes, mais avec un taux de multiplication restreint si l’on le compare à une plante sensible : on parle alors de résistance partielle (Cooper et Jones, 1983). Il ne faut pas confondre résistance/sensibilité avec le terme de tolérance qui fait référence à la capacité d’un plante hôte à supporter une attaque parasitaire, sans que le rendement soit affecté (Schafer, 1971). Ainsi, chez une plante tolérante, un agent pathogène peut pénétrer, migrer et se multiplier sans qu’il n’y ait de graves conséquences sur sa rentabilité.
21 En lien avec ces définitions, et les relations qu’entretiennent les pathogènes et les végétaux, a été établi un autre concept, celui d’interaction incompatible, et par opposition, d’interaction compatible. Lors d’une interaction incompatible sont mis en place par la plante des mécanismes particuliers, qui empêchent le développement du pathogène. Lors d’une réaction compatible, soit les dispositifs de la plante ne sont pas efficaces, soit le pathogène n'est pas reconnu par la plante ou il a établi en retour des mécanismes lui permettant de surmonter les défenses de la plante et de se multiplier normalement.
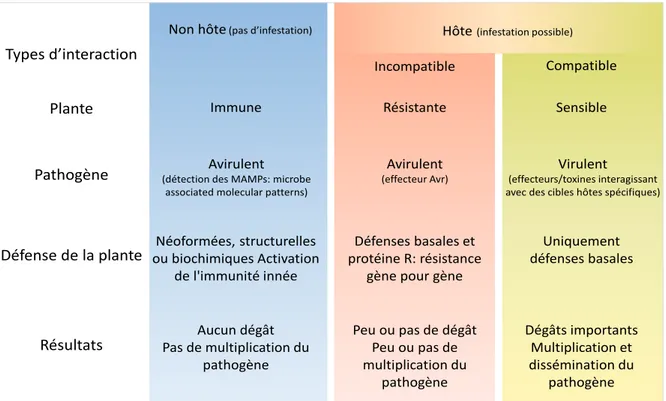
On classe les plantes dans différentes catégories en fonction des relations qu’elles entretiennent avec les différents pathogènes (figure 1). On distingue :
- les plantes hôtes sensibles et non tolérantes qui permettent aux pathogènes de se multiplier, et qui subissent de graves dégâts préjudiciables à leur propre développement. L’interaction est compatible. C’est le pire scénario pour l’agriculteur au niveau de ses récoltes.
- les plantes hôtes sensibles et tolérantes qui ne sont pas ou peu affectées par l’intrusion du pathogène qui se développe normalement. L’interaction est compatible. Ce type de plantes accroît la quantité d’inoculum du pathogène et pose problème lors du retour d’une plante hôte sensible (tolérante ou non tolérante) dans les successions culturales. Cependant, ces génotypes hôtes peuvent contribuer à maintenir une compétition entre populations avirulentes et variants virulents afin d’éviter la montée en fréquence de ces derniers d’autres variétés, sans trop de pertes de rendement.
- Les plantes hôtes résistantes (ou partiellement résistantes) pour lesquelles un pathogène (ou la souche d’un pathogène) n’arrive pas (ou très mal) à réaliser son cycle de développement alors qu’il le peut sur d’autres variétés de la plante en question. L’interaction est incompatible. Cependant, dans certaines situations, ce type de plantes peut subir d’importants dégâts, notamment en présence d’un inoculum important du pathogène par exemple.
- Les plantes non-hôtes pour lesquelles tous les génotypes d’une espèce végétale sont résistants à toutes les souches d’un agent pathogène donné. La plante est dite « immune » vis-à-vis de l’agent pathogène concerné. On considère que c’est le type d’interaction le plus courant (Nurnberger et Lipka, 2005). C’est le cas idéal pour l’agriculteur.
22
Types d’interaction
Non hôte(pas d’infestation) Hôte(infestation possible)
Incompatible Compatible
Plante Pathogène
Immune Avirulent
(détection des MAMPs: microbe associated molecular patterns)
Défense de la plante
Résistante
Néoformées, structurelles ou biochimiques Activation
de l'immunité innée
Résultats Pas de multiplication du Aucun dégât pathogène
Sensible Avirulent
(effecteur Avr) (effecteurs/toxines interagissant Virulent avec des cibles hôtes spécifiques)
Défenses basales et protéine R: résistance
gène pour gène
Uniquement défenses basales Peu ou pas de dégât Peu ou pas de multiplication du pathogène Dégâts importants Multiplication et dissémination du pathogène
Figure 1: Relations entre les plantes et les bioagresseurs, d’après Hammond-Kosack et Kanyuka, 2007 et Cooper et Jones, 1983
Ainsi, les interactions plante-pathogène revêtent plusieurs niveaux. Ces derniers dépendent du degré de défense dont dispose la plante et des moyens dont dispose le pathogène pour passer outre. Le succès ou l’échec de l’invasion résulte de la mise en place de mécanismes plus ou moins complexes de part et d’autre.
2.2 Les mécanismes de défense basale des plantes 2.2.1 Les mécanismes de défense basale pré-infectieux
La composition physico-chimique des cellules végétales et organes végétaux représente un premier obstacle à l’entrée d’un pathogène dans la plante et constitue de ce fait une première ligne de défense pré-infectieuse. Par exemple, la cuticule des feuilles, composée de cutine et de cires, représente une barrière physique préformée des parties aériennes de la plante. Le bois, qu’on peut retrouver au niveau des tiges et des racines, est composé principalement de lignine, un polymère très résistant difficilement franchissable par les bioagresseurs (Hückelhoven, 2007). D’autre part, certaines plantes produisent constitutivement des métabolites secondaires, appelées phytoanticipines, qui représentent une
23 véritable barrière chimique vis-à-vis des pathogènes (van Etten et al., 1994; Bednarek et Osbourn, 2009). Ils agissent comme répulsif, inhibiteur de développement ou toxine. Par exemple, la fragarine, phytoanticipine de la fraise, inhibe la croissance de nombreuses bactéries pathogènes (Filippone et al., 1999). Les glucosinolates, des métabolites secondaires qu’on retrouve notamment chez les Brassicacées, agissent sur de nombreux pathogènes (Baskar et al., 2012). Tous ces mécanismes font partie des défenses basales de la plante et sont de nature passive.
Cependant, même si ces défenses passives parviennent à endiguer la progression de la plupart des agents pathogènes, certains d’entre eux arrivent tout de même à les franchir et à pénétrer plus en avant dans la plante. Ils peuvent, par exemple, s’infiltrer par les stomates ou au niveau de blessures. Ils peuvent également produire des enzymes hydrolytiques qui vont permettre, soit de dégrader la cuticule et les parois cellulaires, soit de métaboliser les phytoanticipines produites par la plante. Cette dernière, en retour, va alors mettre en place des mécanismes actifs de défense.
2.2.2 Mécanismes de défense basale post-infectieux
Lorsque les premières barrières physiques et chimiques de la plante n’ont pas suffi à stopper le pathogène, un deuxième niveau de défense basale, actif cette fois ci, va alors être mis en place. La reconnaissance d’un pathogène par les cellules végétales peut avoir lieu très tôt dans la plante (Keen et Bruegger, 1977). Elle va engendrer un ensemble de cascades métaboliques qui va conduire, suite à l’activation de gènes, à la biosynthèse de novo de protéines. Une fois que le pathogène entre en contact avec la plante, il va libérer des éliciteurs généraux et un premier dialogue moléculaire va s’établir entre le bioagresseur et l’hôte. Bien que très variés, ces éliciteurs généraux ou PAMPs (pour Pathogen-Associated Molecular Patterns) sont très conservés entre les différentes interactions plante-pathogène (Ingle et al., 2006). Ceci s’explique par le fait que ce sont généralement des molécules essentielles à la survie des pathogènes (Nürnberger et al., 2004; Göhre et Robatzek, 2008). La flagelline, le constituant principal du flagelle des bactéries, et le facteur d’élongation bactérien EF-Tu, sont deux PAMPs qui ont été particulièrement bien étudiés (Felix et al., 1999; Kunze et al., 2004). On considère que les produits de dégradation de la cuticule, des parois cellulaires ou encore des phytoanticipines, suite à l’action d’enzymes du bioagresseur, peuvent également jouer le rôle d’éliciteurs généraux (Boller et Felix, 2009). On leur a donné le nom de DAMPs (pour
24 Damage-Associated Molecular Patterns). Ces PAMPs/DAMPs vont être reconnus par la plante via des récepteurs situés à la surface des cellules, les PRR (pour Pattern Recognition Receptors). L’activation de ces récepteurs va alors engendrer un ensemble de cascades métaboliques qui va pouvoir déclencher plusieurs types de réponses physiologiques de la plante (Yamaguchi et Hufferker, 2011; Zhang et al., 2013). Dans un premier temps, il va y avoir des flux d’ions à travers la membrane plasmique qui vont provoquer une alcalinisation du milieu extracellulaire néfaste au développement du pathogène (Schmelzer, 2002). D’autre part, il peut y avoir mise en place d’une réaction hypersensible (HR). Elle se traduit par un burst oxydatif suite à la production rapide et transitoire d’espèces réactives de l’oxygène (ou ROS pour Reactive Oxygen Species) telles que le peroxyde d’hydrogène (H2O2), l’ozone (O3)
ou l’ion superoxyde (O2-) (Shimizu et al., 2010). Cela engendre une mort cellulaire
programmée des cellules infectées par le pathogène qui se retrouve privé des nutriments nécessaires à sa survie. D’autre part, ce burst oxydatif s’accompagne souvent d’un renforcement pariétal suite à un dépôt de callose (polysaccharide) au niveau de l’entrée du pathogène, qui va jouer un rôle de barrière physique supplémentaire (Faulkner et Robatzek, 2012). Il peut également y avoir synthèse de phytoalexines, métabolites secondaires antimicrobiens comparables aux phytoanticipines, mais qui sont produites en réponse à l’entrée du pathogène dans les cellules végétales (Nurnberger et Linka, 2005). Tous ces mécanismes actifs de la résistance basale participent à ce qu’on appelle la PTI (pour PAMP-Triggered Immunity) (Göhre et Robatzek, 2008). Elle constitue le premier niveau de défenses induites et correspond à une immunité innée au sein de la plante (figure 2). Cette résistance basale ou résistance non hôte est peu spécifique et permet de lutter contre la plupart des agents pathogènes. Elle est activée lors de nombreuses interactions entre plantes et agents pathogènes. Cependant, au cours de l’évolution, ces derniers se sont adaptés aux défenses basales de la plante en bloquant les mécanismes mis en jeu. C’est ce qu’on appelle l’ETS (pour Effector-Triggered Susceptibility) (Jones et Dangl, 2006). Toutefois, les couples plante-pathogène étant en perpétuelle coévolution, la plante s’est adaptée en retour par la mise en place d’une résistance spécifique.
25 Figure 2: La résistance non-hôte chez les plantes: mécanismes actifs de la résistance basale, d’après Nurnberger et Linka, 2005 (Les composants pour lesquels un rôle crucial dans la
résistance des espèces végétales a été démontré sont indiqués en bleu. Abréviations: PAMPs, pathogen-associated molecular patterns; MAPK, mitogen-activated protein kinase; FLS2, flagellin sensing 2; MPK6, mitogen-activated protein kinase 6; SGT1, suppressor of G2 allele of Skp1; HSP, heat shock protein; PAD3,
phytoalexin deficient 3; NHO1, non-host resistance 1; PEN, penetration)
2.3 Les mécanismes de défense spécifique des plantes 2.3.1 L’interaction « gène pour gène » ou modèle de Flor
Suite à ses travaux sur l’interaction incompatible entre le lin (Linum usitatissinum) et la rouille du lin (Melampsora lini), Flor (1971) a établi un modèle, connu sous le nom de modèle « gène pour gène », qui a servi de base à l’étude des résistances spécifiques. Ce modèle stipule qu’à chaque gène majeur de résistance (gène R) d’une plante correspond un gène d’avirulence (gène Avr) chez le pathogène. Ces deux caractères (la résistance et l’avirulence) sont dominants et suivent une ségrégation mendélienne. Pour qu’une interaction incompatible ait lieu, il faut que la plante possède au moins un allèle qui confère la résistance et le pathogène au moins un allèle qui confère l’avirulence. Toute autre combinaison conduit à une réaction compatible (figure 3). Lorsqu’une interaction incompatible se produit suite à la mise en place d’une résistance spécifique, on parle d’ETI (pour Effector-Triggered Immunity). Très
26 souvent, cette ETI est à l’origine d’une HR qui se caractérise par la mise en place d’une mort cellulaire au niveau de la zone infectée par l’agent pathogène et bloque sa progression au sein de la plante (Kombrik et Schmelzer, 2001).
Figure 3
d’après Flor, 1971
: L’interaction « gène pour gène » ou modèle de Flor,
Suite aux travaux de Flor, de nombreux gènes R ont été identifiés et clonés (Liu et al., 2007; Joshi et Nayak, 2011). La grande majorité de ces gènes code pour les membres d’une superfamille extrêmement polymorphe de récepteurs intracellulaires de type Nucleotide-Binding Sequences Leucine-Rich Repeat (NBS-LRR ou NLR) (Dangl et al., 2013). Le modèle « gène pour gène » repose a priori sur une interaction directe de type Récepteur-Ligand entre la protéine de résistance R et le facteur d’avirulence Avr. Or, à ce jour, ce type d’interaction directe n’a été démontré qu’à trois reprises (Jia et al., 2000; Deslandes et al., 2003; Doods et al., 2006). Il ne peut donc à lui seul expliquer toutes les interactions hôte-pathogène faisant intervenir un gène R et un gène Avr. Ainsi, d’autres modèles complémentaires ont été proposés.
Dans la majorité des cas, la reconnaissance d’un effecteur par une protéine R se fait de manière indirecte. Le premier système de reconnaissance indirecte qui a été proposé se nomme le modèle « de garde » ou « Guard Model » (figure 4). Ce dernier considère que les protéines R, dites « de garde », jouent un rôle de surveillance vis-à-vis de protéines ciblées par les effecteurs de virulence des pathogènes. Lors de l’interaction d’une protéine végétale
27 cible avec un effecteur, celle-ci changerait de conformation, et c’est ce changement de structure qui serait reconnu par la protéine R et déclencherait la mise en place de réponses adaptées à l’entrée du pathogène dans la plante.
Figure 4: Comparaison des modèles « de garde » ou « Guard Model » et modèle « du leurre » ou « Decoy Model », d’après van der Hoorn et Kamoun, 2008
(les effecteurs sont représentés en gris, les cibles opérationnelles en violet, les protéines « de garde » en vert, les protéines « leurre » en bleu, et la protéine R en
orange)
A l’origine, ce modèle a été proposé pour expliquer le mécanisme de perception du facteur d’avirulence AvrPto de la bactérie Pseudomonas syringae par les protéines Pto et Prf de la tomate (Van der Biezen et Jones, 1998). Il a été généralisé par la suite sur d’autres modèles (Dangl et Jones, 2001). A travers le modèle « de garde », il est notamment possible d’expliquer comment un nombre restreint de gènes R est capable de reconnaître un grand nombre de pathogènes. En effet, les protéines R ne se limiteraient pas à la « surveillance » d’une seule protéine cible mais plusieurs, et donc indirectement à un certain nombre d’effecteurs (van der Hoorn et Kamoun, 2008). Plusieurs modèles ont été proposés afin de
28 décrire les interactions facteur d’avirulence – protéine « gardée » – protéine « de garde » (figure 5).
Figure 5: Comparaison des modèles d’interaction protéine-protéine, d’après Martin et al., 2003 (Les modèles compatibles avec
l'hypothèse "de garde" sont soulignés)
Un des exemples les plus étudiés et qui illustre bien le modèle « de garde » est celui de la protéine RIN4 (RPM1 interacting protein 4) d’Arabidopsis thaliana. Cette protéine est « gardée » par les protéines de résistance RPM1 et RPS2 vis-à-vis des facteurs d’avirulence AvrB, AvrRpm1, AvrRpt2. Deux types de changement structural sont mis en jeu. AvrB et AvrRpm1 phosphorylent RIN4 qui va alors pouvoir être reconnu par RPM1, ce qui va
29 déclencher l’ETI. AvrRpt2, quant à lui, clive RIN4, dont la protéolyse est reconnue par RPS2, ce qui engendre l’ETI (Deslandes et Rivas, 2012). D’autres modes d’activation des protéines « gardées » par les facteurs d’avirulence ont été mis en évidence (Bonardi et Dangl, 2012). Plus récemment, un autre modèle a été proposé afin d’expliquer les interactions indirectes entre protéine R et facteur Avr.
Le modèle « de garde » pose problème d’un point de vue évolutif, ce qui a remis en partie en cause sa validité. En l’absence d’un gène R fonctionnel, la sélection naturelle devrait conduire à diminuer l’affinité de liaison avec l'effecteur et ainsi échapper à sa détection et sa modification. En revanche, en présence d'un gène R fonctionnel, la sélection naturelle devrait favoriser la protéine « gardée » en améliorant l’interaction avec l’effecteur afin de faciliter la perception de l'agent pathogène. Cette situation instable, où deux pressions de sélection contradictoires s’exercent sur le même mécanisme d'interaction protéine « gardée » - effecteur a conduit à proposer d’autres modèles d’interaction.
En plus du modèle « de garde », van der Hoorn et Kamoun (2008) ont proposé le modèle « du leurre » ou « Decoy Model » (figure 4). Il repose sur le concept qu’une cible hôte agit comme un leurre afin de détecter les effecteurs des pathogènes et permettre l’action des gènes
R. Cette protéine « leurre » serait spécialisée, et aurait comme seule et unique fonction la
perception des effecteurs. Elle n’interviendrait pas directement dans la résistance vis-à-vis d’un pathogène, ce qui implique que son interaction avec un effecteur en absence d’un gène R n’a pas d’influence sur la sensibilité de la plante.
Une autre variante du modèle du leurre, nommé modèle « bait and switch model », a été proposée (Collier et Moffett, 2009). Dans ce modèle, la protéine « leurre » s’associe à la protéine R dans un premier temps. Puis une reconnaissance à lieu entre l’effecteur du pathogène et le complexe protéique R – protéine « leurre », ce qui va déclencher les cascades métaboliques nécessaires à la mise en place des défenses de la plante.
Ces modèles, même s’ils apportent des explications conceptuelles utiles à la compréhension des interactions entre gènes de résistance et facteurs d’avirulence, sont peu susceptibles de décrire de manière adéquate toutes les interactions entre plantes résistantes et agents pathogènes. Des mécanismes très différents d’activation des gènes R par les facteurs d’avirulence ont été décrits (figure 6). De plus, ces modèles ont été établis pour des gènes majeurs de résistance vis-à-vis de différents pathogènes. Or, il existe d’autres types de gènes qui permettent à la plante de développer des mécanismes de résistance.
30 Figure 6: Schéma du système immunitaire des plantes (mécanismes
d’activation des gènes de résistance par les facteurs d’avirulence), d’après Dangl et al., 2013
2.3.2 Le cas des gènes de résistance récessifs
Bien que les gènes majeurs de résistance à caractère dominant soient les plus étudiés et les plus employés en sélection végétale, un nombre non négligeable de gènes majeurs de résistance à caractère récessif ont été décrits. Ils sont présents au sein de pathosystèmes très variés. On peut par exemple citer les pathosystèmes piment/virus (Ruffel et al., 2002), riz/bactérie (Chu et al., 2006), pois/champignon (Timmerman et al., 1994), pomme de terre/nématode (Janssen et al., 1991) et maïs/puceron (So et al., 2010). On les trouve même en grand nombredans certaines interactions plante-pathogène, en particulier vis-à-vis des virus. Ainsi, on estime que plus dela moitié des gènes de résistance aux potyvirus se comporte de manière récessive, et cette proportion est estimée à environ 20% vis-à-vis des autres virus de plantes (Provvidenti et Hampton, 1992). Comme pour les résistances à caractère dominant, ils peuvent avoir un large spectre d’action. C’est par exemple le cas des gènes majeurs récessifs bs5 et bs6 du piment qui contrôlent toutes les races connues de Xanthomonas euvesicatoria (Vallejos et al., 2010). Alors que la résistance apportée par les gènes de résistance dominants
31 est un processus actif, il semblerait que la résistance récessive soit un processus passif et qu’elle soit due à des formes mutées d’allèles de sensibilité. Là où la résistance dominante met en jeu la reconnaissance d’une protéine de la plante par un effecteur du pathogène, la résistance récessive serait due à la mutation ou la perte d’un facteur de la plante essentiel au cycle de développement du pathogène. Ainsi, la résistance récessive serait due à un manque de sensibilité plus qu’à l'activation des réponses de défenses (Fraser, 1990). Cette hypothèse a été confirmée par plusieurs études sur différents pathosystèmes (Maule et al., 2007; Iyer-Pascuzzi et McCouch, 2007). Elle permet également d’expliquer pourquoi ce type de résistance est tant représenté chez les virus. En effet, étant donné qu’ils ne possèdent pas de métabolisme propre, certaines modifications d’un gène de l’hôte indispensable à leur cycle infectieux résulteront en un phénotype résistant.
Jusqu’à présent, tous les types de résistance présentés étaient relativement « simples » dans la mesure où ils ne faisaient intervenir qu’un gène au niveau de la plante et un gène au niveau du pathogène. Or, il a été mis en évidence que les interactions hôte/bioagresseurs pouvaient être beaucoup plus complexes.
2.3.3 La résistance variétale quantitative
Outre les résistances qualitatives, résultat de l’expression d’un gène majeur à effet dominant ou récessif, qui confèrent une résistance totale et empêchent la reproduction d’un pathogène, il existe un autre type de résistance à effet plus modéré, qualifié de résistance quantitative ou résistance partielle. Ce type de résistance ne permet pas de bloquer entièrement le cycle de développement d’un bioagresseur mais permet de diminuer significativement son taux de reproduction et les dégâts qu’il occasionne sur la plante. Les résistances partielles font souvent intervenir un ensemble de gènes à effets quantitatifs appelés QTL (Quantitative Trait Loci) (Young, 1996). Quand ces QTL concernent la résistance vis-à-vis d’un pathogène, on parle également de QRL (Quantitative Resistance Loci). En compilant 445 études de cartographie de QRL chez les plantes, Wilfert et Schmid-Hempel (2008) ont estimé qu’en moyenne, trois à quatre QRL étaient mis en jeu dans les interactions plante/pathogène faisant intervenir des résistances partielles. Bien que les mécanismes moléculaires sous-jacents à cette résistance polygénique soient encore peu connus, plusieurs hypothèses, en lien avec diverses études, ont été proposées pour l’expliquer (Poland et al., 2009).
32 La première repose sur l’idée que la résistance partielle est conditionnée par des gènes à effet pléiotrope, qui agissent, outre sur la résistance aux maladies, sur la morphologie et le développement des plantes. La colocalisation de QTL pour la vigueur, la précocité et la résistance vis-à-vis de Phytophtora infestans a été mise en évidence chez la pomme de terre (Collins et al., 1999). Un lien fort entre le temps de floraison et le niveau de résistance de la plante a été démontré. D’autre part, des études ont prouvé qu’il existait une corrélation entre des QTL impliqués dans la résistance partielle et des traits morphologiques tels que la densité de stomates par feuille ou la superficie foliaire (Melotto et al., 2006; Albar et al., 1998).
Une deuxième hypothèse suggère que les facteurs de résistance partielle correspondent à des mutations ou à différents allèles de gènes impliqués dans la réponse basale de la plante. Cela a été démontré chez Arabidopsis thaliana pour FLS2, un gène de résistance basale impliqué dans la reconnaissance de la flagelline (un PAMP), protéine essentielle des bactéries. Suivant les allèles (ou les mutations) porté(e)s par la plante au locus de FLS2, différents niveaux de résistance partielle ont été mis en évidence (Zipfel et al., 2004; Dunning et al., 2007). Cela a également été observé à travers l’étude d’un gène impliqué dans la perception de la chitine, constituant important des champignons (Ramonell et al., 2005). Ainsi, du polymorphisme au niveau des PRR qui interviennent dans la résistance basale (cf. point 2.2.2) pourrait expliquer les différences observées au niveau du degré de résistance vis-à-vis des différents pathogènes. Cette hypothèse permet également d’expliquer le large spectre d’action, souvent observé, des résistances partielles, dans la mesure où les PRR interviennent dans la résistance non spécifique.
Une troisième hypothèse repose sur l’idée que la résistance partielle correspond à une production plus ou moins importante de composés chimiques par la plante, notamment de phytoalexines, intervenant dans la lutte contre les bioagresseurs. Il a été démontré chez le pathosystème Arabidopsis thaliana/Botrytis que le taux de camalexine (une phytoalexine) dans la plante était corrélé avec le niveau de résistance vis-à-vis de ce pathogène (Denby et al., 2004 ; Kliebenstein et al., 2005). D’autre part, des études de mutants au niveau de gènes codant pour des phytoalexines ont montré que leur diminution au sein de la plante provoquait une plus grande sensibilité vis-à-vis des pathogènes (Parisy et al., 2007; Schlaeppi et al., 2008). A travers cette hypothèse, la balance « toxines du pathogène/molécules de détoxification de la plante » jouerait un rôle primordial sur l’intensité d’une maladie.
L’implication des résistances partielles dans la transduction des signaux de défense de la plante est également une hypothèse soutenue par plusieurs études. L’acide salicylique, l’acide
33 jasmonique et l’éthylène sont des phytohormones qui interviennent souvent dans la défense des plantes. Or, on estime que différents allèles de gènes impliqués dans la régulation des voies de signalisation de ces molécules pourraient correspondre à des facteurs de résistance partielle. Plusieurs études ont montré que des mutations au niveau de facteurs de régulation (déclencheurs ou répresseurs) de ces phytohormones jouaient un rôle sur le niveau de résistance à certains bioagresseurs (Kunkel et al., 2002; Koornneef et Pieterse, 2008; Robert-Seilaniantz et al., 2011).
Plusieurs auteurs considèrent que les facteurs de résistance partielle sont en fait des gènes
R, sous une forme « affaiblie », qui ne permettent pas de stopper complètement le
développement d’un pathogène (Parlevliet et Zadocks, 1977; Young, 1996). Le fait que des facteurs de résistance partielle colocalisent avec des gènes R chez plusieurs espèces de plante va dans ce sens (Wang et al., 1994; Gebhardt et Valkonen, 2001; Xiao et al., 2007 ). De plus, lorsqu’un gène R a été contourné par une souche de pathogène, on a observé que, parfois, ce gène rendu inefficace, permettait tout de même de réduire le niveau de la maladie. Ce phénomène, appelé « résistance résiduelle » a été rapporté chez plusieurs pathosystèmes (Nass et al., 1981; Brodny et al., 1986; Li et al., 1999). De plus, bien que l’on considère que les résistances partielles ont un large spectre d’action et que les résistances totales sont spécifiques, de nombreux contre-exemples existent (Parlevliet, 1978; Arru et al., 2003; Perchepied et al., 2005; Li et al., 2006; Darvishzadeh et al., 2007; Whitaker et al., 2007). En particulier, l’évaluation de résistances quantitatives et polygéniques à l’aide de souches différentes d’un même bioagresseur a souvent montré que leur spectre large résultait de l’effet conjoint de QTL à effets individuels plus ou moins spécifiques (Caranta et al., 1997; Calenge et al., 2004, Basnet et al., 2014)
Enfin, une dernière hypothèse considère que les facteurs de résistance partielle constituent une classe à part entière et correspondent à des gènes qui n’ont jamais été décrits par ailleurs. C’est le cas des gènes pi21 et Pi34 chez le riz, qui ne partagent aucune similitude avec les gènes de défense décrits jusqu’à présent (Zenbayashi-Sawata et al., 2007; Fukuoka et al., 2009).
Encore une fois, comme pour les résistances totales, une de ces hypothèses ne permet pas d’expliquer à elle seule tous les cas de résistance partielle observés. Même si il est possible de faire des comparaisons, chaque pathosystème présente des caractéristiques intrinsèques propres. Ces dernières vont influer sur l’utilisation des résistances totales ou partielles qui présentent chacune leurs avantages et leur inconvénients.