Impact de la consommation de produits laitiers sur
l’hypertension artérielle essentielle
Mémoire
Jean-Philippe Drouin-Chartier
Maîtrise en nutrition
Maître ès sciences (M.Sc.)
Québec, Canada
© Jean-Philippe Drouin-Chartier, 2014
iii
Résumé
L’hypertension artérielle essentielle (HTA) est un des plus importants facteurs de risque de maladies cardiovasculaires (MCV). Une des premières manifestations de l’HTA est l’altération de la fonction endothéliale, qui contribue également à l’augmentation du risque de MCV. Plusieurs études suggèrent que la consommation de produits laitiers a un effet bénéfique sur la pression artérielle (PA) et la fonction endothéliale, mais cela n’a été que peu étudié chez des sujets hypertendus. Ce mémoire présente les résultats d’une étude clinique dont l’objectif était d’évaluer l’impact de la consommation de produits laitiers sur la PA moyenne diurne et la fonction endothéliale chez des hommes et des femmes avec une HTA légère à modérée. Les résultats de cette étude suggèrent que la consommation de produits laitiers améliore la pression artérielle systolique des hommes avec HTA légère à modérée et qu’elle apporte des bénéfices sur la fonction endothéliale chez des sujets hypertendus.
v
Table des matières
Résumé... iii
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... ix
Liste des abréviations et des sigles ... xi
Avant-propos ... xiii
Chapitre I- Introduction générale ... 1
Chapitre II- Problématique ... 3
1- Hypertension artérielle essentielle ... 3
1.1- Définition ... 3
1.2- Méthodes de mesure et valeurs diagnostiques ... 3
1.3- Prévalence et fardeau économique ... 5
1.4- Physiologie de la pression artérielle ... 7
1.5- Pathophysiologie de l’hypertension artérielle essentielle ... 9
1.6- Complications de l’hypertension artérielle essentielle ... 12
2- Fonction endothéliale ... 13
3- Produits laitiers ... 14
3.1- Produits laitiers et santé ... 14
3.2- Produits laitiers et pression artérielle ... 15
3.2.1- Mécanismes d’action ... 15
3.2.2- Études observationnelles ... 17
3.2.3- Études randomisées contrôlées ... 25
3.3- Produits laitiers et fonction endothéliale ... 29
4- Objectifs et hypothèses ... 31
Chapitre III- Impact de la consommation de produits laitiers sur l’hypertension artérielle essentielle : une étude clinique ... 33
Résumé ... 34
Title page ... 35
Abstract ... 36
Results and discussion ... 39 Conclusions ... 43 Methods ... 44 Population ... 44 Study design ... 44 Concealment ... 45 Ambulatory BP monitoring ... 45 Office BP measurement ... 46 Dietary assessment ... 46
Endothelial function assessment ... 46
Compliance assessment ... 47
Anthropometry ... 47
Statistical analyses ... 47
Sample size estimate ... 47
List of abbreviations ... 49 Competing interests ... 49 Authors’ contributions ... 49 Authors’ information ... 49 Acknowledgments ... 49 References ... 50 Figure legends ... 58 Figure 1 ... 59 Figure 2 ... 60 Figure 3 ... 61
Chapitre IV- Conclusion ... 63
vii
Liste des tableaux
Tableau 1: Catégories de pression artérielle selon les valeurs et l'appareil de mesure
... 4
Tableau 2: Études transversales ... 19
Tableau 3: Études prospectives ... 23
ix
Liste des figures
Figure 1: Incidence de la morbidité cardiovasculaire par année d’espérance de vie corrigée pour la morbidité en fonction du niveau de la PA systolique. Figure adaptée de Rodgers et coll. [25] ... 5 Figure 2: Distribution de la PA selon le pays, l'âge et le sexe. Figure tirée de Joffres et coll. [26]. ... 6 Figure 3: Mécanismes régulant la pression artérielle. Figure adaptée de Mayet [29]. 9 Figure 4: Effet additif des facteurs héréditaires et environnementaux sur les niveaux de PA. Figure adaptée de Carretero [5] ... 11 Figure 5: Pourcentages des besoins quotidiens comblés par la consommation de 1.8 portion de produits laitiers. Figure tirée de Rice et coll. [44] ... 15
xi
Liste des abréviations et des sigles
CRP: protéine c-réactive (C-Reactive Protein)
DALYs: Espérance de vie corrigée pour la morbidité (Disability Ajusted Life Years) DASH : Dietary Approach to Stop Hypertension
DC : débit cardiaque
ECA : enzyme de conversion de l’angiotensine FC : fréquence cardiaque
FMD : Vasodilatation médiée par le flot sanguin (Flow-mediated dilation) GAC : Guide alimentaire canadien
HOT: Traitement optimal pour l’hypertension (Hypertension optimal treatment) HTA : hypertension artérielle
ICAM : Molécule d’adhésion intercellulaire (Intercellular adhesion molecule) RHI : Indice d’hyperémie réactive (Reactive hyperemia index)
INAF : Institut sur la nutrition et les aliments fonctionnels MAPA : moniteur ambulatoire de pression artérielle MCV : maladie cardiovasculaire
NHANES : National Health and Nutrition Examination Survey OMS : Organisation mondiale de la santé
PA : pression artérielle
PAD : pression artérielle diastolique PAS : pression artérielle systolique
PAT : Tonométrie artérielle périphérique (Peripheral arterial tonometry) PL : produits laitiers
RVP : résistance vasculaire périphérique
VCAM : Molécule d’adhésion des cellules vasculaires (Vascular cell adhesion
molecule)
xiii
Avant-propos
J’ai eu la chance de réaliser ma maitrise en nutrition à l’Institut sur la Nutrition et les Aliments Fonctionnels, à l’Université Laval, au sein de l’équipe des docteurs Patrick Couture et Benoît Lamarche. Mes travaux de maîtrise ont principalement porté sur une étude clinique visant à évaluer l’impact de la consommation de produits laitiers sur l’hypertension artérielle. C’est d’ailleurs sur cette étude que porte ce mémoire. Dr Couture, mon directeur, m’a aussi donné l’opportunité de travailler sur deux autres projets; une étude visant à étudier l’effet du PCSK9 sur les niveaux de cholestérol LDL chez des patients avec hypercholestérolémie familiale et une autre comparant deux méthodes d’aphérèse de lipides chez des patients avec hypercholestérolémie familiale homozygote.
J’ai eu la chance de participer au volet clinique de l’étude sur les produits laitiers et l’hypertension durant un stage d’été en recherche à ma dernière année au baccalauréat en nutrition. L’intervention s’est terminée dans les premiers mois de ma maîtrise à l’hiver 2013. J’ai ensuite analysé les données et présenter nos résultats lors de quelques congrès et réunions scientifiques, pour ensuite aboutir rédiger l’article. D’ailleurs, ce dernier a été soumis à la revue Nutrition Journal. La version présentée dans ce mémoire est celle qui a été envoyée à Nutrition Journal suite à une évaluation par le comité de révision du journal en date du 10 juillet 2014.. Toutes ces réalisations n’auraient pu être possibles sans l’appui et la confiance que Dr Patrick Couture m’a accordée ainsi que les judicieux conseils de Dr Benoît Lamarche. La passion pour la recherche qui anime ces deux hommes est des plus inspirante. Merci à vous deux! Merci aussi à Iris Gigleux pour la coordination du projet. Sans son dévouement, le recrutement des participants serait sûrement encore en cours! Merci à Danielle Aubin et Steeve Larouche, nos infirmiers, et à André Tremblay et Luc Poirier pour vos conseils et vos pistes de réflexion. En fait, merci à tous les membres de l’équipe de m’avoir accueilli parmi vous en 2011! Enfin, merci à mes parents pour le soutien et les encouragements tout au long de mes études universitaires.
1
Chapitre I- Introduction générale
L’hypertension artérielle (HTA) est considérée comme l’un des plus importants facteurs de risque de maladies cardiovasculaires (MCV) et rénales [1]. En 2000, le quart de la population mondiale en était atteint [1]. Cette proportion est toujours grandissante et devrait atteindre près du tiers de la population mondiale en 2025 [1]. Environ 13% des cas de mortalité, 6% de la morbidité cardiovasculaire et 27% des cas d’insuffisance rénale à travers le monde sont attribuables à une PA élevée [1, 2]. L’HTA est aussi un important fardeau économique qui monopolise 10% des dépenses mondiales en santé, soit 370 milliards de dollars américains [3].
L’HTA essentielle est causée par la présence simultanée de plusieurs facteurs et son étiologie exacte est souvent impossible à identifier [4]. Plusieurs éléments génétiques et héréditaires vont définir la PA de base qui est normalement distribuée. Des facteurs hypertensifs, comme l’âge, le sexe (les hommes étant plus à risque avant 45 ans et les femmes après 65 ans), l’obésité abdominale, la sédentarité, la consommation d’alcool et une alimentation de mauvaise qualité, peuvent s’ajouter et contribuer à l’augmentation de la PA et au développement de l’HTA [5, 6].
Plusieurs études montrent les effets bénéfiques d’une saine alimentation sur le contrôle de la PA et la prévention de l’HTA [7]. Alors que la diminution de sodium est la cible de prédilection des programmes d’éducation pour une saine PA, certaines diètes, certains groupes d’aliments et certains nutriments ont été identifiés comme ayant des effets bénéfiques sur la PA. Au début des années 1980, une importante enquête nutritionnelle a montré une relation entre l’augmentation des apports en calcium et la diminution du risque d’HTA [8]. Comme les produits laitiers (PL) fournissent 75% des apports en calcium en Amérique du Nord, plusieurs études ont tenté de déterminer s’il y avait une relation entre la consommation de PL et la diminution du risque d’HTA.
Selon les études de cohortes, il y a une relation inverse dose-réponse entre la consommation de PL, l’élévation de la PA et le risque d’HTA [9, 10]. La consommation de PL a un effet protecteur contre l’HTA chez les personnes normo-tendues, alors qu’il y aurait un effet possiblement bénéfique sur la PA chez les personnes hypertendues [9, 11]. Par contre, les études contrôlées randomisées
n’arrivent pas toutes aux mêmes conclusions. En fait, les résultats de ces études sont parfois même contradictoires [12-15]. En somme, l’impact réel de la consommation de PL sur la PA et l’HTA demeure indéterminé, particulièrement chez les personnes hypertendues. Par ailleurs, des études ont permis d’établir que les peptides bioactifs du lait ont un effet bénéfique sur la PA via leur effet d’inhibition de l’enzyme de conversion de l’angiotensine [16]. De plus, le calcium, le magnésium et le potassium ont un effet vasodilatateur par la régulation du métabolisme ionique du calcium et du sodium [17, 18]. Dans cette optique, nous avons réalisé une étude clinique pour évaluer l’impact de la consommation de PL sur l’HTA essentielle à l’Institut sur la Nutrition et les Aliments Fonctionnels (INAF) de l’Université Laval. L’objectif de ce projet de recherche était d’évaluer l’impact de la consommation quotidienne de trois portions de PL sur la PA diurne moyenne et la fonction endothéliale chez des hommes et des femmes avec une HTA légère à modérée. Ce mémoire débute par une revue de la littérature sur l’HTA essentielle. Ensuite, une section explique la relation entre la consommation de PL et la PA, suivie de l’article en révision dans la revue Nutrition Journal lors de la rédaction du mémoire. Une discussion de nos résultats et une conclusion terminent ce document.
3
Chapitre II- Problématique
1- Hypertension artérielle essentielle
1.1- Définition
L’hypertension artérielle (HTA) essentielle est un facteur de risque majeur et modifiable de maladies cardiovasculaires (MCV) et rénales [5]. Elle consiste en une augmentation persistante de la pression artérielle (PA) systolique et/ou diastolique au-dessus des valeurs normales et peut être causée par des facteurs génétiques et/ou par des facteurs environnementaux, comme l’obésité, la sédentarité et une mauvaise alimentation [4, 19]. Les facteurs familiaux ou génétiques jouent un rôle central dans le développement de l’HTA essentielle. La plupart des patients présentant ce type d’HTA ont une histoire familiale d’HTA et/ou d’accidents cérébrovasculaires. L’étiologie exacte de l’augmentation de la PA dans l’HTA essentielle est souvent impossible à identifier, comparativement à l’HTA secondaire, où la cause est identifiable. Par exemple, l’HTA secondaire peut être attribuable à des maladies rénales (maladie réno-vasculaire, insuffisance rénale, phéochromocytome), des maladies artérielles, une sécrétion excessive d’hormones (aldostéronisme) ou la prise de médicaments [5, 20]. L’HTA essentielle est la forme la plus fréquente représentant 90-95% de tous les cas d’HTA [4].
1.2- Méthodes de mesure et valeurs diagnostiques
La mesure de la PA se fait par l’auscultation des bruits de Korotkoff dans le bras ou par la détection les ondes artérielles [19, 21]. Plusieurs appareils peuvent être utilisés pour mesurer la PA et les critères diagnostiques de l’HTA diffèrent selon la méthode utilisée (Tableau 1). En clinique, un diagnostic d’hypertension est posé lorsque la moyenne des mesures réalisées lors de deux visites subséquentes est supérieure à 140 mm Hg pour la PAS ou à 90 mm Hg pour la PAD [5]. Le stress occasionné par l’environnement médical peut contribuer à augmenter la PA, alors qu’en dehors de cet environnement, la PA est normale; il s’agit du syndrome du sarrau blanc [19]. De 20% à 35% des diagnostics d’HTA sont faussés par ce phénomène [21]. À l’inverse, une HTA peut être masquée i.e. qu’elle est plus basse dans l’environnement médical qu’à l’extérieur [19].
La méthode la plus efficace permettant d’atténuer le syndrome du sarrau blanc, de détecter une HTA masquée et ainsi d’obtenir des diagnostics plus justes est l’utilisation du moniteur ambulatoire de pression artérielle (MAPA), un appareil mesurant la PA à intervalles réguliers durant 24 heures [19]. En plus de permettre la détection des types particuliers d’HTA, l’utilisation du MAPA comporte plusieurs autres avantages. En fait, les mesures recueillies reflètent plus précisément la PA réelle du patient et la validité des mesures est augmentée [21]. Enfin, les mesures du MAPA corrèlent plus fortement avec le risque réel de MCV ou les dommages aux organes, particulièrement la PAS moyenne diurne [22, 23].
Tableau 1: Catégories de pression artérielle selon les valeurs et l'appareil de mesure
Catégories Valeurs (mm Hg)
Mesures ponctuelles conventionnelles Normotensif Optimal <120/<80 Normal 120-129/80-84 Normal haut 130-139/85-89 Hypertension Légère 140-159/90-99 Modérée 160-179/100-109 Sévère >180/>110
Mesures ambulatoires (MAPA) Normal 24 heures <130/<80 Diurne <135/<85 Nocturne <120/<70 Hypertension 24 heures >135/85 Diurne >140/90 Nocturne >125/75
Adapté de Carretero et coll. [5] et Staessen et coll. [19]
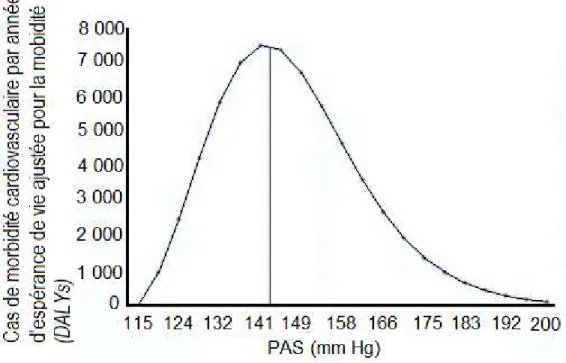
Le Tableau 1 présente les différentes valeurs diagnostiques selon la méthode utilisée. Les valeurs diagnostiques ont été établies par rapport au niveau de risque de MCV. La relation entre l’élévation de la PA et le risque de MCV est continue, linéaire et il n’y a pas de valeur de PA, autant systolique ou diastolique, où le risque de MCV augmente drastiquement [24]. À l’inverse, il n’y a pas de valeurs de PA où le risque est nul [24]. Cette relation est illustrée dans la Figure 1. Le nombre de cas de morbidité cardiovasculaire en fonction du niveau de PA y est illustré. La ligne verticale présente le niveau de PA minimal responsable de 50% des cas de morbidité. Actuellement, le seuil de 140/90 mm Hg est la limite supérieure à viser
5 pour limiter les complications à long terme. Ce seuil a été établi à partir des données de l’étude Hypertension Optimal Treatment (HOT) qui a montré que plus de 50% des événements cardiovasculaires se produisent au-delà de 140/90 mm Hg [24, 25].
Figure 1: Incidence de la morbidité cardiovasculaire par année d’espérance de vie corrigée pour la morbidité en fonction du niveau de la PA systolique.
Figure adaptée de Rodgers et coll. [25]
1.3- Prévalence et fardeau économique
En 2000, à l’échelle mondiale, il est estimé que 25% des adultes souffraient d’HTA, soit environ un milliard d’individus. Cette prévalence est toujours en augmentation, particulièrement dans les pays en développement, et devrait atteindre 29-30% en 2025 [1].
La Figure 2 montre la relation entre la PA et l’âge. La PAS augmente avec l’âge, alors que la PAD augmente, plafonne et diminue avec le vieillissement [26]. Aussi, la prévalence de l’HTA est différente entre les hommes et les femmes avec l’avancement en âge. En effet, avant l’âge de 45 ans, plus d’hommes que de femmes ont une PA élevée. Entre 45 et 64 ans, les taux sont équivalents. Enfin, 57% des femmes de 65 ans et plus souffrent d’HTA comparativement à 54% des hommes du même âge. Les proportions varient également selon l’origine ethnique. Les personnes de race noire ont tendance à avoir une PA plus élevée que les
Caucasiens. D’ailleurs, les Afro-Américains sont le groupe ethnique chez qui la prévalence de l’HTA est la plus élevée au monde, alors que 41.4% de cette population en est atteint. Enfin, le statut socio-économique est aussi un élément influençant la prévalence de l’HTA. Effectivement, cette dernière est plus élevée dans les régions avec un statut socio-économique plus faible. [27]
Au Canada et aux États-Unis respectivement, 66% et 50% des adultes (20-79 ans) ont une PA normale [26]. La pré-HTA touche 27% des Canadiens et l’hypertension 19.5%. Seulement 66% des Canadiens hypertendus sont traités adéquatement et ont une PA normale [26]. Aux États-Unis, 36% des habitants ont une pré-HTA et 29.1% des Américains souffrent d’hypertension [26]. Cela représente environ 77.9 millions d’adultes aux États-Unis [27]. Cette proportion devrait augmenter de 7.2% entre 2013 et 2030 [27]. Chez les Américains, la proportion d’hypertendus traités adéquatement n’est que de 52.8% [26].
Figure 2: Distribution de la PA selon le pays, l'âge et le sexe. Figure tirée de Joffres et coll. [26].
Le fardeau économique relié à l’HTA est non négligeable. À l’échelle mondiale, l’HTA monopolise 10% des dépenses en santé, ce qui correspond à environ 370 milliards de dollars américains. Seulement aux États-Unis, en 2009, les coûts reliés à l’augmentation de la PA élevée atteignaient 51.0 milliards de dollars et pourraient atteindre 340 milliards en 2030 [27]. Au Canada, en 2003, les coûts reliés aux médicaments antihypertenseurs seulement ont atteint 1.7 milliard de dollars et ces chiffres sont constamment en hausse [28]. En somme, ces données renforcent le fait
7 que l’HTA est un problème majeur de santé publique. Dans ce contexte, la promotion des saines habitudes de vie, la prévention et l’optimisation du traitement devraient toutes être promues.
1.4- Physiologie de la pression artérielle
La PA est le résultat de la relation entre la circulation sanguine et la résistance des vaisseaux sanguins [29]. En fait, la PA est le produit du débit cardiaque (DC) et de la résistance vasculaire périphérique (RVP) tel qu’illustré dans la formule ci-dessous [30] :
PA= RVP X DC
La RVP est principalement originaire des petites artères et artérioles qui sont moins élastiques que les grands vaisseaux sanguins, comme l’aorte [29]. À court terme, la RVP est influencée par le diamètre des artères et des artérioles. Des régulateurs localisés dans les artères et artérioles (l’oxyde nitrique, les eicosanoïdes, l’oxygène, l’adénosine, l’endothéline, l’hydrogène) affectent aussi la capacité contractile des cellules musculaires de l’endothélium modifiant ainsi le diamètre des vaisseaux sanguins [29]. Enfin, la RVP est également modulée par l’écoulement et la viscosité du sang ainsi que la longueur des vaisseaux sanguins [29].
Le DC est le produit de la relation entre le volume d’éjection (VE) et la fréquence cardiaque (FC). Il correspond au volume de sang éjecté par le ventricule gauche en une minute [29, 30].
DC= VE X FC
La FC est principalement régulée par le système nerveux autonome sympathique et parasympathique. Lors d’une stimulation, l’activation du système nerveux autonome déclenche la libération de noradrénaline. La sécrétion de noradrénaline augmente la perméabilité de la membrane des cellules cardiaques et fait augmenter la FC. À l’inverse, la stimulation du système nerveux parasympathique ralentit la FC par la sécrétion d’acétylcholine qui produit l’effet inverse de la noradrénaline. Des barorécepteurs ont aussi une influence sur le système nerveux sympathique et parasympathique. Par leur sensibilité à l’étirement, ils stimulent l’un ou l’autre des systèmes nerveux en réponse à des changements rapides de pression artérielle afin
d’ajuster la FC et assurer un DC adéquat. De plus, des chimiorécepteurs sensibles aux concentrations en O2, CO2 et ainsi qu’aux variations de pH stimulent le système
nerveux sympathique ou parasympathique afin de moduler la FC. Enfin, les hormones de la glande thyroïde, la concentration intracellulaire et extracellulaire de potassium, calcium et sodium, l’âge et le sexe influencent aussi tous la FC. [20, 29, 30]
Le VE correspond au volume de sang éjecté lors de la contraction du cœur et la FC au nombre de battements par minutes. Le VE est dépendant du volume diastolique (durée diastole ventricule et retour veineux), du volume systolique (force de contraction ventriculaire et pression artérielle) ainsi que du volume résiduel [29]. Par exemple, lors d’une augmentation de la FC, la libération de noradrénaline augmente la vitesse de contractilité et de relaxation des cellules musculaires cardiaques permettant aussi une augmentation du VE [30].
Le contrôle de la PA à moyen et long terme est assuré par les reins via le système rénine-angiotensine. Il s’orchestre via le VE par la fluctuation du volume sanguin et par la régulation de la RVP. L’activation du système rénine-angiotensine, par le système nerveux sympathique, augmente la réabsorption tubulaire de sodium et l’excrétion de potassium ce qui accroit la rétention d’eau et augmente le volume sanguin. Le volume sanguin est aussi augmenté par la sécrétion de la vasopressine, une hormone antidiurétique qui favorise la rétention d’eau. Ultimement, l’augmentation du volume sanguin va affecter à la hausse le VE et la PA tel qu’illustré à la Figure 3. Enfin, ce système a également un effet vasoconstricteur qui influence la RVP et qui contribue à l’augmentation de la PA.
L’HTA est le résultat d’une augmentation du DC et/ou d’une augmentation de la RVP [24]. L’augmentation de la RVP est présente autant au niveau rénal, musculaire, coronaire que splanchnique et se traduit habituellement par une diminution de la compliance endothéliale (voir section 2-Fonction endothéliale) [29]. Une augmentation de la PAS est attribuable à l’augmentation de la force de contraction du cœur, à l’augmentation du VE systolique ou à la diminution de l’élasticité des parois des grosses artères. La diminution de la vitesse d’écoulement du sang ou l’augmentation de la RVP augmente principalement la PAD. Enfin, dans les cas
9 d’HTA essentielle particulièrement, l’augmentation de la RVP est la principale cause d’élévation de la PA [29].
Figure 3: Mécanismes régulant la pression artérielle. Figure adaptée de Mayet [29].
1.5- Pathophysiologie de l’hypertension artérielle essentielle
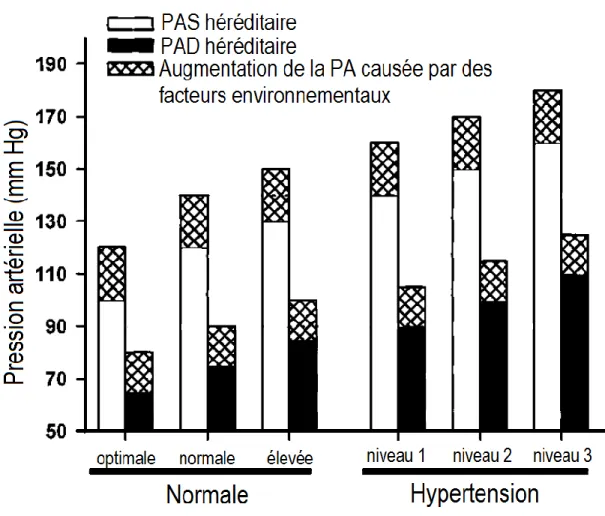
Comme mentionné à la section 1.1- Définition, il est difficile d’identifier l’étiologie exacte de l’HTA essentielle. Cependant, les facteurs génétiques et environnementaux causant l’HTA sont bien connus et l’HTA essentielle est attribuable à l’un ou à la combinaison de ces facteurs. Des variations génétiques peuvent moduler la PA à la hausse ou à la baisse et ainsi influencer la susceptibilité d’un individu à développer de l’HTA. Aussi, des facteurs environnementaux hypertensifs, comme l’obésité, la consommation d’alcool, la résistance à l’insuline, l’âge, la sédentarité, le stress, l’apport en sel et les apports en calcium et en potassium s’ajoutent aux facteurs génétiques et contribuent au développement de l’HTA comme illustré à la Figure 3 [5].
Des études sur des familles ont permis d’établir le fait que des facteurs génétiques influencent la PA [5]. Les modulations héréditaires de la PA font en sorte que d’un
point de vue populationnel, en absence de facteurs hypertensifs, la PA est normalement distribuée avec une asymétrie vers la droite [5]. Ces variations génétiques font que certains individus ont une PA optimale (<120/<80 mm Hg), alors que d’autres ont une PA très élevée (>160/>110 mm Hg) [5]. Cependant, aucun gène ou mutation n’ont été identifié comme la cause d’un phénotype de PA élevée ou basse. Il s’agirait plutôt d’un ensemble de gènes et de phénotypes modulant le système nerveux autonome, les hormones vasopressives, la structure du système cardiovasculaire, le volume de fluides corporels et la fonction rénale. Tous ces éléments affectent le DC et la RVP et détermine la PA héréditaire d’un individu. À l’inverse, l’hyperaldostéronisme sensible aux glucocorticoïdes, le syndrome de Liddle, l'excès apparent de minéralocorticoïdes et l’HTA autosomique dominante avec brachydactylie sont toutes des formes d’HTA héréditaire causée par des mutations génétiques. [5]
L’obésité, la résistance à l’insuline, la consommation d’alcool, l’apport en sodium, la sédentarité, le stress, de faibles apports en potassium et en calcium sont tous des facteurs environnementaux modifiables qui ont un impact important sur la PA [5]. La présence simultanée de plusieurs de ces facteurs a un impact synergique sur l’augmentation de la PA. Bien qu’il soit question de facteurs environnementaux, il est important de noter que chacun de ces facteurs est aussi soumis à un contrôle génétique qui affecte la prédisposition ou la sensibilité d’un individu à ces différents facteurs.
L’obésité est le plus important facteur hypertensif. Il a été montré qu’une augmentation du poids corporel de 10 % est associée avec une augmentation de la PAS de 6.5 mm Hg lorsque mesurée en clinique [5]. Le principal mécanisme par lequel l’obésité cause l’HTA est l’augmentation du volume sanguin, qui a un effet direct sur l’augmentation du débit cardiaque [5]. À l’inverse, il y a une relation linéaire entre la perte de poids et la diminution de la PA [31]. Une perte de 1 kg est associée avec la diminution de la PAS de 2 mm Hg et de la PAD de 1 mm Hg [32].
La résistance à l’insuline augmente le risque d’HTA par son effet sur la sensibilité de la PA au sel (Salt-sensibility). L’augmentation de l’insulinémie augmente la sensibilité au sel de la PA [5]. De plus, comme cette résistance découle
11 majoritairement de l’obésité abdominale, le risque d’HTA est d’autant plus accentué par l’effet néfaste de l’obésité et de la résistance à l’insuline sur la PA.
Figure 4: Effet additif des facteurs héréditaires et environnementaux sur les niveaux de PA. Figure adaptée de Carretero [5]
La sédentarité est associée à l’augmentation du poids et ses effets néfastes sur la PA. À l’inverse, la pratique de 30 minutes d’activité physique d’intensité modérée ou supérieure au moins trois fois par semaine est associée à une diminution de la PA. La pratique d’activité physique devrait être encouragée chez toutes les personnes atteintes d’HTA. [33]
Plusieurs éléments de l’alimentation peuvent contribuer à l’augmentation de la PA. La relation entre la consommation d’alcool, la PA et le risque d’HTA est constante et montre une augmentation importante du risque lorsque la consommation dépasse les recommandations maximales de 2 à 3 verres par jour. Des études ont montré que la PA peut diminuer de 4 à 5 mm Hg lors des journées d’abstinence [33]. L’effet
hypertensif du sodium provient de son effet sur le système nerveux sympathique. En effet, une consommation élevée de sodium provoque l’activation du système nerveux sympathique [29]. D’ailleurs, cet effet est plus important chez les personnes de race noire, chez les personnes obèses ou chez les personnes âgées. Aussi, de faibles apports en potassium et en calcium contribuent à l’augmentation de la sensibilité de la PA au sel tout en diminuant leurs effets sur la production de vasodilatateurs [33, 34]. À l’inverse, la diminution des apports en sodium a des effets bénéfiques sur la PA. Une étude sur la diète DASH avec différents niveaux de sodium a montré l’effet réellement bénéfique sur la PA de l’adoption d’une alimentation saine faible en sodium [35].
1.6- Complications de l’hypertension artérielle essentielle
Le rapport de 2009 de l’Organisation Mondiale de la Santé (OMS) présente l’HTA comme le facteur de risque de mortalité le plus important, devant l’usage du tabac, la résistance à l’insuline, la sédentarité, l’embonpoint et l’obésité [36]. La corrélation entre l’augmentation de la PA et le risque de complications est forte, positive et continue; plus la PA est élevée, plus les risques de MCV, comme les AVC, les infarctus, l’insuffisance cardiaque, de maladies rénales et de mortalité sont élevés [5]. Le risque augmente aussi de façon importante en présence d’autres facteurs de risque comme le tabagisme, le diabète de type II ou la dyslipidémie [20]. Cette corrélation positive est également observée à des niveaux normaux de PA, indiquant que plus la PA est basse, plus le risque de complications cardiovasculaires et rénales est faible. L’augmentation de la PAS est plus fortement corrélée avec l’augmentation du risque de complications que l’élévation de la PAD [5].
Sur 10 ans, les hommes hypertendus ont un risque de développer une première MCV de 10 % alors que les femmes ont 4.4 % de risque de développer une première MCV [24]. La revue de littérature de Lawes et coll. réalisée à partir d’articles publiés entre 1980 et 2001 présente le fardeau social que cause l’hypertension artérielle dans le monde entier [1]. Les problèmes reliés à l’augmentation de la PA systolique au-dessus de 115 mm Hg causerait 13.6 % des morts prématurées et 6.0 % de la morbidité cardiovasculaire. L’HTA causerait aussi 54 % des cas d’AVC, 47 % des cas de maladies cardiaques ischémiques et 27 % des cas d’insuffisance rénale [1, 2]. Les régions avec revenus faibles ou moyens (particulièrement l’Europe de l’Est et l’Asie centrale) constituent 80 % du fardeau
13 mondial relié à l’hypertension. À l’inverse, les régions avec les revenus plus élevés sont les moins touchées par ce problème de santé. De plus, la moitié des cas de mortalité et de la morbidité cardiovasculaire attribuables à l’hypertension touche les adultes âgés entre 45-69 ans.
2- Fonction endothéliale
L’endothélium est la couche de cellules qui tapisse les parois des vaisseaux sanguins et des capillaires. En plus d’agir comme barrière sélective entre la lumière des vaisseaux sanguins et l’espace interstitiel, l’endothélium contrôle l’homéostasie vasculaire. En effet, cet organe contrôle le tonus vasculaire et la réponse inflammatoire, promeut et inhibe la croissance vasculaire et module l’agrégation plaquettaire et la coagulation. L’ensemble des fonctions de l’endothélium assure la vasomotricité des vaisseaux sanguins et protège contre le développement de l’athérosclérose.[37]
La dysfonction endothéliale est la diminution du potentiel de vasodilatation des vaisseaux sanguins. La dysfonction endothéliale est une des premières conséquences de l’HTA. Plus la PA est élevée, plus la fonction endothéliale est altérée. En fait, les différents facteurs de risque de MCV, comme l’HTA, le diabète de type II, la dyslipidémie ou le tabagisme, entraînent tous l’altération de la fonction endothéliale. De plus, la présence simultanée de ces différents facteurs a un effet synergique néfaste sur la fonction endothéliale. La dysfonction endothéliale est principalement causée par l’augmentation de la production de dérivés réactifs de l’oxygène qui diminuent la biodisponibilité de l‘oxyde nitrique, un puissant vasodilatateur. L’altération de la fonction endothéliale se produit avant même que des changements dans la structure des vaisseaux puissent être détectés par angiographie ou par ultrasons intra vasculaires. La mesure de la fonction endothéliale est un outil très utile pour détecter des dommages vasculaires précoces.[37, 38]
Des méthodes non invasives ont été développées pour évaluer la fonction endothéliale. Les deux principales sont la mesure de la dilatation médiée par le flot sanguin (flow-mediated dilation; FMD), et la mesure de la tonométrie artérielle périphérique (peripheral arterial tonometry; PAT). Bien que la FMD soit plus utilisée,
la mesure de la tonométrie artérielle périphérique est plus avantageuse puisqu’elle permet une évaluation indépendante de l’utilisateur de l’appareil. Cependant, bien utilisées, les deux méthodes donnent des résultats similaires.[39, 40]
3- Produits laitiers
Les produits laitiers (PL; lait, fromage, yogourt, kéfir) sont des aliments faisant partie d’une saine alimentation. Au Canada, le Guide Alimentaire Canadien (GAC) recommande de consommer quotidiennement 2 à 3 portions du groupe appelé Lait et substituts, composé des PL et boissons végétales enrichies en calcium et vitamine D [41]. Il est aussi recommandé de privilégier les produits laitiers à teneur réduite en gras (0 % à 2 %) comparativement aux produits entiers, plus riches en gras. Aux États-Unis, les recommandations alimentaires sont très semblables. Jusqu’en 2011, les recommandations illustrées par MyPyramid suggéraient la consommation quotidienne de trois tasses de lait écrémé ou faible en gras ou l’équivalent en fromage ou yogourt [42]. Plus récemment, avec le concept MyPlate, il est suggéré de consommer une portion de PL faible en gras par repas [43].
3.1- Produits laitiers et santé
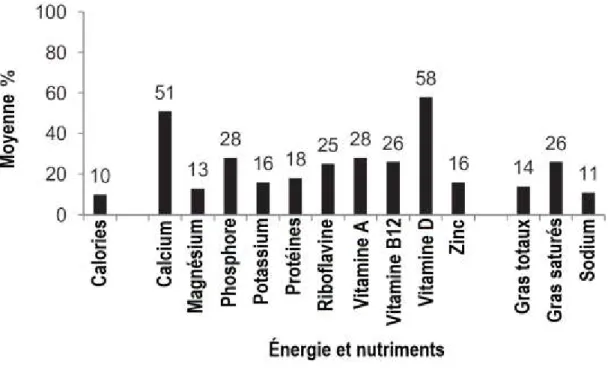
La consommation quotidienne de PL contribue de façon importante aux apports en protéines, calcium, magnésium, vitamine D et potassium dans l’alimentation nord-américaine, et ce, malgré le fait qu’au Canada, seulement un adulte sur trois en consomme assez et qu’aux États-Unis, seulement 15 % de la population en consomme suffisamment [44, 45]. La Figure 5 présente le pourcentage des besoins en énergie, vitamines et minéraux comblés par la consommation de 1.8 portion de PL par jour. Cette quantité correspond à la consommation moyenne de PL aux États-Unis mesurée lors de l’enquête NHANES 2003-2004 [46].
En plus de fournir une importante proportion des nutriments énumérés précédemment, la consommation de PL est associée à plusieurs avantages sur la santé. La consommation de la quantité recommandée de PL est associée à des bénéfices modérés sur la santé osseuse. Les enfants et les adolescents sont les personnes dont la santé osseuse bénéficie le plus d’une consommation élevée de PL [44]. La littérature montre aussi un effet protecteur de la consommation de PL sur le diabète de type II et le syndrome métabolique. Des apports élevés en PL sont
15 associés avec un risque plus faible de développer le diabète de type II ou le syndrome métabolique [44]. Enfin, la consommation de PL serait associée à une diminution de l’incidence de maladies coronariennes et d’infarctus du myocarde [44].
Figure 5: Pourcentages des besoins quotidiens comblés par la consommation de 1.8 portion de produits laitiers. Figure tirée de Rice et coll. [44]
3.2- Produits laitiers et pression artérielle
Le débat sur l’effet de la consommation de PL et sur la PA n’est pas récent. Effectivement, au début des années 1980, une enquête nutritionnelle a montré une relation entre des apports élevés en calcium et une PA plus faible [8, 47]. Comme la consommation moyenne de PL contribue à plus de 50% de l’apport en calcium dans l’alimentation nord-américaine, des chercheurs se sont alors penchés sur la relation entre la consommation de PL et la PA [44].
3.2.1- Mécanismes d’action
Les bénéfices des PL sur la PA proviennent de la composition nutritionnelle unique en micronutriments, plus particulièrement en potassium, magnésium et calcium, et des peptides bioactifs qu’ils contiennent. D’abord, le potassium, le magnésium et le calcium agissent ensemble au niveau cellulaire afin de contrer les effets néfastes du sodium sur la PA. L’impact de la consommation de sodium sur la PA est très bien
documenté. Il s’agit du nutriment avec le plus d’impact sur ce facteur de risque de MCV [17, 35]. L’homéostasie du sodium est contrôlée par les reins [17]. Des apports en sodium élevés et sur une période prolongée augmente la natrémie, le volume de liquide extracellulaire, l’excrétion urinaire de sodium, diminue l’activité de la rénine et de l’aldostérone et provoque une augmentation de la PA [17]. Le contrôle de la natrémie est assuré par la modulation de l’excrétion du sodium et par la modulation du volume sanguin [17].
L’effet du potassium sur la PA est très bien documenté [7]. Des méta-analyses ont mesuré un effet dose-réponse entre les apports en potassium et la diminution de la PA [48-51]. Une kaliémie élevée, mais normale, augmente la rétention de potassium et l’excrétion de sodium. Dans les vaisseaux sanguins, la polarisation des cellules musculaires lisses leur permet de se dilater. Une concentration sérique de potassium élevée provoque l’hyperpolarisation des cellules endothéliales et a un effet vasodilatateur [52]. À l’inverse, de faibles apports en potassium diminuent la concentration sérique de potassium, ce qui diminue l’activité de la pompe sodium-potassium-ATPase et augmente la natrémie [53].
L’effet vasodilatateur du magnésium a aussi été documenté, mais les résultats des études ne sont pas constants. De faibles apports alimentaires en magnésium ou une déficience cause une augmentation de la PA, mais la situation inverse ne semble pas amener de bénéfices [7, 54]. En fait, le magnésium agit comme un bloqueur naturel de faible puissance des canaux calciques en affectant les concentrations intra/extracellulaires des ions de calcium et en inhibant la dépolarisation de la membre cellulaire par le calcium [54]. Son action sur les canaux calciques a un effet vasodilatateur. Des apports élevés en magnésium augmentent aussi la prostaglandine E, un vasodilatateur [55]. Enfin, les bénéfices sur la PA des apports élevés en magnésium seraient surtout présents lorsque les apports en sodium sont faibles.
Sensiblement comme pour le magnésium, les résultats des études de l’effet du calcium sur la PA manquent de concordance [7]. Des études ont observé une relation inverse, mais l’utilisation de suppléments n’apporte aucun bienfait sur la PA. Les apports en sodium ont un effet important sur le calcium : des apports élevés en sodium augmentent l’excrétion rénale de calcium ainsi que la concentration
17 intracellulaire de calcium, ce qui augmente la RVP et la PA. À l’inverse, une alimentation riche en calcium augmente la calcémie, diminue la concentration intracellulaire de calcium et a des effets bénéfiques sur la PA [15]. Lorsque la calcémie est adéquate, le calcium stabilise la membrane des cellules vasculaires, réduisant son entrée dans les cellules et son effet vasoconstricteur. En somme, bien que les évidences ne soient pas toutes aussi fortes quant aux bénéfices de chacun des nutriments des PL sur la PA, leur action synergique semble bénéfique pour la PA.
L’effet des peptides bioactifs du lait sur la PA est relié à l’enzyme de conversion de l’angiotensine (ECA) [16, 17]. L’ECA convertit l’angiotensinogène en angiotensine II qui va ensuite se lier à la membrane cellulaire. Une fois liée, l’angiotensine provoque l’augmentation de la concentration intracellulaire du calcium ainsi que la déplétion de la concentration en magnésium, ce qui résulte en la vasoconstriction et l’augmentation de la PA. L’angiotensine bloque aussi la production d’aldostérone, ce qui augmente la rétention sodée et l’excrétion du potassium et provoque l’élévation de la PA. Les peptides bioactifs du lait inhibent l’ECA. L’inhibition de l’ECA bloque l’ensemble de ses effets néfastes sur la PA. Des médicaments antihypertenseurs ciblent d’ailleurs l’ECA et sont très efficaces. L’effet des peptides du lait sur l’ECA est toutefois moins puissant que celui des médicaments [16, 17].
3.2.2- Études observationnelles
En 1983, Ackley et coll. ont réalisé la première étude transversale sur la relation entre la consommation de PL et la PA. Pour la première fois, une association inverse entre les apports en calcium provenant des PL et la PA a été mesurée [56]. Par la suite, plusieurs études transversales ou prospectives ont été réalisées afin de déterminer l’effet protecteur des PL sur l’HTA. Beaucoup de ces études ont mesuré une relation inverse entre la consommation de PL et au moins un paramètre, systolique ou diastolique, de la PA. À l’inverse, d’autres études n’ont mesuré aucune relation entre ces deux éléments. Le Tableau 2 présente les études transversales sur le sujet. Une association inverse entre l’apport en PL et les niveaux de PA ou le risque de PA élevée ou d’HTA a été mesurée dans toutes ces études, et ce, malgré l’hétérogénéité de la grosseur des cohortes
19
Tableau 2: Études transversales
Auteur, année Population Variable Résultats
Ackley, 1983 [56] N= 5050, H et F
PAS et PAD Chez les H : corrélation inverse entre l’apport total en produits laitiers et la PAD
Joffres, 1987
[57] N= 1 379 PAS et PAD Association inverse entre la consommation de lait et la PAS Azadbakht, 2005
[58]
N= 827, H et F Risque de PA élevée
Corrélation inverse entre l’apport total en produits laitiers et le risque d’hypertension Djousse, 2006 [59] N= 4 797, H et F Prévalence de l’HTA
Association inverse entre la consommation de produits laitiers et la prévalence d’hypertension et la PAS
Ruidavets, 2006 [60]
N= 912, H PAS et PAD Association inverse entre la consommation de lait et la PAS chez les sujets hypertendus et normo-tendus
Snijder, 2007 [61]
N= 1 896, H et F
PAS et PAD Association inverse entre la consommation de produits laitiers et la PAD
Beydoun, 2008 [62]
N= 14 464, H et F
PAS et PAD Association inverse entre la consommation de lait, de fromage ou de yogourt et la PA
21 Le Tableau 3 présente les 11 études prospectives les plus importantes sur le sujet. Huit d’entre elles ont mesuré une corrélation inverse entre l’apport en PL et les niveaux de PA ou le risque d’HTA [63-70]. Il est cependant intéressant de constater que trois de ces études n’ont mesuré aucune association malgré qu’elles aient été réalisées avec un grand nombre de sujets [61, 71, 72]. La durée du suivi ne semble pas être un facteur ayant affecté les résultats puisqu’autant dans les études ayant mesuré une association significative que sans association significative, les suivis étaient plus ou moins longs. L’ensemble des études observationnelles montre une association inverse entre une consommation élevée de PL totaux ou faibles en gras et le niveau de PA ou le risque d’HTA. Conséquemment, une revue sur les études épidémiologiques et deux méta-analyses ont évalué les résultats de l’ensemble de ces études.
La revue de littérature sur les études épidémiologiques a été publiée en 2006 [73]. Les conclusions de cette étude sont basées sur les résultats de six méta-analyses portant sur la consommation de PL et le risque de MCV. Les auteurs ont conclu qu’une alimentation faible en sodium et avec des apports en calcium, magnésium et potassium respectant les recommandations aide à prévenir l’HTA et que l’inclusion des PL dans l’alimentation quotidienne facilite l’adoption d’une telle alimentation. Toutefois, les données recueillies pour cette étude ne permettaient pas d’évaluer la relation de cause à effet entre la consommation de PL et la diminution de la PA. [73] En 2012, la méta-analyse de Ralston et coll. [9] a mesuré la relation dose-réponse entre la consommation de PL et le risque de PA élevée (≥130 mm Hg/ ≥ 85 mm Hg) chez les adultes. Les auteurs se sont aussi intéressés à la différence entre les PL faibles et riches en gras ainsi qu’à la différence entre les PL liquides ou solides. Leurs données regroupaient seulement les études prospectives réalisées avec plus de 1000 sujets et dont le suivi était de plus d’un an. Cette méta-analyse a regroupé cinq études pour un total d’environ 45 000 sujets, dont 11 500 avec une PA élevée. Selon cette étude, les personnes consommant quotidiennement beaucoup de PL ont un risque 13 % inférieur d’avoir une PA élevée comparativement à celles en consommant peu. Cet effet provient principalement de la consommation de PL faibles en gras qui est associée à une diminution de 16 % du risque. À l’inverse, les personnes consommant beaucoup de PL à teneur élevée en matière grasse n’ont pas de bénéfices sur le risque de PA élevée comparativement aux faibles
consommateurs de PL riches en gras. Enfin, la consommation de PL liquides (lait et yogourt) est associée à une diminution du risque de 8 % et aucune diminution du risque n’a été mesurée avec la consommation de produits solides comme le fromage. Enfin, contrairement à la première méta-analyse [73], la relation directe entre la consommation de PL et le niveau de PA a été mesurée.[9]
Finalement, la méta-analyse la plus récente a été publiée un peu plus tard en 2012 [10]. Il s’agit d’une autre étude regroupant des données d’études prospectives. Les auteurs ont inclus neuf études avec des suivis de 2 à 15 ans pour un total de 57 000 sujets, dont 15 000 avec HTA. Selon cette analyse, l’augmentation de la consommation totale de PL (100 g à 700 g par jour), de la consommation de PL faibles en gras (100 g à 500 g par jour) et de la consommation de lait (100 g à 500 g par jour) sont toutes associées à un risque plus faible d’HTA. Ces résultats concordent donc avec la méta-analyse précédente, tout en confirmant que la consommation de ces aliments est protectrice contre l’HTA.
Plusieurs facteurs semblent affecter l’association entre la consommation de PL et l’HTA. Le type d’aliment et le contenu en gras, les apports usuels en minéraux des sujets, leur sexe, le niveau initial de PA des sujets, la prise de médication anti-HTA ou le niveau de risque de MCV [17]. Comme ces méta-analyses ont été réalisées à partir d’études de cohortes, il est impossible de déterminer s’il s’agit seulement d’une corrélation ou s’il s’agit d’une relation de cause à effet. Aussi, il est difficile d’établir la dose recommandée ou la dose efficace à partir de laquelle des bénéfices sur la PA. C’est avec ces différentes interrogations qu’ont été menées différentes études randomisées contrôlées présentées dans la section suivante.
23
Tableau 3: Études prospectives
Auteur, année (référence) Population Durée du suivi Variable Résultats
Ascherio, 1996 [71] n=41 541, F, normo-tendues
4 ans PAS et PAD Associations non-significatives en la consommation de produits laitiers faibles ou riches en gras et la PAS et la PAD
Pereira, 2002 [67] n=3 157, H et F 10 ans Incidence de l’HTA Consommation de produits laitiers associée à une incidence plus faible d’HTA chez sujets avec IMC > 25.0 kg/m2
Elwood, 2004 [64] n=2 512, H Entre 20 et 24 ans
PAS et PAD Association inverse entre la consommation de lait et la PAS Alonso, 2005 [63] n=5 880, H et F Suivi moyen à
27 mois
Risque d’HTA Diminution du risque avec la consommation de produits laitiers totale et de produits laitiers faibles en gras Steffen, 2005 [68] n=4,304, H et F normo-tendus, suivi à 7 et 15 ans Après 7 et 15 ans
PAS et PAD Aucune association entre la consommation totale de produits laitiers et le risque de PA élevée; Association inverse entre la
consommation de lait et le risque de PA élevée
Snijder, 2008 [61] n=1 124, H et F, suivi à 6.4 ans
6.4 ans PAS et PAD Apports en produits laitiers non-reliés à des changements dans la pression artérielle
Auteur, année (référence) Population Durée du suivi Variable Résultats
Toledo, 2008 [69] n=2 290, H et F,
normo-hypertendus, suivi de 12 mois
12 mois PAS et PAD Association inverse entre la consommation de PL et la PA
Wang, 2008 [70] n= 28 886, F normo-tendues, suivi à 10 ans
10 ans Risque d’HTA Association inverse entre les produits laitiers totaux et produits laitiers faibles en gras et le risque d’HTA Engberink, 2009 [65] n= 2 245, H et F,
normo-tendus
après 2 et 6 ans Risque d’HTA Association inverse entre la
consommation de produits laitiers et le risque d’HTA
Heraclides, 2012 [72] n= 1 750, H et F, normo-hypertendus
10 ans PAS et PAD Association inverse non-significative entre la consommation de PL et la PA Livingstone, 2013 [66] n=2 512, H Aux 5 ans,
jusqu’à 22.8 ans en moyenne
PAS et PAD PA plus faible chez les grands consommateurs vs les faibles consommateurs de PL
25
3.2.3- Études randomisées contrôlées
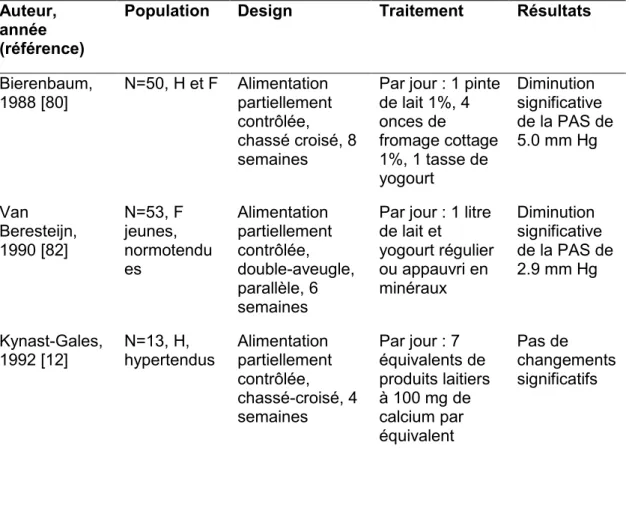
Plusieurs études contrôlées randomisées ont été réalisées pour évaluer l’existence d’une relation cause à effet entre la consommation de PL et la diminution de la PA (Tableau 4). Les résultats de ces études ne concordent pas tous et certains sont même contradictoires. D’abord, certaines études évaluaient la relation entre la consommation de PL et la PA, alors que d’autres évaluaient l’effet de différents régimes alimentaires, avec ou sans PL, sur la PA. Six des onze études réalisées sur l’effet per se des PL sur la PA n’ont pas mesuré de diminution significative de la PA suite à la consommation de produits laitiers [12, 74-78]. À l’exception de l’étude de Stancliffe et coll. [79] qui a mesuré une diminution de la PAS et de la PAD, les autres études n’ont mesuré qu’une diminution significative d’un seul paramètre de la PA [80-83].
Tableau 4: Études randomisées contrôlées Auteur,
année (référence)
Population Design Traitement Résultats
Bierenbaum, 1988 [80] N=50, H et F Alimentation partiellement contrôlée, chassé croisé, 8 semaines
Par jour : 1 pinte de lait 1%, 4 onces de fromage cottage 1%, 1 tasse de yogourt Diminution significative de la PAS de 5.0 mm Hg Van Beresteijn, 1990 [82] N=53, F jeunes, normotendu es Alimentation partiellement contrôlée, double-aveugle, parallèle, 6 semaines
Par jour : 1 litre de lait et yogourt régulier ou appauvri en minéraux Diminution significative de la PAS de 2.9 mm Hg Kynast-Gales, 1992 [12] N=13, H, hypertendus Alimentation partiellement contrôlée, chassé-croisé, 4 semaines Par jour : 7 équivalents de produits laitiers à 100 mg de calcium par équivalent Pas de changements significatifs
Auteur, année (référence)
Population Design Traitement Résultats
Appel, 1997 [13] N= 459, H et F Alimentation contrôlée, traitements en parallèle, 8 semaines Diète DASH, diète riche en fruits et légumes, diète contrôle Vs contrôle : Diète DASH : -5.5 / -3.3 mm Hg; Diète riche en fruits et légumes : -2.9/-1.1 mm Hg Barr, 2000 [74] N= 204, H et F faibles consommate urs de PL Alimentation partiellement contrôlée, parallèle, 12 semaines 3 tasses par jour de lait écrémé ou 1% Diminution significative de la PAS et de la PAD, mais non différente de la diète contrôle Hilary-Green, 2000 [81] N=38, H et F Alimentation partiellement contrôlée, chassé croisé à double aveugle, 4 semaines Par jour : 480 ml lait écrémé avec ou sans supplément de calcium ou supplément de potassium Diminution significative de la PAS avec les trois traitements Nowson, 2004 [14] N=94, H et F Alimentation partiellement contrôlée, chassé-croisé, 4 semaines Diète riche en potassium et faible en sodium, diète riche en calcium et diète DASH Diète riche en potassium et faible en sodium a diminué le plus la PA Alonso, 2009 [84] N= 45, H et F, jeunes normo-tendus Alimentation partiellement contrôlée, chassé-croisé, 8 semaines 3.5 portions par jour de produits laitiers entiers ou faibles en gras Pas de différence significative dans la PA
27
Auteur, année (référence)
Population Design Traitement Résultats
Hilpert, 2009 [15] N= 23, H et F Alimentation contrôlée, chassé-croisé, 5 semaines Diète riche en fruits, légumes et produits laitiers, diète riche en fruits et légumes, diète style Western Diète riche en PL, fruits et légumes : diminution significative de la PA comparé à la Western Wennersberg, 2009 [78] N= 121, H et F, syndrome métabolique Alimentation non contrôlée, parallèle, 6 mois 3 à 5 portions par jour Pas de changement significatif Usinger, 2010 [77] N= 94, H et F, pré/ hypertendus Alimentation partiellement contrôlée, parallèle, 8 semaines, MAPA 150 ml lait fermenté, 300 ml lait fermenté, lait placebo Pas de diminutions significatives Stancliffe, 2011 [79] N=40, H et F, avec syndrome métabolique Alimentation partiellement contrôlée, 12 semaines 3.5 portions vs <0.5 portions Diminution significative de la PAS et PAD avec 3.5 portions Van Meilj, 2011 [83] N=35, H et F avec embonpoint ou obésité Alimentation partiellement contrôlée, chassé-croisé, 8 semaines
Par jour : lait et yogourt faible en gras ou aliments contrôles Diminution significative de la PAS de 2.9 mm Hg Maki, 2013 [75] N=62, H et F, pré/hyperten sion Alimentation partiellement contrôlée, chassé-croisé, 5 semaines Par jour : 1 portion de lait, de yogourt et de fromage faibles en gras Pas de changements significatifs Rideout, 2013 [76] N=23, H et F obèses et normo-tendus Alimentation partiellement contrôlée, chassé-croisé, 12 semaines Par jour : 4 portions ou 2 portions de produits laitiers faibles en gras Pas de changements significatifs Adapté de Kris-Etherton [17]
Dans les trois études ayant évalué l’effet de différentes alimentations, contenant ou pas des PL, sur la PA, la plus importante est l’étude sur la Dietary Approach to Stop
Hypertension (DASH) [13]. Il s’agit d’une étude contrôlée randomisée d’envergure où
l’effet sur la PA de trois régimes alimentaires était comparé. Le premier régime était la diète contrôle; faible en fruits, légumes et produits laitiers. La diète fruits et
légumes était riche en fruits et légumes et faible en produits laitiers et la diète de combinaison était riche en fruits, légumes et produits laitiers à teneur réduite en gras
et faible en gras saturés et totaux. Les 459 adultes recrutés avaient une pression artérielle normale ou élevée (<160 mm Hg). Leur pression artérielle était d’abord stabilisée durant trois semaines avec la diète contrôle. Par la suite, ils consommaient une des trois diètes attribuées au hasard durant huit semaines consécutives. La PA était mesurée à différents moments avec un appareil automatique ou par MAPA. La réduction de la PA suite à la diète de combinaison, comparativement à la diète
contrôle, était plus importante que celle mesurée suite à la diète fruits et légumes.
L’effet était encore plus important chez les sujets hypertendus. Avec le nombre important de sujets, l’excellente méthodologie et l’utilisation du MAPA, les résultats de cette étude ont une grande puissance et ont eu une grande importance pour la rédaction des recommandations pour le traitement de l’hypertension. Enfin, environ 50% de la diminution de la PA dans la diète combinaison est attribuable aux PL [85]. Nowson et coll. ont comparé l’effet d’une alimentation riche en potassium et faible en sodium à la diète DASH et à une diète riche en calcium. En effet, dans le groupe avec une alimentation faible en sodium et riche en potassium, la diminution de la PA était semblable à celle du groupe sous la diète DASH. Ces résultats suggèrent qu’une bonne partie de l’effet bénéfique des produits laitiers sur la PA provient du potassium qu’ils contiennent. Bien que l’alimentation était partiellement contrôlée, il est aussi intéressant de constater qu’avec un counseling provenant de nutritionnistes professionnels, les sujets étaient capables d’adopter ces régimes alimentaires sans difficulté particulièrement. [14]
Enfin, l’étude de Hilpert et coll. portait sur des sujets hypertendus et a comparé l’effet d’une diète riche en produits laitiers, fruits et légumes à une diète riche en fruits en légumes et une diète occidentale typique. L’alimentation était totalement contrôlée. Il s’agit de la seule étude montrant que la diminution du calcium intracellulaire,
29 occasionnée par une alimentation riche en potassium et en calcium, est corrélée à la diminution de la PAD.[15]
Les études où l’alimentation était contrôlée totalement ont mesuré des diminutions significatives de la PA, mais les différences entre les diètes comparées ne permettent par d’attribuer ces diminutions seulement aux PL [13, 15]. Les études où l’alimentation n’était que partiellement contrôlée n’ont pas toutes mesuré de diminution de la PA. Cela est possiblement attribuable aux défauts dans la méthodologie par le contrôle partiel de l’alimentation, par le nombre insuffisant de sujets ou par la durée de l’étude. Malgré certaines incongruités dans les résultats des études contrôlées randomisées, les données montrent que la consommation de PL est associée à la diminution du risque d’HTA et semble aussi avoir un effet hypotenseur. Malheureusement, les études contrôlées réalisées jusqu’à présent n’ont pas permis de déterminer l’impact de la consommation de PL en-soi sur la pression artérielle autant chez les sujets normo-tendus qu’hypertendus. D’autres études contrôlées avec une méthodologie visant directement cet impact ou la quantification de l’impact de la consommation de PL sur l’HTA sont toujours nécessaires.
3.3- Produits laitiers et fonction endothéliale
L’effet de la consommation de produits laitiers sur la fonction endothéliale n’a pas été beaucoup étudié. Une étude transversale a été réalisée sur la relation entre la consommation de PL et la rigidité artérielle. Selon les résultats, l’augmentation de la consommation de PL est inversement associée à la rigidité artérielle [86].
Des études contrôlées ont aussi été réalisées, mais les résultats sont moins concluants. D’abord, une première étude a été réalisée sur 69 sujets qui ont consommé un régime leur procurant un déficit énergétique durant douze semaines, soit riche en protéines laitières et en calcium ou riche en protéines d’autres types et avec un contenu modéré en calcium [87]. La fonction endothéliale était mesurée par les concentrations de ICAM-1, VCAM-1 et de CRP. Les niveaux de ICAM-1 et de CRP étaient significativement réduits à la fin de chacune des interventions, indépendamment des diètes. Selon cette étude, les PL n’ont pas d’effets particuliers sur ces indicateurs de la fonction endothéliale.
Dans l’étude de Wennersberg et coll. [78], lors d’une intervention en parallèle d’une durée de six mois, les participants (n=121) devaient consommer quotidiennement 3 à 5 portions de PL ou conserver leurs habitudes alimentaires usuelles. À la fin de l’intervention, la fonction endothéliale était évaluée par les niveaux sériques de E-sélectine et du facteur de von Willebrand. Aucune différence significative n’a été mesurée entre les deux interventions pour ces deux éléments après six mois.
Une étude contrôlée randomisée avec placebo a évalué l’effet des peptides du lait sur la fonction endothéliale [88]. Les sujets (n=89) devaient consommer du lait faible en peptides (5 mg/jour) ou riche en peptides (50 mg/jour) pendant 12 semaines. La fonction endothéliale était évaluée avec l’indice d’augmentation de l’onde pulsatile digitale suite à l’ingestion de nitroglycérine ou l’inhalation de Salbutamol. Suite à la consommation du lait riche en peptides, l’indice d’augmentation de l’onde pulsatile digitale avait diminué alors qu’il était resté constant dans le groupe placebo. Ces résultats suggèrent une amélioration de la fonction endothéliale suite à la consommation de lait riche en peptides.[88]
L’étude de van Meilj [89] visait à évaluer l’effet de la consommation de produits laitiers faibles en gras sur l’inflammation et la fonction endothéliale chez des sujets avec surpoids ou obèses. Les sujets devaient consommer des produits laitiers faibles en gras ou des aliments contrôles durant deux périodes de huit semaines en chassé-croisé. L’effet des PL sur la fonction endothéliale était mesuré par les variations des concentrations sériques de ICAM-1 et de VCAM-1 et aucune différence n’a été mesurée entre les deux diètes.
La plus récente étude a mesuré l’effet de la consommation de trois portions de produits laitiers faibles en gras durant cinq semaines sur la fonction endothéliale évaluée par l’indice d’hyperémie réactive. Les auteurs ont mesuré une amélioration significative de la fonction endothéliale seulement chez les sujets avec une dysfonction endothéliale au début de l’étude.[75]
L’effet des produits laitiers sur l’amélioration de la fonction endothéliale est toujours incertain. Cependant, les différentes méthodes utilisées pour évaluer la fonction endothéliale ainsi que les différents protocoles peuvent avoir influencé les résultats de ces études. Ainsi, les conclusions de ces études doivent être interprétées avec précautions.
31
4- Objectifs et hypothèses
Suite à cette revue de littérature, nous pouvons constater que :
- Selon les études de cohortes, la consommation de produits laitiers est associée à une diminution du risque d’hypertension artérielle;
- Les résultats des études contrôlées randomisées évaluant l’impact de la consommation de PL sur la PA manquent de concordance et ne permettent pas d’établir une relation claire de cause à effet, et ce, encore moins chez des sujets hypertendus;
- Malgré l’effet potentiellement bénéfique des PL sur la PA, il est difficile de se positionner sur l’effet des produits laitiers sur la fonction endothéliale;
- L’utilisation du MAPA dans les études sur la relation entre la consommation de PL et la PA n’est que très peu fréquente;
- La mesure de l’hyperémie réactive dans les études sur la relation entre la consommation de PL et la fonction endothéliale n’a été utilisée qu’une fois. À partir de ces constats, nous avons établi comme objectif d’évaluer l’impact de la consommation de PL sur la pression artérielle, mesurée par MAPA, et la fonction endothéliale, mesurée par l’indice d’hyperémie réactive, chez des hommes et des femmes avec une hypertension légère à modérée.
Nous avons comme hypothèses :
- La consommation quotidienne de trois portions de produits laitiers diminue de façon significative la PA (PAS et PAD) moyenne diurne, mesurée avec MAPA, comparativement à une alimentation excluant ce groupe d’aliments; - La consommation quotidienne de trois portions de produits laitiers améliore
de façon significative la fonction endothéliale, mesurée par l’indice d’hyperémie réactive, comparativement à une alimentation excluant ce groupe d’aliments.
33
Chapitre III- Impact de la consommation de
produits laitiers sur l’hypertension artérielle
essentielle : une étude clinique
Impact of dairy consumption on essential hypertension: a clinical study
Jean-Philippe Drouin-Chartier1, Iris Gigleux1, André J Tremblay1, Luc Poirier2, Benoît
Lamarche1, Patrick Couture1
1- Institut sur la Nutrition et les Aliments Fonctionnels, Université Laval, Québec (Québec), Canada
2- Centre de recherche du CHUQ, Université Laval, Québec (Québec), Canada
Cet article a d’abord été soumis à la revue Nutrition Journal le 3 mars 2014. La version présentée dans ce mémoire est celle corrigée suite aux commentaires du comité de révision de la revue et qui a été resoumise le 10 juillet 2014.

![Figure 3: Mécanismes régulant la pression artérielle. Figure adaptée de Mayet [29].](https://thumb-eu.123doks.com/thumbv2/123doknet/6686653.183472/23.918.198.818.181.591/figure-mécanismes-régulant-pression-artérielle-figure-adaptée-mayet.webp)