MÉMOIRE DU DIPLÔME D’ÉTUDES SPECIALISÉES
DE PHARMACIE HOSPITALIERE PRATIQUE ET RECHERCHE
Soutenu le 05 Octobre 2017
Par Mlle Marina ORLOFF Né(e) le 04 Janvier 1990
Conformément aux dispositions de l’Arrêté du 04 octobre 1988 tenant lieu de
THÈSE
POUR LE DIPLÔME D’ÉTAT DE DOCTEUR EN PHARMACIE
----oOo----
SIMULATION EN SANTE :
POSITIONNEMENT DANS L’ACQUISITION DES COMPETENCES
EN PHARMACIE CLINIQUE
----oOo----
JURY :
Président : Monsieur le Professeur Stéphane Honoré Membres : Monsieur le Docteur Rémy Collomp
Monsieur le Professeur Bertrand Décaudin Monsieur le Professeur Rémi Varin
Université d’Aix-Marseille – Faculté de Pharmacie – 27 boulevard Jean Moulin – CS 30064 - 13385 Marseille Cedex 05 - France Tél. : +33 (0)4 91 83 55 00 - Fax : +33 (0)4 91 80 26 12
MEMOIRE DU DIPLÔME D’ÉTUDES SPECIALISÉES DE
PHARMACIE HOSPITALIERE PRATIQUE ET RECHERCHE
Soutenu le 05 Octobre 2017
Par Mlle Marina ORLOFF Né(e) le 04 Janvier 1990
Conformément aux dispositions de l’Arrêté du 04 octobre 1988 tenant lieu de
THÈSE
POUR LE DIPLÔME D’ÉTAT DE DOCTEUR EN PHARMACIE
----oOo----
SIMULATION EN SANTE :
POSITIONNEMENT DANS L’ACQUISITION DES COMPETENCES
EN PHARMACIE CLINIQUE
----oOo----
JURY :
Président : Monsieur le Professeur Stéphane Honoré Membres : Monsieur le Docteur Rémy Collomp
Monsieur le Professeur Bertrand Décaudin Monsieur le Professeur Rémi Varin
Université d’Aix-Marseille – Faculté de Pharmacie – 27 boulevard Jean Moulin – CS 30064 - 13385 Marseille Cedex 05 - France Tél. : +33 (0)4 91 83 55 00 - Fax : +33 (0)4 91 80 26 12
27 Boulevard Jean Moulin – 13385 MARSEILLE Cedex 05 Tel. : 04 91 83 55 00 – Fax : 04 91 80 26 12
DEPARTEMENT BIO-INGENIERIE PHARMACEUTIQUE Responsable : Professeur Philippe PICCERELLE
PROFESSEURS
BIOPHYSIQUE M. Vincent PEYROT
M. Hervé KOVACIC
GENIE GENETIQUE ET BIOINGENIERIE M. Christophe DUBOIS
PHARMACIE GALENIQUE, PHARMACOTECHNIE INDUSTRIELLE,
BIOPHARMACIE ET COSMETIQUE M. Philippe PICCERELLE
ADMINISTRATION :
Doyen : Mme Françoise DIGNAT-GEORGE
Vice-Doyens : M. Jean-Paul BORG, M. Philippe CHARPIOT, M. Pascal RATHELOT
Chargés de Mission : M. David BERGE-LEFRANC, M. François DEVRED, Mme Caroline
DUCROS, Mme Pascale BARBIER
Conseiller du Doyen : M. Patrice VANELLE
Doyens honoraires : M. Jacques REYNAUD, M. Pierre TIMON-DAVID, M. Patrice VANELLE
Professeurs émérites : M. José SAMPOL, M. Jean-Pierre REYNIER
Professeurs honoraires : M. Guy BALANSARD, M. Jacques BARBE, M. Yves BARRA,
Mme Claudette BRIAND, M. Jacques CATALIN, Mme Andrée CREMIEUX, M. Aimé CREVAT, M. Bernard CRISTAU,
M. Gérard DUMENIL, M. Alain DURAND, Mme Danielle GARÇON, M. Maurice JALFRE, M. Joseph JOACHIM, M. Maurice LANZA, M. José MALDONADO, M. Patrick REGLI, M. Jean-Claude SARI,
Chef des Services Administratifs : Mme Florence GAUREL
Chef de Cabinet : Mme Sandrine NOURIAN
MAITRES DE CONFERENCES
BIOPHYSIQUE M. Robert GILLI
Mme Odile RIMET-GASPARINI Mme Pascale BARBIER
M. François DEVRED Mme Manon CARRE M. Gilles BREUZARD Mme Alessandra PAGANO
GENIE GENETIQUE ET BIOTECHNOLOGIE M. Eric SEREE-PACHA
Mme Véronique REY-BOURGAREL PHARMACIE GALENIQUE, PHARMACOTECHNIE INDUSTRIELLE,
BIOPHARMACIE ET COSMETOLOGIE
M. Pascal PRINDERRE M. Emmanuel CAUTURE Mme Véronique ANDRIEU Mme Marie-Pierre
SAVELLI
NUTRITION ET DIETETIQUE M. Léopold TCHIAKPE
A.H.U.
CULTURE ET THERAPIE CELLULAIRE M. Jérémy MAGALON
ENSEIGNANTS CONTRACTUELS
ANGLAIS Mme Caroline MONTET
DEPARTEMENT BIOLOGIE PHARMACEUTIQUE Responsable : Professeur Philippe CHARPIOT
PROFESSEURS
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE M. Philippe CHARPIOT
BIOLOGIE CELLULAIRE M. Jean-Paul BORG
HEMATOLOGIE ET IMMUNOLOGIE Mme Françoise
DIGNAT-GEORGE Mme Laurence CAMOIN Mme Florence SABATIER-MALATERRE
MICROBIOLOGIE M. Jean-Marc ROLAIN
M. Philippe COLSON PARASITOLOGIE ET MYCOLOGIE MEDICALE, HYGIENE
MAITRES DE CONFERENCES
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE Mme Dominique JOURDHEUIL-RAHMANI M. Thierry AUGIER
M. Edouard LAMY
Mme Alexandrine BERTAUD Mme Claire CERINI
Mme Edwige TELLIER M. Stéphane POITEVIN
HEMATOLOGIE ET IMMUNOLOGIE Mme Nathalie BARDIN
Mme Dominique ARNOUX Mme Aurélie LEROYER M. Romaric LACROIX
MICROBIOLOGIE Mme Michèle LAGET
M. Michel DE MEO
Mme Anne DAVIN-REGLI Mme Véronique ROUX M. Fadi BITTAR
Mme Isabelle PAGNIER Mme Sophie EDOUARD PARASITOLOGIE ET MYCOLOGIE MEDICALE, HYGIENE
ET ZOOLOGIE
Mme Carole DI GIORGIO M. Aurélien DUMETRE Mme Magali CASANOVA Mme Anita COHEN
BIOLOGIE CELLULAIRE Mme Anne-Catherine LOUHMEAU
A.H.U.
HEMATOLOGIE ET IMMUNOLOGIE Mme Sylvie COINTE
DEPARTEMENT CHIMIE PHARMACEUTIQUE Responsable : Professeur Patrice VANELLE
PROFESSEURS
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION M. Henri PORTUGAL Mme Catherine BADENS CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES M. Philippe GALLICE
CHIMIE MINERALE ET STRUCTURALE – CHIMIE THERAPEUTIQUE
M. Pascal RATHELOT M. Maxime CROZET
CHIMIE ORGANIQUE PHARMACEUTIQUE M. Patrice VANELLE
M. Thierry TERME PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE Mme Evelyne OLLIVIER
PROFESSEURS ASSOCIES A TEMPS PARTIEL (P.A.S.T.) GESTION PHARMACEUTIQUE, PHARMACOECONOMIE ET ETHIQUE PHARMACEUTIQUE OFFICINALE M. Jean-Pierre CALISSI MAITRES DE CONFERENCES
BOTANIQUE ET CRYPTOGAMIE, BIOLOGIE CELLULAIRE Mme Anne FAVEL
Mme Joëlle MOULIN-TRAFFORT
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION Mme Elisabeth SCHREIBER-DETURMENY Mme Catherine DEFOORT
M. Alain NICOLAY Mme Estelle WOLFF Mme Elise LOMBARD
CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET NUISANCES TECHNOLOGIQUES
M. David BERGE-LEFRANC M. Pierre REBOUILLON
CHIMIE THERAPEUTIQUE Mme Catherine DIANA
Mme Sandrine FRANCO-ALIBERT Mme Caroline DUCROS
M. Marc MONTANA
CHIMIE ORGANIQUE
PHARMACEUTIQUE HYDROLOGIE M. Armand GELLIS M. Christophe CURTI Mme Julie BROGGI M. Nicolas PRIMAS M. Cédric SPITZ M. Sébastien REDON
PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE M. Riad ELIAS
Mme Valérie MAHIOU-LEDDET Mme Sok Siya BUN
Mme Béatrice BAGHDIKIAN MAITRES DE CONFERENCE ASSOCIES A TEMPS PARTIEL (M.A.S.T.)
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION Mme Anne-Marie PENET-LOREC CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES M. Thierry ATHUYT
DROIT ET ECONOMIE DE LA PHARMACIE M. Marc LAMBERT
DROIT ET COMMUNICATION PHARMACEUTIQUES A L’OFFICINE ET GESTION DE LA PHARMAFAC
M. Philippe BESSON
AHU
CHIMIE ORGANIQUE PHARMACEUTIQUE Mme Manon ROCHE
ATER
DEPARTEMENT MEDICAMENT ET SECURITE SANITAIRE Responsable : Professeur Benjamin GUILLET
PROFESSEURS
PHARMACIE CLINIQUE Mme Diane BRAGUER
PHARMACODYNAMIE M. Benjamin GUILLET
TOXICOCINETIQUE ET PHARMACOCINETIQUE M. Athanassios ILIADIS
TOXICOLOGIE GENERALE M. Bruno LACARELLE
TOXICOLOGIE DE L’ENVIRONNEMENT Mme Frédérique GRIMALDI
MAITRES DE CONFERENCES
PHARMACODYNAMIE Mme Suzanne MOUTERDE-MONJANEL
PHYSIOLOGIE Mme Sylviane LORTET
Mme Emmanuelle MANOS-SAMPOL
TOXICOCINETIQUE ET PHARMACOCINETIQUE M. Hot BUN
M. Joseph CICCOLINI
Mme Raphaëlle FANCIULLINO TOXICOLOGIE GENERALE ET PHARMACIE CLINIQUE M. Pierre-Henri VILLARD
M. Stéphane HONORÉ
Mme Caroline SOLAS-CHESNEAU Mme Marie-Anne ESTEVE
A.H.U.
PHARMACODYNAMIE M. Philippe GARRIGUE
ATER
PHARMACODYNAMIE M. Guillaume HACHE Mme Ahlel
Mme Nathalie AUSIAS, Pharmacien Praticien hospitalier M. Pierre BERTAULT-PERES, Pharmacien Praticien hospitalier Mme Martine BUES-CHARBIT, Pharmacien-Praticien hospitalier M. Gérard CARLES, Pharmacien-Praticien hospitalier
Mme Nicole FRANCOIS, Pharmacien-Praticien hospitalier Mme Sophie GENSOLLEN, Pharmacien-Praticien hospitalier Mme Christine PENOT-RAGON, Pharmacien-Praticien hospitalier M. Stéphane PICHON, Pharmacien titulaire
M. Alain RAGON, Pharmacien-Praticien hospitalier
M. Badr Eddine TEHHANI, Pharmacien – Praticien hospitalier
Mise à jour le 1er décembre 2015
REMERCIEMENTS
Aux membres du jury
A Monsieur le Professeur Stéphane Honoré,
de bien vouloir m’accorder l’honneur de présider ce jury. Veuillez trouver ici le témoignage de mon profond respect et de mes sincères remerciements.
A mon directeur de thèse, Monsieur le Docteur Rémy Collomp,
pour m’avoir accueillie au CHU de Nice durant cette année d’internat et pour m’avoir initiée à la simulation via ce sujet de thèse, aussi passionnant qu’enrichissant. Merci infiniment Rémy, pour tout le temps que tu as pu m’accorder, pour ton aide et tes précieux conseils. Merci de ton soutien et de ta présence tout au long de ce travail. Sois assuré de toute ma reconnaissance et de mon profond respect. Au plaisir de continuer à travailler avec toi.
A Monsieur le Professeur Bertrand Décaudin,
pour avoir accepté de prendre part au jury et de juger ce travail. Veuillez recevoir l’expression de mes sincères remerciements.
A Monsieur le Professeur Rémi Varin,
pour l’honneur de vous compter dans mon jury. Merci d’avoir accepté de juger ce travail. Soyez assuré de tout mon respect et de ma gratitude.
Aux groupes de travail de la SFPC, pour avoir accepté d’apporter leur aide et leur
expertise à ce travail.
Un grand merci également aux participants aux Journées de formation de la SFPC de
Juin 2107, qui ont bien voulu prendre part à ce projet en partageant leur expérience
professionnelle ; merci également aux pharmaciens et internes du GHT06. Sans leur participation, ce projet n’aurait pas abouti.
A tous mes collègues rencontrés pendant ces quatre années d’internat, merci de m’avoir fait
découvrir la pharmacie hospitalière et de m’avoir toujours si bien accueillie. Par ordre d’apparition, un grand merci :
A l’équipe du CHI de Fréjus-Saint-Raphaël, pour votre gentillesse et votre bienveillance à mon égard lors de mes premiers pas en tant qu’interne.
A l’équipe marseillaise d’Oncopharma Timone, où j’ai découvert le monde passionnant des chimiothérapies. Merci pour toutes ces rigolades avec Bertrand et mes trois super co-internes : Lou, Juliette et Audrey. Merci à Lou pour notre complicité, ma plus belle rencontre marseillaise.
A l’équipe de la Conception de l’APHM, merci pour cette bonne ambiance de travail et ce stage formateur. Albert, merci de tout cœur pour tes conseils avisés, toute l’aide et le soutien que tu m’as apporté. Merci pour ta gentillesse, ta bonne humeur et les bons moments passés ensemble avec nos guitares.
A l’équipe du CH d’Antibes, pour le superbe été passé à vos côtés. Je me suis sentie parmi vous comme au sein d’une famille et y ai fait des rencontres formidables.
A l’équipe du CH de Cannes, un véritable bonheur d’avoir passé ces six mois avec vous, tant sur le plan professionnel que sur le plan personnel. Un immense merci à chacun de vous pour ce que vous m’avez apporté.
A l’équipe de la Clinique Plein Ciel à Mougins, et à madame Roubaud pour sa gentillesse et toute la confiance qu’elle a pu m’accorder durant ce stage.
Enfin, à l’équipe de l’Archet avec qui j’ai passé cette dernière année d’internat. Merci à l’équipe de la dispensation Laulau, Steph, Thomas et Nico. Plus que des collègues de travail, des amis, qui ont pris soin de moi et m’ont fait évoluer.
Merci à tous ceux qui ont fait partie de mon parcours professionnel pendant ces quatre ans. J’ai tout appris à vos côtés, vous m’avez fait prendre confiance en moi. Grâce à vous j’ai pu grandir, progresser et me dépasser.
A mes amis de Montpellier, merci pour ces super années pharma et ces soirées mémorables ! Merci à Jacky et Flo, mes copines qui pendant 5 ans m’ont entouré d’un soutien indéfectible. Même si la vie nous a séparées, je ne vous oublie pas.
Merci à Claire, ma Choue, ma meilleure amie depuis plus de dix ans. Merci d’être ce que tu es et de me permettre d’être ce que je suis. Tu as une place unique dans mon cœur.
A ma famille : mes frères, mes deux grand-mères. Et surtout à ma mère et à Bruno. Merci d’être toujours là, quoi qu’il arrive, de me supporter, de me soutenir, de me rassurer. Vous êtes pour moi un modèle de positivité et de volonté. Merci également de m’avoir transmis votre passion de la danse, qui m’a véritablement changée.
Enfin, merci à tous ceux qui ont fait de moi la personne indépendante et volontaire que je suis aujourd’hui. Aimés ou pas, vous m’avez permis de trouver ce que je voulais être dans la vie, mais surtout ce que je ne voulais pas être.
Cette thèse représente l’accomplissement d’années de travail et de sacrifices, mais également le début d’une nouvelle vie.
Je la dédie à mon grand-père, parti cette année, qui me manque, et qui, je le sais, aurait été très fier de moi à cet instant. C’est sur tes conseils que je me suis dirigée vers la pharmacie. Merci de m’avoir inculqué cette valeur du travail et cette volonté de réussir.
« L’UNIVERSITE N’ENTEND DONNER AUCUNE APPROBATION, NI
IMPROBATION AUX OPINIONS EMISES DANS LES THESES. CES OPINIONS
SOMMAIRE
REMERCIEMENTS ... 8
SOMMAIRE ... 12
LISTE DES ABREVIATIONS ... 17
LISTE DES FIGURES ET DES TABLEAUX ... 21
INTRODUCTION ... 24
PARTIE I. LA FORMATION EN PHARMACIE CLINIQUE : QUELLES METHODES D’APPRENTISSAGE DISPONIBLES ? ... 26
I. LA PHARMACIE CLINIQUE : UNE DISCIPLINE EN PLEINE EVOLUTION ... 27
1. Définitions ... 27
a) La pharmacie clinique ... 27
i. Définition, intérêt ... 28
ii. Historique ... 31
b) L’analyse pharmaceutique des prescriptions médicamenteuses ... 33
c) L’intervention pharmaceutique ... 37
d) La Conciliation des Traitements Médicamenteux ... 39
i. Définition ... 41
ii. Conciliation médicamenteuse à l’admission ... 43
iii. Conciliation médicamenteuse de sortie ou de transfert ... 49
e) Le bilan de médication ... 51
f) L’entretien pharmaceutique ... 56
g) L’éducation thérapeutique du patient ... 57
h) Organisation dans notre établissement ... 61
2. Les évolutions de la pharmacie clinique ... 61
b) Vers un nouveau modèle de pharmacie clinique ... 63
i. Le déploiement de la pharmacie clinique : mesures d’accompagnement ... 63
ii. Les activités de la SFPC ... 66
iii. Le lien ville-hôpital ... 67
c) La problématique de la formation : un frein au déploiement de la pharmacie clinique ... 69
II. LES APPROCHES PEDAGOGIQUES ... 71
1. Formation et compétences ... 71
2. L’enseignement présentiel traditionnel ... 74
3. Le e-learning... 76
4. Le Massive Open Online Course (MOOC)... 79
5. La simulation ... 81
a) Définition ... 81
b) Contexte d’apparition ... 81
c) Les enjeux de la simulation en santé ... 82
i. Apprentissage actif ... 82
ii. Gestion des risques ... 85
iii. Ethique et déontologie ... 86
d) Les limites de la simulation en santé ... 87
e) Différentes techniques de simulation en santé ... 89
i. Expérimentation animale ... 89
ii. Simulation humaine ... 90
iii. Simulation synthétique ... 91
iv. Simulation hybride ... 93
f) Etat des lieux ... 94
i. La simulation en Amérique du Nord ... 95
ii. La simulation en Europe ... 96
iii. La simulation en France ... 96
iv. Simulation en pharmacie ... 97
PARTIE II. MATERIELS ET METHODES ... 102
I. CREATION D’UN PROGRAMME DE SIMULATION ... 103
1. Bonnes pratiques de simulation ... 103
2. Déroulé d’une séance de simulation ... 104
a) Briefing ... 105
b) Déroulement du scénario ... 105
c) Débriefing ... 105
d) Evaluation de la séance ... 107
II. ANALYSE DE LA SITUATION ... 108
1. Participants à l’étude ... 108
2. Identification des axes prioritaires du programme de simulation ... 108
a) Actes de pharmacie clinique : retour d’expérience ... 108
b) Place de la simulation ... 109
3. Conception du programme ... 112
a) Objectif général ... 113
b) Elaboration d’une grille de simulation harmonisée ... 113
c) Elaboration des scénarios ... 114
d) Evaluation du programme de simulation ... 114
PARTIE III. RESULTATS ... 116
I. ANALYSE DE LA SITUATION ... 117
2. Actes de Pharmacie clinique ... 118
a) Répartition ... 118
b) Fréquence de survenue d’un problème ... 120
c) Identification du problème ... 121
i. Compétences techniques ... 122
ii. Compétences non techniques ... 123
d) Retour d’expérience dans la pratique de la pharmacie clinique : situations-problèmes ... 124
3. Place de la simulation ... 127
a) Acquisition de compétences ... 127
b) Pluriprofessionalisme ... 129
c) Réalisation d’une « bibliothèque » de vidéos d’entrainement ... 130
II. DEGAGEMENT DES OBJECTIFS GENERAUX, DES THEMES ET OBJECTIFS PEDAGOGIQUES ... 132
III. REDACTION DES SCENARIOS ... 133
1. Conception de la grille de simulation... 133
2. Module 1 : Réalisation d’un entretien d’admission ... 137
3. Module 2 : Réalisation d’une conciliation des traitements médicamenteux ... 142
4. Module 3 : Réalisation d’un bilan de médication ... 147
5. Module 4 : Réalisation d’un entretien pharmaceutique ... 152
6. Module 5 : Réalisation d’une séance d’éducation thérapeutique du patient ... 156
7. Elaboration des scénarios ... 160
a) Scénario 1- Réalisation d’une conciliation des traitements médicamenteux : échanges avec le médecin ... 160
b) Scénario 2 : Réalisation d’un entretien pharmaceutique avec un patient chronique atteint d’hypertension artérielle (HTA) ... 168
IV. EVALUATION DU PROGRAMME DE SIMULATION ... 172
1. Conception du mode d’évaluation ... 172
2. Réalisation des grilles d’évaluation du programme ... 172
a) Questionnaire de satisfaction et d’évaluation du programme de simulation ... 172
b) Questionnaire de taux de transfert de compétences ... 176
i. Auto-évaluation de l’apprenant ... 176
ii. Evaluation de l’apprenant en situation réelle ... 177
PARTIE IV. DISCUSSION ... 181
PARTIE V. CONCLUSION - PERSPECTIVES ... 189
ANNEXES ... 193
LISTE DES ABREVIATIONS
ACPE : Accreditation Concil for Pharmacy Education ACRM : Anesthesia Crisis Ressources Management AHU : Année Hospitalo-Universitaire
AIPAT : Accompagner et Informer le PATient chronique ALD : Affection de Longue Durée
AMM : Autorisation de Mise sur le Marché
ANEPC : Association Nationale des Enseignants en Pharmacie Clinique AOD : Anticoagulant Oral Direct
APPEX : Association pour la Promotion des Pharmacies EXpérimentales ARS : Agence Régionale de Santé
ASIP : Agence des Systèmes d’Information Partagés
AVK : Anti-Vitamine K BM : Bilan de Médication
BMO : Bilan Médicamenteux Optimisé CBU : Contrat de Bon Usage
CH : Centre Hospitalier
CHRU : Centre Hospitalier Régional Universitaire CHU : Centre Hospitalier Universitaire
CLOM : Cours en Ligne Ouvert et Massif CME : Commission Médicale d’Etablissement CRES : Comité Régional d’Education pour la Santé CRM : Crew Ressource Management
CSP : Code de la Santé Publique
CTM : Conciliation des Traitements Médicamenteux DGOS : Direction Générale de l’Offre de Soins DGS : Direction Générale de la Santé
DI : Divergence Intentionnelle DMP : Dossier Médical Personnel DNI : Divergence Non Intentionnelle DP : Dossier Pharmaceutique
DPC : Développement Professionnel Continu DU : Diplôme Universitaire
EFP : Européenne de Formation pour les Pharmaciens
EHPAD : Etablissement d’Hébergement pour Personnes Agées Dépendantes EIG : Evènement Indésirable Grave
EIM : Evènement Iatrogène Médicamenteux EM : Erreur Médicamenteuse
ENEIS : Enquête Nationale sur les Evènements Indésirables liés aux Soins EP : Entretien Pharmaceutique
EPP : Evaluation des Pratiques Professionnelles ES : Etablissement de Santé
ETP : Education Thérapeutique du Patient
EVER : Environnement Virtuel pour l’Enseignement et la Recherche FAQSV : Fonds d’Aide Qualité Soins de Ville
FFOD : Forum Français de la Formation Ouverte et à Distance FIR : Fonds d’Intervention Régional
FLOT : Formation en Ligne Ouverte à Tous
GIVRE : Groupe pour l’Innovation, la Valorisation et la Réflexion sur les Enseignements
GHT : Groupement Hospitalier de Territoire HTA : Hypertension artérielle
HAS : Haute Autorité de Santé
HPST : Hôpital, Patients, Santé, Territoire ICO : Institut de Cancérologie de l’Ouest
IGAS : Inspection Générale des Affaires Sociales IP : Intervention Pharmaceutique
MIS : Médicament Info Service
MMAS : Morisky Medication Adherance Scale
MOCA : Maintenance of Certification in Anesthesiology MOOC : Massive Open Online Course
OMA : Ordonnance Médicale à l’Admission
OMéDIT : Observatoire des Médicaments, des Dispositifs Médicaux et des Innovations Thérapeutiques
OMS : Organisation Mondiale de la Santé PA : Pédagogie Active
PACA: Provence Alpes Côte d’Azur
PEARLS: Promoting Excellence And Reflective Learning in Simulation PECM : Prise En Charge Médicamenteuse
PNSP : Programme National pour la Sécurité du Patient PPI : Prescription Potentiellement Inappropriée
PPS : Plan de Soins Personnalisé
PROFFIteROLE : Pratiques OFFicinales et jeux de ROLE PUI : Pharmacie à Usage Intérieur
RCP : Réunion de Concertation Pluridisciplinaire
REIPO : Réseau d’Enseignement et d’Innovation pour la Pharmacie d’Officine
RMM : Revue de Morbi-Mortalité
RMO : Références Médicales Opposables SFPC : Société Française de Pharmacie Clinique SOAP : Subjective, Objective, Assessment, Plan SPF : Service Public Fédéral
STP : Suivi Thérapeutique Pharmacologique
URC : Unité de Reconstitution des Chimiothérapies URPS : Union Régionale des Professionnels de Santé
LISTE DES FIGURES ET DES TABLEAUX
Figure 1. Algorithme simplifié de validation d’une ordonnance proposé par J. Calop
Figure 2. Interface Internet Act-IP© accessible librement sur le site de la SFPC
Figure 3. Evaluation des impacts d’une intervention pharmaceutique par l’échelle CLEO©
Figure 4. Conciliation médicamenteuse proactive/rétroactive – Fiche technique SFPC 2014
Figure 5. Conciliation des traitements médicamenteux: arbre décisionnel. D’après un schéma
initial d’Edith Dufay, CH de Lunéville, Mai 2012
Figure 6. Outil « Bilan de médication » validé par la SFPC
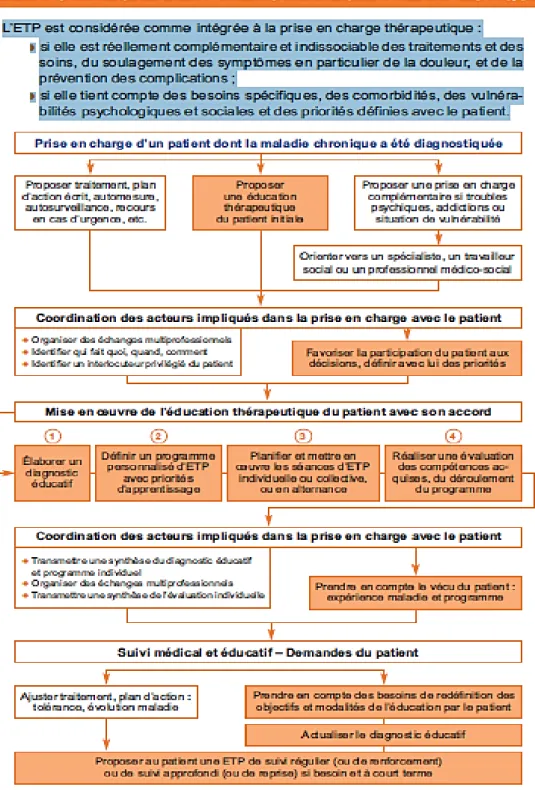
Figure 7. Comment s’intègre l’ETP à la stratégie thérapeutique- Recommandations ETP
HAS 2007
Figure 8. Représentation des objectifs définis par l’appel à projet DGOS 2016 s’articulant
autour du parcours de soins du patient
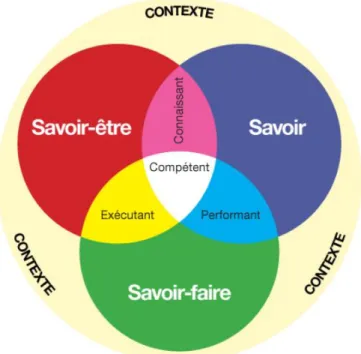
Figure 9. Boudreault H. L’évolution du être au savoir-être. Université du Québec à
Montréal. 2002
Figure 10. Le cône d’apprentissage adapté des travaux d’E. Dale
Figure 11. Les différents champs de la simulation en santé, Chiniara G, 2007
Figure 12. Exemple d’une pharmacie expérimentale, Faculté de Pharmacie de Montpellier
Figure 13. Les étapes d’une séance de simulation
Figure 14. Modèle de Kirkpatrick
Figure 15. Répartition des établissements de rattachement des participants à l'enquête
Figure 16. Fréquence de réalisation de la Conciliation des Traitements Médicamenteux
Figure 17. Fréquence de réalisation du Bilan de Médication
Figure 18. Fréquence de réalisation de l’Entretien Pharmaceutique
Figure 19. Fréquence de réalisation de l’Education Thérapeutique du Patient
Figure 21. Fréquence de survenue d’un problème dans la réalisation des actes de pharmacie
clinique
Figure 22. Nature et occurrence des problèmes rencontrés dans la réalisation des actes de
pharmacie clinique
Figure 23. Fréquence de survenue des problèmes liés à des compétences techniques pour
chaque acte de pharmacie clinique
Figure 24. Fréquence et nature des difficultés de communication ou de réalisation pratique
rencontrées dans les activités de pharmacie clinique
Figure 25. Situations problématiques de pharmacie clinique par thème et par acteur concerné
Figure 26. Evaluation du caractère adapté de la simulation comme méthode d’apprentissage
en pharmacie clinique
Figure 27. Evaluation de l’utilité de la simulation dans l’amélioration des différents types de
compétences
Figure 28. Utilité de la simulation en pharmacie clinique à l’échelle pluriprofessionnelle et
professionnels concernés
Figure 29. Utilité de la réalisation d’une bibliothèque de vidéos d’entrainement à la
pharmacie clinique
Figure 30. Les différents champs d’évaluation de programme de formation Pharmacie
clinique
Figure 31. Méthodologie d’élaboration d’un programme pédagogique intégrant la simulation.
Projet MULTISIM, Rapport final d’activité. R.Collomp, Juillet 2017
Figure 32. Représentation du continuum de formation à la pharmacie clinique
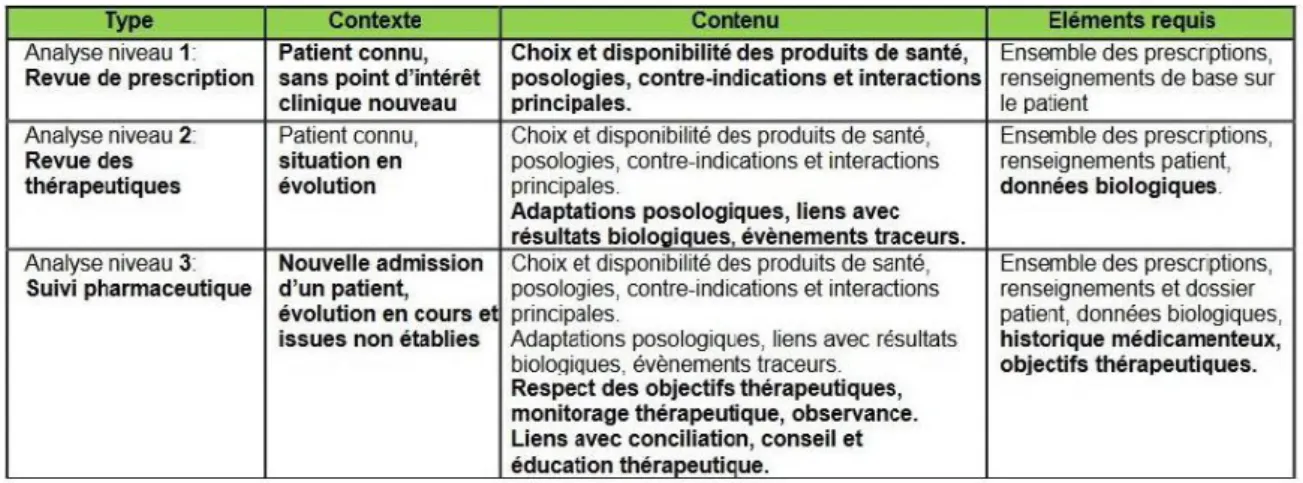
Tableau 1. Différents niveaux d’analyse des prescriptions selon la SFPC
Tableau 2. Trame entretien du patient à l’admission – Inspiré de la trame entretien patient de
la HAS, 2015
Tableau 3. Questionnaire sur l’intérêt de la simulation en santé pour l’acquisition de
compétences en Pharmacie clinique
Tableau 4. Récapitulatif des situations-problèmes identifiées dans les questionnaires
Tableau 5. Trame descriptive d’un module de simulation
Tableau 6. Module de simulation « Entretien d’admission »
Tableau 7. Module de simulation « Conciliation des traitements médicamenteux »
Tableau 8. Module de simulation « Bilan de médication »
Tableau 9. Module de simulation « Entretien pharmaceutique »
Tableau 10. Module de simulation « Education thérapeutique du patient »
Tableau 11. Questionnaire de satisfaction et d’évaluation du programme de simulation
Tableau 12. Questionnaire d’autoévaluation : taux de transfert de compétences en pharmacie
clinique
Tableau 13. Cartographie des compétences requises pour les actes définis dans le modèle
INTRODUCTION
La pharmacie clinique est une discipline actuellement en pleine évolution. Alors qu’elle est largement développée dans certains pays anglo-saxons, son intégration à la prise en charge des patients reste récente et hétérogène en France.
La complexité croissante des traitements médicamenteux, l’augmentation de leur coût, ainsi que la croissance du nombre d’hospitalisations liées à une iatrogénie médicamenteuse, amènent à un développement des activités cliniques du pharmacien, centrées sur le patient et menées en étroite collaboration avec les équipes médicales et soignantes. En tant que spécialiste du médicament au sein des professions de santé, le pharmacien clinicien utilise ses connaissances et son expérience dans un but d’optimisation de la prise en charge thérapeutique du patient et de sécurisation de la prescription, cela sous des contraintes de maîtrise de coûts médicamenteux et de respect du cadre réglementaire et médico-légal.
De nombreuses études montrent la pertinence de l’intégration du pharmacien dans une équipe soignante. Le déploiement des activités de pharmacie clinique dans les services de soins, initié à plus grande échelle depuis 2013, a pour finalité l’amélioration de la qualité de vie du patient, la réduction de la morbidité et de la mortalité tout en tenant compte des contraintes économiques. L’intégration de cette discipline dans les missions obligatoires du pharmacien hospitalier nécessite une description des pratiques actuelles ainsi que la définition d’axes de travail.
L’apparition de récentes évolutions définissant un nouveau modèle de pharmacie clinique met en relief une nécessité de formation, que ce soit pour les futurs ou jeunes pharmaciens dans l’optique d’une formation initiale, mais également en formation continue pour les professionnels de santé dans un but de réactualisation des connaissances et d’harmonisation des pratiques.
De nombreux modèles d’apprentissage existent, de la formation universitaire classique aux nouvelles méthodes de pédagogie active comme le e-learning ou encore la simulation. Cette dernière, développée depuis quelques années, a montré son intérêt dans l’acquisition de compétences techniques et non techniques. La formation par la simulation repose sur la théorie de l’apprentissage par l’expérience, en permettant d’aborder sereinement des situations cliniques standardisées et en consolidant les compétences professionnelles. Dans ce contexte, la simulation apparait comme une méthode de choix, en particulier pour acquérir des compétences relationnelles et améliorer le travail d’équipe. Elle trouve sa place aussi bien
dans le cadre de la formation initiale, de la formation continue ou du Développement Professionnel Continu (DPC) à la pratique de la pharmacie clinique.
Dans un premier temps, nous définirons la pharmacie clinique et ferons un point sur les avancées et le nouveau modèle émergent de la discipline.
Dans un second temps, face à la nécessité de formation des professionnels de santé à cette discipline, nous passerons en revue l’ensemble des méthodes d’apprentissage disponibles. Nous nous demanderons ensuite quelle est la place de la simulation en santé, méthode d’apprentissage novatrice, dans l’enseignement de la pharmacie clinique aux professionnels de santé.
Enfin, après avoir identifié les axes de formation prioritaires, nous présenterons l’élaboration d’un programme de formation intégrant la simulation, destiné à la formation initiale et continue des professionnels de santé à la pharmacie clinique.
PARTIE I
LA FORMATION EN PHARMACIE CLINIQUE :
I. LA PHARMACIE CLINIQUE : UNE DISCIPLINE EN PLEINE EVOLUTION
1. Définitions
a) La pharmacie clinique
La notion de risque est présente tout au long du parcours de soins du patient. Le parcours de soins ne s’arrête pas à la seule hospitalisation, mais se définit comme l’ensemble des étapes que le patient va suivre tout au long de la trajectoire déterminée par sa maladie et par la spécificité de sa situation(1). La prise en charge thérapeutique représente une continuité prenant en compte les modifications de l’état de santé et d’autonomie du patient, ses changements d’environnement ainsi que les différents professionnels de santé engagés dans sa prise en charge.
Il s’agit d’offrir le bon niveau de soins en évitant la survenue d’un Evènement Indésirable Grave (EIG). Un EIG peut résulter d’une erreur médicamenteuse, on l’appelle alors Evènement Iatrogène Médicamenteux (EIM). C’est un évènement le plus souvent évitable, conséquence d'un dysfonctionnement non intentionnel dans l'organisation de la prise en charge médicamenteuse du patient. Toutes les Erreurs Médicamenteuses (EM) n’ont pas de traduction clinique et ne sont donc pas qualifiées de graves. Toutefois, 5 à 7% des hospitalisations sont causées par une iatrogénie, pouvant mener au décès ou à une incapacité majeure.
Selon l’Enquête Nationale sur les Evènements Indésirables liés aux Soins (ENEIS) menée en 2004, un EIG sur deux est une erreur médicamenteuse. 1,5% des hospitalisations sont dues à un EIG lié au médicament, et près de 50% des EIG durant l’hospitalisation sont liés aux médicaments. Cette étude montre également que 1/3 de ces EIM sont évitables(2). L’étude ENEIS 2 menée en 2009 montre que la fréquence des EIG survenus pendant l’hospitalisation est de 6,2 pour 1 000 jours d’hospitalisation. De plus, 4,5 % des séjours sont causés par un EIG, dont 2,6 % par un EIG évitable. Parmi ceux-ci, 1,1% sont liés aux produits de santé(3). La iatrogénie constitue un problème de santé publique majeur. Le pharmacien apparait alors comme un acteur clé dans le parcours de soins du patient pour la sécurisation de la Prise En Charge Médicamenteuse (PECM), notamment grâce au développement des activités de pharmacie clinique.
Cette discipline fait désormais partie intégrante des stratégies de terrain visant améliorer la qualité et la sécurité de la prise en charge médicamenteuse du patient.
i. Définition, intérêt
Pharmacie clinique, du grec klinos qui signifie le lit, désigne littéralement la « pharmacie au lit du patient ». La notion de pharmacie clinique a été définie par Charles Walton en 1961, à l’université du Kentucky : « La pharmacie clinique concerne l’utilisation optimale du jugement et des connaissances pharmaceutiques et biomédicales du pharmacien dans le but d’améliorer l’efficacité, la sécurité et la précision selon laquelle les médicaments doivent être utilisés dans le traitement des patients.»(4) En 2016, la Société Française de Pharmacie Clinique en donne une définition réactualisée : c’est « une discipline de santé centrée sur le patient dont l’exercice a pour objectif d’optimiser la prise en charge thérapeutique, à chaque étape du parcours de soins. Pour cela, les actes de pharmacie clinique contribuent à la sécurisation, la pertinence et à l’efficience du recours aux produits de santé. Le pharmacien exerce en collaboration avec les autres professionnels impliqués, le patient et les aidants. »
La pharmacie clinique est née et surtout pratiquée à l’hôpital, mais trouve également toute sa place en pharmacie d’officine aux vues du lien étroit existant entre le pharmacien officinal et le patient.
Il s’agit d’une approche pluridisciplinaire centrée sur le patient. L’ensemble des activités qu’elle comporte concourt d’une part, à la maîtrise de la iatrogénie médicamenteuse et au bon usage des produits de santé conformément à l’arrêté RETEX du 6 avril 2011(5), d’autre part à l’évaluation de la pertinence et de l’efficience des traitements, et enfin à la sécurisation du parcours du patient à chaque point de transition : entre la ville et l’hôpital, entre les différentes structures, ou au sein d’une même structure. Le coût global de prise en charge s’en trouve diminué. En effet, une part non négligeable des dépenses de santé peut être redistribuée par l’économie réalisée en évitant la iatropathologie.
Sur le terrain, il s’agit d’optimiser les choix thérapeutiques, la dispensation ainsi que l’administration des médicaments au patient. Les rôles du pharmacien clinicien sont nombreux : il aide au choix de la stratégie thérapeutique, à sa mise en place de façon sûre et efficiente, ainsi qu’au suivi du patient. Il réalise l’analyse pharmaceutique des prescriptions médicamenteuses, ainsi que la conciliation des traitements médicamenteux du patient à chaque point de transition du parcours de santé. Il participe à l’élaboration de protocoles médicamenteux et aide au choix des médicaments en tenant compte du rapport bénéfices/risques, mais également coût/efficacité. Il évalue les prescriptions hors Autorisation de Mise sur le Marché (AMM). Le pharmacien clinicien diffuse toute information ciblée aux
prescripteurs sur les nouveautés thérapeutiques, les conférences de consensus, les protocoles médicamenteux, les Références Médicales Opposables (RMO) ainsi que le coût des thérapeutiques. Il participe aux visites médicales, aux staffs, aux Réunions de Concertations Pluridisciplinaires (RCP) et aux Revues de Morbi-Mortalité (RMM). Enfin, il intervient directement auprès du patient, par une activité de conseil et d’information, voire d’éducation : proposition de plans de prises, mises en garde, précautions d’emploi, observance(6). Il est l’élément charnière qui développe les relations ville-hôpital.
L’identification des parcours de soins à risque est primordiale afin de cibler les actions de pharmacie clinique : les parcours comportant de nombreuses interfaces, les thérapeutiques particulièrement complexes et/ou coûteuses sont à privilégier. Les actions du pharmacien hospitalier pour améliorer la prise en charge médicamenteuse doivent donc s’orienter vers les patients, services ou médicaments à risque. C’est par l’identification des facteurs de risque que les patients à risque iatrogène élevé peuvent être repérés. Une étude montre que le taux d’interventions pharmaceutiques est significativement plus élevé chez les patients présentant au moins un facteur de risque (30,4% vs 9,5%)(7). Les facteurs biologiques et cliniques permettent donc d’identifier les prescriptions à haut risque iatrogène.
L’évaluation de l’impact de la présence de pharmaciens cliniciens dans les services de soins est primordiale ; elle permet de valoriser le travail accompli et de convaincre de la nécessité de déployer la pharmacie clinique dans les établissements de soins. Pour cela, des indicateurs d’impact doivent être définis. L’enjeu est d’observer et de décrire les actions mises en œuvre, de les modéliser et de les évaluer.
La pharmacie clinique a un triple impact. Clinique, dans un premier temps : elle est directement liée à une diminution des évènements iatrogènes, de la morbidité et de la mortalité(8)(9)(10). Economique ensuite, par une diminution des coûts directs en agissant sur les médicaments prescrits ; une diminution des coûts indirects en évitant la survenue d’effets indésirables ; et enfin en limitant la durée de séjour(11)(12). L’impact est également mesurable via le degré de satisfaction du patient(13).
La pharmacie clinique présente également un intérêt direct pour les professionnels de santé. Pour le médecin, elle constitue une aide à assurer la continuité des traitements, c’est également un support à la prescription ainsi qu’au suivi du patient. Le pharmacien clinicien fournit des réponses aux questions éventuelles du médecin concernant la thérapeutique. Le gain de temps apporté par l’activité de pharmacie clinique est indéniable. Pour l’équipe infirmière, le pharmacien clinicien est un support en ce qui concerne les modalités
d’administration : dilutions, compatibilités, stabilité. Il fournit des informations concernant les moments d’administration, les possibilités de couper ou broyer les formes orales, les différentes voies d’administration possibles. Il est également un support pour le conseil au patient.
Ainsi, cette discipline d’apparition récente s’impose peu à peu comme incontournable au sein d’une équipe de soins dans la prise en charge multidisciplinaire du patient.
ii. Historique
La pharmacie clinique est une discipline relativement récente, dont les premières bases ont vu le jour en 1950 aux Etats-Unis, à l’université du Michigan. Au début des années 1960, des travaux de synthèse sont réalisés à l’université du Kentucky par David Burkholder, Paul Parker et Charles Walton, suite à des procès intentés aux médecins par des patients du fait d’erreurs thérapeutiques et/ou iatrogènes(14). Les pharmaciens hospitaliers américains sont progressivement intégrés aux équipes médicales dans les services de soins et participent aux visites médicales(15).
La pharmacie clinique se développe ensuite au Québec à partir de 1975, essentiellement en milieu hospitalier, où les compétences du pharmacien en matière de pharmacocinétique et de Suivi Thérapeutique Pharmacologique (STP) sont mises à profit auprès du médecin et du patient dans le but de réduire la iatrogénie médicamenteuse.
La discipline se développe parallèlement en Angleterre. Un nouveau système de prescription et de dispensation est mis en place. Les pharmaciens sont intégrés dans les services de soins aux visites médicales, avec comme objectif la prévention d’effets secondaires et d’interactions médicamenteuses(16).
En France, une première définition de la pharmacie clinique n’est proposée que bien plus tard, en 1983 : « utilisation, dans le seul intérêt du patient, des connaissances pharmaceutiques et biologiques ». Inspirés par le modèle québécois, des pharmaciens hospitaliers et universitaires français souhaitent appliquer la pharmacie clinique en France. Les 3 réformes des études pharmaceutiques ont peu à peu permis l’émergence de la discipline.
En novembre 1962, le stage de première année est supprimé et les filières spécialisées apparaissent en 5ème année: officine, industrie, internat.
En 1978, la réforme Bohuon initie les stages hospitaliers de 6 semaines en 4ème année. En 1984, la réforme Laustriat-Puisieux crée la 5ème Année Hospitalo-Universitaire (AHU) et la 6ème année de formation professionnelle. Elle introduit également l’enseignement de la pharmacie clinique et de la biologie clinique(6)(17).
C’est notamment grâce à la mise en place de la 5ème
année AHU que commence à se développer les premières activités de pharmacie clinique. En effet, elle prévoit un autre exercice de la pharmacie, en mettant l’étudiant en relation directe avec l’ensemble des professionnels de santé ainsi qu’avec le patient. Elle permet au futur pharmacien d’acquérir les connaissances théoriques, pratiques, comportementales et de communication nécessaires pour développer un lien avec le patient mais également intervenir et s’impliquer dans la relation avec le médecin et les différents membres de l’équipe soignante. Cette intégration des étudiants dans les services cliniques représente le point de départ des activités de pharmacie clinique dans de nombreux établissements. La France est actuellement le seul pays européen où la 5ème année AHU est obligatoire. La mise en place de l’internat et du diplôme des études spécialisées par l’arrêté du 31 octobre 2008 vise notamment à améliorer la qualité de la formation et des actes professionnels(18).
La pharmacie clinique reste néanmoins en France une discipline principalement universitaire et son implantation dans le milieu professionnel est encore faible en comparaison aux pays nord-américains. Elle tend cependant à se développer depuis quelques années en milieu hospitalier ainsi qu’en milieu officinal.
La Société Française de Pharmacie Clinique (SFPC), née en 1983, est la principale société savante du monde pharmaceutique hospitalier français. Elle œuvre pour la promotion de la pharmacie clinique, par tous les moyens de formation et d’information disponibles. Tous les trois mois est publié le Pharmacien Hospitalier et Clinicien, journal associant articles originaux, synthèses bibliographiques, lettres de rédaction approuvées par le comité de lecture. Elle est composée de 9 groupes de travail (Conciliation, Gériatrie, Gestion des Risques, Standardisation et Valorisation des Activités de Pharmacie Clinique, etc…) qui présentent leurs travaux tous les deux ans lors d’un congrès. La SFPC met également à disposition de l’ensemble des pharmaciens de nombreux outils et recommandations utiles à la pratique de la pharmacie clinique. Elle propose en 2017 un nouveau modèle de pharmacie clinique, représentant un gradient d’accès à l’information et à l’analyse approfondie, construit en 3 niveaux progressifs : la dispensation, le bilan de médication et le plan pharmaceutique personnalisé, processus innovant en cours de formalisation.
Actuellement, les pharmaciens hospitaliers sont en cours de déploiement dans les services cliniques, néanmoins le contexte économique difficile explique une réticence de la part des établissements à investir dans le personnel pharmaceutique nécessaire au développement de la discipline.
b) L’analyse pharmaceutique des prescriptions médicamenteuses
Depuis la publication de l’arrêté relatif aux modalités de prescription, de dispensation et d’administration des médicaments en établissement de santé (ES) du 9 août 1991(19), remplacé par l’arrêté du 31 Mars 1999(20) puis l’arrêté du 6 avril 2011(5), l’analyse pharmaceutique des prescriptions médicamenteuses est devenue réglementaire en France dans les établissements de santé.
Le groupe de travail de la SFPC « Standardisation et valorisation des activités de pharmacie clinique » donne une définition de l’analyse pharmaceutique des prescriptions médicamenteuses. Il s’agit d’une « expertise structurée et continue des thérapeutiques du patient, de leur modalités d’utilisation et des connaissances et pratiques du patient. »(21) Elle fait partie intégrante de l’acte de dispensation du médicament, qui comprend également la mise à disposition des informations et les conseils nécessaires au bon usage du médicament et des produits de santé, avec éventuellement la préparation des doses à administrer.
L’analyse des prescriptions est réalisée par le pharmacien ou l’interne en pharmacie ayant reçu délégation. Ce processus consiste en une analyse des prescriptions se déroulant en 3 parties: analyse réglementaire, pharmaco-thérapeutique et clinique, l’objectif final étant l’identification, la résolution et la prévention d’éventuels problèmes liés à la prise de médicaments.
L’analyse réglementaire consiste en une vérification par le pharmacien de la conformité de l’ordonnance à la règlementation : identification du patient, du prescripteur, date, informations complètes sur le médicament prescrit.
L’analyse pharmaco-thérapeutique vise à vérifier la sécurité, la qualité et l’efficience de la prescription. Il s’agit de vérifier la cohérence des prescriptions, l’absence de contre-indications, le respect des posologies (doses, durées et rythme d’administration) en tenant compte des caractéristiques physiopathologiques du patient. On recherche également des éventuelles redondances pharmaco-thérapeutiques, des incompatibilités physico-chimiques, des interactions médicamenteuses. Les précautions d’emploi, les mises en garde et les effets indésirables potentiels doivent également être notifiés.
Le troisième volet désigne l’analyse clinique. Elle consiste en une mise en relation des données pharmaco-thérapeutiques avec les informations cliniques du patient, notamment son historique médicamenteux, ses données biologiques, ses antécédents. Elle permet une adaptation des thérapeutiques à la physiopathologie du patient, en tenant compte des objectifs
thérapeutiques définis par le médecin. Les recommandations formulées par le pharmacien doivent également tenir compte du type de prise en charge thérapeutique du patient : curatif, préventif ou palliatif.
Toutes les prescriptions réalisées dans un ES ne bénéficient pas systématiquement d’une analyse pharmaceutique, compte tenu des contraintes en terme de temps et de ressources humaines. Les établissements doivent s’organiser pour garantir a minima une validation pharmaceutique des médicaments à risque. Selon le Contrat de Bon Usage (CBU) 2014-2018 signé entre les Agences Régionales de Santé (ARS) (qui sont en charge de la mise en place de la politique de santé régionale), les établissements de santé et les organismes d’Assurance Maladie, les objectifs visent à augmenter le nombre de lits d’hospitalisation bénéficiant d’une analyse pharmaceutique de la prescription complète du patient.
Différentes méthodes sont proposées pour l’analyse de prescriptions. Certaines sont basées sur l’utilisation de logiciels, de check-list ou de tables. Les plus connues sont la méthode SOAP (Subjective, Objective, Assessment, Plan), la méthode canadienne « les soins pharmaceutiques » et la méthode par résolution de problèmes.
La méthode par résolution de problème pharmaceutique est la technique d’analyse considérée comme étant la plus rigoureuse et la mieux construite. L’identification des problèmes, par comparaison à un référentiel, permet de définir des éléments d’amélioration potentielle. Elle vise l’identification des problèmes actuels, la résolution de ces problèmes, ainsi que la prévention d’apparition de nouveaux problèmes.
En France, la méthode de l’Association Nationale des Enseignants en Pharmacie Clinique (ANPEC) est privilégiée, avec l’utilisation d’algorithmes de validation d’ordonnances. L’objectif de ces algorithmes est d’identifier les risques liés aux problèmes médicamenteux, d’apprécier ces risques et d’en réaliser une gestion pharmaceutique.
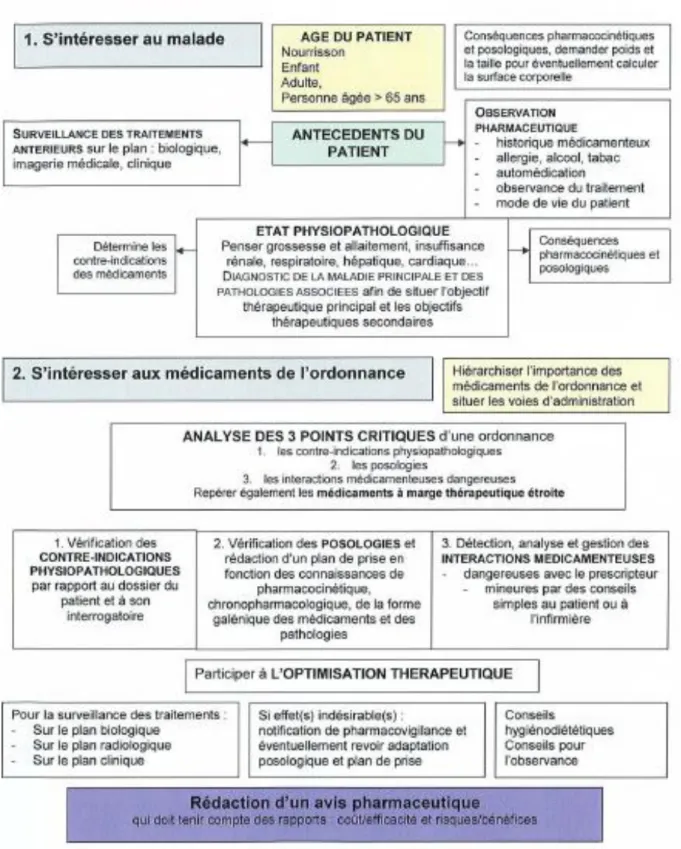
Jean Calop propose en 1997 sous forme de schéma, un algorithme de validation de l’ordonnance. Il reprend les différents items structurant la méthode de résolution par problèmes(6) (Figure 1).
Figure 1. Algorithme simplifié de validation d’une ordonnance proposé par J.Calop
Jusqu’en 2016, plusieurs niveaux d’analyse pharmaceutique étaient définis par la SFPC en fonction de la profondeur du processus (Tableau 1). Trois niveaux sont à distinguer :
1er niveau d’analyse: revue des prescriptions
Elle est réalisée au sein de la Pharmacie à Usage Intérieur (PUI), avec la prescription complète à disposition. Le niveau 1 est le niveau minimal exigé par la réglementation(22). Il consiste en une analyse réglementaire de l’ordonnance, complétée d’une analyse pharmaco-thérapeutique minimale. L’objectif est d’assurer la sécurité du patient.
2ème niveau d’analyse: analyse documentée
Il s’agit du niveau préconisé par les normes de références telles que la Haute Autorité de Santé (HAS) et celle du CBU. Elle peut être réalisée dans le service de soins comme au sein de la PUI, mais nécessite une documentation complémentaire (dossier patient, résultats biologiques…). En plus de l’analyse règlementaire, l’analyse pharmaco-thérapeutique réalisée est couplée aux caractéristiques physiopathologiques du patient. Une collaboration active entre différents professionnels de santé permet l’optimisation thérapeutique.
3ème niveau d’analyse: analyse avec présence dans l’unité de soins et suivi clinique
Elle est systématiquement réalisée dans le service de soins. Le pharmacien part de la situation clinique du patient et collecte les différentes données venant de la prescription, des documentations complémentaires et de l’entretien avec le patient. Une synthèse des données objectives et subjectives concernant les pathologies et les médicaments du patient est réalisée. C’est une intervention réalisée dans un contexte pluridisciplinaire, en partenariat avec l’équipe soignante et tracée dans le dossier du patient. Elle est centrée sur ce dernier et prend en compte ses besoins propres.
L’analyse pharmaceutique de niveau 3 va de pair avec les activités de conciliation médicamenteuse, de conseil et d’éducation thérapeutique, toujours dans le but d’assurer une continuité dans la prise en charge du patient.
L’analyse pharmaceutique peut être suivie de la formulation d’un ou plusieurs avis pharmaceutique(s).
c) L’intervention pharmaceutique
L’intervention pharmaceutique (IP) est définie comme « toute action initiée par le pharmacien qui induit directement une modification de la prise en charge du patient. »(23) Elle met à disposition du prescripteur des éléments pouvant modifier ou améliorer l’efficacité, la sécurité ou le coût du traitement. Cependant, toute proposition du pharmacien est soumise à la validation du médecin, qui reste libre de sa prescription. L’IP, réalisée à l’officine ou à l’hôpital, fait partie intégrante de l’activité de pharmacie clinique et de l’acte de dispensation du pharmacien(24)(25). Elle peut être communiquée au prescripteur oralement (de vive-voix ou par téléphone), par écrit dans le dossier médical du patient ou encore par le biais du logiciel de prescription. Il s’agit de préciser la nature du problème identifié, l’argumentaire ainsi qu’une proposition éventuelle de modification.
La traçabilité des IP est indispensable, dans un souci juridique mais également dans le but de quantifier et valoriser la pertinence de l’activité de pharmacie clinique.
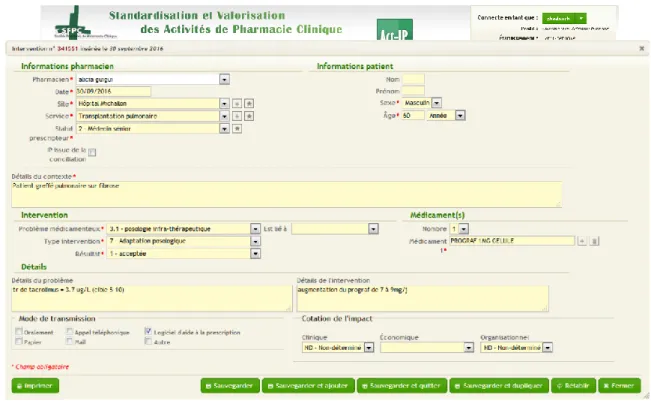
Des outils élaborés par la SFPC dans le cadre du groupe du travail « Standardisation et valorisation des activités de pharmacie clinique » en 2004 permettent d’uniformiser les pratiques d’analyse de prescription et d’IP. Il s’agit d’une fiche permettant la codification des IP, en classifiant la nature du problème, le type d’intervention, la classe du médicament concerné et enfin le devenir de l’intervention (Annexe 1). Elle s’accompagne de tableaux d’aide à la codification des problèmes détectés par l’analyse pharmaceutique (Annexes 2 et 3). En 2006, cet outil a été développé sous la forme d’un site internet Act-IP©, dans le but d’élargir et de faciliter son utilisation. La saisie des IP se fait directement sur le site selon la codification SFPC (Figure 2). Leur recueil dans la base de données rend possible leur analyse ainsi que la mise en place d’un observatoire national des pratiques d’IP.
Figure 2. Interface Internet Act-IP© accessible librement sur le site de la SFPC
L’impact des interventions pharmaceutiques a fait l’objet de nombreux travaux de recherche. Il a été démontré, d’une part en termes de qualité de soins : l’impact clinique sur la gravité de l’EIM en comparaison à une non-intervention du pharmacien est significatif. D’autre part, en termes de maîtrise des dépenses médicamenteuses : l’impact économique est démontré par une réduction des coûts de traitement ou de journées d’hospitalisation. L’étude de Guignon montre que 79% des interventions d'un pharmacien clinicien améliorent la prise en charge du patient, parmi lesquelles 22% ont une conséquence clinique(10).
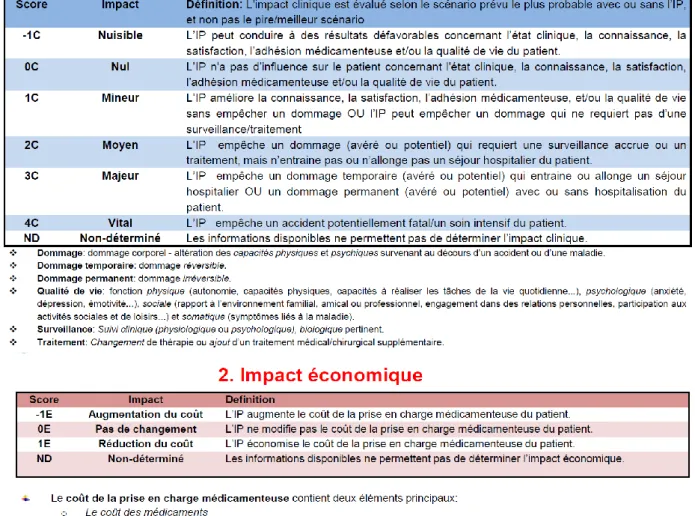
Face à l’absence d’outils d’évaluation adaptés à la pratique française, la SFPC a développé en 2016 l’échelle CLEO©
, un outil multidimensionnel intégré à Act-IP©, permettant de coter l’impact des IP réalisées en prenant en compte trois dimensions: clinique, économique et organisationnelle (Figure 3). L’outil est actuellement testé dans plusieurs hôpitaux français et en cours de traduction et de validation en allemand.
Figure 3. Evaluation des impacts d’une intervention pharmaceutique par l’échelle CLEO©
d) La Conciliation des Traitements Médicamenteux
La Conciliation des Traitements Médicamenteux (CTM) ou conciliation médicamenteuse est une démarche innovante faisant partie des stratégies de terrain qui visent la sécurisation du parcours de soins du patient. Il s’agit d’un processus interactif et pluri-professionnel qui
s’inscrit dans une démarche de prévention et d’interception des EM(26)(27) et contribue à la continuité de la prise en charge du patient dans son parcours de soins.
La CTM s’est développée dans le cadre du projet international de l’OMS « High 5s Agir pour la sécurité des patients » lancé en 2006 et réunissant 8 pays : l’Australie, l’Allemagne, les Pays-Bas, le Canada, les Etats-Unis, Singapour, la République de Trinité-et-Tobago, la France. Ce projet international vise à réduire, de façon pérenne et quantifiable, des problèmes majeurs liés à la sécurité des patients.
En France, cette initiative est coordonnée par la HAS et engagée depuis 2009. L’un des axes de travail est « la sécurité de la prescription médicamenteuse aux points de transition du parcours de soins ».
Le Manuel de Certification V2010 stipule que la continuité de la prise en charge médicamenteuse en ES nécessite la prise en compte du traitement personnel du patient à l’admission, une documentation exhaustive du traitement médicamenteux lors des transferts et à la sortie et une coordination efficace avec les professionnels de ville. Le Manuel de Certification V2014 utilise la méthode du « patient traceur », tout au long de laquelle chaque étape du parcours patient est investiguée.
La CTM apparait alors comme une activité contributive à l’amélioration de la qualité et la sécurité de la prise en charge médicamenteuse.
Les acteurs impliqués sont les professionnels de santé, les patients mais également leur entourage ainsi que les aidants. La CTM est réalisée en ES à trois moments clés : à l’admission, lors du transfert dans un autre service ou ES, et à la sortie.
De nombreuses études montrent le bénéfice de la CTM. Pour 30 à 70% des patients hospitalisés, on retrouve des écarts entre leur traitement habituel et l’ordonnance établie à leur admission dans le service de soins(28). Ces écarts sont dus à une mauvaise transmission des informations entre les professionnels de soins de ville et les hospitaliers.
Une grande partie des EM (46%) survient à l’admission et à la sortie du patient hospitalisé(29). Toutes les EM ne sont pas graves, cependant 3 études ont montré que respectivement 5,7%, 6,3% et 11,7% des EM interceptées par la conciliation auraient pu avoir des conséquences majeures, critiques ou catastrophiques pour le patient(30)(31)(32). L’étude d’Edith Dufay met en évidence 5,2% d’EM majeures et 18,8% d’EM significatives. Parmi toutes celles relevées, 5,2% auraient pu engendrer un EIG et 4,2% des patients auraient pu subir un EIG(33). Le rapport d’expérimentation Med’Rec de la HAS menée par 9 établissements de santé français montre que pour un patient concilié, on retrouve en moyenne
lors de son admission une EM mais également un changement de traitement non documenté(34). Cette étude rapporte 5,7% d’EM graves interceptées et 100% d’EM corrigées suite à une intervention pharmaceutique.
Les données internationales confirment également l’impact clinique de la CTM. Selon 3 études, elle a permis la diminution du recours à l’hospitalisation à 30 jours de la sortie de respectivement 30,5%, 36% et 29,3% des patients conciliés(35)(36)(37). L’étude américaine MARQUIS met en évidence 2 EM par patient concilié, dont 0,9% d’EM graves interceptées, et 75% d’EM corrigées suite à une intervention pharmaceutique. De plus, elle évalue le retour sur investissement de la conciliation dans les pratiques hospitalières : les économies réalisées sont significatives dans le sens d’un bénéfice pour la collectivité(38).
i. Définition
En accord avec celle donnée par la SFPC en 2015 dans sa fiche mémo « Préconisation pour la pratique de la conciliation des traitements médicamenteux »(39), une définition de la CTM est donnée en mars 2015 par le collège de la HAS suite à l’expérimentation Med’Rec(34). « La conciliation des traitements médicamenteux est un processus formalisé qui prend en compte, lors d’une nouvelle prescription, tous les médicaments pris et à prendre par le patient. Elle associe le patient et repose sur le partage d’informations et sur une coordination pluri professionnelle.
Elle prévient ou corrige les erreurs médicamenteuses en favorisant la transmission d’informations complètes et exactes sur les médicaments du patient entre professionnels de santé aux points de transition que sont l’admission, la sortie et les transferts.
Encore appelée « conciliation médicamenteuse», terme consacré par l’usage. »
Cette définition est reprise en décembre 2016 dans le guide de la HAS sur la démarche de conciliation des traitements médicamenteux en ES, rédigée par un groupe d’experts pluri-professionnel associant les patients.(28)
La CTM est une pratique rigoureuse et standardisée, structurée autour d’un ensemble de recommandations. Ses deux principaux objectifs sont :
- la réduction des erreurs médicamenteuses (exemple : interruption inappropriée à l’admission dans les services des traitements habituels, modification erronée des doses, modalités d’administration ou formes galéniques, redondance de principes actifs, ajout injustifié de médicaments, absence de reprise du traitement habituel du patient à sa sortie)
- la diminution de la ré-hospitalisation non programmée par l’action combinée de la CTM et d’autres programmes tels que l’accompagnement thérapeutique du patient à sa sortie(35)(40)(41). D’une part, elle prévient ou corrige les EM liées aux défauts d’informations entre professionnels de santé. D’autre part, elle renforce le processus de réévaluation des traitements en cours. Enfin, elle contribue à la maîtrise des dépenses de santé en permettant une diminution des coûts associés à la iatrogénie médicamenteuse.
La CTM est une pratique impliquant un lien étroit entre les différents professionnels de santé, dont les modalités de partage doivent être formalisées.
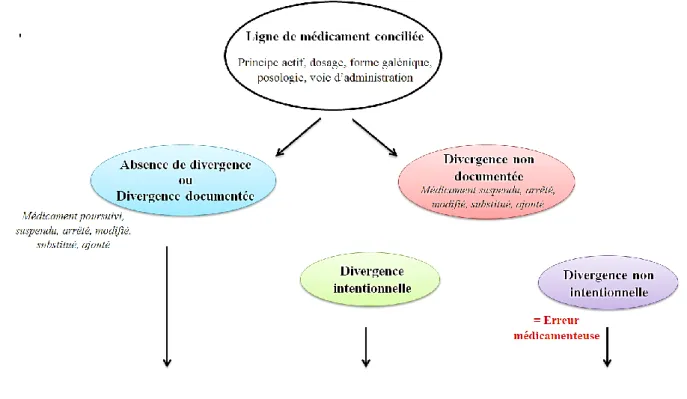
On distingue deux types de conciliation médicamenteuse (Figure 4).
La conciliation est dite proactive lorsque la liste des médicaments pris à domicile est établie avant la rédaction de la première prescription à l’admission. Cette méthode permet la prévention des erreurs médicamenteuses, c’est le processus à privilégier. La conciliation est dite rétroactive lorsque le bilan médicamenteux est établi après la
rédaction de la première prescription à l’admission. Ce processus permet l’interception des erreurs médicamenteuses et doit être engagé le plus tôt possible après l’admission du patient.
Figure 4. Conciliation médicamenteuse proactive/rétroactive – Fiche technique SFPC 2014
En lien avec les problèmes de ressources pharmaceutiques disponibles, la CTM nécessite le plus souvent d’établir une priorisation en fonction de l’organisation de l’établissement. Elle peut être réalisée selon différent critères : la pathologie, l’âge, les critères sociaux ou cognitifs, le service de soins, le mode d’entrée ou encore les thérapeutiques. Selon l’enquête de la Direction Générale de l’Offre de Soins (DGOS), les populations le plus souvent priorisées sont les personnes de plus de 65 ans et les patients polymédiqués(41).
Etant définie comme une activité contributive de la sécurisation de la prise en charge globale du patient, elle est particulièrement indiquée pour des situations à risque et des populations de patients à risque.
ii. Conciliation médicamenteuse à l’admission
Recueil d’informations sur la thérapeutique du patient
La phase de recueil vise à connaître, à chaque point de transition, les médicaments du patient pris ou à prendre et dans un second temps à formaliser ces informations en tenant compte de l’historique médicamenteux, de l’observance et de l’automédication.
Cette étape est réalisable par tout professionnel de santé : médecin ou pharmacien (praticien, interne ou externe), sage-femme, chirurgien-dentiste, infirmier, préparateur en pharmacie. Afin d’obtenir l’exhaustivité du traitement du patient avec toutes ses caractéristiques (dosages, posologies, durées de traitement), la CTM impose de croiser au minimum 3 sources d’information.
Les sources d’information disponibles sont nombreuses : - entretien avec le patient
- entretien avec les proches ou aidants - entretien avec le pharmacien d’officine - entretien avec le médecin traitant - lettre du médecin traitant
- Dossier Pharmaceutique (DP) - médicaments apportés par le patient - liste des médicaments du patient - ordonnances apportées par le patient
- entretien ou lettre du médecin spécialiste - entretien avec l’infirmier à domicile
- fiche de liaison avec le service de soins à domicile - dossier patient d’une précédente hospitalisation - dossier de consultation pré-anesthésique
- logiciel d’aide à la prescription
Les premières sources consultées sont généralement le dossier patient, le patient-lui même ainsi que les professionnels de ville : médecin traitant, pharmacien d’officine. Ces trois sources, complémentaires et facilement accessibles, ne dispensent pas de consulter les autres sources disponibles en cas de doute.
Consultation du dossier patient
Il retrace l’anamnèse du patient: motif d’hospitalisation, origine (domicile, EHPAD, transfert d’un autre service), caractéristiques physiopathologiques, antécédents médicaux et chirurgicaux, pathologies actives et comorbidités, données biologiques, allergies éventuelles. Le dossier patient constitue également une première source d’informations concernant le traitement habituel du patient.
Entretien avec le personnel soignant
Avant l’entretien avec le patient, il est primordial de consulter le médecin hospitalier afin de faire un premier bilan et de connaître les points à investiguer.
Il est également utile de consulter l’infirmier afin de vérifier si le patient est interrogeable et disponible pour l’entretien, mais également pour se renseigner sur les éventuels traitements personnels.
Entretien avec le patient et/ou ses proches
L’entretien patient se déroule selon une trame prédéfinie. L’entrevue doit être structurée de manière à ne pas omettre de points à aborder. Il est préférable de mener l’entretien au moment opportun pour le patient, lorsque celui-ci est disponible et vigilant Les informations à recueillir sont définies au préalable. Il est important d’insister sur les médicaments particuliers et/ou à risque, tels que les antibiotiques, anticancéreux per os, anticoagulants, insuline ; mais également les médicaments autre que formes orales tels que les collyres, les crèmes, les