MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE
Université de Jijel
Faculté des Sciences et de la Technologie
Département : Génie des Procédés
Thème :
Soutenue le
: 07/ 09/ 2017 Devant le Jury composé de :
M
r. BOUDJERDA Azzedine
Prof. Université de Jijel Président
M
r. ZAZOUA Ali Prof. Université de Jijel Rapporteur
M
r.
BENAMIRA Messaoud
M.C.A. Université de Jijel Examinateur
M
me. MORAKCHI Karima M.C.A. Université d’Annaba Examinatrice
M
r. ZOUAOUI Ahmed Prof. Université de Sétif Examinateur
M
r. DOUADI Tahar Prof. Université de Sétif Examinateur
Thèse Présentée
Pour l’obtention du diplôme de Doctorat en Sciences
Option : Génie des Matériaux
Par :
Nawal KHEDIMALLAH épouse MEZLI
Biocapteurs à base de nanomatériaux
et de substances
Je tiens tout d’abord à remercier Dieu le tout puissant, qui m’a donné la force, la patience et le courage d’accomplir ce modeste travail.
C’est avec une immense reconnaissance que j’adresse mes vifs remerciements à mon encadrant Monsieur ZAZOUA Ali, professeur à l’Université de Jijel, pour m’avoir permis
d’effectuer ma thèse sous sa direction et m’a offert la possibilité de travailler sur un sujet passionnant, ainsi que pour la confiance qu’il m’a accordée en acceptant de diriger cette thèse. Je le remercie aussi pour sa disponibilité quotidienne, ainsi que pour ces conseils. Je tiens à remercier aussi Monsieur BOUDJERDA Azzedine professeur à l’Université de
Jijel, pour l’honneur qu’il me fait en acceptant de présider ce jury.
Je prie, Monsieur BENAMIRA Messaoud Maitre de Conférences à l’Université de Jijel, Madame MORAKCHI Karima, maître de Conférences à l’Université d’Annaba, Monsieur
ZOUAOUI Ahmed Professeur à l’Université de Sétif et Monsieur DOUADI Tahar Professeur à l’Université de Sétif, d'accepter l'expression de ma profonde gratitude pour leur
participation au jury de cette thèse.
J’aimerais par ailleurs souligner la contribution importante de Madame Nicole JAFFREZIC RENAULT, Directrice de recherche CNRS au laboratoire des Sciences Analytiques de l’Université Claude Bernard Lyon 1, qui nous a accueillie à bras ouvert dans son laboratoire et mis à notre disposition tout le matériel nécessaire pour la réalisation de ce
travail. J’exprime ma gratitude à Mme
F. BOUREMMAD, Directrice de laboratoire d’Interaction Matériaux Environnement à l’Université de Jijel, de m’avoir permis d’effectuer des
manipulations au sein du son laboratoire.
Un merci particulier pour ma mère, mon mari Abderrahmane et ma petite fille Asma qui ont toujours été là pour me soutenir, même dans les moments les plus difficiles
INTRODUCTION GENERALE ... 1
CHAPITRE I : PARTIE THEORIQUE I.1 DEFINITION ET PRINCIPE DE FONCTIONNEMENT D’UN CAPTEUR ELECTROCHIMIQUE ... 3
I.1.1 Reconnaissance chimique ... 4
I.1.2 Transducteurs ... 5
I.1.3 Les différents types des capteurs ... 5
I.1.3.1 Les capteurs électrochimiques ... 5
I.1.3.1.1 Les capteurs potentiométriques ... 6
I.1.3.1.2 Les capteurs ampérométriques ... 7
I.1.3.1.3 Les capteurs conductimétriques ... 8
I.1.3.1.4 Capteur impédimétrique ... 9
I.1.3.2 Les capteurs optiques ... 10
I.1.3.3 Les capteurs thermiques ... 10
I.1.4 Qualités d’un biocapteur ... 11
I.1.5 Différents types d’interaction entre l’espèce chimique et la partie sensible du capteur ... 12
I.1.5.1 Adsorption physique ... 12
I.1.5.2 Adsorption chimique ... 12
I.2 RAPPELS BIBLIOGRAPHIQUES SUR LES ELECTRODES DE DIAMANT ... 13
I.2.1 Structure du diamant ... 13
I.2.2 Propriétés du diamant ... 13
I.2.3 Synthèse du diamant ... 14
I.2.4 La fonctionnalisation du diamant... 16
I.2.5 Types de conductance des matériaux diamant et leur préparation ... 17
I.3.5.1 Dopants donneurs ... 17
I.2.5.2 Dopants accepteurs ... 17
I.2.6 Les techniques de dopage ... 18
I.2.6.1 Le dopage par diffusion ... 18
I.2.6.2 Le dopage par implantation ionique ... 19
I.2.6.3 La méthode CIRA ... 19
I.2.6.4 Implantation par CVD... 20
I.3 METHODES DE CARACTERISATION ELECTROCHIMIQUES ... 22
I.3.1 Spectroscopie d’impédance électrochimique (EIS) ... 25
I.3.1.1 Principe de la spectroscopie d’impédance ... 25
I.3.1.2 Variation du potentiel et mesure du courant ... 26
I.3.1.3 Circuit électrique équivalent ... 27
I.3.1.4 Représentation graphique de l’impédance ... 29
I.3.2 La voltampérométrie cyclique ... 30
I.3.3 Les techniques pulsées ... 34
I.3.3.1 Voltamétrie à impulsion différentielle ... 35
I.3.3.2 Voltampérométrie à ondes carrées ... 35
I.3.3.3 Voltamétrie à redissolution anodique ... 36
I.4 GENERALITES SUR LES METABOLITES SECONDAIRES ... 38
I.4.1 Les polyphénols ... 38
I.4.2 Rôle et intérêt des composés phénoliques ... 39
I.4.3 Classe des polyphénols ... 40
I.4.3.1 Les flavonoïdes ... 40
I.4.3.2 Les anthocyanes ... 41
I.4.3.3 Les tannins ... 41
I.4.3.4 Les propriétés physico-chimiques des tanins ... 43
I.4.3.4.1 Solubilité des tanins ... 43
I.4.3.4.2 Liaisons aux protéines... 43
I.4.3.4.3 Répartition et localisation ... 43
I.4.3.4.4 Réaction de comlexation avec les métaux ... 43
I.4.4 Généralités sur la plante (le chêne liège « quercus suber ») ... 45
I.4.4.1 Description de la plante ... 44
I.4.4.2 Description botanique ... 45
I.4.4.3 Les tanins dans le chêne ... 45
I.5. SYNTHESE BIBLIOGRAPHIQUE ET ETAT DE L’ART... 47
CHAPITRE II : PARTIE EXPERIMENTALE
II.1 CARACTERISATION PHYTOCHIMIQUE DE LA PLANTE ... 51
II.1.1 Matériau végétal ... 52
II.1.1.1 Choix de plante ... 52
II.1.1.2 Récolte de l’échantillon ... 52
II.1.1.3 Macération et extraction ... 52
II.1.1.4 Filtration et décantation ... 52
II.1.1.5 Evaporation ... 53
II.1.2 Tests phytochimiques ... 53
II.1. 2.1 Réaction de caractérisation (Screening phytochimique) ... 54
II.1. 2.1.1 Solution à analyser : préparation de l’infusé à 5% ... 54
II.1. 2.1.2 Testes phytochimiques ... 54
II.1.3 Méthodes d’extraction et de dosage des composés phénoliques ... 56
II.1.3.1 Préparation de l’extrait brute Acétonique... 56
II.1.3.2 Rendement d’extraction ... 57
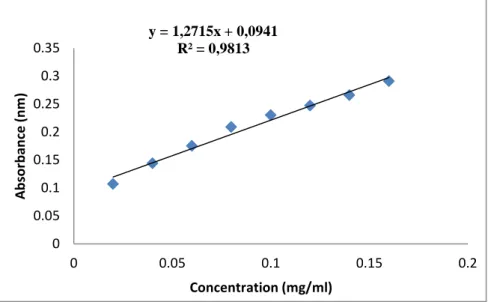
II.1.3.3 Détermination de la teneur en polyphénols ... 57
II.1.3.3.1. Dosage des composés phénoliques totaux ... 57
II.1.3.3.2. Dosage des flavonoïdes totaux ... 59
II.1.3.3.3. Dosage des tannins ... 60
II.1.3.3.4. Dosage des tannins condensés ... 62
II.1.3.3.5. Dosage des tanins hydrolysables ... 63
II.1.3.4 Extraction par les solvants ... 64
II.1.3.4.1. Affrontements : partitions entre solvants ... 64
II.1.3.5 Méthodes et techniques de purification ... 67
II.1.3.5.1 Chromatographie sur couches minces (C.C.M) ... 67
II.1.3.5.2 Essais de caractérisation par chromatographie liquide à haute performance ... 68
II.1.3.5.3 Caractérisation physico- chimiques des extraits par infrarouge IR ... 69
II.1.4 Résultats et discussion ... 71
II.1.4.1 Rendement d’extraction ... 71
II.1.4.2 Détermination de la teneur en polyphénols ... 72
II.1.4.3 Quantification des composés phénoliques des espèces étudiés ... 72
II.1.4.4 Analyse chromatographique sur couche mince CCM ... 74
II.2 DEVELOPPEMENT DU CAPTEUR A BASE D’UN TRANSDUCTEUR EN OR ... 81
II.2.1 Transducteur ... 81
II.2.2 Préparation des électrodes et construction du capteur ... 82
II.2.3 Caractérisation électrochimique de l’électrode Au/Extrait ... 84
II.2.4 Caractérisation physico-chimique des complexes métaux lourds/ Extrait ... 84
II.2.4.1 Caractérisation par spectroscopie infrarouge à transformée de fourrier (FTIR) ... 85
II.2.5 Caractérisations électrochimiques ... 85
II.2.5.1 Choix de l’électrolyte support ... 85
II.2.5.2 Efficacité de nettoyage des électrodes ... 86
II.2.5.3 Optimisation de la polarisation... 87
II.2.5.4 Sensibilité du capteur Au/Extrait ... 87
II.2.5.4.1. Etude la sensibilité du capteur Au/ Extrait vis-à-vis les métaux lourds par spectroscopie d’impédance électrochimique ... 87
II.2.5.4.2. Caractérisation de l’électrode Or- Extrait par voltamétrie à onde carrée SWV ... 91
II.2.5.4.3. Comparaison de la détection des métaux lourds (Zn, Ni, et Cd) sur les électrodes fonctionnalisées par l’extrait de l’écorce du gland ... 93
II.2.5.4.4. Détection simultanée des métaux ... 93
II.2.5.4.5. La sélectivité d’un capteur ... 94
II.2.5.4.6. Comparaison de la détection des métaux lourds de notre capteur avec d’autres travaux dans la littérature ... 96
II.3. ELABORATION DE NOUVELLES MICROCELLULES BDD POUR LA DETERMINATION DES METAUX LOURDS ... 99
II.3.2. Matériels et méthodes ... 99
II.3.2.1. Micro-fabrication de la microcellule BDD... 99
II.3.2.2. Méthode de mesure électrochimique ... 101
II.3.2.3. Préparation de la microcellule BDD et conditions de mesures ... 102
II.3.3. Résultats et discussions ... 104
II.3.3.1. Caractérisation électrochimique des Microcellules BDD ... 104
II.3.3.1.1. Caractérisation par DPASV ... 105
II.3.3.1.2. Détection simultanée des métaux ... 107
II.3.3.1.3. Le coefficient de sélectivité ... 108
II.3.3.2. Performance du capteur ... 109
II.4. PHENOMENES REACTIONNELS LIGAND/ANALYTE ... 111
Références bibliographiques
Figure I.1: Représentation schématique du principe de fonctionnement d'un capteur ... 4
Figure I.2: Principe de mesure potentiomètrique: accumulation de charges électriques à la surface de l’électrode indicatrice ... 6
Figure I.3: Principe de la transduction ampérométrique ... 8
Figure I.4: Principe de la transduction conductimétrique ... 9
Figure I.5: Schéma de principe des mesures impédimètrique ... 10
Figure I.6: Sélectivité d’un biocapteur ... 11
Figure I.7: Maille élémentaire du diamant ... 13
Figure I.8: Schéma de principe de la méthode MPCVD ... 15
Figure I.9: dépôt poly-cristallin, phase de croissance du film ... 16
Figure I.10: Comparaison des voltampérométries cycliques (VC) de différentes électrodes (diamants, or, platine et carbone vitreux) ... 21
Figure I.11: La double couche électrique ... 24
Figure I.12: Schéma d’une fonction de transfert ... 25
Figure I.13: Circuit équivalent de Randle ... 27
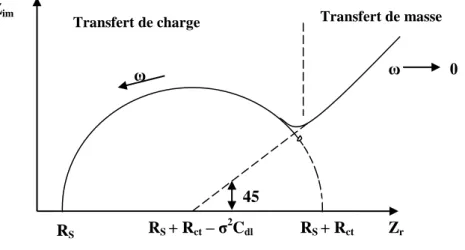
Figure I.14: Diagramme de Nyquist de l’impédance d’une cellule électrochimique ... 30
Figure I.15: Signal potentiel- temps typique de la voltampérométrie cyclique ... 31
Figure I.16: Exemple d'un voltampérogramme cyclique ... 32
Figure I.17: voltamogramme cyclique d’un couple redox ... 32
Figure I.18: Graphe de la densité de courent de transfert de charge en fonction de la surtension d’électrode ... 34
Figure I.19: Voltampérogramme résultant d'une impulsion ondes carrées ... 35
Figure I.20: Les différentes techniques voltamétriques ... 37
Figure I-21: Squelette de base des flavonoïdes ... 40
Figure I-22: Structure de base des anthocyanes ... 41
Figure I-23: Structure de base de l’acide éllagique ... 42
Figure I-24:Structure de base des tanins condensés ... 42
Figure I-25: Les flavonoïdes et leurs sites proposés pour la chélation des ions métalliques (Mn+)….44 Figure I-26: gland de chêne liège ... 45
Figure I-27: structure de base de vescalagine ... 46
Figure I.28: Le mécanisme réactionnel de fixation des ions métalliques ... 48
Figure II.1: Protocole d’extraction des polyphénols ... 53
Figure II.3: Protocole de dosage des polyphénols totaux ... 58
Figure II.4: Courbe d’étalonnage de l’acide gallique ... 59
Figure II.5: Protocole de dosage des flavonoïdes ... 59
Figure II.6: Courbe d’étalonnage de la quercetine ... 60
Figure II.7: Protocole de dosage des tannins ... 61
Figure II.8: Courbe d’étalonnage de l’acide tannique ... 62
Figure II.9: Protocole de dosage des tannins condensés ... 62
Figure II.10: Courbe d’étalonnage de la catéchine ... 62
Figure II.11: Protocole de dosage des tannins hydrolysables ... 63
Figure II.12: Courbe d’étalonnage de l’acide tannique ... 64
Figure II.13: Affrontement des phases aqueuses par les solvants ... 64
Figure II.14: Protocole d’extraction par affrontement ... 66
Figure II.15: Rendement d’extraction de l’écorce du gland ... 71
Figure II.16: Composition physico-chimique de l’écorce de gland ... 73
Figure II.17: Profil de Chromatogramme HPLC de l’acide tannique ... 77
Figure II.18: Profil de Chromatogramme HPLC de l’acide gallique ... 77
Figure II.19: Profil de Chromatogramme HPLC de la quercétine ... 77
Figure II.20: Profil de Chromatogramme HPLC de la phase acétate d’éthyle ... 77
Figure II.21: Profil de Chromatogramme HPLC de la phase éther d’éthylique ... 78
Figure II.22: Profil de Chromatogramme HPLC de la phase aqueuse (EA). ... 78
Figure II.23: Profil de Chromatogramme HPLC de la phase Butanone (méthyl-éthyl-cétone (MEC).78 Figure II-24: Spectre IR de l’extrait de gland ... 79
Figure II.25: Unités de base des polyphénols ... 80
Figure II.26: fonctionnalisation des électrodes ... 82
Figure II.27: Schéma du dispositif expérimental pour les mesures électrochimiques ... 82
Figure II.28: Schéma de la cellule électrochimique à trois électrodes ... 83
Figure II.29: Montage expérimentale ... 84
Figure II.30: Voltammogramme du couple redox Fe(CN) 64-/3- de l’électrode nue ... 85
Figure II.31: Voltammogramme cyclique de l’électrode nue et l’électrode fonctionnalisée en présence du couple redox Fe (CN) 64-/3 (pH=7,2 ... 86
Figure II.32: Diagramme de Nyquist Z pour électrode fonctionnalisée par (l’écorce du gland+ PVC) à différent potentiel (-200mV,-300mV,-400mv), la solution support est le PBS (0,05 M, pH=7,2) ... 87
Figure II.33: Diagramme de Nyquist Z pour électrode nue et électrode fonctionnalisée par (l’écorce du gland+ PVC), la solution support est le PBS (0,05 M, pH=7,2) ... 88
Figure II.35: Diagramme d’impédance Nyguist Z pour une électrode fonctionnalisée par (PVC+
Extrait) suite à l’injection de concentrations croissante des ions:de cadmium, de Zinc, et de Nickel…89
Figure II.36: Voltammogramme obtenu par mesure de SWV de l’électrode suite à l’injection de
concentrations croissante des ions de cadmium, de Zinc et de Nickel ... 92
Figure II.37: Variation de la résistance de transfert de charge (ΔRct) en fonction du logarithme de
concentration des trois métaux ... 93
Figure II.38: Voltammogrammes à onde carrée de cadmium (10-3 M), zinc (10-4 M) et Nickel (10-2
M) dans une solution tampon PBS 50 nM pH 7,2 ... 94
Figure II.39: Structure du substrat utilisé: film de BDD déposé sur du silicium isolé…………..….100 Figue II.40: Design des micro-cellules électrochimiques réparties sur un wafer de silicium isolé .... 100
Figure II.41: Les trois électrodes de la micro-cellule électrochimique ... 101
Figure II.42: Montage expérimentale ... 102
Figure II.43: Voltamétrie cycliques avec HNO3 0,1 M ... 104
Figure II.44: Voltammogramme cyclique de l’électrode BDD nue et l’électrode BDD modifiée par
(Extrait + PVC) en présence du couple redox Fe (CN) 64-/3 ... 104
Figure II.45: Courbes de calibration DPASV pour Pb+2, Cd+2 et Ni+2 ... 105
Figure II.46: Courbes d'étalonnage pour les ions Cd2+, Ni2+, et Pb2+ à pH 2dans le tampon citrate de
potassium 0,1 M ... 106
Figure II.47: Détection simultanée par DPASV obtenue avec les électrodes BDD, de Cd (25nM), Ni
(5,5nM), Pb (75nM) dans le citrate de potassium 0,1 M / HCl, pH2 ... 107
Figure II.48: le mécanisme réactionnel de fixation des métaux lourds avec les tannins ... 114
Tableau I.1: Caractéristiques physiques du diamant comparées à celles du silicium ... 14
Tableau I.2: Les principales classes de composés phénoliques ... 39
Tableau I.3 : Evolution de l’état de l’art concernant la source de tanin………....49
Tableau II.1: tests des caractérisations de l’extrait acétonique ... 54
Tableau II.2: Le rendement des deux extraits ... 71
Tableau II.3: Métabolites secondaires mis en évidence au niveau de l’écorce de gland. ... 72
Tableau II.4: Dosage des composés polyphénoliques ... 73
Tableau II.5: Résultats de la CCM analytique ... 75
Tableau II.6: Temps de rétention des témoins utilisés en HPLC ... 76
Tableau II.7: Paramètres de modélisation des diagrammes de Nyquist Z ... 90
Tableau II.8: coefficient de sélectivité ... 95
Tableau II.9: Comparaison entre les concentrations vraies et calculées ... 96
Tableau II.10: Comparaison de nos résultats avec d’autres travaux ... 108
Tableau II.11: Coefficient de sélectivité ... 108
Tableau II.12: Comparaison entre les concentrations vraies et calculées ... 108
Tableau II.13: Comparaison de nos résultats avec d’autres travaux ... 109
- 1 -
L
a tâche actuelle du spécialiste en traitement des eaux ne consiste pas uniquement à appliquer des principes connus, étant donné que la croissance démographique et l’industrialisation ont augmenté la quantité et la diversité des déchets rejetés dans les rivières et les lacs; ce qui a donné naissance à de nouveaux problèmes (les virus, les métaux lourds, les micropolluants…); et a engendré autant de risques que le spécialiste doit résoudre techniquement et de façon économique.Les métaux lourds sont, en effet, des espèces hautement toxiques au-delà d’une certaine concentration. Ils possèdent la capacité de se concentrer le long de la chaine alimentaire et de s’accumuler dans certains organes du corps humain. Il est donc indispensable d’éliminer totalement les ions des métaux lourds présents dans les différents effluents industriels ou de réduire leurs quantités au-dessous des seuils admissibles définis par les normes.
Les instruments classiques d’analyse pour la détection d’une espèce (bio) chimique sont généralement complexes, coûteux, volumineux et souvent difficiles à mettre en œuvre. De plus, les phases de préparation des échantillons, d’incubation, et d’exploitation des résultats augmentent souvent très fortement la durée totale d’analyse.
Dans le domaine environnemental et plus précisément celui de l’analyse des eaux, les appareils de mesure qualitative en continu doivent être compatibles avec les caractéristiques géomorphologiques et dynamiques des hydro-systèmes étudiés. Pour cela il faut développer des moyens d’investigation présentant des caractéristiques spécifiques : économiques afin de permettre la multiplication des mesures ; autonomes pour limiter les coûts de maintenance ; rapides car adaptés aux événements transitoires, fiables et précis afin de conserver la qualité des mesures actuelles et enfin non perturbateurs pour ne pas modifier les caractéristiques de l'environnement autour du point de mesure.
Dans le but de développer de nouveaux instruments d’analyses des métaux lourds dans les milieux hydriques qui soient portatifs, simple, miniatures, performants et à faible coût capable d’une détection à l’état de trace, nous avons procédé par l’assemblage intime de deux partie à savoir la partie sensible du capteur et le transducteur. En effet, ces capteurs doivent posséder une bonne sensibilité, sélectivité et aussi stabilité. Ils sont en général constitués d’une membrane sensible comprenant un ionophore sélectif. Dans notre cas, nous avons utilisé des polyphénols, extraits des déchets végétaux (écorce du gland de chêne liège). Cette substance est déposée sur le substrat grâce à une matrice en polychlorure de vinyle (PVC) plastifié jouant le rôle de matrice. La membrane polymère en question fonctionnalisera des
- 2 -
transducteurs en or et en diamant dopé au bord (BDD). Ces derniers transformeront l'interaction chimique entre les métaux lourds et l'ionophore en un signal électrique mesurable et interprétable. Le choix de substances extraites de l’écorce du gland du chêne liège comme molécule active denotre capteur repose surtout sur sa richesse en composés polyphénoliques.
Notre thèse est subdivisée en deux grands chapitres :
Dans le premier, on y trouve une revue bibliographique, organisée autour de cinq parties. La première partie rassemble une étude des capteurs chimiques, les différentes composantes impliquées dansleurs constructions et les différents modes de transductions. La seconde partie est consacrée à une présentation des généralités sur les électrodes de diamant dopé au bore. Une troisième partieaura pour objectif deprésenter des différentes méthodes de caractérisations électrochimiques à savoir la spectroscopie d’impédance, la voltamètrie cyclique et les techniques pulsées. Ces méthodes seront utilisées pour évaluer le comportement de la membrane sensible vis-à-vis des différents polluants. Une quatrième partie sera consacrée à une généralité sur les métabolites secondaires, suivi par présentation des notions théoriques fondamentales sur la plante utilisée au cours de ce travail.
Et enfin une partie consacrée à l’état de l’art est réalisée comprenant quelques récents travaux qui ont été effectués pour pouvoir se situer dans le contexte général de l’étude réalisée.
Dans le deuxième chapitre, nous présenterons les différentes techniques expérimentales en allant de la préparation des surfaces des structures utilisées jusqu’aux différentes caractérisations effectuées sur les capteurs, en passant par les méthodes de dépôt des membranes polymères.
Ce chapitre comporte cinq parties. La première englobe l’ensemble des méthodes de caractérisation phytochimiques réalisés. Le développement d’un capteur chimique à base de l’extrait de notre plantes sur un transducteur en or en vue de la détection des métaux lourds fera l’objet de la deuxième partie.
La troisième partie est consacrée à l’élaboration d’un nouveau capteur fonctionnalisé par le même extrait déposé sur un autre transducteur en diamant dopé au bord (BDD).
Et pour mieux comprendre les réactions mis en jeu à la surface des deux capteurs développés, la quatrième partie est réservé à l’étude de phénomène de complexation suivi d’une comparaison entre les résultats obtenus pour les deux transducteurs (or et BDD).
Le manuscrit sera clôturé par une conclusion générale récapitulant les principaux résultatsainsi que les perspectives d’études qui peuvent être envisagées.
- 3
-Chapitre I: Partie théorique
Les progrès récents ont considérablement développés les techniques mises en jeu dans des domaines de la médecine, de la biologie clinique, de l’agro-alimentaire et du contrôle de la qualité de notre environnement (surveillance des rejets industriels ou domestiques) conduisant à la mise au point de méthodes analytiques de plus en plus précises et sélectives depuis le premier biocapteur développé par Clark et Lyons au début des années soixante [1]. Les capteurs sont considérés comme une alternative particulièrement intéressante aux techniques analytiques traditionnelles telles que la chromatographie, la spectrométrie de masse ou la spectrométrie d’absorption atomique. Ces techniques sont généralement complexes, volumineuses, coûteuses, tributaires de sources d’énergie relativement importantes et souvent difficiles à mettre en œuvre. Les capteurs constituent sans doute l’alternative la plus séduisante pour proposer des systèmes simples, fiables, rapides et sélectifs de détection. De plus, leur petite taille, leur facilité d’utilisation ou encore la possibilité qu’ils offrent de réaliser des mesures sur site ont fait des outils particulièrement intéressants. Le marché actuel des capteurs est en forte expansion. Un tour d'horizon des nouveaux produits de ce type commercialisé ou en phase de l'être montre l'effervescence du secteur au niveau international.
Dans cette partie, des généralités sur les capteurs seront présentées. Nous présenterons en suite des généralités sur les électrodes de diamant dopé au bore suivi par les différentes méthodes de caractérisations utilisées. Des généralités sur les métabolites secondaires avec une description de la plantes faisant l’objet de l’étude seront abordées. Enfin, nous présenterons un état de l’art pour pouvoir situer l’intérêt de notre travail vis-à-vis des récentes recherches effectuées dans le domaine.
I.1 DEFINITION ET PRINCIPE DE FONCTIONNEMENT D’UN CAPTEUR ELECTROCHIMIQUE
Les capteurs sont des dispositifs d’analyse chimique associant étroitement ou intégrant un système de reconnaissance moléculaire appelé « récepteur » et un système physique appelé « transducteur », transformant l’information chimique en un signal électrique facilement exploitable. La figure I.1 représente le principe de fonctionnement d’un capteur
- 4
-permettant d’obtenir à partir de l’espèce présente dans un échantillon toute l’information utile à sa détection.
Figure I-1 : Représentation schématique du principe de fonctionnement d'un biocapteur [2]
I.1.1. Reconnaissance chimique
Le choix, la modification ou la synthèse d’une molécule de reconnaissance constitue l’un des points importants de la réalisation d’un capteur chimique. Cependant la recherche d’une très grande sélectivité ne conduira pas nécessairement à un mécanisme d’interaction détectable et il serait illusoire de vouloir disposer d’un système sophistiqué possible si celui-ci et incapable de communiquer l’information de reconnaissance au transducteur. Un grand nombre de possibilité de transduction sont envisageables, mais il est généralement nécessaire de pouvoir fixer la molécule de reconnaissance sur le transducteur tout en conservant l’intégralité de ces éléments et du mécanisme de reconnaissance lui-même. C’est la réussite de cette association qui conditionnera les performances du capteur dérivant.
Dans une optique capteur, il ne faut pas perdre de vue que si les progrès de la synthèse organiques ont permis la construction de molécule de reconnaissance parfaitement adaptée à l’ion où à la molécule à doser, cela ne doit pas masquer les problèmes de la fonctionnalisation du transducteur à l’aide de telle espèces. Ces molécules doivent être : soit modifiées à l’aide de groupements susceptibles de réagir directement avec le substrat du transducteur ou un agent de couplage ayant servi à activer la surface, soit incorporées dans une matrice polymérique, le tout étant ensuite « coulé » sur le transducteur [3]. Nous utiliserons les composés polyphénoliques extraits de l’écorce de gland de chêne liège pour détecter les métaux lourds (cadmium, zinc, nickel et plomb).
Chimiorécepteurs
QCM
Milieu réactionnel Biorécepteur Transducteur Signal Enregistreur
- 5
-Une fois le récepteur mis au point, il est nécessaire de lui associer un système de transduction efficace. Ces systèmes sont nombreux et variés. Nous décrirons les principaux modes de transduction des capteurs chimiques sachant que le choix du transducteur est fonction des paramètres à mesurer.
I.1.2. Transducteurs
Plusieurs types de transducteurs ont été proposés pour l’élaboration de capteurs électrochimique. Parmi les transducteurs les plus fréquemment utilisés, on peut citer le FET ( Field Effect Transisotor) [4,5], les structures IS (Isolant-Semicoducteur) [6,7], les électrodes métalliques notamment l’or [8,9], le platine [10-11], l’argent [12,13], le carbone vitreux[14,15], les fibres optiques [16,17] et les électrodes interdigitées [18-19].
Comme nous avons signalé auparavant, le transducteur va assurer la transduction du signal émis par le récepteur en contact de la substance cible. Cependant, suivant le type de la réaction et les substances libérées ou consommées, on choisira le transducteur approprié [3]. Le choix de ce dernier dépend directement de la réponse du récepteur. Un transducteur doit être capable de suivre efficacement la réaction ou les variations induites par l’élément chimique ou biologique. Plusieurs combinaisons de transducteur-récepteur peuvent donc être construites pour la mise en place de capteurs fiables. Par exemple, une réaction mettant en jeu des variations d’enthalpie doit être nécessairement suivie par un transducteur thermique [20]. Plusieurs systèmes de transduction basés sur des principes différents sont généralement et couramment utilisés afin de convertir la reconnaissance moléculaire en un signal électrique exploitable.
I.1.3. Les différents types des capteurs
I.1.3.1. Les différents types de capteurs électrochimiques
Selon le paramètre mesuré, il s’agit de transducteur ampérométriques (variation de courant), potentiométriques (variation de tension) ou conductimétriques (variation de conductivité) [21]. Basés sur de différents principes, ils sont utilisés afin de convertir la reconnaissance en un signal électrique exploitable. Dans tous processus électrochimiques, on mesure un signal électrique généré entre deux électrodes par une réaction d’oxydo-réduction ou ionique de l’espèce à détecter. Lors de ce transfert de charge, on assiste à une transformation chimique. Ces réactions d’oxydation et de réduction obéissent au schéma réactionnel suivant (Eq.I.1) [22].
Oxydation Réduction
- 6
-Les capteurs potentiométriques et ampérométriques sont les plus répandus. Toutefois, depuis les années 1980, les capteurs conductimétriques commencent à être à leur tour de plus en plus utilisés compte tenu de leur facilité d’élaboration et de la simplicité du circuit de mesure [23].
I.1.3.1.1. Les capteurs potentiométriques
La potentiométrie est une méthode électrochimique basée sur la mesure de la différence de potentiel entre une électrode de mesure et une électrode de référence. La détermination des potentiels des électrodes permet de mesurer directement la concentration de l’analyte à doser [23]. Cette différence de potentiel est fonction de l’activité de l’ion présent dans l’électrolyte où le capteur est plongé (Figure I.2).
Figure I.2 : Principe de mesure potentiomètrique : accumulation de charges électriques à la surface de
l’électrode indicatrice [25].
Les conditions opératoires sont dites « potentiométrie à courant nul » si l’on n’impose pas de courant dans le circuit. Dans le cas contraire, il s’agit de « potentiométrie à courant imposé » [24]. Dans ce type de système, un équilibre local est établi à la surface du capteur et conduit à la génération d’un potentiel proportionnel au logarithme de la concentration (activité) de l’échantillon selon la loi de Nernst, dans le cas d’un capteur redox [25].
Où :
EP : représente le potentiel du couple redox;
E°Ox/Red : le potentiel normal standard du couple redox; R : la constante des gaz parfaits (8.314 J.k-1.mol-1);
Electrode indicatrice Electrode de référence Solution à analyser Membrane sélective C+ : Cation A- : Anion
- 7
- aox/aRed : est le rapport de l’activité de l’espèce déterminant le potentiel à l’état oxydé
et à l’état réduit;
T : la température absolue en Kelvin ;
F : constante de Faraday (96500 C.mol-1).
Les plus anciens et les plus populaires dispositifs représentants ces électrodes sont les électrodes iono-sélectives (ISE).
En effet, les ISE mesurent la différence des potentiels entre les deux électrodes qui se développe à travers une membrane dite iono-sensible (verre, matériaux non organiques, polymères…). Le champ d’application des ISE est extrêmement vaste mais il concerne quasi exclusivement les milieux aqueux. On peut citer, par exemple, les domaines de l’environnement (CN
-, F- dans les effluents et les eaux naturelles), de l’agriculture (NO3- ,
NH4+, K+ dans les sols, les fertilisants, les plantes…etc), de l’alimentaire (le sel dans les
viandes, poissons, jus de fruit…etc), de l’industrie des détergents (Ca2+
, Ba2+, F- dans les eaux résiduelles), de l’industrie papetière, de l’industrie des explosifs (F
-, Cl-, NO3- dans les
explosifs et les produits de combustion) et du biomédical, (Ca2+, K+, Cl- dans les fluides biologiques).
Au-delà des inconvénients pratiques de cette technique d’analyse (sélectivité et fragilité par exemple) ces applications sont fondées principalement sur le faible coût des ISE, leur simplicité d’utilisation et la rapidité de la réponse [26].
Le deuxième type de capteurs potentiométriques sont les ISFET (transistor à effet de champ sélectif aux ions).
En 1970, Bergveld a présenté pour la première fois les capteurs à effet de champ sélectifs aux ions. Et c'est grâce à ce transistor que Bergveld a montré que l'utilisation de dispositifs dont le principe repose sur l'effet de champ est possible en milieu électrolytique. La silice, matériau isolant, est alors directement au contact de la solution électrolytique et une chute de potentiel à sa surface traduit les modifications à l'interface isolant/solution. Les principaux atouts de ces capteurs chimiques sont leur compatibilité avec les micro-technologies, donc, la production en masse à bas coût, leur simplicité d’utilisation, leurs faibles dimensions et leur caractère générique [27].
I.1.3.1.2. Les capteurs ampérométriques
La méthode ampérométrique consiste à mesurer le courant dû aux réactions électrochimiques (oxydation, réduction…) des espèces électroactives. Ce courant circule entre les deux électrodes plongées dans une solution et est fonction de la tension appliquée entre ces
- 8
-électrodes. Le courant mesuré dépend de la propriété des matériaux de détection, de la composition et de la géométrie des électrodes, des concentrations des espèces électroactives et des mécanismes de transport des espèces en phase liquide (migration, convection, diffusion) [28]. Comme le montre la figure I.3, l’interaction avec l’analyte peut provoquer une réaction directe ou indirecte de type redox (oxydo-réduction), modifiant ainsi l’accumulation de charges auniveau de l’électrode par rapport à une électrode de référence.
Les capteurs ampérométriques sont généralement des électrodes métalliques, des électrodes de carbone ou des électrodes modifiées chimiquement (CME) [29,30]. Le capteur ampérometrique le plus connu est le capteur d’oxygène O2 (électrode de Clark). En général,
ils sont caractérisés par de bonnessensibilités et rapidité de réponse.
Figure I.3 : Principe de la transduction ampérométrique.
I.1.3.1.3. Les capteurs conductimétriques
Les méthodes de transduction par conductimétrie sont attractives grâce à leur simplicité de fabrication et leur facilité d’utilisation. Comme le montre la figure I.4, les transducteurs conductimétriques mesurent les changements d’impédance électrique entre deux électrodes, où les variations peuvent avoir lieu à une interface ou dans la région comprise entre les électrodes. Contrairement aux transducteurs ampérométriques et potentiométriques, la simplicité de fabrication provient de l’absence d’électrode de référence. Les capteurs conductimétriques détectent toutes les espèces ioniques présentées dans la solution. La limite de détection est de l'ordre du ppm à quelques ppb suivant les espèces chimiques à détecter et le matériau utilisé. En général, des électrodes interdigitées sont largement utilisées pour ce type de capteurs.
Les capteurs conductimétriques sont caractérisés par leur simplicité, leurs petites dimensions. En revanche, la sensibilité et la sélectivité de ces capteurs sont à améliorer [31].
La mesure de deux types d’impédance peut être un avantage ou un inconvénient selon la composition du milieu. Si les changements doivent être mesurés à l’interface des électrodes,
- 9
-la composition du milieu dans -la région entre les électrodes (-la force ionique entre autre) peut perturber les mesures. C’est pourquoi, malgré la simplicité du principe de détection, des optimisations sont nécessaires afin d’améliorer la sélectivité de ladétection.
Figure I.4: Principe de la transduction conductimétrique.
I.1.3.1.4. Capteur impédimétrique
Les capteurs impédimétriques sont une combinaison entre les capteurs ampérométrique et potentiométrique. Le principe de ce type de capteur électrochimique repose sur la mesure de l’impédance d’une cellule électrochimique par la technique de spectroscopie d’impédance, dont le principe est détaillé dans la partie suivante. Cette technique permet de contrôler le processus de transfert de charge à l’interface électrode / électrolyte [25].
Pratiquement, la mesure de l’impédance s’effectue dans une cellule à trois électrode, une électrode indicatrice sur laquelle est déposé l’élément sensible (récepteur), une électrode de référence et une électrode auxiliaire (figure I.5). En effet, un potentiel imposé avec une perturbation sinusoïdale de faible amplitude, entre l’électrode de référence et l’électrode indicatrice, permet la mesure d’un courant, de la même forme généré par l’électrode indicatrice et l’électrode auxiliaire. Le rapport de la tension appliquée à l’intensité du courant mesuré définit l’impédance du système électrochimique. Cette impédance peut être représentée par un circuit électrique équivalent selon le type du système électrochimique (système faradique ou système non faradique). Ce circuit permet d’exprimer les paramètres électriques qui définissent le phénomène de transfert de charge se produisant à l’interface électrode /électrolyte.
Dans un système de biocapteur ces paramètres varient lorsqu’il y aura des changements provenant des interactions biomoléculaires à la surface de l’électrode indicatrice.
Electrode de mesure Electrode de mesure
- 10
-Figure I.5 : Schéma de principe des mesures impédimètrique [25].
Il existe aussi d’autres types de capteurs basés sur des principes différents tels que :
I.1.3.2. Les capteurs optiques
L’utilisation de transducteurs optiques est de plus en plus répandue notamment pour les milieux biologiques et environnementaux [22]. La détection est réalisée grâce à des changements des propriétés optiques (réflexion, absorption, …). Le choix d’une méthode optique particulière dépend de la nature de l’application et de la sensibilité désirée. Dans le cas de la fibre optique, la détection par ondes évanescentes via les fibres optique est de plus en plus utilisée. Les capteurs à fibres optiques, grâce à leur faible poids, leurs petites dimensions et leur insensibilité aux interférences électromagnétiques ainsi que la possibilité d’effectuer des mesures dans les endroits difficilement accessibles, ont rapidement pris une place importante dans le rang des capteurs chimiques.
Le principe de la détection par capteur à fibre optique se base sur des changements de la fréquence ou de l’intensité du rayonnement électromagnétique (par exemple le visible, l’infrarouge) pour détecter et identifier la présence de produits chimiques.
Une large gamme d’espèces chimiques peut être mesurée en utilisant ces capteurs à fibre optique (pH, pCO2, pNH4, glucose, sodium, cations des métaux…) [25].
I.1.3.3. Les capteurs thermiques
L'intérêt de la mise en œuvre des capteurs enthalpimétriques (thermiques) résulte du fait que la plupart des réactions s'accompagnent d'une émission de chaleur. De nature très générale et donc de potentialité élevée, ces capteurs sont cependant relativement peu sensibles et nécessitent des montages différentiels très bien équilibrés afin de compenser toute variation de température parasite.
Electrode de travail Electrode auxiliaire
- 11
-Le changement de température, ∆T, est déterminé un microcalorimètre et est relié aux variations d’enthalpie, ∆H, et la capacité de chaleur du réacteur, Cp par la relation suivante :
Avec : n : nombre de moles de substrat ayant réagi.
Dans la construction d’un capteur chimique, l’immobilisation du récepteur sur la surface du transducteur est une étape cruciale. En effet, le but principal est de fixer le récepteur à la surface de l’électrode permettant de ce fait son utilisation à long terme tout en maintenant son activité et assurant une bonne détection par le transducteur du signal chimique issu du récepteur [32].
I.1.4. Qualités d’un capteur :
Un biocapteur fiable doit être :
Sélectif : ayant la capacité de distinguer entre des cibles différentes. C'est un paramètre qui dépend principalement du composant biologique ou chimique, bien que parfois le choix du transducteur peut eventuellement contribuer à la sélectivité (figure I.6).
Figure I.6. Sélectivité d’un biocapteur [32].
Sensible : Ce paramètre correspond au rapport entre l’augmentation de la réponse du capteur et la variation correspondante de la concentration de la cible.
Signal Transducteur Elément de reconnaissance moléculaire Analyte Signal X Elément de reconnaissance moléculaire Transducteur
- 12
- Reproductible : Capable de donner des réponses très voisines pour des mesures répétées de la même concentration de la cible.
Exact : Permettant d’avoir un bon accord entre le résultat de la mesure et la valeur vraie de la concentration de la cible. L’écart est appelé erreur absolue.
Avoir une basse limite de détection : Qui correspond à la valeur minimale de la concentration de la cible pouvant être détectée par le biocapteur de façon significativement différente du bruit de fond [32].
I.1.5. Différents types d’interaction entre l’espèce chimique et la partie sensible du capteur
I.1.5.1. Adsorption physique
Les espèces adsorbées à la surface de la structure sont en équilibre, grâce aux forces de Van der Valls qui sont faciles à rompre par désorption (lavage par exemple) donc on aura une réversibilité de mesure plus aisée. La variation de la concentration de l’espèce à détecter peut être déterminée par la variation de la capacité du système.
I.1.5.2. Adsorption chimique
Le mécanisme d’interaction est une liaison chimique ce qui présente un caractère difficilement réversible. Le capteur sera sélectif puisqu’il pourra reconnaître facilement une espèce ionique de charge et de dimension bien définies. La reconnaissance se traduit par la formation d’un complexe qui peut donner des informations relatives à la structure moléculaire. Un signal électrique sera recueilli par la suite [33].
- 13
-I.2 RAPPELS BIBLIOGRAPHIQUES SUR LES ELECTRODES DE DIAMANT
Afin de pouvoir situer le travail présenté dans la troisième partie du deuxième chapitre, un rappel des principales connaissances sur les électrodes de diamants dopés au bore (BDD) est proposé dans cette partie.
I.2.1. Structure du diamant
Le diamant est l’une des trois formes allotropiques du carbone avec le graphite et le fullerène. Alors que le graphite se trouve sous forme de feuillets hexagonaux et le fullerène sous la forme de sphères, d’un ellipsoïde ou d’un tube composé de feuillets, le diamant se présente sous la structure cristalline cubique faces centrées(CFC). La structure diamant comporte huit atomes de carbone par maille élémentaire. Chaque atome de carbone est lié de façon covalente aux quatre autres: ils sont ditshybridés sp3. La forme sp3 est une forme métastable du carbone; la forme stable du carbone étant le graphite où le carbone trivalent a une hybridation sp2.
Figure I.7 : Maille élémentaire du diamant
A l’état naturel, le diamant se forme sous la croûte terrestre à des profondeurs telles que les températures et pressions atteignent respectivement 1100 à 1400 °C sous 4 à 6 GPa, conditions nécessaires à la cristallisation en une structure dérivée du CFC du carbone qui le compose.
I.2.2. Propriétés du diamant
Le réseau cristallin du diamant est très dense (1,54 Å entre chaque atome voisin). Ce matériau possède un fort nombre d’atomes par unité de volume (1,76 1023 atomes.cm-3
). Les fortes énergies de cohésion atomiques (7,3 eV/atome) et sa très faible distance interatomique font du diamant un matériau très résistant, électriquement isolant et très bon conducteur thermique (20 W.cm-1.K-1, 5 fois plus élevée que celle du cuivre). Il est inerte vis-à-vis
- 14
-d’agents agressifs aussi divers que sont les acides, les bases, les oxydants et réducteurs. Le diamant est également très résistant aux rayonnements ionisants (dose intégrée maximale de 2,5 MGy pour le rayonnement gamma de 1 MeV). De plus, son utilisation dans le domaine de la dosimétrie médicale est envisageable car son numéro atomique (Z = 6) est très proche de celui du tissu humain (Z = 7,1) [35].
Le tableau ci-dessous récapitule les principales caractéristiques physiques du diamant et les compare avec celles du silicium [36].
Tableau I.1 : Caractéristiques physiques du diamant comparées à celles du silicium
Caractéristiques Diamant Silicium
Durée de vie des porteurs de charges 100 ps à 10 ns pour le diamant polycristallin et 30 ns pour le diamant Monocristallin 0,10 s
Densité atomique 1,76.1023atomes.cm-3 4,96.10
22 atomes.cm-3 Densité 3,51 2,33 Largeur de bande interdite 5,5 eV 1,1 eV Résistivité de 1012.cm à 1015.cm 5.105 .cm
Mobilité des électrons
à 300 K 2000 cm
2
.V-1.s-1 1350 cm2.V-1.s-1
Énergie de cohésion 7,37 eV par atome 4,63 eV par atome
Énergie de création
paire électron/trou 13 eV 3,6 eV
Température
maximale d’utilisation > 500 °C 50 °C
I.2.3. Synthèse du diamant
Au vu des propriétés intéressantes du diamant pour la recherche et l’industrie, les chercheurs se sont naturellement intéressés à sa synthèse. Le premier diamant artificiel provient de Stockholm et date de 1953 [37].
Dans le cadre de cette étude la synthèse du diamant se fera par dépôt en phase vapeur assisté par plasma microonde (MPCVD) dans une enceinte métallique sous vide qui constitue
- 15
-le réacteur. Le réacteur est identifié au laboratoire sous -le nom de BAOBAB. La méthode
MPCVD nécessite au moins deux gaz, le premier apporte les atomes de carbone, le second les atomes d’hydrogène. Usuellement pour l’apport de carbone, le méthane (CH4) est utilisé,
quant à l’hydrogène il sera fourni par le second gaz (dihydrogène). La pression de l’enceinte est comprise entre 30 et 100 mbar.
Ces deux gaz forment un mélange gazeux qui sera ionisé grâce à un champ électrique intense. Ce champ électrique est produit par l’énergie micro-onde. Le mélange gazeux se transforme alors en plasma. Plusieurs facteurs influencent la qualité du matériau produit : la pression dans l’enceinte, la température du substrat (900 °C), la puissance micro-onde (quelque kW) et la composition du mélange gazeux. (Figure I.8)
Figure I.8 : Schéma de principe de la méthode MPCVD
La première étape de synthèse est la nucléation. Elle consiste à créer des germes de diamant sur un substrat de silicium. Ce dernier est utilisé sous la forme de disques de 5 cm de diamètre recouvert de nanoparticules de diamant par spin coating afin d’initier la nucléation. A partir des sites de nucléation, les germes de diamant croissent pour finalement se rejoindre et ainsi former un dépôt poly-cristallin (figure I.9). Une nouvelle phase débute alors, elle est nommée phase de croissance du film. Les atomes de carbone vont venir se lier à la surface des cristaux afin de les faire grandir.
Gaz : CH4, H2 Micro- Onde Plasma Couche de diamant Substrat de Silicium
- 16
-Figure I.9 : dépôt poly-cristallin, phase de croissance du film
Le but de cette étude étant l’utilisation du diamant pour des applications de type capteurs électrochimiques, il est nécessaire de le doper au bore afin qu’il acquière les propriétés de conduction électrique et de réactivité électrochimique. Pour se faire, il sera dopé au bore (dopage de type p). La concentration en bore qui sera inclus dans le matériau sera contrôlée par l’addition d’oxygène sous forme gazeuse.
I.2.4. La fonctionnalisation du diamant
Pendant longtemps, la surface du diamant était considérée comme chimiquement inerte à la plupart des réactifs. Sa modification de surface était même vue comme impossible comparée à d’autres semi-conducteurs.
Ces quinze dernières années, de nombreux progrès ont été réalisés dans la compréhension de la chimie de surface du diamant. Cela a permis de développer de méthodes robustes quant à l’introduction de différents groupes fonctionnels sur la surface du diamant. Ces méthodes sont basées sur la chimie, la photochimie, et dans le cas des électrodes de diamant sur l’électrochimie. Les techniques traitées ici, ont été adaptées sur diamant sur la base de leur développement sur silicium ou sur carbone vitreux.
Le diamant hydrogéné
Le diamant après synthèse, sorti du bâti, possède une surface hydrogénée, il est alors très hydrophobe.
Lorsque le diamant est lourdement dopé au bore ([B] > 3×1020 B.cm-3), il possède un comportement métallique, et peut servir d’électrode pour l’électrochimie. Au travers de l’étude de l’électrolyse d’une solution aqueuse d’acide sulfurique (H2SO4), un très faible
courant de fond ainsi qu’une large fenêtre électrochimique de 3,5 V ont été obtenus [38]. Ces électrodes peuvent réduire à des bas potentiels et même oxyder à des hauts potentiels des composés que certaines électrodes conventionnelles telles que l’or, le platine, le carbone
Cristal de Diamant Coalescences
Silicium
Germe Silicium
- 17
-vitreux ne peuvent atteindre. Elles demeurent alors très intéressantes à des fins environnementales puisque cela leur permet de réduire les nitrates et d’oxyder les composés organiques qui polluent les eaux sans attaquer l’eau.
Néanmoins, même si pendant très longtemps, la surface hydrogénée du diamant était considérée comme très stable, de récents travaux ont démontré que celle-ci s’oxydait naturellement à l’air et se stabilisait au bout d’une semaine. Ceci mène alors à une baisse de la réactivité de la surface avec une diminution très rapide de la constante de transfert de charge k0. Des traitements (électro-)chimiques permettent d’«activer» les électrodes pour les
stabiliser mais aussi pour obtenir des très bons k0 [39].
I.2.5. Types de conductance des matériaux diamant et leur préparation
En raison de sa grande largeur de bande interdite supérieure à 5 eV, le diamant non dopé est normalement électriquement isolant et ne peut pas être utilisé en tant que matériau d'électrode. Mais comme d'autres grands matériaux non conducteurs le diamant peut être transformé en conducteur par dopage avec certains éléments. Le phosphore [40] et l'azote sont utilisés comme dopant (dopants donneurs). Actuellement, dans la plupart des cas le bore est utilisé en tant que dopant (dopants accepteurs). Il en résulte un semi-conducteurs de type p.
I.2.5.1. Dopants donneurs
Les dopants donneurs sont principalement concentrés sur les premiers atomes de la colonne V du tableau de Mendeleïev : l'azote (N), le phosphore (P) et l'arsenic (As). Le phosphore est le dopant qui a été le plus étudié et a donné les résultats les plus concluants et satisfaisants [41, 42]. Toutefois, son énergie d'ionisation est de 0,6 eV, elle limite fortement a présence d’électrons à température ambiante. L'azote, premier élément de la colonne V, est très soluble dans le diamant. Sa masse atomique est de 14 g/mol. En revanche, son énergie d'ionisation est 1,7 eV, ce qui est bien trop élevé pour obtenir des conductivités acceptables, à température ambiante. Du fait de sa haute énergie d'ionisation, on ne le considère généralement pas comme un dopant mais comme un piège profond. Il pourrait éventuellement trouver des applications électroniques à de très hautes températures [43].
I.2.5.2. Dopants accepteurs
Pour ce qui est du dopage de type p, le dopant utilisé est le bore. Le diamant dopé au bore existe à l'état naturel (diamant IIb) mais il est très rare. Le bore confère au diamant sa coloration bleue. Placé en site substitutionnel, il a une énergie d'activation de 0,37 eV [44]. Cette énergie, relativement grande, induit un faible taux d’ionisation à température ambiante, ce qui limite la conductivité du diamant modérément dopé à de faibles valeurs.
- 18
-Du fait de sa faible masse (11 g/mol), le bore est le dopant qui donne les meilleurs résultats en implantation ionique, dopants p et n confondus, créant moins de dommages dans le cristal que la plupart des autres atomes.
I.2.6. Les techniques de dopage
Nous allons présenter ici les principales techniques de dopage du diamant par diffusion et par implantation ionique relevés dans la littérature. Il a été mis en évidence que les surfaces de diamant qui ont une des terminaisons hydrogène peuvent présenter une conduction de type p [45]. Cette conduction de surface est exploitée pour réaliser des composants à effet de champ haute fréquence [46] mais ne convient pas pour la réalisation de composants de forte puissance, lesquels nécessitent l’exploitation du volume du semi-conducteur. De plus, elle n’est pas stable en température [47].
I.2.6.1. Le dopage par diffusion
Cette technique a jusqu’ici été jugée peu efficace dans le cas du diamant. Les faibles valeurs des coefficients de diffusion de la plupart des impuretés dans le diamant la rendent peu fiable, surtout à des températures inférieures à 1400 °C. Ceci est dû notamment à la très forte densité atomique du diamant. D’après plusieurs études, la faible diffusivité des dopants est compensée par une forte température, allant de 1400 °C à 1900 °C [48-50]. La température est cependant limitée par le mécanisme de transformation du diamant en graphite, qui peut commencer aux alentours de 1500 °C. Tsai et al. [48], montrent que la source du dopage est du nitrure de bore cubique. La diffusion est obtenue par RTP (Rapid Thermal Process) à 1400 °C pendant 30 à 60 s. Les auteurs extraient un coefficient de diffusion du bore dans le diamant de 1.10-12cm2/s à partir des mesures SIMS réalisées.
Dans l’étude de Popovici et al. [51] la température n'est pas contrôlée car l’échantillon est situé à une distance d’1 mm d’un filament maintenu à une température de 2100 °C. La source utilisée est un film de bore solide déposé sur l'échantillon. Des mesures SIMS permettent d'extraire une constante de diffusion de 4.10-13cm2.s-1.Dans l’étude de Krutko et al, [49] l'échantillon de diamant est préalablement encapsulé dans du bore. Après une étape de diffusion de 2 minutes à 1600 °C, les auteurs mesurent une résistance par carré de l’ordre de 350 Ω, et une profondeur de diffusion de l’ordre de 600 nm. La constante de diffusion du bore est estimée à 5,2.10-12cm2/s à cette température. D’autres études proposent de compenser la faible diffusivité des dopants en utilisant la diffusion assistée par champ électrique (EFED) [51-53].Ces études concernant la diffusion du bore dans le diamant ne sont associées qu’à peu de caractérisations électriques, notamment de mesures de mobilité ou d’énergie d’activation des dopants.
- 19
-I.2.6.2. Le dopage par implantation ionique
L'implantation ionique est une technique de dopage particulièrement simple du point de vue de la maîtrise des niveaux de concentrations et des géométries de profils d'impuretés réalisés. Elle a été déterminante dans la conception de composants silicium ayant des géométries complexes. Elle pourrait apparaître, dans le cas du diamant, comme une solution plus simple. Les premiers essais de dopage du diamant par implantation ionique remontent aux années 60 [54]. Le dopage du diamant par implantation ionique été l’objet de nombreuses recherches au cours des 15 dernières années. La difficulté majeure de cette technique est la nature métastable des liaisons C-C de types sp3 relatives au diamant. Le procédé
d'implantation ionique crée des failles dans la structure cristalline du diamant, conduisant à la recristallisation de certaines liaisons sp3 en liaisons sp2, à la création de lacunes,
d’interstitiels, de liaisons pendantes ou d’agrégats de défauts. Ceci peut donner lieu à la formation d’une couche conductrice à l’intérieur des échantillons de diamant [55].
I.2.6.3.La méthode CIRA
La méthode CIRA (Cold Implantation Rapid Annealing) [56-57], proposée par Prins, donne des résultats satisfaisants. Il observe que les interstitiels commencent à migrer à température ambiante, laissant derrière eux une forte densité de lacunes qui se combinent entre elles pour former des agrégats de défauts qui rendent le recuit post-implantation peu efficace. Il met au point un procédé consistant à effectuer l'implantation à très basse température, pour limiter la diffusion des interstitiels et des lacunes. L'échantillon est ensuite recuit in situ, pour que le passage de la basse à la haute température, appropriée pour la recombinaison des interstitiels dopants avec les lacunes, se fasse le plus rapidement possible (quelques secondes). Avec cette technique, et en la combinant avec un deuxième recuit à plus haute température (1400 °C), pour éliminer les défauts cristallins subsistants, Fontaine et al [58], ont obtenu de bons résultats.
L'un des critères de cette technique est que la dose implantée ne doit pas dépasser la dose critique de graphitisation. Tshepe et al [59, 60], en multipliant le procédé CIRA, réalisent de multiples étapes implantation multi-énergie/recuit et parviennent ainsi à réaliser des couches ayant des dopages meilleurs, allant jusqu'aux dopages élevés (> 1.1021cm-3). Il faut cependant préciser que ces nombreuses étapes sont, finalement, relativement lourdes à mettre en œuvre et demandent un équipement très spécifique.
- 20
-I.2.6.4. Implantation par CVD
Semblable aux électrodes platinées, les électrodes de diamant dopé en film mince sont déposées sur un substrat conducteur [61, 62]. La technique de dépôt CVD est assistée par plasma. Le plasma nécessaire pour le dépôt est activé soit par des filaments chauds [87, 88, 89] ou par un rayonnement de micro-ondes [64]. Dans les deux cas, la phase gazeuse (environ 10 à 50mbar) se compose généralement de l'hydrogène comme gaz porteur, le méthane (0,5% - 3%de CH4 dans H2) ou d'un mélange acétone / méthane en tant que source de carbone et
d'autres gaz qui fournissent des dopants [61, 62, 63, 64]. L’utilisation de micro-ondes, se fait soit par voie thermique ou filaments chauds (température de filaments : environ 2200 à 2800°C), la phase gazeuse est activé pour former un plasma.
Des films de diamant dopés peuvent être déposés directement sur silicium sans aucune couche intermédiaire. Les films de diamant dopé sont déposés sur des substrats en métal auto-passivant, souvent appliqués pour améliorer l'adhérence du film de diamant sur le substrat, et pour protéger le substrat contre l'hydrogène dans le mélange gazeux de déposition. D'autres matériaux de substrat pour le dépôt de diamant dopé sont des matières carbonées telles que le graphite [65, 66], le carbone vitreux [65] ou des matériaux en fibre de carbone. Les électrodes de films minces de diamants peuvent être modifiées par une multitude façons pour changer leurs propriétés.
I.2.6.5.Recuit HPHT
Un deuxième type d'électrodes de diamant qui semble devenir le plus important est une électrode avec particules de diamant. Ces électrodes sont produites par l'immobilisation des particules de diamant dans un substrat [67-69]. A cet effet, des particules de diamant dopé au bore HPHT (haute pression, haute température), ayant une taille de particules comprise entre environ 100 et 200 nm sont utilisées. Si des particules de diamant sont noyées dans un substrat métallique conducteur [67, 68], l'espace entre les particules individuelles doit être protégé par une sorte de couche non conductrice de passivation. Des matériaux inorganiques ou des composés organiques perfluorés sont nécessaires. De telles électrodes peuvent être utilisées comme les électrodes habituelles avec films minces de diamants sur des substrats conducteurs. Cependant, il est également possible d'immobiliser les particules de diamant dans des substrats non conducteurs [70]. Les différents types de matériaux d'électrode en diamant actuellement utilisés sont indiqués sur la figure I.10.
- 21
-Figure I.10 : Comparaison des voltampérométries cycliques de différentes électrodes (diamants, or, platine et
carbone vitreux) pour l’électrolyse de l’eau dans une solution à 0,5M H2SO4. VC de différentes électrodes de diamant : deux électrodes de diamant polycristallin dopé au bore (B:PCD) et deux électrodes de diamant
- 22
-I.3 METHODES DE CARACTERISATION ELECTROCHIMIQUES
Durant notre travail, nous avons été amenés à utiliser des techniques
électrochimiques, à savoir la spectroscopie d’impédance, les techniques voltamétriques et plus particulièrement la voltamétrie cyclique et des techniques pulsées tels que : la voltamétrie à onde carrée (SWV), et voltamétrie à résolution anodique (DPASV). C’est pourquoi il est important de rappeler les bases de l’électrochimie qui s’appliquent à ces techniques voltamétriques et de présenter le principe physique des différentes techniques expérimentales utilisées pour le développement des différents capteurs étudiés.
L'électrochimie, fondée sur les lois de diffusion (Fick, 1855) et de l'électrolyse (Faraday, 1838), a connu et connaît encore un essor important. Les progrès de l'instrumentation électronique, l'apparition de nouveaux matériaux conducteurs et l'élaboration de nouvelles électrodes ont permis d'élargir son champ d'application. On la retrouve dans des disciplines aussi diverses que l'électrolyse, l'électrochimie industrielle, l'électro-catalyse et la corrosion. Grâce à la naissance de la polarographie (1950) [71,72], au développement des techniques impulsionnelles, à la diversification des techniques voltampérométriques [73] et à la possibilité de modifier des électrodes conventionnelles, elle occupe une place de choix parmi les méthodes analytiques aux titres de sa spécificité, sa sélectivité et sa sensibilité. Il faut ajouter que depuis le début des années 1990, se développent l'ultramicro-électrochimie et la microscopie électrochimique [74]. L'électrochimie [75-76] s'intéresse aux processus et aux facteurs qui influencent le transfert de charge à travers une interface conductrice électronique (une électrode) et un conducteur ionique (la solution électrolytique). Elle permet d'obtenir des renseignements sur la solution et sur les phénomènes se produisant à l'électrode, d'atteindre des grandeurs fondamentales d'ordre thermodynamique (potentiel normal E0, constante d'équilibre...) ou cinétique (formations d'espèces nouvelles), de concevoir de nouveaux générateurs (piles, accumulateurs...) ou appareils de synthèse ou d'analyse. Le transfert de charge est directement lié au potentiel et plus exactement à une différence de potentiel.
En électrochimie on s'intéresse souvent aux processus et aux facteurs qui influencent le transport de charges à travers l'interface entre phases distinctes chimiquement (électrodes et électrolytes). Le plus souvent l'une des deux phases de part et d'autre de l'interface étudiée est un électrolyte dans lequel les charges sont transportées par le mouvement des ions. La deuxième phase est une électrode, c'est à dire une phase dans laquelle le transport des charges a lieu par le mouvement d'électrons.
![Figure I-1 : Représentation schématique du principe de fonctionnement d'un biocapteur [2]](https://thumb-eu.123doks.com/thumbv2/123doknet/14465411.713382/17.892.128.821.196.522/figure-représentation-schématique-principe-fonctionnement-biocapteur.webp)
![Figure I.2 : Principe de mesure potentiomètrique : accumulation de charges électriques à la surface de l’électrode indicatrice [25]](https://thumb-eu.123doks.com/thumbv2/123doknet/14465411.713382/19.892.209.720.422.719/figure-principe-potentiomètrique-accumulation-charges-électriques-électrode-indicatrice.webp)