HAL Id: tel-01446840
https://tel.archives-ouvertes.fr/tel-01446840
Submitted on 26 Jan 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Evaluation de l’impact des formulations
pharmaceutiques sur l’absorption intestinale des
molécules actives au moyen des Chambres d’Ussing
Godefroy, Bruno Mamadou
To cite this version:
Godefroy, Bruno Mamadou. Evaluation de l’impact des formulations pharmaceutiques sur l’absorption intestinale des molécules actives au moyen des Chambres d’Ussing. Pharmacie galénique. Université Paris Saclay (COmUE), 2016. Français. �NNT : 2016SACLS478�. �tel-01446840�
THESE DE DOCTORAT
DE
L’UNIVERSITE PARIS SACLAY
PREPAREE A LA FACULTE DE PHARMACIE
DE CHÂTENAY-MALABRY
ECOLE DOCTORALE : 569
INNOVATION THERAPEUTIQUE : DU FONDAMENTAL A L’APPLIQUE (ITFA)
POLE : PHARMACOTECHNIE et PHYSICOCHIMIE PHARMACEUTIQUE
Par
Godefroy, Bruno MAMADOU
Thèse soutenue le 23 novembre 2016 à Châtenay-Malabry
Evaluation de l'impact des formulations pharmaceutiques sur
l'absorption intestinale des molécules actives mesurée au moyen
des Chambres d’Ussing
Directeur de thèse : Pr. Gilles Ponchel, Institut Galien Paris sud Composition du jury
Président :
Pr. Philippe POCHART : Conservatoire national des arts et métiers, Paris. Rapporteurs :
Pr. Eric BEYSSAC : Université d’Auvergne, Faculté de Pharmacie, Clermont-Ferrand Dr. Eric CHASTRE : Chargé de recherche -UFR de Médecine Paris 7 Denis Diderot Examinateurs
Pr. Codjo HOUNTONDJI : Université Pierre et Marie Curie, Paris
Dr. Christine CHARRUEAU, Faculté de Pharmacie, Laboratoire de Pharmacie Galénique, Paris 5 (Co-encadrant)
2
Evaluation de l'impact des formulations
pharmaceutiques sur l'absorption intestinale des
molécules actives mesurée au moyen des Chambres
3
Tout d’abord Je tiens à remercier mon directeur de thèse le professeur Gilles Ponchel pour sa confiance, son accompagnement tout au long de ce doctorat, sans qui cette thèse n’aurait pas vu le jour.
Mes co-encadrants, le docteur Bruno Eto qui m’a initié à la pratique de la technique de la chambre d’Ussing, à sa comprehension et sa maîtrise ainsi que le docteur Christine Charrueau pour sa collaboration à la fois pratique et scientifique.
A tous, merci pour vos conseils et votre amitié.
Merci également au professeur Elias Fathal qui m’a accueilli dans son unité à l’institut Galien Paris Sud.
Un grand merci aux membres du jury qui malgré un emploi du temps chargé, ont accepté d’évaluer cette thèse :
Les rapporteurs, le professeur Eric Beyssac et le docteur Eric Chastre, les examinateurs, le professeur Codjo Houtondji et le professeur Philipe Pochart.
Votre participation au jury de cette thèse est un grand honneur pour moi.
Merci à mes collègues du laboratoires Transcell-Lab, le docteur Nicolas Limas Nzouzi pour son soutien moral, son amitié et son apport scientifique, sans oublier le docteur Joe Miantezila.
Bien évidemment je n’oublie pas mes collègues de l’UMR 8612 de l’Institut Galien Paris Sud avec qui j’ai passé des très bons moments d’échanges enrichissants.
Ma gratitude va aussi au docteur Julien Dairou, qui m’a apporté une aide très précieuse pour le dosage du resvératrol. Sa collaboration technique a été déterminante.
Enfin, à ma famille, parents et amis qui ont tant bien que mal accepté mes absences. Je serais un peu plus disponible désormais.
A mon père qui certainement de là où il se trouve doit être fier.
Chacun d’entre vous a participé d’une façon ou d’une autre à l’ellaboration de ce travail.
A tous, je vous dis merci !
4
Liste des abréviations
AC : Acétaminiphène Ach : Acetylcholine
CaCC : Calcium-Activated Chloride Channel (Canaux chlorure calcium-dépendant)
Carb : Carbachol CD : Cyclodextrine
CFTR : Cystic Fibrosis Transmembrane Conductance Regulator ddp : différence de potentiel
DMEM : Dulbecco’s Modified Eagle's Medium ENac: Epithelial Na Channel
FITC : Isothiocyanate de Fluorescéine
FSK : Forskoline Glu : Glutamine Hist : Histamine
HPBCD : Hydroxypropyl-β-Cyclodextrine Icc : Courant de court -circuit
Isc : Short-circuit current NPs : Nanoparticules PA : Principe Actif
Papp : Perméabilité apparente PBS : Phosphate buffered saline P-gp : Permeability- glycoprotéine P PKA : Protéine Kinase A
RMBCD : Randomly-methyled-β-cyclodextrine SEDDs:Self-emulsifying drug delivery systems SGLT: Sodium/glucose cotransporter
5
SMEDDs: Self-microemulsifying drug delivery system
SRO : solution de réhydratation orale VitC : Vitamine C
6
Table des matières
1. Introduction générale ... 12
2. Le modèle de la chambre ... 16
2.1. Description technique de la chambre d’Ussing ...16
2.2. La chambre proprement dite ...17
2.2.1. Les différents types de chambres ...17
2.2.1.1. Les chambres verticales ... 18
2.2.1.2. Les chambres horizontales ou "dual chambers" ...20
2.2.1.3. Les chambres spécifiquement adaptées aux monocouches cellulaires obtenues par culture. ...22
3. les dispositifs techniques de la chambre d’Ussing ... 26
3.1. Le circuit électrique ...26
3.1.1. Les électrodes sélectives de calomel au KCl saturé ...27
3.1.2. Les électrodes de courant ...28
3.1.3. Les ponts d’agar ...28
3.2. Principe de montage ...29
3.3. Origine des courants mesurés en Ussing ...31
3.3.1. Principe de la mesure du courant au moyen du clamp électronique ...31
3.3.2. Approche physiologique et technique du problème...32
3.3.2.1. La différence de potentiel membranaire ... 33
3.3.2.2. Le courant ionique ... 33
3.3.2.3. La résistance et la conductance transépithéliales ... 34
3.3.3. Intérêts et applications de la mesure des paramètres électrique Isc, ddp, Gt ou Rt ...36
4. Applications de la chambre d’Ussing à la mesure du passage des molécules xénobiotiques au travers de la membrane digestive... 40
4.1. Détermination de la perméabilité de l'épithélium gastro-intestinal au moyen de la chambre d’Ussing ...40
4.2. Incidence des conditions expérimentales sur les mesures de perméabilité au moyen de la chambre de Ussing ...41
4.3. Utilisation des composés biologiques dans les solutions tampons ...42
4.4. Utilisation de co-solvant ...42
4.5. Utilisation des solutions tampons différentes dans les deux hémi-chambres constituant le dispositif d’Ussing ...43
7
5. Mise en évidence de l'origine pharmacocinétique d'interactions médicamenteuses survenant au niveau de l'absorption et liées avec les
pompes d’efflux ... 45
►Description de la glycoprotéine P (P-gp)...45
►Effet sur la biodisponibilité des médicaments ...45
6. Prédictibilité des mesures de perméabilité : Corrélations in vitro et in vivo. 47 7. Suivi de la viabilité tissulaire pendant et après les expériences de passage transmembranaire de molécules d’intérêts ... 49
7.1. Les transporteurs d’ions ...49
7.2. Mise en œuvre expérimentale : contrôle de la viabilité tissulaire par la stimulation des transporteurs d’ions ...51
7.2.1. Action du glucose sur le cotransporteur glucose/Na+et l’absorption du glucose ...51
7.2.2. Action des sécrétagogues sur les mécanismes d’excrétion des ions chlorure ....53
7.3. Autres récepteurs ...57
7.4. Principales substances utilisées dans le contrôle de la viabilité et conditions expérimentales correspondantes ...60
8. Avantages et inconvénients de la technique de la chambre de perméation d’Ussing ... 62
8.1. Avantages ...62
8.2. Inconvénients ...63
8.3. Conclusion ...63
Références ... 64
Influence des solutions physiologiques sur la perméabilité in vitro de molécules actives ... 70
Travail expérimental2 ... 97
Stratégies de formulation pour améliorer la solubilité et la perméabilité intestinale du resvératrol ... 97
Méthodologie expérimentale de l’étude de perméation d’une molécule active en chambre d’Ussing...157
1. Etude de passage membranaire d’une molécule d’intérêt ...158
2. Conditions expérimentales ...158
3. Technique de prélèvement du tube digestif d’un rat ...160
4. Plan expérimental ...174
Discussion et conclusion générale ...181
3. Conclusion générale ...199
8
Liste des figures
Figure 1 : Dispositif expérimental original ainsi qu'il fut conçu par H. Ussing en 1951 ... 17 Figure 2: Exemple de chambre d’Ussing verticale. a : Schéma montrant l'organisation
des deux demi chambres et b : Photo de la chambre d’Ussing assemblée et réalisée en plexiglas (Document Biomécatronics). ... 18 Figure 3 : Exemple de chambre de perméation d’Ussing présentant un dispositif
d’insert visant à réduire la surface d'étude (Document Biomécatronics). ... 19 Figure 4 : Disques amovibles servant d’inserts pour la mise en place de fragments
tissulaires présentant de petites surfaces utiles. (Document Biomécatronics). .. 19 Figure 5 : Exemple de disposition horizontale d'une chambre d'Ussing. a : Eclaté
montrant l'organisation de la chambre horizontale en deux demi chambres et b : Exemple de chambre horizontale réalisée en plexiglas. (Document
Biomécatronics). ... 21 Figure 6 : Eclaté montrant l'organisation de la chambre d’Ussing perforée et destinée
à recevoir des inserts supportant les monocouches cellulaires obtenus par
culture (Document Biomécatronics). ... 22 Figure 7 : Insert de type Transwell® avec support poreux (cutoff de 0,4µm) pour la
culture de monocouches cellulaires ... 23 Figure 8: Organisation générale des différentes électrodes (électrodes de courant et
électrodes sélectives au calomel) dans les deux demi chambres d’Ussing et leurs raccordements au clamp électronique (Document Biomécatronics)... 27 Figure 9 : Electrodes sélectives de calomel au KCl saturé ... 27 Figure 10: Organisation générale des différentes électrodes (électrodes de courant et
électrodes sélectives au calomel) dans les deux demi chambres d’Ussing et leurs raccordements au clamp électronique (Document Biomécatronics)... 30 Figure 11 : Dispositif expérimental rassemblant quatre chambres de perméation
d’Ussing montrant les chambres sur support au premier plan et les clamps de mesure électrique au second plan ... 30
9
Figure 12 : Origine des courants ioniques s'établissant de part et d'autre d'une
membrane épithéliale. ... 33 Figure 13 : a : Représentation schématique du cotransporteur Na+ /glucose. b :
L’ajout de la phloridzine côté muqueux, entraine une chute brutale de la réponse de l’Isc suite à l’augmentation de l’Isc induite par le glucose. La phloridzine est un inhibiteur du cotransporteur Na+glucose (Atisook et al., 1990; Garnett et al., 2012; Muscher-Banse et al., 2012) ... 52 Figure 14 : a : Représentation schématique de la régulation du canal chlorure apical
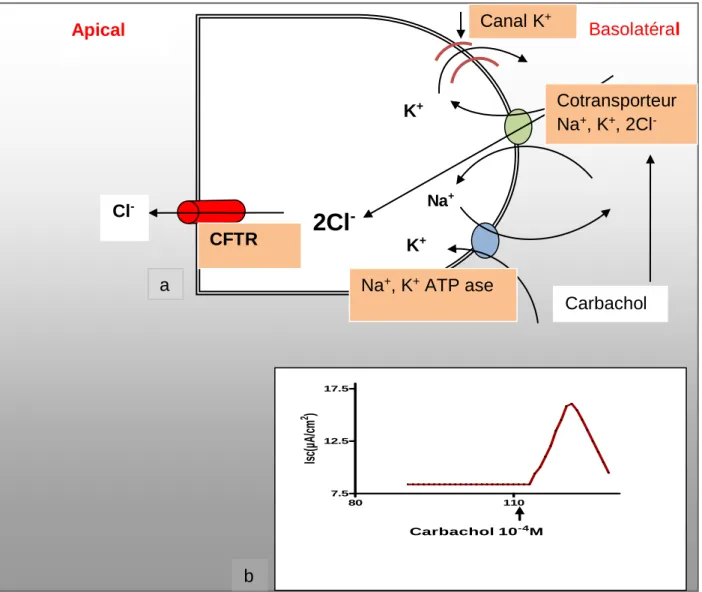
par les cotransporteurs Na+, K+,, 2Cl-. b : L’ajout du carbachol 10-‘4M côté
basolatéral de la membrane épithéliale entraîne une augmentation du courant de court-circuit. ... 55 Figure 15: Représentation schématique de la régulation du canal chlore par les
seconds messagers. b et c : La forskoline (FSK), côté basolatéral de la
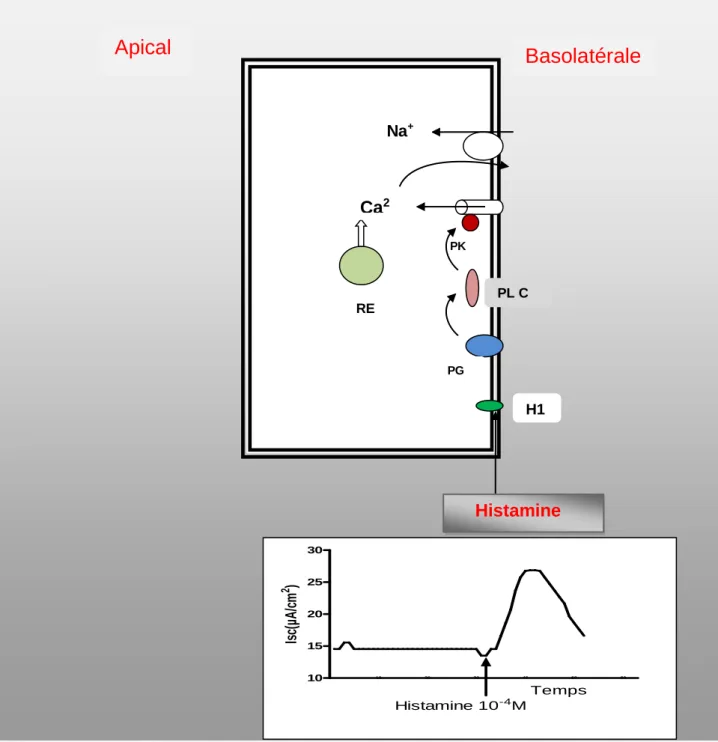
membrane épithéliale entraine une augmentation du courant de l’Isc qui atteint un état stationnaire. b : la bumétanide inhibe l’excrétion des ions chlorures via les seconds messagers. ... 56 Figure 16 : Représentation schématique de récepteur H1. b. réponse de l’Isc à l’ajout de l’histamine. ... 58 Figure 17 : : Représentation schématique de la pompe à proton H+ / K+-ATP ase.
Cette pompe qui assure la sécrétion acide de l’estomac est stimulée par la liaison de l’histamine aux récepteurs H2. b. Réponse de l’Isc à l’ajout de
l’histamine dans la chambre d’Ussing côté basolatéral ... 59 Figure 18 : Classement des techniques dans l’échelle de la phase de développement des médicaments en fonction de leur complexité selon J-F Desjeux. ... 63
10
Résumé
La connaissance des modalités d’absorption trans-épithéliale des molécules actives est un préalable indispensable à leur formulation rationnelle. Parmi les diverses méthodes in vitro disponibles, la technique de la chambre de perméation d’Ussing se distingue non seulement par une relative facilité de mise en œuvre, mais surtout la possibilité de déterminer de manière fiable les modalités de passage des molécules d'intérêt au travers de l'épithélium digestif (transport actif/passif, voies paracellulaire/transcellulaire, transports d’efflux, effets du métabolisme), ainsi que les caractéristiques électrophysiologiques et la viabilité du tissu.
Nous présentons tout d'abord les principes généraux de la technique, les paramètres électriques utilisés en vue de l’interprétation des données physiologiques. Enfin, nous proposons une méthodologie pour l'évaluation du passage transmembranaire des molécules actives.
La partie expérimentale du travail a eu pour objectif d'évaluer l'apport de cette approche du modèle lorsqu'il s'agit de mesurer l'impact des formulations des molécules d'intérêt (solutions, ou dispersions colloïdales) sur le flux d'absorption. Ainsi, dans un premier temps nous avons démontré pour deux molécules modèles, le paracétamol et la vitamine C, que la nature des solutions physiologiques mises en œuvre pouvait avoir un effet important sur le fonctionnement électrophysiologique de la membrane, en modifiant notamment sa conductance, son intégrité et par voie de conséquence modifiant profondément la perméabilité transépithéliale. Dans un second temps, dans le cadre de travaux menés en collaboration, nous avons utilisé le modèle d’Ussing pour caractériser l'absorption des molécules d'intérêt lorsque celles-ci sont préalablement associées à divers systèmes colloïdaux. D'une part, nous avons ainsi montré que l'association du resvératrol, une molécule très hydrophobe, à des microémulsions permettait d'augmenter d'un facteur x6 à x11 le passage du transresveratrol par rapport au resvératrol natif. D'autre part, nous avons également montré que l'association d'une héparine de bas poids moléculaire, très hydrophile et naturellement très peu absorbée, mais associée à des nanoparticules de squalène permettait d’augmenter considérablement le flux d'absorption. En conclusion, l'ensemble de nos travaux montre l'intérêt du modèle d’Ussing lorsqu'on souhaite détailler les mécanismes physico-chimiques et biologiques par lesquels les nanoparticules sont susceptibles d'améliorer le passage digestif de molécules naturellement mal absorbées.
Mots clés : Chambre de perméation d’Ussing, perméabilité, solution physiologique,
11
Introduction générale
12
Introduction générale
1. Introduction générale
Pour de multiples raisons, la voie orale est la voie de choix pour l'administration des molécules actives aux patients. Toutefois, pour de nombreuses molécules candidates à un développement pharmaceutique, il est parfois difficile de concevoir et de fabriquer des formulations efficaces, c'est à dire capables d'assurer une absorption intestinale suffisante et reproductible de la molécule considérée et donc de générer un profil pharmacocinétique satisfaisant. Cette situation amène fréquemment à devoir recourir à une voie d'administration alternative, souvent moins confortable et plus contraignante pour le patient.
Après l'administration d'une forme galénique par la voie orale, le passage des molécules actives depuis la lumière intestinale jusqu'à leur apparition dans la circulation sanguine générale est le résultat de multiples phénomènes. Au moment de son administration, la molécule active est associée à une forme galénique dont elle doit être "libérée". Dans le cas général des formes solides, cette libération consiste en la dissolution des particules solides qui les constituent dans les fluides digestifs. Elle est nécessaire pour que les mécanismes de passage (passifs et/ou actifs) vers la circulation systémique puissent se mettre en place. Ainsi, l'intensité et la vitesse avec lesquelles s’opère le passage de la muqueuse intestinale sont deux paramètres clés puisqu'ils déterminent la biodisponibilité de la molécule considérée. Au plan mécanistique, la biodisponibilité dépend donc simultanément des caractéristiques physico-chimiques de la molécule, des propriétés galéniques de la formulation qui la contient et enfin de la perméabilité effective de la membrane intestinale à la molécule considérée.
La détermination expérimentale de la perméabilité intestinale des principes actifs (PA) chez l'animal et/ou chez l’homme et des mécanismes mis en jeu représente donc un objectif majeur dès les premières phases du développement pharmaceutique, puisque ce paramètre orientera profondément le choix de la formulation galénique. La perméabilité intestinale peut être estimée par différentes méthodologies.
13
Introduction générale
De nombreux modèles d'études ont été proposés qui ont pour objectif commun de mesurer la perméabilité au travers de tissus biologiques. On citera tout d'abord les méthodes qui peuvent être menées in vivo directement chez l’homme ou l’animal, consistant : (i) à extraire du profil pharmacocinétique d'une molécule d'intérêt, le profil d'absorption, grâce aux méthodes classiques de balance de masse ou plus récemment aux méthodes non compartimentales de déconvolution, (ii) à isoler transitoirement un fragment intestinal de taille définie à partir duquel on effectue l'absorption systémique de la molécule d'intérêt. Il existe en effet plusieurs modèles mettant en œuvre des fragments de tissus intestinaux, parmi lesquels: (i) la méthode ex vivo dite de "l’intestin retourné", souvent conduite chez le rat et (ii) l'utilisation de chambres de diffusion telles que les chambres d’Ussing, mettant en œuvre in vitro des fragments de tissus intestinaux ou des monocouches cellulaires obtenues par la culture cellulaire de souches cellulaires d'origine humaine immortalisées et représentatives de l'épithélium digestif (Caco-2, HT29, etc.).
Dans notre travail, nous avons focalisé notre intérêt sur le modèle des chambres d’Ussing en raison des nombreux avantages qu'il présente. Ce modèle d'étude est particulièrement séduisant puisqu'il permet simultanément d’étudier et d’évaluer dans des conditions in vitro suffisamment réalistes, non seulement le passage des molécules au travers des tissus épithéliaux, mais aussi de suivre certaines fonctions physiologiques de la muqueuse, telles que sa capacité à réguler les flux d'ions au travers de la membrane. La possibilité de réaliser la mesure simultanée de deux paramètres distincts (les flux ioniques transmembranaires et le flux d'absorption d'une molécule d'intérêt) permet en premier lieu de contrôler la viabilité du tissu vivant pendant l'expérience, grâce au contrôle continu des paramètres électriques caractéristiques de la viabilité membranaire. En second lieu, elle contribue souvent à expliquer les modalités de passage transépithélial de la substance considérée.
L'objectif de ce travail a été d'évaluer la possibilité d'utiliser le modèle d’Ussing lorsque des formes galéniques liquides, solutions ou suspensions, contenant la molécule active sont placées dans la chambre donneuse du système expérimental. En effet, la
14
Introduction générale
composition de ces solutions ou de ces suspensions s’est parfois éloignée de celle des solutions utilisées dans les travaux expérimentaux visant à étudier la physiologie digestive. Ceci suppose donc de vérifier la robustesse du modèle d’Ussing dans des conditions s’éloignant légèrement des conditions physiologiques et donc des conditions d’Ussing.
Le présent mémoire comprend une première partie bibliographique dans laquelle nous décrirons les aspects fondamentaux de la technique, les paramètres physiques mesurés et les principales fonctions physiologiques mises en jeu dans les phénomènes de transferts ioniques et enfin leur application au suivi de la viabilité membranaire.
Dans la seconde partie du travail nous décrivons nos travaux expérimentaux. Ainsi, nous avons voulu préciser dans un premier temps l’influence de la composition de différents milieux liquides sur les flux d'absorption de deux molécules modèles subissant l'une un transfert actif et l'autre un transfert passif. En effet, ces milieux d'étude doivent fréquemment être adaptés à la nature physico-chimique de la molécule à étudier ou bien de la formulation pharmaceutique qui les contient, afin de rendre possible les études du passage épithélial. La résistance électrique du tissu et la réponse tissulaire à la forskoline, à l’acétylcholine, au carbachol, qui sont le reflet des mouvements ioniques transmembranaires, ont été déterminées en parallèle, l’objectif étant d’évaluer l’intégrité et la viabilité fonctionnelle du tissu dans le milieu étudié. Ainsi, dans ce premier travail, nous avons en particulier utilisé des milieux connus ou reconstitués et évalué les effets en ajoutant des cyclodextrines capables d’augmenter la solubilité apparente de certaines molécules peu solubles dans l’eau, protéines, ainsi que de la glutamine (acide aminé) reconnue pour sa capacité d’améliorer l’entretien de fonctions intestinales.
Dans un second temps, nous avons voulu vérifier la possibilité de mesurer le flux intestinal d'absorption de principes actifs modèles (solubles ou très peu solubles dans l'eau) à partir de suspensions nanoparticulaires ou lipidiques. En effet, dans la mesure où de nombreux principes actifs nécessitent une formulation adaptée du fait de leur
15
Introduction générale
très faible solubilité aqueuse, de leur instabilité ou d’autres facteurs, il serait très intéressant de pouvoir utiliser le modèle d’Ussing, non seulement pour mesurer les flux d'absorption qu'elles permettent de générer, mais aussi pour étudier l’impact de ces formulations sur le passage intestinal et la viabilité tissulaire. En effet, la nature des excipients utilisés, le contact direct des particules avec l'épithélium digestif qui conduit à la modification locale de gradients de concentration, sont autant de paramètres susceptibles de modifier la perméabilité membranaire et/ou le flux transmembranaire mesuré.
Enfin, une discussion générale des résultats obtenus et leur mise en perspective avec la littérature dans le domaine conclut le mémoire.
16
La chambre d’Ussing
2. Le modèle de la chambre
Le modèle de la chambre d'Ussing est largement utilisé afin d'étudier la physiologie de la muqueuse digestive car il permet d'obtenir, dans de bonnes conditions expérimentales, de nombreuses informations sur son fonctionnement. Toutefois, ce modèle est également largement utilisé dans le domaine pharmaceutique car il permet de déterminer assez aisément la perméabilité intestinale des molécules actives ainsi que de d'identifier ses différentes composantes telles que la nature du transfert (passif ou actif), la présence et l'intensité d'éventuels mécanismes d'efflux, l'incidence du métabolisme entérocytaire sur les flux d'absorption, notamment.(Brown et al., 2008; He et al., 2013; Li et al., 2004)
Il va sans dire que la maîtrise de la technique et du protocole expérimental sont les clés indispensables pour tirer profit avec efficacité de la technique de la chambre d’Ussing. Ainsi, dans cette revue, nous nous sommes attachés à décrire de manière détaillée le matériel utilisé et les protocoles expérimentaux pouvant être mis en œuvre. En effet, l’utilisation de ce dispositif expérimental nécessite un apprentissage rigoureux de la technique et une connaissance minimale de l'anatomie digestive et de la physiologie de l'épithélium intestinal, afin d'être en mesure de générer des résultats expérimentaux ayant une réelle signification.
2.1. Description technique de la chambre d’Ussing
La chambre d’Ussing est un dispositif de mesure qui permet simultanément de mesurer le passage transmembranaire d'une molécule d'intérêt et de déterminer les courants électriques qui parcourent la membrane biologique dans les conditions de l'étude. Le système de la chambre d’Ussing est composé de plusieurs éléments
fondamentaux : La chambre elle-même et le circuit électronique permettant de suivre en temps réel les paramètres électriques qui sont des indicateurs du flux ionique mais aussi de l’intégrité du tissu impliqué. Les chambres et le circuit électronique sont dissociables. Dans un premier temps, nous allons décrire l'organisation de la chambre et ses variations, puis les dispositifs électriques et électroniques permettant la mesure des grandeurs électriques physiologiques.
17
2.2. La chambre proprement dite
La chambre d’Ussing est composée de deux demi-chambres initialement construites en verre, mais fréquemment en plexiglas (polymethacrylate) à l'heure actuelle. Elles déterminent un compartiment donneur et un compartiment receveur.
Les demi-chambres sont ouvertes sur une de leurs faces. Ainsi, lorsqu'elles sont assemblées, l'ouverture est appliquée contre la surface exposée du tissu étudié. Cette disposition permet de définir un "compartiment (ou côté) muqueux" et un "compartiment (ou côté) séreux" ou bien encore un "compartiment (ou côté) apical" et un "compartiment (ou côté) basoatéral" selon les terminologies fréquemment rencontrées dans la littérature.
2.2.1. Les différents types de chambres
Du concept initial de chambre conçu par Hans Ussing dans les années 1950 (figure 1) offrant un volume des demi chambres et une surface d’échange assez importants, les techniques ont progressivement évoluées avec l'apparition de chambres offrant des géométries variées, des volumes réduits telles que les micro chambres qui ne nécessitent que de petites surfaces tissulaires (cas des tissus issus de biopsies), alors que les chambres initiales nécessitaient la mise en œuvre d'une surface tissulaire assez importante, de l'ordre du cm2.
Figure 1 : Dispositif expérimental original ainsi qu'il fut conçu par H. Ussing en 1951
18
2.2.1.1. Les chambres verticales
Les chambres verticales sont les plus utilisées et sont idéales pour l’étude du passage intestinal des molécules en solution. Elles se caractérisent par une surface de membrane exposée allant de 0,15 cm2 à 1 cm2 (figure 2). Elles sont très utilisées pour
l'étude du passage au travers des tissus intestinaux d'origine animale (souris, rat, autres espèces) et également de monocouches de cellules cultivées sur support poreux (Collington et al., 1998)
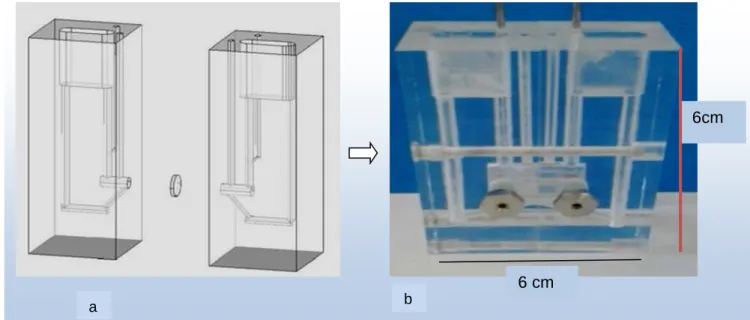
Figure 2: Exemple de chambre d’Ussing verticale. a : Schéma montrant l'organisation des deux demi chambres et b : Photo de la chambre d’Ussing assemblée et réalisée en plexiglas (Document Biomécatronics).
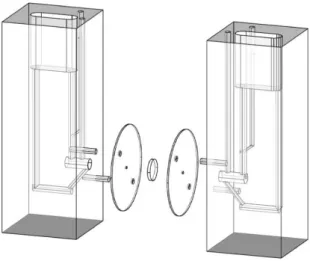
Des supports amovibles (inserts) sont prévus et adaptables à la surface interne des chambres pour permettre l'utilisation de fragments de tissus de surface réduite (quelque mm2) dans le cas où il est difficile de se procurer de grandes surfaces, ce qui
est le cas des tissus issus de biopsies (humaines par exemple) ou lorsque l’épithélium est de petite taille (cornée chez le rongeur) ou difficile à prélever (cas de la trachée chez le rongeur) (Figure 3).
6 cm
6cm
b a
19
Figure 3 : Exemple de chambre de perméation d’Ussing présentant un dispositif d’insert visant à réduire la surface d'étude (Document Biomécatronics).
Les inserts sont des disques amovibles en matière plastique et de surface variables (0,8 mm2 de diamètre à 3,0 mm2) qui peuvent être directement placés entre les deux
demi chambres et servir de support à des fragments tissulaires de petites surfaces (biopsies, trachées…) (Figure 4).
Figure 4 : Disques amovibles servant d’inserts pour la mise en place de fragments tissulaires présentant de petites surfaces utiles. (Document Biomécatronics).
Zayas-Santiago et al.(Zayas-Santiago et al., 2011) ont évalué la possibilité technique d'utiliser des inserts de diamètre inférieur à 2mm2 (1,8mm2) pour mener des études de
passage transmembranaire. Ces auteurs ont ainsi évalué la perméabilité d’un mélange de plusieurs protéines à travers la membrane de Bruch (située entre la rétine et la choroïde) prélevée chez le porc. Les auteurs ont conclu à la fiabilité du dispositif
20
tant au niveau de la mesure de la diffusion qu’au niveau du contrôle de l’intégrité tissulaire.
Ces dispositifs permettant de réduire la surface d'échange disponible sont particulièrement utiles lorsqu'il s'agit de travailler sur des tissus issus de biopsies humaines ou animales (Lee H et al., 2013; Tran et al., 2013; Wallon et al., 2005). On citera les exemples suivants qui illustrent les différentes possibilités de la technique. Ainsi, Wallon et al.(Wallon et al., 2005) ont utilisé des biopsies du côlon humain montées sur un disque de 1,76mm2 en chambre d’Ussing pour évaluer la capacité d’absorption des protéines antigéniques. De la même façon, en utilisant des biopsies de la muqueuse du côlon, Lee et al. (Lee H et al., 2013)ont montré une corrélation entre l’augmentation de la perméabilité et le rôle des mastocytes de la muqueuse des personnes atteintes du syndrome de côlon irritable. (Tran et al., 2013)ont utilisé des biopsies intestinales des babouins afin d'étudier le degré d'intégrité de la muqueuse digestive au cours du vieillissement. Les auteurs ont ainsi suggéré qu'une perméabilité accrue de la membrane était associée aux troubles gastrointestinaux chez les patients vieillissants et qu'elle était due à une rupture de l'intégrité de la barrière intestinale impliquant les protéines des jonctions serrées.
Il faut enfin signaler que la miniaturisation des chambres d’Ussing a permis de réduire le volume des chambres et donc de diminuer les quantités de substances mise en jeu. Toutefois, la sensibilité de la méthode de dosage utilisée pour la quantification des substances étudiées au cours des expériences de perméation représente fréquemment une limite à la miniaturisation.
2.2.1.2. Les chambres horizontales ou "dual chambers"
Lorsque les études d'absorption sont réalisées à partir de formulations semi-solides (hydrogels, émulsions, dispositifs transdermiques, etc.) et non pas liquides, il est possible d'utiliser des chambres horizontales (Bouritius et al., 1998) adaptées pour l'étude de l’absorption cutanée ou d'autres tissus épithéliaux (muqueuse nasale ou vaginale par exemple) (figure 5), en particulier lorsque l'objectif est de déposer des formulations semi-solides et susceptibles de couler à la surface de la muqueuse.
21
Figure 5 : Exemple de disposition horizontale d'une chambre d'Ussing. a : Eclaté montrant l'organisation de la chambre horizontale en deux demi chambres et b : Exemple de chambre horizontale réalisée en plexiglas. (Document Biomécatronics).
Östh Karin et al.(Osth et al., 2002a; Osth et al., 2002b) ont utilisé des chambres d’Ussing horizontales pour l’étude de transport du mannitol et de la testostérone au travers de la muqueuse respiratoire nasale du porc. Ces molécules étaient incorporées dans des hydrogels. Plusieurs configurations de mesure ont été évaluées : muqueuse gel air ; muqueuse gel liquide et muqueuse liquide air. Ces auteurs ont montré qu’il n'y avait aucune différence significative entre ces différentes configurations que ce soit dans les valeurs de perméabilité mesurées ou dans les paramètres électriques associés (la résistance (R), la différence de potentiel (ddp), et le courant de court-circuit (Isc). De plus, l'étude histologique a démontré que la couche de cellules épithéliales tolérait l'exposition de l'interface à la formulation et/ou à l'air. Ainsi, cette étude a montré la fiabilité et la robustesse de la technique lorsqu'elle est adaptée à l'étude du passage transmembranaire à partir de formulations semi solides complexes.
Une autre étude du même auteur utilisant également des hydrogels constitués d'acide poly(acrylique) (Carbopol 934P C934), contenant du dihydroalprénolol (DHA associé à des micelles), de l'hydrocortisone (HC) ou de la testostérone (TS) a visé l'étude du passage de la muqueuse nasale par ces molécules au moyen de ces chambres d’Ussing horizontales.
22
Une comparaison des hydrogels et des solutions de ces molécules et des excipients non modifiés a été réalisée en parallèle afin de mettre en évidence un possible effet de la formulation sur le passage. La viabilité et la toxicité ont été évaluées par des mesures électrophysiologiques et par microscopie optique. Les résultats expérimentaux ont montré que l'acide poly(acrylique) C934 n'a pas affecté la viabilité de la muqueuse et que la vitesse et le profil des flux de perméation dans le sens muqueux-séreux était inchangés, que les substances aient été libérées à partir d'un hydrogel ou d'une solution contenant ces molécules. Les auteurs ont ainsi confirmé que la disposition horizontale de la chambre d’Ussing était appropriée pour l'évaluation des gels destinés à l'administration nasale.
2.2.1.3. Les chambres spécifiquement adaptées aux monocouches cellulaires obtenues par culture.
Les monocouches de cellules polarisées cultivées dans des inserts sur un support poreux sont souvent utilisées dans les étapes précoces de développement des médicaments comme substituts des tissus animaux ou humains. Le support de culture peut être découpé et placé entre les demi-chambres ou simplement monté sur un disque amovible inséré dans la chambre de perméation d’Ussing. Des chambres spécifiquement adaptées de manière à accueillir directement les inserts de culture (Figure 6). La figure 7 présente un exemple d'inserts fréquemment utilisés.
Figure 6 : Eclaté montrant l'organisation de la chambre d’Ussing perforée et destinée à recevoir des inserts supportant les monocouches cellulaires obtenus par culture (Document Biomécatronics).
23
Figure 7 : Insert de type Transwell® avec support poreux (cutoff de 0,4µm) pour la culture de monocouches cellulaires
.
Les techniques de culture cellulaire permettent de reconstituer facilement des monocouches de cellules qui reproduisent dans une certaine mesure les épithéliums. Ces monocouches sont couramment utilisées pour évaluer les transports des électrolytes et des molécules actives. Les lignées cellulaires utilisées sont très fréquemment les cellules Caco-2, les cellules HT-29 lorsqu'on souhaite décrire l'épithélium digestif ou bien les cellules MDCK afin d'étudier notamment les phénomènes de sécrétion au niveau de l'épithélium tubulaire rénal.
L’utilisation des monocouches des cellules polarisées en chambre de perméation d’Ussing a fréquemment pour objectif d'étudier l'effet pharmacodynamique de molécules. Néanmoins, la littérature comporte également de nombreuses études de passage transmembranaire de molécules actives au moyen de cette technique, notamment dans le domaine de l'absorption intestinale. Cette technique est ainsi très fréquemment employée par l'industrie pharmaceutique dans les phases de développement préclinique. Dans la mesure où il est impossible de donner ici une revue exhaustive de ces travaux, le lecteur est renvoyé à la lecture de revues spécifiques sur le sujet (Artursson et al., 2001). Seuls quelques exemples de mise en œuvre de la technique sont développés ci-dessous.
Le passage d'une substance antibiotique, le ceftibutène, au travers de monocouches de cellules Caco-2 a été évaluée en chambre d’Ussing et les flux de passage mesurés ont été comparés à ceux obtenus au travers du jéjunum de rat. Les auteurs ont montré
24
que l’absorption du ceftibutène résultait à la fois de phénomènes de transferts passifs et actifs à travers la monocouche de cellules Caco-2 alors qu’elle était uniquement paracellulaire à travers le jéjunum de rat (Menon et al., 2003), montrant ainsi la limite de ces modèles.
Sakloetsakun et al. (Sakloetsakun et al., 2011) ont évalué l’influence d’une série de 6 chitosanes thiolés parmi lesquelles le N-acétylcystéine-chitosan sur la perméabilité membranaire et leur capacité inhibitrice de la P-gp en utilisant le modèle des monocouches de cellules Caco-2. La mesure des flux de rhodamine 123 et de FITC-dextran 4, utilisés respectivement comme substrat de la P-gp et comme marqueur du passage paracellulaire, ont permis de mettre en évidence la concomitance de plusieurs phénomènes, qui concourent à créer le flux apparent d'absorption. Ces auteurs ont ainsi démontré les capacités inhibitrices des chitosanes thiolés sur la P-gp et leurs facultés d’améliorer la perméabilité notamment en ce qui concerne le N-acétylcystéine-chitosane.
Cette technique est fréquemment utilisée afin de mieux connaître les mécanismes de perméation qui régissent le flux d'absorption apparent et si possible d'établir des corrélations avec d'autres séries de résultats expérimentaux. Par exemple, Yamashita et al. (Yamashita et al., 1997)ont utilisé la chambre d’Ussing pour comparer l’absorption de séries de molécules lipophiles au travers de monocouches de cellules Caco-2, le jéjunum de rat et les fractions absorbées chez l'homme et calculés à partir des profils pharmacocinétiques.
Un autre intérêt du dispositif est de permettre la recherche fine des mécanismes concourant à l'absorption en situation pathologique, comme l'illustre le travail suivant. L’amoxicilline et la clarithromycine sont deux antibiotiques utilisés dans le traitement d’Helicobacter pylori mais dont les mécanismes d’absorption digestive sont mal connus. Ces substances ont fait l’objet d’une étude de passage au travers de monocouches de cellules HT-29 en chambre d’Ussing afin d'évaluer l'incidence de l'infection de l'épithélium sur le passage (Matysiak-Budnik et al., 2002).
Enfin, différents travaux utilisent la technique de Ussing afin de mesurer l'impact de substances co-administrées avec la molécule d'intérêt, dans l'objectif d'en augmenter le flux d'absorption. Ainsi, Martin et al. (Martin J et al., 2009) ont proposé et évalué un peptide synthétique susceptible de moduler le fonctionnement épithélial dans le but
25
d’augmenter la perméation des molécules actives. Des monocouches de cellules de la cornée ont été utilisées dans cet objectif et les travaux ont montré que le passage transmembranaire du FITC-dextran, de la fluorescéine sodique, de la carboxyfluorescéine et du méthotrexate ont été accru en présence de ce peptide. De plus, l’analyse des paramètres électriques a montré une augmentation de l’Isc et de la conductance Gt en présence du peptide synthétique.
26
3. les dispositifs techniques de la chambre d’Ussing
Les dispositifs d’Ussing permettent de mesurer les courants transmembranaires qui s’établissent au travers du tissu biologique étudié. Dans un premier temps, nous allons étudié le montage utilisé et dans un second temps l’origine des courants électriques mesurés.
3.1. Le circuit électrique
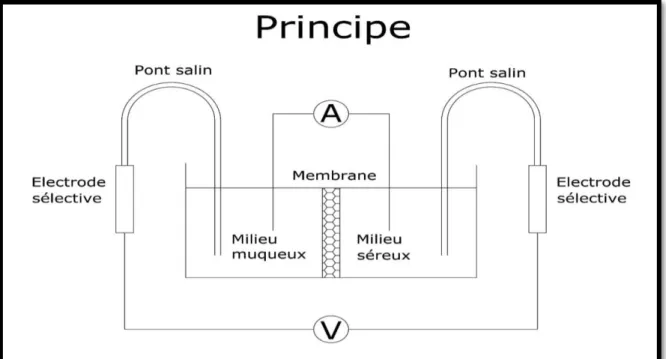
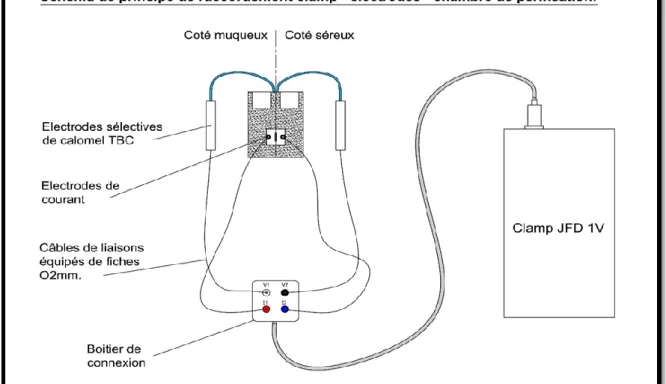
La réalisation de mesures électrophysiologiques et /ou d’étude de perméation en parallèle nécessite la mise en place d'un circuit électrique dans lequel la muqueuse représente un élément résistant du circuit et dont on cherche à mesurer en continu les caractéristiques électriques (Fig. 8). Ainsi, les deux compartiments de la chambre d’Ussing présentent des électrodes immergées dans le liquide et qui permettent de mesurer en permanence les paramètres électriques du tissu. La différence de potentiel (d.d.p), le courant de court-circuit (Isc) et la résistance transépithéliale (R) ou son inverse la conductance (G) sont mesurés grâce à des multimètres appelés clamps électroniques.
Deux types d'électrodes sont mis en place dans chacune des deux demi-chambres. Il s'agit d'électrodes au calomel saturées en KCl sélectives des ions chlorures et d’électrodes de courant. Ces électrodes de courant sont reliées électriquement à un clamp électronique de mesure. La figure 10 montre l'organisation générale des circuits électriques.
27
Figure 8: Organisation générale des différentes électrodes (électrodes de courant et électrodes sélectives au calomel) dans les deux demi chambres d’Ussing et leurs raccordements au clamp électronique (Document Biomécatronics)
3.1.1. Les électrodes sélectives de calomel au KCl saturé
Les électrodes sélectives au calomel saturées en KCl sont classiquement constituées d’une électrode de mercure en contact avec du chlorure mercureux (Ag2/Cl2 ou Calomel) et baignant dans du KCl saturé.
Figure 9 : Electrodes sélectives de calomel au KCl saturé
Les électrodes de calomel relient les deux demi-chambres par des ponts d’agar conducteurs du courant et permettent la mesure de différence de potentiel membranaire (ddp membranaire).
28
3.1.2. Les électrodes de courant
Les électrodes de courant sont insérées en face externe des demi-chambres. Elles relient les chambres au clamp électronique (appareil de voltage-clamp) par l’intermédiaire d'un boitier de connexion (Fig. 10 et 11)
En condition expérimentale, les deux électrodes sont au contact du tissu épithélial intercalé entre les deux demi-chambres. On peut alors mesurer les caractéristiques électriques de la membrane et en particulier le courant électrique qui s'établit de part et d’autre de la membrane appelé courant de court-circuit (ou intensité de court-circuit noté Icc ou Isc de, short circuit-current) et qui tire son origine des déplacements ioniques membranaires.
3.1.3. Les ponts d’agar
Des ponts d’agar sont utilisés pour former des ponts électrolytiques qui relient l’intérieur de chacune des demi-chambres aux électrodes sélectives au calomel. Ils sont en contact avec les deux faces de tissu épithélial. En condition expérimentale, ils permettent la mesure de la différence de potentiel membranaire, la résistance membranaire et le courant ionique membranaire, ces trois grandeurs étant liées entre elles par la loi d’Ohm
(U = RI).
Au plan pratique ces ponts sont constitués par un hydrogel préparé à base d'un hydrocolloïde, l'Agar agar, auquel on ajoute des électrolytes afin de rendre le milieu conducteur du courant électrique. Cet hydrogel est coulé dans la lumière de fins tubes en matière plastique, suffisamment souples pour être aisément mis en place entre les demi-chambres.
29
3.2. Principe de montage
La préparation biologique (tissu épithélial, monocouche de cellules épithéliales…) est montée entre deux demi-chambres en plexiglas déterminant un compartiment muqueux et un compartiment séreux. Les deux demi -chambres sont maintenues par des vis.
En condition expérimentale, les deux compartiments contiennent un liquide physiologique constamment oxygéné par un bullage permanent de carbogène, mélange gazeux composé d’oxygène et de dioxyde de carbone dans les proportions 95 : 5 (O2/CO2). Le bullage assure également le brassage mécanique permanent du
milieu d’incubation dans les deux compartiments.
Les volumes du liquide physiologique dans les deux compartiments sont égaux car il est important de supprimer ou au moins de minimiser les flux d'eau non contrôlés au travers de la muqueuse. De la sorte, il est possible de diminuer l'effet d'éventuelles différences de pression hydrostatique de part et d'autre de la membrane et de surcroît de prévenir la survenue d'éventuels dommages importants aux tissus.
La chambre est thermostatée (posée par exemple sur un support chauffant régulé) afin d'assurer le maintien en température du milieu, et offrant ainsi des conditions physiologiques optimales en termes de température. Au contraire, il est possible de travailler à +4°C, de manière à bloquer d'éventuels mécanismes de transfert actif et/ou le métabolisme.
Deux ponts en gel d’agar en contact avec les deux faces du tissu épithélial relient l’intérieur des chambres aux électrodes de calomels saturée en KCl permettent la mesure de différence de potentiel (ddp).
Les deux électrodes de courant situées en face des chambres et en contact avec les deux faces du tissu épithélial assurent le courant transépithélial (Isc).
Les quatre électrodes (électrodes de courant et électrodes sélective de calomel) sont reliées à un appareil de voltage-clamps par des câbles de connexions. (Figure 10 et 11)
30
Figure 10: Organisation générale des différentes électrodes (électrodes de courant et électrodes sélectives au calomel) dans les deux demi chambres d’Ussing et leurs raccordements au clamp électronique (Document Biomécatronics)
Figure 11 : Dispositif expérimental rassemblant quatre chambres de perméation d’Ussing montrant les chambres sur support au premier plan et les clamps de mesure électrique au second plan
31
3.3. Origine des courants mesurés en Ussing
Après installation du système, un temps de stabilisation variable selon le tissu est nécessaire pour que le flux ionique devienne constant (30 min environ). Un courant s'établit alors entre la face apicale et la face basolatérale. Ce courant, dénommé
courant de court-circuit (Isc) ou encore nommé courant de base représente la
somme des flux ioniques nets qui traversent la membrane. Ce sont principalement, les flux nets de sodium, de chlorure et de bicarbonate.
3.3.1. Principe de la mesure du courant au moyen du clamp électronique
Le système décrit permet de mesurer d’une manière continue les courants transépithéliaux lorsqu’on impose un potentiel transmembranaire bien déterminé, égal ou diffèrent de zéro. Le fait que la résistivité du tissu soit du même ordre de grandeur que celle de la solution physiologique qui le contient oblige l’expérimentateur à supprimer (compenser) la résistance R de la solution entre la paire d'électrodes de mesures (électrodes sélectives au calomel et électrodes de courant). L’utilisation d’un amplificateur opérationnel et d'un circuit de retour spécial (feed-back) permet d’entraîner la somme totale des dérivations vers une terre virtuelle. Cette disposition des circuits permet au système de répondre à l’équation :
VT – Vf - Vm = 0 (équation 2)
où VT représente la différence de potentiel transmembranaire mesurée entre la paire d’électrodes réversible et Vf le potentiel mesuré de la solution physiologique (fluide) dû au passage du courant transmembranaire (IT). La suppression de Vf permet de mesurer Vm qui est par conséquent la vraie différence de potentiel transmembranaire.
32
3.3.2. Approche physiologique et technique du problème
En réalité, la résistance du tissu est très faible et voisine de celle du liquide physiologique utilisé. D’où la nécessité à chaque fois de supprimer la résistance du fluide (compensation du fluide) au cours des expérimentations afin que la différence VT – Vf - Vm soit égale à zéro.
Dans les conditions de court-circuit, Vm = 0, ce qui conduit à la relation VT = Vf. En somme, lorsque l’équation est respectée, le courant qui correspond au flux du transport actif des ions est le courant de court-circuit (Isc). Le courant qui résulte des trois potentiels différents VT, Vf et Vm est additionné comme la somme des dérivations et relié à un amplificateur opérationnel à gain élevé puis utilisé à la sortie pour développer un courant de court-circuit. Durant le temps de l’initialisation, l’amplificateur opère proportionnellement au self contrôle. Pour avoir une erreur voisine de zéro et une fréquence voisine de zéro, l’amplificateur opère comme un intégrateur à une constance de temps de 30 millisecondes ou moins. Ces conditions assurer la stabilité, un faible bruit de fond faible et une erreur minimale.
Pour obtenir Vf on admet que la résistance de la solution physiologique utilisée, le tissu actif et inactif entre les deux électrodes sont constants à la fréquence et au courant utilisés. La ddp supprimée à travers cette partie du système est égale au produit de la résistance et du courant Ce qui n’est autre que la transposition de la loi d’Ohm à un gradient électrochimique.
U = R. I (équation 3) Où :
U = différence de potentiel (ddp) en millivolts (mV) R = résistance du tissu (Ohm/cm²)
33
3.3.2.1. La différence de potentiel membranaire
La différence de potentiel membranaire est due à l'existence d'une différence du nombre de charges électriques présentes à un instant donné de part et d’autre de la membrane étudiée. Ces charges électriques sont portées par les ions provenant des électrolytes qui baignent la membrane. La nature de la membrane impose une répartition inégale des ions de part et d'autre de cette membrane ce qui crée une différence de potentiel (ddp), appelée le potentiel membranaire ou tissulaire s'il s'agit d'un tissu biologique tel qu'un épithélium polarisé.
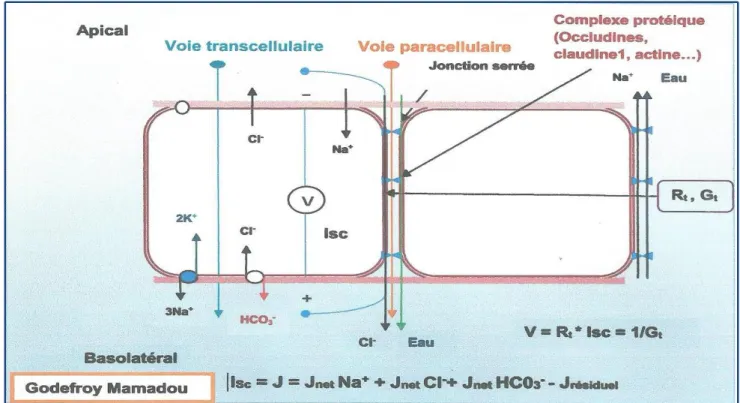
3.3.2.2. Le courant ionique
Le courant ionique tire son origine de la polarisation apicale-basolatérale des entérocytes et de l'existence de jonctions serrées qui lient les cellules épithéliales entre elles. A l’état physiologique, ce courant est un courant ionique dû à l'existence d'un flux ionique au travers de l’épithélium. Ainsi, on observe que les cellules constitutives de la membrane sécrètent des ions Cl- et HCO
3- vers la phase apicale tandis que se
produit simultanément une absorption d'ions Na+ par ces mêmes cellules depuis le
milieu apical (figure 12).
Figure 12 : Origine des courants ioniques s'établissant de part et d'autre d'une membrane épithéliale.
34
Pour cette raison, la face muqueuse d'un épithélium est donc chargée négativement par rapport à la face séreuse. Dans les conditions expérimentales, le système de voltage-clamp génère constamment un courant de court-circuit (Isc) qui annule la différence de potentiel qui existe de part et d'autre du tissu. Le courant de court-circuit mesuré, Isc, suit donc la variation de la ddp et représente les flux net ioniques à travers le tissu (Matysiak-Budnik et al., 2004) comme le montre l'équation suivante:
Isc = J = Jnet Na+ + Jnet Cl-+ Jnet HC03- - Jrésiduel (équation 4)
Une augmentation de la valeur du courant de court-circuit traduit une absorption de cation(s) et/ou une sécrétion d’anion(s) par les cellules épithéliales (par exemple entérocytes dans le cas de l’intestin). Ainsi, un changement de cet Isc indique une variation du flux des électrolytes au travers de la membrane. Ceci permet donc d'étudier finement le ou les mécanismes cellulaires qui en sont la cause.
La compréhension des mécanismes d’absorption du glucose via le cotransporteur Na+/glucose (voir plus loin la figure 13 et 14) et la sécrétion des ions chlorures
(voir plus loin la figure 15) sont deux exemples très connus qui illustrent clairement l'intérêt de la mesure du courant de court-circuit.
3.3.2.3. La résistance et la conductance transépithéliales
Les tissus épithéliaux se distinguent des autres tissus par la polarisation des cellules qui les constituent. Cette asymétrie est due à une différence de répartition des protéines à la face apicale et basolatérale des cellules qui constituent la membrane et par le fait que les cellules sont fortement liées entre elles par l'existence de jonctions serrées intercellulaires qui assurent une grande étanchéité du tissu.
Les jonctions serrées ou zonula occludens ("tight junctions") scellent les cellules épithéliales et endothéliales entre elles grâce à la présence de plusieurs protéines Elles jouent un rôle très important dans la régulation de la perméabilité membranaire. Toutefois, l'étanchéité n'est pas totale et certaines molécules peuvent emprunter l'espace intercellulaire qui existe entre deux cellules contiguës afin de passer d'un côté ou de l'autre de la membrane. Cette voie de passage constitue la voie paracellulaire. Les jonctions serrées régulent de manière sélective le passage paracellulaire des molécules extracellulaires.
35
En situation physiologique, le passage des molécules par la voie paracellulaire est limité par la masse moléculaire et par le degré de lipophilie de la molécule, mais en situation pathologique, l’ouverture des espaces intercellulaires, due à un affaiblissement des jonctions serrées peut permettre le passage de molécules de masse molaire élevée (40 kDa), voire la translocation bactérienne.
Plusieurs études ont cherché à préciser les bases moléculaires de l'augmentation de la perméabilité épithéliale dans des situations pathologiques par exemple ou bien en présences de certaines molécules exogènes et ont permis de montrer que l'affaiblissement et la fragilisation des jonctions serrées étaient en cause (Nusrat et
al., 2001; Otte et al., 2004; Resta-Lenert et al., 2003; Resta-Lenert et al., 2006). Cette
diminution de l’étanchéité membranaire, et donc de la résistance membranaire, peut être directement mesurée en chambre d’Ussing.
En mesurant le courant ionique en fonction du temps, Isc(t), et la différence de potentiel (ddp), on détermine la résistance R (t) ou la conductance G(t) en fonction du temps. La loi d’Ohm indique que la résistance R peut s’écrire :
R = U/I (équation 5)
La conductance (G) étant la réciproque de la résistance, il vient :
U = R x I = (1/G) x I (equation 6)
d'où après réarrangement, la conductance G peut être exprimée par :
G = I / U (équation 7)
La conductance électrique G mesure la facilité avec laquelle un courant se déplace entre deux points. Elle est fréquemment exprimée en millisiemens par unité de surface tissulaire exposée (mS/cm²).
Dans la pratique, et en condition expérimentale d’Ussing, la conductance (G) est mesurée par le rapport du courant de court-circuit (Isc) et de la différence de potentiel expérimentale (ddp).
36
G= Isc / ddp (équation 8)
Du point de vue ionique, il est admis que la conductance caractérise la facilité avec laquelle les ions traversent la membrane biologique, notamment via le port aqueux de la protéine canal. Ainsi, (Madara et al., 1985) ont montré dès 1985 que la résistance électrique semblait dépendre de l'intégrité des protéines transmembranaires impliquées dans les jonctions serrées. Ainsi, la variation de la conductance est généralement attribuée à des changements dans la voie paracellulaire et représente un bon indicateur du passage passif des électrolytes au travers de l’épithélium. En conclusion, la ddp et l’Isc sont les deux paramètres électriques qui représentent plus particulièrement le transport transcellulaire, tandis que la variation de la conductance correspond plutôt à des modifications de la voie paracellulaire et à l'établissement de transports d’électrolytes via les jonctions serrées (Griesmard, 1994).
La conductance membranaire (G), ou sa réciproque (R), est une grandeur qui caractérise la perméabilité hydroélectrique du tissu et donc son intégrité physique. A ce titre, il constitue un bon indicateur, déterminable en temps réel, de l’intégrité des tissus et peut aussi être utile pour distinguer le mécanisme d’action et les effets non spécifiques directs des molécules sur les tissus étudiés, par exemple les effets des réactifs utilisés dans les études de passage de molécules d'intérêt (Caraballo et al., 2011; Clarke, 2009).
3.3.3. Intérêts et applications de la mesure des paramètres électrique Isc, ddp, Gt ou Rt
La mesure et la connaissance des paramètres électriques qui prévalent dans les chambres de perméation d’Ussing sont très utiles à la compréhension et l’interprétation des phénomènes physiologiques induits par la mise en contact de certains composés exogènes avec l’épithélium, en termes de perméabilité et de toxicité.
Ainsi, elle permet de mesurer différents paramètres électriques (Isc, ddp) caractéristiques de la membrane étudiée et comme nous l’avons souligné précédemment la détermination de la conductance ou de la résistance membranaire , ce qui apporte des informations d'une part sur l'état physiologique de la membrane
37
et d'autre part sur les mécanismes de passages de molécules actives (Moazed et al., 2007) et également l'impact de ces molécules sur l'intégrité membranaire.
En effet, les tissus biologiques tels que l’intestin monté en chambre d’Ussing sont placés directement au contact avec les molécules d’intérêts ajoutées directement dans les chambres. Certaines de ces substances peuvent être préjudiciables à l’intestin, ce qui induit une augmentation de la sécrétion des électrolytes et traduit une diminution de la fonction barrière de l'épithélium (Boudry, 2005).
Ainsi, Navarro - Garcia et al. (Navarro-Garcia et al., 1998) ont mis à profit les chambres d’Ussing pour identifier le rôle d'une protéine toxique produite par Escherichia Coli parmi deux protéines issues de la même souche bactérienne grâce à l'évaluation des paramètres électriques (Isc, ddp et Rt). Leurs travaux ont montré une importante
augmentation de ddp et de l’Isc ainsi qu’une diminution de moitié des valeurs de la résistance épithéliale, témoin de l’intégrité tissulaire, en présence de cette protéine. L’étude histologique a permis de constater une nécrose importante avec exfoliation des cellules épithéliales et une forte accumulation de mucus. Ces observations semblent expliquer la diminution de la résistance transépithéliale. Egalement, l’auteur suggère que l’augmentation de l’Isc et la ddp pourrait avoir pour cause la formation de précipité d’ammonium dans le surnageant de culture bactérienne placé dans les chambres d’Ussing.
Awad et al. (Awad et al., 2014) ont montré que le jéjunum de poulet monté en chambre d’Ussing et placé en présence d'une souche aviaire pathogène d’E. coli, subissait une diminution de l’Isc, de ddp et de la conductance (G). Cette diminution de G traduit donc une augmentation de la résistance transépithéliale et suggère à l’auteur un resserrement des jonctions serrées, expliquant probablement l’absence de la diarrhée sécrétoire manifeste observées chez les poulets infectés, cause de la diminution de l’Isc et de ddp.
Rosenthal et al. (Rosenthal et al., 2012) ont étudié l’effet du chitosan sur les mécanismes transcellulaires et paracellulaires en utilisant des monocouches obtenues par coculture des lignées cellulaires colorectales HT-29/B6 en chambre de perméation d’Ussing. Ils ont montré que, la diminution de la résistance transépithéliale (Rt)
38
dépendait du pH en raison de l’activation de l'’échangeur d’anion HCOO3- /Cl-,
entraînant une augmentation de la perméabilité paracellulaire du dextran. Ce résultat semble confirmer l’action de certaine molécule dans l’ouverture des jonctions serrées autorisant ainsi le passage paracellulaire passif de certaines molécules (Deli, 2009). Ainsi en utilisant le même modèle de monocouches cellulaires, Dittmann et al.(Dittmann et al., 2014) ont montré une relation entre l’augmentation de la perméabilité à la fluorescéine (marqueur du passage paracellulaire) et la diminution de la résistance transépithéliale. Les auteurs ont pu montrer que l'ajout de laurate de sodium exerçait une action directe sur les jonctions serrées et permettait un passage important de certaines molécules de petite taille.
De même, Brucker et al. (Bucker et al., 2009) sur un modèle similaire, ont montré que l’augmentation de la perméabilité au FITC-dextran était due à la fragilisation de la monocouche épithéliale HT-29 par l'entérobactérie Arcobacter Butzleri. Cette fragilisation entrainant une diminution de la résistance transépithéliale est corrélée à la diminution des protéines des jonctions serrées telles que les claudines et les occludines. En effet, il à été montré que des toxines (Zonula occludens toxin ou "Zot")
produites par certaines bactéries ont une action sur les jonctions serrées (Fasano et al., 1995) entraînant une augmentation du passage paracellulaire de
certaines molécules (Karyekar et al., 2003)
Dans un exemple illustrant bien l'intérêt de ces mesures électriques, Navabi et al. (Navabi et al., 2013) ont cultivé plusieurs lignées intestinales humaines (Caco-2, HT29, T84…) et gastrique (MKN, AGS…) dans des inserts sur support poreux de type Transwell® (voir la figure.9). Le but de leur travail était de sélectionner des lignées
cellulaires polarisées, présentant des jonctions serrées fonctionnelles et également capables de produire du mucus. Les auteurs ont utilisé une combinaison des différents paramètres électriques mesurés au moyen de la chambre d’Ussing pour évaluer ces monocouches cellulaires. La résistance transépithéliale a été utilisée pour évaluer la fonctionnalité des jonctions serrées, tandis que la ddp et l’Isc l'ont été pour évaluer l’intégrité fonctionnelle de la membrane, et enfin par la technique consistant à ouvrir les canaux ioniques et mesurer la réponse de l’Isc induite, lorsqu'un stimulus extérieur est utilisé.
39
Ces différents exemples montrent l'apport de la mesure des paramètres électriques et leur intérêt non seulement dans l’interprétation des valeurs de la perméabilité transépithéliale mais aussi dans la détermination de possibles effets toxiques de certains composés sur la membrane épithéliale. De plus, d’un point de vue expérimental et pratique, la mesure systématique de la conductance individuellement pour chaque chambre permet de détecter d’éventuels problèmes techniques (chambre mal montée, pont d’agar mal placé, tissu lésé, etc.)
40
4. Applications de la chambre d’Ussing à la mesure du passage des
molécules xénobiotiques au travers de la membrane digestive
L’une des applications les plus importantes de la chambre de perméation d’Ussing concerne la détermination de la fonction barrière de la membrane digestive vis à vis des molécules xénobiotiques et tout particulièrement les molécules pharmacologiquement actives et/ou toxiques. La fonction de barrière de la muqueuse digestive est complexe puisqu'elle est fréquemment le siège de phénomènes d'absorption et de sécrétion de ces molécules, tandis que les sécrétions ioniques et la mise en œuvre de mécanismes de passage et la protection de la muqueuse contre les toxines bactériennes et moléculaires sont mise en place.
4.1. Détermination de la perméabilité de l'épithélium gastro-intestinal au moyen de la chambre d’Ussing
Le système de chambres d’Ussing est devenu une méthode importante pour la détermination de la perméabilité de l'épithélium gastro-intestinal à des molécules xénobiotiques variées, Au plan pratique, il est indispensable de disposer de méthodes analytiques suffisamment sensibles (détection isotopique, spectrométrie de masse, fluorescence, etc.) afin d'être en mesure de mesurer la quantité des composés étudiés qui traversent l'épithélium gastro-intestinal (Mardones et al., 2004) Dans ces études, on mesure expérimentalement le flux dQ/dt de la substance au travers de la membrane étudié puis ensuite, on calcul la perméabilité apparente du tissu selon l'équation (Oxley et al., 2007)
P app = dQ / dt × 1 / (S × C 0) (équation 9)
Où, dQ /dt est la vitesse d'apparition de la substance dans le compartiment receveur (séreux ou muqueux selon le cas), S est la surface de l'épithélium exposé, C0 est la
concentration initiale de la substance étudiée dans la solution expérimentale dans le compartiment donneur (exprimée en mmole/cm3).
Fréquemment, C0 représente donc la concentration initiale de la molécule dans le
compartiment apical.
Le coefficient de perméabilité apparente Papp illustre la capacité de la molécule à
41
de perméabilité ainsi mesuré est dit "apparent" dans la mesure où dans de nombreuses situations, ce coefficient résulte de la superposition de plusieurs phénomènes. C'est ainsi fréquemment le cas lorsqu’une substance subit simultanément un passage dans le sens apical vers basolatéral (en raison d'une absorption passive majoritaire et un passage dans le sens basolatéral vers apical (en raison d'une sécrétion par une pompe d'efflux). Dans cette situation fréquemment rencontrée avec les molécules xénobiotiques, le coefficient mesuré n'est "qu’apparent". Ainsi, il est bien souvent préférable d'exprimer et de comparer entre elles les valeurs de flux par unité de surface pour éviter des interprétations erronées.
4.2. Incidence des conditions expérimentales sur les mesures de perméabilité au moyen de la chambre de Ussing
Les études de perméabilité des molécules nécessitent d'être capable de dissoudre les substances à étudier dans des solutions tampons appropriées (Berginc et al., 2014). Dans la plupart des cas, ces solutions tampons sont composées en grandes partie de sels minéraux auxquelles peuvent s’ajouter des composés biologiques et des co-solvants. Ainsi, il existe une multitude de solutions tampons plus ou moins complexes disponibles pour les essais de perméabilité in vitro. Un des problèmes majeurs rencontrés, est la faible solubilité dans l'eau des substances d'intérêt. Ceci amène à envisager l'utilisation de co-solvants, d'agents tensio-actifs, de protéines d'origine biologique, sels biliaires, etc. Toutefois, alors que l’incidence sur la physiologie membranaire de ces additifs doit être la plus faible possible, elle est parfois loin d'être négligeable, et leur emploi nécessite de minutieuses vérifications expérimentales préalables aux expériences de perméation proprement dites. Une telle caractérisation de l’impact de diverses solutions physiologiques classiquement utilisées est envisagée dans la partie expérimentale du travail.