HAL Id: tel-01743878
https://tel.archives-ouvertes.fr/tel-01743878
Submitted on 26 Mar 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Contrôle des propriétés mécaniques par polymérisation
plasma pour des surfaces innovantes antibactériennes
Mathieu Veuillet
To cite this version:
Mathieu Veuillet. Contrôle des propriétés mécaniques par polymérisation plasma pour des surfaces innovantes antibactériennes. Autre. Université de Haute Alsace - Mulhouse, 2017. Français. �NNT : 2017MULH9533�. �tel-01743878�
Thèse
Pour obtenir le titre de
Docteur de l’Université de Haute Alsace
en Chimie des Matériaux
Soutenue publiquement par Mathieu Veuillet
Le 9 mars 2017
Thèse dirigée par Lydie Ploux et Vincent Roucoules
Encadrée par Yannick Gourbeyre et Jean-Michel Brossard
Jury
Docteur Thierry Jouenne ... Rapporteur Professeur Rony Snyders ... Rapporteur Professeur Jean-Claude Block ... Examinateur Docteur Emmanuelle Gaudichet-Maurin ... Invité Docteur Fouzia Boulmedais ... Invité Docteur Lydie Ploux ... Directrice de Thèse Professeur Vincent Roucoules ... Directeur de Thèse Docteur Yannick Gourbeyre ... Encadrant
3
C’est avec beaucoup de plaisir que je souhaite remercier mes directeurs de thèse, Lydie Ploux et Vincent Roucoules. Ce sont des personnes fantastiques, aussi bien humainement que professionnellement qui m’ont toujours poussé et encouragé à aller plus loin. Leurs mots toujours justes, toujours aux bons moments et toujours avec la plus grande franchise ont été un moteur irremplaçable pendant ces trois dernières années. « Merci pour toutes ces années de travail avec vous. C’était parfait ! »
Je souhaite également remercier Yannick Gourbeyre, Jean-Michel Brossard et Emmanuelle Gaudichet-Maurin pour leur accueil chez Veolia et leur implication dans les travaux de thèse. Leur gentillesse et leur point de vue ont été un enrichissement constant au cours de ces trois ans. Un grand merci tout particulier à Yannick pour son suivi, et pour nos échanges toujours très constructifs et positifs.
Ces travaux de thèse n’auraient également pas été possibles sans quatre ingénieurs du laboratoire. Tout d’abord, merci à Charline Soraru qui a fait un travail remarquable, qui s’est lancé les yeux fermés dans des expériences délicates et qui a obtenue d’excellents résultats. Merci également à Aissam Airoudj et à Samar Hajjar pour leur expertise dans leur domaine respectif, l’AFM et l’XPS. Ils ont été, tous les deux, très disponibles et toujours porteurs de bonnes nouvelles. Enfin, merci à Tatiana Petithory qui a été une interlocutrice indispensable pour les analyses par microscopie confocale. Je voulais également en profiter pour la remercier pour son encadrement au cours de mon stage de master qui m’a fait découvrir les cellules à flux et leurs possibilités infinies.
Je souhaite remercier chaleureusement l’ensemble des personnes travaillant à l’IS2M pour leur disponibilité, leur gentillesse et leur expertise, avec une attention plus particulièrement pour deux personnes, Florence Bally-Le Gall pour ses mots toujours attentionnés et ses précieux conseils et Adeline Marguier, collègue de thèse, avec qui j’ai partagé une partie de l’aventure doctorale.
Je tenais également à remercier les équipes de Veolia qui m’ont merveilleusement bien accueilli et particulièrement aux membres de l’équipe du pôle MAT.
5
INTRODUCTION GENERALE ... 9
Contexte ... 9
Rôle des biofilms et positionnement des travaux de thèse ... 10
Solution envisagée ... 12
CHAPITRE I : ADHESION BACTERIENNE ET POLYMERISATION PLASMA : VERS DES SURFACES INNOVANTES ANTIBACTERIENNES ... 15
L’ADHESION BACTERIENNE ET LE DEVELOPPEMENT DU BIOFILM ... 16
I - 1. Mécanismes de l’adhésion bactérienne ... 16
I - 2. Mobilité et motilité des bactéries dans leur environnement ... 18
I - 3. Biofilm ... 20
I - 4. Effet de la chimie de surface ... 23
I - 5. Effet de la microtopographie de surface ... 25
I - 6. Effet des propriétés mécaniques de surface : le module élastique ... 27
I - 7. Stratégie retenue pour limiter l’adhésion bactérienne ... 27
II. SYNTHESE D’UN FILM MINCE HYDROGEL PAR POLYMERISATION PLASMA ... 29
II - 1. Principe et phénoménologie de la polymérisation plasma ... 29
II - 2. Différents mécanismes réactionnels lors de la polymérisation plasma ... 37
II - 3. Rôle des paramètres externes ... 39
II - 4. Synthèse de films minces d’hydrogels obtenus par polymérisation plasma... 43
III. CONCLUSION ET ORIENTATION DES TRAVAUX ... 44
CHAPITRE II : MATERIEL ET METHODES ... 45
I. LA POLYMERISATION PLASMA ... 46
I - 1. La polymérisation plasma à basse pression ... 46
I - 2. La polymérisation plasma à pression atmosphérique ... 48
I - 3. Les précurseurs sélectionnés ... 51
6
II. CARACTERISATIONS PHYSICO-CHIMIQUES DES DEPOTS POLYMERES PLASMAS ... 53
II - 1. Caractérisation par microscopie à force atomique (AFM) ... 53
II - 2. Caractérisation par spectroscopie infrarouge à transformée de Fourier ... 54
II - 3. Caractérisation par spectrométrie de photoélectrons induits par rayons X (XPS) ... 54
II - 4. Caractérisation par mesure d’angle de contact ... 54
III. CARACTERISATIONS DES PROPRIETES ANTIBACTERIENNES DES DEPOTS POLYMERES PLASMAS ... 55
III - 1. Caractérisation des propriétés antibactériennes des dépôts polymères plasmas vis-à-vis d’une bactérie modèle non soumis à un flux ... 55
III - 2. Caractérisation des propriétés antibactériennes des dépôts polymères plasmas soumis à un flux vis-à-vis d’une bactérie modèle ... 58
CHAPITRE III : CONTROLE DES PROPRIETES MECANIQUES DES FILMS MINCES DE DMAEMA ET HEMA PAR POLYMERISATION PLASMA ... 65
I. RESUME ... 66
II. MACROSCOPIC CONTROL OF DMAHEMA AND HEMA PLASMA POLYMERIZATION TO TUNE THE SURFACE MECHANICAL PROPERTIES OF HYDROGEL COATINGS ... 67
II - 1. Introduction ... 67
II - 2. Results and discussion ... 69
II - 3. Conclusion ... 92
CHAPITRE IV : EFFETS ANTIBACTERIENS INDUITS PAR LES FILMS MINCES HEMA ... 93
I. RESUME ... 94
II. SOFT HYDROGEL SURFACES PREVENT BIOFILM FORMATION ... 96
II - 1. Antibacterial properties evaluation ... 96
CHAPITRE V : VERS UNE REHABILITATION DE CANALISATION SUR SITE : DEVELOPPEMENT D’UN SYSTEME MULTICOUCHE ET D’UN SYSTEME DE POLYMERISATION PLASMA A PRESSION ATMOSPHERIQUE ... 113
I. STRUCTURATION MULTICOUCHE PAR POLYMERISATION PLASMA POUR UNE STRATEGIE ANTIBACTERIENNE A LONG TERME 114 II. ELABORATION DU SYSTEME MULTICOUCHE ... 116
II - 1. Synthèse d’une couche imperméable à l’eau à partir du précurseur VTMOS ... 116
II - 2. Synthèse du système multicouche ... 123
II - 3. Stabilité du système multicouche et cinétique d’effeuillage ... 128
III. ETUDES DES PROPRIETES ANTIBACTERIENNES DU FILM MINCE HEMA DANS UN SYSTEME MULTICOUCHE ... 132
III - 1. Les propriétés antibactériennes du film mince HEMA en surface d’un système multicouche « simple » 132 III - 2. Les propriétés antibactériennes du film mince HEMA après régénération ... 133
7
IV. SYNTHESE D’UN SYSTEME MULTICOUCHE PAR POLYMERISATION PLASMA A PRESSION ATMOSPHERIQUE : ETUDE DE
FAISABILITE ... 137 IV - 1. Plan d’expérience ... 137 IV - 2. Perspectives ... 141 CONCLUSION ET PERSPECTIVES ... 143 BIBLIOGRAPHIE ... 149 ANNEXES ... 163
I. ANNEXES CHAPITRE II : MATERIEL ET METHODES ... 164
II. ANNEXES CHAPITRE III : CONTROLE DES PROPRIETES MECANIQUES DES FILMS MINCES DE DMAEMA ET HEMA PAR POLYMERISATION PLASMA ... 165
9
Contexte
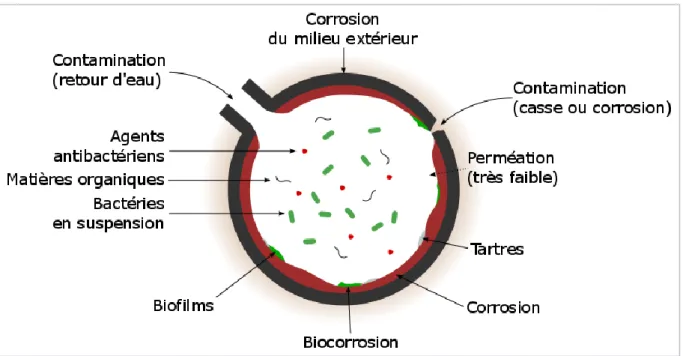
Les réseaux d’eau potable ont été considérés jusque dans les années 1970 comme des ensembles inertes. Assimilés à de simples outils de transport, leur développement reposait essentiellement sur le besoin d’acheminer de l’eau en quantité suffisante. Cet objectif atteint et avec l’avènement de la microbiologie, l’attention est portée aujourd’hui sur la qualité de l’eau délivrée aux consommateurs. Le regard du grand public et les priorités des concepteurs ont fortement évolué. Les canalisations sont maintenant assimilés de véritables réacteurs où ont lieu un grand nombre de réactions physico-chimiques et biologiques (Figure 1). Ces réactions, qui dépendent fortement de la composition des parois internes des canalisations, impactent directement la qualité de l’eau, mais également la durée de vie du réseau.
Figure 1 : Synthèse des différents phénomènes et espèces rencontrées dans une canalisation d’eau potable.
10
Le réseau français compte actuellement 996 000 kilomètres de canalisations qui distribuent 6 milliards de mètres-cubes d’eau par an en France. Parmi elles, 10% ont plus de 60 ans et 60% plus de 40 ans [1]. Le réseau est composé à part égale de canalisations en fonte dont les parois peuvent être revêtues, essentiellement posées avant 1970, et de canalisations plus récentes en polymères (polychlorure de vinyle (PVC) ou polyéthylène haute densité (PEHD)). Avec un taux actuel de renouvellement de seulement 0,6% du linéaire par année, le réseau d’eau potable français vieillit. Un effort important est nécessaire afin de garantir la qualité de l’eau et limiter le vieillissement du réseau car les pertes au cours de la distribution représentent aujourd’hui environ 20% de la production d’eau potable, soit un milliard de mètres-cubes par an.
Différentes stratégies peuvent être mises en œuvre pour le renouvellement d’une canalisation. La première consiste à son remplacement complet. Cela nécessite la réalisation d’une tranchée, l’extraction ou la condamnation de l’ancienne conduite et son remplacement par une neuve. La seconde stratégie met en œuvre uniquement la rénovation de la paroi interne lorsque la canalisation n’est pas trop dégradée ; on parle alors de réhabilitation. Cette solution est moins coûteuse mais nécessite la réalisation de deux fouilles au niveau de la canalisation, espacées de 150 à 200 mètres. La surface interne de la canalisation est ensuite nettoyée par une action mécanique sur toute sa longueur avant d’être chemisée ou enduite avec un nouveau revêtement. Les revêtements utilisés pour l’enduction sont essentiellement des composés polyuréthanes ou polyurées. Ils ont pour unique rôle de former une couche barrière contre la corrosion identifiée comme la source principale de la dégradation des canalisations.
Le projet « Surfaces Innovantes pour les Réseaux d’Eau des Nouvelles Agglomérations et la Réhabilitation des Réseaux Existants » (SIRENAplus) piloté par Veolia Recherche et Innovation et soutenu par le 14e appel du Fonds Unique Interministériel (FUI) a pour objectif de proposer de nouveaux revêtements plus performants et plus durables. Ils devront non seulement protéger la canalisation de la corrosion mais également apporter des propriétés anti-tartes et antibactériennes aux parois internes, permettant ainsi de pérenniser la qualité de l’eau et son acheminement.
Rôle des biofilms et positionnement des travaux de thèse
Un des enjeux majeurs pour les distributeurs d’eau est de garantir la qualité de l’eau potable de l’usine jusqu’au point d’usage. Cela se traduit par l’obligation d’assurer la qualité et la sécurité sanitaire de l’eau distribuée. Pour cela, il est nécessaire de contrôler la qualité microbiologique de l’eau.
11
Les risques microbiologiques se décomposent en trois aspects distincts en fonction de la nature du pathogène :
- le risque parasitaire, qui tend à être maîtrisé en raison de l’amélioration des systèmes de filtration suite au dernier incident qui a eu lieu à Milwaukee (1993) où plus de 400 000 cas d’infection ont été recensés [2,3] ;
- le risque viral ; - le risque bactérien.
La présence de ces agents pathogènes est encadrée par le décret n° 2001-1220 du 20 décembre 2001 [4] qui définit des normes concernant la qualité de l’eau destinée à la consommation humaine. Ce décret reprend l’essentiel des éléments de la directive européenne 98/83/CE du Conseil du 3 novembre 1998 [5] qui fixe les limites de qualité pour les eaux de consommation à partir de paramètres biologiques et chimiques. Afin de répondre aux contraintes biologiques fixées, les eaux sont traitées chimiquement, essentiellement par l’utilisation de produits à base de chlore (eau de javel, dioxyde de chlore) qui, utilisés de manière réglementée, représentent les oxydants les plus largement utilisés pour la désinfection de l'eau de boisson. A cela s’ajoute la réglementation introduite par la directive 98/8/CE qui concerne l’utilisation de produits biocides.
Par ailleurs, d’autres contraintes réglementaires sont en vigueur et concernent les matériaux utilisés au contact d’aliments. Les matériaux composant les réseaux d’eau sont concernés par cette réglementation. Le texte en vigueur est le règlement n°10/2011 de la commission du 14 janvier 2011 [6], introduisant une liste positive de substances chimiques autorisées à être utilisées dans ce domaine.
La limitation de la présence de microorganismes pathogènes dans l’eau, entre l’usine de traitement et le point de distribution, est actuellement assurée par l’utilisation réglementée de produits à base de chlore (0,2 mg.L-1 de Cl2 sont actuellement utilisés). L’effet désinfectant de ces substances est induit par leur capacité à oxyder les structures des microorganismes et à créer des lésions plus ou moins réversibles en fonction de la dose à laquelle les microorganismes sont exposés. Les conséquences pour les microorganismes peuvent être la mort cellulaire dans le cas de lésions irréversibles. Au niveau bactérien, ces lésions se situent essentiellement au niveau de la membrane cytoplasmique (enveloppes polymères des bactéries). L’utilisation de produits chlorés est relativement efficace car elle conduit à endommager définitivement ou à tuer un fort taux de microorganismes présents.
Néanmoins, si l’oxydation des membranes est relativement efficace pour les microorganismes en suspension, l’oxydation de la membrane cytoplasmique est beaucoup plus limitée pour les bactéries
12
présentes au sein de biofilms1 adhérés sur les parois des canalisations. Dans ce cas, seules les bactéries superficielles sont en contact direct avec l’agent oxydant. En effet, les biofilms présentent des mécanismes de résistance aux agressions extérieures beaucoup plus élevés par rapport aux mêmes microorganismes isolés. Cela se traduit notamment par la limitation de la diffusion de l’agent oxydant au sein du biofilm ainsi que par l’activation de systèmes de défense tels que la production d’enzymes dégradant l’agent antibactérien, la limitation de la perméabilité à cet agent,…[7] Cette résistance se propageant grâce à la prolifération des bactéries résistantes, il devient rapidement impossible d’éliminer les bactéries d’une population via l’utilisation d’oxydants aux taux traditionnellement utilisés.
Aujourd’hui, l’utilisation d’un taux de chlore fixé à 0,2 mg.L-1 dans les réseaux favorise finalement le développement de mécanismes de résistance à l’oxydation écartant la possibilité de prévenir durablement la formation de biofilms. Les biofilms formés par les bactéries non pathogènes de l’eau sont également capables d’héberger des microorganismes pathogènes comme des protozoaires (e.g. Giardia, Cryptosporidium, Hartemannella, Acanthamoeba), des bactéries pathogènes (e.g. Legionella pneumophila, Aeromonas hydrophila, Pseudomonas aeruginosa, Helicobacter pilory) ou des virus entériques. Tout arrêt de traitement par l’agent oxydant se traduit immédiatement par leur prolifération et leur libération en suspension dans l’eau [2].
Solution envisagée
Ces travaux de thèse visent à explorer une stratégie innovante pour prévenir l’adhésion bactérienne et la formation des biofilms dans les canalisations d’eau potable. Pour cela, une stratégie basée sur les propriétés mécaniques de surfaces innovantes est développée en prenant en compte certaines contraintes liées à l’application visée. Ces nouvelles surfaces devront :
- répondre aux normes sanitaires sur la qualité de l’eau et être en conformité avec les accréditations de conformité sanitaire (ACS) ;
- posséder des fonctions innovantes anti-biofilms et antitartres ;
1 Un biofilm est composé de microorganismes sécrétant une matrice adhésive et protectrice. Cette matrice permet la formation d’une structure organisée plus ou moins complexe en favorisant l’adhésion des microorganismes entre eux mais également avec la surface.
13
- posséder des propriétés adéquates de recouvrements de la surface de la canalisation ainsi qu’une résistance à l’environnement de la canalisation (contraintes mécaniques, taux de chlore, résistance à la corrosion, …) ;
- conserver ces propriétés pendant une période longue de 20 ans environ.
- pouvoir être appliquées sur des canalisations en fonte par une technologie applicable dans le cadre de travaux de réhabilitation
Afin de répondre à ces différentes contraintes et parvenir à une durabilité de la solution sur l’intervalle de temps requis, le système développé est un système multicouche. Deux types de couches sont alternées : des couches hydrogels antibactériennes et des couches hydrophobes possédant des propriétés barrières à l’eau limitant ainsi sa diffusion. L’originalité de la solution repose sur la capacité du système à s’autorégénérer par effeuillage du couple couche hydrogel – couche barrière, pour prévenir la formation de biofilms sur le long terme et ainsi régénérer une nouvelle surface antibactérienne périodiquement (Figure 2).
Figure 2 : Représentation schématique du système multicouche
Les travaux visant à développer une surface antibactérienne grâce à ses propriétés mécaniques de surface, puis son intégration dans un système multicouche sont décrits dans ce manuscrit de thèse. Il est divisé en cinq chapitres principaux. Dans le premier chapitre, une étude bibliographique montre qu’il existe actuellement quatre stratégies différentes pour prévenir l’adhésion bactérienne sur des surfaces : l’utilisation d’agents biocides, le contrôle de la topographie de surface, le contrôle de la chimie de surface et le contrôle des propriétés mécaniques de surfaces. Parmi ces quatre voies, le contrôle des propriétés mécaniques est une voie émergente et prometteuse car elle semble pouvoir prévenir l’adhésion bactérienne quelle que soit l’espèce bactérienne mise en jeu. La seconde partie de l’étude bibliographique est dédiée au principe de dépôts de films minces par polymérisation plasma.
14
Elle montre l’efficacité de cette technique pour contrôler les propriétés d’une surface et notamment les propriétés mécaniques. Le second chapitre est consacré à la présentation des méthodes expérimentales utilisées au cours des différentes études. Le troisième chapitre décrit la synthèse de films minces par polymérisation plasma à basse pression à partir des deux précurseurs sélectionnés pour ce travail. Au-delà de la caractérisation physico-chimique des dépôts obtenus, cette étude montre que les techniques de polymérisation plasma permettent un contrôle fin des propriétés mécaniques de surface sur une large gamme de module d’Young. Le quatrième chapitre s’intéresse à la caractérisation de l’adhésion et de la prolifération bactérienne sur ces différents revêtements hydrogels dans des conditions statiques ou dynamiques (avec ou sans flux). Le cinquième chapitre s’intéresse aux problématiques de durabilité des revêtements antibactériens en développant un système multicouche et initie sa synthèse par polymérisation à pression atmosphérique. Enfin, des conclusions et des perspectives seront proposées.
15
CHAPITRE I : ADHESION BACTERIENNE ET POLYMERISATION PLASMA : VERS DES SURFACES INNOVANTES
ANTIBACTERIENNES ... 15
L’ADHESION BACTERIENNE ET LE DEVELOPPEMENT DU BIOFILM ... 16
I - 1. Mécanismes de l’adhésion bactérienne ... 16
I - 2. Mobilité et motilité des bactéries dans leur environnement ... 18
I - 3. Biofilm ... 20
I - 4. Effet de la chimie de surface ... 23
I - 5. Effet de la microtopographie de surface ... 25
I - 6. Effet des propriétés mécaniques de surface : le module élastique ... 27
I - 7. Stratégie retenue pour limiter l’adhésion bactérienne ... 27
II. SYNTHESE D’UN FILM MINCE HYDROGEL PAR POLYMERISATION PLASMA ... 29
II - 1. Principe et phénoménologie de la polymérisation plasma ... 29
II - 2. Différents mécanismes réactionnels lors de la polymérisation plasma ... 37
II - 3. Rôle des paramètres externes ... 39
II - 4. Synthèse de films minces d’hydrogels obtenus par polymérisation plasma... 43
16
L’adhésion bactérienne et le développement du biofilm
I - 1. Mécanismes de l’adhésion bactérienne
L’adhésion des bactéries sur une surface est un processus s’effectuant en plusieurs étapes (Figure 3) :
Figure 3: Schéma de développement d'un biofilm décrit par un modèle en quatre étapes. [8]
La première étape de l’adhésion est le transport des bactéries à l’intérieur d’un fluide jusqu’à une surface. Divers phénomènes physiques ont un impact sur ce transport : le mouvement brownien, les effets de convection du liquide, la sédimentation (variable en fonction de la nature du liquide dans lequel sont contenues les bactéries), ainsi que l’écoulement du liquide. A titre d’exemple Yang et al. [9] ont montré que le taux d’adhésion des bactéries est plus important lorsque le flux est orienté perpendiculairement par rapport à une surface (en acier inoxydable dans cette étude) plutôt que parallèlement. Le mouvement du liquide vers la surface facilite ainsi le transport des bactéries vers la surface. Par ailleurs, la mobilité propre de la bactérie par l’intermédiaire de son ou ses flagelles a un effet sur ses propriétés d’adhésion. Cet aspect fait toutefois toujours l’objet de discussion, l’influence du flagelle n’étant pas entièrement comprise. Par exemple, si Pratt et Kolter [10] montrent que la présence d’un flagelle facilite la formation d’un biofilm d’Escherichia coli (E.coli) ; Prigent-Combaret et al. n’observent quant à eux aucune influence significative du flagelle. Il est possible que l’importance du flagelle dépende du milieu environnant ainsi que de la nature de la surface [11].
La seconde phase d’adhésion proprement dite des bactéries sur la surface, se compose de deux étapes : une étape d’adhésion réversible et une étape d’adhésion irréversible. L’étape d’adhésion
17
réversible correspond à l’approche de la surface par la bactérie, qui est alors soumise aux influences de forces physiques et chimiques à courtes distances : forces électrostatiques entre les deux surfaces (forces attractives ou répulsives), de van der Waals (forces considérées comme attractives) et hydrophobes/hydrophiles. Cette étape peut être décrite par les théories DLVO et DLVO étendues [12] [13] [14], éventuellement complétées en prenant en compte les effets stériques [15]. Cependant, ces théories ne tiennent pas compte la nature et des propriétés mêmes de la bactérie, qui est simplement décrite comme un colloïde sphérique et rigide [16]. Pourtant, la bactérie possède une paroi faiblement déformable [17] ainsi que potentiellement poreuse [18]. De plus, la nature chimique de la membrane ne peut pas être définie de manière absolue puisqu’elle dépend directement de son environnement. Ainsi, la paroi externe est plus ou moins protonnée en fonction du pH du milieu [19] et sa composition est directement liée à la présence ou non d’espèces ioniques [20]. En raison de la nature des fonctions chimiques qui constituent la membrane bactérienne (fonctions carboxyles, phosphates et amines), les membranes sont majoritairement chargées négativement dans les environnements biologiques courants (entre pH 5 et pH 7). Ces différences peuvent introduire un biais dans la prévision théorique de l’adhésion. Par ailleurs, la théorie DLVO ne prend pas en compte la capacité de la bactérie à modifier la composition de sa membrane en fonction de sa perception de le surface [21],[22],[23]. Ces modifications peuvent être aussi bien chimiques, via la modification des rapports entre les groupements fonctionnels, que structurelles via la formation d’appendices tels que les flagelles et les pili2 dont ni le
rôle ni les actions vis-à-vis de la surface ne sont actuellement totalement décrits. Chez certaines espèces et souches bactériennes, elles pourraient permettre le déplacement de la bactérie à la surface du matériau vers une zone favorable à son adhésion [24]. La colonisation de la surface dépend aussi de la nature du matériau et de ses propriétés (chimie, topographie, propriétés mécaniques) [8]. Le rôle de ces différents paramètres seront développés dans les parties I - 4, I - 5, de ce premier chapitre.
La seconde étape met en place l’adhésion irréversible de la bactérie sur la surface. Elle met en jeu des forces à courtes distances, comme des liaisons covalentes et des liaisons hydrogènes. Ces forces peuvent être complétées par la mise en place de liaisons de type ligands-récepteurs par l’intermédiaire
2Les pili ou fimbriae sont des appendices extracellulaires protéiques plus minces et plus petits que les flagelles.
Ils sont constitués de diverses protéines selon le type de pili et sont ancrés dans la membrane cytoplasmique. Deux grandes classes de pili sont à ce jour décrites, les pili communs qui ontun rôle dans l’adhésion des bactéries et sont eux-mêmes répartis en plusieurs sous classes, et les pili sexuels dont le rôle est le transfert génétique d’ADN au cours de la conjugaison (échange d’informations génétiques entre deux bactéries). Les pilis communs sont répartis en quatre classes I, II, III et IV qui sont différenciés par les protéines qui les composent.
18
des protéines membranaires ou des pili [25]. Les pili de type I, présents sur la plupart des E.coli, peuvent notamment se lier spécifiquement au mannose par l’intermédiaire de l’adhésine FimH [26].
I - 2. Mobilité et motilité des bactéries dans leur environnement
La première étape de l’adhésion implique une mobilité des bactéries à l’état planctonique. On en distingue deux catégories de mobilité :
- une mobilité passive due au milieu : le mouvement brownien, la gravité, la convection du milieu ou la présence d’un flux ou non.
- une mobilité active nommée « swimming » qui relève d’un déplacement spécifique de la bactérie, qui nage dans le milieu grâce à ses flagelles (Figure 4) [27].
Figure 4 : Schéma des différents types de motilité bactérienne.
Lorsque la bactérie entre en contact avec la surface d’un matériau, il est également possible d’observer un déplacement des bactéries, sur la surface, avant leur adhésion définitive. On parle alors de motilité [28]. Comme pour la forme planctonique, on peut observer une motilité passive, avec les mêmes causes physiques que pour les bactéries plactoniques, et une motilité active. Quatre types de motilités actives ont été identifiés bien que l’ensemble des mécanismes ne soient pas clairement élucidés (Figure 4) :
19
- le « swarming » repose sur le déplacement coordonné d’un groupe de bactéries grâce à leurs flagelles. Permettant une vitesse de déplacement de 2 – 10 µm.s-1, ce mode de déplacement est impliqué dans la colonisation de la surface. Il dépend fortement de l’hydratation de la surface [29][30]. Ce type de motilité a été observé chez des espèces de bactéries possédant un flagelle comme les espèces Escherichia, Bacillus, Pseudomonas et Salmonella.
- le « twitching » est un mode de déplacement qui repose sur l’expression de pili de type IV qui concerne les bactéries de type Streptococcus, Legionella, Neisseria, Pseudomonas et Vibrio. Les bactéries expriment des pili de type IV au niveau de leur pôle, pili qu’elles font croître afin de pouvoir se déplacer [31],[32]. En jouant avec le relâchement et la traction réalisés sur les différents pili, la bactérie est alors en mesure de se déplacer dans une direction donnée [33]. Impliquée dans un grand nombre de processus de colonisation [29], cette motilité est plus lente que le « swarming » avec une vitesse de déplacement de 0,06 - 0,30 µm.s-1. Cependant Holz et al. ont montré qu’elle varie en fonction de la fluidité du substrat. En effet, les bactéries se déplacent plus rapidement par « twitching » lorsque la membrane repose sur un substrat (zone non fluide) que lorsqu’elle est suspendue (zone fluide) [34], atteignant des vitesses de 1 µm.s-1 environ. Enfin, en exerçant des tractions sur la surface, cette motilité transmet à la bactérie des informations vis-à-vis des propriétés mécaniques de surface et influence fortement son déplacement en préférant les zones non fluides [35].
- le « gliding » est probablement le type de déplacement le moins bien compris en raison de l’échelle à laquelle les structures initiant le déplacement se situent. Les mécanismes mis en jeu font en effet intervenir des points focaux, situés dans la membrane bactérienne et constitués d’un ensemble de trois protéines. Décrits via des observations indirectes, ils ont tout de même permis d’expliquer en partie le fonctionnement des complexes d’adhésion focale. Plusieurs travaux suggèrent que ces points focaux présents sur la membrane bactérienne se déplacent suivant des schémas précis sur la membrane de manière à permettre une vitesse de déplacement de 3 – 5 µm.s-1[36][37]. Les mécanismes semblent varier d’une espèce à l’autre [38]. Kinosita et al. décrivent ainsi des sites situées sur un pôle de la bactérie et organisés comme des méridiens vers le reste de la bactérie [39]. Chaque site est constitué de trois protéines constituant une « jambe » actionné par une réaction enzymatique d’ATPase permettant le déplacement de la bactérie à une vitesse de 2 - 4,5 µm.s-1[40].
- le « sliding » est un type de déplacement qui résulte de la prolifération des bactéries et de l’intercalation des nouvelles bactéries au sein du tapis bactérien. Cette intercalation induit alors un déplacement des bactéries sur la surface afin de créer l’espace disponible. Si l’action initiale est une réponse spécifique de la population bactérienne considérée, la translocation des bactéries est, quant à elle, passive [28].
20
Toutes les espèces bactériennes ne permettent pas les quatre types de motilité puisque certains nécessitent l’utilisation de structures dont ne disposent pas toutes les espèces bactériennes. Par exemple, le « swarming » et le « twitching » dépendent de l’activité du flagelle pour le premier, et des pili de type IV pour le second. Tous les types de motilité ont néanmoins en commun de favoriser l’adhésion bactérienne et le développement du biofilm [28].
I - 3. Biofilm
I - 3.a. Formation du biofilm
Les bactéries pionnières, c’est-à-dire les premières bactéries adhérées, produisent très tôt différentes molécules et protéines permettant de consolider leur adhésion sur la surface, regroupés sous l’appelation générique de substances polymères extracellulaires (EPS ; Extracellular Polymeric Substances). Une part importante des molécules produites sont des polysaccharides (on parle alors d’exopolysaccharides), comme l’acide colanique pour E.coli [41], qui sont des éléments clef de la structuration du biofilm qui débute [11]. Le développement et la structuration du biofilm dépendent d’un certain nombre de paramètres, dont l’espèce bactérienne et l’environnement du biofilm en croissance. Ainsi la colonisation de la surface du matériau, dépend des capacités de mobilité des bactéries en suspension et à la surface notamment par l’intermédiaire des flagelles ou des pili (voir paragraphe précédent). Elle dépend également de leur capacité à produire des biosurfactants, comme Serratia liquefaciens, qui leur permet de se disperser plus facilement sur la surface [42]. Le milieu nutritif influence également la formation du biofilm.
Le biofilm crée une structure complexe et encore mal comprise qui lui est propre, afin de permettre l’accessibilité des différents éléments nécessaires à chaque bactérie pour permettre leur prolifération par clonage (oxygène, nutriments…). Sa structure permet également d’éliminer les déchets (d’origine métabolique) qui pourraient ralentir cette croissance s’ils s’accumulaient. Le développement du biofilm s’accompagne finalement d’un renforcement de sa cohésion et d’une augmentation de la densité de bactéries (Figure 3) [43].
L’organisation du biofilm permet l’utilisation de mécanismes complexes de communication inter-bactérienne favorisant l’adaptation de la population inter-bactérienne à des variations d’environnement et sa résistance aux différents stress que la colonie peut subir (Figure 5) [44]. Ces stress peuvent être naturels ou bien provoqués par l’introduction d’antibiotiques ou d’agents antibactériens dans le milieu. L’évolution du biofilm pour aboutir à une résistance accrue peut être une ré-organisation, le
21
rendant moins perméable aux molécules du milieu. Des mécanismes biologiques tels que la production d’ADN extracellulaire et de protéines se mettent également en place [45] qui vont induire une différentiation du comportement des bactéries au sein du biofilm, tant au niveau de la vitesse de prolifération qu’au niveau de l’expression génique des bactéries [44]. Ils entraînent la création de bactéries résistantes et persistantes aux agents antibactériens présents [46]. Finalement, l’organisation du biofilm formé par une espèce et une souche bactérienne donnée varie en fonction du milieu, de la nature des stress qu’il subit et auxquels il s’adapte [47][48].
Figure 5 : Schéma d'un biofilm présentant quelques unes de ses possibles adaptations face à un stress.
Lors de la maturation ou de l’adaptation du biofilm, les voies de communication en son sein sont assurées par les signaux chimiques du QS (Quorum-Sensing ; signal de détection du quorum) [42]. C’est par cet intermédiaire que certaines des bactéries présentes dans le biofilm peuvent retrouver une capacité de mobilité de type planctonique [49] presque totalement absente au sein du biofilm [22]. Le QS peut également induire l’autolyse de la structure des exopolysaccharides autour des bactéries afin qu’elles retrouvent leur caractère planctonique et qu’elles puissent coloniser de nouvelles surfaces [50].
I - 3.b. Bio-détérioration induite par le biofilm
Dans de nombreux domaines d’application comme celui de la disctribution d’eau potable, le biofilm peut avoir un impact sur la surface sur laquelle il est adhéré, au-delà d’un simple encrassement dû à la
22
colonisation. Ainsi, sur les surfaces métalliques, les biofilms peuvent provoquer et accélérer les réactions d’oxydoréduction à la surface des matériaux [45,51–54] en déplaçant l’équilibre des réactions. Les effets microbiologiques impliqués dans cette corrosion peuvent être regroupés en six catégories :
- La production de composés corrosifs comme des acides minéraux ou organiques ainsi que des composés ammoniacs et sulfurés [55];
- La formation de « cellules de concentration » à l’interface entre le matériau et les biofilms avec la formation de zones oxygénées et de zones pauvres en oxygène [56] ;
- La formation de dépôts qui accélèrent la corrosion en créant des zones confinées avec un faible volume d’eau. Cette zone induit une différence d’accessibilité notamment à l’oxygène créant ainsi une pile de corrosion [57] ;
- La modification de la couche de passivation des matériaux à cause de leur participation aux voies métaboliques des bactéries du biofilms (nitrites, ammoniac) ;
- La fragilisation du métal par l’hydrogène produite par les voies métaboliques des bactéries [58]; - La stimulation directe des réactions d’oxydoréduction via l’utilisation des produits de réactions
par les bactéries [51].
Dans un environnement aérobie strict, ces différents effets viennent modifier l’équilibre des réactions d’oxydation (Equation (1)) et de réduction (Equation (2) à (4)) suivantes :
Fe Fe2+ + 2e
-O2 + 2H2O + 4e- 4 OH
-H3O+ + e- H + H2O
H2O + e- H + OH
-Au sein des biofilms, des zones d’anaérobiose peuvent se former. Les vitesses de corrosion sont alors uniquement contrôlées par la réaction de réduction suivante (Equation (5)) [59][60]:
2 H+ + 2 e- H2
Ces mécanismes existent sauf lorsque des bactéries sulfatoréductrices sont présentes et génèrent d’autres voies d’oxydoréduction grâce à la présence de soufre. Les corrosions qu’elles provoquent sont plus rapides de plusieurs ordres de grandeur à cause de la formation de FeS, S2ou de H2S.
Néanmoins les surfaces métalliques ne sont pas les seules à être sujettes à la corrosion, les polymères sont également impactés. La formation de biofilm sur les polymères peut engendrer la mise en place d’un mécanisme en quatre étapes :
(1)
(2)
(3)
(4)
23
- La bio-détérioration exploite les fissures de la surface et les agrandit [61] par dégradation chimique. Celle-ci est favorisée par la diversité des espèces bactériennes éventuellement présence dans le biofilm et productrices de composés acides ;
- La bio-fragmentation est produite par l’action d’enzymes libérées par les bactéries et capables afin de cliver les polymères plastiques en séquences plus courtes, oligomères et monomères. C’est le cas des oxygénases qui rendent les polymères plus hydrosolubles et donc plus facilement dégradables, des lipases et des estérases qui attaquent spécifiquement les groupes carboxyliques ainsi que les endopeptidases qui dégradent les groupements amines [62]. - L’assimilation consiste au transport des molécules plastiques de taille inférieures à 600 Da
dans les cellules bactériennes et à leur transformation en composés cellulaires.
- La minéralisation correspond à la dégradation complète du plastique en molécules oxydées (CO2, N2, CH4, H2O). Sivan démontre ainsi qu’après avoir cultivé une souche de Rhodococcus ruber C208 pendant trente jours sur un polyéthylène photo-oxydé, la présence du biofilm engendrait une perte de masse de 8% du substrat [63].
Ainsi la biocorrosion est un phénomène à prendre en compte lorsqu’on développe des surfaces susceptibles d’être en contact avec des bactéries. Celles-ci sont susceptibles de modifier et de détériorer de manière importante la surface sur laquelle elles se développent.
I - 4. Effet de la chimie de surface
Trois propriétés physico-chimiques de la surface des matériaux sont fréquemment citées pour leur influence sur l’adhésion bactérienne. La première est le comportement de la surface vis-à-vis de l’eau ; on parle alors de caractère hydrophile ou hydrophobe. La seconde est l’énergie libre de surface et notamment sa composante acide ou basique. Enfin, la troisième correspond à la charge de surface que possède le matériau.
I - 4.a. L’hydrophobicité de la surface
Il est reconnu que la mouillabilité à l’eau des surfaces joue un rôle dans l’adhésion des bactéries. An et Friedman [64] ont montré que les matériaux hydrophiles sont défavorables à l’adhésion de bactéries possédant des membranes hydrophobes alors que, les bactéries avec une membrane hydrophile adhèrent plus difficilement sur un matériau hydrophobe. D’autres études confirment ces observations quelle que soit l’espèce bactérienne utilisée [65],[66]. Néanmoins, cette tendance doit être nuancée car d’autres travaux montrent quele caractère défavorable à l’adhésion des surfaces hydrophiles n’est pas absolu. Ainsi certains travaux ne montrent pas de différence d’adhésion entre des matériaux
24
hydrophobes et hydrophiles [67–69]. Toutefois, il a également été montré que les propriétés d’hydrophobicité/hydrophilicité de la membrane bactérienne jouent elles aussi un rôle. Ainsi, D. P. Bakker et al. montrent que des bactéries ayant un plus grand caractère hydrophobe à leur surface colonisent une plus grande surface. Par ailleurs, l’influence de l’hydrophobicité de surface n’intervient pas seulement au cours de l’adhésion bactérienne mais également au cours du développement du biofilm comme le montrent Ploux et al. [70]. La structuration du biofilm est ainsi différente selon la fonctionnalisation de surface du matériau (–CH3 ou –NH2). Ces auteurs montrent également une différence de cinétique de prolifération des bactéries au cours du temps avec une mise en évidence du détachement d’une partie du biofilm pour la surface fonctionnalisée –NH2. Le détachement semble être induit par la structure du biofilm qui est elle-même dépendante de la nature de la chimie de surface.
Une autre étude montre que si les cinétiques de colonisation d’une surface peuvent être identiques, qu’elle soit hydrophobe ou hydrophile, les mécanismes et les dynamiques d’adhésion bactérienne peuvent être différents. Boks et al. ont ainsi mis en évidence des différences de comportement d’adhésion en fonction de l’hydrophobicité de surface [71].
Les propriétés de surface des matériaux peuvent être également modifiées par l’excretion de biosurfactants par les bactéries [72]. Ainsi dans certains cas, un « film conditionnant » se forme, constitué de molécules absorbées à la surface. Il peut complétement écranter la chimie du matériau et selon la composition du milieu, modifier considérablement le comportement des bactéries à la surface du matériau, limitant potentiellement l’effet d’un revêtement antibactérien.
I - 4.b. L’énergie de surface
L’énergie de surface est un autre paramètre pouvant impacter l’adhésion bactérienne. Des études montrent une adhésion bactérienne réduite sur les surfaces à faible énergie de surface [73]. Cependant, peu d’entre elles s’intéressent à l’énergie de surface de la membrane bactérienne. Ainsi, il est difficile de déterminer des règles comportementales du couple bactérie-surface à partir uniquement de l’énergie de surface du matériau. Néanmoins, l’importance des interactions acido-basiques a été mis en avant dans l’adhésion d’E.coli sur des matériaux polymères [74]. L’absence d’interaction acido-basique entre la bactérie et le substrat permet de limiter l’adhésion.
I - 4.c.
Les charges de surface
Les charges de surface jouent un rôle au cours de l’adhésion des bactéries sur une surface. Hormis pour quelques espèces particulières, la membrane bactérienne est en effet chargée négativement
25
[75][76]. Par conséquent, on s’attend à ce que l’adhésion des bactéries soit favorisée lorsque les surfaces sont chargées positivement ce qui a été en partie confirmé par de nombreux auteurs [77–79]. De plus, Terada et al. ont démontré que lorsque la surface est chargée positivement, le mécanisme dominant et conduisant à l’adhésion bactérienne est celui des forces électrostatiques attractives entre les bactéries et la surface [80]. Ceci suggère qu’une surface chargée négativement pourrait posséder un caractère plus défavorable à l’adhésion bactérienne qu’une surface chargée positivement.
Cependant ce résultat n’a été obtenu que pour des temps de culture courts et il est probable que le rôle des forces électrostatiques attractives ne soit pas constant au cours du temps. Gottenbos et al. [81] ont aussi montré que la quantité de bactéries (E.coli et P.aeruginosa) sur des surfaces négativement chargées est toujours supérieure à celle des surfaces positivement chargées après plusieurs heures de culture. Ce résultat peut s’expliquer par une baisse de la viabilité cellulaire liée aux forces électrostatiques trop importantes mises en jeu sur les surfaces chargées positivement, causant ainsi des ruptures membranaires et des disfonctionnements au cours de la multiplication cellulaire.
Par ailleurs, il est probable qu’interviennent aussi les capacités qu’à la bactérie à s’adapter à son environnement. C’est ce que démontre l’étude de Rzhepishevska et al., menée sur Pseudomonas aeruginosa qui semble être en mesure de modifier la surface de sa membrane afin de s’adapter à une surface chargée négativement [23]. Cette capacité d’adaptation à la charge de surface s’observe également au niveau du développement et de l’architecture du biofilm formé. Une augmentation de la production des exopolysaccharides de la matrice du biofilm a ainsi été montrée lorsque la bactérie Pseudomonas aeruginosa est confrontée à une surface chargée négativement. En comparaison, les bactéries E.coli présentent une orientation particulière lorsqu’elles s’adhèrent sur de telle surface [82]. Ceci a été interprété comme un moyen pour les bactéries de faciliter la formation du biofilm en augmentant l’hydrophobicité de la population bactérienne.
I - 5. Effet de la microtopographie de surface
L’effet de la topographie de surface sur l’adhésion bactérienne n’est pas totalement compris. De nombreuses études montrent l’existence d’une relation entre microtopographie et colonisation (Figure 6) [8]. Alors que Flint et al. montrent une adhésion bactérienne supérieure pour des Ra de 0,9 et 1,24 µm [83]. Cependant, d’autres exemples ne montrent aucune influence de ce type de topographie lorsque celle-ci est comprise entre 10 nm et 900 nm [84][85]. Medilanski et al. indiquent même avoir observé un résultat opposé avec une adhésion minimale pour des rayures de 700 nm mais avec un Ra = 0,16 µm [86]. Cette dernière étude montre la difficulté à appréhender les effets de la topographie sur
26
l’adhésion bactérienne qui varient en fonction de l’échelle, de l’organisation et de la complexité de la topographie (association de structures définies et d’une rugosité). De plus, l’impact crucial que peut avoir les éventuels rinçages de la surface avant observation ou les différentes morphologies entre l’espèces bactériennes étudiées ne sont pas toujours pris en compte.
Néanmoins, certains résultats [87] semblent indiquer que les flagelles, impliqués dans la capacité de mobilité des bactéries, leur permettent également d’atteindre des rainures ou anfractuosités pour s’y fixer. Les bactéries seraient ainsi capables d’appréhender la surface du matériau et sa topographie y compris à l’échelle nanométrique. A cette échelle, l’influence de la topographie sur l’adhésion bactérienne n’est que peu décrite et comprise. L’équipe de Diaz et al. [88] a montré une orientation des bactéries suivant une topographie nanométrique de la surface. Cependant, le protocole utilisé au cours de cette étude (démouillage total des surfaces avant l’observation) est très probablement à l’origine de cette orientation, comme ont pu le démontrer K. Anselme et al. [89].
Figure 6 : Image de microscopie électronique à balayage (MEB) de la colonisation bactérienne d’une surface lisse (a) et d’une surface poreuse (b) d’un même échantillon de chimie identique. [11]
Face à ces contradictions, certains auteurs tentent de modéliser l’adhésion bactérienne sur les surfaces topographiées [16]. Par exemple, Kargar et al. [90] utilisent une approche thermodynamique de type « surface – vésicule rigide » sur des nanofibres. Cette approche est basée sur l’estimation de l’énergie nécessaire pour permettre l’adhésion entre une vésicule rigide et une surface et l’énergie nécessaire à la déformation de la vésicule pour permettre cette adhésion. Néanmoins, ces études ne considèrent pas l’influence des appendices de la bactérie au cours de son adhésion à une microtopographie et excluent donc une partie de l’aspect biologique de l’adhésion comme l’intervention potentielle de pili et/ou de liaisons « ligand – récepteur ».
27
I - 6. Effet des propriétés mécaniques de surface : le module élastique
L’impact du module élastique des matériaux est une nouvelle voie, explorée depuis moins de dix ans afin d’obtenir des propriétés antibactériennes. Les études portant sur ces aspects restent rares au sein de la littérature malgré les résultats prometteurs obtenus.
En 2012, Cottenye et al. ont montré que les propriétés mécaniques de la surface jouaient un rôle important au cours de l’adhésion des bactéries (E.coli K12 dans ce cas) [91]. Une surface qui possède un caractère mou, avec un module de l’ordre de quelques centaines de kPa, limite l’adhésion bactérienne. Cette limitation d’adhésion se traduit par une mobilité plus importante des bactéries à la surface [92], ces dernières pouvant parcourir une distance de plusieurs micromètres en quelques minutes. Depuis Guégan et al. ont utilisé une approche semblable en utilisant différent taux de réticulation d’un gel d’agarose avec une rigidité minimum de 6,6 kPa. Ils confirment que la souplesse réduit l’adhésion des bactéries et montrent qu’elle induit un changement de phénotype, que les bactéries soit Gram positives et Gram négatives. L’expression de 21 protéines est modifiée, dont certaines impliquées dans le développement du biofilm ou intervennant peut être dans la préhension de la surface [93]. D’autres études arrivent aux mêmes conclusions en utilisant d’autres hydrogels et en contrôlant la chimie de surface [94][95]. Dans ces études, la variation du module élastique du revêtement est obtenue en faisant varier le ratio de polymères présent dans la solution initiale. Une autre étude, a fait varier, par photoréticulation, le taux de réticulation de films de polyélectrolytes. Une variation de module élastique de quelques kPa à environ 150 kPa a ainsi été obtenue, sans variation significative de la chimie de surface ou du pH. Les auteurs montrent ainsi une diminution de l’adhésion bactérienne obtenue pour les surfaces possédant le plus faible module élastique mais seulement pour les bactéries Gram négatives probablement en raison de la chimie des films produits [96].
I - 7. Stratégie retenue pour limiter l’adhésion bactérienne
Les résultats récents de la littérature montrent clairement que le contrôle des propriétés mécaniques de surface est une nouvelle voie originale et prometteuse pour contrôler l’adhésion bactérienne. C’est cette stratégie qui a été retenue dans ce travail de thèse, en utilisant les propriétés remarquables des hydrogels. Les hydrogels sont des réseaux polymères tridimensionnels hydrophiles capables d’emprisonnée une phase aqueuse grâce à la présence de groupes hydrophiles (-OH, -CONH, -CONH2, …) induisant des liaisons hydrogènes avec les molécules d’eau. La capacité de ces structures à se remplir d’eau (i.e. gonflement) dépend du taux de réticulation engagé dans la matrice hydrogel ainsi que de la densité des liaisons hydrogènes formées. Ces propriétés ont un impact direct sur les propriétés mécaniques du réseau. Ainsi en synthétisant un réseau hydrogel avec des degrés contrôlés
28
de réticulation et des fonctions chimiques spécifiques, il devrait être possible d’obtenir des propriétés mécaniques de surfaces variées afin de contrôler l’adhésion bactérienne. La stratégie retenue pour élaborer de tel réseau sous forme de films minces est la polymérisation plasma.
29
II. Synthèse d’un film mince hydrogel par polymérisation plasma
Le dépôt de films minces assisté par plasma (Plasma-Enhanced Chemical Vapor Deposition, PECVD), ou plus communément désigné par polymérisation plasma, consiste à faire croître sur une surface un réseau tridimensionnel réticulé à partir de précurseurs volatils. Les films minces polymères plasma sont synthétisés par des mécanismes différents de la polymérisation conventionnelle. Les éléments polymérisés peuvent être organiques, inorganiques ou métalliques et la fonctionnalité des précurseurs utilisés ne nécessite pas d’être supérieure à 2. La polymérisation est généralement obtenue au sein d’un plasma froid hors équilibre thermodynamique. Un tel milieux est partiellement ionisé (de 10-4% à 10% du gaz). Il est composé d’électrons, d’ions et de molécules neutres au sein desquels la température des électrons est supérieure à celles des autres espèces (Télectrons > Tions = Tneutres).II - 1. Principe et phénoménologie de la polymérisation plasma
II - 1.a. Approches macroscopiques
C’est bien avant la première description de l’état plasma par W. Crookes en 1879 et la définition de cet état par I. Langmuir en 1928 comme « plasma » [97] que le phénomène de polymérisation plasma est observé pour la première fois à la fin du XVIIIème siècle. Des chercheurs néerlandais, cités par J. Fourcroy en 1796, mènent des expériences sur les décharges électriques à pression atmosphérique et constatent la formation de dépôts. Ce n’est qu’à la fin du XIXème siècle, que ces sous-produits de réactions font l’objet d’études de la part de P. de Wilde, P.A. Thenard mais également de M. Berthelot au cours du développement de la synthèse de l’acétylène par arc voltaïque [98] où ils sont définis comme des polymères. Dans les années 1960, K. Jesch et al. [99] ainsi que F.J. Vastola et J.P. Wightman [100] décrivent ces dépôts polymères comme des composés insolubles, donc réticulés et composés de chaînes carbonées insaturés. Par la suite, Neiswender met en évidence une concentration élevée de radicaux au sein de ces dépôts. Il est également le premier à proposer un facteur qui relie l’énergie fournie afin de décrit les différentes conditions de polymérisation plasma [101]. Ce concept est repris par H. Yasuda en 1978 qui définit le paramètre de Yasuda [102][103].
Le formalisme du paramètre de Yasuda repose sur le constat que chaque réaction plasma est basée sur les réactions entre les espèces réactives présentes au sein du réacteur. Ces espèces réactives sont créées à partir de la fragmentation du précurseur et de la recombinaison de ces fragments qui constituent les blocs du futur film polymère. Les réactions de fragmentation et de recombinaison sont directement contrôlées par l’énergie apportée W (en J.s-1), le flux F du précurseur au sein du réacteur
30
(en mol.s-1) et la quantité de matière se partageant cette énergie M (masse molaire du monomère en kg.mol-1), Equation (6).
Y =
𝑾𝑭 𝒙 𝑴
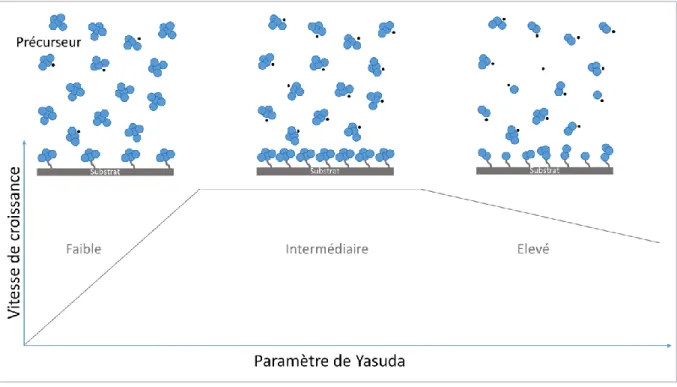
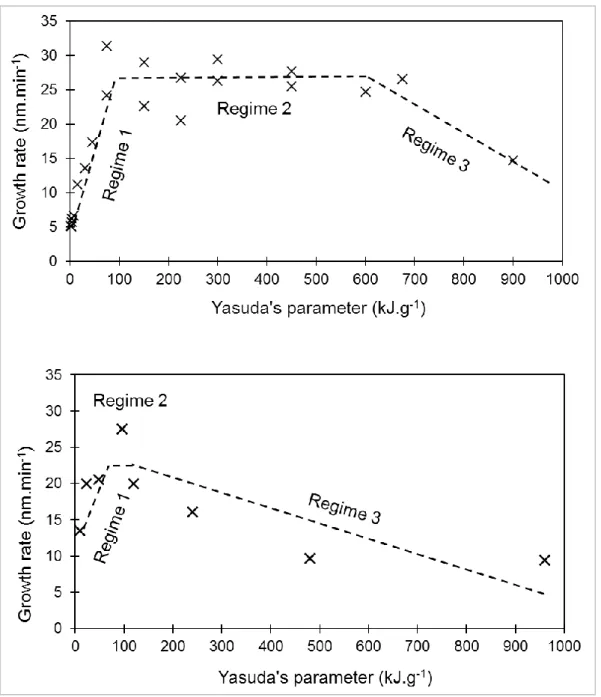
Selon la valeur du paramètre de Yasuda, il est possible de distinguer différents régimes de croissance du film polymère (Figure 7).
- lorsque la valeur du paramètre de Yasuda est faible, l’énergie fournie au plasma est insuffisante par rapport au nombre de molécules de précurseur présentes. Les molécules de précurseur sont peu fragmentées et leur structure est conservée pour la majorité d’entre elles. La vitesse croit linéairement avec le paramètre de Yasuda.
- Lorsque la valeur du paramètre de Yasuda est élevée, l’énergie fournie au plasma est en excès par rapport au nombre de molécules de précurseur. Le précurseur est fortement fragmenté et sa structure est rarement conservée. La vitesse a tendance à décroître avec le paramètre de Yasuda.
- Pour les valeurs du paramètre de Yasuda intermédiaires, l’énergie fournie au plasma est équilibrée entre la puissance fournie et le nombre de molécules de précurseur. La vitesse reste constante en fonction du paramètre de Yasuda.
L’approche décrite précédemment ne prend pas en compte la géométrie du réacteur. Or ce paramètre à un impact direct sur la vitesse de polymérisation comme le montre Y.-S. Yeh, et al. [104]. Outre le flux du précurseur F, ces auteurs introduisent deux facteurs expérimentaux supplémentaires pour décrire la vitesse de croissance du film notée Rm : le rendement de dépôt du polymère plasma Yp et la géométrie du réacteur G.
R
m= GY
pF
Le rendement de dépôt du polymère plasma représente le taux de conversion du précurseur de la phase gazeuse à la phase solide. Ce facteur est fortement dépendant des énergies de dissociation du précurseur décrite par le paramètre de Yasuda. C’est pourquoi Hegemann et al. proposent d’exprimer Yp en négligeant la masse du précurseur tout en reliant W/F à une énergie d’activation [105], Equation (8).
(6)
31
Figure 7 : Représentation schématique de l'évolution de la vitesse du film de croissance en fonction du paramètre de Yasuda.
Y
p= 𝒆
−𝑬𝒂𝑾/𝑭
Ainsi ils obtiennent en remplaçant Yp dans l’Equation (7) :
𝑹𝒎 𝑭 = 𝑮 𝒆
−𝑬𝒂 𝑾/𝑭
L’Equation (9) relie ainsi l’ensemble des paramètres de polymérisation ayant un impact sur la vitesse de croissance à une ou plusieurs énergies d’activation en fonction de l’état du précurseur. Néanmoins les mécanismes mise en jeu au cours de la polymérisation plasma ne sont pas totalement élucidés à l’échelle moléculaire, cependant plusieurs modèles sont proposés dans la littérature.
II - 1.b. Les différents modèles moléculaires
Deux mécanismes principaux sont utilisés dans la littérature pour décrire la croissance des films issus de la polymérisation plasma. Ces mécanismes seront détaillés en section II - 2. Le premier fait intervenir
(8)
32
des mécanismes de polymérisation ionique [106][107], le second utilise des réactions de polymérisations radicalaires [108][109][110]. Bien que ces mécanismes soient encore très controversés dans la littérature, les mécanismes radicalaires sont aujourd’hui privilégiés en raison de la forte présence de radicaux au sein de la structure du polymère plasma ainsi qu’en raison de la nature du plasma où la neutralité des charges domine. Cependant de récents travaux de Michelmore et al. montrent que le flux d’ions dans la phase plasma semblent être un facteur plus important, que l’énergie fournie au système, pour prédire la conservation de la structure du précurseur et la vitesse de croissance [111]. D’autres espèces comme les photons, les électrons ou les neutres sont également susceptibles de jouer un rôle important dans les mécanismes de croissance des polymères plasmas. Aujourd’hui, des efforts doivent être réalisés sur la caractérisation de la phase plasma afin de mieux décrire les procédés de fragmentation et d’ionisation mis en jeu et de mieux appréhender le rôle de chaque espèce.
En se basant principalement sur la structure du polymère plasma obtenu, plusieurs modèles ont été proposés.
II - 1.c. Le modèle de Tibbitt
J.M. Tibbitt a décrit la polymérisation plasma de l’éthylène [112]. En se basant principalement sur des mécanismes radicalaires, il montre que la polymérisation de l’éthylène donne une structure irrégulière réticulée, ramifiée, possédant des doubles et triples liaisons et des cycles aromatiques créés au cours de la polymérisation (Figure 8).
33
II - 1.d. Le modèle « Rapid Step Growth Polymerization » de Yasuda
H. Yasuda propose dès 1985 un modèle basé sur la fragmentation du précurseur sous forme d’espèces réactives radicalaires, leurs recombinaisons et leurs réactivations, qui sont directement influencé par la pression utilisée lors du dépôt. Il propose un mécanisme de polymérisation constitué de deux cycles, un premier cycle est initié avec une espèce monoradicalaire, et un second avec une espèce biradicalaire. Dans les deux cas, ces espèces réagissent avec une molécule de précurseur stable au cours des étapes de propagation. Chaque étape de propagation se termine via une réaction de terminaison et/ou une recombinaison entre deux radicaux. Les molécules ainsi formées sont susceptibles d’être réactivées par l’impact d’un électron est d’être réintroduit dans une étape de propagation. Ce modèle nommé « Rapid Step Growth Polymerization » se résume en fait en une succession de réactions de terminaisons suivis d’étapes de réactivations [103] (Figure 9).
Figure 9 : Modèle « Rapid Step Growth Polymerization » (RSCP) de H. Yasuda.
H. Yasuda défini son mécanisme pour générer les espèces actives comme étant dépendant de la pression. Ainsi, les fragments générés lors de polymérisation dépendent du paramètre de Yasuda (voir le formalisme du paramètre de Yasuda en section II - 1.a). Pour un paramètre de Yasuda élevé, le précurseur se fragmente totalement, permettant d’obtenir une quantité importante d’atomes isolés (i.e. radicaux) au sein de la phase plasma. Les fragments et les atomes obtenus se recombinent de
34
manière aléatoire permettant d’obtenir un dépôt au sein duquel le précurseur de base n’est plus identifiable. En raison de la présence de ces atomes pouvant polymériser entre eux, ce modèle est aussi appelé « polymérisation atomique », ou « polymérisation radicalaire » (Figure 10).
Figure 10 : Mécanismes de polymérisation plasma proposé par H. Yasuda
Ainsi la fragmentation de la molécule est progressive en fonction de l’augmentation de l’énergie fournie. Le modèle de Yasuda suggère la possibilité d’avoir un contrôle sur la fragmentation du précurseur en contrôlant l’énergie fournie à la phase plasma.
II - 1.e. Le modèle de Stille
Le modèle de Stille est basé sur la polymérisation du benzène [113]. Il montre que la polymérisation fait intervenir une déshydrogénation du cycle phényle pouvant permettre d’obtenir une dimèrisation de celui-ci. Un excès d’énergie fournie au système entraîne une fragmentation excessive du précurseur et donne lieu à des polyrecombinaison produisant des polymères plasmas n’ayant plus de point commun avec le précurseur initial. Cette fragmentation se traduit par exemple par l’ouverture du cycle phényle avec l’obtention d’un hexatriène portant deux radicaux et permettant la polymérisation d’un précurseur à base de triène (Figure 12).
35
Figure 11 : Mécanismes de polymérisation plasma pour le benzène proposé par J.K. Stille.
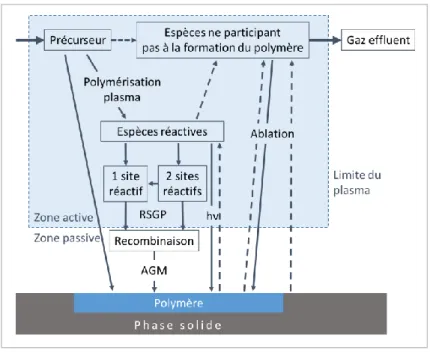
II - 1.a. Le modèle « Activated Growth Mechanism » d’Agostino
R. d’Agostino propose quant à lui un modèle qui décrit les mécanismes de croissance du film mince sur le substrat [114]. Il détaille son mécanisme en six étapes différentes. La première étape décrit la collision d’une molécule de précurseur avec un électron. Cette collision génère un radical (Figure 12 - 1). En parallèle, le bombardement de la surface par des ions influencent la croissance du film mince et peut, le cas échant, créer des défauts qui se caractérise par une diminution de l’énergie d’activation (Figure 12 - 2). Les radicaux créés dans la phase gazeuse peuvent alors soit réagir directement avec la surface activée (Surface*) (Figure 12 - 3) soit polymériser dans la phase gazeuse pour donner des oligomères (Figure 12 - 4). Ces oligomères peuvent alors réagir directement avec la surface pour participer à la croissance du film (Figure 12 - 6) ou s’agglomérer pour former de la poudre qui viendra ensuite participer à la croissance (Figure 12 - 5).
Figure 12 : Mécanismes de polymérisation plasma « Activated Growth Polymerization » proposé par R. d’Agostino.
36
Le film polymère ainsi créé ne possède pas ses propriétés définitives après la réaction des différents radicaux sur les sites actifs de la surface. Le flux d’ions qui est toujours effectif à la surface, produit de nouveaux sites actifs au cours du temps en rompant les liaisons chimiques à l’intérieur du polymère. Il est également acteur au niveau de la diffusion des espèces sur la surface et de l’échauffement de celle-ci. Ces mécanismes sont à l’origine de la densification du réseau polymère. A de hautes énergies, le flux d’ions peut considérablement modifier la structure du film mince jusqu’à dénaturer complétement sa chimie par rapport au précurseur, en générant des bombardements d’atomes, des stress et des réarrangements importants dans la structure.
II - 1.b. Le modèle « pulsé »
Les mécanismes liés à la polymérisation plasma restent encore très discutés avec la parution régulière de nouvelles approches, comme en témoigne des discussions récentes, notamment celles de Short, Hegemann et d’Agostino et al. [115][116][117][118]. Néanmoins les différents auteurs se retrouvent sur un même constat : la structuration finale du polymère plasma est directement liée à la puissance fournie au système. Une puissance faible conduit à une structure régulière, bien définie avec un très fort pourcentage de rétention de la structure du précurseur au sein du film mince.
C’est sur ce constat que le mode de polymérisation plasma en mode pulsé ont été développées notamment par H.J. Tiller [119], H. Yasuda [120][121], R.B. Timmons [122][123], J. Badyal [124] et V. Roucoules [125,126]. Il consiste à délivrer une puissance fournie à une fréquence fixe et pendant un temps donné. La fréquence correspond à (Equation(10)) :
𝒇 =
𝟏(𝒕𝒐𝒏+ 𝒕𝒐𝒇𝒇)
où ton représente le temps pendant lequel la puissance du générateur est fournie au système (durée de l’impulsion électrique) et toff le temps pendant lequel aucune puissance n’est fournie. Lors d’un fonctionnement en mode pulsé, il est possible de calculer la puissance réelle fournie grâce à l’expression (Equation (11)) :
𝑾 = 𝑾
𝑮[
𝒕𝒐𝒏(𝒕𝒐𝒏+ 𝒕𝒐𝒇𝒇)