HAL Id: tel-03092254
https://tel.archives-ouvertes.fr/tel-03092254
Submitted on 2 Jan 2021HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
B non-Hodgkiniens, établissement d’un modèle d’étude
en 3D.
Simon Latour
To cite this version:
Simon Latour. Rôle des protéines Orai1 et STIM1 dans les lymphomes B non-Hodgkiniens, établisse-ment d’un modèle d’étude en 3D.. Autre [q-bio.OT]. Université de Bordeaux, 2018. Français. �NNT : 2018BORD0038�. �tel-03092254�
Thèse présentée Pour obtenir le grade de
Docteur en Sciences de
L’UNIVERSITÉ DE BORDEAUX
École doctorale des Sciences de la Vie et de la Santé Spécialité Biologie Cellulaire et Physiopathologie
Présentée et soutenue publiquement par
Simon LATOUR
Rôle des protéines Orai1 et STIM1 dans les lymphomes B
non-Hodgkiniens, établissement d’un modèle d’étude en 3D.
Sous la direction du Dr. Laurence Bresson-Bépoldin
Soutenue le 26 mars 2018
Membres du jury :
Pr. Jean-Philippe MERLIO PU-PH, Université de Bordeaux Président Dr. Corinne ALBIGES-RIZO DR CNRS, Université de Grenoble Rapporteur
Dr. Bruno CONSTANTIN DR CNRS, Université de Poitiers Rapporteur
Dr. Pierre NASSOY DR CNRS, Université de Bordeaux Examinateur
« C'est avec la logique que nous prouvons et
avec l'intuition que nous trouvons »
Remerciements
A ma directrice de thèse,Laurence, tu as été mon encadrante pendant 4 ans et aujourd’hui, c’est une page qui se tourne. Tout au long de cette période, tu m’as inculqué ta vision de la recherche et tu as été un véritable mentor. Ta disponibilité, ton enthousiasme, ton expertise et ta confiance m’ont accompagné pendant ces quatre belles années et m’ont fait grandir aussi bien professionnellement qu’humainement. Nos débats, souvent après 19h, où s’affrontaient ton optimisme sans limite et mon scepticisme pas toujours mesuré (maintenant je peux le reconnaître) vont cruellement me manquer. Aujourd’hui, je n’ai qu’une seule chose à te dire : MERCI pour tout.
Ps : Tu noteras qu’après quatre ans, j’ai enfin réussi à te tutoyer.
Aux membres du jury,
Pour l’honneur que vous me faites en participant à ce jury de thèse je vous remercie profondément. Merci au professeur Jean-Philippe Merlio qui a accepté de le présider, au docteur Corinne Albiges-Rizo et au docteur Bruno Constantin qui ont bien voulu juger ce travail, et enfin au docteur Pierre Nassoy qui a accepté de l’examiner.
Aux membres de l’unité ACTION,
Au professeur Pierre Soubeyran, merci de m’avoir permis d’intégrer l’unité que vous dirigez.
A Isabelle, merci pour toutes les coupes et pour la relecture de ce manuscrit. Au bout de 4 ans, je ne mets toujours pas ma blouse, mais ne désespère pas, peut-être que tu arriveras à la faire porter au prochain étudiant de Laurence ^^.
A Valérie, merci pour la relecture de ce manuscrit et pour tous les « bons plans rando Pyrénées ». Maintenant il ne me reste plus qu’à tous les essayer. Bonne route avec les capsules. A tous les stagiaires que j’ai eu l’occasion d’encadrer : Lisa, Hannah, Andréa, Maylis, Alexandre, Gabriel, Dylan, merci pour tout. C’était vraiment enrichissant de « passer de l’autre coté ».
« secrètes » où les potins fusaient.
A Kelly, merci pour ta joie de vivre. Les trois Médocaines avec toi resteront de supers souvenirs ^^. Je viens de réaliser que maintenant, on pouvait t’appeler la sarladaise et ça c’est chouette, mais ne te vexe pas ça n’a rien à voir avec les pommes de terre^^.
A Stéphanie, merci pour ton rire communicatif et pour ne jamais refuser une petite mousse ou un petit burger.
A Vanessa, merci pour ta bonne humeur et ta gentillesse. Je compte sur toi pour me faire un état des lieux régulier de l’avancée des travaux de Bergo.
A Anne-Marie, Audrey, Elodie, Jennifer, Lucile, Lydia, Mojgan, Nicolas, Olivier, Pierre, Sylvia, Tom, Thomas, Vanessa et tous ceux que j’aurais pu oublier, merci pour tous ces bons moments passés au labo.
Aux collaborateurs,
A Sandrine, merci d’avoir accepté de mettre « nos cellules » dans « ton modèle ». Ta bienveillance et ta bonne humeur faisaient passer beaucoup plus rapidement les longues heures nécessaires à ces expérimentations in vivo.
A Floriane et Lamia, merci pour votre aide précieuse pour la réalisation et l’analyse de ces expérimentations in vivo.
A tous les membres du LP2N, c’était vraiment une super expérience de découvrir un autre domaine ou les perceuses et les tuyaux remplacent les plaques 96 puits sur les paillasses (c’était mon ressenti la première fois que j’ai débarqué chez vous). Merci à Dan pour les premières capsules, à Kévin pour les suivantes et à Nelson et Amaël pour les dernières et les futures.
A Gaëlle, merci de m’avoir montré une infime partie de ton savoir dans le domaine de l’imagerie et de m’avoir donné envie de poursuivre dans ce domaine. Le « marathon de l’imagerie » de 17H à 5H du matin au BIC restera un sacré souvenir.
A Karin Tarte, Frédéric Mourcin et Claire Lamaison, merci de m’avoir montré l’importance du microenvironnement dans le lymphome et merci pour les fameuses Resto.
collègue. Merci pour tous ces moments passés ensemble au labo et en dehors. Merci pour toutes ces activités sportives (c’est un peu grâce à toi si aujourd’hui je peux me mesurer à Federer). C’est une belle amitié qui s’est écrite et j’espère que ce n’est que le début. Je profite aussi de ce paragraphe pour remercier Sandrine. Maintenant que j’ai du temps, on va enfin pourvoir faire cette via-ferrata, depuis le temps que tu me le demandes….
A Loïc, merci pour les centaines d’heures passées au téléphone à me raconter les tribulations de l’INCIA. Merci d’être monsieur fléxi-rigidité, Ronald McDonald, le petit bonhomme en mousse et tout ça en même temps. Maintenant je peux te dire la fameuse phrase : « bon alors le prochain c’est toi maintenant ? ».
A la team « la réserve » : Arthur2, Simon2, Laura2, Alex, Manon, Clélia, Maxime, Rodolphe, Alison, Steve et Céline. Toutes ces « chouilles » Nivernaises et ces vacances dans l’Aveyron ont été autant de moments agréables qui permettaient de déconnecter (peut être un peu trop des fois, mais ce qui se passe dans la Nièvre reste dans la Nièvre) et de se ressourcer (je pense que l’on est tous d’accord pour dire que la base du resourcement c’est : des boissons houblonnées et des chansons de Johnny et C. Jérôme). Merci pour tout.
A Florian, merci pour ces week-ends grimpe un peu partout qui permettaient de décompresser tout en se dépensant et en respirant le bon air. Maintenant, il ne nous reste plus que le miroir d’argentine à grimper…
A la bande du fond, merci pour ces belles années sur les bancs de la fac de Clermont. Qui aurait pu prévoir que l’on ferait tous une thèse….
A mes parents et à ma sœur, merci pour votre confiance inconditionnelle, votre soutient dans mes choix ainsi que vos encouragements qui m’ont permis de travailler dans un domaine qui me passionne.
Enfin je tiens à remercier la ligue nationale contre le cancer pour m’avoir financé pendant 6 mois supplémentaires.
Abréviations
-A-
ABC : Activated B-Cell AC : Anticorps
ADCC : Antibody-Dependent Cell-mediated
Cytotoxicity
ADCP : Antibody-Dependent Cell-mediated
Phagocytosis
ADN : Acide Desoxyribonucléique Ag : Antigène
AID : Activation Induced Deaminase AM : Acetoxy Methylster
ARC : Arachidonic Acid-Regulated Calcium Channel ARN : Acide Ribonucléique
ARP 2/3 : Actin-Related Proteins 2/3 ATP : Adénosine Triphosphate
-B-
Bcl-2 : B-Cell Lymphoma 2
Bcl-xL : B Cell Lymphoma Extra Large BCR : B Cell Receptor
BIM : Bcl-2 Like Protein 11 BLNK : B Cell Linker BSA : Bovine Serum Albumine BTK : Bruton Kinase
-C-
c-FLIP : Cellular Flice-Like Inhibitory Protein C3C : Caspase 3 Clivée
CaBP : Calcium Binding Protein CAD : CRAC Activation Domain CAM : Complexe d’Attaque Membranaire
CamKII : Ca2+/Calmodulin-Dependent Protein Kinase
II
CAR : Calcium Accumulating Region
CAR-T cells : Chimeric Antigen Receptors –T cells CBD : Calcium Binding Domain
CC : Coiled Coil
CD : Cluster de différenciation
CDC : Complement-Induced Cell Death Cdc42 : Cell Division control protein 42 CG : Centre Germinatif
CHOP : Cyclophosphamide, Doxorubicine, Vincristine
et Prednisone
Chr : Chromosome
CICR : Calcium-Induced Calcium Release CMD : Crac Modulatory Domain
CMHII : Complexe Majeur d’Histocompatibilité de type
II
CRAC : Calcium Release Activated Channel
CRACR2A : Calcium release activated channel regulator
2A
CSH : Cellule Souche Hématopoietique CTID : C-Terminal Inhibitory Domain
-D-
DAG : Diacylglycérol
DLBCL : Diffuse Large B Cell Lymphoma DMEM : Dulbecco's Modified Eagle Medium
-E-
EBV : Epstein-Barr virus
ECC : Entrée Capacitive de Calcium EDTA : Ethylene Diamine Tetraacetic Acid Edu : 5-Ethynyl-2´-Deoxyuridine
EGTA : Ethylene Glycol-bis(β-aminoethyl
ether)-N,N,N',N'-Tetraacetic Acid
EIF2a : Eukaryotic translation Initiation Factor 2A
ERK : Extracellular Signal-Regulated Kinase ETON : Extended Transmembrane Orai1 N-terminal EZH2 : Enhancer of Zeste Homolog 2
FAK : Focal Adhesion Kinase FDC : Fibroblastic Dendritic Cell
FFPE : Formalin-Fixed Paraffin-Embedded FISH : Fluorescent In Situ Hybridation FRC : Fibroblastic Reticular Cell FSC : Forward-Scattered Light
-G-
GAG : Group-Specific Antigen GAP : GTPases Activating Protein GCB : Germinal Center B-cell
GEF : Guanine-Nucleotide Exchange Factor
-H-
HBSS : Hank's Balanced Salt Solution
HEPES : 4-(2-hydroxyethyl)-1-Piperazineethanesulfonic
Acid
HEV : High Endothelial Veinuls HLA : Human Leukocyte Antigen HRP : Horseradish Peroxidase HTS : High Throughput Screening
-I-
ICAM-1 : InterCellular Adhesion Molecule 1 ICOS : Inducible T-Cell Costimulator IF : Immunofluorescence
Ig : Immunoglobuline IL : Interleukine
IP3 : Inositol 1,4,5-Trisphosphate
IP3R : Inositol 1,4,5-Trisphosphate Receptor ITAM : Immunoreceptor Tyrosine-based Activation
Motif -K- KO : Knock Out -L- LB : Lymphocyte B LF : Lymphome Folliculaire
LFA-1 : Lymphocyte Function-Associated Antigen 1 LIMK : LIM Kinase 1
LLC : Leucémie Lymphoïde Chronique
LNHT : Lymphome Non Hodgkinien T LT : Lymphocyte T
-M-
MALC : Multicellular Aggregates of Lymphoma Cells MALT : Mucosa Associated Lymphoid Tissue MAPK : Mitogen-Activated Protein Kinase MCU : Mitochondrial Calcium Uniporter MEC : Matrice Extra Cellulaire
MLC2 : Myosin Light-Chain 2 MLCK : Myosin Light-Chain Kinase MLCP : Myosin Light-Chain Phosphatase MOI : Multiplicity of Infection
MP : Membrane Plasmique
-N-
NA : Ouverture Numérique
NAADP : Nicotinic Acid Adenine Dinucleotide
Phosphate
NCX : Sodium-Calcium Exchanger Nf-kB : Nuclear Factor-Kappa B
NFAT : Nuclear Factor of Activated T-cell NK : Natural Killer
-O-
OASF : ORAI1 Activating Small Fragment
-P-
PAK : p21 Activated Kinase PBS : Phosphate-Buffered Saline
PBST : Phosphate-Buffered Saline / Tween PD-1 : Programmed cell Death 1
PFA : Paraformaldehyde
PI3K : Phosphoinositide 3-Kinase
PIP2 : Phosphatidylinositol-4,5-Bisphosphate PKA : Protein Kinase A
PKC : Protein Kinase C PLC : Phospholipase C
PMCA : Plasma Membrane Ca2+ ATPase POL : DNA Polymerase
Pyk2 : Prolin Rich Tyrosine Kinase 2
-R-
RE : Réticulum Endoplasmique RhoA : Ras Homolgy member A RHOD : Rhodamine
ROCK : Rho-Associated Protein Kinase ROS : Reactive Oxygen Species RPMI : Roswell Park Memorial Institute RyR : Ryanodine Receptor
-S-
S1P : Sphingosine 1 Phosphate
S1PR : Sphingosine 1 Phosphate Receptor SAM : Sterile Alpha Motif
SARAF : SOCE-associated regulatory factor SCID : Severe Combined Immunodeficiency SDF1 : Stromal Derived Factor 1
SDS : Sodium Dodecyl Sulfate
SERCA : Sarco/Endoplasmic Reticulum Ca2+-ATPase shARN : Short hairpin ARN
SLAM : Signaling Lymphocytic Activation Molecule SMOC : Second Messenger Operated Channel SOAR : STIM1 Orai Activating Region SOCE : Store Operated Calcium Entry SSC : Side-Scattered Light
STAT : Signal Transducer and Activator of Transcription STIM : Stromal Interaction Molecule 1
SVF : Serum de Veau Foetal SYK : Spleen Tyrosine Kinase
-T-
TAM : Tumor Associated Macrophages TCR : T Cell Receptor
Tfh : T Follicular Helper TG : Thapsigargine TG2 : Transglutaminase 2
TGFb : Transforming Growth Factor Beta
TM : Transmembranaire TMA : Tissue Microarrays
TMRM : Tetramethylrhodamine Methyl Ester TNF : Tumor Necrosis Factor
TPC : Two Pore Channel
Inducing Ligand
TRP : Transient Receptor Potential
TRPC : Transient Receptor Potential Canonical TRPM : Transient Receptor Potential Melastatin TRPML : Transient Receptor Potential Mucolipin TRPV : Transient Receptor Potential Vanilloid
-U-
UNG : Uracil DNA Glycosylase UPR : Unfolded Protein Response
-V-
VCAM-1 : Vascular Cell Adhesion Molecule VDAC : Voltage-Dependent Anion Channel VIH : Virus de l’Immunodéficience Humaine VLA-4 : Very Late Antigen 4
VSVG : Vesicular Stomatitis Virus
-X-
Index des illustrations
Figure 1 : Les différentes étapes de développement des lymphocytes B ... 2
Figure 2 : Organisation des locus des gènes des immunoglobulines et structure des immunoglobulines ... 3
Figure 3 : Rôle de la niche médullaire dans la différenciation des lymphocytes B ... 5
Figure 4 : Différentes étapes de la diapédèse des lymphocytes B ... 7
Figure 5 : Organisation du ganglion lymphatique ... 8
Figure 6 : Différentes voies de présentation des antigènes aux lymphocytes B dans les follicules. .... 10
Figure 7 : Cascade de signalisation activée en réponse à la liaison de l'antigène sur le BCR ... 11
Figure 8 : Structure du centre germinatif ... 13
Figure 9 : Représentation schématique du mécanisme de commutation de classe isotypique ... 15
Figure 10 : Comparaison des modes de migration mésenchymateux et amiboïde ... 16
Figure 11 : Voies activées par les RhoGTPases impliquées dans la migration cellulaire ... 19
Figure 12 : Les différents types de LNH selon la cellule d’origine. ... 22
Figure 13 : Classification d’Ann Arbor ... 28
Figure 14 : Structure du Rituximab ... 30
Figure 15 : Mécanismes d'action du Rituximab ... 31
Figure 16 : Intérêt des sphéroïdes en tant que modèle d’étude en cancérologie ... 38
Figure 17 : Schéma explicatif de la technique de la goutte pendante ... 40
Figure 18 : Dynamique et homéostasie calcique intracellulaire. ... 45
Figure 19 : Différents acteurs de la régulation du Ca2+ réticulaire ... 46
Figure 20 : Structure du récepteur à l’IP3 ... 47
Figure 21 : Structure des récepteurs à la ryanodine ... 48
Figure 22 : Structure des pompes calciques ATPase membranaires ... 53
Figure 23 : Structure de l'échangeur Na+ / Ca2+ ... 54
Figure 24 : Entrée de calcium dépendante de seconds messagers ... 56
Figure 25 : Principe de l’ECC ... 58
Figure 26 : Structure moléculaire de STIM1. ... 59
Figure 27 : Structure de STIM2 ... 61
Figure 28 : Structure moléculaire de Orai1 ... 62
Figure 29 : Structure du canal Orai1 et de son pore ... 63
Figure 30 : Comparaison des structures d’Orai1, Orai2 et Orai3 ... 64
Figure 33 : Voie intrinsèque et voie extrinsèque de l'apoptose ... 76
Figure 34 : Cartes des vecteurs utilisés lors de l’étude. ... 86
Figure 35 : Principe de la mesure de concentration intracellulaire de calcium par la sonde calcique Indo1. ... 90
Figure 36 : Mesure de l’entrée capacitive de calcium. ... 92
Figure 37 : Principe de la mesure de concentration intracellulaire de calcium grâce au Fluo-2. ... 93
Figure 38 : Principe de la mesure de migration cellulaire par la technique de la chambre de Boyden. 94 Figure 39 : Construction d’un TMA ... 99
Figure 40 : Principe de l’analyse des données de TMA issue de la cytométrie à balayage laser. ... 101
Figure 41 : Dispositif de co-extrusion microfluidique utilisé ... 105
Figure 42 : Impact des gouttelettes dans le bain de calcium ... 106
Figure 43 : Mesure du pourcentage de remplissage par analyse d’image ... 108
Figure 44 : Microscopie confocal et reconstruction 3D ... 109
Figure 45 : Evaluation de la croissance des sphéroïdes par imagerie ... 186
Figure 46 : Evaluation de la croissance des sphéroïdes par cytométrie en flux ... 187
Figure 47 : Immunofluorescence C3C / Ki67 sur sphéroïdes ... 187
Figure 48 : Cohésion des sphéroïdes ... 188
Figure 49 : Comparaison de l’expression de la matrice dans des cellules cultivées en suspension ou en 3D ... 189
Figure 50 : Comparaison des effets cytotoxiques de l’étoposide et du cisplatine sur des cellules cultivées en suspension ou en 3D ... 190
Figure 51 : Etude de la diffusion de la doxorubicine dans des cellules HLY1 cultivées en suspension ou en sphéroïdes. ... 191
Figure 52 : Effet supplétif des cellules Resto sur la prolifération des cellules DOHH2 ... 193
Figure 53 : Cohésion des sphéroïdes 2.0 ... 194
Figure 54 : Organisation spatiale des sphéroïdes 2.0 à J6 post-encapsulation ... 195
Figure 55 : Organisation des sphéroïdes au cours du temps ... 197
Figure 56 : Répartition du Matrigel dans les sphéroïdes 2.0 ... 197
Figure 57 : Prolifération des cellules au sein des sphéroïdes ... 198
Figure 58 : Induction du stroma lymphoïde au sein des sphéroïdes ... 199
Figure 59 : Expression des protéines STIM1 et Orai1 dans des cellules cultivées en 2D ou en 3D. . 200
Figure 60 : Croissance des sphéroïdes formés à partir de SUDHL4 sh NT, sh STIM1 et sh Orai1 ... 201
Index des tableaux
Tableau 1 : Caractéristiques des anticorps anti-CD20 de deuxième génération ... 33
Tableau 2 : Avantages et inconvénients des différentes méthodes d’obtention de sphéroïdes ... 41
Tableau 3 : Caractéristiques des différents types de canaux TRP ... 54
Tableau 4 : Vue d'ensemble des différentes mutations gain ou perte de fonction de Orai1 ou STIM1 et pathologies associées. ... 71
Tableau 5 : Caractéristiques des différentes lignées de LNHB utilisées lors de l’étude. ... 84
Tableau 6 : Séquence des shARN utilisés pour la sous-expression de STIM1 et Orai1. ... 86
Tableau 7 : Caractéristiques des différents agents pharmacologiques utilisés lors de l’étude. ... 88
Tableau 8 : Composition des milieux utilisés pour étudier la signalisation calcique. ... 91
Tableau 9 : Liste des différents anticorps primaires utilisés en western blot. ... 97
Tableau 10 : Anticorps utilisés pour les marquages sur TMA ... 99
Tableau 11 : Anticorps utilisés pour les marquages sur sphéroïdes ... 112
Tableau 12 : Comparaison des IC50 de l’étoposide et du cisplatine sur des cellules cultivées en 2D ou 3D ... 190
Table des matières
Remerciements Abréviations Index des illustrations Index des tableaux Introduction ... 1 I. Ontogenèse du lymphocyte B normal ... 2 1) Génération des lymphocytes B immatures : phase indépendante de l’antigène. ... 3 A. Recombinaisons des gènes des immunoglobulines au cours des différentes étapes de différenciation aboutissant à la formation du BCR ... 3 B. Rôle du microenvironnement de la moelle osseuse dans la différenciation des LB. ... 5 2) Maturation des lymphocytes B dans les organes lymphoïdes secondaires : phase dépendante de l’antigène. ... 6 A. Entrée des lymphocytes B dans les organes lymphoïdes secondaires ... 7 B. Structure des organes lymphoïdes secondaires ... 8 C. Présentation des antigènes et activation des lymphocytes B ... 9 a) Activation du BCR ... 10 b) Activation des lymphocytes B par les cellules Tfh ... 12 D. Fin de la maturation des lymphocytes B dans les centres germinatifs. ... 12 a) La zone sombre : lieu de prolifération et d’hypermutation somatique ... 13 b) La zone claire : lieu de sélection et de commutation isotypique ... 14 3) Migration des lymphocytes dans l’organisme ... 16 A. Généralités sur la migration cellulaire ... 16 B. Régulation de la migration des lymphocytes B ... 17 II. Lymphomes B non hodgkiniens : généralités cliniques et biologiques ... 21 1) Définition ... 21 2) Epidémiologie ... 21 3) A chaque stade de développement du lymphocyte B, une pathologie correspondante ... 21 A. Lymphome de Burkitt ... 22a) Description et origines génétiques ... 23 b) Importance du microenvironnement tumoral dans le LF ... 24 C. Lymphomes diffus à grandes cellules B ... 24 a) Lymphome diffus à grande cellules B de type GCB ... 25 b) Lymphome diffus à grande cellules B de type ABC ... 26 D. La leucémie lymphoïde chronique B ... 26 4) Dissémination des lymphomes ... 27 5) Traitement des LNHB ... 29 A. Chimiothérapie conventionnelle ... 29 B. Immunothérapie par utilisation des anticorps anti-CD20 ... 30 a) Anticorps anti-CD20 de première génération : le rituximab ... 30 b) Anticorps anti-CD20 de deuxième génération : exemple du GA101 ... 33 C. Nouvelles approches ... 34 6) Modèles d’étude des lymphomes B non Hodgkiniens ... 35 A. Modèles de lymphomes non Hodgkiniens établis ... 35 B. Modèles émergents : les modèles de culture cellulaire en 3D ... 37 C. Modèles émergeants de lymphome non Hodgkiniens en 3D ... 41 III. Le calcium, un messager ubiquitaire en conditions physiologiques ... 44 1) Homéostasie calcique et encodage du signal calcique ... 44 2) Les différents régulateurs de l’homéostasie calcique dans les cellules non-excitables ... 45 A. Régulateurs réticulaires ... 45 a) Les récepteurs à l’inositol-1,4,5-triphosphate ... 46 b) Les Récepteurs à la ryanodine ... 47 c) Les canaux de fuite ... 48 d) Les pompes calcium ATPase du réticulum endoplasmique ... 48 B. Régulateurs mitochondriaux ... 49 C. Régulateurs lysosomaux ... 50 D. Régulateurs nucléaires ... 51 E. Régulateurs cytoplasmiques ... 51 F. Régulateurs membranaires ... 52 a) Les pompes calciques ATP dépendantes ... 52 b) L’échangeur Sodium / Calcium ... 53 c) Les canaux calciques membranaires ... 54 3) Les différents types d’entrée de calcium dans les cellules non-excitables ... 55 A. L’entrée constitutive de calcium ... 55 B. L’entrée de calcium dépendante de seconds messagers ... 55
4) Les protéines STIM et Orai, acteurs majeurs de l’entrée capacitive de calcium ... 58 A. La famille des protéines STIM ... 58 a) STIM1 ... 58 b) STIM2 ... 60 c) Quel rôle pour quel STIM ? ... 61 B. La famille des protéines Orai ... 61 a) Orai1 ... 61 b) Orai2 ... 63 c) Orai3 ... 64 C. STIM1 et Orai1 acteurs majeurs de l’entrée capacitive de calcium ... 64 a) Activation de STIM1 ... 65 b) Interaction STIM1/Orai1 et ouverture du canal ... 65 c) Régulation des canaux CRAC ... 66 5) Rôle des protéines Orai1 et STIM1 dans les lymphocytes ... 68 A. Dans le contexte physiologique ... 69 B. Dans le contexte pathologique ... 70 IV. Calcium et cancer ... 73 1) Généralités ... 73 2) Role du calcium dans la migration des cellules tumorales ... 74 A. Implication du calcium dans la migration cellulaire ... 74 B. Rôle de Orai1 et STIM1 dans la migration des cellules tumorales ... 75 3) Rôle du calcium dans l’apoptose des cellules tumorales ... 76 A. Importance de la signalisation calcique dans le processus d’apoptose ... 76 B. Rôle des protéines Orai et STIM1 dans l’apoptose des cellules tumorales ... 77 4) Rôle des protéines Orai1 et STIM1 dans les autres « hallmarks » du cancer ... 79 Problématique et objectifs du travail ... 80 Matériel et méthodes ... 83 I. Modèles d’étude ... 84 1) Lignées de lymphomes ... 84 2) Cellules stromales ... 84 3) Cellules B primaires de Leucémies Lymphoïdes Chroniques ... 85 II. Méthodes de biologie cellulaire ... 85 1) Modification des lignées par transduction lentivirale ... 85 A. Principe ... 85 B. Protocole et vecteurs utilisés ... 85
b) Vecteurs utilisés ... 86 c) Transduction lentivirale ... 87 d) Selection ... 87 2) Pharmacologie utilisée. ... 87 3) Mesure de la mort cellulaire ... 88 A. Par cytométrie ... 88 a) Principe de la cytométrie ... 88 b) Marquage au TMRM ... 88 c) Marquage à l’iodure de propidium ... 89 d) Mesure du clivage de la caspase 3 ... 89 B. Par imagerie ... 89 4) Mesure de l’entrée capacitive de calcium dans une population cellulaire ... 90 A. Principe ... 90 B. Protocole ... 91 C. Analyse des résultats ... 91 5) Mesure de la réponse calcique sur cellules uniques ... 92 A. Principe ... 92 B. Protocole ... 93 a) Protocole de mesure ... 93 b) Pharmacologie utilisée ... 93 C. Analyse des résultats ... 94 6) Mesure de la migration cellulaire en chambre de Boyden ... 94 A. Principe ... 94 B. Protocole ... 95 C. Analyse des résultats ... 95 III. Méthodes Biochimiques ... 96 1) Western Blot ... 96 A. Principe ... 96 B. Protocole ... 96 a) Extraction et dosage protéique ... 96 b) Electrophorèse sur gel SDS-Page et transfert ... 96 c) Détection immunologique des protéines d’intérêt ... 97 2) Immunofluorescences sur Tissues MicroArrays ... 98 A. Principe ... 98 B. Protocole de marquage et acquisition des données ... 99 C. Analyse des résultats ... 100
1) Xénogreffes intrahépatiques : modèle de dissémination ... 101 A. Choix du modèle et avantages ... 101 B. Protocole ... 102 C. Analyse des résultats ... 103 a) Quantification de la dissémination par cytométrie ... 103 b) Quantification de la dissémination par immunohistochimie ... 103 V. Utilisation de la technologie des capsules cellulaires ... 104 1) Obtention des sphéroïdes ... 104 A. Principe ... 104 a) Principe général ... 104 b) Adaptation de la technologie à la culture cellulaire ... 104 c) Dispositif de co-extrusion utilisé et principe de l’encapsulation ... 104 B. Protocole ... 106 a) Préparation des cellules pour l’encapsulation ... 106 b) Encapsulation ... 107 2) Culture des sphéroïdes ... 107 3) Suivi de croissance des sphéroïdes ... 108 A. Mesure de la taille par imagerie ... 108 B. Comptage du nombre de cellules par cytométrie ... 108 4) Etude de l’organisation spatiale des sphéroïdes par microscopie confocale ... 109 A. Utilisation de la microscopie confocale ... 109 a) Principe ... 109 b) Paramètres d’acquisition ... 110 c) Traitement et reconstruction tridimensionnelle des images ... 110 B. Imagerie des sphéroïdes ... 111 a) Utilisation de cellules exprimant la fluorescence ... 111 b) Marquages Immunologiques ... 111 c) Marquage Click-it Eduâ ... 112 C. Limites de l’approche par microscopie confocale ... 112 5) Immunofluorescence sur coupe en paraffine de sphéroïdes ... 113 A. Protocole ... 113 VI. Analyse statistique des résultats ... 114 Résultats expérimentaux et discussion ... 115 I. Rôle de la signalisation calcique dans la réponse au GA101 ... 116 1) Contexte de l’étude ... 116
II. Orai1 et STIM1 contrôlent la migration des cellules de DLBCL ... 154 1) Contexte de l’étude ... 154 2) Article ... 156 III. Etablissement d’un nouveau modèle de LNHB ... 184 1) Résultats expérimentaux ... 184 A. Caractérisation du modèle 1.0 ... 185 a) Croissance des sphéroïdes ... 185 b) Résistance aux drogues des sphéroïdes ... 189 B. Complexification du modèle : vers un modèle 2.0 ... 192 a) Croissance des sphéroïdes ... 192 b) Organisation cellulaire des sphéroïdes ... 194 c) Relation cellules stromales / Lymphocytes B ... 199 C. Etude du rôle d’Orai1 et STIM1 dans un contexte 3D en utilisant le modèle ... 200 2) Discussion ... 202 A. Intérêt du modèle 1.0 ... 202 B. Intérêt du modèle 2.0 ... 205 C. Rôle de STIM1 et Orai1 dans un contexte 3D ... 209 Discussion générale et perspectives ... 211 Annexes ... 220 I. Annexe 1 : Rôle d’Orai1 dans la réponse au Rituximab ... 221 II. Annexe 2 : Brevet modèle de culture 3D de LNHB ... 235 III. Annexe 3 : Revue sur l’intérêt des modèles 3D en cancérologie ... 259 IV. Annexe 4 : Article bioprinting ... 272 Références bibliographiques ... 280
I. Ontogenèse du lymphocyte B normal
Le système immunitaire, dont le rôle est la défense de l’organisme contre les agressions externes et internes, fait intervenir deux types de réponses immunitaires : l’immunité innée et l’immunité adaptative. L’immunité innée repose sur des mécanismes peu spécifiques et sans mémoire alors que l’immunité adaptative est spécifique à un antigène donné et génère une mémoire immunitaire. Les lymphocytes B (LB) constituent les acteurs principaux de la réponse humorale, qui est une composante de la réponse adaptative, basée sur la sécrétion d’anticorps spécifiques d’un antigène par les plasmocytes. En effet, les anticorps sécrétés, en se liant aux antigènes, permettent la neutralisation et l’élimination des pathogènes. Cette sécrétion d’anticorps n’est possible qu’après activation des lymphocytes B par leur récepteur spécifique composé d’une immunoglobuline membranaire : le BCR (B Cell Receptor).
Les lymphocytes B peuvent être séparés en deux populations, les précurseurs B et les cellules B périphériques. Les précurseurs B, regroupant les cellules pré-pro-B, pro-B, et pré-B sont retrouvés dans la moelle osseuse. Les cellules B périphériques, regroupant les lymphocytes B dans des phases de différenciation intermédiaire et les lymphocytes B matures sont, quant à elles, localisées dans les organes lymphoïdes secondaires, la circulation lymphatique et la circulation sanguine. La première phase de différenciation des LB a lieu dans la moelle osseuse où la cellule B acquière un BCR mature, puis le LB migre vers les organes lymphoïdes secondaires où une deuxième phase de maturation dépendante de l’antigène aboutira au stade final de la différenciation : le plasmocyte ou le lymphocyte B mémoire (Figure 1).
Figure 1 : Les différentes étapes de développement des lymphocytes B
Le développement du lymphocyte B s’effectue dans un premier temps dans la moelle osseuse et comprend les stades pré-pro-B, pro-B, pré-B et LB immature. Ensuite le LB immature caractérisé par la présence d’un BCR
mature migre vers les organes lymphoïdes secondaires où il finit sa maturation pour donner au final un plasmocyte ou un lymphocyte B mémoire. Adapté d’après Cambier J-C et al., 20071
Ontogenèse du lymphocyte B normal
1) Génération des lymphocytes B immatures : phase indépendante de
l’antigène.
C’est au cœur de la moelle osseuse que se passe l’hématopoïèse permettant la production des lymphocytes B à partir des cellules souches hématopoïétiques (CSH). En effet, les CSH qui sont à la base de toutes les cellules hématopoïétiques de notre organisme peuvent se différencier en différents progéniteurs dont les progéniteurs des lymphocytes B : les cellules pré-pro-B. Ces progéniteurs subissent différentes phases de différenciation donnant naissance successivement aux cellules pro-B, aux cellules pré-B et enfin aux cellules B immatures. Les cellules B immatures sont caractérisées par la présence d’un BCR spécifique d’un antigène et fonctionnel, c’est-à-dire constitué d’une immunoglobuline membranaire (IgM) associée à un fragment cytoplasmique de transduction du signal formé d’un hétérodimère CD79A/CD79B (ou Iga/Igb).
A. Recombinaisons des gènes des immunoglobulines au cours des différentes étapes de différenciation aboutissant à la formation du BCR
Une immunoglobuline (Ig) est une protéine composée de deux chaînes lourdes et de deux chaînes légères. Chaque chaîne est elle-même composée d’une région variable (site de reconnaissance de l’antigène) et d’une région constante. Les gènes codant pour les chaînes lourdes et les chaînes légères sont organisés en locus sur différents chromosomes (Figure 2).
Figure 2 : Organisation des locus des gènes des immunoglobulines et structure des immunoglobulines (A) Les gènes des chaînes des immunoglobulines sont organisés en locus. Il existe trois locus, un pour les chaînes légères kappa, un pour les chaînes légères lambda et un pour les chaînes lourdes. Ces locus sont composés de différents gènes appartenant à la famille des gènes de variabilité (V, en vert), de diversité (D, en Bleu), de jonction (J, en rouge) et des gènes codant la partie constante des immunoglobulines (C, en jaune). (B) Structure d’une immunoglobuline. L’immunoglobuline est composée de deux chaînes, une lourde regroupant une partie constante ainsi qu’une partie variable constituée des segments VH, DH et JH, ainsi que d’une légère formée
d’une partie constante et d’une partie variable composée des segments JL et VL.
V1 V2 V3 V30 J1Cλ1 J2Cλ2 J3 Cλ3 J4Cλ4 J5 Cλ5 J6Cλ6 Locus des chaines legères λ Chr 22 V1 V2 V3 V65 D1 D2 D3 D27 J1 J2 J3 J4 J5 J6 CμCδ Cγ Cε Cα Locus des chaines lourdes Chr 14 V1 V2 V3 V40 J1 J2 J3 J4 J5 Cκ Locus des chaines legères κ Chr 2 VH DH JH VL JL
A
B
Le locus des gènes des chaînes lourdes des immunoglobulines (IgH) est situé sur le chromosome 14. Ce locus est composé de différents segments organisés en famille de gènes. On retrouve les gènes de variabilité (VH) de diversité (DH) et de jonction (JH) qui constituent la
partie variable de l’immunoglobuline (Ig) et les gènes CH codant la partie constante de l’Ig. Il
existe 9 gènes codant pour les chaînes lourdes, ces gènes définissent 9 isotypes d’immunoglobulines différents, chacun ayant un rôle spécifique dans la réponse immunitaire. Ainsi, les IgG comme les IgA se fixent sur les bactéries et virus, les IgE sont impliquées dans les phénomènes allergiques et les IgM et IgD ont des rôles primordiaux dans l’activation du lymphocyte B.
Il existe deux locus pour les gènes des chaînes légères : les gènes des chaînes légères k (situés sur le chromosome 2) et les gènes des chaînes légères l (situés sur le chromosome 22). Au sein des locus k et l, on retrouve des gènes de variabilité (Vk ou Vl) et de jonction (Jk et Jl) ainsi que des gènes codant pour la partie constante (Ck ou Cl).
Ainsi, à chaque étape de différenciation des LB au sein de la moelle, il y a des réarrangements des différents segments entre eux qui permettent de donner naissance à une grande diversité d’immunoglobulines, spécifiques d’un antigène donné.
Lors du stade pré-pro B, la cellule n’est pas encore engagée de manière définitive dans la voie de différenciation B et ne subit aucun remaniement des gènes des immunoglobulines2,3. Cependant les cellules expriment déjà la protéine CD79A mais sous forme cytoplasmique. Le
rôle de cette protéine essentielle dans la transduction du signal du BCR sera détaillé dans les parties suivantes.
C’est lors du stade pro-B que les premiers réarrangements des gènes des immunoglobulines ont lieu. Un premier réarrangement entre un segment DH et un segment JH
du locus des chaînes lourdes se produit et défini le stade pro-B précoce. Un deuxième réarrangement consistant en l’assemblage d’un segment VH avec les segments DHJH déjà
réarrangés défini le stade pro-B tardif. Une région variable complète et fonctionnelle est ainsi formée. L’ajout du gène codant pour la partie constante permet enfin la synthèse d’une chaîne lourde complète qui reste cytoplasmique. A ce stade la cellule exprime aussi l’hétérodimère CD79A/CD79B4.
C’est au stade pré-B qu’est générée la chaîne légère du BCR. Dans un premier temps, il y a d’abord une pseudo chaîne légère formée par les protéines l5 et V-préB5,6
. Cette pseudo-chaîne légère s’associe avec la pseudo-chaîne lourde pour former le Pré-BCR. Ce dernier est activé par
Ontogenèse du lymphocyte B normal
les cellules du microenvironnement de la moelle osseuse (voir partie suivante), entrainant une diminution de l’expression des gènes codant pour la pseudo-chaîne légère et une augmentation de l’expression des gènes codant pour la chaîne légère7. Il y a ensuite, une recombinaison entre un segment des gènes VL et un segment des gènes JL d’un des locus des chaînes légères donnant
ainsi une chaîne légère complète.
La production d’une chaîne légère complète au stade précédent fait entrer le LB dans le stade LB immature. A ce stade, la cellule exprime une immunoglobuline membranaire (IgM) complète et spécifique d’un antigène. Cette immunoglobuline est associée à l’hétérodimère CD79A/CD79B, formant ainsi le BCR mature
Toutes les étapes de différenciation du lymphocyte B présentées ci-dessus ont lieu dans la moelle osseuse. Le microenvironnement présent dans la moelle n’est pas passif, bien au contraire, il forme une niche essentielle à la différenciation des LB. En effet, il intervient dans la survie des LB au cours de leur développement mais aussi dans la sélection négative à l’issue de leur différenciation.
B. Rôle du microenvironnement de la moelle osseuse dans la différenciation des LB.
La niche médullaire est constituée d’un réseau de cellules stromales fibroblastiques, de cellules endothéliales et de cellules osseuses, chaque type cellulaire de cette niche possédant un rôle spécifique dans le développement des LB (Figure 3).
Figure 3 : Rôle de la niche médullaire dans la différenciation des lymphocytes B
Le microenvironnement au sein de la moelle osseuse joue un rôle essentiel dans la différenciation des lymphocytes B. En effet, les cellules sont d’abord au contact de cellules stromales exprimant la chimiokine SDF1
puis elles changent de partenaire pour interagir avec des cellules stromales exprimant l’IL-7 et enfin elles interagissent avec des cellules stromales exprimant la Galectine-1. Adapté de Clark et al., 20148
CSH Pré-pro B Pro-B Récepteur à l’IL7 Pré-B B immature CXCL12 Cellule stromale CXCL12+
Cellule stromale IL7+
IL7
Cellule endothéliale Galectine 1
Cellule stromale GAL1+
S1RP
S1P
OS
Après la différenciation de la cellule souche hématopoïétique en cellule pré-pro-B, cette dernière entre en contact avec des cellules fibroblastiques réticulaires (FRC) exprimant CXCL12. CXCL12 (ou SDF1) est une chimiokine dont les récepteurs CXCR4 et CXCR7 sont exprimés à la surface de nombreux types cellulaires incluant les lymphocytes B. Nous reparlerons de cette chimiokine tout au long de l’introduction au vu de son rôle central dans de nombreuses étapes du développement du lymphocyte B. Dans la niche médullaire l’expression de SDF1 attire les cellules pré-pro-B au contact des FRC qui favorisent la survie et le développement des cellules pré-pro-B9. Lorsque la cellule pré-pro B se différencie en cellule Pro-B, elle est attirée par un autre type de cellules stromales qui expriment l’IL-7. Ces cellules, exprimant l’IL-7 vont intervenir dans la différenciation des cellules pro-B en cellules pré-B notamment en activant le facteur de transcription STAT58. Puis la cellule pré-B exprimant un pré-BCR change de partenaire stromal pour interagir avec des cellules exprimant la galectine-110. Cette molécule de la famille des lectines active le pré-BCR par liaison au niveau de sa chaîne légère. Une fois activé, le pré-BCR déclenche une cascade de signalisation qui permet la synthèse d’une chaîne légère complète et fonctionnelle entrainant la différenciation en cellule B immature11.
Enfin, la cellule B immature va s’affranchir des contacts avec les cellules stromales de la moelle et rejoindre la circulation sanguine. Ce phénomène est guidé par le S1P (Sphingosine 1 Phosphate) qui est une molécule abondante dans la circulation sanguine. Ce ligand en se fixant sur son récepteur S1PR (Sphingosine 1 Phosphate Receptor) exprimé à la surface des cellules B immatures entraine un remaniement du cytosquelette d’actine permettant aux cellules de passer la barrière endothéliale et de se retrouver dans la circulation sanguine12.
2) Maturation des lymphocytes B dans les organes lymphoïdes
secondaires : phase dépendante de l’antigène.
Une fois que les lymphocytes B immatures se retrouvent dans la circulation sanguine et lymphatique, ils cherchent à entrer dans les organes lymphoïdes secondaires afin de rencontrer l’antigène reconnu spécifiquement par leurs BCR. En effet, si au bout de 48-72H la cellule B n’a pas rencontré d’antigène, elle n’est pas activée et est donc vouée à la mort.
Chez l’homme, il existe plusieurs organes lymphoïdes secondaires tels que la rate, les tissus lymphoïdes associés aux muqueuses (MALT) comme les amygdales et environ 450 ganglions lymphatiques répartis dans tout l’organisme13.
Ontogenèse du lymphocyte B normal
A. Entrée des lymphocytes B dans les organes lymphoïdes secondaires
L’entrée des LB dans les organes lymphoïdes secondaires est guidée par des chimiokines et notamment SDF1.
Les LB peuvent entrer dans les ganglions de plusieurs manières, mais c’est le passage par les veinules endothéliales (HEV) qui est la voie principale. Afin de sortir de la circulation sanguine et rejoindre les organes lymphoïdes secondaires, les lymphocytes doivent effectuer une diapédèse (ou migration transendothéliale) comprenant plusieurs étapes (Figure 4). Dans un premier temps, les lymphocytes s’attachent à la paroi des HEV grâce à des molécules d’adhésion que sont les sélectines. Cet attachement entraine un phénomène de rolling où l’interaction devient de plus en plus forte ralentissant ainsi les lymphocytes et leur permettant d’échapper peu à peu au flux sanguin. Suite à ce phénomène de rolling, il y a une intervention des intégrines qui sont activées par les chimiokines CCL21 et SDF1. Ce sont surtout les intégrines a4b1, a4b7 et aLb2 (ou LFA-1 pour Lymphocyte Function Associated antigen 1) qui sont activées dans le phénomène de diapédèse des LB. L’activation de ces intégrines entraîne un attachement très fort des lymphocytes à la membrane des HEV. La dernière étape de la diapédèse est la traversée de la barrière endothéliale. Pour ce faire, les lymphocytes explorent la surface des HEV grâce à des podosomes résultant du remaniement du cytosquelette jusqu'à trouver une faille afin de se faufiler au cœur de l’organe lymphoïde secondaire14,15. Les mécanismes moléculaires de la migration des LB sont développés dans une partie suivante.
Figure 4 : Différentes étapes de la diapédèse des lymphocytes B
Les LB interagissent dans un premier temps avec la membrane des HEV via les sélectines. Cette interaction entraine le phénomène de rolling qui se traduit par un ralentissement du LB et un échappement au flux sanguin.
L’intervention des intégrines activées par les chimiokines permet ensuite l’adhésion des LB à la membrane des HEV. Une fois adhéré le LB va explorer la surface des HEV pour trouver un point d’entrée dans l’organe
B. Structure des organes lymphoïdes secondaires
Le ganglion possède une structure très organisée. En effet, celui-ci est constitué de trois parties distinctes : la zone médullaire, le paracortex et le cortex (Figure 5). Chaque zone possède une population cellulaire stromale spécifique qui intervient dans les différentes étapes de maturation des lymphocytes B.
Ainsi la zone médullaire est une zone qui contient des lymphocytes B et T, des plasmocytes et des macrophages. Cette zone débouche sur les vaisseaux lymphatiques afférents par lesquels sortent les lymphocytes à l’issue de leur maturation.
Ensuite le paracortex est caractérisé par la présence de cellules dendritiques, de HEV et de cellules stromales de type les FRC (Fibroblastic Reticular Cell). Ces cellules servent de soutien aux lymphocytes B en interagissant directement avec eux et elles les guident vers la troisième zone du ganglion, le cortex, en sécrétant des chimiokines17.
Figure 5 : Organisation du ganglion lymphatique
Le ganglion lymphatique est une structure très complexe et très organisée. Son organisation permet de définir plusieurs zones aux rôles et aux populations cellulaires bien distinctes. On distingue 3 zones principales que
Ontogenèse du lymphocyte B normal
La zone corticale constitue la zone où les lymphocytes B prolifèrent et se différencient. C’est dans cette zone que l’on retrouve les follicules. Il existe deux types de follicules, les follicules primaires où a lieu la présentation de l’antigène aux lymphocytes B et les follicules secondaires (ou centres germinatifs) au sein desquels les LB prolifèrent et finissent leur maturation19. Bordant ces follicules, se trouve la zone T qui contient des lymphocytes T nécessaires au développement des LB. Le cortex, contient également des cellules stromales de type FDC (Folicular Dendritic Cells), qui ont un rôle essentiel dans la survie et la maturation des lymphocytes B. En effet, en sécrétant des chimiokines tels que CXCL13, elles attirent les LB dans les follicules primaires afin de leur présenter des antigènes20. De plus, les FDC secrètent aussi des facteurs tels que le ligand BAFF qui a pour effet de favoriser la survie des lymphocytes B qui sont encore immatures à ce stade21.
C. Présentation des antigènes et activation des lymphocytes B
Afin de rencontrer l’antigène, les lymphocytes B n’ont de cesse de migrer dans tout le ganglion dans le but d’explorer entièrement celui-ci et donc d’augmenter leur chance de rencontrer l’antigène. A ce moment, les lymphocytes B sont donc de véritables explorateurs se déplaçant dans le ganglion à des vitesses pouvant atteindre 6µm/min22.
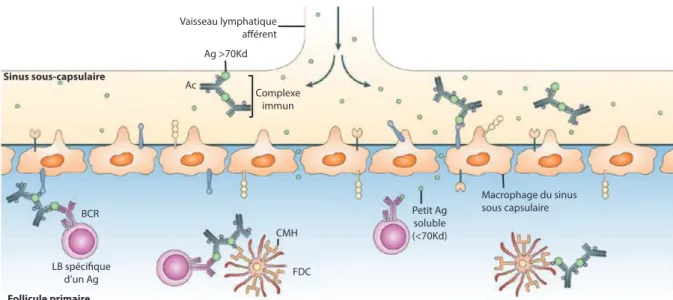
Les antigènes pénètrent dans le ganglion par la circulation lymphatique via les vaisseaux afférents. Une fois à l’intérieur de la capsule, selon leur taille, le mode de diffusion est différent. En effet, les petits antigènes (<70Kd) transitent dans le ganglion à travers un réseau de conduits pour atteindre les follicules où ils sont pris en charge par les FDC qui ont un rôle de cellules présentatrices d’antigènes23. Pour les antigènes de plus grosse taille (par exemple antigènes présentés par un anticorps ou par le système du complément), la diffusion dans les conduits n’est pas possible. Ces antigènes sont alors pris en charge par les cellules du microenvironnement du ganglion spécialisée dans la présentation d’antigènes aux LB (Figure 6).
Les FDC qui présentent les antigènes aux cellules B sous la forme de complexes immuns sont des cellules résidentes des follicules qui ne peuvent pas migrer. Les antigènes de grande taille doivent donc être apportés aux FDC afin qu’elles jouent leur rôle de cellules présentatrices d’antigènes. De manière surprenante, ce sont les lymphocytes B eux même qui transportent les antigènes des macrophages du sinus sous capsulaire aux FDC via leurs récepteurs au complément24.
Figure 6 : Différentes voies de présentation des antigènes aux lymphocytes B dans les follicules. Les antigènes qui pénètrent dans les ganglions par les vaisseaux lymphatiques afférents empruntent différentes voies selon leur mode de présentation et leur taille. Ainsi les petits antigènes diffusent librement dans le follicule
alors que les gros antigènes sont pris en charge par des cellules spécialisées dans la présentation d’antigène que sont les FDC et les macrophages du sinus sous capsulaire. Adapté d’après Batista et al., 200919
Les cellules dendritiques sont les cellules présentatrices d’antigène par excellence. Il existe deux sortes de cellules dendritiques : des cellules résidentes et des cellules qui proviennent de la périphérie des ganglions, là où elles ont capturé l’antigène. Ces cellules provenant de la périphérie exposent l’antigène aux LB sous forme non dégradée à la surface des molécules de CMH de type II (Complexe Majeur d’Histocompatibilité de type II)25,26. Le CMH de type II est un complexe protéique exprimé principalement par les cellules présentatrices d’antigènes. C’est à la surface de ce complexe qu’est exposé l’antigène qui a été préalablement capté par la cellule présentatrice d’antigène.
Enfin, les macrophages résidents dans le sinus sous capsulaire sont eux aussi hautement spécialisés dans la présentation de l’antigène aux cellules B. En effet, ils phagocytent les antigènes circulant dans le sinus sous capsulaire puis les présentent aux cellules B afin de les activer27,28.
a) Activation du BCR
La cellule B reconnait son antigène par liaison de celui-ci à son BCR. Comme décrit précédemment, ce dernier est composé d’une IgM couplée à un hétérodimère CD79A/CD79B.
Ces protéines CD79 possèdent sur leurs séquences cytoplasmiques des domaines ITAM (Immunoreceptor Tyrosine-based Activation Motif) qui sont responsables de la transduction du signal. En effet, après liaison de l’antigène, ces domaines sont phosphorylés par des kinases
LB spécifique d’un Ag BCR FDC Macrophage du sinus sous capsulaire Complexe immun Ag >70Kd Ac Petit Ag soluble (<70Kd) Vaisseau lymphatique afférent Follicule primaire Sinus sous-capsulaire CMH
Ontogenèse du lymphocyte B normal
associées au BCR (notamment Lyn). Les domaines ITAM une fois phosphorylés servent de lieu d’ancrage à des protéines possédant un domaine SH-2. Parmi ces protéines, on retrouve notamment la kinase SYK qui active par phosphorylation BTK (Bruton Kinase) et BLNK (B Cell Linker). L’activation de BTK induit l’activation de la PLCg qui à son tour active la PKC et une entrée capacitive de calcium responsable de l’activation de facteurs de transcription tels que NFAT (voir partie suivante). BLNK va, quant à lui, activer VAV qui à son tour, active les GTPase Rac et la PI3K. De plus, les co-récepteurs CD19, CD21 et CD81 permettent d’amplifier l’activation du BCR29.
Ainsi la liaison de l’antigène sur le BCR induit l’activation de nombreux acteurs moléculaires appartenant à diverses voies de signalisation intracellulaire ayant un rôle dans la survie et la prolifération des lymphocytes B (Figure 7).
Figure 7 : Cascade de signalisation activée en réponse à la liaison de l'antigène sur le BCR
La liaison de l’antigène sur le BCR induit la transduction du signal via l’activation de kinases associées au BCR qui vont phosphoryler les domaines ITAM du dimère Iga/Igb. Ces domaines phosphorylés servent de lieu
d’ancrage aux protéines BTK et BLNK. Ces deux protéines vont à leur tour activer différents acteurs moléculaires impliqués dans les voies de survie et de prolifération des LB. Adapté d’après Cambier et al., 20071
Suite à son activation, le BCR est internalisé et l’antigène lié au BCR est dégradé afin d’être présenté à la surface des molécules du CMH de type 2. Cette présentation de l’antigène à la surface du CMHII permet l’interaction avec les lymphocytes Tfh (Lymphocyte T Follicular
Helper) qui vont favoriser la prolifération et la différenciation des lymphocytes B ayant été
b) Activation des lymphocytes B par les cellules Tfh
L’activation du BCR induit entre autres l’expression par les LB du récepteur CCR7 qui est le récepteur aux chimiokines CCL19 et CCL21. Ces deux chimiokines sont sécrétées par les lymphocytes Tfh dans la zone T. Ainsi, CCL19 et CCL21 attirent les LB dans la zone T où ils interagissent avec les Tfh qui ont été activés par le même antigène. Une fois les deux partenaires associés, une véritable synapse de signalisation se met en place impliquant l’interaction de nombreux ligands avec leur récepteur qui contribuent à la prolifération des LB mais également à leur devenir.
En effet à ce stade, le LB a trois destinées possibles : 1) il peut devenir un plasmablaste extra-folliculaire qui synthétise des IgM de faible affinité. Les anticorps sécrétés par ces plasmablastes servent notamment à former des complexes immuns qui seront captés par les macrophages du sinus sous capsulaire et seront présentés aux LB n’ayant pas encore été activés. Ce devenir est réservé aux LB dont le BCR a une haute affinité pour l’antigène30,31, 2) les LB peuvent devenir des LB mémoires précoces qui ne sont pas issus de la réaction du centre germinatif et qui sont retrouvés dans le sang32,33 et 3) les LB peuvent emprunter la voie du centre germinatif. Cette voie va permettre la génération soit de plasmocytes synthétisant des immunoglobulines avec une très forte affinité pour l’antigène soit de lymphocytes B mémoires.
D. Fin de la maturation des lymphocytes B dans les centres germinatifs.
Les centres germinatifs sont des structures établies par les LB activés par les Tfh. Ces structures sont localisées dans les follicules (un follicule abritant un centre germinatif étant appelé follicule secondaire). Les centres germinatifs sont polarisés et sont constitués de deux parties principales : la zone sombre et la zone claire, chaque zone ayant un rôle spécifique dans les étapes finales de maturation des lymphocytes B menant à la formation d’une cellule B mémoire ou d’un plasmocyte (Figure 8).
Ontogenèse du lymphocyte B normal
Figure 8 : Structure du centre germinatif
Le centre germinatif, structure dédiée aux dernières étapes de la maturation des LB est composée de deux zones : la zone sombre et la zone claire. La zone sombre est le lieu de l’hypermutation somatique et c’est dans cette zone qu‘a lieu la prolifération des LB. La zone claire, quant à elle, a plutôt un rôle de « garde-fou » afin de
sélectionner uniquement les LB ayant une haute affinité pour leur antigène. C’est aussi dans la zone claire qu’a lieu la commutation isotypique. Adapté d’après Heesters et al., 201434
a) La zone sombre : lieu de prolifération et d’hypermutation somatique
Dans la zone sombre du centre germinatif, les LB prolifèrent de manière très importante et subissent un phénomène appelé l’hypermutation somatique. Ce phénomène consiste en l’introduction de mutation dans la partie variable des immunoglobulines afin d’augmenter leur affinité pour l’antigène. Une fois activées et entrées dans le centre germinatif, les cellules B matures vont exprimer l’enzyme AID (Activation Induced Deaminase) qui est responsable de l’hypermutation somatique. En effet, cette enzyme convertie une cytosine en uracile, entrainant un mésappariement des bases reconnu par les systèmes de réparation de l’ADN, dont l’enzyme UNG (Uracil DNA Glycosylase), qui va exciser la base. Le vide laissé par l’excision de la base est comblé par une ADN polymérase à haut taux d’erreur, introduisant ainsi une mutation35, qui engendre une augmentation ou une diminution de l’affinité des immunoglobulines pour l’antigène. A l’issue de l’hypermutation somatique, une diminution de l’expression de CXCR4 (récepteur de SDF1) rend les LB insensibles à SDF1, ainsi ils ne sont plus retenus dans la zone sombre du CG. En revanche, ils continuent à exprimer CXCR5, et vont donc être attirés par le gradient de CXCL13 vers la zone claire du centre germinatif36 (Figure 8).
FDC Plasmocyte LB mémoire LB LT Zone sombre CXCL12 + CXCL13 -CXCL13 + CXCL12 -Zone claire Follicule Hypermutation somatique Prolifération Re-entrée dans le CG Entrée dans le CG Commutation isotypique Selection d’affinité Signaux de survie Signaux de sélection
b) La zone claire : lieu de sélection et de commutation isotypique
La zone claire du centre germinatif a un rôle de contrôle. En effet, c’est dans cette zone que la sélection des LB s’effectue de manière à éliminer les cellules dont le BCR muté ne reconnait pas l’antigène.
La première étape de sélection est basée sur la capacité du LB à reconnaitre l’antigène présenté sous forme de complexes immuns par les FDC. En effet, une synapse se crée entre le LB et la FDC au sein de laquelle les intégrines présentes à la surface des LB (LFA-1 et VLA-4) vont interagir avec leurs ligands respectifs (ICAM-1 et VCAM-1) exprimés à la surface des FDC37. Si le LB n’arrive pas à reconnaître l’Ag présenté par les FDC, il mourra par manque de signaux de pro-survie. Mais, dans les cas où le lymphocyte B reconnaît l’Ag, il va recevoir des signaux de survie de la part des FDC et va donc pouvoir subir la deuxième étape de sélection dépendante des Tfh.
De la même manière que les LB, les Tfh qui expriment CXCR5 sont attirés dans la zone claire du centre germinatif grâce au gradient de CXCL13. Ces Tfh synthétisent de l’IL-21 et de l’IL-4 qui activent des voies de survie chez les LB38. En plus des cytokines, les Tfh secrètent d’autres molécules dont le CD40L, qui en se fixant sur son récepteur CD40 induit l’expression de protéines anti-apoptotiques tels que Bcl-xL et c-FLIP favorisant aussi la survie des LB. Inversement, les Tfh peuvent également envoyer aux LB des signaux apoptotiques, notamment en induisant l’expression de protéines pro-apoptotiques comme Fas. Ainsi, c’est la balance des signaux pro-survie et pro-apoptose émis par le Tfh qui détermine la survie ou la mort des LB. Cette balance de signaux contraires permet donc le maintien de l’homéostasie en limitant le nombre de cellules B finissant leur maturation.
En plus de participer à la sélection des lymphocytes B, les Tfh vont induire le phénomène de commutation de classe isotypique. Ce mécanisme permet de modifier l’isotype des immunoglobulines produites les faisant passer d’un isotype IgM à un isotype IgG, IgA ou IgE. C’est par la sécrétion de différentes cytokines, que les Tfh orientent la commutation isotypique vers l’un ou l’autre des isotypes. En effet, chaque cytokine active un (ou plusieurs) facteur de transcription spécifique, qui se fixe sur des régions en amont des gènes codant les chaînes lourdes : les régions S (Switching region). Ceci entraine le relâchement de la chromatine rendant l’ADN accessible à l’enzyme AID. Comme décrit précédemment, l’enzyme AID modifie des cytosines en uracile à l’origine de cassures double brin après l’action de UNG. Ces cassures activent un mécanisme de réparation de l’ADN qui va exciser toute la séquence comprise entre les deux cassures situées au niveau des régions S39. Ainsi, un seul gène codant
Ontogenèse du lymphocyte B normal
pour la partie constante de l’immunoglobuline est préservé entrainant la commutation de classe isotypique (Figure 9).
Figure 9 : Représentation schématique du mécanisme de commutation de classe isotypique L’enzyme AID induit des cassures au niveau des régions switch situées en amont des gènes codant pour les chaînes lourdes des immunoglobulines. Ces cassures activent un mécanisme de réparation de l’ADN qui excise
toute la partie comprise entre les deux cassures. Les deux régions switch sont ligaturées entrainant la transcription d’ARNm d’IgG1 dans le cas décrit sur cette figure. La partie excisée est circularisée sous forme
d’épisome puis éliminée.
Ainsi par exemple la synthèse d’IL-4 va orienter la commutation d’un isotype IgM vers un isotype IgG1 ou IgE40 alors que la sécrétion de TGFb va entrainer le switch vers un isotype IgA41.
Une fois la commutation isotypique effectuée, les LB se différencient en plasmocytes ou en lymphocytes B mémoire. Cette dernière étape de la différenciation est encore sous le contrôle des Tfh, via notamment la sécrétion d’IL-21 qui active les facteurs de transcription STAT3 et STAT5. C’est la balance d’activation entre ces deux facteurs qui semble déterminer le devenir du lymphocyte B : STAT3 orienterait le LB vers un devenir plasmocytaire, en induisant l’expression de Blimp-142, alors que STAT5 lui orienterait le LB vers un phénotype de type lymphocyte B mémoire43.
Les mécanismes de sortie des plasmocytes et des cellules B mémoires du centre germinatif ne sont pas encore bien identifiés.
VHDHJH Cμ Cδ Cγ3 Cγ1 Cγ2b Cγ2a Cε Cα ARNm IgM VHDHJH Cγ1 Cγ2b Cγ2a Cε Cα C γ3 Cδ Cμ VHDHJH Cγ1 Cγ2b Cγ2a Cε Cα ARNm IgG1 Cμ Cδ C γ3 Episome Induction des cassures par AID dans les régions
switch
Réparation des cassures
3) Migration des lymphocytes dans l’organisme
A. Généralités sur la migration cellulaireLes lymphocytes B une fois dans la circulation sanguine vont continuellement migrer dans tout l’organisme, passant des tissus au sang et inversement, afin d’assurer leurs rôles de surveillance et de défense. La migration cellulaire est un processus universel utilisé par la plupart des cellules de l’organisme lors de leur développement ou de leur différenciation. Plusieurs mécanismes de migration existent dont les deux plus répandues sont la migration mésenchymateuse et la migration amiboïde (Figure 10).
Figure 10 : Comparaison des modes de migration mésenchymateux et amiboïde
Les deux types de migration les plus utilisés par les cellules sont la migration mésenchymateuse et la migration amiboïde. A gauche la migration mésenchymateuse est caractérisée par de fort contact focaux, l ‘émission de pseudopodes et la synthèse de protéases dégradant la matrice extracellulaire. A droite la migration amiboïde est
caractérisée par une très grande déformation de la cellule et peu de contacts focaux. Adapté d’après Pals et al., 200716
La migration mésenchymateuse, qui représente l’archétype de la migration cellulaire (notamment utilisée par les cellules fibroblastiques et les cellules cancéreuses ayant subi la transition épithélio-mésenchymateuse), nécessite plusieurs étapes. : 1) une réorganisation du cytosquelette d’actine entrainant la formation d’un pseudopode, 2) attachement du pseudopode à la matrice extracellulaire (MEC) via des intégrines formant des adhésions focales, 3) la dégradation de la MEC par des enzymes appelées métalloprotéases en arrière des adhésions focales, et 4) l’activation de protéines contractiles telles que la myosine, entraînant une contraction de la cellule, qui ramène la partie arrière de la cellule vers les adhésions focales provoquant ainsi son déplacement. Ce mode de migration est assez lent puisqu’il permet des vélocités de l’ordre de 0.1 à 2µm/min.
La migration amiboïde est totalement différente de la migration mésenchymateuse. Cette migration nécessite très peu d’interactions avec la matrice (pas ou peu de présence d’adhésions focales) et la migration se fait grâce à la grande capacité de déformation des
Migration
mesenchymateuse Migrationamiboide Protéase
Ontogenèse du lymphocyte B normal
cellules qui utilisent ce mode de migration, comme les lymphocytes. Ce mode de migration permet des déplacements très rapides puisque les cellules peuvent se déplacer à des vitesses atteignant 30µm/min.
Les lymphocytes B n’ont de cesse de migrer lors de leur différenciation et tout au long de leur vie. Ainsi la régulation de la migration des LB est essentielle à l’ontogénèse de ceux-ci mais aussi à leur fonction au sein de l’organisme.
B. Régulation de la migration des lymphocytes B
Les lymphocytes ne migrent pas de manière aléatoire dans l’organisme. En effet, il existe un phénomène dit de « homing » permettant aux LB de sortir de la circulation à un site précis. Ce phénomène est dépendant des chimiokines sécrétées sur ce site et des récepteurs exprimés par les LB. Parmi toutes les chimiokines impliquées dans ce phénomène, c’est clairement SDF1 qui constitue le régulateur majeur. Le homing de LB fait intervenir un grand nombre d’acteurs intracellulaires impliqués dans la modulation de l’adhésion et de la réorganisation du cytosquelette, résultant de la liaison des chimiokines à leurs récepteurs.
Les récepteurs aux chimiokines sont des récepteurs à 7 domaines transmembranaires couplés aux protéines G. Lorsqu’une chimiokine se lie à son récepteur, les différentes sous-unités de la protéine G vont être activées. CXCR4, récepteur de SDF1 est couplé à une protéine G de type Gai, ainsi les sous-unités Gai et Gbg vont chacune activer des voies de signalisation différentes.
L’activation dans les LB de la sous-unité Gai après fixation de SDF1 sur CXCR4
entraine l’activation de Src, une tyrosine kinase qui active à son tour la protéine FAK44. Cette protéine a surtout été étudiée dans les cellules adhérentes, migrant selon un mode mésenchymateux. En effet, dans ces cellules de nombreux travaux ont montré que FAK était impliqué dans l’activation des intégrines et la formation de protrusions et d’adhésions focales45. L’implication de FAK dans la migration des LB est beaucoup moins décrite. Une étude a tout de même montré que l’activation de FAK par SDF1 était impliquée dans la rétention des cellules B dans la moelle osseuse au cours de leur différenciation et que la durée d’activation de FAK déterminait la capacité d’adhésion des LB à VCAM-146. Une autre étude de la même équipe a montré que l’activation de FAK par SDF1 était aussi impliquée dans le chimiotactisme des précurseurs hématopoïétiques47.