HAL Id: jpa-00206369
https://hal.archives-ouvertes.fr/jpa-00206369
Submitted on 1 Jan 1966
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-entific research documents, whether they are
pub-lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diffusion de documents
scientifiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
recherche français ou étrangers, des laboratoires
publics ou privés.
Changements de phase du gallium à la pression
atmosphérique
Louis Bosio, André Defrain, Israël Epelboin
To cite this version:
Louis Bosio, André Defrain, Israël Epelboin. Changements de phase du gallium à la pression
at-mosphérique. Journal de Physique, 1966, 27 (1-2), pp.61-71. �10.1051/jphys:01966002701-206100�.
�jpa-00206369�
61.
CHANGEMENTS DE PHASE DU GALLIUM A LA PRESSION
ATMOSPHÉRIQUE
Par L.
BOSIO,
A. DEFRAIN et I.EPELBOIN,
Laboratoire dePhysique
desLiquides
etd’Électrochimie,
Département
des RecherchesPlysiques,
Faculté desSciences,
Paris. Résumé. 2014Après
avoirsignalé
l’importance
du choix des échantillons de faible volumedans l’étude de la
germination
dans legallium
liquide,
on montre que les conditions de lagermination
homogène
sont réalisées vers 2014 123 °Cpour certaines
gouttelettes
provenant de
J’émulsion du métal
liquide ;
laphase
solidequi
apparaît
est alors la forme métastableGa03B2
et l’on mesurel’enthalpie
libre interfaciale entre leliquide
et un germe deGa03B2.
Ces échantillonsliquides
ne cristallisentqu’exceptionnellement
en la forme stableGa03B1,
mais on peut aussi obtenir une deuxièmephase
solide métastableGa03B3
dont on déterminequelques propriétés physiques.
Par leurs
paramètres
thermodynamiques,
les formesGa03B2
etGa03B3
sont identifiéesrespecti-vement aux formes Ga II et Ga III stables à haute
pression.
Des considérations sur larègle
des
degrés
d’Ostwald permettent dejustifier
l’obtention de ces formes métastables àpartir
des états
liquide
ou vapeur. Abstract. 2014 Afterpointing
out theimportance
of the choice of small volumesamples
inthe
study
of nucleation inliquid gallium,
the authors show thathomogeneous
nucleationcon-ditions are obtained at 2014 123 °C for
droplets resulting
from the emulsion of theliquid
metal. The solid
phase
which then appears is the inetastable formGa03B2 ;
the free interfacialenthalpy
between theliquid
and aGa03B2
nucleus is measured. Thèseliquid samples
crystal-lise
only
exceptionally
in the stable formGa03B1
but it ispossible
to obtain a second solidmetas-table form
Ga03B3
of which somephysical
characteristics are determined. From theirthermo-dynamic
parameters, the formsGa03B2
andGa03B3
arerespectively
identified with the forms Ga IIand Ga
III,
stable athigh
pressure. Theproduction
ofthese
metastable forms fromliquid
or vapour states isproved by
the Ostwalddegree
rule.LE JOURNAL DE PHYSIQUE 27, JANVIER-FEVRIER 1966, PAGE
Introduction.
- La surfusion d’une substancemaintenue
liquide
à unetempérature
inférieure àson
point
de fusion11f
cesse avecl’apparition
dupremier
cristalqui
donnera naissance à laphase
solide.L’expérience
montre que la formation dupremier
cristal est leplus
souvent favorisée par laprésence,
dans leliquide,
departicules
étrangères
ausystème
et constituées par desimpuretés
solubles ouinsolubles. La
germination
est alorshétérogène
paropposition
à lagermination homogène qui
sepro-duirait dans un
liquide
idéalement pur,débar-rassé de toute surface solide
étrangère
promotrice
dela
germination.
La teneur en
impuretés
insolubles del’échan-tillon étudié conditionnant fortement la nature
de la
phase
solidequi
apparaît,
nous montreronssous
quelle
forme cristallise legallium liquide
maintenu en surfusion. Les variétés cristallines métastables seront identifiées aux formes stables à haute
pression
et à cellesqui proviennent
de lacondensation de la vapeur de
gallium.
Ontrou-vera par ailleurs
[1]
des détails sur lapartie
expérimentale
de ce travail.Germination
àpartir
de laphase liquide.
-Lorsqu’un
cristal,
contenant nparticules
devolume v,
apparaît
dans unliquide,
la variationd’enthalpie
libre dG dusystème
est donnée[2]
parla relation
dans
laquelle n 0~,
=n(pi
-[.le) représente
lava-riation du
potentiel chimique,
~,1 et p sontrespec-tivement les
potentiels chimiques
d’un atome dans lesphases
liquide
etsolide, a
est un facteur de formequi dépend
de lagéométrie
du germequi apparaît
et a est
l’enthalpie
libre interfacialerapportée
àl’unité de surface entre le solide et le
liquide.
Lorsque
ncroît,
la fonction AG =f(n)
passe par un maximum 6.G*
qui
définitl’enthalpie
librecri-tique.
- Si n
n’~,
la théorie des fluctuations[3]
prévoit
que depetits
agrégats
d’atomes se formentpar
hasard,
mais ilsdisparaissent
puisque
leurcrois-sance
correspondrait
à uneaugmentation
del’en-thalpie
libre.Par contre, si n >
n*,
lesagrégats
correspondants,
appelés
germessupercritiques,
pourront
croître.Cependant,
la croissance d’unagrégat
suppose un transfert des atomes duliquide
à la surface de cetagrégat
et nécessite une certaineénergie
d’acti-vation A Uqui
dépend
de la diffusion ou de la visco-sité de laphase
liquide.
On sait[31
que la vitesse degermination
J,
c’est-à-dire le nombre de germesapparaissant
par unité detemps
et parunité
de volume à latempérature
T,
est donnée par larela-tion :
k est un coefficient
cinétique qui dépend
de lasubstance et est la constante de Boltzmann. Pour les
métaux,
la mobilité des atomes estgrande
et leterme exp
[-
voisin de1,
si bien que lavitesse de
germination
est donnée par :Nous nous limiterons au cas des métaux pour
lesquels
la vitesse de cristallisation est trèsgrande
aux
températures
considérées[4].
L’étude de lavariation de J en fonction de la
température
montrequ’au-dessous
dupoint
de fusionTf
etjusqu’à
unecertaine
température
To,
la vitesse degermination
est
pratiquement
nulle et le métalpeut
êtrecon-servé en surfusion
pendant
untemps
illimité. L’in-tervalle detempérature
compris
entreTf
etTo
définit le domaine de métastabilité d’Ostwald. En
explicitant A G* [2]
la relation
(2)
s’écrit,
enpremière
approximation :
où B est une constante
caractéristique
de lasubs-tance, son
expression
étant :dans
laquelle
Lf
désigne
la chaleur latente de fusion.Lorsque
lagermination
esthétérogène,
le travail de formation du germe est diminué par laprésence
des
impuretés
insolubles « actives », car la vitesse degermination
Js[2J
est alorségale
à :où
g(6)
-(1-
cos8) 2 (2
+
cos6)/4
est unefonc-tion de
l’angle
de raccordement 6 entre le germe etl’impureté
au sein duliquide.
Surfusion et
germination
dugallitim. -
Legallium,
dont la f orme stable à lapression
atmo-sphérique
Gaa
(ou
GaI)
fond àTa
=29,78 °C,
reste facilement ensurfusion,
probablement
[5]
àcause de sa structure cristalline assez
particulière :
ainsi,
lorsqu’une
masseliquide
dequelques
grammes a été chauffée vers 100 °C dans une solution diluée d’acidechlorhydrique,
la solidification ne seproduit
que vers 2013 40 OC. Mais il existe une relation entrela
température
T+ àlaquelle
leliquide
a été chauffé au-dessus dupoint
de fusion et latempérature
T- àlaquelle
cesse la surfusion[6J.
Cette relation entre T+ et 7’-
s’explique
par laprésence,
dans lesystèmes,
d’impuretés
que Danilov[7] appelle impuretés
« artificiellement actives »,c’est-à-dire
d’impuretés qui
ne deviennent promo-trices de lagermination
que si elles ont étépréala-blement en contact avec la substance solide. Au
contraire,
uneimpureté
« naturellement active » estune
impureté qui
catalyse
lagermination
sansacti-vation
préalable.
On a montré que, dans le cas dugallium [8]
comme dans celui du bismuth[9]
lesimpuretés
naturellement et artificiellement activessont des
produits
d’oxydation
de ces propresmétaux.
En étudiant la surfusion de masses de
plusieurs
grammes de
gallium,
nous avonssignalé [10J
que leliquide pouvait
cristalliser en une forme solide métastable fondant àTg
= --16,3
°C : legallium
~.
Avec des masses de
plusieurs
grammesl’apparition
de cettephase
est unphénomène
très aléatoire àmoins que le
liquide
ne contienne des traces deplomb
ou d’étain[11].
Nous avons étudié ensuite lasurfusion d’échantillons de
quelques
microgrammes
environ,
dans le but d’obtenir desgouttelettes
exemptes
d’impuretés
insolubles. Eneffets,
considé-rons une masse
liquide
deplusieurs
grammesconte-nant mo
impuretés
insolubles favorisant lasolidifi-cation de la substance. Si l’on divise cette masse en m
gouttelettes
isolées les unes des autres et sim » mo, la
probabilité
pour unegouttelette
d’êtreexempte
d’impuretés
insolubles est trèsgrande,
etpar
conséquent
celle de réaliser les conditions de lagermination homogène
l’est aussi.Pratiquement
cettedispersion
s’obtient enagitant
la massemétal-lique
liquide
dans unephase
continue contenant unagent
émulsifiant ;
dans laplupart
de nosexpé-riences la
phase
continue est l’alcooléthylique
etl’agent
émulsifiant l’oléate desodium ;
lesgoutte-lettes que nous choisissons ont des diamètres
qui
s’échelonnent entre 10 et 800Pour déterminer les
changements
dephase
dans ceséchantillons,
nous avonspréféré [1]
aux méthodesdilatométrique [13]
ouoptique [12]
uneméthode de
microanalyse
thermique
différentielledont la
description
a été donnée par ailleurs[14].
Dans certains cas, la tensionprélevée
aux bornes desthermocouples
montés enopposition
a étéamplifiée
par unamplificateur
à courant continuayant un
gain
de 104. Cedispositif [1]
permet
alors de déceler desquantités
de chaleur de l’ordre de 2 X 10-8 caloriescorrespondant
à la chaleur miseen jeu
à la solidification d’unegouttelette
degallium
de 10 yni de diamètre. Unegouttelette liquide
pro-venant de l’émulsion est donc
disposée
sur l’une dessoudures du
couple thermoélectrique
et l’ensembleest refroidi.
En
général,
la solidification seproduit,
suivant leséchantillons,
entre -- 60 et --123 °C[1].
Outre le fait que le domaine detempérature
danslequel
le métalliquide
reste en surfusion estgran-dement
augi»enté -
plus
de L50 °C en dessous dupoint
de fusionTex
dugallium x
- le résultat leplus
caractéristique
est que laphase
solidequi
apparait
dans la presque totalité des cas est la forme
métas-table
Gap.
Si l’échantillon a un volume V et si t est le
temps
nécessaire pour que cesse la surfusion à une
tempé-rature
T,
lafréquence
degermination I,
c’est-à-dire le nombre de germesapparaissant
par unité detemps, est
proportionnelle
à :Si I est constant, on voit
qu’une
relationappelée
«
isocinétique
»[15]
doit exister entre le volume Vet la
température
T.Cependant,
cetteinterpré-tation suppose
qu’à
toutinstant,
unepopulation
d’agrégats
existe dans laphase
liquide ;
Buckle[16]
a montré
qu’au
début de latransformation,
il se passe untemps
de relaxation Tpendant lequel
la concentrationd’équilibre
s’établit : cet auteuradmet que T est voisin du
temps
expérimental t
etest défini par le
rapport
du nombre d’atomes ni parunité de volume du
liquide
à la vitesse degermi-nation, T
=ni[J
et il en déduitque la
température
de solidification est
pratiquement indépendante
du volume.Si l’on divise en m
gouttes
de même volume une masse initiale contenant moparticules
ensuspen-sion,
ilapparaît
que : - Sim » mo, la
germination
doit êtrehomogène
dans la
plupart
desgouttes
choisies,
la courbe don-nant latempérature
T de solidificationspontanée
sera
représentée
par ab(fig.
- Si m« mo, les
gouttes
contiennent au moinsune
impureté
et lagermination
esthétérogène
(courbe
ce).
- -
Enfin,
si in ~ ino, les échantillons cristal-lisent àn’importe quelle
température
comprise
entreles
températures
définiespar b
et c. Cette interpré-tation suppose que lesimpuretés
non solubles sontde même nature et elle ne tient pas
compte
de laconcentration dans
chaque
goutte ;
enréalité,
iln’y
aura pas de discontinuité mais une courbe dont l’allure estreprésentée
par b’c’[15].
Sur la
figure
1 b sontportées
lestempératures
minimales degermination
spontanée
en fonction du diamètre desgouttelettes
degallium,
ces diamètresétant
compris
entre 10 ynx et 1 mm. Sur la por-tion a’b’ de lacourbe,
latempérature
de cristalli-sation d’un même échantillon estreproductible
à~
1 °C alors que pour des échantillons de diamètressupérieurs
à 80 (l.n1 ladispersion
destempératures
peut atteindre 30 °C. Des résultats absolument
identiques
ont été obtenus avec des émulsions où leséchantillons étaient entourés d’un filiii de nature
différente
[1]
et nous pensons que les conditions de lagenmination homogène
ont été réalisées pour lesFie. 1. -
a) Influence
du diamètre desgouttelettes
surla
température
àlaquelle
cesse la surfusion(d’après
[15]).
b)
Courbeexpérimentale
relative augallium.
gouttelettes
de diamètreinférieur
à 80 Vm ; au delà de 80 vm lagermination
devienthétérogène.
Jusqu’ici
nous n’avons considéré que latempé-rature à
laquelle
cesse la surfusion sans tenircompte
de la f orme solide
qui
apparaît ;
précisons cependant
qu’aux
températures
qui correspondent
à lapor-tion a"b’ de la
courbe,
nous avonstoujours
obtenu la forme métastableGap qui
fond à- 16,3
°C.L’enthalpie
libre interfaciale. --L’expression
(7)
de la
fréquence
degermination
relative àGap
montre que, pour un échantillon
donné,
il existe une relation entre letemps t
nécessaire à lagermi-nation de l’échantillon de volume V et la
tempé-rature à
laquelle
la solidification seproduit.
On a donc un moyen de déterminerl’énergie
libreinter-faciale
rapportée
à l’unité de surface entre un germe deGa3
et leliquide.
Dans cetteexpression,
on ne tient pascompte
de l’influence de la courbure dugerme sur la valeur de
l’enthalpie
libreinterfaciale ;
on
peut
rappeler
les étudesthéoriques
de Tolman[17]
et Kirkwood et Buff
[18] qui
proposent
la relation : a =7o/[l
-i- entre lesenthalpies
libres super-ficielles 6o pour une surfaceplane ~r
==00)
et a64
pour un germe de rayon r, 8 étant voisin de 1()-8 cm.
Un échantillon de diamètre inférieur à 80 pLm et cristallisant
spontanément
vers - 120 °G estdis-posé
sur la soudure d’undispositif
de mesurether-mique
différentielle,
puis immergé
dans un bainmaintenu à différentes
températures
T constantes à~
0,02
°C. On mesure letemps
nécessaire à la cristallisation de l’échantillon[11.
Sur la
figure
2 nous montrons, à titred’exemple;
la variation de
Log
(t
estexprimé
ensecondes)
en fonction
T)2
pour un échantillon dediamètre
égal
à28,5
pLm.’
FIG. 2.
- Variation deLog
i jt
~t
étantexprimé
en([secondes)
en fonction de10 /T(7’p - T~ .
Pour différents échantillons de diamètres
com-pris
entre 19 et 53 {.Lm, nous avons trouvé :Turnbull a établi
[19]
quel’enthalpie
libreinter-faciale d’une substance est sensiblement propor-tionnelle à
Lt
etp 2/3
siLf
et p sontrespectivement
la chaleur latente de fusion et la masse
volumique
du solide. A
partir
de 6p =38,1
ergs/cm2,
onpeut
donc déterminer un ordre de
grandeur
del’énergie
interfaciale 6a entre un germe de la forme stable oc
et le
liquide.
On trouve sa ~ 77ergs/cm2.
La relation
(3)
permet
de calculer lerapport
=
0,7
del’enthalpie
librecritique
desgermes de
Gap
à celle des germes deGaa
vers 158 OK.Comme AGp
il en résulte que lafréquence
degermination
Ig
estsupérieure
àla.
- Dans le domaine de
température
où lagermi-nation est
homogène,
la cristallisation duliquide
en laphase
Ga0153
sera doncexceptionnelle,
laprobabilité
pourqu’un
germe degallium ~ apparaisse
étantbeaucoup
plus grande.
Ce fait est confirméexpéri-mentalement : sur 1 500 essais effectués sur des
échantillons
différents,
la forme a, c’est-à-dire laforme normale
stable,
n’estjamais
apparue.La forme
cristalline
MISE ENÉVI-DENCE. - En
opérant
[20]
sur certains échantillonsde diamètre inférieur à 800 pLm, nous avons
parfois
observé les
phénomènes
thermiques
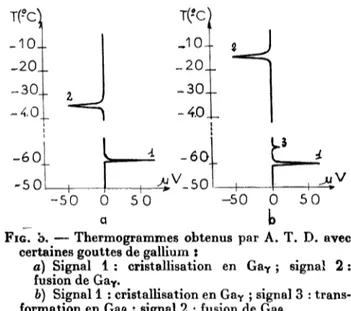
suivants(fig. 3).
FiG. b. -
Thermogrammes
obtenus par A. T. D. aveccertaines
gouttes
degallium :
a) Signal
~. : cristallisation enGay ;
signal
2 : fusion deGay.
b) Signal
1 : cristallisation enGay ;
signal
3 :trans-formation en
Gap ;
signal
2 fusion deGag.
A une
température
comprise
entre - 60 et-105 °C,
il seproduit
undégagement
de chaleur(signal
1,
fig.
3a)
qui correspond
à la solidification duliquide ;
or, parréchauffement,
on remarque unpic
endothermique (signal 2)
à -35,6
°C,
aucunautre
phénomène
n’est observé auxtempératures
supérieures,
enparticulier
à -16,3
°C(point
defusion du
gallium ~),
ni à29,78
°C(point
de fusiondu
gallium a).
Avec ces mêmes
gouttes,
nous avons très souventobservé, après
unpremier pic
exothermique (signal
1fig. 3b)
qui correspond
à la solidification duliquide,
un deuxièmedégagement
de chaleur(signal 3)
beau-coupplus
faible que leprécédent ;
dans ce cas, en élevant latempérature
nous obtenons unpic
endo-thermique
à- 16,3
°C(signal 2).
Cette dernièreexpérience
montre que legallium
s’est solidifié en une forme solide(premier
signal
exothermique)
qui
s’est ensuite transformée enGap
et celle-ci fondà -
16,3
OC. Les mêmesphénomènes thermiques
ont été retrouvés avec des échantillons de
gallium
de différentesorigines
et sur des émulsionsoù les
gouttelettes
étaient enrobées par des filmsde natures différentes
[21].
Une deuxième forme métastable de
gallium
fon-dant à -35,6
°C a donc été mise enévidence ;
nousl’appellerons gallium
y. La mesure dequelques
pro-priétés
physiques
et l’étude auxrayons X
CHALEUR LATENTE DE FUSION. - Pour mesurer la
chaleur latente de
fusion,
nous avons utilisé undis-positif
d’analyse thermique
différentielle[22]
assezcomparable
à celui mis en oeuvreprécédemment.
Cependant
l’une des soudures descouples
montés enopposition
a été creusée d’une cavité danslaquelle
lagoutte
degallium
estdisposée.
La chaleur latentede fusion de l’autre forme solide
Gap
connue etégale
à9,1
cal/g [23]
apermis
d’étalonner lecalori-mètre.
A -
35,6
°C,
la chaleur latente de fusion de la forme y dugallium
ainsi mesurée est de8,35 ± 0,15
cal/g.
Les variations
d’entropie
à la fusion desphases
métastables yet p :
AS,
=2,45
cal. mole-1.deg-1
etilSf1
=2,47
cal. mole-1.deg-1,
sontbeaucoup plus
proches
de celles des métaux à structurecompacte
(voisines
de2,2
cal . mole-ledeg-1)
que la variationd’entropie
à la fusion de la forme solide stable/1Sa.
=4,41
cal .deg-1 [24].
VARIATION DE VOLUNIE. - Les variations de
volume
accompagnant
la fusion des échantillonsont été mesurées à l’aide d’un microdilatomètre à
tige
[25].
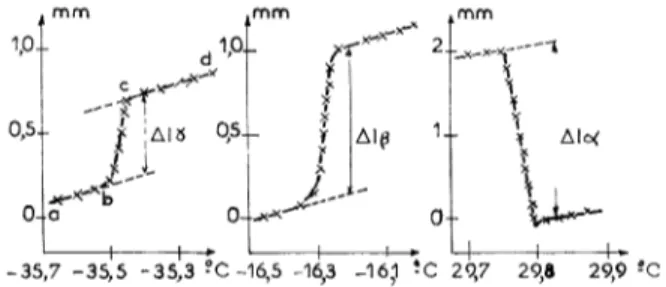
Sur lafigure
4 on montre, parexemple,
FIG. 4. - Variations du niveau
dilatométrique
accom-pagnant
respectivement
les fusion des formesx, P,
y.pour un échantillon de 700 yIn de
diamètre,
lavariation du niveau
dilatométrique
en fonction dela
température,
celle-civariant
de 2OC/h.
Les écarts6.ly, AlB, Ala
donnentrespectivement
la déni-vellation à la fusion de chacune des trois formesallotropiques
dugallium
pour la mêmegouttelette.
La variation de volume
accompagnant
la fusionde la
phase
stable oc étantégale
à0,00529
cm3/g,
onpeut
déduire de ces mesures :En utilisant une émulsion de métal
liquide,
nousavons déterminé la masse
volumique
duliquide
à-
35,6
°C et à- 16,3
°C :Par suite les masses
volumiques
deGay
etGag
sontrespectivement :
et
On remarquera que la forme métastable
Gay
estmoins dense que l’autre
phase
instableGap.
ÉTUDE
CRISTALLOGRAPHIQUE. - L’étudecristal-lographique
deGay [26]
a été faite en collaboration avec le Laboratoire deMinéralogie Cristallographie
de la Sorbonne par une méthodeanalogue
à celledéjà
utilisée pour déterminer la structure du
gallium
~.
Quatre
séries de clichés ontpermis
d’obtenir desreprésentations
cotées du réseau dans desorien-tations différentes.
La maille est
orthorhombique
detype
C,
avec lesparamètres
suivants : a -10,60 ~ 0,07
À,
b =
13,56
-~--0,04 Á
et c =5,19 ~ 0,04 1~.
Enutilisant les résultats rëlatifs à la masse
volu-mique :
py =6,20
et à la valeur moyenne duvolume de la maille élémentaire nous trouvons Z = 40 atomes
par maille.
L’indexation des taches montre que les seuls
groupes de
symétrie
à retenir sont :SUR LE TABLEAU 1 sont réunies les
principales
propriétés cristallographiques
etthermodynamiques
du
gallium
dans les étatsliquide
etcristallin,
à lapression atmosphérique.
Le
diagramme température -pression
dugal.
lium. ---- Nous essaierons d’établir
une relation
entre les
diagrammes
d’équilibre
à hautepression
et les données
thermodynamiques
à lapression
atmosphérique ;
la forme métastableGay
peut
eneffet
posséder
un domaine de stabilité auxpressions
élevées
puisque
sa massevolumique
estplus
grande
que celle de la forme stable Gaoc.
La difficulté d’établir à
partir
des donnéesthermo-dynamiques
le domainepression-température
danslequel
une substancepeut
exister sous une formecristalline donnée
provient
des faibles différencesénergétiques
entre les diverses modificationssolides ;
par
exemple,
ladifférence
entre lesenthalpies
libresdes formes
cubique
diamant etquadratique
del’étain est seulement de
0,022
eV/atome
(valeur
rapportée
à 0OK)
[24].
Les différencesénergétiques
entre les modifications cristallines d’une même subs-tance étantaussi
faibles,
il n’est pas étonnant quel’on
puisse
obtenirparfois
desformes,
à l’étatméta-stable,
dans le domainetempérature-pression
destabilité d’une autre
phase
solide. A titred’exemple
considérons le cas de la
glace
dontplusieurs
formesTABLEAU 1
domaine de stabilité aux
pressions
élevées. Desexpériences
récentes ont montré que vers-180 °C,
ces formes obtenues à haute
pression,
peuvent
être conservées à lapression
atmosphérique
~36~.
L’exis-tence dephases
métastables dans le domaine eststabilité d’une autre forme solide est
également
bienvérifiée dans le cas du
gallium
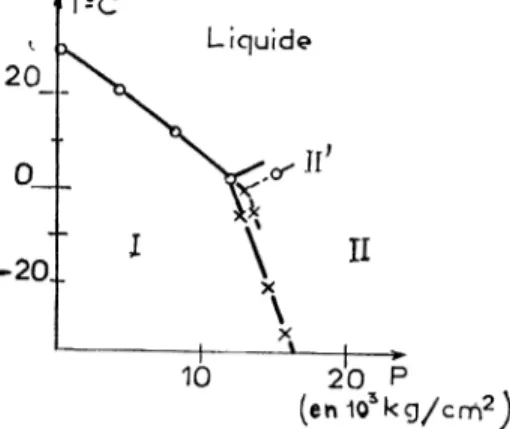
II. Sur lafigure
5nous
rappelons
lediagramme
d’état dugallium,
établi par
Bridgman
[37]
en 1935 : les coordonnées dupoint triple
L -- I -- II sont2,4
OC et11,9
kbars,
FIG. 5. -
Diagramme
d’état dugallium,
établi par
Bridgman
(1935).
la forme Ga II’
apparaît
ucapricieusement
» àl’état
métastable,
dans le domaine de stabilité de GaII ;
on sait[6]
que la formeGaB
s’identifie
à la forme Ga IIqui apparaît
à lapression
atmosphé-rique.
Nous avionssuggéré
[20]
que la formeméta-stable
Gay
pouvait correspondre
à une forme solidestable à haute
pression
mais les données concernantle
diagramme
d’état auxpressions
élevées ne nouspermettaient
pas alors de vérifier cettehypothèse.
Or,
récemmentJayaraman
et al.[38]
ont fait unenouvelle étude du
polymorphisme
dugallium
àhaute
pression
et mis en évidence une troisièmeforme solide Ga III
(fig. 6)
lepoint triple
Ga II - Ga III -liquide
se situant à 45 OC et30
kbars ;
ces auteurs montrent que la variétéGa III
peut
être facilement obtenue à l’étatméta-stable dans le domaine de stabilité de Ga Il et
l’identifient à la forme Ga II’
signalée
parBridgman.
Remarquons
que Ga III est moins dense que Ga Ilet
rappelons
queGay
estégalement
moins dense queGap (ou
GaIl) ;
il est alors tentant d’identifierGay
à Ga III.
Si,
dansl’équation
deClapeyron-Clausius
FIG. 6. -
Diagramme
d’état dugallium publié
parJayaraman
et al.(1963).
Dans la
partie
située en haut et àgauche,
leslignes
en traits continus délimitent les domaines de stabilitédes
phases ;
laligne
en traits discontinuscorrespond
àl’équilibre
métastable entre Ga III et leliquide.
que le
rapport
Lf//1 V
de la chaleur latente defusion
Lf
à la variation de volume AV est unefonction linéaire de la
pression,
onpeut
écrire :où b et c sont des constantes.
L’intégration
del’équation (8)
conduit à larela-tion :
To
étant latempérature
de fusion de la substanceconsidérée à une
pression
Po
donnée.En
posant : a
=Po
+
b,
on obtient la formulede Simon-Glatzel
[40]
Gilvary [41]
a montré que pour les métauxfaible-ment
compressibles,
cpeut
s’exprimer
en fonction de la constante de Gruneisen y par la relation c =6y - 2
alors que a est étroitement lié à la6y
2pression
interne du solide.En réalité c varie avec la
pression,
lerapport
n’étant fonction linéaire de lapression qu’en
première
approximation :
la relation(9)
n’estqu’une
formule «
d’interpolation
». Le tableau IIqui
donneà la fusion de la modification II du
gallium,
pour différentes valeurs de la
pression,
montre quela formule de Simon ne
peut
êtreappliquée
danstout l’intervalle s’étendant de la
pression
atmo-sphérique
à 30 kbars.Nous avons alors
[1]
établi uneexpression
analy-TABLEAU II
tique
de la courbe de fusion de Ga II àpartir
des résultatsexpérimentaux :
l’allure de la courbe estbien traduite entre la
pression atmosphérique
et30 kbars par une relation de la forme :
la
pression
étantexprimée
en kilobars et latempé-rature en
degrés Kelvin ;
lepremier
termecorres-pond
à la formule deSimon,
le second est un termecorrectif.
L’équation
de Simon(9)
donnantl’expression
analytique
de la courbe de fusion de la forme solide Ga III pour lespressions comprises
entre 30 et70 kbars est :
Les
propriétés thermodynamiques
des deuxmodi-fications à haute
pression
sont très voisines et nousporterons dans
l’équation exprimant
la courbe de fusion de Ga III le même terme correctif 69 Xe’"o.i4~P ~
l’équation
de la courbe de fusioncomprises
entre lapression atmosphérique
et70 kbars :
, T"III.. /,
~~.-Si l’on admet que Ga .III
peut
exister à lapression
atmosphérique
sonpoint
de fusionTIll
et lapente
(dTIdP)Ill
calculés àpartir
de la relation(10)
sont :Ces valeurs sont très voisines de celles obtenues
expérimentalement
pourGay :
Enfin Zohkovski
[42]
aremarqué
que pour ungrand
nombre desubstances,
la variation de volumeAV
accompagnant
la fusion à latempérature
T(T
étant fonction de lapression)
est donnée par la relationempirique :
dans
laquelle
C et B sont des constantescaracté-ristiques
de la substance. Les variations de volumeà la fusion de Ga III sont
égales
à :et
la relation
(11)
s’applique
à Ga III et devientA la
pression atmosphérique,
pour T = 241°K,
la variation de volume
sera AVIII
=0,0017
cm3jg ;
cette valeur n’est pas très
éloignée
deAVy
=0,0014
cnx,lg.
L’identité
déjà
établie[6]
desphases Ga~
et GaII,
les densités de
Gay
et Ga IIIrespectivement
plus
faibles que celles deGa~
et de GaII,
la solidifi-cation occasionnelle de laphase
Ga III dans le domaine de stabilité de la forme GaII,
l’accordentre les valeurs de
Ty
et deTIII,
de(dT/dP),
etde de
AVy
et de nouspermettent
de supposer que laphase Gay,
mise en évidence à lapression atmosphérique
àpartir
duliquide
main-tenu en
surfusion,
est la forme GaIII,
stable auxpressions
supérieures
à 30 kbars.Conditions
d’apparition
desformes
métas.tables de ~-
a)
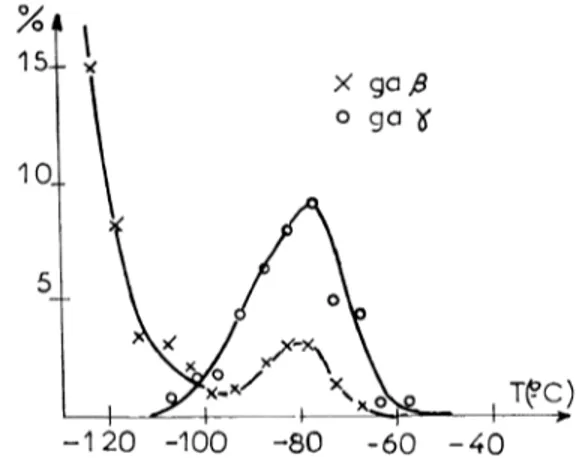
A PARTIR DE LA PHASELIQUIDE. - Nous
appuyant
sur une étudeconcer-nant un millier de
gouttelettes
de diamètrescompris
entre 10 et 800 nous avons
porté
sur lafigure
7 lepourcentage
des échantillonsqui,
à unetempé-rature
donnée,
cristalJisent soit enGap
soit enGay.
On voit que si la cristallisation seproduit
entre- 55 et
- 100°C,
laprobabilité
d’apparition
deFIG. 7. -
Pourcentage
des gouttesqui
cristallisent àune
température
donnée enGaB
ou enGay.
la forme y est
plus
grande
que celle de laformes
tandisqu’au-dessous
de- ils °C,
on obtienttou-jours
~3.
Un fait intéressant est que la
présence
d’unpro-duit
d’oxydation
dugallium
semble favoriser la formation deGay.
Eneffet,
soit unegouttelette
cristallisant à - 120 °C
en ~ ;
si l’on déchirelégè-rement le film
qui
enrobe lagoutte, permettant
ainsi
une faibleoxydation
du métalliquide,
onconstate que la
surfusion
cesse à destempératures
plus
élevées variant entre - 70 et - 90OC ;
dans ce cas c’est leplus
souvent laphase
solideGay
qui
apparaît.
(Notons
que si le film adsorbé à la surface de l’échantillonmétallique
est entièrementdétruit,
la
goutte
liquide
cristallise entre - 10 et - 48 °C en la forme stableIl est
possible d’expliquer
ces résultats encom-parant
les variationsd’enthalpie
libreAG%
etàG*
accompagnant
la cristallisation duliquide
respec-tivement enGay
etGap.
Eneffet,
l’enthalpie
libre interfaciale 6Y entre un germe degallium
y et leliquide,
calculée[15]
àpartir
de la valeurexpéri-mentale 6p, est dy cri 34
ergsfcm2;
si lagermination
est
homogène,
à unetempérature
voisine de - lls°C,
=1,2
AG*
et lafréquence
de ger-mination(formule 2)
deGap
estsupérieure
à celle deGay.
Si la
germination
esthétérogène,
lesimpuretés
diminuent le travail de formation des germes(for-mule
6)
et le termeJs
correspondant
à la vitesse degermination
deGay
devientsupérieur
à celui dugallium ~.
b)
A PARTIR DE LA PH ASE VAPEUR. - Bückel etGey [43]
ont étudié lasupraconductivité
des films degallium
provenant
de la condensation de lavapeur sur des
supports
dequartz ;
lorsque
lesup-port est maintenu à 4
OK,
ledépôt
obtenu serait«
amorphe
o et satempérature
critique
desupra-conductibilité est
Toi
=8,4
OK alorsstable Gaex
possède
latempérature
de transitionfco:== 1,07
OK. Parréchauff emcnt,
l’état «amorphe »
du
gallium
se transforme vers 20 OK en une forme cristalline dont latempérature
de transition est6,5
OK et identifiée par Bückel augallium
II(ou
P).
TABLEAU III
Sur la
régle
desdegrés
d’Ostwald.
- A PARTIR DU LIQUIDE. -Supposons qu’à
unetempé-rature donnée il
puisse
se former àpartir
d’unliquide
maintenu en surfusion desphases
y, ~
et ocplus
stables que laphase liquide
initiale et que lespotentiels chimiques
de cesphases
soient tels que> > > La
règle
desdegrés
d’Ostwaldénonce que le
liquide
cristallisera pardegrés
succes-sifs en ces formes intermédiaires avant d’atteindre l’état stable final.Cependant,
cetterègle
n’est pastoujours
suivie et les conditions del’apparition
desphases
métastables yet ~
dépendent
avant tout de laprobabilité
de formation des germes.La vitesse de
germination
d’unephase
i estdonnée par :
avec
=
03BC1 -
03BCi étant un
potentiel chimique
de la formei,
pi : densité de la
phase
solide iqui
apparaît,
Ai :
est un facteurpositif
sensiblementidentique
pour les différentesphases
d’une mêmesubstance,
6f : est
l’enthalpie
libre interfaciale entre lesphases
enprésence.
Il en résulte que la cristallisation du
liquide
en la formemétastable ~
ou en la forme stable ocdépend
dusigne
del’expression
Par un réchauffement
ultérieur,
vers 70 ou 80°K,
il se
produit
une transformation engallium
«(1).
Sur le tableau III nous
indiquons
les domaines detempérature
où les formes degallium
peuvent
exis-ter à la
pression atmosphérique.
ou encore de :
Dans le cas du
gallium,
la variation despotentiels
chimiques 03BC1,
fLf3 et fLet desphases
liquides, Ga3
etGaa,
en fonction de latempérature
estrepré-sentée sur la
figure
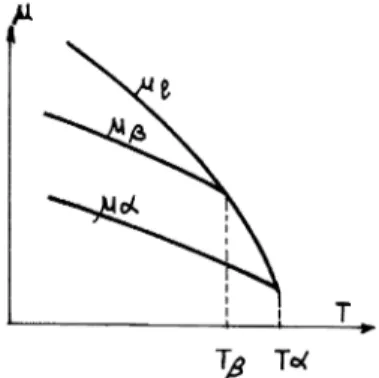
8.FIG. 8. - Allures du
potentiel
chimique
desphases :
liquide,
Ga3
etGaoc,
en fonction de latempérature.
Lorsque
latempérature
estlégèrement
inférieureà
Tp
= - ~6,3 °C,
0 etf(T)
estpositif ;
il s’ensuit queAGg
estsupérieur
àAGg
etJI3
Ja :
(1)
Des mesures récentes effectuées en collaboration avec lelaboratoire,
C. N. R. S. " très bassestempéra-tures " de Grenoble ont donné
6,0
± 01 OK commetempérature
critique
d’une forme métastable à la pres sionatmosphérique.
Sci.1965,
261,
5431.)
si le
liquide
cristallise,
il le fera en la forme Gaoc. Si latempérature
àlaquelle
leliquide
peut
se con-server est très inférieure àTp
l’écart relatif entre les valeurs de et diminue et l’influence destermes ci sur le
signe
de croît notablement. Nous avons vu que J3 a une valeur voisine de7x/2y
donci(T)
1
peut
devenirnégatif
pour destempé-ratures très inférieures à
T3 ;
dans ce cas,Jp
devientsupérieur
àJa
et leliquide
cristallise en la formeGap.
Il doit exister unetempérature Tl
pourlaquelle
lacondition
f(T)
= 0 estsatisfaite ;
à ce’ttetempé-rature
Tl
leliquide
doit cristalliser indifféremmenten
Gaa
ou enGap :
l’expérience
montre en effet quecette
température T~
se situeapproximativement
vers -
45 ~C.
Dans le cas
général,
les variations de cri et deA03BCi
avec la
température
ne sont pas connues mais il sepeut
que nous ayons la succession suivante :Les
températures
7B
etT 2
sont des racines del’équation f(T)
=0 ;
par
suite,
larègle
desdegrés
d’Ostwald ne
s’applique
que dans l’intervalle destempératures
comprises
entreT 1
etT 2.
Effecti-vement
Gay
n’apparaît qu’entre
lestempératures
55 °C etT 2 ^_’ --
100 OC.L’expression
de devient :la
signification
des termesgp(6)
etgy(O)
est celledonnée
précédemment
(formule
6).
A PARTIR DE LA PHASE VAPEUR. - Palatnik
et
Zorine
[44]
ont montréqu’il
convenait de tenircompte
des termes du seconddegré
dans ledévelop-pement
en série deTaylor
de la variation dupoten-tiel
chimique Aui :
Li est la chaleur de transformation de la
phase
i en laphase
vapeur à latempérature
d’équilibre
Ti,
~Ci
est la différence descapacités calorifiques
àpression
constante des formes considérées. Pourexprimer f (T) (formule
12),
on obtient ainsi uneéquation
du seconddegré
en T etl’application
ou lanon-application
de larègle
desdegrés
d’Ostwalddépend
de la discussion des racinesT 1
etT 2
del’équation f (T).
Une telle résolution nécessite laconnaissance des
capacités
calorifiques
et desenthal-pies
libres interfaciales des différentesphases
jusqu’aux
très bassestempératures ;
néanmoins l’existence destempératures
limitesT,
etT 2
s’est vérifiée au cours d’un ensemble d’études concernantla condensation des vapeurs de seize métaux
(Pb,
Sn,
Bi,
In,
... ) ;
ces études ontpermis
à Palatnik[45]
d’établirexpérimentalement
que larègle
desdegrés
s’applique
alors dans tout l’intervalle detempérature
extérieur aux racinesT,
etT~
selon lediagramme
suivant :Les zones hachurées délimitent les intervalles où
l’apparition
de l’unequelconque
desphases
adja-centes est
possible.
Par condensation de la vapeurde
gallium,
Bückel et al.[43]
montrent bienl’exis-tence d’une
température
T,
délimitant deuxdo-maines dans
lesquels
legallium
se trouve soit àl’état
amorphe
soit à l’état cristallin.D’autre
part,
par échauff ement du filmamorphe,
celui-ci se transforme vers
20 ,°K
enGap,
larègle
desdegrés s’applique
encore à cettetempérature.
Signalons
toutefoisqu’à partir
de ce filmamorphe
ces auteurs n’ont obtenuqu’une
seule forme cristal-line métastable.Les résultats concernant le
polymorphisme
dugallium
à lapression
atmosphérique
montrentl’importance
du choix de trèspetits
échantillonsdans l’étude des
changements
dephase,
et aussi de leurprotection
contre lesagents
extérieurs. L’obten-tion degouttelettes
liquides
très pures enrobées d’unfilm
protecteur
doitpermettre
de réaliser lescondi-tions de la
germination
homogène
et d’observer lestypes
possibles
de cristallisation. Si l’intervalle detempérature
danslequel
la substance reste ensur-fusion est suffisamment étalé il doit être
possible
d’observer la cristallisation du
liquide
en formes métastablescorrespondant
à des états stables àhaute
pression.
Dans cetterecherche,
le cas dugallium
a été favorable par suite de la structurecomplexe
de la forme stable à lapression
atmo-sphérique :
ilpeut
ainsiapparaître
des formesinter-médiaires dont
l’énergie
de formation du germe estplus
faible. Par condensation de la vapeur en couchesminces,
il est aussipossible
d’obtenir desphases
cristallines métastables(condensation
enGap
parexemple) puisqu’à partir
d’un état désordonnétoutes les
possibilités
de cristallisation sontper-mises. La réalisation d’un ultravide et la conden-sation sur des
supports
débarrassésd’impuretés
adsorbées doivent
permettre
desprogrès
dans cetteétude.
BIBLIOGRAPHIE
[1]
BOSIO(L.),
Thèsed’État,
Paris, 1965,
Mét. Corr.Ind. 1965,
n°483,
421 et n°484,
451.[2]
VOLMER(M.),
Kinetik derPhasenbildung, Leipzig,
Steinkopf,
1939.[3]
FRENKEL(J.),
Théoriecinétique
desliquides,
DoverPublic.,
NewYork,
1955.[4]
TAMMANN(G.), Agregatzustände, Leipzig,
1929.[5]
TURNBULL(D.),
J. Chem.Physics, 1952, 20, 412.
[6]
DEFRAIN(A.),
Thèsed’État,
Paris ;
Mét. Corr.Ind.,
1960,
n°417,
175.[7]
DANILOV(V. I.),
Structure et cristallisation desliquides,
Acad. U. R. S.S., 1956.
[8]
DEFRAIN(A.),
Mét. Corr.Ind., 1962,
n° 438, 1.
[9]
BOSIO(L.),
DEFRAIN(A.)
et EPELBOIN(I.), C.
R. Acad.Sc., Paris, 1961,
253,
2343.[10]
DEFRAIN(A.)
et EPELBOIN(I.),
J.Physique
Rad.,
1960, 21,
76.[11]
DELCROIX(S.),
DEFRAIN(A.)
et EPELBOIN(I.),
J.Physique
Rad., 1963, 24, 17.
[12]
TURNBULL(D.),
J. Chem.Physics,
1950, 18, 198.
[13]
BOSIO(L.)
et DEFRAIN(A.),
C. R. Acad.Sc.,
Paris,
1962, 254, 1020.
[14]
BOSIO(L.)
et DEFRAIN(A.),
C. R.Acad. Sc., 1963,
257, 901.
[15]
HOLLOMON(J.)
et TURNBULL(D.),
Progress in
metalphysics,
Pergamon
Press, Londres, 1953,
4.[16]
BUCKLE(F.
R.),
Proc.Roy. Soc., 1961,
261, 190.
[17]
TOLMAN(R. C.),
J.Chem. Physics,
1949, 17, 118.
[18]
KIRKWOOD etBUFF,
J. Chem.Physics, 1949, 17, 338.
[19]
TURNBULL(D.),
Solid StatePhysics,
Acad.Press,
New
York, 1956,
3,
225.[20]
BOSIO(L.),
DEFRAIN(A.)
et EPELBOIN(I.),
J.Phy-sique
Rad., 1962, 23,
878.[21]
ANDARELLI(G.), Diplôme
d’Études
Supérieures.
Paris, 1965.
[22]
BOSIO(L.)
et DEFRAIN(A.),
C.R. Acad. Sc., 1964,
258, 4929.
[23]
DEFRAIN(A.),
C. R. Acad.Sc., 1960, 250,
483.[24]
KAUFMAN(L.),
Solids underPressure,
MacGraw-Hill, 1963,
p. 307.
[25]
BOSIO(L.),
C. R.Acad. Sc., 1964,
259,
4545.[26]
BLANCONNIER(P.),
BOSIO(L.),
DEFRAIN(A.),
RIMSKY
(A.)
et CURIEN(H.),
Bull. Soc.Franç.
Minér.Crist., 1965,
88, 145.
[27]
CURIEN(H.),
RIMSKY(A.)
et DEFRAIN(A.),
Bull.Soc. Franç. Minér.
Crist.,
1961,
84,
260.[28]
LAVES(F.),
Z.Krist., 1933, 84, 256.
[29]
BRAHAMA,
SHARMA(D.)
et DONOHUE(J.),
Z.Krist.,
1962, 117,
293.[30]
RICHARDS (T.W.)
et BOYER(S.),
J. Amer. Chem.Soc.,
1921, 43,
280.[31]
ADAMS(C.
B.),
JOHNSTON(H. L.)
et KERR(E. C.),
J. Amer. Chem.Soc., 1952, 74, 4784.
[32]
ERNY(M.),
Thèsed’État,
Paris, 1958, Éditions
Métaux.[33]
BOSIO(L.),
DEFRAIN(A.)
et EPELBOIN(I.),
C. R.Acad.
Sc.,
1960, 250,
2553.[34]
MENKE(H.),
Physik
Z., 1932, 33,
593.[35]
HENDUS(H.),
Z. Naturf., 1947,
2a,
505.[36]
BERTIE(J. E.),
CALVERT(L.
D.)
et WHALLEY(E.),
Canad. J.Chem.,
1964,
42,
n°6, 1373-1378.
[37]
BRIDGMAN(P. W.), Phys. Rev., 1935, 48, 893.
[38]
JAYARAMAN(A.),
KLEMENT(W.),
NEWTON(R.
C.)
et KENNEDY
(G.
C.),
J.Phys.
Chem.Solids, 1963,
24, 7.
[39]
VORONEL(A. V.),
Z. Tekh.Fiz.,
1958,
28,
n°11,
2630.
[40]
SIMON(F. E.)
et GLATZEL(G.),
Z.Anorg. Allgem.
Chem.,
1929, 178,
309.[41]
GILVARRY(J. J.),
Phys.
Rev.,
1956, 102,
308.[42]
ZOKHOVSKI(M. K.), Z.
Fiz.Khim.,
1963,
37,
2635.[43]
BÜCKEL(W.)
etGEY
(W.),
Z.Physik,
1963, 176,
336.
[44]
PALATNIK(L. S.)
et ZORINE(V. S.),
Z. Fiz.Khim.,
1959, 33, 1859.
[45] PALATNIK
(L.
S.)
et PAPIROV(I.
I.),
Croissanceorientée,
Éd.
«Métallurgie
»,Moscou, 1964.
Note