HAL Id: tel-02954124
https://tel.archives-ouvertes.fr/tel-02954124
Submitted on 30 Sep 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Caractérisation des déterminants moléculaires impliqués
dans l’entrée des sporozoïtes de Plasmodium dans les
cellules hépatocytaires
Anne-Claire Langlois
To cite this version:
Anne-Claire Langlois. Caractérisation des déterminants moléculaires impliqués dans l’entrée des sporo-zoïtes de Plasmodium dans les cellules hépatocytaires. Immunologie. Sorbonne Université, 2019. Français. �NNT : 2019SORUS235�. �tel-02954124�
« Savoir s'étonner à propos est le premier pas fait sur la route de la découverte. » Louis Pasteur
REMERCIEMENTS
Je tiens tout d’abord à remercier mon directeur de thèse Olivier Silvie pour son encadrement scientifique de qualité qui m’a beaucoup apporté, ainsi que pour sa patience, sa disponibilité, mais également la réactivité et la pertinence de ses corrections lors de la rédaction d’articles, de présentations et de mon manuscrit de thèse.
Je remercie les membres du Labex Parafrap de m’avoir sélectionnée et d’avoir financé ma thèse, ainsi que pour l’organisation d’excellentes formations reçues au cours de celle-ci - pour cela, merci à Patrick Bastien en particulier. Merci également aux doctorants de ma promotion Parafrap pour tous les bons moments partagés.
Je remercie les rapporteurs de cette thèse, Jérôme Clain et Benoît Gamain, pour leur investissement, ainsi l’ensemble des membres de mon jury de thèse pour leur participation : Maryse Lebrun, Marlène Dreux et Thierry Huby.
Je tiens également à remercier les membres de mon comité de suivi de thèse, Maryse Lebrun, Sylvie Garcia et Frédéric Ariey, qui m’ont suivie pendant ces trois années et ont enrichi ma réflexion par leurs commentaires toujours pertinents.
J’aimerais également remercier les collaborateurs Eric Rubinstein, Thierry Huby, Marlène Dreux, Véronique Carrière et François-Loï̈c Cosset qui ont contribué à l’avancement de nos projets.
Je remercie également chaleureusement l’ensemble de mes collègues pour leur aide, leurs conseils et remarques sur mon travail, ainsi que les bons moments passés ensemble dans le laboratoire ou à l’extérieur : Manon, Priyanka, Marion, Chriss’Even, Loïse, Laetitia, Delphine, Ludivine, Mallaury, Valérie, Sylvie, Carine, Catherine, ainsi que les collègues en charge de l’insectarium : Jean-François, Maurel, Thierry et Mariem. Merci particulièrement à Laetitia pour sa contribution précieuse à mon travail.
Je remercie les personnes qui m’ont permis d’entrer dans le monde de la recherche sur le paludisme, Odile Mercereau-Puijalon et tout particulièrement Frédéric Ariey pour ses encouragements. Je remercie également mon directeur de stage de Master 2, Didier Ménard, pour son encadrement.
Merci à mes amies proches pour leur présence au long de ces années décisives, Marine, Natacha, Elisabeth et Anne-Lyse, et à tous les copains pour les concerts et les soirées – Johann, Nicolas, Théo, Antoine, Greg, Esther.
Merci infiniment à Edouard pour son soutien de tous les jours et son positivisme sans faille qui m’ont aidée à prendre le recul nécessaire sur ce challenge.
Enfin, je remercie chaleureusement ma famille pour son soutien total au cours de ces longues années d’études, et particulièrement mes parents pour m’avoir donné le goût et la curiosité du voyage.
SOMMAIRE
LISTE DES ABREVIATIONS 6
PREMIERE PARTIE : INTRODUCTION 9
I. GENERALITES SUR LE PALUDISME 10
II. BIOLOGIE DU SPOROZOÏTE 21
III. FACTEURS MOLECULAIRES DE L’HOTE IMPLIQUES DANS L’INVASION
PRODUCTIVE DES HEPATOCYTES 45
OBJECTIFS 68
METHODOLOGIE 71
DEUXIEME PARTIE : RESULTATS 75
I. Contribution du recepteur EphA2 à l’invasion des hépatocytes par les sporozoïtes de
Plasmodium 76
II. Caractérisation des déterminants structuraux du recepteur SR-BI dans l’invasion des
hépatocytes par les sporozoïtes de Plasmodium 79
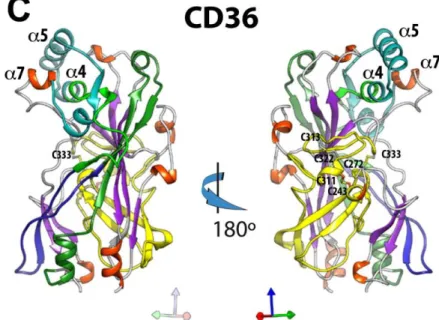
III. Etude fonctionnelle des récepteurs de la famille CD36 dans l’invasion hépatique par les
sporozoïtes 106
TROISIEME PARTIE : DISCUSSION 118
BIBLIOGRAPHIE 153
TABLE DES FIGURES 167
L
ISTE DES
A
BREVIATIONS
ACT Artemisinin combined therapy
ALIX ALG2-interacting protein X AMA1 Apical membrane antigen 1 BLT Blocker of lipid transport
CBL Chitin binding like
CD Cluster of differentiation CD2AP CD2-associated protein
CelTOS Cell-traversal protein for ookinetes and sporozoites
CI Concentration inhibitrice
CIDR Cystein rich interdomain region
CIN85 SH3 domain-containing kinase-binding protein 1
CLDN Claudins
CMH Complexe majeur d’histocompatibilité
CSP Circumsporozoïte protein
CyRPA Cysteine-rich protective antigen DARC Duffy antigen/chemokine receptor
DBL Duffy binding like
DEET N,N-diethyl-3-methylbenzamide
EBA Erythocyte binding antigen
EBL Erythocyte binding like
EEF Exo-erythrocytic form
EGFR Epithelial growth factor
EphA2 Ephrin A2
ESCRT Endomembrane Sorting Complex EV71 Enterovirus 71
EWI Without its N-terminus
FACS Fluorescent activated cell sorting
GADPH Glycéraldéhyde-3-phosphate déshydrogénas
GFP Green fluorescent protein
GOMO Gene out marker out
GPI Glycosylphosphatidylinositol
GPA Glycophorin A
G6PD Glucose 6-phosphate déshydrogénase
HCV Hepatitis C virus
HDL Lipoprotéine de haute densité
HGF Hepatocyte growth factor
HO-1 Heme oxygenase
HRP2 Histidine rich protein 2 HSPG Highly sulfated proteoglycans HVR1 Hypervariable region 1
ICAM intercellular adhesion molecule 1 IFNγ Interferon γ
IMC Inner membrane complexe
LAMTOR late endosomal/lysosomal adaptor, MAPK and mTOR activator 1
LC3 Microtubule-associated protein 1 light chain 3 LDL Lipoprotéine à faible densité
LEL Large extracellular loop L-FABP Liver fatty acid bing protein
MACPF Membrane attack complex/perforin
MAEBL Membrane antigen/erythrocyte binding-like MAR Microneme adhesive repeat
MIC Micronemal proteins
MSP Merozoite surface protein
MTOC Microtubule organizing centers
MTRAP Merozoite thrombospondin related apical merozoite M2AP MIC associated proteins
NPC1L1 Niemann–Pick C1 like 1
OMS Organisation mondiale de la santé PAMP Pathogen-associated molecular patterns PDZ1 PDZ Domain Containing 1
PL Phospholipase
PLP1 Perforin-like protein 1
PVM Parasitophorous vacuole membrane RAMA Rhoptry associated membrane antigen
RAP Rhoptry associated proteins
RBP Reticulocyte binding protein
RDT Rapid diagnostic test
RH Erythrocyte binding like
Ripr RH5- interacting protein RON Rhoptry neck protein
ROP Protéine de bulbe de rhoptrie SEL Small extracellular loop
SPECT sporozoite protein essential for cell traversa SR-BI Scavenger receptor type B class I
SSP3 Sporozoite surface protein
TIM T-cell immunoglobulin and mucin domain
TLP TRAP Like protein
TRAP Thrombospondin-related adhesiv protein
TRAMP Thrombospondin related apical merozoite protein
TSR Thrombospondin type 1 repeat
UIS Upregulated in infectious sporozoite VIH Virus de l’immunodéficience humaine VLDL Very low density lipoprotein
P
REMIERE PARTIE
I.
G
ENERALITES SUR LE
P
ALUDISME
I.1.
É
PIDEMIOLOGIE DU
P
ALUDISME EN
2019
En 2019, le paludisme reste la première endémie parasitaire mondiale. Environ 3,4 milliards de personnes, soit la moitié de la population mondiale, sont exposées au risque de paludisme. Plasmodium falciparum est le parasite le plus prévalent dans la région africaine de l’OMS avec 99,7% des cas estimés en 2017, alors que Plasmodium vivax prédomine dans la région Amériques de l’OMS avec 74,1 % des cas de paludisme (World Health Organization, 2018). La transmission est actuellement considérée comme endémique dans 92 pays : les régions intertropicales, la quasi-totalité de l’Afrique, une grande partie de l’Asie du Sud-est, l’Amérique centrale et l’Amérique du Sud sont concernées. Aucun des pays de la région Européenne de l’OMS n’a rapporté de cas indigène de paludisme en 2016 ainsi qu’en 2017.
Malgré les progrès obtenus cette dernière décennie dans le contrôle du paludisme, les estimations de l’OMS font état de l’arrêt de la décroissance du nombre de cas à l’échelle mondiale avec 219 millions d’épisodes palustres en 2017 (IC 95%: 203–262 million). Au total, on aurait enregistré une augmentation de 3,5 millions de cas de paludisme supplémentaires dans les dix pays d’Afrique les plus touchés par la maladie par rapport à 2016.
FIGURE 1 : CARTE DES PAYS ENDEMIQUES EN 2000 ET LEUR STATUT EN 2017 (WORLD HEALTH ORGANIZATION, 2018)
Les pays considérés comme exempts de paludisme (vert) n’ont pas connu de cas de paludisme au cours des 3 dernières années. Source : WHO database.
Au niveau mondial, on estime que le paludisme a causé 435 000 décès pour l’année 2017 contre 607 000 en 2010. Les enfants de moins de 5 ans constituent la population la plus touchée et représentent 61 % des décès associés au paludisme dans le monde. En 2017, 93 % de l’ensemble des décès ont été enregistrés dans la région africaine de l’OMS, avec la diminution la
plus importante de la mortalité enregistrée au niveau mondial depuis 2010. Par rapport à 2010, le taux de mortalité par paludisme a donc diminué globalement à l’exception des Amériques (Brésil, Nicaragua et Venezuela). On a observé la baisse la plus prononcée en Asie du Sud-Est (54 %), en Afrique (40 %) et en Méditerranée orientale (10 %). Cependant, cette diminution a ralenti globalement depuis 2015, reflétant l’arrêt de la progression dans l’élimination.
Il n’est cependant pas possible d’évaluer les tendances dans tous les pays d’endémicité en temps réel étant donné le manque d’exhaustivité des données soumises et les modifications dans les pratiques diagnostiques ou le recours aux services de santé. Ce manque d’exhaustivité pose un problème supplémentaire pour l’évaluation des besoins dans la lutte pour l’élimination de la pathologie menée par l’Organisation mondiale de la Santé.
En effet, la lutte mondiale contre le paludisme fait face à de nombreuses difficultés. Les progrès réalisés jusqu’alors restent constamment menacés par l’émergence de la résistance du parasite aux traitements existants ainsi que celle de résistance du moustique aux insecticides. Le rapport 2018 de l’OMS montre une augmentation de l’incidence du paludisme dans les pays les plus touchés, ainsi que des niveaux de financement nationaux et internationaux insuffisants. Ces deux points constituent de sérieux obstacles à l’atteinte des objectifs 2020 et 2025 du « Global technical strategy for malaria 2016–2030 » qui visent à diminuer de 40 % puis 75 % l’incidence de la maladie ainsi que la mortalité à travers le monde par rapport à 2015. Aujourd’hui, il apparaît donc d’autant plus urgent de poursuivre les efforts engagés dans la prévention et dans la lutte contre le paludisme, mais également de développer des outils innovants pour atteindre les objectifs fixés.
I.2.
P
ALUDISME
:
T
RANSMISSION ET CYCLE PARASITAIRE
FIGURE 2 : CYCLE PARASITAIRE DE PLASMODIUM FALCIPARUM CHEZ L’HOMME ET LE MOUSTIQUE ANOPHELE (WHITE ET AL., 2014).
Le paludisme est transmis à l’Homme par la piqûre d’un moustique culicidé du genre Anopheles au cours de son repas sanguin. En Afrique subsaharienne, Anopheles gambiae est l’une des espèces les plus impliquées dans la propagation de la pathologie. Les espèces hématozoaires responsables du paludisme appartiennent, quant à elles, au genre Plasmodium. Les 6 espèces infectant l’homme, P. falciparum, P. vivax, P. malariae, P. ovale (wallikeri and curtisi) et P. knowlesi, présentent deux phases de reproduction : une reproduction asexuée chez l’homme (hôte intermédiaire) et une reproduction sexuée chez l’Anophèle femelle (hôte définitif).
S
CHIZOGONIE PRE-
ERYTHROCYTAIRELe parasite est inoculé à l’homme lors du repas sanguin de l’anophèle femelle sous la forme de sporozoïtes qui vont rapidement migrer jusqu’au foie et infecter les hépatocytes
(Figure 2). Les formes exo-érythrocytaires (EEF) s’y développent au sein d’une vacuole
parasitophore, puis se différencient en schizontes fragmentés qui libèrent par la suite des mérozoïtes dans la circulation sanguine (10 000 à 30 000 suivant les espèces). Cette première phase asymptomatique est unique dans le cycle de vie de Plasmodium et sera détaillée en
section II de cette introduction. Elle dure environ 7 à 12 jours chez l’homme et environ 2 jours
chez le rongeur. Chez P. vivax et P. ovale, des formes intrahépatiques, les hypnozoïtes, peuvent persister plusieurs mois après la piqûre du moustique sous une forme dormante avant de se réactiver pour libérer des mérozoïtes dans le sang et de causer les reviviscences tardives qui caractérisent ces infections. Les hypnozoïtes n’ont pas été observés dans les infections à P. falciparum.
S
CHIZOGONIE ERYTHROCYTAIREDurant la phase érythrocytaire, les mérozoïtes envahissent les globules rouges et forment une vacuole parasitophore à l’intérieur de laquelle ils se différencient en trophozoïtes (anneau ou « ring ») puis en schizontes.
De 0 à 3h, on observe de jeunes « rings » sous forme de bagues à chatons, petits et fins. À 16h, les jeunes trophozoïtes présentent un anneau épaissi et complet. Les taches de Maurer commencent à apparaître. En arrivant à maturité, les trophozoïtes grandissent jusqu’à occuper 2/3 de la cellule. La vacuole digestive disparaît alors et l’hémozoïne, produite par dégradation de l’hème, commence à se former à partir du stade trophozoïte.
À 40h, le schizonte se fragmente en noyaux multiples qui deviennent totalement indépendants à 48 heures (schizonte segmenté) et donneront les mérozoïtes. La lyse maitrisée par le parasite des membranes de la vacuole parasitophore et de l’érythrocyte permet ensuite la libération de 16 à 32 nouveaux mérozoïtes. Ceux-ci pénètrent alors dans de nouveaux globules rouges et initient un nouveau cycle d’infection permettant la progression rapide de la parasitémie. La synchronisation des cycles parasitaires au sein de l’hôte infecté entraîne la destruction périodique d’un grand nombre de globules rouges et la libération l’hémozoïne, responsable de la fièvre palustre. Le cycle parasitaire érythrocytaire peut durer 24 heures (P. knowlesi), 48 heures (P. falciparum, P. vivax, P. ovale) ou 72 heures (P. malariae) en fonction des espèces. Une petite fraction des mérozoïtes se différencie en précurseurs des cellules sexuées, les micro- et macro-gamétocytes.
C
HEZ LE MOUSTIQUESeule la femelle Anophèle hématophage transmet la maladie. Le pic d’activité, et donc l’intensité des piqûres, varie sensiblement au cours de la journée/nuit suivant l’espèce du moustique (41 espèces vectrices du genre Anopheles). Lors de son repas sanguin sur un hôte humain infecté, l’Anophèle femelle ingère du sang contenant des gamètocytes mâles et femelles, s’infectant par la même occasion. La fécondation se déroule dans le tractus digestif du moustique vecteur, formant un œuf libre, l’ookinète, qui va aller s’enkyster dans la paroi externe de l’estomac du moustique après l’avoir traversée pour se transformer en oocyste. Les cellules se multiplient alors dans l’oocyste, produisant des sporozoïtes infectieux qui rejoindront les glandes salivaires et seront inoculés à un nouvel hôte vertébré durant le repas sanguin du moustique. La formation des sporozoïtes infectieux sera détaillé au chapitre II.2.
I.3.
D
IAGNOSTIC DU PALUDISME
D
IAGNOSTIC CLINIQUEL’accès palustre sans signe de gravité se déroule suivant la triade « frissons, chaleur, sueurs » survenant tous les deux à trois jours suivant l’espèce de parasite. Il fait suite à un stade d’incubation asymptomatique (7 à 12 jours pour P. falciparum) puis de primo invasion non spécifique, qualifié d’embarras gastrique fébrile. Le premier stade de l’accès palustre est caractérisé par une augmentation progressive de la température corporelle accompagnée de frissons violents pendant environ 1 h, suivi d’une forte fièvre à plus de 40°C avec des céphalées et des douleurs abdominales durant 3 à 4 h. La crise se termine par des sueurs profuses, une émission d’urine foncée et un effondrement brusque de la température ; ce stade dure entre 2 et 4 heures.
Chez un sujet non prémuni, tout accès palustre peut s’aggraver en quelques heures sous la forme d’un paludisme potentiellement mortel. L’accès palustre grave peut prendre plusieurs formes cliniques dont la plus importante est le neuropaludisme. Cette atteinte cérébrale se caractérise par des troubles de la conscience, une prostration et des convulsions. Le diagnostic du paludisme est alors une urgence vitale : le malade doit être immédiatement hospitalisé dès l’observation de tout symptôme neurologique (World Health Organization, 2010). Les autres complications graves d’un paludisme comprennent l’anémie sévère et le paludisme gestationnel.
La pratique du diagnostic clinique était plus compréhensible par le passé lorsque des antipaludéens peu chers et bien tolérés, comme la chloroquine, étaient encore efficaces
(Wongsrichanalai et al., 2007). Cependant, du fait de la non-spécificité des symptômes, il est difficile de différencier le paludisme des autres pathologies tropicales à accès fébrile. L’approche strictement syndromique apparaît donc comme peu fiable. En effet, cette pratique a entrainé la prescription excessive d’antipaludéens, favorisant l’apparition de la résistance aux traitements, ainsi que le manque de prise en charge des pathologies non palustres à symptomatologie identique en zone endémique (Gwer et al., 2007).
D
IAGNOSTICM
ICROSCOPIQUELe diagnostic microscopique est un diagnostic de certitude qui repose sur la mise en évidence des formes érythrocytaires de Plasmodium grâce à l’observation microscopique d’un prélèvement de sang périphérique du patient. Il existe deux techniques différentes et complémentaires : le frottis mince et la goutte épaisse.
• Le frottis mince : Le frottis mince est effectué en étalant quelques microlitres de sang
sur une lame de microscope. Cette méthode est la plus adaptée à l’identification du stade et de l’espèce du parasite.
• La goutte épaisse : Cette technique, considérée comme la technique de référence, est
une observation, après hémolyse et coloration au Giemsa, de quelques microlitres de sang sur une lame de microscope. Le dénombrement de parasites doit être effectué par un manipulateur expérimenté, car la lecture des lames reste assez délicate. Le diagnostic d’espèce n’est pas toujours possible.
D
IAGNOSTIC DEB
IOLOGIEM
OLECULAIRELa technique PCR (Polymerase Chain Reaction) repose sur la détection de l’ADN des parasites circulants afin de pouvoir estimer semi-quantitativement la densité parasitaire sanguine. Cette technique peut être utilisée comme aide au diagnostic, car elle possède une excellente sensibilité et est discriminative d’espèce. Elle peut ainsi détecter jusqu’à 0,5 parasite/mL après concentration de l’échantillon.
D
IAGNOSTIC SEROLOGIQUELa sérologie du paludisme n’est indiquée que dans le diagnostic rétrospectif de l’accès palustre étant donné que la présence d’anticorps (sérologie positive) signe seulement un contact préalable avec le parasite. Elle peut également être conseillée dans les enquêtes épidémiologiques, le contrôle des donneurs de sang ou d’organes à risque, le diagnostic de paludisme viscéral évolutif ou celui d’une splénomégalie palustre (Enseignants de Parasitologie et Mycologie, 2014).
D
IAGNOSTIC PART
EST DED
IAGNOSTIC RAPIDEBasés sur le principe d’immunochromatographie sur membrane, les tests de diagnostic rapide ont considérablement amélioré la prise en charge de la maladie sur le terrain, en particulier dans les zones reculées ayant un accès limité à des services de diagnostic. D’utilisation et d’interprétation relativement faciles, ces tests permettent d’obtenir un résultat après 15 à 30 min en détectant spécifiquement les antigènes des différentes espèces de Plasmodium telle que la protéine HRP2, la lactate deshydrogènase ou l’aldolase. Certains tests de diagnostic rapide détectent les infections monospécifiques (soit P. falciparum soit P. vivax), d'autres détectent des infections mixtes (P. falciparum, P. vivax, P. malariae et P. ovale) tandis que d'autres distinguent les infections par P. falciparum et non P. falciparum, ou des espèces spécifiques.
I.4.
L
ES TRAITEMENTS CURATIFS ACTUELS
Le choix du traitement repose principalement sur la fréquence de résistance du parasite (qui est plus faible chez P. vivax, P. ovale P. malariae et P. knowlesi que chez P. falciparum) plutôt que sur les différences intrinsèques entre les espèces de parasite. D’après les directives 2010 de l’OMS, les thérapies combinées avec un dérivé de l’artémisinine (ACT) constituent le traitement recommandé pour le paludisme non compliqué à P. falciparum (World Health Organization, 2018). L’artémisinine et ses dérivés ne doivent pas être utilisés en monothérapie dû au risque accru d’émergence de résistance. Le choix de l’ACT dans un pays ou une région sera basé sur le niveau de résistance à la drogue partenaire de l’association. Le paludisme sévère est une urgence vitale : après une évaluation rapide de l’état clinique et une confirmation du diagnostic, des doses complètes d’antipaludéens par voie parentérale doivent être administrées sans attendre, quel que soit le traitement disponible. En première intention, chez l’enfant et chez l’adulte, l’artésunate en administration intraveineuse ou intramusculaire est recommandé, de préférence à la quinine, pour le traitement du paludisme sévère à P. falciparum.
Les propriétés antipaludiques de l’artémisinine, extraite des feuilles de l’Artemisia annua, ont été découvertes par la chercheuse Youyou Tu, lauréate du Prix Nobel de physiologie ou médecine 2015, et introduites dans l’arsenal thérapeutique contre le paludisme dans les années 1970 afin de lutter contre l’émergence des résistances. Découverte dans la région du Grand Mékong, la résistance aux traitements antipaludiques est un problème récurrent : la résistance de P. falciparum aux générations précédentes de traitements, comme la chloroquine et l’association sulfadoxine- pyriméthamine, a émergé à la fin des années 50, puis s’est répandue dans les années 70 et 80, sapant les efforts de contrôle du paludisme et détruisant les progrès dans la survie infantile (Mita and Tanabe, 2012).
Ces dernières années, la résistance de P. falciparum à l’artémisinine a été détectée dans 4 pays de la sous-région du Grand Mékong : Cambodge, Myanmar, Thaïlande et Viêtnam (Takala-Harrison et al., 2013). Parmi les nombreux facteurs contribuant à l’émergence de la résistance, l’utilisation d’artémisinine en monothérapie par voie orale semble être un élément déclencheur important (Dondorp et al., 2010). Si la résistance à l’artémisinine se développe et se répand à d’autres grandes zones géographiques, les conséquences pour la santé publique pourraient être dramatiques, dû au manque d’alternatives thérapeutiques. L’OMS recommande donc un suivi régulier de la résistance aux traitements antipaludiques. Dans ce but, une surveillance de certaines mutations sur le gène K13 (PF3D7_1343700), marqueurs moléculaires de la résistance à l’artémisinine, est effectuée régulièrement à travers le monde (Ariey et al., 2014; Menard et al., 2016).
Alors que le paludisme à P. falciparum nécessite urgemment de nouveaux traitements pour surmonter les problèmes de résistance multiple, la chloroquine reste utilisée dans la plupart des cas de paludisme non P. falciparum du fait de son coût bas et de sa faible toxicité. Dans le cas des infections à P. vivax sensibles à la chloroquine ou à P. ovale, la chloroquine associée à la primaquine constitue le traitement de choix, y compris dans les cas de déficience moyenne à modérée en Glucose-6 phosphate déshydrogénase (G6PD). En effet, la persistance des formes hypnozoïtes, malgré l’élimination totale des formes sanguines, nécessite un traitement additionnel pour éviter les rechutes. Seules la primaquine et la tafénoquine ciblent les hypnozoïtes. Dans les cas de déficience sévère en G6PD (risque d’hémolyse), la primaquine est contre-indiquée et ne doit pas être utilisée. Dans les zones où P. vivax est chloroquino-résistant, les ACT (en particulier celles dont la drogue partenaire présente une longue durée de vie) sont recommandées. La chloroquine est également utilisée en traitement de première intention pour les infections à P. malariae et P. knowlesi. La primaquine et la tafénoquine sont utilisées pour éliminer les formes sexuées gamétocytes du parasite chez l’homme.
I.5.
M
ESURES PROPHYLACTIQUES ET
A
PPROCHE
V
ACCINALE
I.5.1 PREVENTION DE LA TRANSMISSION
Le renforcement de la prévention et des interventions de lutte anti-vectorielle a été une étape décisive dans le recul de la pathologie depuis l’an 2000. À l’échelle individuelle, la prévention du paludisme doit associer une protection physique contre les piqûres de moustique à une chimioprophylaxie médicamenteuse antiparasitaire (pour les sujets non immuns se rendant en zone impaludée). Les mesures de protection individuelle contre les piqûres de moustique comprennent :
• Le port de vêtements longs, imprégnés d’insecticide si possible,
• L’application de répulsif sur les parties découvertes du corps (DEET 30 à 50%, IR3535 20 à 35% ou picaridine 20 à 30%),
• La pose de moustiquaire imprégnée,
• La pulvérisation d’insecticide sur les murs internes des habitations.
La chimioprophylaxie est prescrite suivant la zone impaludée où se rend le voyageur, classée en trois groupes d’après des données épidémiologiques de résistance aux médicaments antipaludéens. Les principaux traitements utilisés sont l’atovaquone-proguanil, la doxycycline et la méfloquine.
Les moyens de contrôle du vecteur incluent la pulvérisation extérieure d’insecticides, la désinfection des zones de rétention d’eau (larvicides) ainsi que le drainage des zones de reproduction. Ces approches diffèrent en termes de coût, d’efficacité et d’étendue de leur impact sur l’environnement. Comparativement, les approches ciblées que sont les mesures de prévention individuelle, comme la distribution de moustiquaires imprégnées ou la pulvérisation dans les habitations, ont démontré une efficacité supérieure et rapide. L’émergence de résistance aux insecticides, particulièrement aux pyréthroïdes, pose désormais un problème important dans la lutte anti-vectorielle.
I.5.2 APPROCHES VACCINALES
Un vaccin efficace contre le paludisme constituerait un avantage majeur afin de compléter l’arsenal thérapeutique de lutte contre cette pathologie. Cependant, par rapport aux virus et aux bactéries, la recherche vaccinale se heurte à la complexité du parasite et de son cycle de vie : Plasmodium présente en effet une grande variété d’antigènes spécifiquement exprimés à chaque stade, une diversité de formes intra ou extracellulaires (Figure 3) et induit donc des réponses immunitaires hétérogènes chez l’homme. Il n’existe donc actuellement aucun vaccin capable d’assurer une protection idéale de 75% minimum contre P. falciparum et P. vivax. L’immunité protectrice partielle acquise par les personnes vivant en situation d’endémie indique cependant la possibilité d’une vaccination pour cette pathologie.
Les efforts de développement vaccinal sont ainsi actuellement axés sur le stade pré-érythrocytaire, le stade érythrocytaire asexué, le stade érythrocytaire sexué ou encore le passage chez le moustique (Figure 3). Ces derniers sont destinés à prévenir l’infection, à diminuer la morbidité et la mortalité en réduisant la multiplication asexuée du parasite dans le sang ou à diminuer la transmission au moustique.
Le stade pré-érythrocytaire est un stade particulièrement intéressant pour la recherche vaccinale car il est asymptomatique et essentiel au cycle de vie de Plasmodium. Injectés en petit nombre par l’Anophèle, 10 à 100 par repas sanguin, les sporozoïtes constituent une cible immunitaire plus accessible que les millions de parasites du stade sanguin (Frischknecht et al., 2004). Lors de leur migration à travers les tissus, les sporozoïtes vont ainsi être en contact avec l’immunité humorale, grâce aux anticorps de l’hôte présents dans les fluides et le sang. Après l’invasion hépatique des sporozoïtes, les hépatocytes vont présenter des antigènes du parasite en association avec des complexes majeurs d’histocompatibilité de classe I (CMH) permettant la reconnaissance immunitaire cellulaire par les lymphocytes.
C’est pour ces raisons que le modèle du vaccin vivant atténué est particulièrement intéressant en permettant l’induction d’une réponse immunitaire par injection de sporozoïtes entiers incapables de passer au stade sanguin, maximisant ainsi la diversité des antigènes immunogènes. Parmi les vaccins en développement, les vaccins sous unitaires présentant des antigènes spécifiques (pouvant provenir de plusieurs stades/plusieurs espèces) sont également étudiés.
V
ACCINS
OUS UNITAIRELa recherche vaccinale s’est focalisée, d’une part, sur les antigènes de surface du parasite ayant également été identifiés comme immunogènes dans les sérums de patients. Ces protéines, superficielles et spécifiques d’espèces, sont cependant capables de présenter des variabilités antigéniques afin d’échapper au système immunitaire de l’hôte (Hoffman et al., 2015). C’est pour cela que les nouveaux candidats vaccinaux sont désormais composés de plusieurs antigènes issus de différents stades du cycle parasitaire.
Le plus développé, le vaccin RTS,S/AS01 (nom commercial: Mosquirix; développé par GlaxoSmithKline et le Program for Appropriate Technology in Health Malaria Vaccine Initiative) est formulé à base de protéines circumspozoïtes (CSP) recombinantes de P. falciparum combinées à un antigène de surface du virus de l’hépatite B et d’adjuvants (Cohen et al., 2010). Il vise ainsi l’élimination des stades pré-érythrocytaires. Les études de phase 3 ont permis le suivi d’enfants de 6 à 12 semaines et de 5 à 17 mois sur une période de 43 mois en moyenne à la suite de 3 vaccinations successives. On a observé une protection de 28% (95% CI=23–33) chez les enfants de la catégorie des plus âgés, de 18% (95% CI=12–24) chez les enfants les plus jeunes et
de 26% (95% CI=20–32) chez les enfants les plus jeunes ayant reçu une dose « booster » au 20e
mois. Une protection contre le paludisme grave n’a été observée dans aucune des catégories d’enfants (Hoffman et al., 2015). Bien que ce vaccin ait démontré un potentiel de protection dans certaines conditions, il est nécessaire de développer un vaccin ayant des catégories d’âge ciblées plus étendues et une efficacité plus importante. Les développements envisagés concernent l’augmentation de l’immunogénicité du vaccin ainsi que la combinaison du RTS,S/AS01 avec des antigènes cibles de différents stades de Plasmodium.
Après une étude clinique de phase 3 sur 5 ans, en octobre 2015, deux groupes consultatifs de l’OMS se sont prononcés en faveur de l’implémentation pilote du vaccin RTS,S/AS01 dans trois pays d’Afrique (Ghana, Malawi et Kenya), en reconnaissant l’importance du vaccin pour la santé publique mais aussi la nécessité d’une évaluation précise de son efficacité avant son utilisation à plus grande échelle.
V
ACCIN VIVANT ATTENUEDe nombreuses études ont montré que l’immunisation avec de fortes doses de parasites vivants atténués, incapables de se développer après le stade pré-érythrocytaire, pouvait conférer une protection lors de l’exposition consécutive à des sporozoïtes infectieux chez l’homme et chez l’animal, dû au grand nombre d’antigènes présents sur ces parasites entiers. Les parasites actuellement étudiés ont été atténués par irradiation, par modification génétique, par traitement thérapeutique simultané ou par modification chimique. Cependant, de nombreux obstacles restent à surmonter quant à la faisabilité d’une telle immunisation chez l’homme dans les zones en développement car elle implique une injection intraveineuse, de nombreuses doses, une grande quantité de sporozoïtes produits ainsi que leur transport et conservation à basse température. Il est important de noter qu’il n’existe, pour le moment, aucun système de production efficace de sporozoïte in vitro et la production de sporozoïte in vivo nécessite l’élevage et l’infection de moustiques Anophèles.
II.
B
IOLOGIE DU SPOROZOÏTE
II.1.
C
LASSIFICATION
:
L
E PHYLUM DES
A
PICOMPLEXA
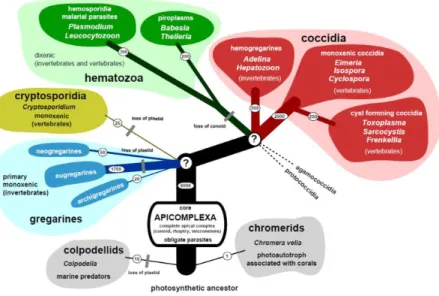
FIGURE 4 : ARBRE PHYLOGÉNÉTIQUE HYPOTHÉTIQUE DES APICOMPLEXA (VOTÝPKA ET AL., 2017).
L’épaisseur des traits représente la diversité́ des espèces par embranchement
Plasmodium appartient au phylum des Apicomplexa qui se divise en trois sous-groupes principaux : les coccidies, les grégarines, et les hématozoaires (Figure 4). Ce phylum comprend un grand nombre d’organismes eucaryotes unicellulaires, uniformément connus pour parasiter les hôtes vertébrés et invertébrés mais morphologiquement et écologiquement très différents. Le cycle de vie de la majorité des Apicomplexa implique une reproduction sexuée et asexuée dans l’hôte parasité, ainsi que des formes kystiques dormantes. Les stratégies de transmission sont diverses, de la transmission directe à un seul hôte (parasite monoxène comme les grégarines) à des cycles complexes au sein des chaînes trophiques entre les prédateurs et leurs proies (parasites polyxènes comme Toxoplasma), ou encore impliquant des vecteurs arthropodes. On estime qu’il existerait potentiellement 1,2 à 10 millions d’espèces d’Apicomplexa, et seules 6000 d’entre elles ont été identifiées et décrites à ce jour (Adl et al., 2007). Ces organismes sont responsables de pathologies médicales et vétérinaires ayant un lourd impact économique et représentant des défis majeurs pour la santé mondiale. En effet, le phylum comprend entre autres : Toxoplasma gondii, agent de la toxoplasmose qui infecte actuellement un adulte sur trois avec des conséquences graves chez les patients infectés par le VIH ainsi que chez les femmes enceintes ; Cryptosporidium, un pathogène aquatique également délétère chez les patients immunodéprimés ; Eimeria, responsable de pathologies chez les volailles, bovins et ovins, ou encore Theileria, qui cause fièvre, anémie et arrêts cardiaques chez
les bovins, ovins et caprins. Le genre Plasmodium compte quant à lui plus de 140 espèces infectant diverses espèces animales mais seules 6 sont retrouvées en pathologie humaine.
Anatomie d’un Apicomplexa
Le nom d’Apicomplexa provient du complexe destiné à l’invasion d’une cellule hôte qui est présent à l’apex des stades infectieux de ces parasites. Cette structure, composée du conoïde (sauf chez Plasmodium) et d’un anneau apical polaire, induit le déplacement du noyau et des mitochondries vers l’arrière de l’organisme. L’anneau polaire apicale sert de centre d’organisation (MTOC) pour les microtubules présents sous la paroi des parasites. Ceux-ci donnent leur forme aux Apicomplexa. La cellule est délimitée par la paroi, une structure formée de la membrane plasmique et du complexe membranaire interne (IMC) (Figure 5) (Morrissette and Sibley, 2002).
FIGURE 5 : STRUCTURE INTRACELLULAIRE D’UN APICOMPLEXA (MORRISSETTE AND SIBLEY, 2002)
Trois types d’organites sécrétoires sont typiquement présents chez les Apicomplexa, mais peuvent varier en forme et en nombre : les rhoptries, les micronèmes et les granules denses (Figure 5). Ils contiennent les protéines nécessaires à la mobilité de l’organisme, l’invasion de la cellule hôte et la mise en place d’une vacuole parasitophore. Les rhoptries et micronèmes sont toujours associés avec la partie antérieure de l’organisme alors que les granules denses sont souvent situés dans la partie postérieure (Morrissette and Sibley, 2002). Enfin, l’apicoplaste, organite caractéristique des Apicomplexa, est un vestige non-photosynthétique de l’endosymbiose secondaire d’une algue unicellulaire. Il est essentiel à la survie des parasite en participant à la synthèse des acides gras et des isoprénoïdes (Brooks et al., 2010).
II.3.
P
HYSIOLOGIE DU STADE PRE
-
ERYTHROCYTAIRE
II.3.1.
A
NATOMIE DU SPOROZOÏTELes sporozoïtes de Plasmodium présentent une forme de croissant de 8 à 14 µm de long et de 1 à 2 µm de large (Figure 7B). Ces dimensions varient en fonction des espèces. Leur morphologie allongée est parfaitement adaptée à leur déplacement continu à travers les tissus ainsi qu’à l’invasion cellulaire. Elle est due à la présence de microtubules (Figure 7 - A, C –
MT-vert) situés sous la double pellicule constituée de la membrane plasmique (violet) et de
complexe membranaire interne (IMC – stries jaunes) qui enveloppent le sporozoïte.
FIGURE 7 : STRUCTURE INTRACELLULAIRE DU SPOROZOITE DE PLASMODIUM (FRISCHKNECHT ET AL.,2017)
Contrairement à Toxoplasma, les sporozoïtes de Plasmodium ne présentent pas de conoïde au niveau du pôle apical mais uniquement un anneau polaire (Figure 6A et C – APR-
rouge). Ils possèdent les organites apicaux, propres à leur phylum, que sont les micronèmes (MIC-cyan), les rhoptries (entre 2 et 4 par parasite) (Rho-magenta) et les granules denses (DG-marron). Les micronèmes et les rhoptries ont pour fonction la sécrétion séquentielle de
protéines impliquées dans la mobilité et l’invasion. Ces phases de sécrétion complémentaires sont séparées temporellement en fonction des organites (Frischknecht and Matuschewski, 2017).
II.3.2.
G
LISSEMENT ACTIF DU SPOROZOÏTELors de son repas sanguin, la femelle Anophèle sonde le derme à la recherche de vaisseaux sanguins et injecte, avec sa salive, probablement moins d’une cinquantaine de sporozoïtes en moyenne dans la peau (Beier et al., 1991). Depuis leur site d’injection, les sporozoïtes progressent grâce à un glissement actif dans la matrice extracellulaire ainsi qu’en traversant différents types cellulaires. Les sporozoïtes vont rester en moyenne 30 minutes dans la peau. Certains vont demeurer sur le site d’injection alors que d’autres vont rejoindre les vaisseaux sanguins ou les vaisseaux lymphatiques (Figure 8).
Le glissement actif est un moyen de locomotion caractérisé par l’absence de cil, de flagelle ou de déformation cellulaire. Le sporozoïte se déplace avec une vitesse moyenne de 1–2 µm/s, selon un tracé tortueux et d’apparence hasardeuse in vivo (Amino et al., 2006) contrairement au tracé circulaire observé in vitro en présence de sérum (Figure 7B).
FIGURE 8 : PHASE PRE-ERYTHROCYTAIRE DU PALUDISME CHEZ LE RONGEUR (MENARD ET AL., 2013)
Le glissement actif implique un processus d’attachement ainsi qu’une force exercée sur le substrat, mais il nécessite également le renouvellement continu des sites d’attachement (Münter et al., 2009). Un complexe protéique parasitaire appelé glidéosome entre alors en jeu : il est formé d’un moteur cytoplasmique d’actine-myosine, fixé au cytosquelette, couplé à des « invasines » transmembranaires de la famille TRAP (thrombospondin related anonymous
protein) qui vont générer la traction en se liant à des protéines de l’hôte et permettre ainsi le
déplacement et l’invasion (résumé dans (Frischknecht and Matuschewski, 2017)). La protéine TRAP est une protéine micronémale à domaines TSR (thrombospondin type-1 repeat) et von Willebrand factor A (vWA), particulièrement impliquée dans la mobilité directionnelle du sporozoïte (Münter et al., 2009; Sultan et al., 1997). En effet, les parasites mutés pour la partie cytosolique de la protéine montrent une mobilité anormale (Kappe et al., 1999). Une étude récente a démontré que TRAP interagissait avec les intégrines à sous unité αv de l’hôte lors de la migration des sporozoïtes (Dundas et al., 2018). D’autre part, la protéine circumsporozoïte
(CSP), recouvrant densément la surface du sporozoïte, pourrait également contribuer à ce
processus. En effet, le blocage de la CSP avec des anticorps bloquants est capable d’immobiliser les sporozoïtes (Stewart et al., 1986)
Chez le sporozoïte, le renouvellement des sites d’attachement, permettant la locomotion, implique une sécrétion des protéines d’adhésion à l’apex du parasite puis leur translocation progressive sur la membrane vers l’arrière de la cellule avant d’être clivées par des protéases parasitaires. C’est le phénomène de « capping ». On retrouve ainsi, entre autres, les protéine CSP et TRAP déposées sur le passage des sporozoïtes, formant une « trace » observable in vitro
(Figure 7B) ou disséminées dans le microenvironnement du parasite in vivo (Stewart and
Vanderberg, 1991). Les protéines parasitaires impliquées dans l’attachement au substrat et le glissement actif restent en cours d’identification et leur rôle précis reste mal connu: S6, TLP (Hegge et al., 2010), LIMP (Santos et al., 2017), S4/Celtos (Steel et al., 2018) et SSP3 (Harupa et al., 2014) ont ainsi récemment été découvertes.
Au cours de la phase de migration, les sporozoïtes atteignant les ganglions lymphatiques sont majoritairement dégradés alors qu’une minorité d’entre eux s’y développe partiellement, présentant les antigènes précoces des EEFs (Amino et al., 2006). Parallèlement, on a montré chez P. berghei que jusqu’à 10% des parasites infectent le derme, l’épiderme et même les follicules pileux, zone d’immunotolérance (Figure 8) (Gueirard et al., 2010). Un faible nombre de parasites y complèteront leur développement mais la possibilité qu’ils puissent ainsi induire une infection sanguine reste encore controversée (Gueirard et al., 2010; Voza et al., 2012). La plupart des sporozoïtes ayant rejoint un vaisseau sanguin atteignent le foie. Des études montrent qu’ils s’arrêtent spécifiquement à ce niveau grâce à l’interaction forte de la protéine circumsporozoïte (CSP) parasitaire avec les protéoglycanes fortement sulfatés (Highly sulfated proteoglycans), présents à la surface des cellules stellées de l’espace de Disse, qui dépassent dans la lumière sinusoïdale à travers les fenêtres endothéliales (Coppi et al., 2007; Frevert et al., 1993; 1996; Pradel et al., 2002).
II.3.3.
D
E LA TRAVERSEE CELLULAIRE A L’
INVASION PRODUCTIVEEn atteignant le foie, les sporozoïtes quittent les vaisseaux sanguins grâce à un processus de traversée cellulaire des cellules endothéliales (Figure 8 - bleu), ou encore des cellules de Küpffer (macrophages résidents) avant d’atteindre les hépatocytes (Tavares et al., 2013). La traversée des cellules de Küpffer semble impliquer le récepteur CD68 de l’hôte et la protéine parasitaire GAPDH (Cha et al., 2016; 2015). Au sein du parenchyme hépatique, les sporozoïtes traversent ensuite successivement plusieurs hépatocytes avant d’envahir productivement l’un d’eux en formant une vacuole parasitophore où ils se différencieront.
La traversée cellulaire peut donc, par opposition, être appelée invasion non productive, car le parasite va pénétrer à l’intérieur de la cellule, traverser rapidement son cytoplasme et rompre la membrane plasmique pour en sortir, induisant parfois son apoptose (Mota et al., 2001).
• Rôle de la traversée cellulaire et déclenchement de l’invasion productive
Les premières études menées sur ce sujet soutenaient l’hypothèse que la traversée cellulaire permettait d’activer le mode d’invasion productif chez le sporozoïte en permettant l’exocytose de protéines d’invasion (Mota et al., 2002). Le mécanisme impliqué reste cependant inconnu et plusieurs hypothèses ont ainsi été suggérées.
L’activation de l’invasion productive pourrait être due à la libération de facteurs de croissance hépatocytaire (HGF) après la rupture membranaire des cellules traversées (Carrolo et al., 2003). Afin de tester cette hypothèse, on a observé que les sporozoïtes de P. berghei déficients pour l’une des protéines micronémales SPECT (sporozoite protein essential for cell traversal), soit SPECT1 ou SPECT2 (aussi appelée PLP1 pour Perforin like protein 1), sont incapables de traverser les cellules (Ishino et al., 2005a; 2004). PLP1 présente en effet un domaine de « complexe d’attaque membranaire » ou domaine perforine (MACPF). Grâce à une approche d’imagerie in vivo, on a ainsi montré que les parasites P. berghei mutants pour PLP1 présentent une infectiosité réduite et des défauts sévères de migration à travers le derme et la barrière sinusoïdale hépatique (Amino et al., 2008; Ishino et al., 2005a; Tavares et al., 2013). Deux études montrent cependant que ces parasites mutants réussissent néanmoins à envahir productivement les hépatocytes in vitro (Ishino et al., 2005a; Risco-Castillo et al., 2015). La traversée cellulaire apparaît donc comme un processus essentiel à la migration du sporozoïte à travers différents types cellulaires, dans la peau et dans le foie, mais elle ne semble pas indispensable à l’invasion productive. Une étude récente montre en ce sens que HGF serait impliquée dans la différenciation des sporozoïtes en EEFs au sein des hépatocytes et non lors de l’invasion (Bando et al., 2019).
D’autre part, une étude défend l’hypothèse que ce serait le haut niveau de sulfatation des HSPG à la surface des hépatocytes qui induirait le déclenchement du mode infectieux chez le sporozoïte (Coppi et al., 2007). Cependant, le clivage des HSPG à la surface des cellules HepG2 n’altère en aucun cas l’invasion productive (Frevert et al., 1996).
Enfin, la protéine CSP comprend une région N-terminale avec un site de clivage protéolytique, une région centrale variable répétitive et une région C-terminal à domaine TSR. Le contact du sporozoïte avec les HSPG induit le clivage de la partie N-terminale de la protéine (CSP) par une cystéine-protéase de la famille de la papaïne et l’exposition d’un domaine TSR (Coppi et al., 2005; Pradel et al., 2002). Ce mécanisme, critique pour une invasion efficace, a souvent été désigné comme responsable du passage au mode d’invasion productive (Coppi et al., 2005; 2007; 2011). De fait, la protéine CSP du sporozoïte est connue pour se lier aux HSPG (Frevert et al., 1993) mais le domaine précis de liaison reste inconnu.
• Mécanisme de la traversée cellulaire
L’étude menée en 2015 par Risco-Castillo montre que les sporozoïtes peuvent traverser activement une cellule au sein d’une vacuole transitoire lors de la traversée cellulaire ou invasion non productive (Figure 9A).
FIGURE 9 : MODELE D’INVASION CELLULAIRE PAR LES SPOROZOITES DE PLASMODIUM (RISCO-CASTILLO ET AL., 2015)
D’après son hypothèse, le processus d’entrée s’effectue sans rupture de la membrane de l’hôte comme initialement envisagé, mais au sein d’une vacuole transitoire dont le sporozoïte s’échappe ensuite en utilisant PLP1, dépendant de l’acidification lysosomale (2). Les sporozoïtes évitent ainsi la dégradation par fusion de la vacuole transitoire avec les lysosomes de l’hôte,
comme démontré avec les parasites déficients en PLP1 (4). Une rupture de la membrane de la vacuole pourrait néanmoins survenir avant la fermeture complète de celle-ci et permettrait la pénétration directe du sporozoïte dans le cytoplasme de la cellule (3). L’invasion productive dépend quant à elle d’une jonction mobile qui prendrait place avant la formation de la vacuole afin que le parasite se glisse directement dans une vacuole parasitophore (comme chez Toxoplasma - voir chapitre suivant) (5). Cette jonction pourrait également se former de façon intracellulaire, en permettant la transformation d’une vacuole initialement non-réplicative en vacuole parasitophore (7) (Risco-Castillo et al., 2015). Il a ainsi été démontré que Toxoplasma pouvait initier une invasion après avoir été passivement phagocyté par des macrophages (Zhao et al., 2014). In vitro, le passage de la traversée cellulaire à l’invasion s’effectue entre 30 et 90 minutes, suivant les expériences, après l’incubation des sporozoïtes de P. yoelii avec des cellules de lignée HepG2/CD81 (Risco-Castillo et al., 2015).
Enfin, d’autres protéines sont impliquées dans la traversée cellulaire. La protéine
CelTOS (Cell-traversal protein for ookinetes and sporozoites) est indispensable à la traversée du
parasite sous sa forme ookinète chez le moustique et sous sa forme sporozoïte chez l’hôte humain (Kariu et al., 2006). CelTOS se lie à l’acide phosphatidique, présent dans le feuillet interne des membranes plasmiques, afin de former des pores qui permettront une rupture membranaire et le passage des parasites Apicomplexa à travers divers vecteurs et cellules hôtes (Jimah et al., 2016). D’autre part, la délétion de la protéine TLP (Trap-like protein), appartenant à la famille TRAP/MIC2, empêcherait également la traversée cellulaire des sporozoïtes (Moreira et al., 2008). Enfin, la protéine PL est une phospholipase de surface qui contribuerait à l’étape d’échappement du parasite de sa cellule hôte lors de la traversée cellulaire du derme afin d’accéder aux vaisseaux sanguins (Bhanot et al., 2005).
II.3.4.
M
ECANISME D’
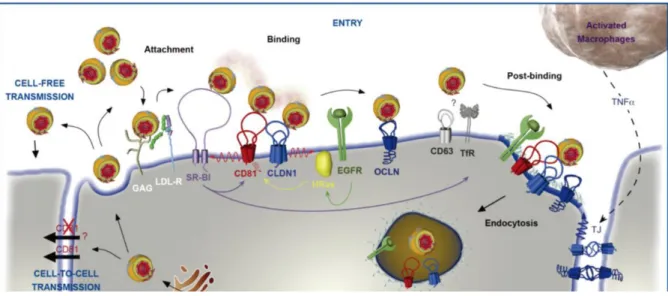
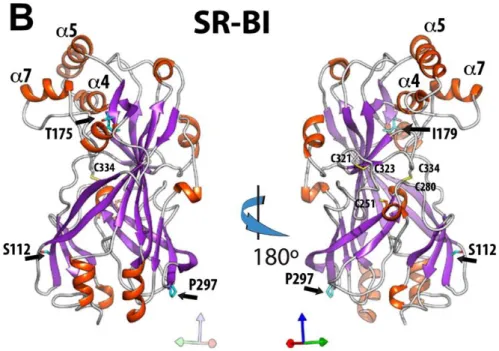
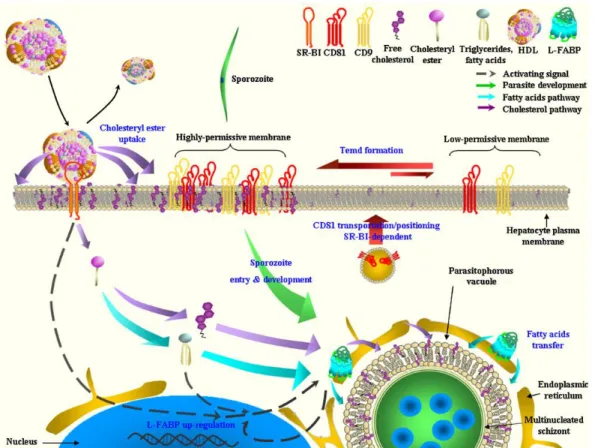
INVASIONL’invasion productive des hépatocytes par le sporozoïte de Plasmodium reste un processus encore méconnu contrairement à l’invasion des érythrocytes par la forme mérozoïte du parasite, mieux caractérisée. Ces deux processus d’invasion impliquent l’internalisation et le remodelage de la membrane cellulaire de l’hôte afin de former une vacuole parasitophore où le parasite réalisera son développement et sa réplication. À l’instar d’autres membres de la famille des Apicomplexa comme Toxoplasma, on pense que le sporozoïte forme une jonction mobile qui requiert un assemblage de facteurs d’hôte et de protéines parasitaires. Cependant, la composition et le moment de formation de cette jonction demeurent encore inconnus. Enfin, le virus de l’hépatite C (HCV) présente des similitudes intéressantes avec les sporozoïtes de Plasmodium dans le choix des récepteurs de l’hôte impliqués dans l’invasion (CD81, SR-BI…) Ainsi, l’analyse de ces trois modèles d’invasion – par les mérozoïtes, Toxoplasma et le virus de l’hépatite C – pourrait apporter de nouvelles clés dans la compréhension de l’invasion par le stade sporozoïte de Plasmodium. Nous allons particulièrement axer cette étude sur le stade de reconnaissance cellulaire entre le parasite et la cellule hôte. Nous étudierons ensuite en détails les facteurs moléculaires de l’hôte, récepteurs candidats à l’invasion hépatique de Plasmodium, et leur interaction avec les sporozoïtes au cours de l’invasion dans le chapitre suivant (III).
A. I
NVASION AU STADE ERYTHROCYTAIRE DEP
LASMODIUMLe mécanisme d’invasion des érythrocytes par Plasmodium falciparum a été étudié par microscopie (Gilson and Crabb, 2009). Le stade sanguin de Plasmodium, appelé mérozoïte, possède les mêmes organites sécrétoires que le stade sporozoïte : micronèmes, rhoptries et granules denses. Après l’éclatement d’un schizonte, les mérozoïtes sont relâchés dans la circulation sanguine afin d’envahir de nouveaux érythrocytes. Le processus d’invasion implique un attachement initial du mérozoïte par une adhésion faible, peu caractérisée, puis une réorientation du corps du mérozoïte afin de présenter son apex vers la membrane cellulaire
(Figure 10). Ensuite, l’établissement de liaisons irréversibles grâce aux protéines adhésines
déclenche la formation d’une jonction mobile avec l’érythrocyte (apparaissant dense par microscopie électronique) par sécrétion des protéines de rhoptries par le mérozoïte (Aikawa et al., 1978). La mise en place de cette jonction permet au parasite de se glisser à l’intérieur de l’érythrocyte à l’aide des connections entre les protéines de surface de l’hôte et le moteur actine-myosine parasitaire (Baum et al., 2006). De façon simultanée, une vacuole parasitophore se crée autour du mérozoïte grâce au flux de membrane érythrocytaire vers le cytoplasme cellulaire, à
travers la jonction mobile. La vacuole va ensuite se sceller et le parasite internalisé, désormais au stade d’anneau, entame sa métamorphose.
FIGURE 10 : UN MODELE D’INVASION ERYTHROCYTAIRE PAR LES MEROZOÏTES DE PLASMODIUM (SRINIVASAN ET AL., 2011)
Les protéines fonctionnellement impliquées dans l’invasion peuvent être divisées en deux groupes : les adhésines qui se lient directement aux récepteurs des érythrocytes et les invasines qui participent à l’invasion sans nécessairement établir une liaison avec la membrane de l’érythrocyte.
Les adhésines garantissent la spécificité d’adhésion des mérozoïtes aux érythrocytes. Les principales adhésines identifiées pour le moment appartiennent à deux familles protéiques : les EBL (erythrocyte binding-like) et les pfRH (reticulocyte binding-like homologue) (Figure 11) localisées respectivement dans les micronèmes et le cou des rhoptries. Des liaisons spécifiques ont déjà été caractérisées pour P. falciparum (Figure 11) (Cowman et al., 2017) :
• EBA-175, EBL1 et et EBA-140 se lient aux glycophorines A, B et C respectivement (Dolan et al., 1994; Maier et al., 2003; Mayer et al., 2009). EBA-181 serait également impliquée.
• PfRH4 se lie au récepteur 1 du complément (Tham et al., 2010).
• Le complexe de PfRH5 (peut-être associé à Pf113), PfRipr (Rh5-interacting protein) et CyRPA (cysteine-rich protective antigen) se lie à la Basigine ou CD147 (Crosnier et al., 2011).
• PfRH1, 2a et 2b n’ont pas de récepteurs connus.
• MTRAP (merozoïte TRAP) et PTRAMP (thrombospondin-related apical merozoïte protein) sont des protéines micronémales de la famille TRAP (thrombospondin-related anonymous protein) qui pourraient faire le lien entre les adhésines et les invasines en se liant avec le moteur actine-myosine du parasite (Uchime et al., 2012).
FIGURE 11 : FACTEURS MOLECULAIRES DE L’INVASION (COWMAN ET AL., 2017)
Il est intéressant de noter que les adhésines PfRH et EBL, à l’exception de RH5, sont également impliquées dans l’utilisation de voies d’entrée alternatives chez différentes souches de P. falciparum. Cette variation phénotypique permet une adaptation au polymorphisme érythrocytaire mais également un échappement vis-à-vis du système immunitaire de l’hôte (Duraisingh et al., 2003).
D’autre part, les protéines orthologues aux EBL chez P. vivax sont les protéines DBL (duffy binding like) qui se lient au récepteur aux antigènes Duffy (DARC) (Figure 11). Elles ne sont pas spécifiques des réticulocytes nécessaires à la réplication de P. vivax, au contraire du récepteur à la transferrine Tfr1 qui a été récemment découvert comme se liant à PvRBP2B (Gruszczyk et al., 2018).
Suite à la liaison aux adhésines, les invasines vont permettre la mise en place de la formation de la jonction mobile. AMA1 (apical membrane antigen 1) est une protéine de micronème, comme la famille de protéines EBL, mais n’est cependant pas présente dans les mêmes organites, suggérant ainsi l’existence de sous-populations de micronèmes (Healer et al., 2002). AMA1 interagit avec les protéines de la famille RON (rhoptry neck proteins) – RON2, RON4 et RON5 - qui s’assemblent à la jonction mobile lors de l’invasion (Alexander et al., 2006; Besteiro et al., 2011). Cet assemblage entre des protéines originaires de différents compartiments semble être typique des protéines impliquées dans l’entrée du parasite, dont les invasines (Chen et al., 2011). Malgré l’importance du complexe RON/AMA1 pour la jonction mobile, il n’existe actuellement aucune évidence de sa liaison directe ou indirecte avec le moteur d’actine-myosine (Angrisano et al., 2012). Enfin, il est intéressant de noter qu’AMA1 est actuellement considéré comme un candidat vaccinal d’intérêt qui est désormais en phase d’étude clinique (Besteiro et al., 2011; Thera et al., 2011).
Pour conclure, le processus d’invasion dépend de la sécrétion séquentielle de protéines de façon anticipée mais aussi synchrone à l’invasion. Ainsi, il y a de plus en plus d’évidences qui montrent une sous-compartimentation des protéines entre les organites et au sein même de celles-ci. Les rhoptries sont ainsi divisées en trois segments avec les protéines PfRh1, -2a, -2b, -4, and -5 situées dans le segment le plus apical et RON2-5 dans le segment suivant (« cou » des rhoptries). Enfin, des lipides et des protéines impliqués dans la formation de la vacuole parasitophore se situent dans le bulbe des rhoptries, comme RAP1-3 et RAMA. Cette organisation a pu être prédite grâce à la libération et l’utilisation précoce des protéines PfRH à la surface des mérozoïtes, en contraste avec la libération du complexe protéique RON. Cependant, ce modèle n’a pas encore été définitivement prouvé (Riglar et al., 2011).
D’autre part, le processus d’invasion implique un attachement initial du mérozoïte par une adhésion faible, peu caractérisée, puis une réorientation du corps du mérozoïte. MSPDBL1 et -2 ainsi que la famille des 6-cystéines (Pf38, Pf12, Pf92) sont présents en surface du mérozoïte (non sécrétés par des organites) (Cowman et al., 2012; Sakamoto et al., 2012; Sanders et al., 2005). Ces protéines se présentent comme des candidats potentiels à cette primo-interaction mais elles pourraient également jouer un rôle dans la protection contre les attaques du système immunitaire. Une étude récente a montré que la protéine Pf92 recrutait activement le Facteur H afin d’inhiber l’activation du système du complément et protéger le mérozoïte de la lyse (Kennedy et al., 2016).
B. I
NVASION CHEZ LES APICOMPLEXA:
T
OXOPLASMAG
ONDIIPour Toxoplasma Gondii, la phase initiale d’attachement à la cellule hôte dépend des protéines SAG, appartenant à la famille des protéines SRS, présentes à la surface du parasite. Cette famille de 20 protéines homologues présente deux rôles distincts : l’adhésion réversible à différents types de glycosaminoglycanes de la surface de la cellule hôte mais également la subversion vis-à-vis du système immunitaire (Boothroyd et al., 1998). À la différence de Plasmodium, Toxoplasma est capable d’infecter de nombreux types cellulaires grâce à la diversité des domaines adhésifs de ses ligands (Carruthers and Boothroyd, 2007). Cependant, les récepteurs de l’hôte impliqués dans l’infection n’ont pas encore été identifiés.
La phase suivante d’attachement implique la sécrétion dépendante du calcium des adhésines MICs. Ces protéines micronémales présentent différents domaines adhésifs : le Chitin Binding-like domain (CBL), le domaine EGF (epidermal growth factor-Binding-like), le domaine MAR (microneme adhesive repeat), et les domaines TSR (Figure 12) (Carruthers et al., 1999).
Les protéines MICs semblent posséder des rôles d’adhésion distincts au cours de l’infection. Elles forment toutes des complexes de protéines solubles liées à des protéines transmembranaires (Figure 12). La protéine transmembranaire MIC2 présente les mêmes régions conservées que la protéine TRAP chez Plasmodium. En complexe avec M2AP, elle est requise dans l’invasion des fibroblastes humains (Huynh et al., 2003).
FIGURE 12 : SCHEMA DES COMPLEXES DE MICS CHEZ TOXOPLASMA GONDII (CEREDE ET AL., 2005 ; HUYNH ET AL., 2003)
Les parasites déficients en MIC1 ou MIC3 induisent une infection moyennement atténuée chez la souris, alors que les parasites doublement déficients pour MIC1 et MIC3 sont non-virulents in vivo et ne peuvent pas produire d’infection mortelle (Cérède et al., 2005). Cela pourrait s’expliquer par l’adhésion des complexes MIC1/4/6 et MIC3/8 à deux récepteurs différents au sein de deux voies d’invasion distinctes. Ainsi les protéines MICs auraient un rôle synergétique en complétant et stabilisant l’interaction basale effectuée par MIC2 afin d’optimiser l’efficacité et l’adaptabilité de l’invasion par Toxoplasma gondii en fonction du type cellulaire (Carruthers and Boothroyd, 2007; Cérède et al., 2005).
L’identité des récepteurs de ces protéines chez l’hôte n’est pas encore complétement définie. Il a été démontré que le complexe MIC 1/4/6 pouvait se lier aux carbohydrates à résidus galactosidiques (Marchant et al., 2012). Un certain nombre de récepteurs candidats ont également été proposés pour lier le complexe MIC2/M2AP : ICAM-1, laminin-immobilized heparin, les chondroïtines sulfate A et C, les glycosaminoglycanes sulfatés, LAMTOR1 et la RnaseH2B (Barragan et al., 2005; Wang et al., 2014).
Cette phase de reconnaissance déclenche la sécrétion d’AMA1 à la surface du parasite et des protéines du « cou » des rhoptries, les RONs, au sein de la cellule hôte afin de former une structure en forme d’anneau appelée la jonction mobile.
La plupart des protéines de la jonction mobile sont conservées chez les Apicomplexa : les orthologues de RON2, RON4, RON5 and AMA1 sont présents dans les génomes de Plasmodium, Toxoplasma, Neospora, Eimeria, Theileria et Babesia (Besteiro et al., 2011).
Le mécanisme d’export de ces protéines vers la membrane et le cytoplasme de la cellule hôte reste cependant inconnu. On sait que RON2 est inséré dans la membrane plasmique de l’hôte : un court domaine est exposé de façon extracellulaire où AMA1, liée au moteur actine-myosine du parasite par une aldolase, vient interagir (Figure 13). AMA1 et RON2 établissent ainsi une interaction irréversible entre l’hôte et le parasite qui va permettre la traction de ce dernier dans la cellule (Lamarque et al., 2011). Des études récentes montrent que l’absence d’AMA1 et RON2 n’empêche pas la formation de la jonction mobile. En effet, les tachyzoïtes dépourvus d’AMA1 semblent activer l’expression d’homologues d’AMA1 et RON2 afin de maintenir leurs capacités d’invasion (Bargieri et al., 2013).
Toxoplasma va sécréter les protéines solubles RON4, RON5 RON8 et RON4LI du côté
cytosolique de la membrane cellulaire de l’hôte afin qu’elles se lient à RON2 (Besteiro et al., 2009; Guérin et al., 2017b) (Figure 13). RON 2, 4 et 5 vont ensuite coopérativement recruter les protéines de l’hôte, CIN85, CD2AP et les composants du complexe ESCRT-I, ALIX et TSG101. Ces protéines pourraient alors contribuer à la liaison du parasite au cytosquelette d’actine de la cellule hôte (Guérin et al., 2017a).
FIGURE 13 : DETAILS DE LA JONCTION MOBILE CHEZ TOXOPLASMA GONDII (BESTEIRO ET AL., 2011)
Peu après la formation de la jonction mobile, les protéines localisées dans le bulbe des rhoptries ROP1 et ROP2 sont relâchées dans la cellule hôte au sein de vacuoles qui fusionneront avec la vacuole parasitophore. Le parasite se tracte ensuite à l’intérieur de la cellule à travers la jonction mobile en formant une vacuole parasitophore. C’est à l’intérieur de celle-ci qu’il sécrètera les protéines de granules denses GRA qui permettront les échanges moléculaires entre le parasite et la cellule hôte (Résumé dans (Clough and Frickel, 2017)).