HAL Id: tel-01776865
https://hal.univ-lorraine.fr/tel-01776865
Submitted on 24 Apr 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
A la recherche de matériaux organiques pour l’optique
non linéaire : synthèse de 2,5-diaryl thiophènes, de
thiéno3,2-b thiophènes et de leurs analogues sélénies
Damien Prim
To cite this version:
Damien Prim. A la recherche de matériaux organiques pour l’optique non linéaire : synthèse de 2,5-diaryl thiophènes, de thiéno3,2-b thiophènes et de leurs analogues sélénies. Autre. Université Paul Verlaine - Metz, 1994. Français. �NNT : 1994METZ058S�. �tel-01776865�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le jury de
soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement lors de
l’utilisation de ce document.
D'autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact : ddoc-theses-contact@univ-lorraine.fr
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/V2/leg/leg_droi.php
UNTVERSITE
DE METZ
THESE
présentée en \nre de I'obtention du grade
Docteur de I'Université de METZ
È '
de
Mention: Chinie Moléculaire
par
Damien PRIM
A LA RECHERCHE
DE MATERIAUX ORGANIQUES
POUR
L'OPTIQUE
NON LINEAIRE:
SYNTHESE
DE 2,s-DIARYL
THIOPHENES,
DE THIENOI3,2-b]THIOPHENES
ET DE LEURS
ANALOGUES SELENIES
Soutenue Ie 22 Septenbre 1994 devant la comission d'examen
G. QUEGUINER, Frofesseur à lrUniversité de ROUEN (rapporteur) L. CHRISTIAENS, Professeur à l'Université de LIEGE (rapporteur)
F. LEISING, Directeur de Départenent RIIONE-POIJLENC-AIJBERVILLIERS J. F. NICOUD, Professeur à lrUniversité de STRASBOURG
G. IIIGNANI, Directeur de recherches RITONE-POIILENC-LYON St FONS G. KIRSCH, Professeur à lrUniversité de METZ (direcreur de thèse)
d
t
I*r -\ . oÈ)' l . ; f ' nË. ['* hit i.'iltF,.
K,.
lirTF'
UNIVERSITE
DE METZ
THESE
présentée en vue de I'obtention du grade de
Docteur de I'Université de METZ
M e n t i o n : C h i m i e M o l é c u l a i r e
par
Damien PRIM
A L A R E C H E R C H E
D E M A T E R I A U X O R G A N I Q U E S
POUR L'OPTIQUE NON LINEAIRE:
SYNTHESE
DE z,5-DIARYL THIOPHENES,
DE THIENOI3,2-b]THIOPHENES
ET DE LEURS
ANALOGUES
SELENIES
S o u t e n u e l e 2 2 S e p t e m b r e 1 9 9 4 d e v a n t l a c o m m i s s i o n d ' e x a m e n G . Q L I E G U I N E R , P r o f e s s e u r à 1 ' U n i v e r s i t é d e R O U E N ( r a p p o r t e u r ) L . C H R I S T I A E N S , P r o f e s s e u r à I ' U n i v e r s i t é d e L I E G E ( r a p p o r t e u r ) F. LEISING, Directeur de Département RHONE-POLJLENC-AUBERVILLIERS J . F . N I C O U D , P r o f e s s e u r à I ' U n i v e r s i t é d e S T R A S B O U R G
c. MIGNANI, Directeur de recherches RHONE-POULENC-LYON St FONS G . K I R S C H , P r o f e s s e u r à I ' U n i v e r s i t é d e M E T Z ( d i r e c t e u r d e t h è s e )
BIBLTOTHEQU E Uf{IVËTISITAIRE
- -l€rz
)9s+/+4s
I
A LA RECHERCHE
DE MATERIAUX ORGANIQUES
POUR L'OPTIQUE NON LINEAIRE:
SYNTHESE
DE 2,5-DIARYL THIOPHENES,
DE THIENOI3,2-b]THIOPHENES
ET DE LEURS
ANALOGUES SELENIES
Les travaux présentés concernent Ia synthèse de thiophènes, s é I é n o p h è n e s e t t h i e n o [ 3 , 2 - b ] t h i o p h è n e s s u b s t i t u é s p a r d e s groupements donneurs et attracteurs. L'introduction de ces substituants a pour but de créer une déIocalisation électronique pouvant induire des effets en optique non linéaire. Une première p a r t i e d é c r i t I a s y n t h è s e d e 2 , 5 - d i a r y l - t h i o p h è n e s e t - s é l é n o p h è n e s . L a m é t h o d e g é n é r a l e p r é c o n i s é e , u t i l i s e I a c o n d e n s a t i o n d e
béta-aryl-béta-chloro acroléines, de chalcogénures alcalins et de bromures de benzyles. Une étude comparative entre la synthèse précitée et une autre voie utilisant des rnéthodes de couplages de type SUZUKI et STILLE est également réalisée. Les études
spectroscopiques UV montrent qu'iI existe dans une même série, une r e l a t i o n e n t r e I a l o n g u e u r d ' o n d e d ' a b s o r p t i o n m a x i m a l e e t l e s constantes de HÀMMETT des substituants présents; et un déplacement bathochrome en passant de Ia série soufrée à Ia série séIéniée. Dans une deuxièrne partie, une étude en série hétérocyclique condensée a permis de développer trois nouvelles voies de synthèse d'aryl
t h i e n o 1 3 , z - b l t h i o p h è n e s , u t i l i s a n t d e s r é a c t i o n s d ' a r y l a t i o n à I ' a i d e d , o r g a n o m é t a l l i q u e s m a i s é g a l e m e n t d e s c y c l i s a t i o n s
intramoléculaires évitant ces réactions de couplages. Une étude comparative des différentes approches est présentée.
NON LINEAR OPTICS:
SYNTHESIS
OF 2,5-DIARYL THIOPHENES,
THIENOI3,2-b]THIOPHENES
AND THEIR
SELENIUM ANALOGUES
T h e s y n t h e s i s o f 2 r S - d i a r y l t h i o p h e n e s a n d s e l e n o p h e n e s a r e described in the first part. A general method of synthesis is used starting from beta-aryl-beta-chloro acroleins, sodiun sulfide and setenide and various substituted benzyl bromides. Association of donnor and attractor groups is used for introducing polarization in the molecule. It has been shown that exist a correlation between HAMMETT's sigrna values and the maximum absorption wavelength. AIso a bathochromic effect exist when going from thiophene to selenophene s e r i e s . I n a s e c o n d p a r t , n e h t 2 - a r y l t h i e n o l 3 , z - b l t h i o p h e n e s a r e presented. Their synthesis are described and compared using
palladium catalysed reactions and intramolecular cyclisation r e a c t i o n s .
REMERCIEMENTS
Le présent travail a été effectué dans Ie laboratoire de Chimie Organique de Ia Faculté des Sciences de METZ sous Ia direction du P r o f e s s e u r G i l b e r t K I R S C H .
A v a n t d e d é c r i r e m e s t r a v a u x , i e t i e n s à f a i r e p a r t d e m a
reconnaissance à toutes les personnes qui ont partagê, à un titre ou à un autre, mes joies et mes peines pendant les quatres années
p a s s é e s a u l a b o r a t o i r e .
Je tiens tout d'abord à remercier Ie Professeur Gilbert KIRSCH q u i r n ' a a c c e u i l l i v o i c i q u a t r e a n s d a n s s o n g r o u p e , q u i a g u i d é m e s premiers pas et qui m'a comnuniqué son goût pour Ia chirnie. Puisse notre collaboration ne pas s'achever par ce mémoire.
Je remercierais également le Professeur PAQUER de m'avoir a c c e u i l l i a u L . C . O . e n J u i n l - 9 9 0 e t d e s o n a i d e d a n s
I'interprétation des spectres RMN.
J e t i e n s à r e m e r c i e r I e P r o f e s s e u r G . Q U E G U I N E R d e I ' u n i v e r s i t é d e R O U E N , I e P r o f e s s e u r L . C H R I S T f À E N S d e I ' u n i v e r s i t é d e L I E G E e t
I e P r o f e s s e u r J - F . N I C O U D d e l ' u n i v e r s i t é d e S T R À S B O U R G d ' a v o i r accepté de juger mon travail.
Jtadresse également mes remerciements à Messieurs G. MIGNANI et F. LEISING, directeurs de recherches RHONE-POULENC, pour leurs
conseils avisés lors de nos réunions de travail, leur intérêt à mes travaux et leur disponibilité durant ces quatres dernières années.
Je tiens à exprimer toute ma reconnaissance à Messieurs G. RÀMOS et P. CHEMLÀ, directeurs de recherches CIBÀ-GEIGY, qui m'ont
fait bénéficier avec leur gentillesse coutumière des services de la bibliothèque de CIBÀ lors de ma recherche bibliographique.
P i e r r e , N i c o l a s e t P a s c a 1 d u L E M , I e s p r o f e s s e u r R . G R U B E R e t D . C A G N I À N T , a i n s i q u e l e s m e m b r e s d u g r o u p e : D e l p h , L o I o , A l a i n ,
N a s h u a , M u r i e l , V a l é r i e , t e s t é c h n i c i e n n e s M o n i q u e , V e r o , F r a n ç o i s e , Christelle mais également Véronique et Eric DIDIER pour leur aide et I e u r s y n p a t h i e .
Mes pensées vont également au Professeur Pierre FÀLLER, gui a su me guider et me conseiller dans mes premières expériences
d ' e n s e i g n e m e n t . J e n t o u b l i e p a s n ' o n p l u s q u e s a n s s o n a i d e , ie n ' a u r a i s a n s d o u t e p a s r é u s s i m o n e n t r é e à I ' U n i v e r s i t é .
Je ne terminerais pas ces remerciements sans penser à mes p a r e n t s , Ç u t i I s v o i e n t d a n s c e m é m o i r e l ' a b o u t i s s e m e n t d e l e u r s e f f o r t s e t d e l e u r s s a c r i f i c e s .
S O M M A I R E
INTRODUCTION BIBLIOGRÀPHIE Diaryl thiophènes D i a r y l s é l é n o p h è n e s 2 - A r y L e t 2 , S - d i a r y l t h i e n o L3 ,2-bl thiophènesCIAPITRE I: SYIflTIIESE DE 2,5-DrÀRYL THTOPHENES
I-]- INTRODUCTION I - 2 M E T H O D E S D E S Y N T H E S E D E S 2 , s - D I À R Y L T H I O P H E N E S L 6 7 1 1 I 4 1 _ 8 1 _ 8 l _ 9 L 9 1 _ 9 2 0 2 0
I-2-L Les néthodes à I-?-L-L Couplage par I - 2 - L - 2 C o u p l a g e p a r I-2-L-3 Couplage par I-2-1,-4 Couplage par I-2-L-5 Conclusion
partir du thiophène des organozinciques des organomagnésiens des organostanniques des acides boroniques
T-2-2 Les néthodes de construction du cycle thiophénique
I-2-2-L La synthèse de PAÀL-KNORR
I - 2 - 2 - 2 L a c o n d e n s a t i o n d e s Ê - a r y l - Ê - c h l o r o a c r o l e i n e s
2 L 2 I 2 2
thiophènes
I - 3 S Y N T H E S E D E S 2 , 5 - D I A R Y L T H I O P H E N E S I - 3 - 1 - S y n t h è s e d e s Ê - a r y l - Ê - c h l - o r o a c r o l e i n e s I - 3 - 2 A c c è s a u x 2 , S - d i a r y l t h i o p h è n e s
I-3-2-L Synthèse des bromures de benzyles T - 3 - 2 - 2 S y n t h è s e d e s n o l é c u l e s c i b l e s I - 3 - 3 C o n c l u s i o n
I-4 ETUDES DES REACTTONS DE COUPLÀGE A PÀRTTR DU THIOPHENE I - 4 - L S y n t h è s e d u 2 ( 4 N N d i m é t h y l a m i n o p h e n y l ) s -( 4 - n i t r o p h e n y l ) t h i o p h è n e l - g , k I - 4 - 2 E t u d e d e l a V O I E A 1 - 4 - 2 - L V O f E A l - : R l = Z n C L i R 2 = H a I I - 4 - 2 - 2 V O I E A 2 : R 1 = H a l ; R 2 : S n B u 3 l - 4 - 2 - 2 - 1 - S y n t h è s e d e l ' o r g a n o s t a n n i q u e I T - 4 - 2 - 2 - 2 S y n t h è s e d u S - h a l o g é n o - 2 - ( 4 - n i t r o p h e n y l ) thiophène 9 I - 4 - 3 E t u d e d e I a V O I E B I - 4 - 3 - l - S y n t h è s e d u 2 - ( 4 - N N d i m é t h y l a m i n o p h e n y l ) thiophène 12 I - 4 - 3 - 2 O b t e n t i o n d u d é r i v é 1 g , k p a r c o u p l a g e T - 4 - 4 C o n c l u s i o n 2 4 3 3 2 5 2 5 2 8 2 8 2 9 3 2 3 3 3 5 3 5 3 6 3 6 3 9 4 0 4 2 3 6 3 9
I-5 SPECTROGRÀPHIE f - 5 - 1 f n t r o d u c t i o n T-5-2 Influence des I ' a b s o r p t i o n I - 5 - 3 I n f l u e n c e d e s I ' a b s o r p t i o n I - 5 - 4 C o n c l u s i o n ULTRÀVIOLETTE
groupements donneurs sur
maximale
groupements attracteurs
sur
maximale
4 3 4 3 4 6 5 3 5 5CIIAPITRE IT: SYIITHESE DE 2,5-DIARYL SELENOPHENES
rI-1 INTRODUCTION 56
IÏ_2 CHOIX DE LA METHODE DE SYNTHESE 57 rr-3 SYNTHESE DE 2,s-DIARYL SELENOPHENES 57 I T - 4 E T U D E U . V . 6 0 I I - 5 C O N C L U S I O N 6 2 II-6 REMÀRQUE: APPROCHE DE LÀ SYNTHESE DE 5,5, -DIARYL
- 2 , 2 , - B I T H I O P H E N E S 6 3 I I - 6 - 1 - I n t r o d u c t i o n 6 3 I I - 6 - 2 S y n t h è s e e n s é r i e b i t h i o p h é n i q u e 6 5 T . I - 6 - 2 - L 2 - a c é t y l - 5 - a r y l t h i o p h è n e s e t s é I é n o p h è n e s 6 5 TI-6-2-2 Réaction de VILSI{AIER-IIAÀCK-ARNOLD appliquée
aux dérivés 15e et l-6e 66 I I - 6 - 3 C o n c l u s i o n 6 7
I - G é n é r a l i t é s
I I - P r é p a r a t i o n d e s Ê - a r y l - Ê - c h l o r o a c r o l e i n e s 2 I I I - S y n t h è s e d e s 2 , S - d i a r y l t h i o p h è n e s 1
IIf-l Synthèse des bromures de benzyles 3 TII-2 Synthèse des 2,S-diaryl thiophènes
IV- Synthèse des 2,S-diaryl thiophènes par les réactions de couplages rv-l- voIE A1_ T V - 2 V O I E À 2 I V - 3 V O I E B 6 9 7 0 7 2 7 2 7 3 8 2 8 2 8 3 8 5 V - S y n t h è s e d e s 2 , 5 - d i a r y l s é I é n o p h è n e s L 4 8 8 V-1 Préparation du séIéniure de sodium 88 V - 2 C o n d e n s a t i o n d e s Ê - a r y l - Ê - c h l o r o a c r o l e i n e s a v e c
N a 2 S e g g
V-3 Synthèse en série bithiophénique 94
CIAPITRE III: SYI{IHESE DE 2,5-DfÀRYL THIENO [ 3, 2-b ] TIIIOPHENES III.1 INTRODUCTION
IIT-2 SYNTHESE DES 2-ARYL THIENO[3,2-b]THTOPHENES 20 I I I - 2 - 1 - V O I E A : p a r c o u p l a g e d ' o r g a n o n é t a l l i q u e s d u
t h i e n o L3 ,2-b l thiophène
f I I - 2 - 1 - 1 - S y n t h è s e d u t h i e n o t 3 , 2 - b J t h i o p h è n e 2 I I I I - Z - L - 2 C o u p l a g e d e s o r g a n o m é t a l l i q u e s d u
t h i e n o [ 3 , 2 - b . ] th i o p h è n e
TIT.-2-L-Z-L Synthèse des organométalliques du t h i e n o 1 3 , z - b l t h i o p h è n e 2 6 , 2 7 e E 2 A III-2-I--2-2 Réactions de couplage
I f I - 2 - 1 - - 2 - 2 - L M é t h o d e À : c o u p l a g e d e I , o r g a n o z i n c i q u e T T T - 2 - L - 2 - 2 - 2 M é t h o d e B : c o u p l a g e d e s a c i d e s boroniques I f I - 2 - 1 - 2 - 2 - 3 M é t h o d e C : c o u p l a g e d e l'organostannique I I I - 2 - L - 2 - 2 - 4 C a s d u m é t h y l s u l f o n y l z O j I I I - 2 - l - - 3 C o n c l u s i o n T T T - 2 - 2 V O I E D ' A C C E S B
ITT-2-2-L Synthèse des sulfures 29
I I T - 2 - 2 - 2 S y n t h è s e d e s d é r i v é s f o r n y l é s 3 0
TII-2-2-3 Obtention des thieno13,2-blthiophènes 20 IIT.-2-2-4 Cas particulier du 2-phenyl
t h i e n o 1 3 , 2 - b l t h i o p h è n e s 2 O a n o n s u b s t i t u é I 2 7 ITI-2-2-5 Conclusion L2B 1 _ 0 6 L O 7 l_ l_ t_ 1 1 1 L L 4 1 _ 1 6 1 , L 7 L L 7 L 1 _ 9 L 2 0 L 2 t L 2 2 L23 L 2 4 L 2 5 L 2 6
2 , 5 d i s u b s t i t u é s I I I - 2 - 3 - L l n t r o d u c t i o n
I T I - 2 - 3 - 2 P r é p a r a t i o n d e GOD
thiophènes substitués par
L29
r29
un
L 3 3 1-34 l _ 3 5 l i t h i a t i o n l - 3 5 L 3 7 1 , 3 7 l _ 3 8 L 4 0 I 4 T L 4 t L 4 L 1 4 3 L 4 6 L 4 7 L 4 8 L 4 9 I I I - 2 - 3 - 3 L i t h i a t i o n a s s i s t é e I I I - 2 - 3 - 3 - ] - E s s a i s d e l i t h i a t i o n I T T - 2 - 3 - 3 - 2 O b t e n t i o n d e s u l f u r e s p a r I I I - 2 - 3 - 4 C y c l i s a t i o n I I I - 2 - 3 - 4 - 1 - C y c l i s a t i o n p a r I a r o u t e l -I -I -I - 2 - 3 - 4 - 2 C y c l i s a t i o n p a r I a r o u t e 2 ITI-2-3-5 ConclusionIII-3 SYNTHESE DE STRUCTURES DONNEUR-ÀTTRÀCTEUR s E R r E T H T E N O 1 3 , z - b I T H I O P H E N I Q U E I I I - 3 - l - I n t r o d u c t i o n I I I - 3 - 2 S y n t h è s e d e 2 , S - d i a r y l t h i e n o l3 ,2-b lthiophènes I I I - 3 - 2 - 1 S y n t h è s e d e 2 - a r y l - 5 - h a l o g é n o t h i e n o f3 ,2-b lthiophènes I I I - 3 - 2 - 2 O b t e n t i o n d e s 2 , 5 - d i a r y l t h i e n o [ 3, 2-b] thiophènes III-3-2-3 Conclusion
III-3-3 Structures de type donneur-attracteur I I I - 3 - 4 E t u d e U . V .
CHÀPITRE TV: E)(TENSTON À IÀ SERIE
SELENOT.o [ 3, 2-b ] IHIOPHENTQUE IV-]- INTRODUCTION
IV-z CHOIX DES METHODES DE SYNTHESE
I V - 2 - 1 P a r m é t a l l a t i o n d u s é I é n o l o [ 3 , 2 - b ] t h i o p h è n e puis arylation par couplage
T V - 2 - 2 P a r c y c l i s a t i o n i n t r a m o l é c u l a i r e TV-2-3 Synthèse des séléniures 50
I V - 2 - 3 - 1 - P a r c o n d e n s a t i o n d ' u n d i s é I é n i u r e s u r l e 3 - t h i e n y l l i t h i u m I V - 2 - 3 - 2 P a r i s o l e m e n t d u s é l é n a t e d e l i t h i u n i n t e r m é d i a i r e s u i v i d e I a c o n d e n s a t i o n d ' u n bromure de benzyle I V - 2 - 3 - 3 P a r d i l i t h i a t i o n à p a r t i r d u 2,3 dibromothiophène
IV-2-3- 4 Par quaternisation-déquaternisation IV-3 CONCLUSION
PARTIE EXPERII,IENTALE B
I- Synthèse des 2-aryl thieno13,2-blthiophènes I - 1 V O I E A : p a r c o u p l a g e d ' o r g a n o m é t a l l i q u e s I-2 VOIE B: par cyclisation intrarnoléculaire I - 3 V O I E C : p a r l i t h i a t i o n a s s i s t é e L 5 4 L 5 5 l _ 5 5 L 5 6 t57 1 5 8 l _ 5 8 l _ 5 9 1 5 9 t_61_ L62 t _ 6 3 1 6 3 1 " 7 0 L 7 7
s é r i e t h i e n o 1 3 , 2 - b l t h i o p h é n i q u e If-L synthèse de 2-aryl-5-halogéno
t h i e n o 1 3 , z - b l t h i o p h è n e s 4 2 II-2 Formylationdes dérivés
t h i e n o l3 ,z-bl thiophéniques
L87
L87
1 8 9
I I I - E x t e n s i o n à I a s é r i e s é l é n o l o [ 3 , 2 - b ] t h i o p h é n i q u e 1 9 1 III-1 Synthèse du séléniure de butyle et de
3-thienyle 5l- L9L
lII-2 Essais de synthèse du séléniure 5O L92 III-3 Essais de synthèse par quaternisation L92
REFERENCES 1 _ 9 3
CONCLUSION L 9 9
B u I i
ccM
DBA DME DMF dppe HaI Hept LDA NBS TBÀHS THF TPPABBREVIATIONS
b u t y l l i t h i u mChromatographie sur couche mince dibenzylidèneacétone
dinethoxyethane dinethylformamide
diphenyl phosphi noethane halogène heptane diisopropylamidure de Iithiun n-bromo succinimide tetrabutylamoniumhydrogènesul f ate tetrahydrofurane triphenylphosphine
INTRODUCTION
L'avènement du laser et l-'évolution de ses applications ont été les catalyseurs des recherches dans Ie domaine de I'optique dite t r n o n }inéairerr(nous c h o i s i s s o n s I a d é s i g n a t i o n o . N . L . d a n s I a s u i t e d u t e x t e ) .
L a t h é o r i e d e 1 I O . N . L . a d ' a i l l e u r s é t é c o u r o n n é e p a r
1'attribution au Professeur Bloenbergen du prix Nobel de physique en L 9 8 L . L ' é I a b o r a t i o n d e c e s m a t é r i a u x O . N . L . r é v o l u t i o n n e
actuellement le monde des télécommunications avec les transmissions optiques de données mais trouve également des applications dans Ia i chimie }aser avec des recherches sur les doubleurs de fréquences ou
encore dans les natériaux photoréactifs, les guides d'ondes et les modulateurs éIéctro-optiques.
Les matériaux inorganiques ont été les premiers à être
utilisési par exemple les cristaux tels que Ie Niobate de Lithium LiNbOs ou de potassium KNbO3, I'oxyphosphate de titanyl potassium KTioPo4 (KTP) ou des filrns transparents de céramiques inorganiques de Titanate-Zirconate de Plornb-Lanthane (PLZT \.
Depuis peu et de plus en plus, des composés organiques exhibant ces propriètés sont développés <87MI25O> tels que J-a
paranitroaniline utilisée conme systèrne modèle ou encore }es
exernples suivants choisis dans Ia littérature illustrant Ie type de I structures déjà synthétisées dans les dernières années.
. 2
-M . , < 6 7 T I 7 3 > N O , CHO Me rN < 7 7 A X ( B 3 3 ) 2 3 3 7 > < 7 1 M r ( 1 8 )4 s 6 > R - O 2 s - N H < 8 0 M r ( 4 9 ) s 8 6 > < 8 4 J C P 4 1 6 0 > < 8 8 C C 7 3 7 > < 8 3 M r ( 5 7 ) 2 3 3 > < 8 0 c R V 4 1 > < 8 5 M r > M e , N.H
, C N Mes/ \a* < 8 3 A X ( C 3 9 ) s B 9 > N1/l
P h ( M e ) c H - T 1 , 1No,
HC e n ' e s t q u e t r è s apparus dans le domaine
récemment que d e l ' O . N . L . ;
Ies dérivés thiophéniques sont
C N <90TL4143> *i+ Me/ r\.\ M e , N < 9 O E U P > < 9 2 C C 6 2 0 > < 9 3 A G ( E ) 1 1 9 > < B O J P S 2 8 6 9 > < 8 9 C C 1 3 1 8 >
I
t_'
, 4
-L e p h é n o m è n e d ' O . N . -L . s ' o b s e r v e l o r s q u e I e m a t é r i a u e s t p l a c é dans un champ éIéctrique, Ia polarisation qui en résulte est donnée p a r I ' é q u a t i o n s u i v a n t e :
P : u o * a E + Ê 5 ( z ) a X E ( 3 ) .
-où P représente 1a somme de Ia polarisation dans I'état
fondamental p6 et de la polarisation induite par Ie champ externe; c é t a n t I e c o e f f i c i e n t d e p o l a r i s a t i o n l i n é a i r e e n r e l a t i o n
notamment avec f indice de réfraction de Ia molécule, F et x sont les coefficients d'hyperpolarisabilité quadratique et cubique r e s p o n s a b l e s d e s p r o p r i è t é s o . N . L . .
L e s p h é n o m è n e s O . N . L . s o n t t i é s à d e s v a l e u r s d e F e t x é l e v é e s .
Caractéristiques structurales influençant les effets o.N.L. :
-les valeurs élevées de Ê et x sont généralement associées à f importance du systène éléctronique n dans les composés organiques: Ia quantité d'énergie considérable d'un système éIectronique rT (une double liaison équivaut à environ 1-SOkcal/mol) est associée à une i m p o r t a n t e p o s s i b i l i t é d e d é l o c a l i s a t i o n d e s é l e c t r o n s .
-L'influence des substituants sur Ia molécule: une fonctionnalité appropriée à chaque extrénité peut accroitre Itarrangement non-centrosymétrique des chromogènes actifs. Un groupement Donneur ou Attracteur seuL sur un systène aromatique
perturbe Ia densité électronique mais Ie naximurn d'effet est obtenu lorsque ces deux groupements sont conjugués.
L'introduction du thiophène dans les structures à propriètés O . N . L . e s t p e r t i n e n t e p o u r p l u s i e u r s r a i s o n s :
-I'étude de systèmes thiophéniques a permis de mettre en
évidence I'activité supérieure (jusqu'à trois fois) de ces systèmes par rapport à leurs honologues benzéniques <90Mf>.
-Ia bonne résistance thermique des systènes potythiophéniques < 9 0 J C P 4 0 7 7 > .
-la résistance à I'irradiation laser lors des analyses s p é c i f i q u e s à I ' o . N . L . < 9 0 T L 4 7 4 3 > .
-la possibilité d'intervention des orbitales d du soufre dans I e s d é I o c a l i s a t i o n s d ' é l e c t r o n s d a n s c e r t a i n s f i l m s à b a s e d e
6 '
-Les substances envisagées dans la présente étude tiennent compte des différentes caractéristiques structurales énnoncées précédenment.
Nous avons retenu plusieurs types de structures: -des composés thiophéniques
-des dérivés séIénophéniques
-des structures thiophéniques condensées
X : S o u S e
Le présent travail
aura pour principal
souci Ia synthèse des
I
structures
proposées en variant
les substituants
D et A, Ies
I
fystèmes aronatiques ainsi
que I'hétéroatome
(S ou Se) mais
également en proposant de nouvelles voies d'accès.
DIARYL THIOPHENES
Depuis Ia fin du siècle dernier, uD grand nombre de t h i o p h è n e s 2 , 5 d i s u b s t i t u é s o n t é t é s y n t h é t i s é s < 5 2 H C ; 5 4 H C ; 8 5 H C ( 1 )
; 8 5 H c ( 2 ) ; e s H c ( 3 ) > m a i s s e u l e m e n t q u e l q u e s 2 , S - d i a r y l t h i o p h è n e s o n t é t é d é c r i t s .
L a p r i n c i p a l e m é t h o d e d e s y n t h è s e u t i l i s é e e s t l ' a n c i e n n e méthode de PÀÀL-KNOOR <1-886CB555> de construction des cycles thiophéniques. substituées Ia I e 2 , S - d i p h e n y l P r S t - I I t t
A
* 1 r ' > R '
À p a r t i r d e d i c é t o n e s L , 4 j u d i c i e u s e m e n t synthèse de diphenyl thiophènes est possibl-e. Àinsi KUES et PAÀL<1886CB3141> obtenaient t h i o p h è n e :P , S ,
8
-D è s L 8 8 7 , I I A L L E M A N < 1 8 8 7 R T C 6 0 > d é c r i v a i t I e 2 , s - d i p - t o l y l thiophène.
Depuis, quelques composés ont été synthétisés toujours à partir d e d i c é t o n e s I , 4 à I ' a i d e d e P 2 S 5 , H 2 S < 7 7 2 C 4 I 1 " > , d u r é a c t i f d e L À I i I E S S O N < 8 2 5 1 0 6 ] . ) , d e ( B u 3 S n ) 25 <92JOCL722>, ou encore d'autre systèmes suLfurants <7 4T4LL3>z
-des dérivés disubstitués
syxnétriques:
a v e c R = R t : C I , M ê , M e O , H . -des dérivés dissytnétriques:
a V ê C R : M e O ; R r : M e O U H L e s 1 , 4 - d i a r y l d i y n e s c o n s t i t u e n t <62C8L943>. é g a l e m e n t u n e v o i e d ' a c c è s H , S
+
Dernièrernent Gronowitz <90H645> décrivait Ia synthèse du 2,S-diphenyl thiophène par couplage aryl--aryl.
n
M e 3 s n { s n M e , B r - P h t
Dtautre part, I'obtention de composés diversement substitués sur les noyaux benzéniques ne peut pas s'envisager par substitution éIectrophile du 2,S-diphenyl thiophène car celle-ci conduiÈ à des tétrasubstitutions <1886C83 L4l> ?
La néthode de PÀÀL-KNOOR a I'avantage d'une mise en oeuvre relativement simple rnalgré des rendements variabl-es.
Cette voie semble particulièrement adaptée à Ia synthèse de 2 , S - d i a r y l t h i o p h è n e s s y n é t r i q u e s .
La difficulté de synthèse de dérivés non syrnétriques par cette m é t h o d e r é s i d e d a n s I ' o b t e n t i o n d e s d i c é t o n e s L , 4 , v u I a v a r i é t é d e substituants, nécessaires sur les différents noyaux benzéniques et susceptibles cl'apportêr ites propriètés o.N.L., çlue nous avons c h o i s i s .
Le tableau suivant thiophènes disubstitués
, 1 0
-résume les différents d é j à s y n t h é t i s é s : 2 , 5 - d i p h e n y l R R ' R é f é r e n c e s H H 1 8 8 6 C B 3 1 4 1 ; 1 8 8 7 R T C 6 0 : t 1 Z C 4 I 1 ; 8 2 S 1 0 6 1 ; 6 2 C 8 I 9 4 3 ; 9 0 H 3 0 ( 1 ) 6 4 5 Me Me 1 8 87RTC60 : 7 4T 4L13 : 9 2JoCLl 22 MeO H 8 2 S 1 0 6 1 MeO Me 8 2 S 1 0 6 1 C 1 C I 8 2 S 1 0 6 1 MeO MeO 8 2 5 1 0 6 1 I
DIARYL SELENOPHENES
Les propriètés chimiques et e n g é n é r a l v o i s i n e s d e c e l l e s d e s 8 6 M r ( 1 ) 3 e e > .
structurales des sélénophènes thiophènes <7oÀHC (L2) L î
Certaines synthèses de 2,S-dlaryL sélénophènes ont été inspirées de leurs analogues thiophéniques.
P a r e x e m p l e I ' a c t i o n d e N a S e H o u H 2 S e s u r d e s d i y n e s L , 4 d i s u b s t i t u é s a p e r n i s I ' o b t e n t i o n d u 2 , 5 - d i p h e n y l s é I é n o p h è n e < 6 8 C C 3 6 5 ; 7 8 J H C 1 1 - 8 5 > . H r s e
+
( o u N a S e H )Le 2,5-diphényl sélénophène est également obtenu par GRONOI{fTZ <77CS11> qui nodifia Ia précédente ruéthode en utilisant du séIénium supporté sur alumine.
SeuI LÀLEZÀRI a proposé deux voies de synthèse permettant d ' o b t e n i r d e s 2 , S - d i a r y l s é I é n o p h è n e s d i s u b s t i t u é s < 7 3 J H C 9 5 3 ; 7 6 J H C 5 7 > .
- par décomposition élevée et en présence de s é l é n o p h è n e s :
' 1 2
-d e I , 2 , 3 - s é l é n a -d i a z o l e s à séIénium, oD obtient des
température
d i a r y l
m a j o r i t a i r e m i n o r i t a i r e S e l o n l e s c o n d i t i o n s o p é r a t o i r e s u t i l i s é e s , o r o b t i e n t d e s s é t é n o p h è n e s 2 , 5 d i s u b s t i t u é s o u u n m é l a n g e d ' i s o m è r e s 2 , 4 e E 2 , 5 d i s u b s t i t u é s . l a d é c o n p o s i t i o n d e 2 , 5 - d i a r y l - 1 , 4 - d i t h i i n L , I , 4 , A - t e L r o x i d e s par voie thermique en présence de sélénium permet également I'accès aux 2,S-diaryl séIénophènes obtenus conme précédemment en méIange d ' i s o m è r e s : NI
S eo\.y'
\rZt
Io7s\o
Ces deux voies de synthèse ont permis I'obtention de dérivés s é ] é n o p h é n i q u e s s y r n é t r i q u e s : R : H ; F ; C I ; B r ; M e ; M e o '
Ces voies ne sont pas appropriée pour Ia synthèse de diaryl séténophènes dissymétriques .
L e s 2 , S - d i a r y l s é l é n o p h è n e s d é j à s y n t h é t i s é s s o n t r a s s e m b l é s dans Ie tableau suivant:
R R é f é r e n c e s H 6 8 C C 3 6 5 ; 7 8 J H C 1 1 8 5 ; 7 7 C S 1 1 ; 7 3 J H C 9 5 3 ; 1 6 J H C 5 7 F 7 3 J H C 9 5 3 ; 7 6 J H C 5 7 C I 7 3 J H C 9 5 3 : 7 6 J H C 5 7 Br 7 3 J H C 9 5 3 ; 7 6 J H C 5 7 Me 7 3 J H C 9 5 3 : 7 6 J H C 5 7 MeO 7 3 J H C 9 5 3 : 1 6 J H C 5 ]
1 4
-2- ARYL ET 2,5-DIARYL
THIENO[3,
2-b]THIOPHENE
S
A notre connaissance, très peu de travaux ont porté sur Ia s y n t h è s e d ' a r y l t h i é n o 1 3 , 2 ' b l t h i o p h è n e s o u d e d i a r y l
t h i é n o [ 3 , 2 - b ] t h i o P h è n e s .
Nous avons cependant relevé plusieurs synthèses aboutissant au 2 - p h e n y l t h i e n o 1 3 , 2 - b l t h i o p h è n e : I a c y c l i s a t i o n e n p r é s e n c e d e s o u f r e d e l - p h e n y l - 2 - ( 2 - t h i é n y I ) - é t h è n e < 7 2 J C S ( P 1 ) 9 3 > . T I E C C O e t s e s c o l l a b o r a t e u r s < 6 8 J C S ( C ) 9 0 1 > p r o p o s è r e n t u n e s y n t h è s e p a r v o i e r a d i c a l a i r e . c rHu t *
-Deux autres B'r.AZy, BONÀRTRE, proposé une voie
équipes BCIfrcHER, LIIERINGHÀUS <49LÀ( 557 ) 89> et P F I S T E R - G U I L I O U Z O < 6 6 B S F ( 2 ) 2 L 3 6 ; 6 8 B S F ( 2 ) 4 2 4 7 > o n t d ' a c c è s a u x d i a r y l t h i e n o l 3 , 2 - b ] t h i o p h è n e s
ZnCI, E r 3 S i H
symétriques par déconposition thermique de 1,2-dithiole-3-thione.
s - s
6r: p-MeO-Ph, Ph.
Remarque: Nous synthèses concernant
n ' a v o n s p a s r e c e n s é les aryl ou diarYl
dans Ia littérature de s é l é n o l o [ 3 , 2 - b ] t h i o P h è n e s .
CIIÀPITRE I:
I-]- IIflIRODUETION
La première partie de ce thiophènes, plus exactement de t y p e 1 : Donneurs Àttracteurs
1 6
-SYNTHESE
DE
2,S-DIARYL THIOPHENES
travail concerne Ia synthèse de diaryl 2rS-diaryl thiophènes disubstitués du
1
L e s s u b s t i t u a n t s q u e nous avons choisis s o n t :
D : A :
M e ( b ) , M e O ( c ) , F ( d ) , C I ( e ) , B r ( f ) , M e z N ( g ) ; c N ( h ) , c o 2 M e ( i ) , s o z u e ( j ) , N o 2 ( k ) .
L a d é s i g n a t i o n d e s p r o d u i t s p a r l e s l e t t r e s b , c , d , e , f , 9 , h, i, j et k sera utilisée pour désigner Ie substituant auquel nous
I ' a f f e c t o n s .
Comme produit de référence, nous avons également synthétisé Ie d é r i v é n o n s u b s t i t u é 1 â , â ( A = D = H ( a ) ) .
La préparation des structures 2,5-diarylthiophéniques peut s'envisager de plusieurs manièresi soit au départ de thiophène soit en construisant le cycle thiophénique, comme ont été synthétisés les diaryl thiophènes décrits dans Ia littérature.
\
11,",".
ll
Schema l-: Stratégies de synthèse envisageables.
v o i e B + H A l - C H ;
tl
tl,#
+
""'-O-lïl
tl
't}
O
+
""'#lÏi
i 8
-I-2 IIHIHODES DE SYIflIHESE pES 2r5-DïÀRyt THTOPHENES
I-2-1, LES I,IHIïODES À PÀRTIR DU TIIIOPHEIIE (Voie À, schéma l-)
La synthèse des molécules cibles peut-être envisagée à partir du thiophéne et d'halogénures d'aryles substitués par des réactions d e c o u p l a g e ( e q . l ) .
( e q . 1 )
( e c . 2 ) L'introduction des chromogènes actifs en positj-on 2 et 5 du
thiophène est possible en utilisant des réactions de couplage de type rrHECKrr ou rrSTIT.T.Br.
Ces réactions permettent Ia formation de liaison sp2-sp' p.t couplage de systèmes aromatiques (ou éthyléniques) avec des
organométalliques en présence de palladium ou de nickel à divers d e g r é s d ' o x y d a t i o n s < 8 7 M I i 9 O T L 4 7 4 3 ; 9 0 A C 4 l - 9 ; 9 0 H 6 4 5 ; 9 ] - S Y N 8 4 5 ; 8 8 C S 2 7 5 ; 9 O J H C 2 L 6 5 ; 8 6 À C 5 0 8 ; 9 1 - J H C 4 l _ l _ > .
Les couplages dans Ie cas de formation d'aryl ou de diaryt t h i o p h è n e s p e u v e n t s ' e n v i s a g e r d e d e u x m a n i è r e s ( e q . 2 ) .
1\r
+ Hal{r,/
Différents accès à réactions de couplages
d e s a r y l e s ( o u ont été décrits
hétaryles) thiophènes par des e t s o n t r é s u m é s c i - a p r è s .
I-2-I-I Couplage par des orgianozinciques <9OTL47 43 )
r é a c t i f s : i :
R : - C H 2 - C H : C H 2 R d r : 1 1 %
T-2-I-2 Couplage par des organomagnésiens <91JHC411>
r é a c t i f s : i : E t 2 0 , N i ( d p p e )
I-2-L-3 Couplage par des organostannigues <9 0H6 4 5>
r\
uers'n
,/-SnMe.
R : OMe Rdt : 40% R : N M e , R d t : 3 0 % B u I i , T H F ; i i : Z n C L " , T H F ; i i i : H a l - P h - R , T H F , P d ( 0 ) r é a c r i f s : i : P h - B r , P d ( I I ) , T H F R d r : 6 1 %, 2 0
-T-2-I-4 Couplage par des acides boroniques <88CS275>
- . 8 { o H ) 2 - B t
1/ \
+ // \
\rÂ."o
\rÀr,
cocH3 R d r : 6 5 % r é a c t i f s : i : N a H C O ' D M E , P d ( O ) I-2-I-5 ConclusionNous disposons de plusieurs méthodes de synthèses élégantes faisant intervenir autant de conditions opératoires différentes que d'organonétalliques et de catalyseurs de métaux de transitions
d i f f é r e n t s .
Remarque: Certaines méthodes de couplages ntont pas encore été étudiées en série thiophéniques comme par exemple:
A r - S M e + A r ' - M g B r A r - N r - B F r - + H a l - A r ' A r - S i M e F , + T f O - A r ' N i ( I I )
N i ( r r ) >
P d ( I I ) --..# A r - A r l A r - A r ' A r - A r ' < l 9 c L I 4 4 7 > < 9 3 J C S ( P 1 ) 1 9 4 > < 9 1 S Y N 8 4 5 > \T-2-2 LES IIIBIHODES DE CONSIB.UCIION DU CYCLE THIOPHENIQUE ( v o i e B , s c h é m a 1 - )
ft existe plusieurs méthodes de construction du cycle
thiophénique, nous pouvons envisager d'utiliser Ia synthèse de PÀAL-KNORR ou égalenent la condensation des p-chloro acroléines
< 8 6 H C ( 4 4 p a r t - 2 ) 1-30>.
I-2-2-L La slmthèse de PÀAL-KNORR
Certains dérivés diphényl thiophéniques dont quelques dissymétriques ont déjà été synthétisés par cette voie.
La construction des dicétones L,4, non symétriques est possible (eq.3) par Ia réaction de STHTTER <9LVII4O7>, dont voici la
d e s c r i p t i o n : CHO
+
c H 2 : c H - c o ( e q . 3 ) cH2-cH- co+
CHO Bien que préparées par très peu de dicétones cette néthode, Ia voieL , 4 d i s s y n é t r i q u e s o n t é t é B r e s t e e n v i s a g e a b l e .
2 2
-I-2-2-2 La condensation des F-aryI-Ê-chloro acroléines ( v o i e C , s c h é m a f - )
Cette rnéthode plus récente que Ia précédente a été utilisée p o u r l a s y n t h è s e d e t h i o p h è n e s 2 , 5 d i s u b s t i t u é s < 8 6 H C ( 4 4 p a r t 2 ) 1 3 0 > L ' i n t r o d u c t i o n d e I ' h é t é r o a È o m e s e f a i t p a r I ' i n t e r m é d i a i r e d u s u l f u r e d e s o d i u m N a 2 S ( e q . a ) .
--q*"
n g 2 - n ( e q . 4 ) H a I - C H , - R ' L ' a d a p t a t i o n d e c e t t e m é t h o d e à t a s y n t h è s e d e 2 , 5 - d i a r y l thiophènes est possible si les deux groupements R et R, sont des d é r i v é s a r o m a t i q u e s s u b s t i t u é s ( s c h é m a 2 ) .s c h é m a 2 : C o n d e n s a t i o n d e s Ê - a r y l - Ê - c h l o r o a c r o l é i n e s
i , i i
f"
r é a c t i f s : N a r S , D M F ; i i : B r - C H r - P h - A 3 ; i i i : b a s e
Le choix de Ia position des groupements D sur Ie derivé 2 et A sur Ie bromure de benzyle 3 est déterminé par l,étape finale de la formation du noyau thiophénique.
L a c y c l i s a t i o n e t I ' a r o m a t i s a t i o n d e l - ' i n t e r m é d i a i r e 4 , q u i n ' e s t p a s i s o l é , s € f o n t d ' a u t a n t m i e u x q u e I e c a r b a n i o n b e n z y l i q u e est stabilisé par Ia présence d'un çtroupement attracteur sur Ie c y c l e b e n z é n i q u e .
L'avantage de cette néthode est la facilité de manipulation des r é a c t i f s e t I a p o s s i b i l i t é d ' e x t e n s i o n a u x d é r i v é s s é I é n i é s e n
u t i l i s a n t l e s é l é n i u r e d e s o d i u m < 7 3 C R C ( 2 7 7 ) 3 7 > .
Une variante de cette méthode développée par LIEBSCHER et HÀRIIiANN <76JPC731-> utilise des perchlorates d'iminiums condensés avec les thiols correspondants HS-CHz-Ar.
- - Ç N + M e '
c 1 0 4
-Cette dernière néthode permet un accès aux dérivés
2 4
-T-2-3 CHOIX DE I,A I,IENIODE DE SYNTHESE DES DIÀRYL IHIOPHENES
Notre choix pour la synthèse de 2,S-diaryl thiophènes
disubstitués s'est porté sur Ia condensation de Ê-chloro acroléines p o u r p l u s i e u r s r a i s o n s :
- un accès aisé aux matières premières,
- des conditions de travail plus simples (pas de rnanipulations d ' o r g a n o n é t a l l i q u e s ) ,
le développement de cette technique de synthèse d'trétérocycles pentagonaux au laboratoire,
I-3 SYNIHESE DES 2,s-DTÀRYL THIOPHENES
La voie de synthèse que nous avons retenue nécéssite Ia préparation des Ê-aryl-B-chloro acroléines à partir de diverses acétophénones.
Dans une seconde étape, ces Ê-aryl-Ê-chloro acroléines seront condensées avec Ie sulfure de sodium puis avec un halogénure de benzyle permettant après cyclisation et aromatisation d'aboutir aux c o m p o s é s d é s i r é s .
I-3-]- SYT THESE DES P-ÀRYL-P-CHI,ORO ÀCROTEINBS
L ' u t i l i s a t i o n d u r é a c t i f d e V T L S U A I E R - I I À À C K ( e q . 5 ) < 7 6 M I ( 9 partl-)> a été étendue par ÀRNOI,D <58PCS81-7> âuX cx-rréthyt cétones et c o n d u i t a u x B - a r y l - Ê - c h l o r o a c r o l é i n e s .
DMF-poc,3-+
F'-.{1
,-opoc,2
€
b-;|,-opoc,2
( e q . 5 )Le mécanisrne généralement admis pour cette réaction <77TH25> est celui présenté au schéma 3.
Remarque: À LÀ nomenclature fUPÀC DU rF-aryl-Ê-chloro propenaltr nous substituons Ie nom plus trivial de Ê-aryl-9-chloro acroléines.
, 2 6
-schéma 3: synthèse des Ê - a r y l - Ê - c h l o r o a c r o l é i n e s
-'\âi",
l.
*'/"\o"
, - o P o c l 2 N + M u r , - o p o c l 2 P o z c r 2 - , u " r n \ " / R ' - ' \ ô N + M . r , - o p o c l 2ll+tl
n r  c r
B l  c r
'"'Y*' -Y*
*'A.r
nlAcr
Les sels d'iminiums interrnédiaires peuvent être isolés sous f o r m e s d e p e r c h l o r a t e s . I I s s , h y d r o l y s e n t p o u r d o n n e r l e s p a r y l -Ê - c h l o r o a c r o l é i n e s g é n é r a l e m e n t e n m é I a n g e d r i s o m è r e s Z e t E .
Ces deux isomères réagissent de Ia même manière lors de la s y n t h è s e d e s m o l é c u l e s c i b l e s .
Les dérivés 2 ainsi préparés sont présentés dans Ie tableau 1: t a b l e a u 1 - : Ê - a r y l - F - c h l o r o a c r o l é i n e s 2 s y n t h é t i s é e s
D H Me MeO F C 1 Br N M e ,
2 a b c d e f 8
2 8
-ï-3-2 ACCES ÀUX 2,5-DIÀRYL THIOPHENES
Les condensations des Ê-aryl-F-chloro acroléines se déroulent en une opération mais en plusieurs étapes:
introduction de I'trétéroatome par le sulfure de sodium réaction avec les tralogénures de benzyles
cyclisation et aromatisation
I-3-2-l- Slmthèse des bronures de benzyles
Les halogrénures de benzyles utilisés sont généralement des produits commerciaux. Uniquement dans un cas nous Itavons préparé:
nethyl-(4-bromomethyl)-benzènesulfonate 3j (schéna 4) . schéma 4: synthèse du
methyl-(4-brononethyt)-benzènesulfonate 3j
B r C H j S o r M e
1,,,'
T-3-2-2 Slmthèse des molécules cibles
La préparation des diaryl thiophènes se fait en une réaction avec introduction des réactifs en plusieurs étapes. Le schéma 5 montre Ia suite des étapes mises en oeuvre.
Schéma 5: Préparation des 2,S-diaryI thiophènes
l"
tiii'ivt#'b^
r é a c t i f s : i :
L ' a d d i t i o n d ' u n e b a s e ( M e O N a , K O H e t c . . ) est nécéssaire pour Ia cyclisation. Dans certains cas cependant À : NO z eE À = CN, Ia
çtroupement À est suffisamment attracteur pour induire Ia cyclisation s a n s l t a j o u t d t u n e b a s e .
3 0
-Les conditions décrites ici ne permettent pas Ia formation du 2rS-diphényl thiophène I ara par condensation du bromure de benzyle
( À : H ) . D a n s c e c a s I ' a c i d i t é d e I ' h y d r o g è n e b e n z y l i q u e n e p e r m e t p a s I a c y c l i s a t i o n m ê m e e n p r é s e n c e d , u n e b a s e .
Le choix de la condensation avec I'o-bromo-c-phényl acétate d'éthyle permet d'avoir un hydrogène suffisament acide pour provoquer Ia cyclisation (schérna 6).
Schéma 6: Cas particulier de Ia condensation de I' o-bromo-c-phényl acétate d'éthyle
r é a c t i f s : i :
D a n s c e c a s I ' a r o m a t i s a t i o n s e f a i t l o r s d e I ' a c i d i f i c a t i o n , conditions dans lesquelles iI y a décarboxylation puis
deshydratation.
I
+-1 a , q - b r o m o - a - p h e n y l - a c e t a t e d ' e t h y l e ; i i : N a O H , H r O , Â ; i i i : H * , - C O 2 , - H r O COOEILes tableaux 2 à 6 présentent les composés 1 préparés ainsi que les rendements obtenus.
T a b l e a u 2 : A = H T a b l e a u 3 : A = C N T a b l e a u 4 : A = C O 2 I { e D H Me MeO F C I Br N M e , 1 4 r 4 b , a c r à d , a e , a f , â 8 , 4 R d r ( % ) 3 5 3 8 4 5 3 9 4 5 5 1 3 4 D H Me MeO F C 1 Br N M e , 1 ê r h b , h c , h d , h e , h f , h 8 , h R d r ( % ) 40 4 6 4 9 4 5 5 1 5 5 4 Z D H M e MeO F C I Br N M e , 1 â r I b , i c , i d , i ê , i f , i 8 ' L R d r ( % ) 3 9 4 T 44 40 44 4 9 3 7
3 2
-T a b l e a u 5 : À = S O r l l e
T a b l - e a u 6 : À : N O 2
I-3-3 CONCLUSION
Cette méthode a permis Ia synthèse de 35 diaryI thiophènes. Les rendements globaux à partir des différentes acétophénones varient de 3 4 à s 5 ? .
Tous ces produits ont été caractérisés par microanalyse et spectroscopie de RMN. D H Me MeO F C I Br N M e , 1 a r j b , j c , J d , j e r j f , j I ' J R d r ( % ) 40 4 3 5 1 4 3 4 9
s 3
4 6 D H Me MeO F C I Br N M e , 1 a r k b , k c r k d , k e , k f , k g , k R d r ( % ) 5 1 5 3s 2
s 0
5 5 5 5 5 4r-4 ETUDES DES REÀCTIONS DE COUPI,ÀGE A PARTIR DU TTIIOPHENE
Àfin de comparer cette méthode de préparation à celle utilisant
res réactions
de couplage nous avons réarisé
ra synthèse d'un
c o m p o s é d i a r y l
t h i o p h é n i q u e ( 1 g , k ) p a r l a v o i e À (Schérna 1)
I-4-1- SYtflt'HESE DU 2- ( 4-NNDIT.TBI'IIYLÀIIINOPHENYL) -5- ( 4-NITROPIIENYL) THIOPHEIIE L g,k
Nous avons choisi de synthétiser par couprage re dérivé 1 grk c a r I ' a s s o c i a t i o n N M e 2 - N O 2 e s t l a p l u s d é c r i t e m a i s c e r t a i n e m e n t I a p l u s e f f i c a c e d a n s l e s s t r u c t u r e s à p r o p r i é t é s O . N . L .
< 9 3 À G ( E ) 7 L 9 i 9 2 C C L 3 8 L > .
A travers cet exemple, nous présenterons les diverses voies de couprages étudiées aux dépends du thiophène ou de ces dérivés.
Ces études ont servi à I'exploration des néthodes qui ont été a p p r i q u é e s p a r l a s u i t e a u t h i é n o [ 3 , z - b l t h i o p h è n e v o i r e à d e s dérivés plus condensés.
Le schéma rétrosynthétique 7 montre les différentes voies e n v i s a g é e s .
3 4
-Schéma 7: Ànalyse retrosynthétique pour Ie dérivé 1 g,k
M e r N
+
R l : S n B u r .R 2 : H a 1il
A 1 R r : Z n C l ; R 2 A 2 R 1 : H a I ; R 2t l
tl
t l
r/
V O I E B+
H a I - P h - N M e ,,-r/
\t
H a l - P h - N O , : Hal : SnBu, ,/-,ru"'u\-7Fn'z+
V O I E V O I E ST-4-2 ETUDE DE I,À v o I E A ( S c h é n a 7 )
1 - 4 - 2 - 1 , V o i e À l - : R 1 : Z n C I ; R 2 : H a l
Cette approche nécessite Ia synthèse du 2-(4-nitrophényl) thiophène 7. Ce dernier est préparé par couplage entre
I ' o r g a n o z i n c i q u e d u t h i o p h è n e e t l e 4 - n i t r o b r o m o b e n z è n e ( e q . O ) .
G,".,
( e q . 6 ) N O , s o l v a n r : T H F R d t 4 0 % D M F R d t 8 5 % < 7 7 J O C T S 2 L > R é a c t i f s : i : P d ( D B A ) 2 , B r - P h - N O , L ' o b t e n t i o n d u d é r i v é 1 g , k n é c e s s i t e I a f o r m a t i o n d ' u n o r g a n o m é t a l l i q u e p a r I i t h i a t i o n d u c o m p o s é Z e n p o s i t i o n 5 .Une étude de la métallation en utilisant différentes conditions ( n B u l i , t B u l i , O " , - 8 0 " ) n r a p a s c o n d u i t à I a r é a c t i o n e s p é r é e (piégeage de 1'organorithien par addition de borate de butyle par e x e m p l e ) .
3 6
-I - 4 - 2 - 2 V o i e A 2 : R 1 : H a l ; R 2 : S n B u 3
L ' o b t e n t i o n d u d é r i v é c i b l e p a s s e p a r I a p r é p a r a t i o n d e
I ' o r g a n o s t a n n i q u e I e t d u 5 - H a l o g é n o - 2 ( 4 - n i t r o p h é n y l ) t h i o p h è n e 9 .
T - 4 - 2 - 2 - 1 S y n t h è s e d e l r o r g a n o s t a n n i q u e 8
L'action du chlorure de tributyl étain sur Ie
a - I i t h i o - N N - d i m é t h y l a n i l i n e à - 8 0 ' C a p e r m i s I a s y n t h è s e d e l ' o r g a n o s t a n n i q u e 8 ( e q . Z ) . B r i ' i i > M e r N 5 n B u a ( e q . 7 ) M e , N R é a c t i f s : i : B u L i , T H F , - 8 0 " ; i i : C I S n B u . 8 Bdt' 75,,. I - 4 - 2 - 2 - 2 S y n t h è s e d u S - H a l o q é n o - 2 - ( 4 n i t r o n h é n v l ) t h i o n h è n e 9
- par bromuration
Les deux méthodes généralement utilisées dans les réactions de b r o m u r a t i o n d u t h i o p h è n e ( B r z , À c o H z < 5 2 H C 2 o o > ; N B S , cHcr3, AcoH: < 3 8 L 4 ( 5 3 6 ) 1 3 5 > ) n ' o n t p a s p e r m i s I ' o b t e n t i o n d u d é r i v é h a t o g é n é g
( e q . 8 ) .
( e q . 8 ) N O ,
- par halodecarboxylation de HUNDSDfECKER <52HC448>
Cette néthode vise à obtenir un halogénure par rrhalodecarboxylationrr d'un acide carboxylique
en présence dtoxyde de m e r c u r e e t d e p e r i o d a t e d e p o t a s s i u m d a n s I ' a c i d e a c é t i q u e ( e q . 9 ) . o r N i : D M F - P O C I 3 ; ii : N a r S , D M F , i v : H g z O , K I O 3 , A c O H R d t : l % ( e q . 9 ) R é a c t i f s : C I C H T C O T E t ; ii i : N a O H , H r O , E t O H ;
, 3 8
-- par couplage de I,acide 5-brono-2-thiophèneboronique 11
L ' a c i d e b o r o n i q u e 1 1 - d é j à d é c r i t p a r L À W E S S O N < 5 7 À K ( 4 1 ) 3 8 1 - > e s t c o u p l é d a n s l e s c o n d i t i o n s d e G R O N O I T I T Z < 8 6 C C A 3 1 _ 3 > ( e q . t _ O ) . B ( O H ) 2 ( e q . 1 0 ) R é a c t i f s : i : L D A , T H F , 0 " p u i s B ( O H ) . ; B r - P h - N O , P d ( O ) , D M E , H 2 O , N a H C O '
Cette dernière néthode aurait pu être interessante mais eIIe n ' a c o n d u i t q u ' à d e s m é r a n g e s d i f f i c i l e m e n t s é p a r a b r e s m ê m e p a r c h r o m a t o g r a p h i e s u r g e l d e s i l i c e .
Àucune des trois techniques mises en oeuvre dans les voies ÀI-et À2 ntont été satisfaisantes, nous nous sommes donc interessés à
I - 4 - 3 H I U D E D E I À V O I E B ( S c h é n a 7 )
La voie B que nous avons envisagée exige Ia préparation du 2 - ( 4 - N N - d i m é t h y l a m i n o p h é n y l ) t h i o p h è n e L 2 .
I-4-3-l- Slmthèse du 2-(4-NN-diméthylarninophényl) thiophène L2
LEISING et I{IGNAI{I ont décrit cette synthèse <9OTL4743> à I ' a i d e d ' u n o r g a n o z i n c i q u e ( R d t 3 5 % ) . E n u t i l i s a n t I ' a c i d e
2-thiophèneboronique, également décrit par LAUTESSON <57ÀK(41) 381>, dans une réaction de couplage avec deux équivalents d,halogénure d ' a r y l e < 9 2 J O C 1 - 6 5 3 > , n o u s é l e v o n s I e r e n d e m e n t à 5 S Z ( e q . t _ l ) .
N M e ,
( e q . 1 1 )
4 0
-T-4-3-2 Obtention du dérivé L 9,k par couplage
Cette ultirne étape nécessite Ia synthèse du
2- ( 4-NN-dinéthylaninophényl ) -S-tributylstannyl thiophène 13 , par l i t h i a t i o n e t c o n d e n s a t i o n d e c h l o r u r e d e t r i b u t y r é t a i n ( e q . t - 2 ) . S n B u , ( e q . 1 2 ) Me rN R d t : 9 0 % R é a c t i f s : i : B u L i , 0 ' , T H F ; i i : C l S n B u " L e d é r i v é 1 g , k a été obtenu comme d é c r i t c i - a p r è s ( e q . l - 3 ) M e rN S n B u a g , k ( e q . 1 3 ) R d t : 6 0 4 1 3 i : I - P h - N O 2 , D i o x a n n e , P d ( T P P ) 4 t 2 R é a c t i f s :
La synthèse des molécules cibles peut donc être envisagée par l a v o i e d e s c o u p r a g e s c s p 2 - c s p 2 e n t r e organométarriques e t
halogénures aromatiques.
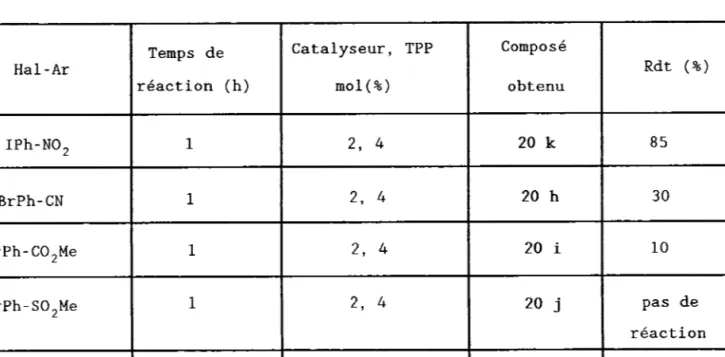
L e s d i f f é r e n t s e s s a i s r é a l i s é s d a n s c e c h a p i t r e s o n t r é s u m é s d a n s l e t a b l e a u s u i v a n t .
T a b l e a u 7 : R é s u l t a t s des réactions de couplage H a l - P h - R ' .----....--* Thiophène R M Hal Rl C a t a l y s e u r / b a s e S o l v a n t / T e m p s r é a c t i o n ( h ) C o m p o s é obtenu R d r ( % ) H ZnCL B r N M e , P d ( D B A ) 2 ' T P P T H E / T 6 I 2 3 0 H ZnCI B r N O , P d ( D B A ) 2 ' TPP T H F / 1 6 7 4 0 H Z n C I r N o 2 P d ( T P P ) 4 DMF/ 1 7 8 5 H B ( O H ) 2 B r x N M e , P d ( T P P ) a / N a r C o ' ' C 6 H 6 , M e O H , H 2 O / 7 l I 2 5 5 B r B ( O H ) 2 I N O 2 P d ( T P P ) r / t l a u c o , DMF/ 2 9 i n d e t . B r B ( O H ) 2 B r N O , Pd( TPP ) o/ llauco, D M F / 1 6 9 i n d e t . N M e r P h S n B u , I N O 2 Pd( TPP ) 4 Dioxane/ 44 1 g , k 6 0 x c o u p l a g e a v e c d e u x é q u i v a l e n t s d ' h a l o g é n u r e d'aryle <92Joc1653>
4 2
-T-4-4 CONCLUSION
Nous démontrons que Ia slmthèse des dérivés 2,5 diaryt thiophéniques est possible par des réactions de couplages entre orgranométalliques et halogénures aromatiques.
Les voies de synthèse que nous avons choisies nront pas été optimisées, d'autres dérivés organométaltiques du thiophène peuvent être envisagés.
Notre but était de se farniliariser avec ces techniques de c o u p l a g e s , I ' u t i l i s a t i o n d e r é a c t i f s s e n s i b l e s e t
d'organométarriques variés ters que zinciques, stanniques et boroniques.
L'expérience acquise servira dans les synthèses de la série thiéno 13, 2-bl thiophénique .
Avec les résultats actuels en notre possession, nous pouvons toutefois comparer res rendements obtenus pour la synthèse de L grk u t i l i s a n t l e s c o n d e n s a t i o n s d e B-chtoroacroleines ( V o I E c ) e t l e s réactions de couplages (VOIE À)
VOIE A A c i d e 2 - t h i o p h è n e b o r o n i q u e l 2 o r g a n o -s t a n n i q u e 1 3 1 g , k Rdr G l o b a l R d r ( % ) 8 0 5 5 9 0 6 0 24 VOIE C P r é p a r a t i o n d e p - chloroacroleine I a 2 g C o n d e n s a t i o n 1 g , k Rdr G l o b a l R d r ( % ) 8 0 5 4 4 3
Pour l'instant sur cet exemple, la voie des condensations de Ê-chroroacroreines est une néthode drobtention des 2r5 diaryr
thiophènes conpétitive et reste préférabre sur le pran des rendements et du nombre drétapes.
r-5 SPECTROGRÀPHIE T'LTRÀVIOLETTE
I-5-1 INTRODUqFON
Selon Zyss <87UII25O>, IraugTmentation des valeurs de Ê
c a r a c t é r i s t i q u e s d e s e f f e t s O . N . L . s ' a c c o m p a g n e d ' u n e a u g m e n t a t i o n d e s a b s o r p t i o n s m a x i m a l e s d a n s I ' U V e t I e V I S I B L E .
Nous avons entrepris une étude de ltabsorption dans les domaines trv et/ou visibre systématique de tous res composés
s y n t h é t i s é s . L e s r é s u r t a t s d e s m e s u r e s é f f e c t u é e s ( À * " * e t € ) s o n t regroupées dans les tableaux suivants:
T a b l e a u S : A = H D c o m p o s é € ( l . m o l - 1 . c m - 1 ) À max ( n m ) H L a , a 27000 3 2 4 Br I f , a 1 9 3 0 0 3 1 5 C 1 1 e , a 3 4 9 0 0 3 2 7 F I d , a 20600 3 2 2 Me I b , a 29r00 326 MeO 1 c , a 1 s 0 0 0 320 N M e , I 9 , " 1 4 6 0 0 3 5 6
4 4
-T a b 1 e a u 9 : A : N O 2 T a b l e a u 1 0 : À : S O 2 I . l e D c o m p o s é € ( 1 . n o 1 - t . . r - t ) À max ( nsr) H 1 ê r k 1 8 1 0 0 3 7 8 Br 1 f , k 5 4 0 0 3 8 0 C 1 I e , k 26r00 3 7 7 r I d , k2r900
346 M e 1 b , k 2 s 1 0 0 3 8 4 MeO 1 c , k 1 2 5 0 0 3 9 2 N M e , 1 g , k 1 7 0 0 4 3 0 D c o m p o s é € ( 1 . n o 1 - 1 . c m - 1 ) À max ( n n ) H 1 ê , i 22700 347 Br 1 f , i 2 9 3 0 0 3 4 2 C 1 1 e , i 21400 342 F 1 d , i 2 9 3 0 0 342 Me 1 b , i 6 7 0 0 346 MeO 1 c , i 1 2 3 0 0 3 6 2 N M e , 1 g , i 6 1 0 0 387T a b l e a u 1 - l - : À = C N T a b l e a u 1 2 : À : C O 2 l l e D c o m p o s e ( l . m o I - t . " * - t ) À max (run) H 1 a , j 27500 3 4 5 Br 1 f , j 42500 3 5 0 C I 1 e ' J 1 s 8 0 0 349 F 1 d , j 3 5 4 0 0 345 Me 1 b , j 3 0 9 0 0
3 s 0
MeO 1 c , j 2 1 8 0 0 3 s 9 N M e , 1 g , j 1 4 8 0 0 3 8 9 D c o m p o s é ( 1 . r n o I - t . " r - t ) À nax ( n m ) H 1 a , h9 s 0 0
346 Br 1 f , h 1 s 2 0 0 348 C I 1 e , h 3 4 0 0 0 3 6 1 F 1 d , h 1 2 1 0 0 3 4 0 Me 1 b , h 3 2 0 0 349 MeO 1 c , h 2 2 r O O 3 5 5 N M e , I g , h 6700 2 7 04 6
-T-5-2 INFLUENCE DES GROI PEI'IENTS DONNEURS St R L'ÀBSORPIION IIAKI}IÀLE
L ' i n f l u e n c e
d e I ' e f f e t
m é s o m è r e d e s d i f f é r e n t s
s u b s t i t u a n t s
peut-être
corrérée à r'absorption
maximare par la retation
de
HÀI{EET:
À O - À H : p A o D ( À o À n ) d o n n e u r s s u r I a r e p r é s e n t e I , i n f l u e n c e r é e l I e structure suivante: des substituants p a e s t l e c o e f f i c i e n t d e p r o p o r t i o n n a l i t é q u i t r a d u i t l a succeptibilité de Ia fonction À à subir Ia perturbation provoquée par les substituants D, pa est par conséquent caractéristique de Ia f o n c t i o n A .Les vareurs de Àp Àn observées sont regroupées dans re t a b l e a u s u i v a n t : D A : N O 2 À ^ - ^ . .u n A - S O 2 C H 3 À ^ - À . .U N A : C N ^ D - ^ H A : ^ D co 2 cH3 - À H Br 2 1 5 2 C 1 - 1 1 4 1 5 F - 3 2 1 0 - 6 Me 6 5 5 3 MeO T 4 2 I 7 4 9 N M e , 5 2 4 6 44 - 7 6
S u r l e s d i f f é r e n t s g r a p h e s G 1 _ (A : N O 2 ) , G 2 ( À : S O 2 M e ) , G 3 ( A = C N ) ' G4 (A : CO2Me) se trouvent l e s p o i n t s c o r r e s p o n d a n t s a u x v a l e u r s ( À o i n ) p o u r o p e t o p * N o u s a v o n s u t i l i s é l e s v a l e u r s s u i v a n t e s p o u r o p e t o p * . Br C I F Me MeO N M e , op 0 . 2 3 0 . 2 3 0 . 0 6 - 0 .7 l - o . 2 7 - 0 . 8 3 I o P 0 . 1 5 0 . 1 1 - 0 . 0 7 - 0 . 3 1 - 0 . 7 8 - 1 . 7 0
-10
4,t)
-G1 (A = NOr)
l" en fonction
de o
0 20 B . -1,00 -0,75 -0.50 {,25 0 0,25À = -55,2o -68,9
Coeff.
Corr.
- 0,81
- 2 , 0 - 1 , 5 - 1 , 0 - 0 , 5 o 0 , 5
7 v = - 3 2 , 3 o - 7 , 2
C o e f f .
C o r r .
= 0,84
l, en fonction
de o- 1 sans le point
F)
- 2 , 0 - 1 , 5 - 1 , 0 - 0 , 5 0 0 . 5
),"
= -27.3o +80,2
Coeff.
Corr.
= 0,97
À en fonction
de o+
40 20 0 -20 ^ N M " , M.o ' B t a F ^ l l 20 1 0 o l o M 0 . B . ^ -{c2 (A = SOzMe)
L en fonction
de o
-0,75 -0,s0l , = - 4 3 ,
1 o + 7
, 1
- 2 , O - 1 , 5 - 1 , 0L = - 2 5 , 3 o + 1 , 5
4,25 0 0.25Coeff.
Corr.
= 6,95
À en fonction
de o+
.NMe 2 pN.t^^B' 40 30 20 1 0 0 -0,5 0Coeff.
Corr.
= 0,987
l" en fonction
de o- ( sans les points Cl et Br)
ItM"z 40 30 20 1 0 0 - 1 , 5 - 1 , 0À = - 2 8 , 3 o -1 , 9
-0,5 0 0,5Coeff. Corr. = 0,998
5 0
-G3 (A = CN)
À en fonction
de o
40 30 20 1 0 0 - 1 , æ {,75 -0,50l, = -34,3o'
+7,3
{,25 0Coeff.
Corr.
= 0,91
30 20 1 0 0 - 1 , 5 - 1 , 07 t
= - 2 1 , 9 o
+ 2 , 5
-0,5 0Coeff.
Corr. = 0,95
À en fonction
de o- 1 sans les points
Cl et Br)
NMc2 30 20 1 0 0 - 1 , 5 - 1 , 0
)u
= -27,2o -3,7
-0.5 0Coeff.
Corr.
= 0.992
l, en fonction de o+
40 20 0 -20 40 -60 -80
G4 (A = COzMe)
l" en fonclion
de o
McO ^ M e r-1.
^ n".,, F rl" en fonction
de o- 1 sans les points
Cl et Br)
M€O .
---- 2 , O - 1 , 5 - 1 , 0 - 0 , 5 0 0 , 5
l , = 4 6 , 1 o +15,4
C o e f f .
C o r r .
= 9.64
-1,00 -0,75 -0,50 -0,25 0 0,25
À = 70,8o +12,8
Coeff.
Corr.
= 0,84
l, en fonction
de
o-MeO . M e r - , t '.>-''
+NYt z, - 2 , O - 1 , 5 - 1 , 0 - 0 , 5 0 0 . 5À = 4 0 , 1 o + 8 , 6
C o e f f .
C o r r .
= 9.64
40 20 0 -20 -40 -60 €0 40 20 U -20 -40 -60 -805 ?
-Nous pouvons faire quelques constatations d'après I'analyse des droites de corréIations effectuées à partir des 4 nuages de points obtenus:
- u n e meilleure d r o i t e d e r é g r è s s i o n l i n e a i r e ( c o e f f i c i e n t d e régréssion linéaire Ie plus proche de l-) est obtenue en fonetion des s i g m a m o d i f i é s ( o p * ) .
-Ies coefficients de régréssions éIevés pour les groupements NOz, SO2Me et CN permettent de constater une corréIation entre 1'effet mésomère donneur des substituants et res variations d t a b s o r p t i o n s m a x i m a l e s .
- r e comportement des halogènes F, cr, Br est particurier.En e f f e t , s u r l e s g r a p h e s , I e s v a l e u r s l e s p l u s é l o i g n é e s d e s d r o i t e s de corrélations sont dues aux halogènes.
ceci peut s'expriquer par Ia dualité attracteur par effet
inductif et donneur par effet mésomère. Nous obtenons drailleurs de m e i l l e u r s c o e f f i c i e n t s d e c o r r é I a t i o n s l o r s q u , o n é c a r t e c e r t a i n s points dus aux halogènes.
Les coefficients de corréIations proches de 1 que nous obtenons signifient que nous pouvons appriquer un modère linéaire à 1a
c o r r é I a t i o n e n t r e I ' i n f l u e n c e d e I ' e f f e t m é s o m è r e d o n n e u r d e n o s substituants et Ia variation de lrabsorption maximare dans res domaines W et\ou VfS.
I-5-3 INFLUENCE DBS GROUPEUEilTS ÀTTRÀCTEURS ST'R L'ÀBSORPTION tINKII'IÀLE
L'étude inverse, concernant rrinfluence des groupements
attracteurs cette fois a montré des résultats très divers, dont une seule très bonne corrélation avec le groupement NMe2 comme Ie montre I e g r a p h e G 5 . L e s v a l e u r s ( À a À n ) s o n t l e s s u i v a n t e s : A D : N M E , À o - À " N O , 7 4 s o r M e 1 9 C N 2 7 corMe - 8 6
L e s v a r e u r s o p et op- sont regroupées dans re tabreau suivant:
c o r M e C N S O r M e N O , o p 0 . 4 5 0 . 6 6 0 . 7 2 0 . 7 8
op 0 . 6 4 1 1 . 1 3 I . 2 7
II semble que sur cet exemple au moins une corréIation existe mais les graphes et les droites de régréssions constitués de 4 points seurement, ne peuvent être représentatives et ne nous permettent pas de tirer de conclusions.
40 20 0 -20 -40 .60 -80 1ftt