Synthèse et caractérisation de phospholipides
monofluorés et de peptides modèles :
développement de nouvelles sondes membranaires
Thèse
Marie-Claude Gagnon
Doctorat en chimie
Philosophiae doctor (Ph.D.)
Québec, Canada
© Marie-Claude Gagnon, 2017Synthèse et caractérisation de phospholipides
monofluorés et de peptides modèles :
développement de nouvelles sondes membranaires
Thèse
MARIE-CLAUDE GAGNON
Sous la direction de :
Jean-François Paquin, directeur de recherche
Michèle Auger, codirectrice de recherche
iii
Résumé
Développer de nouvelles méthodes pour l'étude des interactions entre les membranes cellulaires et diverses molécules bioactives telles que des peptides, des protéines ou des médicaments est d’une grande importance. Ces interactions sont primordiales dans l’activité de ces composés et leur meilleure compréhension pourrait permettre, entre autres, la mise au point de nouveaux médicaments, l’amélioration de leur efficacité et la diminution de leur toxicité. La spectroscopie RMN des solides est une technique de choix pour l’étude de telles interactions. Plus spécifiquement, l’utilisation de sondes membranaires est courante et permet d’accéder à de nouvelles expériences.
Le projet de thèse principal porte sur la synthèse et l’étude de phospholipides monofluorés pour leur validation comme sonde membranaire modèle en RMN des solides. Le fluor possède de nombreuses caractéristiques chimiques et spectroscopiques d’intérêt pour son utilisation pour l’étude de complexes de biomolécules en spectroscopie RMN. La présente thèse rapporte d’abord les travaux de synthèse de trois nouveaux analogues monofluorés de la dimyristoylphosphatidylcholine (F-DMPC), ayant un atome de fluor sur la chaîne acyle en position 2 du glycérol, dans le but de mimer les membranes eucaryotes. L’étude des propriétés de ces trois nouveaux F-DMPC, ainsi que de trois dérivés synthétisés antérieurement, réalisée principalement en spectroscopie infrarouge et en RMN des solides, est aussi présentée. Dans l’ensemble, les résultats ont montré que l’incorporation d’un atome de fluor à la DMPC induit des perturbations significatives, mais que des mélanges F-DMPC/DMPC composés d’au maximum 25% de phospholipides monofluorés se comportent de façon similaire aux membranes de DMPC. Afin de valider ce nouveau modèle, l’orientation de deux peptides antimicrobiens au comportement connu a été estimée dans des membranes contenant 25% de F-DMPC. Pour tous les F-DMPC, la RMN de l’azote-15 a montré que l’orientation des peptides n’était pas affectée par la présence de DMPC monofluorée. De tels mélanges pourraient ainsi être utilisés comme sonde membranaire pour l’étude d’interactions entre ces membranes et différentes molécules bioactives par RMN des
iv
solides. La thèse présente aussi le développement d’une méthodologie de synthèse flexible de phosphatidylglycérols. Puisque des chaînes acyle identiques ou différentes et de longueur variée peuvent être incorporées, cette méthodologie permettra d’accéder aux F-DMPG en vue de mimer les cellules procaryotes.
Le second projet de thèse porte sur l’étude de nouveaux peptides modèles afin de mettre au point un outil pour évaluer l’épaisseur des membranes biologiques. Une série de peptides analogues au peptide antimicrobien synthétique MSI-103 ayant différentes longueurs, appelés KIAn, a d’abord été synthétisée et étudiée afin d’étudier l’importance du concept de décalage hydrophobe dans la formation de pores transmembranaires et l’activité des peptides. Cette étude a démontré que la longueur est un facteur clé dans l’activité de ces peptides : ils doivent être suffisamment longs pour traverser l’épaisseur hydrophobe des bicouches lipidiques. Toutefois, dans le design de la série KIAn, les peptides plus longs sont davantage chargés et ce facteur peut aussi affecter la tendance observée. Cette thèse rapporte donc les travaux menés afin de vérifier l’influence de la charge cationique des peptides KIAn dans leur activité. Deux nouvelles séries de peptides de longueur variable (14 à 28 acides aminés) et de charge globale constante (+7), appelées KIA(7)n et KIXAn, ont été synthétisées et analysées par différentes techniques (dichroïsme circulaire, tests biologiques, spectroscopie de fluorescence, RMN de l’azote-15). Cette étude a permis de confirmer l’importance du principe de décalage hydrophobe et l’absence d’effet dû à la charge des peptides dans leur activité. Elle a ainsi permis de valider l’utilisation de ces peptides comme règle moléculaire afin d’estimer l’épaisseur des bicouches lipidiques.
v
Abstract
The development of new methodologies to investigate interactions between cell membranes and various bioactive molecules such as peptides, proteins or drugs is of primary importance. These interactions are essential for the activity of those compounds and a better understanding would allow, among others, the development of new drugs, the improvement of their efficiency and the reduction of their toxicity. Solid-state NMR spectroscopy is a method of choice to study membranes – molecules interactions. Specifically, using membrane probes is common and allows to access new experiments.
The main project within this thesis focuses on the synthesis and study of monofluorinated phospholipids for their validation as model membranes probe in solid-state NMR. Fluorine possesses numerous chemical and spectroscopic characteristics of interest for its use to study biomolecule complexes in NMR spectroscopy. This thesis reports the synthesis of three new monofluorinated analogs of dimyristoylphosphatidylcholine (F-DMPC), having one fluorine atom located on the acyl chain at position 2 of the glycerol, with the goal of mimicking eukaryotic membranes. Property studies of these three new F-DMPCs and of three previously synthesized derivatives are also presented. Overall, the results have shown that the incorporation of a fluorine atom into DMPC perturbs significantly the membrane properties, but that F-DMPC/DMPC mixtures containing 25% F-DMPC or less behave in a similar way to DMPC membranes. To validate this new model, the orientation of two antimicrobial peptides having a known behaviour in the presence of DMPC membranes has been estimated in F-DMPC/DMPC (1/3) membranes. For all F-DMPC,
15
N NMR has shown that peptide orientation is not affected by the presence of monofluorinated DMPC. Such mixtures can therefore be used as membrane probes to study interactions between them and various bioactive molecules with solid-state NMR. This thesis also presents the development of a new and flexible synthetic methodology of phosphatidylglycerols. As identical or different acyl chains with various lengths can be incorporated, this methodology will allow access to F-DMPG in order to mimic prokaryotic cell membranes.
vi
The second thesis project focuses on the study of new model peptides in order to develop a new tool to evaluate biological membrane thickness. A series of peptides analogues to the antimicrobial synthetic peptide MSI-103, having various lengths and called KIAn, have first been synthesized and studied to investigate the importance of the hydrophobic mismatch in the formation of pores and in the activity of these peptides. This study showed that peptide length is a key factor in their activity: the length must be sufficient to span the hydrophobic thickness of the lipid bilayers. However, the design of KIAn peptides implies that longer peptides are more charged and this factor can also influence the observed tendency. Therefore, this thesis reports our study aimed at verifying the influence of global cationic charge of KIAn peptides on their activity. Two new peptide series of various lengths (14 to 28 amino acids) and of constant global charge (+7), called KIA(7)n and KIXAn, have been synthesized and analyzed with several techniques (circular dichroism, biological tests, fluorescence spectroscopy and
15
N NMR). This study confirmed the importance of hydrophobic mismatch and the absence of charge effect in the activity of these peptides. It also validated the use of these peptides as molecular rulers to estimate the hydrophobic thickness of lipid bilayers.
ix
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... ix
Liste des abréviations ... xiii
Liste des tableaux ... xvi
Liste des schémas ... xvii
Liste des figures ... xviii
Remerciements ... xxvi
Avant-propos ... xxx
Chapitre 1. Introduction ... 1
1.1 Interactions membranes cellulaires – molécules ... 1
1.2 Membranes biologiques ... 3
1.2.1 Membranes cellulaires naturelles ... 3
1.2.2 Membranes cellulaires modèles ... 9
1.2.3 Structures adoptées ... 10
1.3 Peptides antimicrobiens ... 14
1.3.1 Résistance bactérienne ... 15
1.3.2 Peptides antimicrobiens naturels ... 16
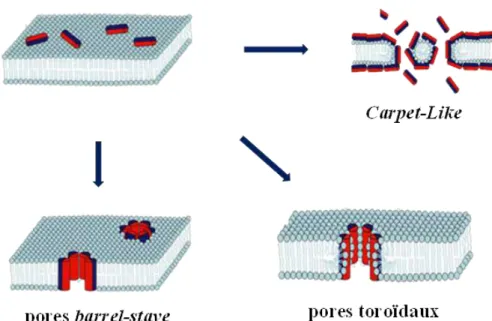
1.3.3 Mécanismes d’action ... 17
1.4 Étude des interactions membranes cellulaires – molécules ... 19
1.4.1 Spectroscopie RMN des solides ... 19
1.4.2 Sondes membranaires ... 20
1.5 Phospholipides fluorés ... 22
1.5.1 Inconvénients des noyaux usuels en spectroscopie RMN ... 22
1.5.2 L’atome de fluor ... 23
1.5.2.1 Propriétés chimiques ... 23
1.5.2.2 Propriétés en spectroscopie RMN ... 24
1.5.2.3 Utilisation du fluor comme sonde membranaire ... 25
1.5.3 Travaux antérieurs ... 26
1.5.4 Objectifs ... 30
1.5.4.1 Objectifs généraux et précédents sur le projet ... 30
1.5.4.2 Objectifs du projet de thèse ... 32
1.6 Peptides KIA ... 33
1.6.1 Peptides PGLa et MSI-103 ... 34
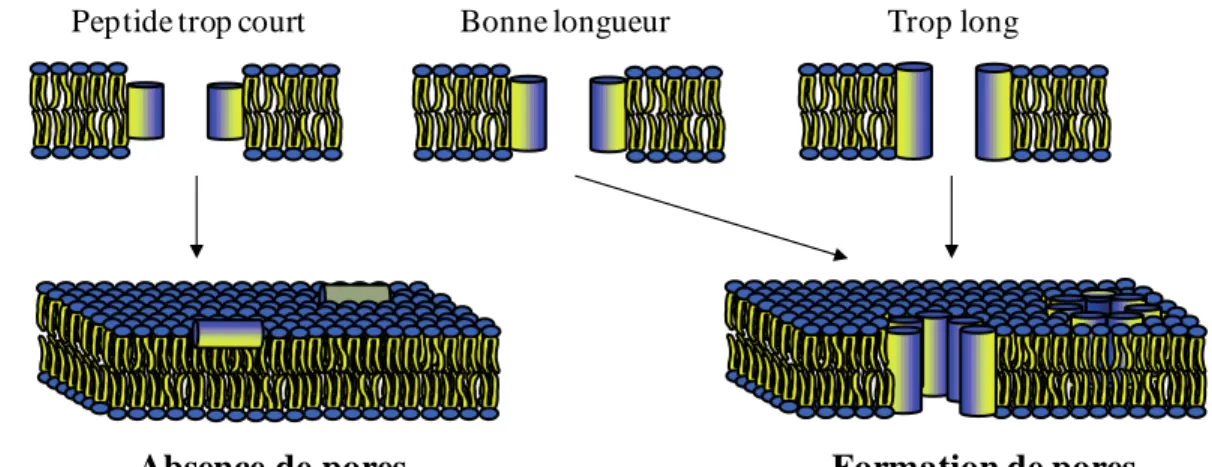
1.6.2 Décalage hydrophobe ... 35
1.6.3 Travaux antérieurs ... 36
1.6.4 La charge globale, un déterminant moléculaire ... 38
1.6.5 Objectifs du projet ... 39
x
2.1 Spectroscopie infrarouge ... 42
2.1.1 Principes théoriques ... 42
2.1.2 Étude du thermotropisme des lipides ... 43
2.2 Spectroscopie RMN des solides ... 45
2.2.1 Anisotropie de déplacement chimique ... 47
2.2.2 RMN du phosphore-31 ... 48
2.2.2.1 RMN du phosphore-31 en milieu statique ... 48
2.2.2.2 RMN du phosphore-31 en milieu orienté ... 51
2.2.3 RMN du fluor-19 ... 52
2.2.4 RMN de l’azote-15 ... 53
2.2.5 Couplage quadrupolaire et RMN du deutérium ... 55
2.3 Films monomoléculaires ... 58
2.3.1 Films de Langmuir ... 58
2.3.2 Microscopie à angle de Brewster ... 62
2.4 Dichroïsme circulaire ... 64
2.4.1 Étude conformationnelle de peptides ... 64
2.5 Spectroscopie de fluorescence ... 67
2.5.1 Étude de relargage ... 67
Chapitre 3. Evaluation of the Effect of Fluorination on the Property of Monofluorinated Dimyristoylphosphatidylcholines ... 70
3.1 Résumé ... 71
3.2 Abstract ... 71
3.3 Introduction ... 72
3.4 Results and discussion ... 75
3.4.1 Synthesis of monofluorinated dimyristoylphosphatidylcholines ... 75
3.4.2 Characterization of monofluorinated dimyristoylphosphatidylcholines ... 79
3.5 Conclusions... 84
3.6 Acknowledgements ... 85
3.7 Annexe 1 : Estérification finale ... 85
3.8 Experimental ... 87
3.8.1 Materials and methods ... 87
3.8.2 Synthesis of 2F-DMPC ... 88
3.8.3 Synthesis of 12F-DMPC ... 91
3.8.4 Synthesis of 14F-DMPC ... 94
3.8.5 General procedure for the synthesis of XF-DMPC ... 96
Chapitre 4 New insights into the influence of monofluorination on dimyristoylphosphatidylcholine membrane properties: A solid-state NMR study 98 4.1 Résumé ... 99
4.2 Abstract ... 100
4.3 Introduction ... 101
4.4 Materials and methods ... 105
4.4.1 Materials ... 105
xi
4.4.3 Solid-state NMR of multilamellar vesicles (2H, 19F, 31P) ... 107
4.4.4 Solid-state NMR of oriented lipid bilayers (15N, 19F, 31P) ... 108
4.5 Results and discussion ... 110
4.5.1 Lipids in multilamellar vesicles ... 110
4.5.1.1 Pure F-DMPC ... 111
4.5.1.2 F-DMPC/DMPC mixtures ... 118
4.5.2 Macroscopically oriented lipid bilayers ... 119
4.5.2.1 F-DMPC pure or in mixture with DMPC ... 120
4.5.2.2 DMPC/F-DMPC mixtures in the presence of antimicrobial peptides ... 121
4.6 Conclusion ... 124
4.7 Acknowledgements ... 125
4.8 Annexe 1 : Autres méthodes de caractérisations ... 125
4.8.1 Matériel et méthodes ... 125
4.8.2 Monocouches de Langmuir ... 126
4.8.3 Microscopie à angle de Brewster ... 128
4.9 Supplementary Information ... 131
Chapitre 5 A Flexible Synthetic Approach to Phosphatidylglycerols ... 139
5.1 Résumé ... 140
5.2 Abstract ... 140
5.3 Introduction ... 141
5.4 Results and discussion ... 142
5.5 Conclusion ... 149
5.6 Acknowledgements ... 150
5.7 Experimental ... 150
5.7.1. General information ... 150
5.7.2. Experimental procedure ... 151
Chapitre 6. Towards the Use of Monofluorinated Dimyristoylphosphatidylcholines as 19F NMR Reporters in Bacterial Model Membranes ... 161
6.1 Résumé ... 162
6.2 Abstract ... 162
6.3 Introduction ... 163
6.4 Results and discussion ... 165
6.4.1. FTIR spectroscopy ... 165
6.4.2. Solid-state NMR spectroscopy ... 168
6.5 Conclusion ... 171
6.6 Materials and methods ... 172
6.6.1. Materials ... 172
6.6.2. Sample preparation ... 173
6.6.3. FTIR spectroscopy ... 173
6.6.4. Solid-state NMR spectroscopy ... 174
xii
6.8 Supplementary Information ... 175
Chapitre 7 Influence of the Length and Charge on the Activity of α-Helical Amphipathic Antimicrobial Peptides ... 176
7.1.Résumé ... 177
7.2.Abstract ... 178
7.3.Introduction ... 179
7.4.Materials and methods ... 185
7.4.1. Materials ... 185
7.4.2. Peptide synthesis ... 186
7.4.3. Circular dichroism spectroscopy (CD) ... 186
7.4.4. Minimum inhibitory concentration assay ... 187
7.4.5. Hemolysis assay ... 188
7.4.6. Vesicle leakage assay ... 189
7.4.7. Solid-state NMR ... 190
7.5.Results... 191
7.5.1. Peptide synthesis and characterization by CD ... 191
7.5.2. Antimicrobial assay ... 194
7.5.3. Hemolysis assay ... 197
7.5.4. Vesicle leakage ... 199
7.5.5. Solid-state NMR ... 201
7.6.Discussion ... 206
7.6.1. Length and charge ... 206
7.6.2. Influence of hydrophobicity and Gly residues ... 207
7.6.3. Leakage ... 209
7.6.4. Influence of a charged C-terminus ... 210
7.6.5. Peptide orientation ... 213
7.7.Conclusion ... 216
7.8.Acknowledgements ... 217
7.9.Supplementary information ... 217
Chapitre 8. Conclusions et perspectives ... 238
8.1 Phospholipides monofluorés ... 238 8.1.1 Conclusion ... 238 8.1.2 Perspectives ... 240 8.2 Peptides modèles ... 242 8.2.1 Conclusion ... 242 8.2.2 Perspectives ... 244
xiii
Liste des abréviations
ADC Anisotropie de déplacement chimique
AMP Peptide antimicrobien (ou Antimicrobial peptide)
ANTS 8-Amino-naphtalène-1,3,6-trisulfonate de sodium (ou 8-amino naphthalene-1,3,6-trisulfonic acid sodium salt)
ATR Spectroscopie infrarouge à réflexion totale atténuée (ou Attenuated total
reflection)
B0 Champ magnétique externe
BAM Microscopie à angle de Brewster CSA Chemical shift anisotropy
CD Dichroïsme circulaire (ou Circular dichroism)
CFU Colony-forming units
CP Cross-polarization
DDQ 2,3-Dichloro-5,6-dicyano-p-benzoquinone DErPC 1,2-Dierucoyl-sn-glycero-3-phosphatidylcholine
DErPG 1,2-Dierucoyl-sn-glycero-3-phosphatidylglycerol
DHPC Dihexanoylphosphatidylcholine DLS Diffusion dynamique de la lumière
DMF N,N-diméthylformamide
DMoPC 1,2-Dimyristoleoyl-sn-glycero-3-phosphatidylcholine
DMoPG 1,2-Dimyristoleoyl-sn-glycero-3-phosphatidylglycerol
DMPC Dimyristoylphosphatidylcholine (ou 1,2-Dimyristoyl-sn-glycero-phospho
choline)
DMPE Dimyristoylphosphatidylétanolamine
DMPG Dimyristoylphosphatidylglycérol (ou 1,2-Dimyristoyl-sn-glycero-3-phosphoglycerol)
DMSO Diméthylsulfoxyde
DPPC Dipalmitoylphosphatidylcholine
DPX Bromure de p-xylène-bis(N-pyridinium) (ou p-xylene-bis(N-pyridinium)
bromide)
DSC Calorimétrie différentielle à balayage
E. coli Escherichia coli
EDTA Acide éthylène diamine tétraacétique
E. faecalis Enterococcus faecalis
ESI Electrospray ionization
F-DMPC Dimyristoylphosphatidylcholine monofluoré Fmoc Fluorenylmethoxycarbonyl
FTIR Fourier transform infrared spectroscopy (ou Spectroscopie infrarouge à
transformée de Fourier)
HEPES Acide hydroxyéthyl)-1-pipérazine éthane sulfonique (ou
4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid)
HPLC Chromatographie en phase liquide à haute performance (ou
High-pressure liquid chromatography)
xiv
Hz Hertz
I Niveaux d’énergie
IR Spectroscopie infrarouge (ou Infrared spectroscopy)
J Coupling constant
LPCD Lumière polarisée circulairement à droite LPCG Lumière polarisée circulairement à gauche LPS Lipopolysacharide
LUV Grande vésicule unilamellaire (ou Large unilamellar vesicle) lyso-MPC 1-myristoyl-2-hydroxy-sn-glycero-3-phosphatidylcholine
14:0 LysoPC 1-Myristoyl-2-hydroxy-sn-glycero-3-phosphocholine
M1 First spectral moment ( ou premier moment spectral)
MAS Rotation à l’angle magique
Me-DAST Trifluorure de diméthylaminosoufre MIC Minimal inhibitory concentration
MLV Vésicule multilamellaire
NAG N-acétyl-glucosamine
NAM Acide N-acétyl-muramique
NBS N-bromosuccinimide
NMR Nuclear magnetic resonance
NMRSD Normalized root mean square deviation
OD Optical density
P. Aeruginosa Pseudomonas Aeruginosa
PB Phosphate buffer PC Phosphatidylcholine PE Phosphatidyléthanolamine PG Phosphatidylglycérol PI Phosphatidylinositol POPC 1-Palmitoyl-2-oleoyl-sn-glycero-3-phosphatidylcholine POPE 1-Palmitoyl-2-oleoyl-sn-glycero-3-phosphatidylethanolamine POPG 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphatidylglycerol
P/L Peptide-to-lipid molar ratio
ppm Partie par million PS Phosphatidylsérine
REDOR Rotational-echo double-resonance
Rhod-PE Rhodamine B (ou
1,2-Dioleoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl))
RMN Résonance magnétique nucléaire
R2 Résonance rotationnelle (ou rotational resonance)
rt Room temperature
S. Aureus Staphyloccocus Aureus
SCD Paramètre d’ordre orientationnel (ordre des liaisons C-D des
phospholipides)
SM Sphingomyéline
SPPS Solid phase peptide synthesis
SUV Petite vésicule unilamellaire (ou Small unilamellar vesicle) SVD Singular value decomposition
xv TEMPO 2,2,6,6-Tetramethyl-1-piperidinyloxy
THF Tétrahydrofurane
TLC Thin-layer chromatography
Tm Température de transition de phase
TOF Time-of-flight
t.p. Température pièce
σ11, σ22, σ33 Éléments principaux du tenseur de déplacement chimique du 31P
σII Élément du tenseur de CSA observé pour un lipide orienté à 0° par
rapport au champ magnétique
σ⊥ Élément du tenseur de CSA observé pour un lipide orienté à 90° par rapport au champ magnétique
δ Déplacement chimique (en ppm) (ou chemical shift)
δiso Déplacement chimique isotrope (en ppm) (ou isotropic chemical shift)
δ⊥ Déplacement chimique perpendiculaire (en ppm) (ou perpendicular
chemical shift)
∆σ Anisotropie de déplacement chimique ∆ fréquence (en ppm)
Q Écart quadrupolaire (en Hertz)
Tension de surface de l’état initial Tension de surface observée Pression de surface (en mN/m2)
xvi
Liste des tableaux
Tableau 1.1. Composition lipidique de cellules érythrocytes humaines et de cellules de
la bactérie E. coli. ... 6
Table 3.1. Phase transition temperature for pure F-DMPC’s, DMPC and for
mixtures with DMPC. The error is estimated to be ± 0.5 °C. ... 82
Table 4.1. Isotropic contribution (31P and 19F), S1 (31P, defined in Eq. 4.1) and CSA (19F,
defined in Eq. 4.2) in solid-state NMR spectra of pure DMPC and pure F-DMPCs. ... 115
Table 6.1. Phase transition temperatures for F-DMPC/DMPC/DMPG mixtures at
various fluorinated lipids/non-fluorinated lipids (1:1, 1:3 and 1:9) and PC/PG ratios (1:1 and 3:1) in comparison to the corresponding DMPC/DMPG (1:1 and 3:1) system. The error is estimated to be ±0.5 °C. ... 169
Table 6.2. Isotropic contribution (31P and 19F) in solid-state NMR spectra of pure F-DMPC, DMPC/DMPG (1:1) mixture and F-DMPC/DMPC/DMPG mixtures. .... 172
Table 7.1. Peptide sequencesa ... 194
Table 7.2. MIC values (micrograms per milliliter) for KIA(7) peptides in four different
bacterial strainsa ... 197
Table 7.3. MIC values (micrograms per milliliter) for KIXA peptides in four different
bacterial strainsa ... 198
Table 7.4. MIC values (micrograms per milliliter) for the original KIA peptides in four
different bacterial strainsa ... 198
Table S 7.1. Secondary structure composition of KIA(7) and KIXA peptides in the
presence of DMPC/DMPG 3/1 vesicles, as evaluated by deconvolution of the CD spectra using three different algorithms. ... 219
Table S 7.2. MIC values (μmol/L) for KIA(7) peptides in four different bacterial strains.
Inactive peptides are marked in bold for each strain. ... 220
Table S 7.3. MIC values (µmol/mL) for KIXA peptides in four different bacterial
strains. Inactive peptides are marked in bold for each strain. ... 221
Table S 7.4. MIC values (µmol/mL) for the original KIA peptides in four different
bacterial strains. Inactive peptides are marked in bold for each strain.a ... 221
Table S 7.5. Hemolysis (in %) of KIA(7) and KIXA peptides at various concentrations
(8-512 µg/mL). Inactive peptides are marked in bold. ... 222
Table S 7.6. Leakage (in %) of KIA,a KIA(7) and KIXA peptides at P/L=1/12.5-15 with different lipid membrane thicknesses. Inactive peptides are marked in bold. ... 223
Table S 7.7. Leakage (in %) of KIA,a KIA(7) and KIXA peptides at P/L=1/25-29 with different lipid membrane thicknesses. Inactive peptides are marked in bold. ... 224
Table S 7.8. Leakage (in %) of KIA,a KIA(7) and KIXA peptides at P/L=1/50-59 with different lipid membrane thicknesses. Inactive peptides are marked in bold. ... 225
Table S 7.9. Chemical shifts of solid-state 15N-NMR spectra of KIA(7) and KIXA peptides in different lipid bilayers and at a constant peptide-to-lipid mass ratio (corresponding to P/L = 1/41 to 1/72). ... 226
Table S 7.10. Chemical shifts of solid-state 15N-NMR spectra of KIA(7) and KIXA peptides in DMPC/lyso-MPC 2/1 at P/L=1/20 to 1/24. ... 227
xvii
Liste des schémas
Scheme 3.1. Synthesis of 2F-DMPC. ... 77 Scheme 3.2. Synthesis of 12F-DMPC. ... 79 Scheme 3.3. Synthesis of 14F-DMPC. ... 80 Schéma 3.1. Conditions réactionnelles initiales de l’estérification de la Lyso-MPC avec
l’acide fluoromyristique. ... 86
Schéma 3.2. Conditions réactionnelles optimisées de l’estérification de la Lyso-MPC
avec l’acide fluoromyristique. ... 88
Scheme 5.1. Initial results for the synthesis of 4 using phosphoryl chloride. ... 145 Scheme 5.2. Opening of the epoxide, reprotection of the phosphate and esterification [a]
Yield of the desired compound corrected for the purity estimated by 31P NMR. [b] Ratio 10/impurity. [c] Yield corrected for the purity of 10a and 10b estimated by
31
P NMR. ... 149
xviii
Liste des figures
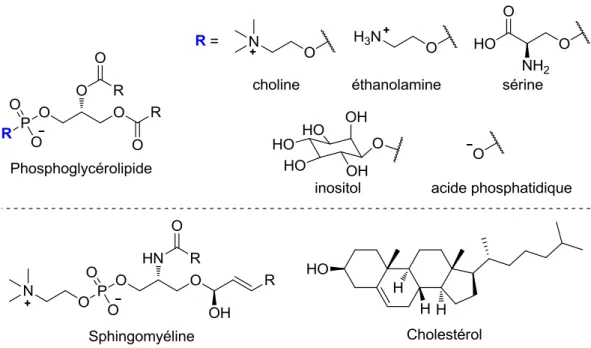
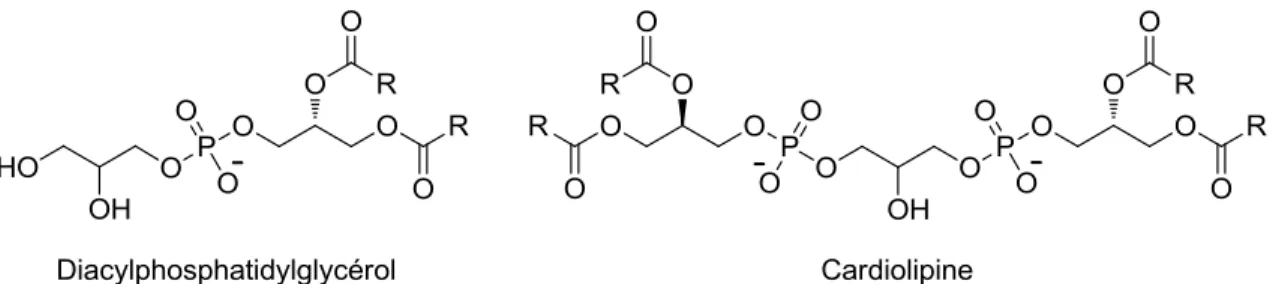
Figure 1.1. Structure générale d’un phosphoglycérolipide, illustration de la dimyristoyl-
phosphatidylcholine (DMPC). ... 4
Figure 1.2. Structure des composantes lipidiques majoritaires des membranes cellulaires
eucaryotes. ... 5
Figure 1.3. Structure des composantes lipidiques anioniques majoritaires des
membranes cellulaires procaryotes. ... 6
Figure 1.4. Illustration schématique des parois des cellules des bactéries à Gram positif
(A) et à Gram négatif (B). Figure adaptée de la référence 11. ... 7
Figure 1.6. Structures adoptées par les phospholipides. Images adaptées des références
27, 28, 29, 30, 31. ... 11
Figure 1.7. Principaux mécanismes d’action des peptides antimicrobiens. Figure adaptée
de la référence 69. ... 19
Figure 1.8. Phosphocholines polyfluorées rapportées dans la littérature.127,128,129,130,131 28
Figure 1.9. Phosphocholines monofluorées rapportées dans la littérature. 116,132,133 ... 28
Figure 1.10. Structure en bicouche interdigitée adoptée par la 16F-DPPC. Figure
adaptée de la référence 132. ... 29
Figure 1.11. Structure des dérivés monofluorés de la DMPC (F-DMPC) et du DMPG
(F-DMPG). ... 30
Figure 1.12. Schématisation des nouveaux phospholipides monofluorés (tête polaire
représentée en bleu, position du fluor indiquée en rouge) et des membranes
lipidiques modèles partiellement fluorées (lipide monofluoré en bleu, lipide natif en vert). ... 31
Figure 1.13. Illustration du concept de décalage hydrophobe. Figure adaptée de la
référence 152. ... 36
Figure 1.14. Série de peptides KIA. KIA21 correspond au peptide MSI-103. ... 37 Figure 1.15. Roues hélicoïdales des peptides KIA14, KIA21 et KIA28 de la série de
peptides KIAn. Portion hydrophile représentée en blanc et portion hydrophobe du peptide représentée en bleu. ... 38
Figure 1.16. Roues hélicoïdales des peptides KIA(7)14, KIA21 et KIA(7)28 de la série
de peptides KIA(7)n. Portion hydrophile représentée en blanc et portion hydrophobe du peptide représentée en bleu. Les acides aminés encadrés
correspondent aux modifications à la séquence primaire des peptides de la série KIA. ... 41
Figure 1.17. Roues hélicoïdales des peptides KIKA14, KIA21 et KISA28 de la série de
peptides KIXAn. Portion hydrophile représentée en blanc et portion hydrophobe du peptide représentée en bleu. Les acides aminés encadrés correspondent aux
modifications à la séquence primaire des peptides de la série KIA. ... 42
Figure 2.1. Transition de phase d’un phospholipide d’une phase gel ordonnée à une
phase fluide désordonnée et introduction de conformères gauche. ... 45
Figure 2.2. Région des bandes d’élongation des méthylènes des chaînes acyle d’un
phospholipide d’un spectre infrarouge à plus basse (noir) et plus haute (bleu) température que la température de transition de phase. ... 45
xix
Figure 2.3. Courbe de thermotropisme de la bande d'élongation symétrique des CH2 de
la DMPC. Figure adaptée de la référence 165. ... 46
Figure 2.4. Principaux éléments du tenseur de déplacement chimique du phosphore-31
du groupement phosphate de phospholipides. ... 49
Figure 2.5. Spectres de phospholipides en RMN solide du phosphore-31 d’un
phospholipide a) sous forme de poudre, b) en phase gel, c) en phase fluide, d) en phase hexagonale inverse et e) en structure isotrope (micelle, petites vésicules unilamellaires, molécules libres). Figure adaptée de la référence 35. ... 50
Figure 2.6. Principaux éléments du tenseur d’anisotropie de déplacement chimique de
l’azote-15 d’une liaison peptidique. Figure adaptée de la référence 97. ... 55
Figure 2.7. Spectre d’un peptide en hélice α en présence de membranes lipidiques en
RMN solide de l’azote-15 a) ayant une topologie transmembranaire et b) localisé à la surface des membranes. ... 56
Figure 2.8. Patron spectral schématisé obtenu par étude du deutérium en spectroscopie
RMN des solides. Figure adaptée de la référence 77. ... 57
Figure 2.9. Spectre 2H en RMN à l’état solide de la DMPC-d54 en vésicules
multilamellaires. Figure adaptée de la référence 35. ... 59
Figure 2.10. Composantes d’un bain de Langmuir. ... 60 Figure 2.11. Isotherme de compression typique d’une monocouche de phospholipides et
les quatres sections qui le caractérise. Figure adaptée de la référence 30. ... 61
Figure 2.12. Isothermes de compression de monocouches de DMPC à différentes
températures. ... 63
Figure 2.13. Principe de réflexion et d’absorption du faisceau laser en microscopie à
angle de Brewster à une interface air-eau. Figure adaptée de la référence 184. ... 64
Figure 2.14. Absorption de la lumière polarisée circulairement à gauche (LPCG) et à
droite (LPCD) et ellipse polarisée résultant de la biréfringence circulaire ainsi que de la différence d’absorption entre les deux composantes de la lumière. ... 66
Figure 2.15. Spectre d’absorption typique d’un peptide selon les trois structures
secondaires principales. Figure adaptée de la référence 189. ... 67
Figure 2.16. Structure de la paire fluorophore-extincteur ANTS/DPX. ... 69 Figure 2.17. Étapes principales de la préparation des échantillons de vésicules
unilamellaires avec encapsulation d’ANTS/DPX et exemple d’une expérience de relargage de fluorescence pour le peptide KIA21 dans des vésicules unilamellaires de POPC/POPG (1/1) à un rapport P/L de 1/50. Figure adaptée de la référence 152. ... 70
Figure 3.1. Polyfluorinated and monofluorinated phosphatidylcholines previously
reported. ... 75
Figure 3.2. Previously reported and targeted monofluorinated
1,2-dimyristoyl-sn-glycero-3-phosphocholines (F-DMPC’s). The colored circle represents the carbon bearing the fluorine atom. ... 76
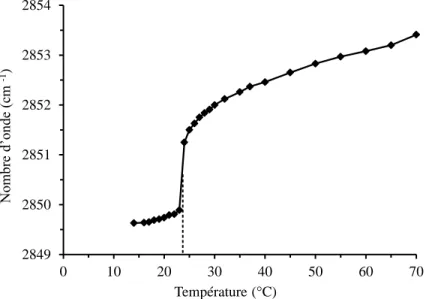
Figure 3.3. Retrosynthetic analysis. ... 76 Figure 3.4. Temperature dependence of the wavenumber of the CH2 symmetric
stretching vibration for DMPC and F-DMPC’s. The error is estimated to be ± 0.1 cm-1. ... 81
Figure 3.5. Temperature dependence of the wavenumber of the CH2 symmetric
stretching vibration for various mixtures of F-DMPC and DMPC. The error is estimated to be ± 0.1 cm-1. ... 84
xx
Figure 4.1. Chemical structures of the series of monofluorinated
1,2-dimyristoyl-sn-glycero-3-phosphocholines (F-DMPCs). The blue circles represent the carbon bearing a single fluorine atom in each analogue., ... 106
Figure 4.2. Static solid-state 31P NMR spectra of pure F-DMPC multilamellar vesicles in comparison to pure DMPC. ... 114
Figure 4.3. Static 19F solid-state NMR spectra of pure F-DMPC multilamellar vesicles. ... 116
Figure 4.4. CSA of F-DMPC 19F solid-state NMR spectra as a function of the position of the fluorine atom along the phospholipid acyl chain. The error is estimated to be ± 0.5 ppm. ... 118
Figure 4.5. Static solid-state 2H NMR spectra of F-DMPC/DMPC (1/1) mixtures in comparison to pure DMPC. The DMPC portion of all 2H samples contains 20 mass-% DMPC-d54. ... 119
Figure 4.6. Static solid-state 31P (A) and 19F NMR (B) spectra of 4F-DMPC/DMPC (1/3, 1/9, and 1/19) mixtures in comparison to pure 4F-DMPC and pure DMPC. (C) Static 2H NMR spectra of 4F-DMPC/DMPC (1/1, 1/3 and 1/9) mixtures in
comparison to pure DMPC. The DMPC portion of all 2H NMR samples contains 20% DMPC-d54. ... 120
Figure 4.7. Solid-state 31P (A) and 19F NMR (B) spectra of a 4F-DMPC/DMPC (1/3) mixture in comparison to pure 4F-DMPC and pure DMPC in oriented samples. . 122
Figure 4.8. Solid-state NMR spectra of 15N-labeled KIKA14 peptide in
4F-DMPC/DMPC (1/3) mixture or pure DMPC at P/L = 1/20 using oriented samples. (A) 31P NMR spectra (before 15N NMR), (B) 19F NMR (before 15N NMR), (C) 15N NMR, and (D) 31P NMR after 15N NMR. The 15N NMR signals of KIKA14 are indicative of the expected surface-bound state. ... 124
Figure 4.9. Solid-state NMR spectra of 15N-PGLa/Mag2 peptides (1/1) embedded in a 4F-DMPC/DMPC (1/3) mixture or pure DMPC at P/L = 1/20 using oriented
samples. (A) 31P NMR spectra (before 15N NMR), (B) 19F NMR (before 15N NMR), (C) 15N NMR. (D) 31P NMR after 15N NMR. The 15N NMR signals of PGLa are indicative of the expected inserted state. ... 124
Figure 4.10. Isothermes de compression de monocouches de 4F (A) et de 7F-DMPC (B)
en mélange avec la DMPC à 7 °C à l’interface air-eau. ... 128
Figure 4.11. Images de microscopie à angle de Brewster pour la DMPC (A), pour la
4F-DMPC seule (B) et en mélange avec la 4F-DMPC dans un rapport F-PC/PC de 1/3 (C) et pour la 7DMPC seule (D) et en mélange avec la DMPC dans un rapport F-PC/PC de 1/3 (D). Images prises lors du plateau du passage des lipides de la phase liquide expansée à condensée d’une isotherme de compression à 7 °C. ... 130
Figure S 4.1. Static solid-state 31P- (A-B) and 19F-NMR (C-D) spectra of two duplicates of 2F-DMPC/DMPC (1/3, 1/9 and 1/19) mixtures in comparison to pure 2F-DMPC and pure DMPC using different synthetic batches of 2F-DMPC. (E-F) Static solid-state 2H-NMR spectra of 2F-DMPC/DMPC (1/1, 1/3 and 1/9) mixtures in
comparison to pure DMPC. The DMPC portion of all 2H-NMR samples contains 20% DMPC-d54. ... 132
Figure S 4.2. Solid-state 31P-NMR spectra of F-DMPC/DMPC (1/3, 1/9 and 1/19) mixtures in comparison to pure F-DMPC and pure DMPC. ... 133
xxi
Figure S 4.4. Solid-state 2H-NMR spectra of F-DMPC/DMPC (1/1, 1/3 and 1/9)
mixtures in comparison to pure DMPC. The DMPC portion of all samples contains 20% DMPC-d54. ... 135
Figure S 4.5. Oriented solid-state 31P- (A) and 19F-NMR (B) spectra of pure F-DMPC samples in comparison to pure DMPC. ... 136
Figure S 4.6. Oriented solid-state 31P- (A) and 19F-NMR (B) spectra of F-DMPC/DMPC (1/3) mixtures samples in comparison to pure DMPC. ... 137
Figure S 4.7. Solid-state NMR spectra of 15N-KIKA14 peptide in F-DMPC/DMPC (1/3) mixtures or pure DMPC at P/L = 1/20 using oriented samples. (A) 31P-NMR
spectra (before 15N-NMR), (B) 19F-NMR (before 15N-NMR), (C) 15N-NMR, (D)
31
P-NMR spectra after 15N-NMR. The 15N-NMR signals of KIKA14 in all lipid systems are indicative of the expected surface-bound state. ... 138
Figure S 4.8. Solid-state NMR spectra of 15N-PGLa/Mag2 (1/1) peptide in
F-DMPC/DMPC (1/3) mixtures or pure DMPC at P/L = 1/20 using oriented samples. (A) 31P-NMR spectra (before 15N-NMR), (B) 19F-NMR (before 15N-NMR), (C)
15
N-NMR, (D) 31P-NMR after 15N-NMR. The 15N-NMR signals of PGLa in all lipid systems are indicative of the expected inserted state. ... 139
Figure 5.1. Phosphatidylcholines (PCs) 1 and phosphatidylglycerols (PGs) 2. ... 143 Figure 5.2. Initial retrosynthetic analysis for the synthesis of phosphatidylglycerols. . 144
(X = O or N, R = protecting group, R1 = alkyl chain) ... 144
Figure 6.1. Monofluorinated dimyristoylphosphatidylcholines (F-DMPCs) combined
with dimyristoylphosphatidylglycerol (DMPG) as potential fluorine-labelled bacterial model membranes. The colored circle represents the carbon bearing the fluorine atom. ... 166
Figure 6.2. Temperature dependence of the wavenumber of the CH2 symmetric
stretching vibration for various F-DMPC/DMPC/DMPG mixtures for 4F-DMPC (A and B) and for 7F-DMPC (C and D) at various fluorinated lipids/non-fluorinated lipid ratio (1:1, 1:3 and 1:9) and at PC/PG ratios of 1:1 (A and C) and 3:1 (B and D) in comparison to the corresponding reference system (DMPC/DMPG 1:1 or 1:3). The error is estimated to be ±0.1 cm−1. ... 168
Figure 6.3. Static solid-state 31P NMR spectra of F-DMPC/DMPC/DMPG (1:1:2) mixtures of 4F- and 7F-DMPC in comparison to DMPC/DMPG (1:1) mixture. .. 172
Figure 6.4. Static solid-state 19F NMR spectra of F-DMPC/DMPC/DMPG (1:1:2) mixtures of 4 (A) and 7DMPC (B) in comparison to the corresponding pure F-DMPC. ... 173
Figure S 6.1. Static solid-state 31P NMR spectra of pure 4F- and 7F-DMPC
multilamellar vesicles. ... 177
Figure 7.1. Helical wheels of the original MSI-103 peptide (KIA21), and of the shortest
and longest peptide within each of the three series [KIAn, KIA(7)n, and KIXAn]. The hydrophobic sector is colored gray and the polar sector white. Charged residues and termini are labeled. Boxed residues indicate changes compared to the corresponding KIA peptides of the same length. ... 186
Figure 7.2. Circular dichroism spectra of (A and B) KIA(7) and (C and D) KIXA
peptides (A and C) in phosphate buffer (corresponding to peptide concentrations of 34−60 μM) or (B and D) in the presence of 3/1 DMPC/DMPG small unilamellar vesicles at a P/L ratio near 1/55, with a peptide concentration near 25 μM. ... 196
xxii
Figure 7.3. Hemolysis (in percent) of (A−D) KIA, (E−H) KIA(7), and (I−L) KIXA
peptides as a function of concentration (8−512 μg/mL). Results for KIA were taken from ref 152. ... 200
Figure 7.4. Leakage (in percent) induced by (A−D) KIA, (E−H) KIA(7), and (I−L)
KIXA peptides in (A, E, and I) 1/1 DMoPC/DMoPG vesicles, (B, F, and J) 1/1 POPC/POPG vesicles, (C, G, and K) 1/1 POPE/POPG vesicles, and (D, H, and L) 1/1 DErPC/DErPG vesicles (KIA results in POPC/POPG and DErPC/DErPG vesicles were taken from ref 152). The lipid concentration was 100 μM and the peptide concentration ≈8 μM, giving P/L ratios of 1/12.5 to 1/15. ... 202
Figure 7.5. Solid-state 15N NMR spectra of (A, C, and E) KIA(7) and (B, D, and F) KIXA peptides at a constant peptide-to-lipid mass ratio (corresponding to 1/41 to 1/72) in (A and B) 1/1 POPC/POPG, (C and D) 1/1 DMoPC/DMoPG, and (E and F) DMPC bilayers. The black dotted line (at 90 ppm) indicates the typical position for surface-oriented peptides. KIA19 and KIA21 were measured only once but are added in all series as a comparison (data for KIA19 and KIA21 in DMPC were taken from ref 152). ... 205
Figure 7.6. Solid-state 15N NMR spectra in DMPC/lyso-MPC (2/1) bilayers. (A) KIA(7) series and (B) KIXA series of peptides at a constant peptide-to-lipid mass ratio, corresponding to P/L ratios of 1/35−62. (C) KIA(7) peptides at a constant P/L ratio of 1/20−24. (D) KIXA peptides at a constant P/L ratio of 1/20−24. The dotted (90 ppm), dashed (138 ppm) and solid (175 ppm) lines indicate the typical spectral positions for surface-oriented, tilted, and inserted peptides, respectively (data for KIA19 and KIA21 at low concentrations were taken from ref 152). ... 207
Figure 7.7. Hypothetical model of peptide insertion and pore formation. Peptides are
represented by cylinders, where hydrophobic parts are colored yellow and polar parts blue; the hydrophobic core of the membrane is shown as a yellow box. All KIA peptides carry a free N-terminal Lys, which provides two positive charges. (A) Peptides like KIA21 (MSI-103) have a hydrophobic Ile-Ala segment on their amidated C-termini. They bind to the membrane surface with a slight tilt angle such that the C-terminus lies deeper in the membrane. This hydrophobic C-terminus makes it easier to insert even further into or across the lipid bilayer and form a transmembrane pore. (B) KIA peptides like KIA22 carry a charged Lys at their termini. They will likely lie flat in the membrane, like magainin. Their charged C-termini make it harder to insert into or across the membrane and form a pore, as observed here in the activity assays (MIC, hemolysis, and vesicle leakage). ... 215
Figure S 7.1. Leakage (in %) induced by KIA (A-C), KIA(7) (D-F), and KIXA (G-I)
peptides at P/L=1/25-29 in DMoPC/DMoPG 1/1 (A, D, G), in POPC/POPG 1/1 (B, E, H), and in DErPC/DErPG 1/1 (C, F, I) vesicles. (KIA results in POPC/POPG and in DErPC/DErPG are taken from ref 152.) ... 228
Figure S 7.2. Leakage (in %) induced by KIA (A-D), KIA(7) (E-H), and KIXA (I-L)
peptides at P/L=1/50-59 in DMoPC/DMoPG 1/1 (A, E, I), in POPC/POPG 1/1 (B, F, J), in POPE/POPG 1/1 (C, G, K) and in DErPC/DErPG (1/1) (D, H, L) vesicles. (KIA results in POPC/POPG and in DErPC/DErPG are taken from ref 152.) ... 229
Figure S 7.3. Solid-state NMR spectra of KIA(7) peptides in POPC/POPG at a constant
peptide-to-lipid mass ratio (corresponding to P/L = 1/41 to 1/72). (A) 31P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after 15 N-NMR. KIA14 does not form an α-helix, and the orientation therefore cannot be
xxiii
determined from the 15N-NMR spectrum. The 15N-NMR signals of all other peptides are typical of the surface-bound state. Lines in 15N-NMR spectra are shown at 90 ppm (black, surface state) and 140 ppm (blue, tilted state). ... 230
Figure S 7.4. Solid-state NMR spectra of KIXA peptides in POPC/POPG at a constant
peptide-to-lipid mass ratio (corresponding to P/L = 1/44 to 1/72). (A) 31P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after 15 N-NMR. The 15N-NMR signals of all peptides are typical of the surface-bound state. ... 231
Figure S 7.5. Solid-state NMR spectra of KIA(7) peptides in DMoPC/DMoPG at a
constant peptide-to-lipid mass ratio (corresponding to P/L = 1/41 to 1/72). (A) 31 P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after
15
N-NMR. KIA14 does not form an α-helix and the orientation can therefore not be determined from the 15N-NMR spectrum. The 15N-NMR signals of all other
peptides are typical of the surface-bound state. The 31P-NMR spectra show a worse orientation in these lipid systems than in the other systems used. ... 232
Figure S 7.6. Solid-state NMR spectra of KIXA peptides in DMoPC/DMoPG at a
constant peptide-to-lipid mass ratio (corresponding to P/L = 1/44 to 1/72). (A) 31 P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after
15
N-NMR. The 15N-NMR signals of all peptides are typical of the surface-bound state. The 31P-NMR spectra show a worse orientation in this lipid system than in the other systems used. ... 233
Figure S 7.7. Solid-state NMR spectra of KIA(7) peptides in DMPC at a constant
peptide-to-lipid mass ratio (corresponding to P/L = 1/41 to 1/72). (A) 31P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after 15 N-NMR. KIA14 does not form an α-helix and the orientation can therefore not be determined from the 15N-NMR spectrum. The 15N-NMR signal of KIA21 is typical for tilted state. The 15N-NMR signals of all other peptides are typical of the surface-bound state. ... 234
Figure S 7.8. Solid-state NMR spectra of KIXA peptides in DMPC at a constant
peptide-to-lipid mass ratio (corresponding to P/L = 1/44 to 1/72). (A) 31P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after 15 N-NMR. The 15N-NMR signals of all peptides are typical of the surface-bound state except for KIA21, which is at a chemical shift typical for a tilted state. ... 235
Figure S 7.9. Solid-state NMR spectra of KIA(7) peptides in DMPC/lyso-MPC 2/1 at a
constant peptide-to-lipid mass ratio (corresponding to P/L = 1/41 to 1/72). (A) 31 P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after
15
N-NMR. KIA(7)14 does not form an α-helix and the orientation therefore cannot be determined from the 15N-NMR spectrum. KIA19 and KIA21 results are taken from ref 152. ... 236
Figure S 7.10. Solid-state NMR spectra of KIXA peptides in DMPC/lyso-MPC 2/1 at a
constant peptide-to-lipid mass ratio (corresponding to P/L = 1/44 to 1/72). (A) 31 P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after
15
N-NMR. The 15N-NMR signals of peptides are indicating surface-bound or tilted peptides. KIA19 and KIA21 results are taken from ref 152. ... 237
Figure S 7.11. Solid-state NMR spectra of KIA(7) peptides in DMPC/lyso-MPC 2/1 at
P/L=1/20 to 1/24. (A) 31P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after 15N-NMR. The 15N-NMR signals of all other peptides
xxiv
are typical of strongly tilted peptides. KIA(7)14 does not form an α-helix and the orientation therefore cannot be determined from the 15N-NMR spectrum. ... 238
Figure S 7.12. Solid-state NMR spectra of KIXA peptides in DMPC/lyso-MPC 2/1 at
P/L=1/20 to 1/23. (A) 31P-NMR spectra before 15N-NMR. (B) 15N-NMR spectra. (C) 31P-NMR spectra after 15N-NMR. The 15N-NMR signals of all peptides are typical of strongly tilted peptides. ... 239
xxv
« Je n’ai pas échoué. J’ai simplement trouvé 10 000 solutions qui ne fonctionnent pas. » Thomas Edison
xxvi
Remerciements
Bien qu’un seul nom figure en page titre de la thèse, tout le chemin parcouru au long du doctorat ne se fait jamais seul. Cette section est pour tous ceux et celles qui m’ont aidé, d’une façon ou d’une autre, à me lancer dans cette épreuve de vie qu’est le doctorat, à le poursuivre, et maintenant, à achever ce long travail. C’est ici que je prendrai le temps de souligner votre soutien et de vous dire MERCI.
Tout d’abord, je tiens à remercier chaleureusement mes directeurs de thèse, Jean-François et Michèle. Merci de m’avoir permis de profiter d’autant d’opportunités au cours de mes études universitaires, à commencer par un stage de 1er cycle, en passant par un stage doctoral en Allemagne et par plusieurs congrès à l’international. Merci aussi de m’avoir aidé à pousser mes limites. L’étudiante en début de maîtrise qui assistait à ses premiers congrès anglophones n’aurait jamais parié oser un jour présenter devant une telle audience scientifique ! Merci pour votre grande disponibilité, pour votre rapidité légendaire de correction, pour votre soutien et votre compréhension lors des moments plus difficiles, pour la confiance et la liberté que vous m’avez accordées dans ce projet de doctorat multidisciplinaire. Merci d’avoir cru en moi et de m’avoir permis de devenir une meilleure scientifique, plus autonome, plus rigoureuse et plus critique. Je n’oublierai pas non plus votre optimisme et la motivation que vous avez su me transmettre lorsque les résultats étaient décourageants. C’est ce qui m’a permis de persévérer, et parfois de m’acharner, à mener à bien ce projet de thèse.
J’aimerais aussi remercier les professeurs qui ont accepté de faire partie de mon comité de thèse. D’abord, merci au Pr Steve Bourgault d’avoir accepté d’être l’évaluateur externe de ma thèse. Merci aussi aux Pr Normand Voyer et Jean-François Morin d’avoir accepté d’évaluer ma thèse. Un merci particulier au Pr Voyer pour m’avoir suivi en tant qu’évaluateur tout au long de mes études graduées, allant des séminaires à l’examen doctoral et maintenant, pour la thèse.
xxvii
Je tiens également à remercier tous ceux et celles qui ont participé étroitement à mon projet de doctorat. D’abord, Jonathan, merci d’avoir si bien amorcé ce projet, tu as bien débroussaillé le terrain ! Merci d’avoir supervisé l’étudiante plutôt tannante que j’étais durant mon stage de 1er
cycle. C’est ton amour pour la science, ton humour et ta détermination qui m’ont fait adorer mon stage et donné le goût de poursuivre à la maîtrise. Merci aussi aux différents étudiants stagiaires qui se sont relayés sur le projet depuis mon entrée à la maîtrise : Jozy-Ann, Jean-Daniel, Jean-François, Bianka, Paméla et Xavier. Votre aide au laboratoire fut très précieuse et j’ai eu beaucoup de plaisir à tous vous côtoyer. J’espère que votre séjour aux labos Paquin et Auger fut tout aussi agréable et que vous en gardez de bons souvenirs. Enfin, merci à Sébastien, toi qui as travaillé d’arrache-pied sur le projet des PG.
Merci à tous mes collègues actuels et passés des groupes Paquin et Auger. Vous êtes bien nombreux, alors ne m’en tenez pas rigueur si votre nom ne s’y retrouve pas. Du labo Paquin, un merci tout particulier à Marco, Marie-France et PA pour votre aide lors de mon arrivée à la maîtrise. J’étais plutôt intimidée, mais vous avez vite su me faire sentir inclue au groupe. Merci pour votre amitié et pour les bons moments passés en votre compagnie au labo et lors de nos sorties de groupe. Et merci les gars de m’avoir si souvent parlé du doctorat, c’est en partie grâce à vous si je me suis finalement lancée dans cette aventure ! Merci aussi à mes compatriotes de hottes, Mélissa, tout récemment et Carole-Anne, il y a plus longtemps. J’ai adoré pouvoir vous côtoyer au labo et j’espère pouvoir vous côtoyer de nouveau dans le futur. Merci aussi à JD, le seul autre membre actuel du labo à avoir connu certains des plus anciens du groupe. Merci d’avoir partagé ces moments de nostalgie et quelques insides avec moi, ça me fait sentir un peu moins vieille !
Du groupe Auger, je tiens à mentionner Matthieu. Collègues de longue date, on s’est suivis tout au long des études. Ce fut un plaisir de partager ces quelques années avec toi, entre autres avec nos quelques mois dans le cocon au bureau et lors de congrès, de San Francisco à Kyoto. Je tiens également à remercier Maud, pour ton amitié, pour les discussions au bureau comme ailleurs, pour les sorties à la piscine, les délicieux
xxviii
fromages et les desserts au chocolat ratés ! Merci aussi à Ben et Justine, j’ai eu beaucoup de plaisir à partager le bureau Auger en votre compagnie ces dernières années. Maud et Ben, merci pour les soirées passées chez vous, j’espère qu’on pourra continuer ça ! Et Justine, une soirée teckel s’imposera en temps et lieu !
Merci aussi à tous ceux qui travaillent trop souvent dans l’ombre, les indispensables professionnels de recherche. Sans vous, tout ce travail n’aurait jamais été possible. Je tiens spécialement à souligner le travail de Pierre Audet, spécialiste incontestable de la RMN. Merci Pierre pour toute l’aide que tu m’as apportée. Merci aussi pour nos discussions, scientifiques ou non, et merci de m’avoir partagé une partie de ta mer de connaissances en spectroscopie. Un grand merci aussi à Thierry Lefèvre. Merci pour ton aide en spectroscopie infrarouge, mais surtout merci pour toutes nos grandes discussions, scientifiques, philosophiques et environnementales. Merci d’avoir si bien su m’écouter quand j’étais découragée !
Merci aux autres professionnels qui m’ont permis d’utiliser certains appareils, François Paquet-Mercier, Rodica Plesu et Serge Groleau. Merci aussi à tous les autres employés du département, pour votre disponibilité, votre aide et votre courtoisie. Enfin, merci au support financier, principalement du regroupement PROTEO ainsi que du CRSNG, de m’avoir permis de faire ces recherches et de profiter d’autant d’opportunités aux études graduées.
I would also like to thank several people who helped me during my internship in Germany, at the Karlsruhe Institute of Technology. First, I would like to acknowledge Pr. Anne Ulrich for providing me this chance to do a PhD internship in your research group. Thanks also to Dr. Erik Strandberg, for supervising me during my stay, for your help with NMR and for your availability. I would also like to thank all the staff who helped me in the lab: Parvesh, Andrea and Kerstin for peptide synthesis, Jochen and Bianca for CD experiments, Johannes for fluorescence analysis, Erik and Markus for NMR and finally, Papia and Jonathan for biological tests. I would also like to mention
xxix
once again Papia, Jonathan and Bianca for your friendship. I will always remember our discussions and our trips, particularly into the Black Forest and at Weingarten. Vielen
dank!
Merci à mes amis chimistes, vous qui avez fini les études graduées et qui travaillez. Marco, Jodrey, Claire et tous les autres que je côtoie plus ou moins régulièrement. Merci aussi à Jérémie, toi qui te retrouves souvent seul parmi une mer de chimistes lors des soirées. Merci pour votre amitié et pour ses moments où l’on ne parle pas de chimie. Vous me donnez tous hâte d’enfin finir les études et de commencer à travailler ! Merci aussi à mes amis non-chimistes et à ma famille. Merci pour vos encouragements et merci de vous intéresser à ce que je fais bien que la chimie rebute plusieurs d’entre vous. Un merci particulier à mes amies de longue date, avec qui l’amitié arrive à se poursuivre malgré le temps, la distance et nos horaires chargés. Mention particulière ici à celles qui passent par Québec parfois et viennent me rendre visite, Audrey, Olivia, Marie-Pier et Noémie.
Pour terminer, je tiens à remercier celui avec qui j’ai partagé ces cinq dernières années et qui a su être présent à chaque instant, Olivier. Tu as partagé ma joie quand les résultats au labo étaient au rendez-vous et tu as aussi su me motiver dans les moments de découragement où je voulais tout abandonner. Tu as fait preuve d’une patience exemplaire pour arriver à m’endurer, surtout au cours de la dernière année et je ne t’en remercierai jamais assez. Tu as su rendre les moments difficiles moins pénibles et les moments de bonheur encore plus agréables. J’espère qu’avec la fin de mes études, nos projets de vie pourront se réaliser et qu’on partagera encore de longues années de bonheur ensemble, à rire, complices et sans se prendre au sérieux, avec nos cœurs d’enfants.
xxx
Avant-propos
Les travaux de synthèse organique présentés dans cette thèse ont été réalisés dans le groupe de chimie organique et médicinale du Pr Jean-François Paquin, à l’Université Laval, tandis que les études spectroscopiques ont été réalisées dans le laboratoire de recherche en biophysique et RMN des solides de la Pr Michèle Auger, aussi à l’Université Laval. De plus, une partie des études biophysiques a été réalisée à l’Institute
of Biological Interfaces, dans le laboratoire de la Pr Anne S. Ulrich, au Karlsruhe Institute of Technology (KIT, Karlsruhe, Allemagne).
Cette thèse est divisée en huit chapitres, dont cinq décrivent une recherche originale publiée. Pour ces chapitres, le texte et les figures des articles scientifiques ont été reproduits sans modifications, sauf pour adapter la mise en page ainsi que la numérotation (schémas, figures, tableaux, molécules). Ma contribution personnelle ainsi que la contribution de chaque auteur des publications rapportées dans cette thèse est décrite ci-dessous.
Le chapitre 3 est tiré d’un article intitulé « Evaluation of the effect of fluorination on the property of monofluorinated dimyristoylphosphatidylcholines ». Il a été publié dans la revue Organic & Biomolecular Chemistry et mis en ligne le 27 mai 2014 (Org.
Biomol. Chem. 2014, 12, 5126-5135). Les travaux de synthèse des trois analogues
fluorés de la DMPC rapportés ont été réalisés dans le laboratoire du Pr Jean-François Paquin. J’ai effectué la majorité des synthèses, avec la collaboration de trois stagiaires du groupe Paquin qui étaient alors sous ma supervision. Il s’agit de trois étudiants de 1er cycle en chimie de l’Université Laval. Bianka Turgeon a participé au développement d’une méthode de synthèse de la 14F-DMPC tandis que Daniel Savoie et Jean-François Parent ont participé à l’optimisation de la méthodologie de synthèse de la 12F-DMPC. J’ai réalisé l’entièreté des études en spectroscopie infrarouge sous la supervision de la Pr Michèle Auger. Concernant la rédaction, j’ai participé à l’écriture du manuscrit en collaboration avec mes deux directeurs de thèse, Jean-François Paquin et Michèle
xxxi
Auger. J’ai principalement rédigé l’introduction et la partie expérimentale de l’article ainsi que préparé les figures se trouvant dans le manuscrit et le document d’informations supplémentaires. L’annexe (section 3.7) incluse à ce chapitre constitue des travaux de synthèse que j’ai effectués seule au laboratoire, sous la supervision du Pr Jean-François Paquin.
Le chapitre 4 porte sur l’étude des analogues monofluorés de la DMPC par spectroscopie RMN des solides. Le manuscrit, intitulé « New Insights Into the Influence of Monofluorination on Dimyristoylphosphatidylcholine Membrane Properties: A Solid-State NMR Study », a été accepté dans Biochimica et Biophysica Acta le 4 décembre. La version acceptée du manuscrit a par la suite été publiée en ligne le 7 décembre 2017 (Biochim. Biophys. Acta 2017, https://doi.org/10.1016/j.bbamem.2017.12.002, In press). La plupart des analyses réalisées dans le cadre de ses recherches ont été effectuées à l’Université Laval, sous la supervision de la Pr Michèle Auger. Les autres analyses ont été réalisées en Allemagne, dans le laboratoire de la Pr Anne S. Ulrich au Karlsruhe
Institute of Technology (KIT). J’ai effectué la totalité des analyses RMN à l’Université
Laval et une partie de celles réalisées au KIT. Les autres analyses ont été effectuées par le Dr Erik Strandberg, professionnel au sein du laboratoire de la Pr Ulrich. Concernant la rédaction, j’ai écrit la totalité du manuscrit et préparé le document d’informations supplémentaires, sous la supervision de ma codirectrice de thèse, la Pr Auger. De plus, les coauteurs ont tous participé à la révision du manuscrit. Enfin, l’annexe à cette publication (section 4.8) présente les études de F-DMPC en monocouches par les techniques de Langmuir et de microscopie à angle de Brewster. J’ai dirigé ces travaux et les manipulations au laboratoire ont été majoritairement réalisées par Paméla Ouellet, étudiante stagiaire de premier cycle en chimie de l’Université Laval.
Le chapitre 5 décrit des travaux de synthèse publiés récemment dans European
Journal of Organic Chemistry. L’article, intitulé « A Flexible Synthetic Approach to
Phosphatidylglycerols », a été mis en ligne le 21 novembre 2017 (Eur. J. Org. Chem.,
2017, 6401-6407). Les travaux ont été amorcés par le Dr Sébastien Dautrey, dans le
xxxii
côté, j’ai réalisé l’optimisation des premières étapes synthétiques et la complétion de la voie de synthèse développée par le Dr Dautrey en accédant à six différents phosphoglycérols. J’ai effectué la majorité de la caractérisation de ces nouveaux composés ainsi que la totalité de la rédaction de la partie expérimentale et de la préparation du document d’informations supplémentaires. J’ai aussi supervisé Xavier Bertrand, un étudiant stagiaire de premier cycle en chimie de l’Université Laval, qui a travaillé sur ce projet et dont quelques résultats se retrouvent dans la publication. Le manuscrit a principalement été rédigé par mon directeur de thèse, Jean-François Paquin, et j’ai participé activement à la correction de celui-ci et à plusieurs modifications et ajouts aux schémas, au texte ainsi qu’à la bibliographie.
Le chapitre 6 décrit des travaux d’un article intitulé « Towards the Use of Monofluorinated Dimyristoylphosphatidylcholines as 19F NMR Reporters in Bacterial Model Membranes » récemment publié. Celui-ci a été accepté dans la revue Journal of
Fluorine Chemistry le 10 décembre 2017, puis publié en ligne le 12 décembre (J. Fluorine Chem., 2017, https://doi.org/10.1016/j.jfluchem.2017.12.009, In press). Cet
article décrit l’étude, par spectroscopie infrarouge et par RMN à l’état solide, d’un nouveau modèle membranaire fluoré qui permettrait de mimer les membranes cellulaires bactériennes. J’ai effectué la totalité des études par RMN ainsi qu’une partie des études en spectroscopie infrarouge. L’autre partie des analyses infrarouge au laboratoire a été effectuée par Paméla Ouellet sous ma supervision dans le cadre d’un stage académique de premier cycle. J’ai par la suite rédigé le manuscrit en totalité et préparé le document d’informations supplémentaires, sous la supervision de mes directeurs de recherche, les Prs Jean-François Paquin et Michèle Auger.
Le chapitre 7 est tiré d’un article paru dans le journal Biochemistry et publié en ligne le 10 mars 2017 (Biochemistry 2017, 56, 1680-1695). L’article, intitulé « Influence of the Length and Charge on the Activity of α-Helical Amphipathic Antimicrobial Peptides », rapporte principalement les travaux que j’ai effectués dans le cadre d’un stage doctoral dans le groupe du Pr Anne S. Ulrich, à Karlsruhe, en Allemagne, et sous la supervision du Dr Erik Strandberg. J’ai effectué la totalité de la synthèse et de la
xxxiii
purification des peptides des séries KIA(7) et KIXA ainsi que la quasi-totalité des analyses effectuées sur ces peptides en laboratoire. La synthèse peptidique, le dichroïsme circulaire, la spectroscopie RMN et la spectroscopie de fluorescence ont été réalisés respectivement sous la supervision des Drs Parvesh Wadhwani, Jochen Bürck, Erik Strandberg et Johannes Reichert. De plus, les analyses biophysiques (tests biologiques et spectroscopie de fluorescence) de la série de peptides KIA rapportées dans cette publication ont été obtenu par Ariadna Grau-Campistany, alors qu’elle était étudiante au doctorat sous la supervision de la Pr Francesc Rabanal, à l’Université de Barcelone, en Espagne. Enfin, j’ai participé à la rédaction du manuscrit à titre d’auteur principal en collaboration avec le Dr Erik Strandberg et j’ai préparé la totalité du document d’informations supplémentaires. Les coauteurs ont aussi tous participé à la révision de l’article.
1
Chapitre 1. Introduction
1.1
Interactions membranes cellulaires – molécules
Les interactions avec les membranes cellulaires sont primordiales dans l’activité d’une multitude de composés tels que des médicaments, des protéines et des molécules bioactives. D’une part, ces molécules affectent les membranes cellulaires, les traversent et modifient leurs propriétés. Ces effets sont variés et incluent, entre autres, une séparation de phase pouvant aller jusqu’à la formation de domaines. C’est le cas, par exemple, du cholestérol, qui forme des microdomaines riches en cholestérol appelés radeaux lipidiques.1 Une modification de la fluidité et de la coopérativité des phospholipides d’une membrane peut aussi être observée par un changement de température de transition de phase (Tm), une
propriété caractéristique des phospholipides qui correspond à la température à laquelle ils passent d’une phase gel ordonnée à une phase fluide, plus désordonnée. Les molécules peuvent aussi affecter les membranes lipidiques plus spécifiquement en surface, notamment par la variation du potentiel de surface et de l’hydratation des têtes polaires.2 Notons aussi la modification de l’épaisseur hydrophobe des bicouches lipidiques, celles-ci s’ajustant à l’épaisseur hydrophobe de protéines transmembranaires ou de peptides lors de leur insertion.3,4 Enfin, une déformation membranaire peut aussi avoir lieu, ce qui peut se traduire par une modification de courbure de surface des membranes et pouvant aller jusqu’à la formation de micelles. Par exemple, le récepteur nicotinique de l’acétylcholine, qui sert à la transmission neuromusculaire chez l’humain, induit, de par sa forme conique, une courbure de surface positive aux membranes lipidiques des jonctions musculaires dans lesquelles il s’insère.5
1 Simons, K.; Vaz, W. L. Annu. Rev. Biophys. Biomol. Struct. 2004, 33, 269-295.
2 Seydel, J. K.; Wiese, M., Drug-Membrane Interactions Analysis, Drug Distribution, Modeling. Wiley-VCH: Weinheim, 2002; p 349.
3 de Jesus, A. J.; Allen, T. W. Biochim. Biophys. Acta 2013, 1828, 851-863. 4 Killian, J. A.; Nyholm, T. K. M. Curr. Opin. Struct. Biol. 2006, 16, 473-479. 5 McMahon, H. T.; Gallop, J. L. Nature 2005, 438, 590-596.
2
D’autre part, la composition des membranes cellulaires peut moduler l’activité de certaines molécules et les propriétés pharmacologiques de médicaments (absorption, distribution, métabolisme, excrétion). En effet, la plupart des médicaments étant administrés par voie orale, ceux-ci doivent traverser les membranes cellulaires du système gastro-intestinal, ce qui correspond à l’absorption du médicament, avant d’atteindre le site actif. Cette étape est par ailleurs le facteur clé régissant la biodisponibilité du composé actif. Parmi les effets que peuvent avoir les membranes cellulaires sur une molécule bioactive, notons sa diffusion à travers la membrane, qui peut être limitée, voir même bloquée en direction du site actif si un mécanisme de résistance s’établit. Les médicaments peuvent aussi se lier fortement aux membranes lipidiques, ce qui est associé à des problèmes d’accumulation et de toxicité. Plusieurs anti-inflammatoires et analgésiques possèdent une fonction acide carboxylique au sein de leur structure et d’autres groupements cationiques tel qu’un groupement aminé chargé sont présents dans certains bêtabloquants, anesthésiques locaux ou antiarythmiques. Ceux-ci sont donc prompts à interagir plus fortement avec la tête polaire des phospholipides, d’autant plus que les molécules amphiphiles interagissent aussi avec les chaînes hydrophobes au cœur de la bicouche lipidique. De plus, la désolvatation d’une molécule à travers une membrane peut conduire à des changements conformationnels ou orientationnels. Cela peut forcer un médicament à adopter une structure optimale et une orientation préférable pour son action, permettant ainsi une meilleure efficacité.2
Une multitude de médicaments utilisés pour des applications variées (anticancer, anesthésique local, anti-inflammatoire non stéroïdien, antibiotique) entre en interaction avec les membranes cellulaires lors de leur action dans le corps.2 De plus, certains d’entre eux agissent différemment selon la composition lipidique des membranes. C’est le cas des peptides antimicrobiens cationiques, qui interagissent plus fortement avec les membranes bactériennes dû à la présence de phospholipides chargés négativement et donc, aux