Influence de 6 semaines d’entraînement par intervalles à
haute intensité sur l’autorégulation cérébrale
dynamique d’hommes entraînés en endurance
Mémoire
Audrey Drapeau
Maîtrise en kinésiologie - avec mémoire
Maître ès sciences (M. Sc.)
Influence de 6 semaines d’entraînement par intervalles à
haute intensité sur l’autorégulation cérébrale
dynamique d’hommes entraînés en endurance
Mémoire
Audrey Drapeau
Sous la direction de :
Résumé
Des études transversales récentes ont révélé qu’une fonction cardiorespiratoire (FCR) élevée était associée à une détérioration de l’autorégulation cérébrale dynamique (ACd); capacité intrinsèque des vaisseaux cérébraux à moduler leur résistance en réponse à des changements rapides et abrupts de la pression sanguine afin de maintenir le débit sanguin cérébral (DSC). Jusqu’à présent, peu d’études ont observé les effets longitudinaux de l’entraînement sur le DSC et l’ACd. Celles qui l’ont fait, ont étudié des sédentaires jeunes et âgés ou ayant des conditions cliniques qui ont eu des effets bénéfiques sur la santé cardiorespiratoire et cérébrovasculaire suite à l’entraînement. Cependant, l’étendue possible de l’amélioration de la FCR chez des individus déjà entraînés en endurance est inconnue. Pour améliorer leur FCR, ils ont souvent recours aux entraînements par intervalles à haute intensité soit infra-maximal ou supra-maximal. Par contre, l’influence de l’intensité des entraînements sur le DSC ou sur l’ACd n’a jamais été étudiée. La présente étude a caractérisé l’hémodynamie cérébrale de repos ainsi que l’ACd en réponse à des oscillations forcées de la pression sanguine induites par des manœuvres de squats répétés, suite à 6 semaines de HIIT chez des hommes entraînés en endurance. Nous avons aussi examiné si les changements potentiels seraient dépendants de l’intensité de l’entraînement. Nos résultats indiquent qu’indépendamment de l’intensité, le DSC de repos demeure inchangé suite à l’entraînement malgré une amélioration significative de la FCR. De plus, les vaisseaux cérébraux d’hommes entraînés en endurance maintiennent leur capacité à tamponner les oscillations lentes et abruptes de la pression artérielle forcées à 0,05 Hz. Par contre, lorsque les oscillations sont forcées à un rythme plus rapide, 0,10 Hz, la phase est diminuée tel qu’estimé par l’analyse de la fonction de transfert. Ces résultats suggèrent que 6 semaines de HIIT sont bénéfiques pour la FCR mais détériorent l’ACd d’hommes entraînés en endurance.
Abstract
Recent cross-sectional evidence revealed that an elevated cardiorespiratory fitness (CRF) is associated with an impaired dynamic cerebral autoregulation (dCA); ability of the cerebrovasculature to alter its resistance in response to abrupt and rapid changes in blood pressure to maintain cerebral blood flow (CBF). Very few studies have attempted to assess longitudinally how resting CBF and dCA react to training. The ones that did, observed that sedentary young and elderly or clinical populations had beneficial effects of training on cardiorespiratory and cerebrovascular health. The extend at which improving CRF in already cardiofit individuals remains unknown. When seeking CRF improvement, they often resort to high-intensity interval training (HIIT) either submaximal or supramaximal. The literature related to the influence of intensity training per se on the cerebral hemodynamics is limited. The present study characterized CBF at rest and dCA using forced oscillations of blood pressure induced by the repeated squat-stand maneuver following 6 weeks of HIIT in endurance-trained men. We also examined if the potential changes would be intensity-dependant. Our results indicate that independently of intensity, CBF at rest remained unchanged following training even in the face of a significantly improved CRF. Furthermore, the cerebrovasculature of endurance-trained men retained the ability to counteract slow and abrupt changes during forced oscillations of BP at 0.05 Hz. However, when the forced oscillations are more rapid, at 0.10 Hz, there is a decrease in phase shift as estimated by transfer function analysis. Taken together, HIIT training over a period of 6 week is beneficial for CRF but deteriorates dCA of endurance-trained me.
Table des matières
Résumé ...ii
Abstract ... iii
Table des matières ...iv
Liste des figures ...vi
Liste des abréviations, sigles, acronymes ... vii
Remerciements ... x
Avant-propos ...xi
Introduction ... 1
Chapitre 1 Circulation cérébrale ... 3
1.1 Mise en contexte historique de l’étude de la circulation systémique et cérébrale ... 3
1.2 Anatomie de la circulation cérébrale ... 4
1.3 Circulation artérielle ... 5
1.4 Microcirculation ... 7
1.5 Circulation veineuse ... 8
Chapitre 2 Débit sanguin cérébral ... 10
2.1 Mesures du débit sanguin cérébral ... 11
2.2 Doppler transcrânien ... 12
2.3 Régulation du débit sanguin cérébral ... 13
2.4 Déterminants du débit sanguin cérébral ... 15
2.4.1 Déterminant chimique et réactivité au dioxyde de carbone ... 15
2.4.2 Déterminant systémique et débit cardiaque... 17
2.4.3 Déterminant métabolique et activité nerveuse cellulaire ... 18
2.4.4 Déterminant neurogénique et activité du système nerveux autonome ... 18
2.4.5 Pression sanguine et autorégulation cérébrale... 20
Chapitre 3 Mesures de l’autorégulation cérébrale dynamique ... 22
3.1 Méthodes d’induction des oscillations de la pression artérielle ... 22
3.1.1 Manoeuvre de squats répétés et ses effets physiologiques ... 24
3.2.1 Analyse de la fonction de transfert... 27
Chapitre 4 Exercice et hémodynamie cérébrale ... 30
4.1 Effets aigus de l’exercice aérobie sur l’autorégulation cérébrale dynamique ... 31
4.1.1 Effets aigus de l’entraînement par intervalles sur l’hémodynamie cérébrale et l’autorégulation cérébrale dynamique ... 33
4.2 Effets de la fonction cardiorespiratoire sur l’hémodynamie cérébrale et l’autorégulation cérébrale
dynamique ... 36
4.3 Effets de l’entraînement sur l’hémodynamie cérébrale et l’autorégulation cérébrale dynamique ... 37
Chapitre 5 Problématique ... 39
Chapitre 6 Article scientifique ... 41
6.1 Résumé ... 41
6.2 Abstract ... 42
6.3 Research article ... 43
Chapitre 7 Discussion ... 64
7.1 Effets de l’entraînement sur le débit sanguin cérébral de repos ... 64
7.2 Effets de l’entraînement sur l’autorégulation cérébrale dynamique ... 65
7.3 Forces de l’étude ... 65
7.4 Limites de l’étude ... 66
7.4.1 Utilisation du Doppler transcrânien ... 66
7.4.2 Analyse de la fonction de transfert utilisant la manœuvre des squats répétés... 67
7.4.3 Différences sexuelles de la régulation du DSC... 67
7.4.4 Différences régionales de la régulation du DSC ... 69
7.4.5 Protocole HIIT jusqu’à épuisement et surentraînement ... 72
Chapitre 8 Perspectives ... 75
Conclusion ... 77
Annexe A Sommaire des effets de l’entraînement par intervalles sur l’hémodynamie cérébrale et l’autorégulation cérébrale dynamique ... 78
Annexe B Sommaire des études présentant les effets de l’entraînement sur l’hémodynamie cérébrale de repos et l’autorégulation cérébrale dynamique ... 80
Liste des figures
Figure 1-A: Angiographie de la circulation antérieure gauche et droite; 1-B: Angiographie de la circulation postérieure gauche et droite.Tirée de Chandra, 2017... 6 Figure 2: Cercle de Willis par angiographie. Tirée de Chandra, 2017. ... 6 Figure 3: Image de l'ultrason envoyé par la sonde du Doppler transcrânien en direction de l'artère cérébrale moyenne via la fenêtre acoustique temporale. Tirée dans Tymko, 2018. ... 13 Figure 4: Relation directionnelle de la régulation du débit sanguin cérébral et de ses principaux déterminants. Tirée de Ainslie et Duffin, 2009. ... 15 Figure 5: Manœuvre de squats répétés et ses répercussions oscillatoires forcées sur la pression artérielle, le débit sanguin cérébral et la pression partielle en fin d'expiration du dioxyde de carbone. Tirée de
Brassard,2017. ... 26 Figure 6: Analyse de la fonction de transfert. Tirée de van Beek, 2008 ... 28 Figure 7: Représentation schématique d'une bonne autorégulation cérébrale (LOW Gain) et d'une mauvaise autorégulation cérébrale dynamique (High Gain). Tirée et modifiée de Thewissen et al, 2018... 29 Figure 8: Changements relatifs du débit sanguin cérébral (gCBF) et la pression partielle en dioxyde de
carbone (PaCO2); haut à gauche. Tirée de Smith, 2017. ... 31 Figure 9: Pourcentage du changement de la vélocité du débit sanguin cérébral et du débit dans l'artère cérébrale moyenne, l'artère cérébrale postérieure, l'artère carotide interne et l'artère vertébrale durant un exercice incrémental effectué à 80% du travail maximal. Tirée de Smith, 2017. ... 71
Liste des abréviations, sigles, acronymes
AC : autorégulation cérébrale
ACd : autorégulation cérébrale dynamique ACI : artère carotide interne
ACM : artère cérébrale moyenne ACP : artère cérébrale postérieure AFT : analyse de la fonction de transfert AV : artère vertébrale
AVC : accident vasculaire cérébral C1 : première vertèbre cervicale CO2 : dioxyde de carbone
DCL : déficit cognitif léger DSC : débit sanguin cérébral Échauf : échauffement F : femme
FC : fréquence cardiaque FCR : fonction cardiorespiratoire H : homme
HIIE : high-intensity interval exercise HIIT : high-intensity interval training Hz : hertz
IAR: indice de l’autorégulation mm Hg : millimètre de mercure O2 : oxygène
LBNP : lower body negative pressure Max: maximum
MICT : moderate intensity continuous training Min: minute
MISS : moderate intensity steady-state
MPOC: maladie pulmonaire obstructive chronique M.sup : membre supérieur
M. inf. : membre inférieur NAP : niveau d’activité physique NO: oxyde nitrique
PA : pression artérielle
PaCO2 : pression artérielle en dioxyde de carbone
PaO2 : pression artérielle en oxygène
PAM : pression artérielle moyenne PAS : pression artérielle systolique
PIC : pression intra-crânienne
PPC : pression de perfusion cérébrale Q : débit cardiaque
RCV : réactivité cérébrovasculaire
RCVCO2 : réactivité cérébrovasculaire au dioxyde de carbone
Reps : répétitions
RoR : taux de régulation « rate of regulation » S : seconde
Sem : semaine
SIT: sprint interval training SNA: système nerveux autonome SNC: système nerveux central SNS : système nerveux sympathique StS : sit-to-stand
T : temps
vACM : vélocité du sang dans l’artère cérébrale moyenne VAS : voies aériennes supérieures
VO2max : consommation maximale en oxygène
W : watts X : fois : delta 🚫 : aucun changement ↑ : augmenté ↓ : diminué : autour de
Brisez vos limites, faites sauter les barrières de vos contraintes, mobilisez votre volonté, exigez la liberté comme un droit, soyez ce que vous voulez être. Découvrez ce que vous aimeriez faire et faites tout votre possible
pour y parvenir. Richard Bach, Jonathan Livingston le goéland
Remerciements
Mon parcours académique en est un tortueux, parcouru d’obstacles nécessitant une constante adaptation mais aussi rempli de gratifications et expériences enrichissantes. Je ne serais pas où j’en suis aujourd’hui si ce n’était du soutien et des encouragements de ma famille. Merci à ma mère Francine et Luc mon beau-père de m’avoir toujours poussé à dépasser mes limites et avoir le courage d’atteindre mes rêves. Merci à mon père Charles de m’avoir montré à rester debout malgré les obstacles que la vie puisse faire rencontrer. Merci à mon conjoint Stéphane et aux enfants Tristan, Camille et Mégane, de m’avoir appuyé et avoir su s’adapter à cette vie qui me partage entre Montréal et Québec et entre le travail, les études et la vie en famille. Merci à Patrice Brassard, mon ami depuis près de 20 ans et directeur de maitrise, qui m’a convaincu en une conversation de 30 minutes que la maitrise était possible, accessible mais surtout qu’elle était la suite logique de mon parcours pour atteindre mes objectifs personnels et de carrière. Merci d’avoir cru en moi dès le départ, d’avoir eu l’ouverture et la curiosité d’appuyer mon parcours non conventionnel chevauchant le traditionnel et l’alternatif, l’ostéopathie et la physiologie vasculaire cérébrale. Ta patience, ta passion et détermination sont des moteurs à la motivation et la poursuite en recherche. Merci à mes collègues qui m’ont poussé à prouver ce dont j’étais capable en faisant valoir mes atouts pour faire partie de l’équipe. Le projet « SNAc » nous aura enfin permis de s’unifier en une équipe dynamique, complémentaire et performante. Un merci particulier à Lawrence, « ma boss » et amie, qui m’a montré et fait confiance avec les collectes de données du doppler et Nexfin lors de cette épopée du « projet pilote » à l’HDQ. Merci pour ta patience à m’enseigner la fonction de transfert, l’interprétation et l’analyse de données. Merci aussi à Sarah, d’avoir eu la gentillesse de prêter son corps à la science de l’ostéopathie mais aussi d’avoir favorisé mon apprentissage à la maitrise. Ta passion pour les commotions est contagieuse! Finalement un merci particulier à Pascale Mauriège qui a cru en moi et a soutenu de maintes façons mon cursus à la maitrise. Cet accueil chaleureux et encadrement empathique tout en étant pertinent ont aussi contribué à mon succès. Merci!
Avant-propos
L’article inséré dans ce mémoire a été soumis pour publication. Il répond à une sous-question d’un projet qui avait initialement pour objectif d’étudier les déterminants de la performance athlétique. Ainsi les premières étapes du projet notamment la planification, le recrutement et les collectes de données furent effectuées à l’époque par d’anciens étudiants; Myriam Paquette, Olivier Leblanc et Simon Malenfant. Pour ma part, j’ai relevé les données pertinentes à la physiologie vasculaire cérébrale à partir de la base de données du projet. Je me suis chargée des autres étapes; compilation des données, analyses statistiques, interprétation des résultats, rédaction. J’ai eu de l’aide des membres de mon équipe de recherche, Lawrence Labrecque (étudiante au doctorat) et Sarah Imhoff (étudiante au doctorat) pour la compilation, l’analyse de données et l’interprétation. Tous ont aussi participé à la révision de l’article scientifique. Patrice Brassard, PhD., a agi à titre de superviseur de projet et directeur de maitrise. Il est intervenu à chaque étape du processus.
Introduction
La santé du cerveau est mise de l’avant par les statistiques canadiennes accablantes qui relèvent que depuis 2012, les maladies cérébrovasculaires sont la troisième cause principale de décès des Canadiens après les maladies du cœur et les tumeurs malignes (1). Aux soins intensifs, un moyen d’établir le pronostic des patients ayant une atteinte cérébrovasculaire tel qu’un traumatisme crânien ou une hémorragie sous-arachnoïdienne, est d’enregistrer de façon intermittente ou continue, la pression intra-crânienne, le débit sanguin cérébral (DSC) et la pression artérielle afin de quantifier les indices d’autorégulation cérébrale. De bons indices d’autorégulation prédisent généralement une bonne récupération (2). Affectant la population en général, le vieillissement inévitable a des répercussions sur la santé cardiovasculaire mais aussi cérébrovasculaire. Pour ne nommer qu’un exemple, avec l’âge, la diminution du DSC est souvent associée à un déclin des fonctions cognitives (3). Heureusement, une piste préventive a été explorée; le niveau d’activité physique (NAP). L’activité physique permet des améliorations physiologiques systémiques à plusieurs niveaux tels que musculosquelettique et cardiovasculaire. En l’occurrence, l’amélioration de la fonction cardiorespiratoire est considérée comme étant un facteur cardioprotecteur dans une mesure plus élevée que le NAP en soi (4). Un moyen de « rajeunir » le cerveau ou plutôt de ralentir le déclin de ses fonctions de plus de 10 ans, semble résider dans le fait de rester actif et maintenir un niveau élevé des fonctions cardiorespiratoires (5, 6). Considérant que le NAP est un facteur modifiable ayant des bénéfices multiples connus sur la santé systémique, ses répercussions sur la santé cérébrale commencent à être démontrées (7). Par contre, les effets spécifiques de l’entraînement sur les fonctions cérébrovasculaires restent à clarifier (7). De plus, les entraînements par intervalles à haute intensité qui gagnent en popularité pour ses améliorations rapides de la performance et adaptations physiologiques intéressent non seulement la population en général mais aussi celle qui s’entraîne régulièrement. Bien que les bénéfices systémiques des entraînements par intervalles à haute intensité soient de plus en plus reconnus, les répercussions sur l’hémodynamie cérébrale est limitée et semble défavoriser les individus ayant une FCR élevée. Cette révélation curieuse et plutôt contre-intuitive fut l’instigatrice des réflexions entourant et initiant le présent projet de recherche. Jusqu’à présent, les études s’intéressant aux effets de l’entraînement sur l’hémodynamie cérébrale sont peu nombreuses et ciblent principalement des populations cliniques variées. Aucune étude n’a à ce jour révélé les effets longitudinaux de l’entraînement sur la physiologie vasculaire cérébrale d’hommes en bonne santé déjà entraînés et ayant une fonction cardiorespiratoire élevée. Ce
mémoire de maîtrise portera donc son attention sur un échantillon d’hommes entraînés en endurance afin de quantifier les effets de 6 semaines d’entraînement par intervalles à haute intensité sur le DSC de repos, mais surtout sur l’autorégulation cérébrale dynamique. Afin de bien mettre en contexte l’objet de cette recherche, les concepts clés concernant l’anatomie de la circulation cérébrale, du DSC et de l’autorégulation cérébrale dynamique seront abordés au cours des trois premiers chapitres. Ensuite, les effets aigus de l’exercice sur la physiologie vasculaire cérébrale avec une emphase sur les entraînements par intervalles à haute intensité seront présentés. Les répercussions hémodynamiques cérébrales d’une fonction cardiorespiratoire élevée seront abordées pour terminer avec les effets de l’entraînement. Le contexte étant ainsi détaillé, le cinquième chapitre fera état de la problématique pour ensuite introduire l’article scientifique soumis pour publication au chapitre 6. Finalement, ce mémoire terminera avec la discussion des diverses forces, faiblesses du projet menant aux perspectives de recherche futures avant de conclure.
Chapitre 1 Circulation cérébrale
« Un fleuve qui arrose tout l’intérieur du corps. Quand les fleuves sont à sec, l’homme est mort ». Hippocrate (460-375 av. J.-C)
1.1 Mise en contexte historique de l’étude de la circulation
systémique et cérébrale
L’importance de la circulation des fluides du corps pour le maintien de la vie date d’aussi loin que 600 av J.C et était originellement définie comme étant constituée des 4 éléments; terre, air, feu et eau. C’est à cette même époque que le cerveau fut considéré comme l’organe de la raison par Pytagoras (8). Quelques centaines d’années plus tard, ils furent plusieurs (Hippocrate, Arise, etc.) à tenter de rationaliser les rouages du corps humain et le fonctionnement de ses systèmes élaborant par le fait même les principes fondateurs de la médecine (8, 9). Aristote (300 av J.C) alla même jusqu’à réfuter Pytagoras en attribuant plutôt au cerveau le rôle de refroidisseur et purificateur du sang contrôlant les excès de fluides par expulsion nasale. L’étude de « la maladie sacrée », l’épilepsie, dans les années 400 av J.C, permit une première description des vaisseaux sanguins veineux du cou; voyageant par-delà la clavicule vers l’oreille jusqu’au cerveau. Ce n’est que quelques cinquante ans plus tard, qu’Hérophylos redonna au cerveau son rôle de site de la conscience et intelligence. Il fit la description anatomique des méninges, du confluent des sinus et de la capacité pulsatile des artères (8).
Dans les années 200 (après J. C) Galien fit son apparition à Rome. Il eut un rôle important pour rallier les principes anciens égyptiens de la physiologie et les bases scientifiques de la médecine dite « moderne » pour ainsi créer un consensus cohérent (8, 9). Sa fascination pour l’anatomie et sa pratique de la dissection le mena à jumeler ses propres observations aux idées préconçues du mouvement des fluides pour développer une première description du mouvement du sang. Selon lui, il prenait origine dans le foie pour être ensuite transporté vers les intestins puis le reste des organes. Ce système sanguin était naturel et nourricier. Il était décrit comme étant vital puisque le mélange de celui-ci à l’air des poumons le dotait d’un « esprit » vital. Il alla même jusqu’à élaborer sur la transformation de l’esprit vital, qui partait du cœur, en esprit animal dans un site situé à la base du cerveau appelé rete mirabile. Finalement, il croyait également que le sang qui passait dans le
cœur était distribué vers la périphérie pour être consumé entièrement devant ainsi être recréé de novo par le foie suite à l’ingestion de nourriture et de liquides. Sa distribution dans les artères vers la périphérie était comprise comme étant en partie le résultat de la pulsation indépendante des artères et l’effet d’attraction des organes récepteurs, donnant ainsi à la vie, chaleur et mouvement (8).
Cela prit 1300 ans, avant que quelqu’un n’ose contredire les propos de Galien. Andreas Vesalius (1514-1564) dans un ouvrage intitulé De Humani Corporis Fabrica dessina l’anatomie des vaisseaux cérébraux en illustrant une communication entre le sinus transverse et l’artère carotide. De cette façon, il présenta aussi le trajet de la carotide qui entre dans le crâne et réfuta le concept de rete mirabile de Galien. Les travaux de William Harvey, quant à eux, réfutèrent la compréhension originelle de la circulation du sang vers une vision d’un système clos qui circule en continu grâce à la force motrice du cœur. Les circulations artérielle et veineuse furent distinguées et définies par la direction de leur flot du et vers le cœur, tout en étant présumément connectées par une microcirculation anastomosée. Plusieurs auteurs discutèrent au cours des années suivantes, de la description plus exacte des vaisseaux sanguins cérébraux grâce à la vivisection. Ainsi, la pulsatilité du cerveau synchrone avec les battements du cœur, la bifurcation antérieure de l’artère basilaire allant de part et d’autre de la selle turcique, la perforation des vaisseaux dans les couches de la dure-mère ainsi que les premières ébauches d’une formation en cercle des vaisseaux sanguins à la base du crâne, ne sont que des exemples de l’évolution de l’étude de la circulation cérébrale (8, 9). Le présent chapitre se restreindra à résumer les connaissances à ce jour de l’anatomie et de l’innervation de la circulation sanguine cérébrale.
1.2 Anatomie de la circulation cérébrale
Aujourd’hui, les techniques d’imagerie médicale permettent une visualisation encore plus précise de l’anatomie des vaisseaux cérébraux. Schématiquement résumée, la circulation cérébrale est composée d’un apport artériel et d’un drainage veineux, qui, selon la dimension des vaisseaux, peuvent être sous-divisés en macrocirculation (vaisseaux responsables de la perfusion de l’encéphale) et en microcirculation (site microscopique d’échanges gazeux et de nutriments à
de l’arbre vasculaire de la macro-circulation assure une perfusion constante et auto-suppléante via ses anastomoses. En effet, elles se rejoignent pour former le cercle de Willis à la base et au centre du cerveau d’où émerge un réseau de vaisseaux collatéraux. Pour ce qui est de la circulation veineuse, elle prend naissance au site terminal de la microcirculation et produit un système interconnecté de veines et de sinus. La section qui suit décrira l’anatomie de la circulation artérielle, veineuse et leurs communications via la microcirculation pour terminer avec l’innervation périvasculaire.
1.3 Circulation artérielle
Tout d’abord, l’apport artériel cérébral a deux origines soit une antérieure en provenance des carotides internes droite et gauche (Figure 1-A) et une postérieure qui provient de la paire bilatérale d’artères vertébrales (Figure 1-B). Le trajet de la circulation antérieure débute avec les carotides communes qui émergent du tronc brachio-céphalique à droite et de la crosse de l’aorte à gauche. Elles migrent céphaliquement où elles se sépareront en une branche externe et une branche interne. C’est la branche interne de la carotide qui assurera l’apport artériel antérieur du cerveau. Elle devra bifurquer une première fois afin de pénétrer le canal carotidien pour longer le rocher pétreux puis ressortir avec une autre bifurcation, cette fois à l’intérieur du crâne pour transporter le sang qui perfusera l’encéphale. Les artères vertébrales qui prennent origine dans les artères sous-clavières droite et gauche migrent aussi céphaliquement bien protégées à l’intérieur des foramens transverses des vertèbres jusqu’à la première cervicale (C1). Elles coudent pour longer l’arc postérieur de C1, puis coudent à nouveau en direction céphalique pour pénétrer le crâne via le foramen magnum. À ce niveau, les branches droite et gauche, s’unifieront pour former l’artère basilaire qui constituera la circulation postérieure et irriguera le cervelet et le tronc cérébral. L’anastomose des deux circulations avec les vaisseaux communicants se situe à la base et au centre du cerveau et se nomme le cercle de Willis (Figure 2).
Figure 1-A: Angiographie de la circulation antérieure gauche et droite; 1-B: Angiographie de la circulation postérieure gauche et droite.Tirée de Chandra, 2017
Figure 2: Cercle de Willis par angiographie. Tirée de Chandra, 2017.
La spécificité de ce cercle se fait valoir d’autant plus dans des conditions d’ischémie. En effet, il a été rapporté que les variabilités anatomiques du cercle peuvent priver certains territoires d’un apport artériel qui expliquerait partiellement l’incidence de certaines maladies cérébrovasculaires tels que les accidents vasculaires ischémiques (10). Les branches bilatérales formant le cercle, d’antérieur vers postérieur, sont les artères cérébrales antérieures, les artères communicantes antérieures, les artères carotides internes, les artères cérébrales moyennes, les artères cérébrales postérieures, les artères communicantes postérieures et finalement l’artère basilaire (10, 11).
Cet arbre vasculaire se divise en des ramifications de plus en plus petites permettant ainsi aux vaisseaux de pénétrer le parenchyme encéphalique via l’espace de Virchow-Robin; espace qui est
artérioles, élaguent des couches de tissus musculaires lisses et font transiger les vaisseaux dans les profondeurs du parenchyme jusqu’à devenir capillaires. À ce niveau, l’association des cellules endothéliales, les neurones, les boutons terminaux des astrocytes avec la lame basale encéphalique forme l’unité neurovasculaire. Cette transition structurelle, artérioles en capillaires, se fusionnera aux veinules qui inversement grossiront pour redevenir veines et faire surface au niveau du cerveau. Cet endroit de transition devient l’interface de communication pour les échanges gazeux et de nutriments. C’est ce qu’on appelle la microcirculation (10-12).
1.4 Microcirculation
Le rôle principal de la microcirculation est de maintenir la totalité des fonctions cérébrales via une communication intime entre la « macro-circulation » et le parenchyme cérébral (10). Ce sont les interactions entre l’activité neuronale, le métabolisme cellulaire et le DSC qui permettent de réguler le fonctionnement du système cérébrovasculaire. Ainsi, la vasoconstriction et la vasodilatation des artérioles pré-capillaires et des veinules post-capillaires, modifient les gradients de pression de façon dynamique dans le lit capillaire. Ce mécanisme fait fluctuer la vitesse des globules rouges qui circulent un à un dans une fourchette entre 0,3 mm/s à 3,2 mm/s (10, 11).
Un des composants essentiels de la microcirculation est la barrière hématoencéphalique. Elle sert de barrière sélective qui par exemple laisse diffuser librement des petites molécules gazeuses tels que l’oxygène (O2) et le dioxyde de carbone (CO2) ou des agents lipophiles alors que le passage
des agents hydrophiles est contrôlé par des transporteurs endothéliaux spécifiques. La très faible perméabilité de la membrane est due aux resserrements de ses jonctions cellulaires et au colmatage de celles-ci par les astrocytes et péricytes sur la lame basale. Les composants de la barrière régulent la perméabilité, l’angiogénèse, la « clairance » des métabolites et le débit sanguin capillaire (10).
Il est à noter qu’à ce niveau (espace périvasculaire), des études récentes proposent l’existence d’une autre circulation dite « glymphatique ». Il semblerait que cette circulation, entre le liquide interstitiel, le liquide céphalo-rachidien et le sang, serait permise par les cellules gliales formant la couche enveloppant les capillaires sanguins. Cette circulation aurait pour rôle de nettoyer et nourrir le système nerveux central permettant le transfert de certaines molécules qui ne pourraient traverser la barrière hématoencéphalique (12). Finalement, le sang, qui a circulé dans le lit capillaire de la
microcirculation, devient dépourvu au gré des demandes métaboliques cérébrales de ses molécules gazeuses et nutriments,et entre enfin dans la circulation veineuse.
1.5 Circulation veineuse
Au contraire de sa contrepartie artérielle, peu de place est accordée dans la littérature à la circulation cérébrale veineuse. Ceci est dû au fait que ce n’est que vers la fin du 19e siècle qu’un intérêt plus
prononcé lui fut accordé, permettant une description anatomique plus adéquate (13). Ce qu’il faut savoir est que la circulation veineuse cérébrale a des caractéristiques structurelles différentes des autres vaisseaux sanguins du reste du corps. En effet, le parallélisme observé dans tout le corps entre la circulation artérielle et veineuse est inexistant au niveau cérébral. Les variations anatomiques structurelles sont multiples, inter-individuelles et inter-hémisphériques. Ce qui rend la description de ce système plus ardue (10, 14).
Toutefois, fondée principalement sur les données embryologiques, et plus récemment grâce à l’imagerie, deux réseaux ont été identifiés dans la composition du réseau veineux; l’un est superficiel alors que l’autre est profond. Le réseau superficiel draine le cortex cérébral et la matière blanche sous-corticale. Le réseau profond qui draine la matière blanche profonde et la matière grise cérébrale est composé des veines sub-épendymales, cérébrales internes, basales et de la grande veine de Galien. Le réseau profond fait anastomose avec le réseau en superficie avec les veines corticales puis se jette dans le sinus sagittal supérieur. Ensuite, le drainage de ce sinus rencontre celui des veines profondes au niveau du confluent des sinus qui se dirigeront dans les sinus sigmoïdes, droite et gauche, pour finalement sortir du crâne dans les veines jugulaires (10, 11, 14). Deux séries de veines drainent le cervelet, ce sont les veines cérébelleuses inférieures et les sinus occipitaux. Finalement, les sinus pétreux transverses et inférieurs reçoivent le drainage du tronc cérébral (11).
Ni les veines cérébrales, ni les sinus n’ont de valves ou de tunique musculaire. La physiologie du drainage est dépendante de la position du corps. En général, le flot veineux de la microcirculation circule à une vitesse moyenne variant entre 0,05 cm/s à 10 cm/s. Celle dans les veines jugulaires internes varient entre 30 et 50 cm/s. Ces vitesses sont grandement dépendantes de la pression interne sur les vaisseaux qui peut passer de +1 mm Hg en position couchée vers -3 mm Hg en
Cette brève révision de l’architecture vasculaire cérébrale illustre la relation des divers éléments dont dépend le DSC. En effet, d’un point de vue hémodynamique, celui-ci est directement relié à la pression artérielle sanguine (PAS) des vaisseaux sanguins en amont et à la pression veineuse en aval [souvent équivalente à la pression intra-crânienne (PIC)], modulées constamment par la résistance cérébrovasculaire (RCV) des vaisseaux (15). La prochaine section du document se penchera sur le DSC.
Chapitre 2 Débit sanguin cérébral
Le cerveau est confiné dans un espace peu extensible, la boite crânienne. Il est positionné au-dessus du cœur, mettant en jeu un défi gravitaire. Il requière pour son bon fonctionnement un juste mais complexe équilibre hémodynamique. De surcroît, puisqu’il a une capacité limitée en stockage de nutriments (16), alors qu’il a des taux de dépenses énergétiques et métaboliques élevés, il dépend sévèrement du métabolisme oxydatif et d’un apport constant en perfusion cérébrale. Cette perfusion est intimement reliée à la régulation des volumes intra-crâniens notamment les lits cérébrovasculaires artériels, les veines cérébrales et la gestion production/résorption des liquides extra-cellulaire et céphalo-rachidien (11, 17-19). Cet équilibre hydrostatique est essentiel pour maintenir une -PIC dans les limites de la normale permettant un milieu ionique idéal. Le milieu ionique favorise une fine coordination entre l’activité neuronale parenchymateuse et la circulation sanguine.
Ainsi, lorsque l’on considère la taille du cerveau, étant de tout juste 2% du poids corporel, en fonction de ses besoins en apport sanguin, équivalent à 15-20% du débit cardiaque, cela permet de dire que cet organe se classe comme étant l’un des plus perfusés et énergivores du corps humain (11, 17, 20). Dans le cas adverse où il y aurait une défaillance de cet équilibre, par exemple lors d’une baisse du DSC non compensée par l’augmentation de l’extraction de l’O2 dans le sang, alors on pourrait
observer l’apparition de symptômes pré-syncopaux. Les symptômes les plus souvent observés sont - étourdissements, confusion (17), nausée, sueurs, inconforts digestifs, besoin de s’asseoir (18), pouvant s’aggraver vers la perte de connaissance et de tonus musculaire voir même des dommages au cerveau ou la mort par défaut maintenu dans le temps de l’oxygénation cérébrale (18, 19).
Puisque différentes régions du cerveau desservent différentes fonctions, il convient au corps de moduler la distribution du flot sanguin selon les besoins. Plusieurs mécanismes interagissent constamment dans le but de moduler le DSC et maintenir une perfusion cérébrale adéquate. Bien que ces interactions intrinsèques soient extrêmement efficaces, il n’en convient pas moins qu’elles ne sont pas limitées à la boite crânienne et qu’elles font partie intégrante du système cardiovasculaire. Les prochaines sections décriront les mesures pour évaluer le DSC, la régulation
2.1 Mesures du débit sanguin cérébral
Les premières publications sur la perfusion cérébrale datent des années 1880 et furent effectuées par Angelo Mosso sur des humains avec des déformations de la boîte crânienne. À cet époque, Mosso utilisa la pléthysmographie afin d’enregistrer la pulsatilité de la matière cérébrale lui permettant de détecter les changements de volume cérébral. De cette façon, il réalisa que l’exécution de tâches cognitives tels que des calculs mathématiques, augmentait l’amplitude de la pulsatilité. Cette méthode n’évaluait pas de façon directe le DSC mais estimait plutôt les changements de DSC en réponse à l’activité neuronale.
Une dizaine d’années plus tard, d’autres chercheurs (Roy et Sherrington) ont plutôt utilisé le modèle animal afin de décrire les mécanismes complexes qui interagissent localement et systémiquement dans la régulation du DSC (16). On a dû attendre cinquante autres années avant qu’une méthode directe de la mesure du DSC ne soit élaborée par Kety et Schmidt. Cette méthode utilise un gaz inerte comme traceur qu’il infuse dans la circulation sanguine afin de calculer la différence artério-veineuse (prélevée dans l’artère radiale et la veine jugulaire interne) entre les taux d’apparition et de disparition du traceur. Ainsi, la différence permet de quantifier le volume de sang qui perfuse le cerveau. Bien qu’innovante, cette technique possède des limites; entre autres celle de ne pas avoir de résolution temporelle puisque la technique représente une moyenne sur une dizaine de minutes et doit être fait au repos. D’autres limites, telle que l’absence d’information régionale du DSC, ont mené des chercheurs à développer d’autres méthodes de mesures.
À l’exercice, la réponse du DSC a été étudiée au moyen d’une technique de dilution d’oxyde nitrique. Il est rapporté que les premiers résultats étaient équivoques parmi les auteurs; certains discutant qu’à l’exercice une augmentation autour de 18 % du DSC global survenait alors que d’autres n’observaient aucun changement. Les disparités trouvées peuvent être expliquées par le fait que les intensités d’exercice variaient parmi les études et que des facteurs confondants tel que le rythme ventilatoire affectant les concentrations en dioxyde de carbone, n’étaient pas contrôlés et donc pouvaient eux aussi influencer la régulation du DSC à l’exercice (16). À ce jour, des méthodes employant des traceurs radioactifs et l’imagerie ont amélioré les mesures temporelles et spatiales
du DSC. Considérant la diversité des techniques et le cadre du présent projet, seule l’imagerie par doppler transcrânien sera décrite plus en détails.
2.2 Doppler transcrânien
La particularité de la mesure du DSC vient de la difficulté d’y accéder puisque les vaisseaux sanguins sont enfermés et protégés par la boîte crânienne. Ainsi, Aaslid fut l’un des premiers à découvrir que l’os temporal situé sur le côté du crâne et entourant l’oreille, avait une épaisseur plus mince fournissant ainsi une fenêtre acoustique permettant de sonder les vaisseaux sanguins cérébraux. Cette méthode non-invasive permet au moyen d’un ultrason de mesurer la vitesse à laquelle se déplacent les globules rouges dans le vaisseau d’intérêt et cela de façon continue, battement par battement (Figure 3).
La validité de la mesure de la vélocité du sang dans l’artère cérébrale moyenne (ACM) au moyen du doppler transcrânien dépend d’une assomption non négligeable, celle que le diamètre du vaisseau sondé reste constant. Dans les années 2000, Serrador et son équipe ont démontré que le diamètre de l’ACM ne changeait pas suite à des stimuli physiologiques faisant fluctuer la PaCO2 tel que mesuré
par de l’imagerie par résonnance magnétique (21). Ce constat a ainsi validé l’utilisation du doppler et de la mesure de la vélocité du sang dans l’ACM comme mesure représentative du DSC global bien que récemment cela fut contesté (22). Ses caractéristiques non invasives, peu dispendieuses et faciles d’utilisation dans un éventail varié de perturbations, réactivité au dioxyde de carbone, stress orthostatique, exercice, semblent maintenir le doppler dans le haut des palmarès d’utilisation pour l’évaluation du DSC et cela malgré ses limites (22). Afin de mieux comprendre ce qui peut faire varier le DSC, la prochaine section décrira la régulation du DSC.
Figure 3: Image de l'ultrason envoyé par la sonde du Doppler transcrânien en direction de l'artère cérébrale moyenne via la fenêtre acoustique temporale. Tirée dans Tymko, 2018.
2.3 Régulation du débit sanguin cérébral
Tel que mentionné précédemment, la régulation du DSC, peut être quantifiée selon la loi d’Ohm par la différence de la pression artérielle moyenne au niveau du cercle de Willis et la pression intracrânienne divisée par la résistance cérébrovasculaire; résumée par l’équation suivante :
𝐷𝑆𝐶 = (𝑃𝐴𝑆 − 𝑃𝐼𝐶) 𝑅𝐶𝑉
La loi de Poiseuille quant à elle stipule que le DSC est relié directement à la pression de perfusion cérébrale, à la viscosité sanguine, la longueur des vaisseaux et qu’il est inversement relié au radius à la 4ième puissance :
𝐷𝑆𝐶 = (8 ∗ ∗ 𝐿) 𝑟4
(11). Cette dernière loi soulève l’importance que peut avoir un changement même minime du diamètre de la lumière d’un vaisseau sur le DSC. En effet, lorsqu’une certaine région du cerveau requiert plus de sang, une cascade de mécanismes module la lumière des vaisseaux de distal vers proximal pour permettre aux vaisseaux sanguins en amont de la région en demande de se dilater pour répondre aux besoins de maintenance de la pression microvasculaire en aval. Ces mécanismes de régulation de la résistance cérébrovasculaire sont nombreux et sont illustrés dans la Figure 4. Pour n’en nommer que quelques-uns, on y retrouve la réponse myogénique, la réponse endothéliale chimique et métabolique à la prostacycline, l’oxyde nitrique ou aux facteurs hyperpolarisants, au pH
et le couplage neurovasculaire (11, 23, 24). Ils permettent une altération régionale et globale du DSC par l’entremise de la modulation rapide de la résistance cérébrovasculaire (11, 18). Cette résistance est principalement constatée dans le lit artériolaire cérébral alors que les vaisseaux cérébraux plus larges seraient moins accommodants et agiraient plutôt à titre de conduits pour le flot pulsatile artériel en provenance de l’aorte (17, 18). La position anatomique des vaisseaux pials dans l’espace sous-arachnoïdien permet une proximité et exposition aux conditions métaboliques du cerveau, expliquant leur rôle clé dans la modulation de la résistance cérébrovasculaire (19).
Contrairement à ce qui était cru, la vasoactivité de l’arbre vasculaire des larges conduits cérébraux a récemment aussi été identifiée dans les travaux de Willie et ses collègues en 2012. En effet, ils ont démontré que l’artère carotide interne (ACI) et l’artère vertébrale (AV) étaient réactives aux changements des concentrations en gaz artériel. Par exemple, ils ont quantifié que l’ACI pouvait augmenter de 20% la lumière de son diamètre en réponse à une pression artérielle de dioxyde de carbone (PaCO2) variant entre 15 et 65 mm Hg (25). Ainsi, le rôle de ces larges artères est fort
possiblement celui de fournir de manière relativement constante le flot sanguin tout en protégeant la microcirculation des augmentations de la pression sanguine (23).
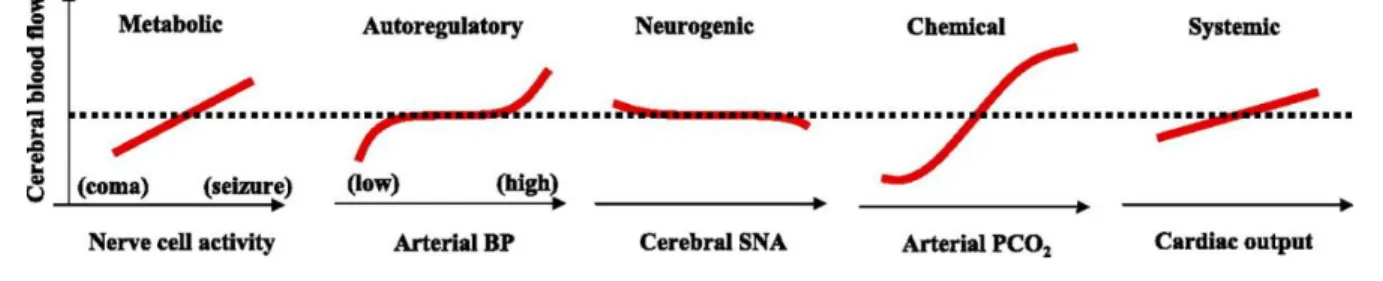
Il existe donc différents facteurs qui font moduler le DSC de façon dynamique. Certains ont identifié la pression de perfusion, l’activité métabolique du cerveau, les facteurs humoraux et l’activité du système nerveux autonome (26). Plus récemment en 2009, d’autres ont synthétisé par une illustration, la relation directionnelle des principaux déterminants identifiés à ce jour agissant sur la régulation du DSC. Ceux-ci sont la pression artérielle (facteur d’autorégulation), l’activité cellulaire nerveuse (facteur métabolique), l’activité nerveuse sympathique au niveau cérébral (facteur neurogénique), la PaCO2 (facteur chimique) et finalement le débit cardiaque (facteur systémique).
Cette figure a été adaptée par Smith et ses collègues en 2017, afin de mettre à jour la plage d’action de l’autorégulation cérébrale et ajouter l’interaction de la pression partielle en O2 (PaO2) sur le DSC
2.4 Déterminants du débit sanguin cérébral
Au repos comme à l’exercice, le DSC est finement régulé par une myriade de mécanismes interdépendants qui interagissent entre eux de façon non linéaire. La prochaine section définit et décrit l’implication de ces mécanismes sur la régulation du DSC.
2.4.1 Déterminant chimique et réactivité au dioxyde de carbone
Le facteur chimique se définit par l’influence sur la régulation du DSC des concentrations en gaz artériels notamment le CO2 et dans une moindre mesure l’O2. Ces concentrations sont mesurées en
pression partielle du gaz dans le sang artériel en millimètre de mercure (mm Hg). Bien que le métabolisme cérébral dépende sévèrement du processus oxydatif, la PaO2 agit dans une moindre
mesure sur la régulation du DSC comparativement à la PaCO2.
Figure 4: Relation directionnelle de la régulation du débit sanguin cérébral et de ses principaux déterminants. Tirée de Ainslie et Duffin, 2009.
En effet, le phénomène d’hypoxie occasionne une puissante vasodilatation du réseau cérébrovasculaire lorsque les valeurs diminuent en deçà d’un certain seuil évalué à 40-50 mm Hg. Le reste du temps, le lit cérébrovasculaire reste plutôt insensible aux changements de concentrations d’O2 (17, 25). En dehors du seuil, le mécanisme compensatoire de l’hypoxie est
l’augmentation du taux d’extraction en O2 (26). La réactivité à l’O2 est fortement modulée par la PaCO2
car en situation d’hypercapnie, forte PaCO2, elle augmente alors qu’en hypocapnie, faible PaCO2, la
sensibilité à l’hypoxie du réseau cérébrovasculaire est diminuée. L’étroite relation entre CO2 et O2
normale à l’hypoxie est la tachypnée qui produit une hypocapnie résultant en une vasoconstriction au lieu d’une vasodilatation attendue (17, 26).
En ce qui concerne le CO2, une relation directe le relie au DSC. Ainsi, pour chaque hausse d’1 mm
Hg de CO2, le DSC répond avec une hausse de 3-6%. Alors qu’une baisse de 1-3% du DSC survient
pour chaque baisse d’1 mm Hg de CO2 par rapport à l’état eupnéique; état de respiration normale,
de PaCO2 (25). La réactivité au CO2 semble manifeste dans tous les vaisseaux sanguins qu’ils soient
extra ou intra-crâniens mais plus marquée au niveau des vaisseaux pials. Au niveau cérébral, cette réponse du DSC aux changements de PaCO2 se nomme réactivité cérébrovasculaire (27). Des
différences régionales à l’intérieur même de la matière corticale quantifiées par résonnance magnétique révèlent que les micro-vaisseaux de la matière grise sont plus réactifs aux variations de CO2 que les vaisseaux de la matière blanche (26).
Le CO2 tient un rôle physiologique important pour le maintien de l’homéostasie cérébrale en réponse
aux demandes métaboliques tissulaires. En effet, le mécanisme d’action sous-jacent pourrait être illustré comme suit : l’augmentation de la fonction cérébrale provoque une augmentation du métabolisme oxydatif et donc une production de déchets tel que le CO2. Cette augmentation de la
concentration en CO2 entraîne une réponse réflexe myogénique de relaxation du tonus intrinsèque
des cellules musculaires de la paroi des vaisseaux sanguins occasionnant un changement de résistance vers la vasodilatation et donc l’augmentation du DSC. Ainsi, l’excès en CO2 est éliminé
par l’augmentation du DSC. La réactivité au CO2 modifie le DSC et contribue de cette façon à la
régulation de l’apport des substrats énergétiques, à l’élimination des déchets métaboliques et à l’équilibre acido-basique.
Conjointement, la respiration permet mécaniquement d’altérer les concentrations en CO2 et ainsi de
favoriser l’évacuation des ions H+ intracellulaires (27). Le CO2 a aussi une influence sur la stabilité
respiratoire. En effet, le contrôle respiratoire dépend de la réponse motrice ventilatoire qui suit l’activation des différents chémorécepteurs répondant aux stimuli chimiques dans le sang artériel. Ces chémorécepteurs ont deux origines: centrale (dans le tronc cérébral) et périphérique (dans les corps carotidiens et aortiques). Ces récepteurs mesurent les concentrations en O2 et en CO2. Ainsi,
la physiologie respiratoire et le DSC sont tous deux interreliés puisqu’ils ont un médiateur commun : le niveau de CO2. L’interaction entre la respiration et le DSC doit être optimale lors de l’exercice.
Par exemple à l’exercice, la production de CO2, en provenance de l’activité métabolique musculaire,
augmente drastiquement. Par contre, la réponse ventilatoire suite à l’activation des chémorécepteurs centraux en réponse aux changements de concentration de CO2, est diminuée pendant l’exercice.
Pour contrebalancer, le DSC et la réactivité cérébrovasculaire à l’exercice sont augmentés. De cette façon, l’augmentation du DSC promeut la diffusion du CO2 des liquides céphalo-rachidien et
extracellulaire vers la circulation cérébrovasculaire afin de diminuer la concentration en ions H+. Ainsi, le pH redevenant basique est détecté par les chémorécepteurs qui, de façon réflexe, ralentira la respiration. Ces réponses en boucle s’alimentent et s’inhibent, jouant de cette façon un rôle important dans le maintien de l’homéostasie du cerveau durant l’exercice (27).
De plus, le CO2 serait impliqué dans la modulation du tonus musculaire des conduits aériens des
voies aériennes supérieures (VAS) particulièrement durant les phases d’éveil. Lors du sommeil, il est généralement admis que l’initiateur central de la respiration est diminué conséquemment à la diminution des « stimulus d’éveil » induisant la respiration. Aussi, les chémorécepteurs sont réprimés pendant le sommeil. Donc, les concentrations en signaux chimiques fluctuent au courant du sommeil ce qui nécessite une « surveillance » des centres de contrôle du système nerveux central (SNC). Dans les cas où la concentration dans le sang artériel du CO2 diminue en deçà d’un certain seuil
appelé seuil apnéique, il en résulte un arrêt respiratoire jusqu’à ce que le niveau de CO2 retourne à
des valeurs au-dessus du seuil. En résumé, l’instabilité respiratoire peut être occasionnée par une réponse inappropriée du DSC en fonction d’un changement de concentration du CO2 à l’état
hypercapnique ou hypocapnique. Cette instabilité est souvent liée au développement de certaines pathologies tel que le syndrome d’apnée du sommeil (17).
2.4.2 Déterminant systémique et débit cardiaque
Le facteur systémique s’est nouvellement ajouté à la liste des déterminants car il a été découvert que le DSC était dépendant du débit cardiaque (Q). Par contre, ce constat est limité par le fait que l’évaluation de l’influence du Q n’a pas été mesurée de façon indépendante à la pression de
sympathique et du rythme cardiaque est modulée par la réactivité au CO2, il serait logique d’observer
un changement du DSC avec le Q (17). Il a par contre été rapporté que lorsque le rythme cardiaque et la PaCO2 étaient maintenus constants, une augmentation ou une diminution du Q (via
l’augmentation du volume sanguin ou l’application d’une pression négative au niveau des membres inférieurs) entraînait un changement linéaire du DSC. De plus amples recherches doivent être faites afin d’élucider le mode d’action du Q sur le DSC. L’hypothèse actuelle implique le stress de cisaillement lié à l’augmentation de la pression pulsatile ou du flot sanguin à l’intérieur de vaisseaux qui modulerait la circulation cérébrale de façon pression-passive (17).
2.4.3 Déterminant métabolique et activité nerveuse cellulaire
Le facteur métabolique cible l’endothélium et les cellules des muscles lisses de la paroi des vaisseaux sanguins. Il contribue à la fonction vasculaire par son influence sur la tonicité des vaisseaux sanguins qui réagissent par la libération ou la réponse à la présence de certaines molécules. Parmi les prostacyclines, facteurs hyperpolarisants et peptides natriurétiques de type C, l’oxyde nitrique (NO) est considéré le plus important pour le maintien du tonus vasculaire. En plus d’avoir une action vasodilatatrice, le NO a des propriétés inhibitrices de l’inflammation et de l’adhésion de molécules. Il est aussi reconnu pour prévenir la prolifération des cellules des muscles lisses (28). La production de NO fait souvent suite à un stimulus mécanique de contraintes de cisaillements sur les parois des vaisseaux sanguins. Cette contrainte active des canaux potassiques qui facilite l’entrée de calcium qui, à son tour, activera la synthase de NO. Une autre molécule, l’acétylcholine, influence grandement la capacité des vaisseaux à se dilater. En effet, la réponse vasodilatatrice à l’infusion de l’acétylcholine, est quantifiée par la mesure du diamètre des artères coronaires et est considérée comme la méthode étalon de référence.
2.4.4 Déterminant neurogénique et activité du système nerveux
autonome
Concernant l’apport nerveux aux vaisseaux sanguins artériels et artériolaires, l’innervation sympathique origine de l’hypothalamus qui projette des fibres de deuxième ordre dans les cellules qui forment la chaine ganglionnaire sympathique (24) et des synapses de troisième ordre dans le
L’innervation parasympathique, quant à elle, provient du noyau salivaire supérieur et du nerf facial qui distribuent des fibres au ganglion sphéno-palatin, au ganglion otique, au ganglion trijumeau et au mini-ganglion carotidien (11, 24). Cette innervation est appelée extrinsèque car bien qu’elle débute dans le SNC, elle projette des fibres à l’extérieur du crâne (11). Il semble exister une différence d’innervation pour les artères cérébrales parenchymateuses et microvasculaires corticales qui recevraient plutôt des fibres afférentes sympathiques à partir du pons et du locus coreuleus (24) alors que le parasympathique recevrait des fibres du locus coreuleus, du noyau du raphé, des noyaux corticaux ou du proencéphale. Cette innervation est identifiée comme intrinsèque (11, 24).
Le rôle du système nerveux parasympathique sur la circulation cérébrale a été observé principalement chez les animaux et serait vasodilatateur, indépendant des demandes métaboliques ou de pression de perfusion. En support, chez les humains, il est rapporté que le système parasympathique, via les récepteurs cholinergiques cérébraux, aurait un rôle important dans l’augmentation du DSC pendant l’exercice autant statique, contraction isométrique de la main, que dynamique, exercice sur vélo, et cela indépendamment du groupe musculaire impliqué à l’exercice (29). Ses neurotransmetteurs ou neuromodulateurs principaux identifiés à l’heure actuelle sont l’acétylcholine, le polypeptide vasoactif intestinal, le peptide histidine méthionine et le NO.
Concernant l’innervation sympathique, son rôle serait plutôt constricteur via les neurotransmetteurs et neuromodulateurs noradrénaline, et neuropeptide Y (24). Malgré l’identification de l’innervation périvasculaire datant de plusieurs siècles, son rôle fonctionnel reste encore controversé (23). En effet, traditionnellement, il avait été constaté que l’augmentation de l’activité du système nerveux sympathique (SNS) n’avait que peu d’influence sur le réseau cérébrovasculaire de l’humain au repos (17) alors que dans le reste du corps, elle permettrait l’altération de la résistance périphérique totale et conséquemment de la pression artérielle (30). Mais une étude de Cassaglia et ses collègues, réalisée en 2008 sur des animaux, suggère que le SNS aurait une fonction plutôt protectrice de la microcirculation cérébrale que régulatrice du maintien de la pression systémique artérielle. En effet, ils ont enregistré en continu l’activité du SNS dans le ganglion cervical supérieur et ont ainsi démontré que l’activité du SNS dirigée sur le système cérébrovasculaire augmentait en réponse à une hypertension aigue mais pas en situation d’hypotension (31).
2.4.5 Pression sanguine et autorégulation cérébrale
La pression de perfusion, différence de pression entre les artères et les veines cérébrales, était initialement considérée comme l’une des forces directrices de la circulation cérébrale. Et puisque la pression dans les veines ne dépasse que rarement la pression atmosphérique que de quelques mm Hg, c’est la pression artérielle qui représente le plus adéquatement la PPC. La relation qui existe entre la pression sanguine artérielle et le DSC est étroite et dépendante de la fréquence oscillatoire. En effet, les oscillations fréquentielles de la pression sanguine artérielle se répercutent jusque dans le réseau cérébrovasculaire. Les fréquences dépassant les 0,20 Hertz (Hz) sont transmises plutôt directement au cerveau alors que les petites fréquences, celles qui restent sous le seuil de 0,20 Hz (32), sont relativement bien tamponnées par les vaisseaux cérébraux grâce à un mécanisme appelé autorégulation cérébrale.
Les études classiques portant sur l’autorégulation cérébrale ont été réalisées en état stable. C’est-à-dire que les changements de pression artérielles moyennes (PAM) étaient induits de manière progressive et donc les mesures du DSC reflétaient plutôt les adaptations de la résistance cérébrovasculaire au nouvel état stable de pression sanguine (33). C’est l’étude en 1959 de Lassen qui a mis en évidence que la relation entre les deux variables (DSC et PAM) semblait plutôt démontrer que le DSC reste stable et est indépendant des changements de pression artérielle dans une fourchette allant de 60 à 160 mm Hg (34). En dehors de ce plateau, l’autorégulation cérébrale serait inefficace donc le DSC varierait de façon linéaire avec la PAM (11). Au niveau de ce plateau, le DSC est maintenu relativement constant à 50 mL par 100 g de tissu cérébral par minute indépendamment des changements de pression artérielle. La limite principale de l’étude de Lassen est qu’elle compilait des données en provenance de sept études cumulant plus d’une dizaine de conditions cliniques différentes. Alors en 2014, basé sur des études plus récentes, Willie et ses collègues ont rapporté que ce plateau est vraisemblablement beaucoup plus petit qu’originalement cru et donc que la relation entre la pression artérielle et le DSC serait plutôt de type pression-passive. Ce qui signifie que pour arriver à maintenir le DSC relativement constant, cela suppose que la résistance cérébrovasculaire est sujette à des ajustements réflexes en réponse aux changements de pression. Ce mécanisme a été nommé autorégulation cérébrale statique. Elle s’opère typiquement entre quelques minutes à quelques heures et pour la mesurer, elle requiert une
intervention pharmacologique afin de maintenir l’hypertension ou l’hypotension stable sur une certaine période permettant la mesure (33).
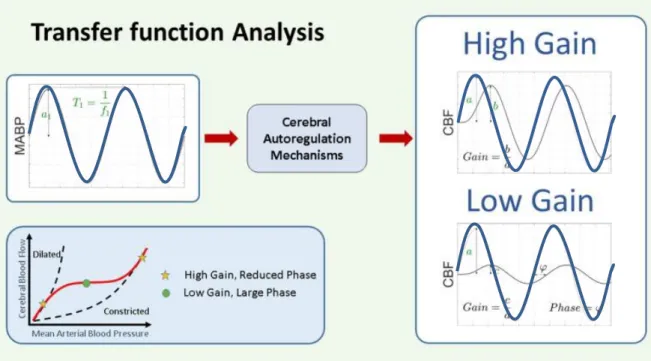
L’évolution des techniques d’imagerie et de quantification du DSC et de la PAM au cours des dernières décennies -a permis de faire évoluer l’étude de l’autorégulation cérébrale. En effet, il est maintenant possible d’estimer la réponse dynamique de l’autorégulation cérébrale (ACd) aux changements rapides et transitoires de la pression sanguine. Ainsi, l’ACd se définit par la capacité des vaisseaux cérébraux à répondre aux changements transitoires de pression sanguine. Sa mesure est permise par l’habileté à mesurer de façon concomitante, le DSC et la PAM, en continu.
Il existe toutefois une limite importante à cette mesure et c’est le baroréflexe. Ce réflexe module plusieurs paramètres cardiaques tels que la fréquence cardiaque (FC), l’inotropie; la contractilité myocardique. Le baroréflexe influence aussi le tonus vasculaire en réponse aux changements de pression sanguine. Les deux mécanismes ont donc un rôle très important de complémentarité pour la protection et le maintien de la perfusion cérébrale. Conséquemment, la distinction de l’action unique de l’ACd implique la manipulation physique ou pharmacologique inhibant l’action des baroréflexes pour arriver à interpréter le réflexe cérébrovasculaire attribuable plus spécifiquement à l’ACd (25). À ce jour, l’interaction entre le baroréflexe et l’ACd semble compensatoire. D’une part, le mécanisme de l’ACd a été démontré comme étant plus rapide que l’action réflexe des barorécepteurs (35). D’autre part, il est reconnu qu’avec l’âge, alors que les fonctions des baroréflexes diminuent, celles de l’ACd semblent - préservées (36). Ce n’est que lorsque les deux « flanchent » que le cerveau devient à risque d’hypoperfusion qui, selon la sévérité, peut occasionner une syncope.
La prochaine section explorera les différents moyens de forcer des changements hémodynamiques afin de caractériser l’ACd. Les méthodes de caractérisation de l’ACd seront ensuite brièvement présentées pour focaliser sur l’analyse de la fonction de transfert.
Chapitre 3 Mesures de l’autorégulation cérébrale
dynamique
3.1 Méthodes d’induction des oscillations de la pression artérielle
Essentiellement, la caractérisation de l’ACd requiert l’observation des réponses du DSC aux fluctuations rapides de la pression artérielle. Différents stimuli peuvent donc être utilisés pour moduler la pression artérielle.
Naturellement, le corps fait osciller la PAM entre les fréquences de 0,02 et 0,40 Hertz (Hz) de jour comme de nuit et cela indépendamment des stimuli externes. C’est ce qu’on appelle les oscillations spontanées. Une analyse des spectres oscillatoires a permis de déterminer trois bandes de fréquences principales. La première correspond à la fréquence respiratoire qui se situe dans les hautes fréquences (0,20 Hz à 0,40 Hz) autour de 12 cycles par minute. La deuxième correspond aux variations en lien avec le tonus vasomoteur (ondes de Mayer) qui se situe autour de 6 cycles par minute dans les fréquences moyennes (0,10 Hz). Finalement, les basses fréquences se situant entre 0,02 et 0,07 Hz ont un rythme d’environ un cycle par minute. Par contre, dans cette bande de fréquence, la source des oscillations reste encore à élucider. C’est dans cet intervalle que se fait principalement l’étude de l’ACd. Alors un moyen de bien étudier la réponse de l’ACd est de forcer les oscillations. Ainsi, le rapport signal/bruit est augmenté et il est plus évident de cibler la réponse autorégulatrice.
De façon forcée maintenant, la réponse à une baisse de la pression artérielle peut être observée suite à l’utilisation de la méthode de dégonflement de brassards positionnés sur les deux cuisses (thigh cuff method) ou l’utilisation d’un caisson à pression négative à l’intérieur duquel les membres inférieurs se trouvent « enfermés » [lower body negative pressure (LBNP)]. Pour illustrer la réponse à une baisse rapide et prononcée de la PAM, citons l’équipe de Aaslid qui en 1989, a étudié l’ACd chez les humains, en induisant une baisse de pression artérielle au moyen de brassards positionnés sur les deux cuisses (35). Ils ont gonflé ceux-ci au-dessus de la pression systolique. Lorsque
près des valeurs de normales dans un délai de 6-7 secondes (s); intervalles de temps où le baroréflexe réagit. À l’intérieur d’un intervalle de 1 à 3,5 s, ils ont observé la réponse de l’autorégulation cérébrale par la pente de régression entre la différence de RCV et l’intervalle de temps (T) en fonction de la pression artérielle (PA). Cette pente correspond au taux de régulation (RoR) qui se calcule par l’expression mathématique suivante :
𝑅𝑜𝑅 = (𝑅𝐶𝑉/𝑇)𝑃𝐴
Ainsi, ils ont découvert que l’ACd répondait plus rapidement que le baroréflexe et qu’elle était dépendante des taux de PaCO2; (1,9 s en hypocapnie, 3,4 s en normocapnie et 5,2 s en hypercapnie
comparativement à 6 - 7 s requises pour le baroréflexe) (35). Le thigh cuff est une méthode qui peut s’avérer douloureuse et le LBNP ne peut être utilisé avec des individus de fortes tailles. Ces limites doivent donc être considérés lors de leur utilisation.
Au contraire, lorsque l’on veut étudier l’ACd suite à une hausse rapide de la PAM, des méthodes telles que l’immersion dans l’eau froide (cold pressor test) ou la contraction isométrique unilatérale de la main (isometric handgrip), sont couramment utilisées. Par contre, comme toutes méthodes, elles ont des limites, et la plus importante est d’induire des réponses très hétérogènes au niveau du DSC (33). Une autre limite est la possible influence de l’activité nerveuse sympathique. En effet, tel que discuté précédemment, bien que son effet sur le DSC -soit équivoque, des méthodes comme le
cold pressor test sont reconnues pour induire une augmentation de l’activité sympathique systémique (37). On ne peut donc pas exclure une possible interaction entre l’activité sympathique et l’ACd dans la régulation du DSC.
Un autre moyen de faire fluctuer la PAM d’une façon qui se rapproche plus d’un challenge physiologique de la vie quotidienne, est la procédure du passage de la position assise à debout
[sit-to-stand (STS)]. La position debout qui suit la levée, induit une diminution notable de la PAM (environ 25%) par la diminution significative de la résistance périphérique totale. Cette réponse hypotensive orthostatique est ensuite détectée par les barorécepteurs artériels qui communiquent avec les récepteurs cardio-pulmonaires réagissant ainsi à la diminution de la pré-charge cardiaque. En
somme, la résistance périphérique totale va augmenter pour contrebalancer le changement hémodynamique systémique. (33). La réponse de l’autorégulation cérébrale se mesure donc en un délai de réponse entre la baisse de pression et de vélocité dans l’ACM et le moment où la vitesse du sang dans l’ACM augmente. Elle peut également être mesurée par le RoR, tel que décrit précédemment. N’étant pas des méthodes utilisées dans le cadre du présent travail, elles ne seront pas expliquées plus en détail.
Finalement, le dernier moyen utilisé pour forcer des changements hémodynamiques peut se faire de manière oscillatoire. En effet, le LBNP, le thigh cuff, la manœuvre de squats répétés peuvent provoquer des oscillations périodiques de la PAM. L’avantage de ces méthodes est de forcer les oscillations de la PAM à des fréquences oscillatoires précises et ainsi évaluer la réponse cérébrovasculaire correspondante.
Puisque la quantification de l’ACd dépend de la prémisse d’une relation linéaire entre le DSC et la PAM, il importe de s’assurer d’une forte corrélation entre les deux mesures. Parmi tous les moyens présentés ci-haut, celui recommandé à ce jour pour induire la plus forte corrélation est la manœuvre de squats répétés (32).
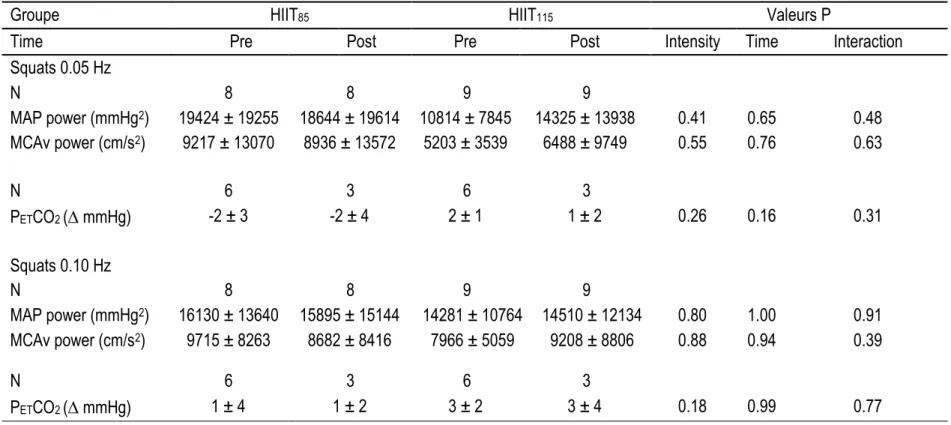
3.1.1 Manoeuvre de squats répétés et ses effets physiologiques
En effet, la manœuvre de squats répétés est celle qui améliore le plus la cohérence, est la plus reproductible et est comparable à travers les âges (32). Pour comprendre comment la pression sanguine peut être modulée par l’exécution des squats répétés, il faut décortiquer les étapes. Dans un premier temps, la position de squat avec les genoux fléchis à 90 degrés, fait contracter les muscles des jambes créant un effet de pompage vasculaire et augmentant le retour veineux. Conséquemment, le Q augmente et entraîne une augmentation de la pression sanguine et du DSC dans un délai de 2-3 s (32). La contraction stimule aussi les mécanorécepteurs musculaires qui contribuent à l’augmentation de la PAM et du DSC tout en faisant un certain effet d’ischémie périphérique prédisposant à la vasodilatation lors du retour à la position debout.