UNIVERSITÉ MOHAMMED V
– AGDAL
FACULTÉ DES SCIENCES
Rabat
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc
N° d’ordre: 2569
THÈSE DE DOCTORAT
Présentée par
Amina Chnirheb
Discipline: Chimie
Spécialité : Chimie Physique
Soutenue publiquement le 05-05-2012
devant la commission d’examen:
Abdellah. ZRINEH
PES, Faculté des Sciences de Rabat
Président
Philippe. SCHMITT-KOPPLIN
Directeur de Recherche au Centre
Helmoltz-muenchen-Allemagne
Examinateur
Souad .EL HAJJAJI
PES, Faculté des Sciences de Rabat
Examinateur
Hafida. MOUNTACER
PES, Facu lté des Sciences et techniques
de Settat
Examinateur
Abderrahim. EL HOURCH
PES, Faculté des Sciences de Rabat
Examinateur
Abdelmalek. DAHCHOUR
PES, Institut Agronomique et Vétérinaire
Hassan II
– Rabat
Examinateur
Mohammed. EL AZZOUZI
PES, Faculté des Sciences de Rabat
Examinateur
Phototransformation des herbicides Mefenpyrdiethyl et
l’Amidosulfuron en milieux homogène et hétérogène:
Louange et Gloire à Allah qui m
’a accordé l’aboutissement de ce travail.
A mes très chers parents :
Si aujourd’hui j’ai réussi c’est pour vous et grâce à
vous, merci de nous avoir
donné tant de forces et d’avoir été toujours là pour
nous. Aucune dédicace ne saura vous exprimer la profondeur de mes
sentiments.Vous êtes exceptionnels.
A mon mari : Pour ton amour et ton soutien, ta patience durant les moments
durs, pour avoir été à la foi mon mari et mon ami, pour avoir donné de ton temps
et m’avoir laissé le temps de faire, sans ta présence à mes côtés, je n’en serais pas
là aujourd
’hui.
A mon petit rayon de soleil Ayman : Qui a vécu cette thèse « de l
’intérieur ».
Merci p
our m’avoir donné tant d’amour, pour ton sourire qui me redonnait la foi
quand elle s’éloignait de moi. Je t’aime énormément. Je te souhaite aussi un très
bel anniversaire pour tes 1an.
A mes frères et soeurs: Rajae, Mohammed, Imade, Loubna, et Soukayna : Pour
votre amour et votre soutien
Pour m’avoir remonté le moral, pour avoir été à
l
’écoute à chaque fois que j’en ai eu besoin.
A mon baux frère et ses petits Khalil et Souhail.
A ma famille
qui m’ont soutenu pendant toutes mes années d’études.
AVANT-PROPOS
Ce travail a été réalisé au laboratoire de Chimie-Physique Générale de la Faculté des Sciences de Rabat en collaboration avec le laboratoire de Biogéochimie et Analyse du Centre de recherche allemand pour l’environnement et la santé: Helmholtz Zentrum München, Neuherberg dans le cadre du programme Sandwich du Service Allemand d'Echanges Universitaires (DAAD). Il n’aurait pu être mené à bien sans l’aide, la patience et le soutien de nombreuses personnes auxquelles j’aimerais adresser tous mes remerciements.
Tout d’abord, je tiens à remercier Mr M. El Azzouzi et Mr A. Zrineh, Professeurs à l´université Mohammed V- Agdal de m’avoir accueillie au sein de leur équipe de recherche et d’avoir été des directeurs de thèse. Qu´ils trouvent ici l´expression de ma respectueuse reconnaissance, pour l´attention constante avec laquelle ils ont dirigé cette thèse et le soutien qu´ils m´ont apporté avec compétence au cours de la réalisation de ce travail.
Les travaux au laboratoire de Biogéochimie et analyse à l´institut de chimie écologique au Centre de recherche Helmholtz Zentrum München ont été menés sous la direction de Mr P. Schmitt kopplin. Je tiens à le remercier pour m’avoir initié à la recherche et pour sa très grande disponibilité et son aide qui m’ont permis de progresser dans les meilleures conditions pendant cette thèse ainsi que pour la confiance qu’il m’a toujours accordée.
Je tiens à le remercier Mr M. Harir : Docteur chercheur au Centre de recherche allemand pour l’environnement et la santé: Helmholtz Zentrum München, Neuherberg, Unité de recherche analyse Biogéochimie, pour m’avoir dirigé et guidé avec sérieux et compétence tout le long de ce travail et pour son disponibilité tout au long de ces années de recherche, son critique judicieuse, son attention inlassable, son soutien moral et son enthousiasme de chercheur a instauré une ambiance propice au travail.
Que Mr A. Zrineh, Professeur à la Faculté des Sciences de Rabat et directeur de l´UFR (Valorisation des Ressources Naturelles et Protection de l’environnement) trouve ici l´expression de ma profonde reconnaissance en me faisant le grand honneur de présider ce jury.
Je remercie Mme S. El Hajjaji, Professeur à la Faculté des Sciences de Rabat, membre du jury, qui était toujours là pour répondre à mes questions. Elle s’est rendu très disponible pendant les derniers mois de la thèse et j’ai beaucoup usé et abusé de sa disponibilité.
Je tiens aussi à remercier, A. El Hourch, Professeur à la Faculté des Sciences de Rabat, membre du jury. Je lui suis reconnaissante d´avoir accepter d´évaluer ce travail.
Il m´est agréable aussi d´adresser mes remerciements à Mme H. Mountacer, Professeur à la Faculté des Sciences de Settat et Mr A. Dahchour Professeur à l’Institut Agronomique et Vétérinaire de Rabat qui ont bien voulu m´honorer de leur participation au jury de cette thèse je leur adresse mes vifs remerciements.
Merci à tous les chercheurs et ingénieurs du laboratoire qui à un moment ou un autre m’ont conseillé et m’ont aidé : B. Kanawati (DFT), A. Fekita (UPLC), et N. Hertkon (RMN).
RÉSUMÉ
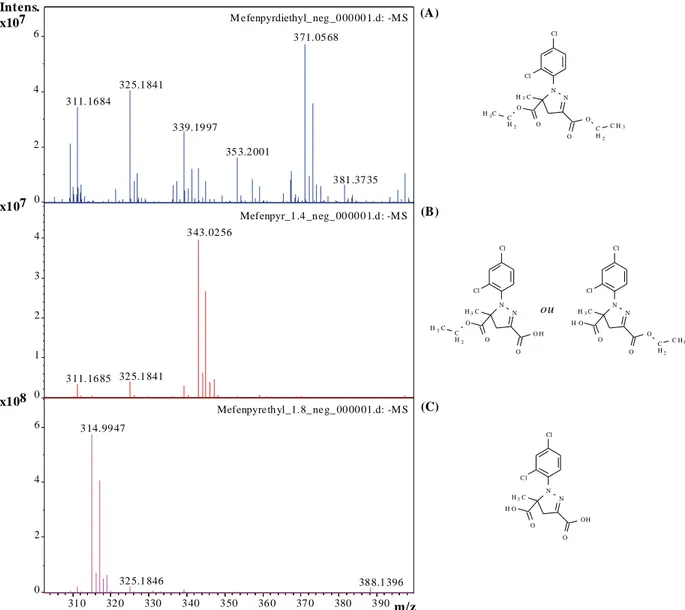
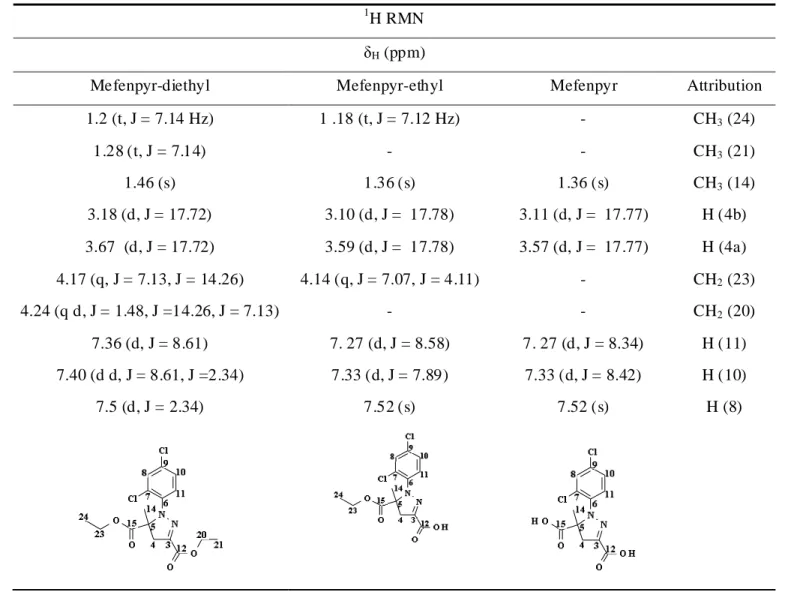
Cette étude a eu pour but de comprendre le comportement des herbicides mefenpyrdiethyl et l’amidosulfuron en milieu aqueux. Dans un premier chapite l’étude de l’hydrolyse de l’herbicide mefenpyrdiethyl en solution tampon aqueuse nous a permis d’évaluer l’influence de certains paramètres tels que le pH et la température. Ainsi le suivi de la dégradation de mefenpyrdiethyl par l'UPLC a permis la détection de deux principaux produits d’hydrolyse : le mefenpyrethyl et le mefenpyr, ces derniers ont été identifiés par l’FT-MS et l’RMN. Les calculs DFT ont permis de confirmer les résultats expérimentaux obtenus.
Dans un deuxième chapitre, nous nous sommes intéressés à l’étude de la phototransformation de l'herbicide mefenpyrdiethyl sous irradiation simulant la lumière solaire. L'étude de la photolyse directe de mefenpyrdiethyl a mis en évidence l’effet de la concentration initiale en mefenpyrdiethyl, le pH du milieu et la nature du solvant. L’analyse par l’UPLC nous a permis de détecter 10 photoproduits issus de la photolyse directe dont la nature a été etablie par analyse FT-MS. Ces informations permettront l’établissement des différents mécanismes réactionnels.
Une étude systématique de la photocatalyse de mefenpyrdiethyl et de l'amidosulfuron en présence de TiO2, a montré que le Degussa P-25 est plus efficace que l’Hombikat UV100, et que la présence de H2O2 améliore la photocatalyse de mefenpyrdiethyl. Ainsi les analyses FT-MS nous ont permis de détecter les principaux photoproduits.
Dans un troisième chapitre, nous avons confirmé que la phototransformation est une technique émergente et efficace dans la dégradation de l'amidosulfuron dans un milieu aqueux. Sur la base des résultats obtenus, nous avons conclu que la dégradation de l’herbicide amidosulfuron est relativement rapide dans l’eau à pH neutre et a des températures élevées. Cette étude fournit également des informations sur la caractérisation des photoproduits obtenus dans ce processus.
Mots-clefs: Mefenpyrdiethyl, Amidosulfuron, Hydrolyse, P hototransformation, sous-produits de degradation.
Abstract
The aim of this study is to understand the behavior of two herbicides e.g. mefenpyrdiethyl and amidosulfuron in aqueous medium. Three levels of investigation were adopted:
In the first chapter, we were interessted : (i) to study the degradation of the herbicide mefenpyrdiethyl in buffer solutions at different pH and temperatures, (ii) to follow the degradation of mefenpyrdiethyl by Ultrahigh Performance Liquid Chromatography (UHPLC) that shows the presence of two main products of hydrolysis e.g. mefenpyrethyl and mefenpyr, which were identified by the Fourier Transform Ion Cyclotron Resonance Mass Spectrometry (FTICR-MS) and Nuclear Magnetic Resonance (NMR) and (iii) to confirm the experimental results by using Density Functional Theory calculation (DFT).
In the second part, our aim was to study the photodegradation of mefenpyrdiethyl under simulated sunlight irradiation. In absence of photocatalysts, this study allowed us to determinate the effect of the initial concentration of mefenpyrdiethyl, pH and solvents. Thus, UHPLC analysis of the degradation products shows the presence of ten degradation products based on their retention time. Accordingly, the molecular formulas of the main degradation products were identified with high accuracy and resolution using FTICR-MS, such information allows us to draw the general mecanistical pathways of the photodegradation process.
In the presence of photocatalysts e.g. Degussa P-25 and Hombikat UV100, the photodegradation of mefenpyrdiethyl and the amidosulfuron shows that: Degussa P-25 is more effective than Hombikat UV100, and the presence of H2O2 improves the mefenpyrdiethyl photocatalysis.
In the third part, we can assert that the photodegradation is an emergent and effective technique in the degradation of the amidosulfuron in an aqueous solution. On the basis of the obtained results in solar light conditions, we can conclude that the degradation of amidosulfuron is relatively rapids in the water in neutral pH and high temperature. This study also supplies information on the characterization of by-products obtained in this process.
Keywords: Mefenpyrdiethyl, amidosulfuron, hydrolysis, photodegradation, by-products of degradation.
LISTE DES TABLEAUX
Chapitre II: MATERIEL ET METHODES : PROCEDES EXPERIMENTAUX,
METHODES ANALYTIQUES ET OPTIMISATION DES METHODES ANALYTIQUES PAR LA CHROMATOGRAPHIE EN PHASE LIQUIDE A HAUTE PERFORMANCE (UPLC)
Tableau II-1: Les caractéristiques physico-chimiques de l’amidosulfuron... 60 Tableau II-2 : Propriétés physico-chimiques de Mefenpyrdiethyl... 61 Tableau II-3: Produits chimiques et matériaux utilisés dans cette étude 61 Tableau II-4: Gradient d’élution utilisé dans l’étude de la cinétique de dégradation des herbicides ... 64 Tableau II-5: Gradient d’élution utilisé pour la détection des produits de dégradation (a) du mefenpyrdiethyl, et (b) du l’amidosulfuron ... 65
Chapitre III: ÉTUDE DE L’HYDROLYSE DE L’HERBICIDE SAFENEUR
MEFENPYRDIETHYL EN MILIEU TAMPON
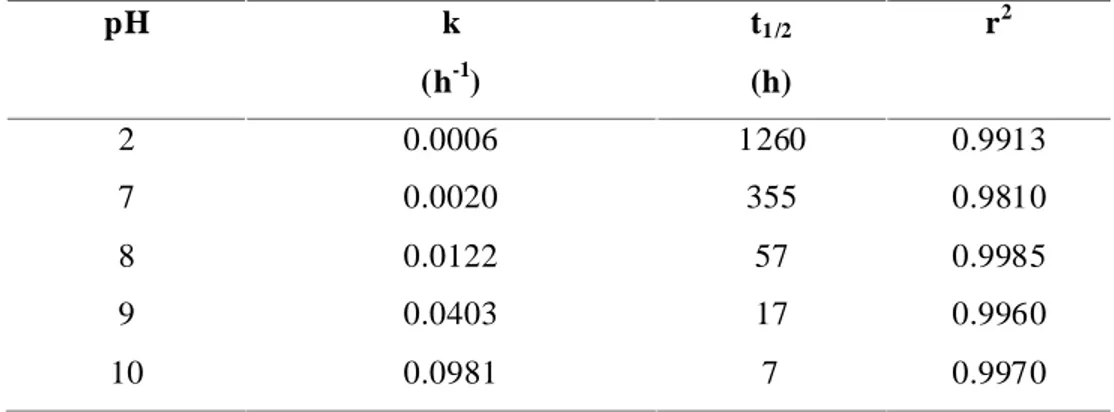
Tableau III-1: Constante de vitesse apparente et temps de demi-vie de l’hydrolyse du mefenpyrdiethyl selon les pH étudiés ... 85 Tableau III- 2: Résultats des analyses des produits d’hydrolyse du mefenpyrdiethyl par la spectrometrie de mass à transformée de Fourier (FT-ICR/MS) en mode négative ... 91 Tableau III-3: Résultats des analyses des produits d’hydrolyse du mefenpyrdiethyl par la spectrometrie de mass à transformee de Fourier (FT-ICR/MS) en mode positive ... 91 Tableau III- 4: Déplacements chimiques 1H RMN et constante de couplage du mefenpyrdiethyl dans l’acétone-d6 (δ = 2.04 ppm à 303K), mefenpyrethyl et le mefenpyr dans le CD3CN (δ = 1.93 ppm à 303K) ... 94 Tableau III-5: Déplacements chimiques 13C RMN du mefenpyrdiethyl dans l’acétone-d6 (δ = 29,8 ppm a 303K), mefenpyrethyl et mefenpyr dans le CD3CN (δ = 118.2 ppm a 303K). ... 95 Tableau III-6: Energie relative totale des différents mécanismes réactionnels d’hydrolyse du mefenpyrdiethyl en milieu neutre et en milieu alcalin. ... 101 Chapitre IV : PHOTOTRANSFORMATION DE MEFENPYRDIETHYL EN SOLUTION
Tableau IV-1 : Constantes de vitesse et temps de demi-vie de la photolyse direct des différentes concentrations de mefenpyrdiethyl ... 107 Tableau IV-2: Constantes de vitesse et temps de demi-vie de la photolyse direct de mefenpyrdiethyl dans différents solvants ... 109 Tableau IV-3: Données spectrales et massiques des produits issus de la dégradation ... 114 Tableau IV-4:Paramètres des modèles de Langmuir et Freundlich pour la modélisation de l’isotherme d’adsorption du pesticide mefenpyrdiethyl sur Degussa P-25 et Hombikat UV100 (1,33mg/L) à 25°C. ... 125 Tableau IV-5: Paramètres de la cinétique de dégradation en fonction de la concentration initiale du mefenpyrdiethyl en présence de P-25 et de l’Hombikat UV100 ... 135 Tableau IV-6: Valeurs des constantes cinétiques selon le modèle de Langmuir-Hinshelwood. ... 137 Tableau IV-7: Mefenpyrdiethyl et leur produits de dégradation en absence et en présence de H2O2, Hombikat UV100 et P-25 (erreurs < 1ppm). ... 147
Chapitre V : PHOTOTRANSFORMATION DE L’HERBICIDE AMIDOSULFURON EN
MILIEUX AQUEUX
Tableau V-1: Constantes de vitesse et temps de demi-vie de la photolyse direct d’amidosulfuron dans différents solvants ... 155 Tableau V-2: Données des analyses FT- ICR /MS et UPLC/MS en mode positif et négatif de l’amidosulfuron et leur produits de dégradation. ... 168 Tableau V-3: Paramètres des modèles de Langmuir et Freundlich pour la modélisation de l’isotherme d’adsorption à 25°C de l’amidosulfuron sur 1 g.L-1
de TiO2 P-25. ... 178 Tableau V-4: Valeur des constantes cinétiques selon le modèle de Langmuir-Hinshelwood. ... 184
LISTE DES FIGURES
Chapitre I: SYNTHÈSE BIBLIOGRAPHIQUE
Figure I-1 : Evolution du marché mondial des pesticides sur la période 1990-2008 (FAOSTAT., 2008) ... 30 Figure I-2: Marché mondial des pesticides en 2008 par catégorie de produits ... 30 Figure I-3 : Evolution du marché marocain des pesticides sur la période 1990-2008 (FAOSTAT., 2008). ... 31 Figure I-4: Marché national des pesticides en 2008 par catégorie de produits ... 32 Figure I-5: Répartition des intoxications par types de toxique durant l’année 2009... 33 Figure I-6: Pourcentage des échantillons de fruits et légumes contenant des résidus multiples entre 1997 et 2005 en Europe (d’après le rapport de la Commission Européenne 2007). ... 38 Figure I-7: Processus de dissipation des pesticides dans l’environnement (Chfik. 2002) ... 39 Figure I-8: Excitation électronique d’une molécule diatomique (Blanchet., 2008). ... 45 Figure I-9: Structure cristalline des trois formes allotropiques les plus courantes de TiO2: anatase (a), rutile (b) et brookite (c) (Carp et al., 2004) ... 49 Figure I-10: Principe de l’attaque photocatalytique sur les polluants organiques (Herrmann, 1999) ... 50 Figure I-11: le premier sulfonylurée de la classe des herbicides sulfonylurées... 52 Figure I-12: les étapes réactionnelles de la synthèse de l’amidosulfuron ... 54 Chapitre II: MATERIEL ET METHODES : PROCEDES EXPERIMENTAUX,
METHODES ANALYTIQUES ET OPTIMISATION DES METHODES ANALYTIQUE PAR LA CHROMATOGRAPHIE EN PHASE LIQUIDE A HAUTE PERFORMANCE (UPLC)
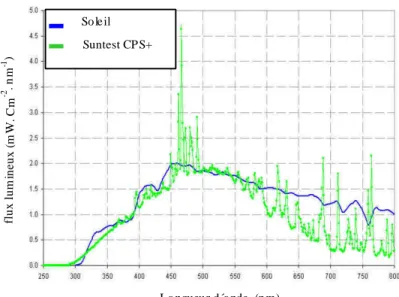
Figure II-1: Schéma du dispositif expérimental (Harir et al., 2008)... 63 Figure II-2: Comparaison entre le spectre de distribution spectrale d’émission du soleil et la lampe arc au Xénon du simulateur (Heraeus Suntest CPS+) (AtlasMaterial Testing Solutions, 2006) ... 63
Chapitre III : ÉTUDE DE L’HYDROLYSE DE L’HERBICIDE SAFENEUR
Figure III-1: Structure chimique et Spectre d’absorption UV-Visible du pesticide mefenpyrdiethyl (a, R1 et R2= C2H5) et ces dérives d’hydrolyse (b, R1=H et R2=C2H5 ; c, R1 et R2=H) ... 82 Figure III-2: L’évolution de la concentration de mefenpyrdiethyl en fonction du temps à différente valeurs du pH ... 84 Figure III-3: L’évolution de la constante de vitesse observée Kobs de l’hydrolyse du pesticides mefenpyrdiethyl en fonction du pH (Insertion : le trace de –log Kobs en fonction du pH ; -log[k] = -0,5623 [pH]-6,5366; R2=0,9735) ... 85 Figure III-4: Variation de la constante de vitesse observée de l’hydrolyse de mefenpyrdiethyl en fonction du pH à différentes température, (Insertion : l'évolution de l'énergie d'activation (Ea) en fonction du pH). ... 86 Figure III-5: Évolution des produits de l’hydrolyse à 25°C de 5,4×10−5 M de mefenpyrdiethyl dans les solutions tampons [a : pH 8 ; b : pH 9 ; c : pH 10] ... 88 Figure III-6: Superposition des chromatogrammes UPLC des produits d’hydrolyse de mefenpyrdiethyl M1et M2 au temps initiale et après une journée d’incubation. Conditions : C0=5,4×10−5 M, T=25 °C, et pH 11 ... 89 Figure III-7 : Spectres de masse FT-MS en mode négative du mefenpyrdiethyl et de ces produits d’hydrolyse ... 92 Figure III-8 : Spectre parcelle de corrélations hétéronucléaires 1H-13C RMN HMBC du mefenpyrethyl dans le CD3CN (A) et mefenpyrdiethyl dans l’acétone-d6 (B) ... 96 Figure III-9 a, b: géométrie de l’état de transition pour a) l'attaque concerté de l'eau sur la chaîne d’ester libre, et b) l'attaque concerté de l'eau sur la chaîne d’ester encombrants... 97 Figure III-10 a–d : Les géométries optimisées pour a) le premier état de transition correspondant à l’attaque de l’eau sur l’ester libre, b) l’état intermédiaire, c) le deuxième état de transition correspondant au transfert de proton de l'oxygène attaqué à la fraction éthanolique, et d) l'ester monocarboxylique obtenu après le deuxième état de transition ... 99 Figure III- 11a–d : Géométrie de l’état de transition pour a) l'attaque concertée d’OHˉ sur la chaîne d’ester libre, et b) l'attaque concertée d’OHˉ sur la chaîne d’ester encombrant ... 100 Chapitre IV : PHOTOTRANSFORMATION DE MEFENPYRDIETHYL EN SOLUTION
AQUEUSE
Figure IV- 1: Spectre d'absorption UV-visib le du pesticide mefenpyrdiethyl en solution aqueuse et la distribution spectrale de l'intensité de la lumière solaire et du Suntest ... 105
Figure IV-2: Cinétique de disparition du pesticide mefenpyrdiethyl (2,68x10-5 M) en photolyse directe à T = 25 °C (Insertion : tracée ln(C/C0 en fonction du temps d’irradiation)
... 106
Figure IV-3 : Tracée de Ln (C/C0) en fonction du temps d’irradiation pour différentes concentrations initiales en mefenpyrdiethyl (avec C0 : concentrations initiales, C : concentrations au temps t) ... 107
Figure IV-4: Traçage de Ln (C/C0) en fonction du temps d’irradiation à différents pH acide. C0 = 5,36x10-5 M (Insertion : Evolution de la constante de vitesse de la réaction de photolyse en fonction du pH) ... 108
Figure IV-5: Cinétique de disparition du mefenpyrdiethyl (5,36x10-5 M) en photolyse directe dans différents solvants. (Insertion : Evolution de la constante de vitesse en fonction la constante diélectrique ε des solvants) ... 109
Figure IV-6: Chromatogramme UPLC de l’échantillon concentré de mefenpyrdiethyl ... 111
Figure IV-7: Evolution des photoproduits de mefenpyrdiethyl en fonction du temps d’irradiation selon leur temps de rétention ... 112
Figure IV-8: Mécanisme proposé de dégradation photolytique du mefenpyrdiethyl ... 115
Figure IV-9: Cinétiques d’adsorption du pesticide mefenpyrdiethyl sur les photocatalyseurs à savoir : P-25 et Hombikat UV100... 118
Figure IV-10: Effet des doses des catalyseurs Degussa P-25 et l’Hombikat UV100 sur la quantité retenue du pesticide mefenpyrdiethyl. Conditions: C0 = 6 mg. L-1, pH de l’eau et T = 25 °C ... 120
Figure IV-11: Quantités de mefenpyrdiethyl adsorbées à l’équilibre sur les photocatalyseurs (P-25 et Hombikat UV100) en fonction du pH du milieu (C0=6 mg.L-1) ... 121
Figure IV- 12 : Isothermes d’adsorption du pesticide mefenpyrdiethyl sur les photocatalyseurs (P-25 et Hombikat UV100) ... 122
Figure IV-13: Représentation linéaire de la relation de Langmuir ... 124
Figure IV-14: Représentation linéaire de la relation de Freundlich ... 124
Figure IV-15: Allures des isothermes d'adsorption selon Giles et coll., 1960 ... 126
Figure IV-16: Cinétiques de photodégradation du pesticide mefenpyrdiethyl en présence des deux TiO2 commerciaux P-25 et UV100. [TiO2]=1,33 g/L, C0 = 1,61x10-5 M, 25°C (Insertion : détermination de l'ordre de la cinétique de photodégradation) ... 130
Figure IV-17: Cinétiques de photodégradation du pesticide mefenpyrdiethyl à différentes concentrations de TiO2 : a) P-25 et b) UV100 ... 132
Figure IV-18: Effet de la concentration du TiO2 sur la vitesse initiale de photodégradation du pesticide mefenpyrdiethyl... 133 Figure IV-19: Effet de la concentration initiale du pesticide mefenpyrdiethyl en présence de 1,33 g.L-1 de TiO2 : a) P-25 et b) UV100. ... 134 Figure IV-20: Effet de la concentration initiale en mefenpyrdiethyl sur la vitesse initiale de la photodégradation (Insertion : Modélisation de la cinétique de dégradation (Modèle Langmuir-Hinshelwood)) ... 136 Figure IV-21: Variation de la vitesse de disparition du mefenpyrdiethyl en fonction du pH.138 Figure IV-22: Effet de la concentration du peroxyde d´hydrogène sur la photolyse de mefenpyrdiethyl ... 140 Figure IV-23: Influence du peroxyde d'hydrogène sur la phototransformation du pesticide mefenpyrdiethyl (1,61x10-5 M) en présence du P-25 et l’UV100 (1,33 g.L-1), T = 25°C, pH5. ... 142 Figure IV-24: Influence de la concentration en peroxyde d'hydrogène sur la phototransformation du pesticide mefenpyrdiethyl (1.61x10-5 M) en présence de TiO2 (1,33 g.L-1), T = 25°C, pH =5 ... 143 Figure IV-25: Spectre de masse FT-ICR/MS de la dégradation de mefenpyrdiethyl en absence et en présence de H2O2, Hombikat UV100, et P-25. ... 146 Figure IV-26: Schéma des principales voies de la dégradation de mefenpyrdiethyl... 148
Chapitre V : PHOTOTRANSFORMATION DE L’HERBICIDE AMIDOSULFURON EN
MILIEUX AQUEUX
Figure V-1: Spectre d'absorption UV-visible d’amidosulfuron en solution aqueuse et la distribution spectrale de l'intensité de la lumière solaire et du Suntest ... 152 Figure V-2: Cinétique de photodégradation de l’amidosulfuron dans l’eau, C0 = 2.71x10-5 M (Insertion : détermination de l'ordre de réaction) ... 153 Figure V-3: Tracé de Ln (C/C0) en fonction du temps d’irradiation de l’amidosulfuron à différents pH, C0 = 2,71x10-5 M. (Insertion : Variation de la vitesse initiale de la réaction de photolyse en fonction du pH) ... 154 Figure V-4: Cinétique de la photolyse d’amidosulfuron (2,71x10-5M) dans différents solvants. (Insertion: Evolution de la constante de vitesse en fonction la constante diélectrique ε des solvants) ... 155 Figure V-5: Variation de la constante de vitesse en fonction de la concentration initiale en amidosulfuron... 156
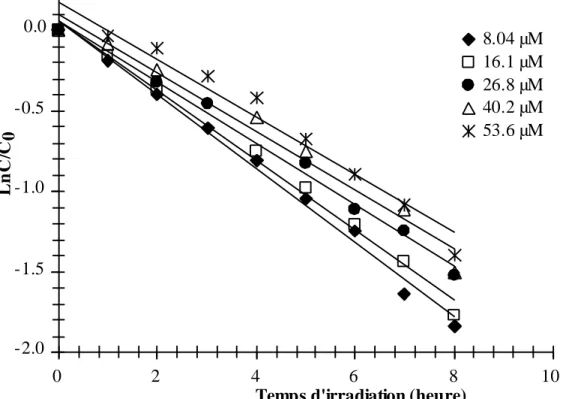
Figure V-6: Cinétiques de photolyse d’amidosulfuron à différentes températures (Insertion : variation de Ln de la constante de vitesse en fonction de 1/T(K)) ... 157 Figure V-7: Influence du mefenpyrdiethyl sur la variation de la cinétique de photolyse de l’amidosulfuron ... 158 Figure V-8: Influence de l’amidosulfuron sur la variation de la cinétique de photolyse du mefenpyrdiethyl ... 159 Figure V-9: Chromatogramme UPLC de la photolyse d’amidosulfuron en solution aqueuse ... 160 Figure V-10: Evolution des photoproduits de la photolyse d’amidosulfuron en solution aqueuse ... 161 Figure V-11: Chromatogrammes UPLC-MS de l’amidosulfuron et de ces produits de photolyse (“a” mode positif et “b” mode négatif)... 162 Figure V-12: Spectres LC-MS des ions extraits d’amidosulfuron et de ces intermédiaires (A1, A2, A3 et A4) en mode positif (voir figure V.11a) ... 163 Figure V-13: Spectres LC-MS des ions extraits d’amidosulfuron et de ces intermédiaires (A2, A5, A6 et A7) en mode négatif (voir figure V.11b) ... 163 Figure V-14: (a) Spectre de mass FT-ICR /MS en mode positif de la photolyse d’amidosulfuron. (b) Elargissement du segment 138-215m/z “i” du spectre contenant les produits de dégradation A1, A4 et A3. ... 165 Figure V-15: (a) Spectre de mass FT-ICR/MS en mode négatif de la photolyse d’amidosulfuron. (b) Elargissement du segment 138-215m/z “i” du spectre contenant les produits de dégradation A2, A5, A6 et A7. ... 166 Figure V-16: Mécanismes réactionnels de la photolyse d’amidosulfuron en solution aqueuse ... 170 Figure V- 17: Cinétiques d’adsorption de l’amidosulfuron sur le TiO2 à savoir Degussa P-25 et Hambikat UV100. ... 174 Figure V-18: Effet de la dose de TiO2 P-25 sur la quantité d’amidosulfuron adsorbée. ... 175 Figure V-19: Influence du pH sur l’adsorption de l’herbicide amidosulfuron sur le TiO2 P-25 ... 176 Figure V-20: Répulsion entre la charge d’amidosulfuron et la charge de surface du TiO2 ... 177 Figure V- 21: Isothermes d’adsorption de l’amidosulfuron sur le photocatalyseur P-25 ... 177 Figure V-22: Représentation linéaire de la relation de : A) Langmuir, B) Freundlich ... 178
Figure V-23: Cinétiques de la photodégradation de l’herbicide amidosulfuron en présence des deux TiO2 commerciaux P-25 et UV100. [TiO2]=1 g/L, C0 = 8,12 µM, 25°C (Insertion : détermination de l'ordre de la cinétique de photodégradation) ... 180 Figure V-24: Cinétique de disparition de l’amidosulfuron (8,12 µM) à différentes concentrations de TiO2 P-25... 181 Figure V-25: Effet du pH sur la vitesse de dégradation de l’amidosulfuron ... 183 Figure V-26: Effet de la concentration initiale sur la cinétique de dégradation photocatalytique de l’amidosulfuron [insert : Modélisation de la cinétique de dégradation (Modèle Langmuir-Hinshelwood)] ... 184 Figure V-27: Effet de la concentration du peroxyde d´hydrogène sur la photolyse de l’amidosulfuron ... 185 Figure V-28: Influence de la concentration de H2O2 sur la transformation photocatalytique d'une solution d’amidosulfuron (8,12 µM) en présence de TiO2 P-25 (1g.L-1). ... 186 Annexe
Figure 1: Spectre proton 1H RMN de mefenpyrdiethyl réalisé à 500 MHz et à 303 K. Les déplacements chimiques sont mesurés par rapport à une référence interne : les protons de l'acetone-d6 résonnent à 2,04 ppm. ... 221 Figure 2: Spectre 13C-RMN (a), séquence DEPT 90° (b) et DEPT 135° (c) de mefenpyrdiethyl enregistrés à 125 MHz et 303K dans l’acetone-d6... 222 Figure 3: Spectre hétéronucléaire 1H-13C RMN HSQC de mefenpyrdiethyl enregistrés à 303K dans l’acetone-d6. Permettant de déterminer les corrélations entre les protons et leurs carbone sur lequel il est attaché (1JH-C ~150Hz)... 223 Figure 4: Spectre hétéronucléaire 1H-13C RMN HMBC de mefenpyrdiethyl enregistrés à 283 K dans l’acetone-d6. Permettant de déterminer les corrélations et les couplages (3JH-C ~145Hz) entre un proton et l’hétéroatome voisin. ... 223 Figure 5: Spectre proton 1H RMN de mefenpyrethyl réalisé à 500 MHz et à 303 K. Les déplacements chimiques sont mesurés par rapport à une référence interne : les protons de CD3CN résonnent à 1,93 ppm. ... 224 Figure 6: Spectre 1 3C-RMN (a) et séquence DEPT 135° (b) de mefenpyrethyl enregistrés à 125 MHz et 303K dans CD3CN résonnent à 118,2 ppm. ... 225 Figure 7: Spectre hétéronucléaire 1H-13C RMN HSQC de mefenpyrethyl enregistrés à 303K dans CD3CN. ... 226 Figure 8: Spectre hétéronucléaire 1H-13C RMN HMBC de mefenpyrethyl enregistrés à 303 K dans CD3CN. ... 226
Figure 9: Spectre proton 1H RMN de mefenpyr réalisé à 500 MHz et à 303 K. Les déplacements chimiques sont mesurés par rapport à une référence interne : les protons de CD3CN résonnent à 1,93 ppm. ... 227 Figure 10: Spectre 13C-RMN (a), séquence DEPT 90° (b) et DEP T 135° (c) de mefenpyr enregistrés à 125 MHz et 303K dans CD3CN. ... 228 Figure 11: Spectre hétéronucléaire 1H-13C RMN HSQC de mefenpyr enregistrés à 303K dans CD3CN. ... 229 Figure 12: Spectre hétéronucléaire 1H-13C RMN HMBC de mefenpyr enregistrés à 303 K dans CD3CN. ... 229
Table des Matières
Résumé
Liste des tableaux Liste des figures
Introduction Générale... 21
Chapitre I : SYNTHÈSE BIBLIOGRAPHIQUE... 24
Partie A. Généralités sur les pesticides ... 25
I.Qu’est-ce Qu’un Pesticide ? ... 25
II.Aperçu Historique ... 25
III.Classification... 27
IV.Utilisation des pesticides ... 29
IV.1.Contexte mondial ... 29
IV.2.Contexte national ... 31
V.Impacts sur l’environnement et la santé humaine... 33
V.1.Effets sur l’environnement ... 33
V.2.Effets sur la Santé... 33
V.2.1.Toxicité aiguë ... 34
V.2.2.Toxicité chronique ... 35
V.3.Mélanges de pesticides et effets sur la santé ... 37
VI.Comportement et devenir des pesticides dans l'environnement ... 38
VI.1.Phénomènes de transfert ... 39
VI.1.1.Processus de transfert vers l’air : la volatilisation et la dérive ... 39
VI.1.2.Processus de rétention dans le sol ... 40
VI.1.3.Processus de transfert vers les eaux : le ruissellement et le lessivage... 40
VI.2.Processus de dégradation ... 40
VI.2.1.La dégradation biotique ... 41
VI.2.2.La dégradation abiotique ... 41
Partie B. Procédés d'oxydation avances (POAs) ... 43
I.1.Généralité sur la photochimie ... 43
I.2.Principe de la photochimie ... 43
II.Procédés D'oxydation Avancés (POAs) ... 45
II.1.Généralité ... 45
II.2.Procédés basés sur la photolyse ... 46
II.2.2.Photolyse directe ... 46
II.2.3.Procédé photochimique assistée: H2O2/UV ... 47
II.3.Photocatalyse hétérogène ... 47
II.3.2.Photocatalyse ... 47
II.3.3.Photocatalyseur TiO2... 48
II.3.4.Principe de la photocatalyse hétérogène ... 49
II.3.4.1.Production des radicaux OH• ... 49
II.3.4.2.Processus d’attaque du polluant... 50
II.3.4.3.Les produits de dégradation... 51
Partie C. Les Herbicides Sulfonylurées ... 52
I.Généralités sur les Sulfonylurées ... 52
II.Mode d’action ... 52
III.Amidosulfuron ... 53
III.1.Synthèse ... 53
Partie D. Les herbicides safeneur ... 55
I.Historique... 55
II.Activité et mode d'action ... 55
III.Mefenpyrdiethyl ... 57
III.1.Généralité ... 57
Conclusion ... 58
Chapitre II : MATERIEL ET METHODES : PROCEDES EXPERIMENTAUX, METHODES ANALYTIQUES ET OPTIMISATION DES METHODES ANALYTIQUE PAR LA CHROMATOGRAPHIE EN PHASE LIQUIDE A HAUTE PERFORMANCE (UPLC) ... 59
Partie A. Procédés Expérimentaux et méthodes Analytiques ... 60
I.Produits Chimiques et matériaux ... 60
I.1.Les herbicides ciblés par l’étude ... 60
-Propriétés physico-chimiques ... 60
Amidosulfuron ... 60I.2.Produits Chimiques ... 61
I.3.Photocatalyseur ... 62
II.Instrumentation ... 62
II.1.Le dispositif de Photodégradation ... 62
II.2.Techniques Analytiques ... 64
II.2.1.Analyse par la chromatographie en phase liquide à haute performance (UPLC) ... 64
II.2.2.Chromatographie Liquide couplée à la -Spectrometrie de Masse (LC-MS) ... 65
II.2.3.Spectrométrie de Masse à Transformée de Fourier (FT-ICR/MS) ... 66
II.2.4.Résonance Magnétique Nucléaire RMN en phase liquide. ... 66
III.Méthodologie expérimentale ... 67
Partie B. Optimisation des méthodes analytique par la chromatographie en phase liquide à haute performance (UPLC) ... 70
I.Introduction... 70
II.Développement des méthodes analytique UPLC de séparation des produits de la dégradation du pesticide mefenpyrdiethyl en milieu aqueux ... 71
II.1.Développement des méthodes de séparation des produits d’hydrolyse... 71
II.2.Développement des méthodes de séparation des produits de la photodégradation. ... 75
III.Développement des méthodes analytiques UPLC de séparation des photoproduits de l’amidosulfuron en milieu aqueux... 77
Conclusion ... 79
Chapitre III : ÉTUDE DE L’HYDROLYSE DE L’HERBICIDE SAFENEUR MEFENPYRDIETHYL EN MILIEU TAMPON ... 80
I.Introduction... 82
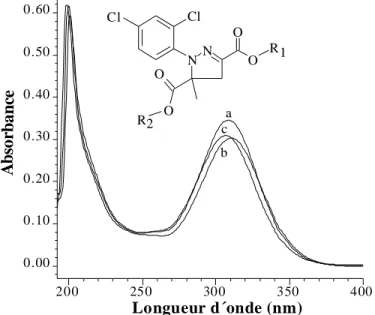
II.Caractéristique spectral du pesticide mefenpyrdiethyl... 82
III.Aspect cinétique de l’hydrolyse du pesticides mefenpyrdiethyl en milieux aqueux... 83
III.1.Effet du pH ... 83
III.2.Effet de la température ... 85
IV.Suivi des produits d’hydrolyse du pesticide mefenpyrdiethyl par la Chromatographie en phase Liquide à haute Performance (UPLC) ... 87
V.Identification des produits d’hydrolyse du pesticide mefenpyrdiethyl par la spectrométrie de masse a transformée de Fourier (FT-ICR/MS) ... 89
VI.Identification des produits d’hydrolyse du pesticide mefenpyrdiethyl par Résonance Magnétique Nucléaire (RMN) ... 93
VII.Calculs par la Theortie de la Fonctionnelle de la Densite (DFT) sur la formation de
mefenpyrethyl ... 96
VII.1.L’hydrolyse en milieu aqueux neutre ... 96
VII.1.1.Mécanisme concerté de l’attaque de l'eau ... 97
VII.1.2.Mécanisme multi-étapes de l’attaque de l’eau ... 97
VII.2.L’hydrolyse en milieu aqueux alcalin ... 99
VII.2.1.Mécanisme concerté de l'hydrolyse du mefenpyrdiethyl en milieu alcalin... 99
Conclusion ... 102
Chapitre IV : PHOTOTRANSFORMATION DE MEFENPYRDIETHYL EN SOLUTION AQUEUSE ... 103
Partie A : Photolyse directe du pesticides mefenpyrdiethyl en solution aqueuse... 104
I.Introduction... 104
II.Spectre d'absorption UV-Visible du pesticide mefenpyrdiethyl ... 104
III.Cinétique de la réaction de photolyse directe du pesticide mefenpyrdiethyl en milieux aqueux .………..105
IV.Etude de l’influence de quelques paramètres sur la photolyse du mefenpyrdiethyl ... 106
IV.1.Effet de la concentration initiale sur la vitesse de dégradation ... 106
IV.2.Effet du pH... 107
IV.3.Effet du solvent ... 108
V.Identification des intermédiaires de la photolyse du pesticide mefenpyrdiethyl ... 110
V.1.Etude analytique ... 110
V.2.Etude spectrale ... 112
V.3.Mécanisme de formation des différents photoproduits ... 113
Conclusion ... 116
Partie B: Adsorption de mefenpyrdiethyl sur le photocatalyseur TiO2 ... 117
I.Introduction... 117
II.Cinétiques d’adsorption du pesticide mefenpyrdiethyl sur Degussa P-25 et Hombikat UV100 ... 117
III.Effet des doses des adsorbants Degussa P-25 et Hombikat UV100 sur la rétention du pesticide mefenpyrdiethyl ... 118
IV.Effet du pH sur la rétention du pesticide mefenpyrdiethyl sur les adsorbants Degussa P-25 et Hombikat UV100... 120
V.Isotherme d’adsorption du pesticide mefenpyrdiethyl sur les adsorbants Degussa P-25 et Hombikat UV100... 121
Conclusion ... 127
Partie C: Transformation photocatalytique de mefenpyrdiethyl par le TiO2 en suspension . 128 I.Introduction... 129
II.Cinétique de la dégradation photocatalytique du pesticide mefenpyrdiethyl par le TiO2 en milieux aqueaux ... 129
III.Effet de quelques paramètres sur la photodégradation du pesticide mefenpyrdiethyl ... 131
III.1.Optimisation de la masse de TiO2 ... 131
III.2.Influence de la concentration initiale en mefenpyrdiethyl ... 133
III.2.1.Modélisation de la cinétique de dégradation ... 135
III.3.Influence du pH initiale de la solution ... 137
III.3.1.Calculs par la théorie de la densite fonctionnelle (DFT) ... 138
III.4.Influence du peroxyde d´hydrogène ... 139
III.4.1.Effet du peroxyde d´hydrogène en absence de dioxyde de titane ... 140
III.4.2.Effet de l’addition du peroxyde d'hydrogène en présence de dioxyde de titane ... 141
III.4.3.Influence de la concentration initiale en peroxyde d´hydrogène sur la photodégradation du pesticide mefenpyrdiethyl ... 142
IV.Identification des intermédiaires de la photocatalyse du pesticide mefenpyrdiethyl ... 143
Conclusion ... 149
Chapitre V : PHOTOTRANSFORMATION DE L’HERBICIDE AMIDOSULFURON EN MILIEUX AQUEUX... 150
Partie A : Photolyse directe de l’amidosulfuron... 151
I.Introduction... 151
II.Caractéristiques spectrales ... 151
III.Cinétique de la réaction de photolyse directe de l’amidosulfuron en milieux aqueux ... 152
IV.Facteurs influençant la cinétique de la réaction de photolyse directe ... 153
IV.1.L’influence du pH de la solution ... 153
IV.2.L’influence du milieu ... 154
IV.3.L’influence de la concentration initiale en amidosulfuron sur la vitesse de dégradation ... 156
IV.4.L’influence de la température ... 157
V.Photodégradation du mélange des deux pesticides, l’amidosulfuron et le mefenpyrdiethyl ……… …158
V.1.Influence du mefenpyrdiethyl sur la cinétique de disparition de l’amidosulfuron ... 158
VI.Identification des intermédiaires de la photolyse du pesticides amidosulfuron ... 160
VI.1.Etude analytique ... 160
VI.2.Etude spectrale ... 161
VI.3.Mécanismes réactionnels... 169
Conclusion : ... 172
Partie B : Transformation photocatalytique de l’amidosulfuron ... 173
I.Introduction... 173
II.Adsorption de l’herbicide amidosulfuron sur le semi-conducteur TiO2 ... 173
II.1.Cinétique d’adsorption ... 173
II.2.Influence de la masse de TiO2 P-25 sur le taux d'adsorption ... 174
II.3.Influence du pH ... 175
II.4.Isotherme d’adsorption de l’amidosulfuron ... 177
III.Transformation photocatalytique de l’herbicide amidosulfuron par le TiO2 ... 179
III.1.Etude cinétique de l’effet de la nature du semi-conducteur... 179
III.2.Effet de la concentration initiale de TiO2 P-25 sur la vitesse de dégradation. ... 180
III.3.Effet du pH initial sur la photodégradation ... 182
III.4.Effet de la concentration initiale en amidosulfuron sur la vitesse de dégradation ... 183
III.5.Effet de l’addition du peroxyde d'hydrogène (H2O2)... 185
III.5.1.Effet du peroxyde d´hydrogène sur la photolyse de l’amidosulfuron ... 185
III.5.2.Effet de l’addition du peroxyde d'hydrogène sur la photocatalyse de l’amidosulfuron ………..186 Conclusion ... 187 Conclusion générale ... 188 Références Bibliographiques... 192 Annexe... 221 1.Résultats de RMN de mefenpyrdiethyl ... 221 2.Résultats de RMN de mefenpyrethyl ... 224 3.Résultats de RMN de mefenpyr ... 227
Introduction Générale
Depuis les années 1950, le développement de l'agriculture et la volonté d'augmenter les rendements des denrées majeures faisant partie du régime alimentaire ainsi que l’amélioration de la santé publique ont conduit à une utilisation croissante des pesticides (95% à usage agricole) et notamment les herbicides.
L'usage des pesticides a constitué une avancée importante dans la maîtrise des ravageurs, des maladies parasitaires et des mauvaises herbes en agriculture. Ces produits ont largement facilité les conditions de travail et de production des agriculteurs et ont permis une sécurisation incontestable de la production alimentaire. En effet, depuis la mise sur le marché des molécules herbicides, la lutte contre les mauvaises herbes a pu réduire le désherbage manuel ou mécanique. Cependant, les pesticides peuvent aussi être très nocifs et l’utilisation accrue de ces produits peut endommager l’environnement.
Des études ont montré la présence des résidus de pesticides dans les écosystèmes fréquemment en phase aqueuse (dans les eaux des rivières (Irace-Guigand et al., 2004 ; Zhang et al., 2004), dans les eaux usées (Katsoyiannis et al., 2004), dans les eaux souterraines (Worrall et al., 2004 ; Di Corcia et al., 1992) et dans les eaux de pluie (Haraguchi et al., 1995)), ils sont aussi présents dans l’air (Coupe et al., 2000), sur les particules de l’atmosphère (Scheyer et al., 2005) et dans les aliments (Strandberg et al., 2001; Rastrelli et al., 2002; Cunnif, 1995). Ils possèdent le potentiel de causer toute une gamme d’effets toxiques envers la santé humaine, dépendant de la dose appliquée. Parmi ces effets, on trouve le cancer, les dysfonctions des systèmes reproductifs, des systèmes endocriniens et immunitaires, l’atteinte aiguë et chronique du système nerveux et l’endommagement des poumons. Il apparaît donc nécessaire d’étudier le devenir et l’impact des pesticides sur l’environnement.
A cet effet, la réglementation en matière de commercialisation des molécules des pesticides est devenue de plus en plus contraignante en Europe (directive Européenne 91/414/CEE) et un programme de réévaluation des substances actives existantes a conduit au retrait d’un grand nombre de molécules du marché, jugées nocives pour l’environnement en général, pour la santé humaine ou animale et pour la qualité des eaux souterraines en particulier. De plus, un nombre de moins en moins important de molécules nouvelles sont mises sur le marché dû au coût élevé des homologations.
Le Parlement européen a interdit, en 2009, la mise sur le marché de 22 pesticides dangereux cancérigènes, toxiques pour la reproduction humaine ou possédant des effets perturbateurs sur le système endocrinien. Même si les quantités de produits phytosanitaires mises sur le marché
tendent à diminuer, il reste encore plus de huit cents poisons autorisés à être utilisés.
Au Maroc, le recoure aux pesticide dans le domaine agricole est devenu indispensable pour atteindre les niveaux de production maximaux et satisfaire une demande de plus en plus accrue des consommateurs en produits alimentaires. Avec plus de 10000 tonnes de produits phytosanitaires utilisés annuellement au Maroc, la complexité et la diversité de ces produits imposent une surveillance et un contrôle régulier des eaux destinées à l’alimentation, surtout dans les zones rurales dont la population s’approvisionne directement de l’aquifère. En effet, sur l’ensemble des intoxications aiguës déclarées officiellement au Maroc, les pesticides ont été incriminés dans 5% des cas ces dernières années. Les actions de prévention de la contamination doivent donc être privilégiées.
La prise en compte du devenir des pesticides dans l'environnement s'est renforcée au cours des dernières décennies, tant pour les utiliser plus judicieusement que pour réduire les nuisances environnementales. Les travaux scientifiques réalisés au cours des 20 dernières années ont permis de faire progresser les connaissances dans deux domaines importants :
− D’une part celui du devenir de ces molécules dans l'environnement, et notamment de leur dégradation qui conditionne leur plus ou moins grande pérennité et les risques induits,
− d'autre part dans le domaine de l'écotoxicologie concernant les effets de ces produits, tant sur les cibles visées que sur les autres composantes du milieu.
D’une manière générale, lorsque l’eau est polluée par des substances toxiques et persistantes, notamment les produits phytosanitaires, un traitement adéquat est nécessaire afin d’obtenir des qualités d’eau traitée répondant à des normes devenues de plus en plus sévères. L’expérience a montré que les techniques classiques d’élimination des pesticides tels que les méthodes physiques de transfert de masse (décantation (Allegre et al., 2004), précipitation (Sado, 1991), adsorption des polluants sur le charbon actif (Ormad et al., 2008)), l’incinération (Ahling et al., 1979), ou la voie biologique (Vroumsia et al., 1996), sont inefficaces. C’est ainsi que ce sont développés, durant ces dernières années, des procédés de dégradation oxydante de composés organiques en milieu aqueux, grâce à l’application de méthodes catalytiques et photochimiques. Ces méthodes, appelées Procédés d’Oxydation Avancée (POA) dont la particularité est de former in situ d’entités radicalaires très réactives et non sélectives tels que les radicaux •OH, qui possèdent un pouvoir oxydant très élevé, capables de minéraliser partiellement ou en totalité la plupart des composés organiques. Il permet alors, la dégradation de molécules en phase aqueuse ou gazeuse (Pflieger, 2009) et a déjà prouvé son efficacité pour la minéralisation complète de nombreux polluants des eaux comme les pesticides. Ces entités radicalaires peuvent être générées en milieu aqueux soit par un couplage d’oxydants avec la lumière ultraviolette
(O3/UV, H2O2/UV, O3/H2O2) soit par photocatalyse (TiO2/UV).
Ces dernières années, beaucoup de travaux publiés dans la littérature sont consacrés à l’étude de la dégradation des substances herbicides pures. Alors qu’un herbicide commercial est un mélange soit en agents tensio-actifs et débullants (anti-foaming), phytoprotecteurs et autres additifs.
L’objectif de ce travail est de déterminer les conditions optimales de la dégradation homogène et hétérogène des herbicides mefenpyrdiethyl et l’amidosulfuron en solution aqueuse.
Les travaux de la thèse sont présentés à travers cinq chapitres, dans lesquelles, nous présenterons dans un premier chapitre, une synthèse bibliographique sur les pesticides de manière générale, ainsi que leurs caractéristiques physico-chimiques, leur impact sur l’environnement et les différentes techniques de leur traitement. Egalement, nous présentons les différents procédés d’oxydation avancée, les mécanismes d’oxydation par les radicaux hydroxyles, et les réactions prépondérantes intervenant dans la photocatalyse hétérogène.
Le second chapitre de ce manuscit est consacré à la présentation de la méthode d’élaboration des échantillons et des techniques expérimentales mises en oeuvre pour la caractérisation, ainsi que les méthodes analytiques utilisées, et l’optimisation des conditions d’analyse par la chromatographie en phase liquide à haute performance (UPLC).
Le troisième chapitre de ce manuscit sera réservé à la détermination des facteurs influençant l’hydrolyse de l’herbicide mefenpyrdiethyl ainsi que la détermination des conditions optimales de la dégradation. Également, il y aura le suivi et l’identification des sous-produits formés lors de l’hydrolyse.
Dans le quatrième chapitre nous présentons une étude détaillée de la phototransformation de mefenpyrdiethyl en milieux aqueux en absance et en présence des catalyseurs à savoir : TiO2 Degussa P-25 et TiO2 Hombikat UV100. Des données cinétiques sont relevées afin d’évaluer l’importance de différents paramètres opératoires, ainsi les sous-produits de dégradation ont été identifiés.
Dans le cinquième et dernier chapitre concerne notre second axe de recherche, nous présentons les résultats de l’étude de la photodégradation de l’herbicide amidosulfuron en milieux aqueux en absence et en présence des catalyseurs à savoir : TiO2 Degussa P-25 et TiO2 Hombikat UV100. Nous avons suivi cinétiquement le comportement photochimique de ce dernier dans des conditions représentatives de l’environnement. Nous avons ensuite procédé à la caractérisation des sous-produits formés. Également, nous avons procédé à l’étude du mélange des deux herbicides : l’amidosulfuron et le mefenpyrdiethyl.
Chapitre I
Partie A. Généralités sur les pesticides
I. Qu’est-ce Qu’un Pesticide ?
Pesticide est un mot récent emprunté à la langue anglaise. Il date de 1959 et il est composé de pest, lui-même emprunté au français peste au XVIe siècle, lequel provient du mot latin pestis qui désigne animal, insecte parasite ou plante susceptibles d’être nuisible à l’homme et à son environnement, et se terminant par le suffixe « cide » du latin -cida, « frapper, abattre, tuer » indique qu’il a pour fonction de tuer des êtres vivants.
Le mot « pesticide » est un terme générique définis par la directive 91/414/CEE du 15 juillet 1991 comme toute substance ou mélange de substances chimiques (naturelles ou synthétiques) utilisée pour lutter contre les ravageurs qui portent atteinte aux ressources végétales ou animales, nécessaires à l’alimentation humaine. Ces produits, sont également appelés produits agropharmaceutiques, produits phytosanitaires, ou produits de protection des plantes, (selon l’UIPP – Union des Industries de la Protection des Plantes). Les pesticides commercialisés sont composés d’une ou plusieurs matières actives auxquelles on a ajouté d’autres substances : produits de dilution, surfactants, synergisants… afin d’améliorer leur efficacité et de faciliter leur emploi.
II. Aperçu Historique
Les pesticides ont constitué un progrès considérable dans la maîtrise des ressources alimentaires. Ils ont grandement contribué à l’amélioration de la santé publique en permettant, d’une part, d’éradiquer ou de limiter la propagation de maladies parasitaires très meurtrières (lutte contre les insectes, vecteurs de ces maladies) et en garantissant, d’autre part, une production alimentaire de qualité. Depuis longtemps, les agriculteurs protègent leurs cultures contre les ravageurs. Dès 1000 ans avant J.C le soufre a été utilisé en Grèce antique par les chinois, et l'arsenic est recommandé par Pline, naturaliste romain, en tant qu'insecticide (Lhoste et al., 1989 ; Colin, 2000). Des plantes connues pour leurs propriétés toxiques ont été utilisées comme pesticides (par exemple les aconits, au Moyen Âge, contre les rongeurs). Les produits arsenicaux ou à base de plomb (Arséniate de plomb) étaient utilisés au XVIe siècle en Chine et en Europe.
Dès la fin du XVIe siècle, les propriétés insecticides de la roténone, extraite de plusieurs espèces végétales (le Derris originaire d’Asie du Sud-Est et le Lonchocarpus originaire d’Amazonie), étaient connues, comme le furent plus tard, vers la fin du XVIIe siècle, celles de la nicotine, extraite du tabac.
Au XIXe siècle, les pesticides sont de plus en plus utilisés. La chimie minérale prend son essor et autorise la mise sur le marché de traitements fongicides à base de mercure ou de sulfate de cuivre, telle la bouillie bordelaise, un mélange de sulfate de cuivre et de chaux qui permet de lutter contre certaines maladies cryptogamiques comme la cloque du pêcher ou le mildiou, champignon parasite de la vigne et de la pomme de terre.
Rappelons que l’histoire de l’humanité est émaillée de grandes famines comme celle que connut l’Irlande de 1845 à 1848 où les récoltes successives de pommes de terre furent détruites par le mildiou.
L'ère des pesticides de synthèse débute vraiment dans les années 1930, profitant du développement de la chimie organique de synthèse et de la recherche sur les armes chimiques durant la Première Guerre mondiale.
En 1874, Zeidler synthétise le DDT [1] (dichlorodiphényltrichloroéthane), dont Muller en 1939 établit les propriétés insecticides. Le DDT est commercialisé dès 1943 et ouvre la voie à la famille des organochlorés. Le DDT a dominé le marché des insecticides jusqu’au début des années 1970.
Après la Seconde Guerre mondiale le monde connaît une vague d'intensification de l'agriculture appelée «révolution verte ». Elle a assuré la sécurité alimentaire, tant en quantité qu'en qualité, des pays développés et contribué à améliorer l'approvisionnement de certains pays en voie de développement. en 1943, Templeman et Sexton, découvrent en Grande Bretagne le premier herbicide systémique et sélectif qui est le 2,4-D [2].
Des insecticides très efficaces et peu coûteux sont utilisés à partir des années 1950 et jusqu’au début des années 1970 pour éliminer le moustique, vecteur du paludisme et le doryphore qui ruine les cultures de pommes de terre. D'autres pesticides sont mis au point pour l'industrie textile (anti-moisissure, anti-acariens…) et du bois (traitement contre les insectes xylophages et les champignons des charpentes), pour les usages domestiques (insecticides), pour l'entretien de la voirie publique et pour une utilisation en médecine (antiseptiques et désinfectants).
L’utilisation de ces produits s’est généralisée au cours des dernières décennies. Au niveau mondial, même si les quantités et les types de pesticides utilisés varient (sous les Tropiques, par exemple, 50 % des produits appliqués sont des insecticides), le même constat peut être fait, quel que soit le niveau de développement économique des pays : les pesticides se sont imposés dans la plupart des pratiques agricoles. De 1945 à 1985, la consommation de pesticides a doublé tous les dix ans.
Les pesticides, à la fois efficaces, d'un coût relativement faible et faciles d'emploi, ont contribué au développement de systèmes de production intensifs, qui bénéficiaient de marchés et de prix agricoles favorables, et de la relative sous évaluation des conséquences environnementales de leur usage.
On peut donc affirmer qu’au cours des cinquante dernières années, l’agriculture s’est construite autour de l’utilisation des produits phytopharmaceutiques, considérés, parce qu’ils permettent de diminuer l’action des ravageurs de culture, comme un facteur de productivité, mais aussi comme le moyen de proposer des produits végétaux de qualité et d’aspect irréprochables tels qu’attendus par le consommateur.
Cependant, en Europe, depuis une dizaine d’années, les quantités de pesticides vendus ont tendance à décroître.
Cette tendance à la baisse a plusieurs explications principales :
- l'apparition de nouvelles molécules s'utilisant à de très faibles doses par hectare et la limitation voire l'interdiction d'usage des substances actives dont la dose d'emploi homologuée est généralement élevée ;
- la diminution de 40 % de l'emploi des produits soufrés et cuivrés, ces deux substances représentant près d'un tiers de la consommation totale des pesticides ;
- enfin, les agriculteurs raisonnent de plus en plus leurs interventions : une meilleure connaissance du risque parasitaire, un usage de techniques agro-environnementales approfondies, et la nécessité de maîtriser les coûts de tous les intrants dans l’exploitation sont, alliés aux nouvelles réglementations, des facteurs déterminants et limitants.
III. Classification
Les pesticides disponibles aujourd’hui sur le marché sont caractérisés par une telle variété de structure chimique, de groupes fonctionnels et d’activité que leur classification est complexe. D’une manière générale, ils peuvent être classés en fonction de la nature de l’espèce à combattre mais aussi en fonction de la nature chimique de la principale substance active qui les compose. Les produits phytosanitaires sont indispensables à la production agricole, il en existe une grande
variété. Ils regroupent plus de 900 matières actives qui rentrent dans plus de 8800 spécialités commerciales (IUPP, Union des Industries de la Protection des Plantes). De plus, les variétés et les quantités utilisées diffèrent en fonction du pays où ils sont utilisés. Néanmoins, les systèmes de classification sont universels.
Le premier système de classification repose sur le type de parasites à contrôler. Il existe principalement trois grandes familles chimiques qui sont: les herbicides, les fongicides et les insecticides.
Les herbicides sont des substances destinées à éliminer les végétaux rentrant en concurrence avec les plantes à protéger en ralentissant leur croissance. Les herbicides possèdent différents modes d’actions sur les plantes:
- les perturbateurs de la régulation d’une hormone « l’auxine » (principale hormone agissant sur l'augmentation de la taille des cellules),
- les perturbateurs de la photosynthèse, - les inhibiteurs de la division cellulaire, - les inhibiteurs de la synthèse des lipides, - les inhibiteurs de la synthèse de cellulose, - les inhibiteurs de la synthèse d’acides aminés.
Les fongicides permettent quant à eux de combattre la prolifération des maladies des plantes provoquées par des champignons ou encore des bactéries. Les fongicides peuvent agir différemment sur les plantes peuvent être:
- des inhibiteurs respiratoires,
- des inhibiteurs de la division cellulaire,
- des perturbateurs de la biosynthèse des acides aminés ou des protéines, - des perturbateurs du métabolisme des glucides.
Les insecticides sont des substances utilisées pour la protection des plantes contre les insectes. Ils interviennent en les éliminant ou en empêchant leur reproduction. Différents types existent comme:
- les neurotoxiques,
- les régulateurs de croissance,
- ceux agissant sur la respiration cellulaire.
Outre les trois grandes familles de pesticides mentionnées ci-dessus, différentes familles peuvent être cité comme par exemple :
- les acaricides, contre les acariens,
- les rodonticides, contre les rongeurs, - les taupicides, contre les taupes,
- les molluscicides, contre les limaces et escargots,
- les corvicides et corvifuges, contre les corbeaux et les autres oiseaux ravageurs de culture.
Le deuxième système de classification tient compte de la nature chimique de la substance active majoritaire qui compose les produits phytosanitaires. Les principaux groupes chimiques sont:
- les organochlorés, - les organophosphatés, - les carbamates, - les pyrethrynoïdes, - les sulfonyl urées, - les triazines
- les urées substituées.
Compte tenu de la variété de pesticides disponibles sur le marché, ils se répartissent en près de 150 familles chimiques et l’hétérogénéité de ce vaste ensemble de produits rend difficile toute classification.
Les pesticides relèvent en effet également d’une utilisation non agricole qui s’appelle les biocides qui sont similaires aux premiers, utilisés par exemple en hygiène publique (lutte anti-vectorielle) et dans d’autres applications comme la conservation du bois, la désinfection, ou certains usages domestiques. Les produits biocides sont régis par les articles L. 522-1 et suivants du code de l’environnement issus de la transposition de la directive 98/8/CE relative à la mise sur le marché des produits biocides.
IV. Utilisation des pesticides IV.1. Contexte mondial
Les données disponibles pour appréhender l’utilisation des pesticides sont généralement basées sur les chiffres de vente des principales sociétés phytopharmaceutiques. Ces chiffres ne représentent pas les consommations réelles du fait des stockages ou déstockages effectués par les utilisateurs ainsi que des exportations ou importations vers d’autres pays. Ils traduisent par contre une diversité des utilisations, certes agricoles pour la plupart, mais également domestiques (jardins,…) (Aubertot et al., 2005).
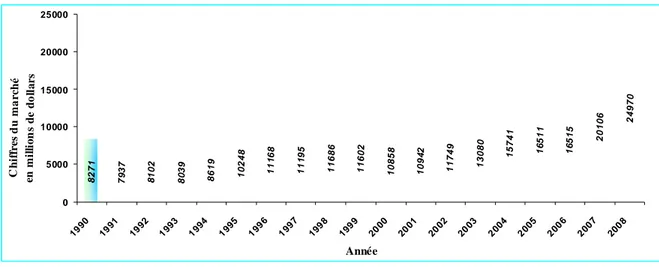
Le marché mondial des pesticides a atteint près de 11 milliards de dollars en 2000 et a globalement augmenté depuis cette date (Figure I-1) pour atteindre près de 30 milliards de dollars en 2008. 7 9 3 7 8 1 0 2 80 3 9 8 6 1 9 1 0 24 8 1 1 1 6 8 1 1 1 9 5 1 1 68 6 1 1 6 0 2 1 0 8 5 8 10 9 4 2 1 1 7 4 9 1 3 08 0 1 5 7 4 1 1 6 5 1 1 1 6 5 1 5 2 0 1 0 6 249 7 0 82 7 1 0 5000 10000 15000 20000 25000 1990 1991 1992 199 3 199 4 199 5 199 6 199 7 199 8 199 9 2000 2001 2002 2003 200 4 200 5 200 6 200 7 200 8 Année C h if fr es du m a rc h é en m il li o n s d e d o ll a rs
Figure I-1 : Evolution du marché mondial des pesticides sur la période 1990-2008 (FAOSTAT., 2008) He r bicide s 32% Dive r s 13% Ins e cticide s 34% Fongicide s 21%
Figure I-2: Marché mondial des pesticides en 2008 par catégorie de produits (FAOSTAT., 2008)
En 2008, les herbicides représentaient près de 32% du marché mondial (Figure I-2). En 2007, en Europe et en Amérique du Nord, ces pesticides constituaient généralement 70 à 80% du marché (notamment à cause de la forte augmentation des cultures de maïs) tandis que sous les tropiques, 50% des produits appliqués sont des insecticides. La diversification des cultures et l’amélioration du niveau de vie dans certains pays, modifient cette répartition. Ainsi, la Chine a supprimé des rizières pour les transformer en cultures maraîchères sur des surfaces équivalentes à l’Angleterre entraînant une diversification des pesticides utilisés. Les usages
non agricoles représentent environ 12% du marché mondial (ORP, 2008). En Amérique du Nord, les pesticides sont présents dans 82 à 90% des ménages, avec en moyenne au moins 3 à 4 produits différents, dont 75% sont des insecticides utilisés dans la maison et 22% des produits de jardins (ORP, 2008).
Depuis les années 60, les pesticides et les engrais ont permis de multiplier la productivité agricole mondiale par trois. Malgré ces traitements, les pertes occasionnées par les ravageurs aux cultures telles que le maïs représentent encore près de 30% en Europe et 50% en Afrique.
IV.2. Contexte national
Au Maroc, le secteur des traitements phytosanitaires reste moins maîtrisé. Ces pesticides sont très mal utilisés dans la majorité des cas : utilisation le plus souvent de produits très toxiques, aucun respect des doses d’emplois (surdosage), réalisation de plusieurs applications chimiques au cours du cycle de la culture et non respect du délai avant récolte. Par conséquent, une pollution accrue des différentes composantes de l’environnement (nappe phréatique, sol, air, etc.) est observée mais surtout la présence de quantités énormes de résidus de pesticides dans les fruits et légumes (dépassement des limites maximales de résidus). Il en résulte des risques accrus pour la santé du consommateur marocain (Boutaleb et al., 2003).
En 2008, le marché marocain des pesticides a atteint un chiffre d’affaire d’environ 125 millions de dollars (Figure I-3), dont des insecticides (40% du total), des fongicides (31%), des herbicides (17%), et divers (12%) (Figure I-4) (FAOSTAT., 2008).
4 1 3 9 3 7 3 0 43 45 5 4 5 2 63 5 4 5 1 53 55 8 2 10 1 8 8 94 10 3 12 5 0 20 40 60 80 100 120 140 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 Année c h if fre s d u m arc h é e n m illi o n s d e do ll a rs
Figure I-3 : Evolution du marché marocain des pesticides sur la période 1990-2008 (FAOSTAT., 2008).
He r bicide s 17% Dive r s 12% Ins e cticide s 40% Fongicide s 31%
Figure I-4: Marché national des pesticides en 2008 par catégorie de produits (FAOSTAT., 2008)
Les risques environnementaux liés à l'utilisation des pesticides sont très peu étudiés au Maroc. Aucune information n’est disponible sur les résidus de pesticides dans l'environnement biologique (eau et autres). P ar ailleurs, la législative en matière d'utilisation des pesticides et les moyens de la faire appliquer constituent une autre lacune inhérente aux traitements phytosanitaires au Maroc. Selon le rapport de l’Organisation Mondiale de la Santé, le nombre annuel d’intoxications par pesticides est estimé entre 1 et 5 millions, dont plusieurs milliers de cas mortels (WHO/FAO/UNEP ., 2004).
Au Maroc, bien que peu d’études aient mis l’accent sur la place des pesticides dans la pathologie toxique, certaines d’entre elles ont montré qu’ils constituent une cause d’intoxication loin d’être négligeable. Selon une étude rétrospective réalisée sur une série de 500 malades admis à l’hôpital pour enfants de Rabat, les pesticides étaient responsables de 38 % des cas d’intoxication aiguës (Madani et al., 2000). Une autre étude a montré qu’ils étaient
impliqués dans 28,5 % des intoxications traitées aux urgences de l’hôpital Ibn Rochd de Casablanca (Chara et al., 2002, Zahidi 2004). Selon le Centre Anti-Poison du Maroc (CAP M), un ensemble de 2609 cas d’intoxications dues aux pesticides a été recensé au Maroc entre janvier 1992 et décembre 2007. Pendant cette période de 16 ans, 82 décès ont été enregistrés. Durant l’année 2009, l’unité de toxicovigilance a reçu 4 514 Fiches de déclaration de cas d’intoxication (FDI) contre 4 313 FDI durant l’année 2008. Les pesticides occupent la quatrième place avec un pourcentage de 9,2% après les aliments, les produits gazeux et les médicaments (Figure I-5) (Benlarabi 2009).
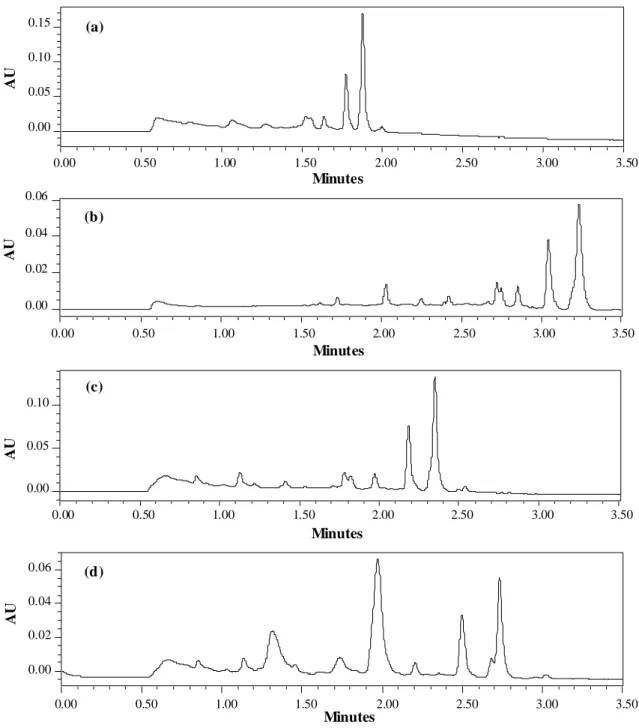
![Figure III-5 : Évolution des produits de l’hydrolyse à 25°C de 5.4×10 −5 M de mefenpyrdiethyl dans les solutions tampons [a : pH 8 ; b : pH 9 ; c : pH 10]](https://thumb-eu.123doks.com/thumbv2/123doknet/2187693.11089/89.918.177.761.95.868/figure-iii-evolution-produits-hydrolyse-mefenpyrdiethyl-solutions-tampons.webp)