Coopération fonctionnelle entre le récepteur de l’IL-7
(IL-7R) et l’intégrine α2β1 dans l’activation des Th17
Mémoire
Claudie Arseneault
Maîtrise en Microbiologie-Immunologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Claudie Arseneault, 2015
iii
Résumé
Les lymphocytes Th17 sont une sous-population de lymphocytes T auxiliaires impliqués dans les maladies inflammatoires et auto-immunes dont les mécanismes d’activation sont encore mal compris.
Au laboratoire, nous avons déjà démontré que α2β1 ainsi que le récepteur à l’IL-7 étaient deux molécules de costimulation potentielles chez les lymphocytes T. Nous avons donc émis l’hypothèse que l’intégrine α2β1 et l’IL-7R coopèrent pour activer la production d’IL-17 chez les Th17.
Nous avons montré que les lymphocytes Th17 co-expriment l’IL-7R et l’intégrine α2β1. De plus, la liaison de l’IL-7R et de l’intégrine α2β1 avec leurs ligands respectifs mène à la production d’IL-17, et ce, de manière additive. L’augmentation de la production d’IL-17 par l’IL-7R et l’intégrine α2β1 dépend de l’activation des voies de signalisation JAK/STAT, PI3 kinase/AKT et MAPK/ERK, respectivement. Ainsi, l’intégrine 21 et l’IL-7R sont des voies de réactivation importantes chez les Th17 et pourraient constituer des cibles thérapeutiques importantes.
v
Tables des matières
Résumé ... iii
Tables des matières ... v
Liste des schémas ... vii
Liste des figures ... ix
Liste des abréviations ... xi
Chapitre I : Introduction... 1
1. Les lymphocytes T ... 1
1.1. Le récepteur des lymphocytes T ... 3
2. Les lymphocytes T auxiliaires... 4
2.1. Lymphocytes Th1 ... 4
2.2. Lymphocytes Th2 ... 4
2.3. Lymphocytes Treg ... 5
2.4. Lymphocytes Th17 ... 6
3. Les lymphocytes Th17 dans l’arthrite rhumatoïde ... 8
3.1. Activation des lymphocytes T dans l’arthrite rhumatoïde ... 10
4. Interleukine-7 ... 10
4.1. Le récepteur à l’IL-7 ... 11
4.2. Signalisation de l’IL-7R ... 12
4.3. Fonctions de l’IL-7 ... 14
4.4. Rôle de l’IL-7 dans l’auto-immunité ... 14
5. Les intégrines ... 16
5.1. La régulation des intégrines ... 17
5.2. Fonction des intégrines ... 18
5.3. Signalisation des intégrines ... 19
5.4. Expression des intégrines par les lymphocytes T ... 22
5.5. Rôle des intégrines liant le collagène comme molécules de costimulation ... 22
6. But du travail ... 24
Chapitre II : Matériels et méthodes ... 27
Chapitre III : Résultats ... 29
L’IL-7R et α2β1 sont coexprimés sur les lymphocytes humains polarisés Th17. ... 29
La liaison d’IL-7R et de l’intégrine α2β1 par leur ligand active les lymphocytes Th17 humains. ... 31
vi
La liaison d’IL-7R et de l’intégrine α2β1 par leur ligand augmente également la
production d’IFN-γ par les lymphocytes Th17 humains. ... 33 L’IL-7R et l’intégrine α2β1 augmentent la production d’IL-17 via JAK/STAT5 et MAPK/ERK, respectivement. ... 34
Chapitre IV : Discussion ... 27 Bibliographie... 42
vii
Liste des schémas
Schéma 1………9
Schéma 2………13
Schéma 3………16
Schéma 4………21
ix
Liste des figures
Figure 1………30
Figure 2………32
Figure 3………33
Figure 4………34
xi
Liste des abréviations
CIA Arthrite induite par le collagène (collagen induced arthritis)
CMH Complexe d’histocompatibilité majeur
CPA Cellules présentatrices d’antigène
EAE Encéphalomyélite auto-immune expérimentale (Experimental
Autoimmune Encephalomyelitis)
ERK Kinase régulée par des signaux extracellulaires (extracellular
signal-regulated kinase)
FAK Kinase d’adhésion focale
ICAM-1 Molécule d’adhésion intercellulaire 1 (intercellular adhesion molecule)
IFN-γ Interféron gamma
IL Interleukine
ILK Kinase liée aux intégrines
Iono Ionomycine
ITAM Motif d’activation des immunorécepteurs via une tyrosine
JAK Janus kinase
JNK Kinase de c-Jun en N-terminale (c-Jun N-terminal kinase)
LFA-1 Antigène associé à la fonction lymphocytaire (lymphocyte
function-associated antigen)
MAPK Protéine kinase à action mitogène (Mitogen activated protein kinases)
MEC Matrice extracellulaire
MMP Métalloprotéinase
NF-AT Facteur de transcription des lymphocytes T activés
NF-κB Facteur nucléaire kappa B
NK Cellules « tueuses naturelles » (natural killer)
PIP3 Phosphatidylinositol 3,4,5-trisphosphate
PI3K Kinase de phosphatidyl-inositols 3
PKC Protéine kinase C
PLCγ Phospholipase C gamma
PMA Phorbol-12-Myristate 13-Acétate
PYK2 Tyrosine kinase riche en proline 2
RANK Récepteur activateur du facteur de transcription NF-κB
RANKL Ligand du récepteur activateur du facteur de transcription NF-κB
SH2 Homologie à Src 2
STAT Transmetteurs et activateurs de signaux de transcription (Signal
transducers and activators of transcription)
TCR Récepteur des lymphocytes T (T-cell receptor)
TGF Facteur de croissance tumoral (tumor growth factor)
Th T auxiliaire (T helper)
TNF Facteur nécrosant des tumeurs
VCAM-1 Molécule d’adhésion cellulaire vasculaire 1
1
Chapitre I : Introduction
La réponse immunitaire se divise en deux branches: l’immunité innée et l’immunité adaptative. L’immunité innée, composée entre autres des macrophages et des neutrophiles, est la première ligne de défense du système immunitaire, et n’est pas spécifique à un antigène. L’immunité adaptative est quant à elle principalement menée par les lymphocytes T et B qui, par le biais de leur récepteur à l’antigène, sont hautement spécifiques.
Le système immunitaire peut parfois se déréguler et mener au développement de maladies auto-immunes inflammatoires. C’est le cas de l’arthrite rhumatoïde, dans laquelle une activation chronique du système immunitaire cause une inflammation douloureuse aux articulations ainsi que la destruction des os et du cartilage. C’est pourquoi il est important de comprendre les mécanismes par lesquels le système immunitaire peut induire et maintenir l’inflammation. Dans mon travail de maîtrise, j’ai étudié comment deux éléments du microenvironnement tissulaire, l’interleukine-7 (IL-7) et le collagène de la matrice extracellulaire contribuent à l’activation d’un sous-type de lymphocytes T auxiliaires connus pour être hautement inflammatoires, les Th17.
1. Les lymphocytes T
Les lymphocytes T sont divisés en deux types principaux, CD8+ et CD4+. Les lymphocytes T CD8+ sont surnommés cytotoxiques. Ils sont responsables de l’élimination des cellules infectées par des pathogènes en sécrétant des enzymes telles que la perforine et le granzyme B [1]. Les lymphocytes T CD4+ sont plutôt dits auxiliaires. Ils ne participent pas directement à l’élimination des pathogènes, mais vont sécréter des cytokines et d’autres médiateurs qui activent les autres types cellulaires essentiels à la réponse immunitaire [2, 3]. Les cytokines influencent de nombreux aspects de la réponse immune et leur régulation homéostatique est donc d’une grande importance. Les déséquilibres dans les concentrations de cytokines peuvent contribuer au développement de maladies inflammatoires.
2
Les lymphocytes T se développent dans le thymus, ce qui leur a valu leur nom. Les lymphocytes T sortant du thymus sont dits naïfs car ils n’ont pas été activés. Ils migrent à travers les systèmes circulatoires et lymphatiques, à la recherche de l’antigène qui leur est spécifique afin d’être activés et de conduire la réponse immune spécifique [4]. Celle-ci a lieu au niveau du ganglion lymphatique, riche en cellules présentatrices d’antigène (CPA). Ces dernières capturent les antigènes dans les tissus périphériques avant de migrer aux ganglions lymphatiques. Les CPAs les plus fréquentes dans le ganglion lymphatique sont les cellules dendritiques, les lymphocytes B et les macrophages. L’antigène doit quant à lui être présenté via le complexe majeur d’histocompatibilité (CMH). Les molécules de CMH existent sous deux formes. Le CMH de type I est présent sur les lymphocytes CD8+, ainsi que sur toutes les cellules de l’organisme à l’exception des cellules germinales. Le CMH de type II est plutôt exprimé par les lymphocytes CD4+ ainsi que par les CPAs.
La reconnaissance par un lymphocyte T de son antigène donne lieu à son activation et le lymphocyte T naïf devient alors effecteur. Il a pour ce faire besoin de deux signaux [5]. Le premier signal, appelé seulement signal 1, est transmis par le récepteur à l’antigène du lymphocyte T (TCR). Il ne suffit toutefois pas pour activer complètement le lymphocyte T. Pour ce faire, il faut le deuxième signal, provenant des molécules de costimulation. Sans ce dernier, les lymphocytes T passent plutôt en anergie ou apoptose [6]. Un lymphocyte T anergique ne peut être activé par la suite, même lors d’une seconde rencontre avec son antigène [7].
Chez les lymphocytes T, la molécule de costimulation la plus importante est le CD28 [8]. Ce dernier possède deux ligands exprimés par les CPAs, CD80 et CD86, également nommés B7.1 et B7.2. La liaison du CD28 avec l’un de ces ligands déclenche une signalisation qui augmente l’activation du lymphocyte T. Il existe d’autres récepteurs, tels que les récepteurs de la famille du TNF [9] ou les intégrines [10], qui peuvent également jouer ce rôle. Les intégrines seront discutées plus loin.
3
1.1. Le récepteur des lymphocytes T
Le TCR est un récepteur membranaire permettant aux lymphocytes T de reconnaître les antigènes qui lui sont présentés. Ces derniers sont associés à des molécules de CMH de type I ou II. Les lymphocytes exprimant également CD4 à leur surface reconnaissent les molécules de CMH de type II, alors que ceux exprimant le CD8 reconnaissent le CMH de type I. Bien que ces deux molécules ne fassent pas partie du TCR, elles sont importantes pour son activation [11].
Le TCR lui-même est un hétérodimère composé soit de sous-unités αβ ou γδ. Les lymphocytes exprimant un TCR γδ sont ceux qui n’ont pas réussi à exprimer un TCR αβ fonctionnel [12] et ces lymphocytes jouent un rôle différent mais important dans l’immunité [13, 14]. Le TCR est un récepteur membranaire faisant partie de la super famille des immunoglobulines. Il possède une région constante pour l’ancrer à la membrane et une région variable, responsable de sa spécificité. Il n’a toutefois qu’une courte région intracellulaire sans activité enzymatique. Afin de pouvoir transmettre un signal et activer les lymphocytes T, le TCR doit s’associer à un complexe moléculaire, le CD3.
Le CD3 est un complexe de molécules de surface composé de trois dimères : γε, δε et ζζ. Les sous-unités γ, δ, et ε font également partie de la super famille des immunoglobulines et peuvent interagir et se lier avec le TCR [12]. La sous-unité ζ n’a qu’une courte région extracellulaire, mais un long domaine intracellulaire, et elle est la principale source de la signalisation induite par le récepteur. Cette signalisation passe par les motifs d’activation des immunorécepteurs via une tyrosine (ITAM), présents sur toutes les sous-unités de CD3 [15]. Le terme « TCR » réfère fréquemment au complexe TCR/CD3, puisque la présence du CD3 est nécessaire aux fonctions du TCR.
4
2. Les lymphocytes T auxiliaires
Les lymphocytes T CD4+, ou auxiliaires, sont des acteurs essentiels dans l’immunité acquise ainsi que dans l’auto-immunité. Leur rôle dans la réponse immunitaire varie en fonction de leur phénotype. La différenciation des lymphocytes en différents phénotypes est largement dirigée par les cytokines présentes dans le milieu.
2.1. Lymphocytes Th1
Les premiers phénotypes de lymphocytes T auxiliaires, décrits par Mosmman et Coffman il y a plus de vingt-cinq ans, étaient les Th1 et les Th2 [16]. Les Th1 sont des cellules associées à l’immunité cellulaire, souvent activés lors des infections virales ou bactériennes. Ce sont des cellules productrices d’interféron-γ (IFN-γ) et de TNF. Ces cytokines peuvent activer les macrophages et les lymphocytes T cytotoxiques, en plus de provoquer un changement de classe d’immunoglobulines chez les cellules B. Les lymphocytes Th1 se différencient principalement en présence d’IL-12 et d’IFN-γ. Le facteur de transcription maître de leur différenciation est le t-bet qui, une fois activé, induit l’expression de gènes spécifiques au phénotype Th1, tels que CXCR3 et CCR5 [17, 18]. Le t-bet vient également inhiber la différenciation en d’autres phénotypes de lymphocytes T auxiliaires, contribuant à établir un phénotype stable [19]. Les Th1 sont souvent générés dans plusieurs maladies auto-immunes, telles que l’arthrite rhumatoïde ou les maladies inflammatoires intestinales [20].
2.2. Lymphocytes Th2
Les Th2 sont, quant à eux, principalement impliqués dans l’immunité humorale et sont activés en présence de pathogènes et de parasites extracellulaires. Ils produisent principalement de l’IL-4 et de l’IL-5 qui peuvent activer les lymphocytes B et augmenter la production d’anticorps [21, 22]. Ceux-ci permettent l’agrégation des pathogènes et leur élimination subséquente par les macrophages. La différenciation des Th2 nécessite trois interleukines : l’IL-4, l’IL-5 et l’IL-10. La signalisation induite par ces cytokines active
5 GATA-3, le récepteur de transcription spécifique aux Th2 [23]. Comme pour le t-bet, le GATA-3 inhibe la différenciation en d’autres phénotypes en bloquant la transcription des cytokines qui y sont associées [24].
2.3. Lymphocytes Treg
D’autres sous-populations de lymphocytes se sont toutefois ajoutées à la dichotomie Th1/Th2. Jusqu’à maintenant, les mieux caractérisées sont les lymphocytes T régulateurs (Treg) et les lymphocytes Th17 [25, 26]. Ces deux populations sont fortement soupçonnées d’être impliquées dans le développement de maladies auto-immunes [25, 27].
Les Tregs contribuent au développement de la tolérance immunitaire en inhibant l’activation des autres cellules de l’immunité. Les Tregs sont généralement divisés en deux grandes familles : les lymphocytes Tregs naturels (nTreg) et les Tregs induits (iTreg) [28]. Les nTregs sont produits dans le thymus, alors que les iTregs se sont différenciés à partir de lymphocytes T auxiliaires naïfs. Ils expriment le facteur de transcription Foxp3 et se différencient en présence de TGF-β [29].
Les Tregs inhibent principalement l’activité des lymphocytes T [30, 31], mais ils sont également capables de réguler l’activité des lymphocytes B [32], des cellules NK [33], des monocytes et des macrophages [34]. On distingue deux façons d’inhiber la réponse immunitaire chez les nTreg. La première se fait par contact entre les cellules. Les nTregs expriment entre autres CTLA-4, une molécule de costimulation inhibitrice, qui diminue le niveau d’activation des cellules avec laquelle elle entre en contact [34]. De plus, les nTregs produisent des molécules telle que la perforine, permettant de tuer la cellule cible [35]. La deuxième façon repose sur la production de cytokines anti-inflammatoires, dont les plus importantes sont l’IL-10 et le TGF-β [34, 36].
6
2.4. Lymphocytes Th17
Les lymphocytes Th17 sont un sous-type de lymphocytes T auxiliaires plus récent. Les premières études caractérisant les Th17 remontent à plus de six ans. Leur cytokine signature, l’IL-17, a toutefois été identifiée il y a presque vingt ans. Les Th17 ont un rôle dans l’immunité protectrice contre les pathogènes extérieurs, tel que M. tuberculosis ou
Chlamydia muridarum [37].
Les premières études de différenciation pour les Th17 montrèrent que chez la souris, seuls l’IL-6 et le TGF-β étaient nécessaires [38]. Par contre, chez l’humain, la différenciation des Th17 impliquait aussi les cytokines inflammatoires IL-1 et IL-23 [39]. En fait, les Th17 qui se différenciaient uniquement en présence d’IL-6 et de TGF-β n’étaient pas inflammatoires et ne pouvaient pas transférer la maladie chez la souris [40]. Dans ce contexte, des travaux ultérieurs ont pu montrer que, chez la souris, la différenciation des Th17 requiert comme chez l’humain la présence de IL-1β et de l’IL-23 qui est très importante pour le maintien du phénotype [40, 41]. Dans tous les cas, le TGF-β inhibe la différenciation en Th1 et favorise la différenciation en Th17 [42]. Le rôle précis du TGF-β dans la différenciation des Th17 n’est pas complètement élucidé. Il semblerait effectivement que différents isoformes aient différents effets sur la différenciation [41].
Afin de produire de l’IL-17, les Th17 doivent d’abord être activés par différentes voies de signalisation intracellulaires. Parmi les voies importantes pour la production d’IL-17 se trouve le facteur de transcription RORγT qui est aussi important pour la différenciation [43]. L’expression de ce facteur de transcription nécessite l’activation du TCR. Les voies reliant RORγT et le TCR ne sont pas encore élucidées, mais nous savons qu’elles impliquent STAT3. STAT3 est un autre facteur de transcription qui peut être induit par l’IL-6, l’IL-21 et l’IL-23. Il a la capacité d’augmenter la production d’IL-17 [44, 45] en se liant directement au promoteur du gène de l’IL-17 et en stimulant l’expression de RORγT [46]. Cette dernière méthode d’action serait plus importante, puisque la transfection d’une forme active de STAT-3 dans des souris déficientes pour RORγT n’induit que de faibles niveaux d’IL-17 [47]. D’autres études montrent également que les voies des MAP kinase
7 ERK et JNK, ainsi que celles du facteur de transcription des lymphocytes T activés (NF-AT), peuvent contribuer significativement à la production d’IL-17 [48].
En plus de l’IL-17, les Th17 produisent l’IL-21 et l’IL-22 [49, 50]. Ce ne sont toutefois pas les seules cytokines que ces lymphocytes auxiliaires peuvent produire. En effet, l’une des caractéristiques principales des Th17 est leur étonnante plasticité. Il existe des Th17 capables de produire de l’IFN-γ, que l’on nomme Th1/Th17 [51]. D’autres expriment plutôt de l’IL-4 en plus de l’IL-17 et sont connus comme des Th2/Th17 [52]. Les changements de phénotypes des Th17 sont principalement influencés par les cytokines présentes dans le milieu.
Les Th17 ont surtout été étudiés pour leurs rôles dans diverses maladies inflammatoires. Les plus connues sont le psoriasis, la sclérose en plaques, l’arthrite rhumatoïde et les maladies inflammatoires intestinales. La relation entre l’arthrite rhumatoïde et les Th17 sera détaillée plus tard.
2.4.1. L’interleukine 17
Lorsqu’activés, les Th17 expriment de nombreuses cytokines pro-inflammatoires, notamment l’IL-17, l’IL-21, l’IL-22 et, dans le cas des Th1/Th17, l’IFN-γ. L’IL-17 joue un rôle important dans le développement de plusieurs maladies auto-immunes, et il convient donc de l’étudier plus en détails.
L’IL-17 appartient en fait à une famille de cytokines avec six membres connus : l’IL-17A, B, C, D, E et F. [53] L’IL-17 est un dimère de 30-35 kDa, le plus souvent retrouvé en homodimères d’IL-17A ou d’IL-17F. Il existe également des hétérodimères d’IL-17A/F. [54] L’appellation « IL-17 » réfère le plus souvent à l’homodimère IL-17A, le membre prototype de cette famille.
L’IL-17 peut être produit par d’autres cellules que les Th17 comme les lymphocytes T , mais ces derniers en demeurent la source majeure, surtout pour l’IL-17A.
8
2.4.2. L’interféron-γ
Les interférons (IFN) sont des cytokines très impliquées dans la résistance aux virus chez les mammifères [55]. Les interférons de type I (IFN-α et IFN-β) sont sécrétés par les cellules infectées et servent à protéger les cellules environnantes. L’interféron de type II (IFN-γ) est plutôt sécrété par des cellules du système immunitaire telles que les cellules NK et les Th1. Il joue un rôle important dans la réponse immune cellulaire ainsi que dans l’inflammation [55]. L’activation des lymphocytes Th1 via le TCR induit la production d’IFN-γ qui peut également être augmentée par l’IL-12 et l’IL-18. La signalisation impliquée dans la production d’IFN-γ inclut les MAP kinases ERK, JNK et p38 ainsi que la voie PI3K/AKT [56, 57].
L’IFN-γ peut contribuer à la réponse immunitaire en activant de nombreux types cellulaires. Par exemple, il augmente l’expression des molécules de CMH II chez les CPAs, ce qui mène à une plus grande activation des lymphocytes T [58]. L’IFN-γ induit également la production des réactifs intermédiaires de l’oxygène et de l’azote chez les macrophages, ce qui permet la destruction des bactéries phagocytées [58]. Il induit aussi la production de cytokines inflammatoires par les macrophages tels que le TNF et la production de métalloprotéinases [59]. Un dérèglement de la production d’IFN-γ peut contribuer au développement des maladies auto-immunes de type Th1 [60]. Bien que certaines études montrent un rôle protecteur de l’IFN-γ, tel que dans l’arthrite induite par le collagène [61, 62], ses propriétés inflammatoires et sa capacité à réactiver les lymphocytes T anergiques autoréactifs [63] pointent plutôt dans une direction pro-inflammatoire. Le rôle de l’IFN-γ dans le développement pourrait dépendre du moment et de sa localisation. En effet, son injection dans le liquide synovial favorise le développement de l’arthrite rhumatoïde, alors qu’une injection systémique inhibe plutôt la maladie [61-63].
9 Les Th17 jouent également un rôle important dans la pathogénèse de l’arthrite rhumatoïde. Une fois le milieu inflammatoire atteint, les Th17 sécrètent leur cytokine signature, l’IL-17. Cette cytokine peut activer un grand nombre de cellules présentes dans l’articulation [64]. Tout d’abord, elle contribue au développement de l’inflammation par l’activation des macrophages, qui produisent alors des cytokines pro-inflammatoires telles que l’IL-1β, l’IL-6 et le TNF-α [65]. L’IL-17 induit également une plus grande production de métalloprotéinases (MMP) et d’oxyde nitrique via l’activation des synoviocytes, des chondrocytes et des macrophages [65, 66]. Les synoviocytes activés produisent également de l’IL-8, ce qui attire les neutrophiles à l’articulation et contribue à son inflammation [67]. En plus de ces effets, l’IL-17 peut induire la production du ligand du récepteur activateur de NF-κB (RANKL) chez plusieurs types cellulaires, tels que les macrophages et les ostéoblastes [66]. Le RANKL est un facteur important dans la dégradation des os. Lorsqu’il se lie à son récepteur, RANK, il induit une signalisation qui viendra éventuellement activer NF-κB, et mènera à la différenciation des monocytes en ostéoclastes, qui sont les cellules de l’os responsables de la dégradation de l’os observée lors de la maladie [68, 69].
10
Schéma 1 : Une fois arrivés dans le milieu inflammatoire, les Th17 produisent de l’IL-17. Cette cytokine active différents types cellulaires qui produisent des médiateurs de l’inflammation et entrainent la destruction du cartilage et des os [70].
3.1. Activation des lymphocytes T dans l’arthrite rhumatoïde
Les mécanismes d’activation des lymphocytes T effecteurs dans le synovium arthritique sont d’une grande importance afin de comprendre l’évolution de la maladie. Ceux-ci peuvent d’abord être réactivés par leur TCR. Cependant, des études ont démontré que les lymphocytes T répondent peu à l’activation et à la régulation par le TCR dans les milieux inflammatoires chroniques. Par exemple, les lymphocytes ne produisent pas beaucoup d’IL-2 [71] et ne prolifèrent pas massivement après une activation par le TCR dans un contexte d’arthrite rhumatoïde [72]. Cette hypo-réponse des lymphocytes proviendrait d’un défaut dans la chaîne ζ du CD3, qui lui-même pourrait être dû aux niveaux de stress oxydatif et de TNF-α élevés dans les milieux inflammatoires [73]. Ce défaut de signalisation par le TCR se retrouve aussi chez les lymphocytes Th17, ce qui pourrait expliquer leur faible prolifération et leur rareté dans les tissus inflammatoires [74]. Ceci suggère que, pour une maladie chronique, il existe d’autres voies d’activation des lymphocytes T, provenant du microenvironnement inflammatoire. Dans le cadre de ce travail, nous avons examiné la voie de l’IL-7 et de son récepteur (IL-7R), et la voie du collagène, une fibre de la matrice extracellulaire qui lie l’intégrine α2β1.
4. Interleukine-7
L’IL-7 fait partie de la famille des cytokines de l’IL-2. C’est une cytokine essentielle au développement et à la survie des lymphocytes B et T [75]. L’IL-7 est produit principalement par les fibroblastes réticulaires des organes lymphoïdes [76], par les cellules stromales du synovium et de la moelle osseuse [77] ainsi que par les cellules épithéliales thymiques qui dirigent la différenciation des lymphocytes T [78]. La structure et la signalisation intracellulaire du récepteur à l’IL-7 seront d’abord abordées, avant d’examiner leurs fonctions dans les lymphocytes et leur rôle dans l’auto-immunité.
11
4.1. Le récepteur à l’IL-7
Le récepteur à l’IL-7 est un récepteur de la famille des récepteurs à l’IL-2. C’est un hétérodimère composé de la chaîne commune gamma (γc) et de la chaîne alpha (IL-7Rα). La chaîne commune est partagée avec d’autres récepteurs de la famille de l’IL-2, tels que l’IL-2, l’IL-4, l’IL-9, l’IL-15 et l’IL-21, tous des récepteurs pouvant réguler la croissance et la différenciation des lymphocytes T. La spécificité du signal de l’IL-7R passe principalement par sa chaîne alpha et celle-ci peut également former un dimère avec le TLSR (thymic stromal lymphopoeitin), un homologue de la chaîne γc [79]. Ce dernier peut donc également se lier à la chaîne alpha de l’IL-7R, faisant compétition avec la chaîne γc et limitant la formation d’un récepteur IL-7R fonctionnel.
Tel que mentionné précédemment, la spécificité du signal de l’IL-7R passe principalement par sa chaîne alpha. Il existe deux domaines d’interaction sur la partie intracellulaire de cette dernière, d’une importance particulière pour la transduction du signal chez les thymocytes. Le premier est la Box1, une séquence de huit acides aminés commune à tous les récepteurs de type I. Elle permet la liaison à JAK1, une tyrosine kinase impliquée dans la signalisation de l’IL-7R. La deuxième région est l’une des trois tyrosines de la queue cytoplasmique de l’IL-7Rα. Elle est nommée Y449 et sa phosphorylation permet le recrutement des membres de la famille des facteurs de transcriptions STAT.
L’IL-7R régule également sa propre expression à la surface des cellules T. En absence d’IL-7, le récepteur ne demeure pas à la surface mais est internalisé par endocytose, puis recyclé à la membrane plasmique. Sans stimulation, seule une fraction de l’IL-7R est dégradée. La liaison de l’IL-7 renverse toutefois cette proportion, menant à une dégradation plus prononcée de l’IL-7Rα et donc à une expression plus faible de ce dernier à la surface des cellules [80]. Cette dégradation dépend de JAK3 et ne s’applique pas à la chaîne commune γc [80, 81]. Ce mécanisme constitue une boucle de rétroaction négative qui
12
limite l’amplitude et la durée du signal et pourrait contribuer à une meilleure répartition de l’utilisation de l’IL-7 présent en quantité limitée dans l’organisme, maximisant ainsi la population de lymphocytes T ayant été activés par l’IL-7 [82].
4.2. Signalisation de l’IL-7R
L’un des mécanismes de signalisation les plus importants pour l’IL-7R passe par l’induction de la voie des JAK/STAT. Les JAK sont des tyrosines kinases recrutées par le récepteur de l’IL-7. La JAK1 vient s’associer à la chaîne IL-7Rα alors que la JAK3 se lie à la chaîne γc [83]. Lors de l’activation du récepteur, les deux JAKs s’entre-phosphorylent, c’est-à-dire que JAK1 phosphoryle JAK3 et vice-versa. Une fois phosphorylée par JAK1, JAK3 peut phosphoryler la tyrosine Y449 sur la queue cytoplasmique de la chaîne alpha.
La tyrosine Y449 phosphorylée permet de recruter les membres de la famille des facteurs de transcription STAT contenant un domaine SH2. La principale STAT recrutée à la chaîne alpha est STAT5, mais le récepteur de l’IL-7 est également connu pour activer STAT1 et STAT3 [84, 85]. D’autres protéines liant les phosphotyrosines, telle que la protéine adaptatrice Shc, peuvent également faire compétition à STAT5 pour la liaison à Y449 [86]. Les dynamiques de compétition entre les différentes protéines pouvant lier l’IL-7Rα influencent la nature et l’amplitude du signal transmis par le récepteur.
Les protéines STATs sont des facteurs de transcription impliqués dans la signalisation des récepteurs de cytokines avec une chaîne γc [87]. Elles sont présentes en haute concentration dans le cytosol des cellules au repos, ce qui permet une réponse rapide suite à la phosphorylation des JAK [88]. La phosphorylation des STATs par les JAKs mène à leur dimérisation. Ces dimères transloquent ensuite au noyau où ils peuvent réguler l’expression de certains gènes liés à la survie ou à la prolifération des lymphocytes. Les souris dont les lymphocytes T sont dépourvus de STAT5 ont un nombre réduit de lymphocytes CD4 et CD8 naïfs en périphérie. C’est également vrai des souris surexprimant SOCS1, un inhibiteur des quatre membres de la famille JAK [89, 90].
13
Schéma 2 : Phosphorylation des Stats par l’IL-7R
Schéma 2 : Suite à sa ligation avec l’IL-7, JAK3 est recrutée à la chaîne γc de l’IL-7R et JAK1 à la chaîne α. Il y a transphosphorylation des JAKs : JAK3 phosphoryle JAK1 et vice-versa. JAK3 peut alors phosphoryler la tyrosine Y449, présente sur l’IL-7Rα. Les STATs sont alors recrutés à Y449 via leur domaine SH2, puis phosphorylés par la protéine JAK1. Ceci mène à leur activation et à leur dimérisation [91].
La tyrosine Y449 phosphorylée pourrait également induire un deuxième signal de survie suite au recrutement de la kinase phosphatidyl-inositol 3 (PI3K) à ce site [87]. En effet, de nombreuses études ont démontré que la liaison de l’IL-7 à son récepteur amène une activation rapide de la voie PI3K. Ces données proviennent toutefois principalement de lignées cellulaires immortalisées ou de thymocytes primaires et le rôle de la voie PI3K dans les lymphocytes T effecteurs est encore nébuleux [92]. Par exemple, l’activation de la voie PI3K est essentielle à la survie et à la prolifération induite par l’IL-7 dans des lignées de leucémie lymphoblastique aigüe [93]. Certaines études démontrent également que la phosphorylation d’AKT dans des cellules T naïves est indétectable avec des stimulations à court terme d’IL-7, mais demanderait plutôt une exposition prolongée à de hautes concentrations d’IL-7 [94]. Toutefois, même une stimulation d’une heure à de fortes concentrations d’IL-7 ne parvient pas à induire une forte phosphorylation d’AKT dans des
14
lymphocytes T effecteurs/mémoires [95]. Les conditions précises amenant l’activation de la voie PI3K par l’IL-7R et le rôle exact de cette signalisation dans la survie et la prolifération des lymphocytes T demeurent donc encore à élucider.
4.3. Fonctions de l’IL-7
L’IL-7 a été identifié comme l’une des cytokines majeures dans l’homéostasie des lymphocytes T et joue un rôle essentiel dans leur survie. Cette survie est d’abord contrôlée par la régulation de l’expression des protéines de la famille de Bcl-2 (pour B-cell lymphoma
2), particulièrement Mcl-1 et Bcl-2, connues pour inhiber la voie mitochondriale de
l’apoptose [96]. Dans des thymocytes double-négatifs, la stimulation via l’IL-7 mène à la phosphorylation et l’inactivation de Bad, une protéine pro-apoptotique, et ce de manière dépendante de la voie de PI3K. À l’inverse, un manque d’IL-7 amène plutôt l’association de Bad et Bax à Bcl-2, ce qui induit par la suite l’apoptose [97, 98]. Dans des lymphocytes T effecteurs/mémoires humains, un manque d’IL-2 induit l’apoptose en diminuant l’expression de Mcl-1, Bcl-2 et Bcl-xL. L’IL-7 peut remplacer l’IL-2 et induire la survie de ces lymphocytes T en induisant les protéines Bcl-2 de survie. Cette survie pouvait être abrogée par des inhibiteurs de la voie JAK/STAT, mais pas de PI3K [95].
L’IL-7 a également la capacité de prévenir l’atrophie et l’apoptose des lymphocytes T en affectant leur métabolisme du glucose. En effet, des études in vitro ont démontré que l’IL-7 pouvait réguler l’expression du transporteur de glucose GLUT1 via une signalisation dépendante de la tyrosine Y449. Cette régulation dépendrait à la fois de STAT5 et de AKT [99].
4.4. Rôle de l’IL-7 dans l’auto-immunité
L’IL-7 semble avoir un rôle dans la pathologie de plusieurs maladies auto-immunes. En effet, un gène de polymorphisme pour l’IL-7R a récemment été associé à une susceptibilité à la sclérose en plaques [100]. Dans cette étude, il a également été montré que l’ARNm de ce gène et de celui de l’IL-7 sont surexprimés dans les patients avec cette maladie [100].
15 Dans un modèle murin d’experimental autoimmune encephalomyelitis (EAE), l’utilisation d’anticorps bloquant contre l’IL-7Rα réduisait la sévérité de la maladie. Cet effet bénéfique pouvait être corrélé avec une diminution des concentrations d’IL-17 dans le milieu ainsi que du pourcentage de lymphocytes Th17 effecteurs ayant infiltré le site inflammatoire [101]. Dans ce modèle, l’IL-7R signalait via la voie de JAK-STAT5.
L’IL-7 est également impliqué dans l’arthrite rhumatoïde. L’IL-7 est présent en concentrations plus élevées dans le liquide synovial de patients arthritiques [102] et ce niveau persiste même après le traitement avec des anti-TNF-α [103]. L’IL-7 stimule l’activation des macrophages et des lymphocytes T, ce qui mène à une production accrue de TNF-α et de métalloprotéinases dans le milieu [102, 104]. De plus, l’utilisation d’anticorps bloquant contre l’IL-7 inhibe le développement de l’arthrite dans un modèle murin d’arthrite induite par le collagène (CIA) [105]. Une autre étude suggère que l’amélioration de l’arthrite et de la dégradation osseuse dans ce modèle repose sur l’inhibition du recrutement des monocytes, de leur différenciation en ostéoclastes et de la vascularisation de l’articulation induite par l’IL-7R [106]. L’IL-7R est également exprimé de façon plus élevée chez les lymphocytes T de liquides synoviaux de patients arthritiques [104, 107]. L’IL-7 peut augmenter la production de RANKL dans les lymphocytes T effecteurs [108]. RANKL est une cytokine ostéoclastogénique dont la concentration peut être directement corrélée avec la dégradation osseuse. Lorsque l’IL-7 se lie à son récepteur sur des lymphocytes T effecteurs, ces derniers relâchent une plus grande quantité de RANKL dans le milieu, contribuant à la dégradation du cartilage et de l’os dans l’arthrite rhumatoïde [108, 109]. Tous ces résultats laissent penser que cette cytokine joue un rôle majeur dans le développement ou le maintien de la maladie, possiblement indépendamment de celui joué par le TNF-α. Malgré ces études, il n’est pas clair si l’IL-7 favorise le développement de l’auto-immunité en agissant sur la survie des lymphocytes T ou sur leurs capacités effectrices.
L’IL-7 n’est pas le seul élément du microenvironnement inflammatoire pouvant influencer l’activité des Th17. En effet, la matrice extracellulaire peut également stimuler les lymphocytes via les intégrines et il importe donc d’examiner son rôle.
16
5. Les intégrines
Les intégrines sont des molécules d’adhésion permettant les interactions entre les cellules et la membrane extracellulaire, ou entre deux cellules. Elles sont des hétérodimères α/β, et ce sont les différentes combinaisons entre les deux sous-unités qui amènent la spécificité du ligand reconnu par l’intégrine. La sous-unité β désigne la famille à laquelle appartient l’intégrine [110].
Une intégrine donnée peut lier plus d’un ligand, et un ligand peut reconnaître plus d’une intégrine. Par exemple, l’intégrine α1β1 lie à la fois le collagène et la laminine. À l’inverse, la fibronectine peut être reconnue par un grand nombre d’intégrines, dont α4β1, α5β1 et αvβ5 [111], pour n’en nommer que quelques-unes. Les intégrines peuvent également lier des ligands indépendants de la matrice extracellulaire.
Schéma 3 : Combinaison de différentes structures de sous-unités α et β
Tiré de : Intracellular signaling controlling integrin activation in lymphocytes [112]
Les intégrines sont exprimées de façon ubiquitaire. Les intégrines de la famille β1 et β3 sont présentes dans presque tous les types cellulaires et participent aux interactions avec la matrice extracellulaire, alors que les intégrines de la famille β2 se retrouvent uniquement chez les leucocytes et sont impliquées dans les contacts cellules-cellules [113].
17 Dans le cadre de ce travail, nous nous intéressons principalement aux intégrines liant le collagène dont les deux plus importantes sont α1β1 et α2β1. Le collagène est une protéine en forme de triple hélice et l’une des fibres principales de la matrice extracellulaire. Il existe de nombreux types de collagène. Le collagène de type I est le plus abondant et se retrouve dans les os et les tissus conjonctifs. Le collagène de type II se retrouve plutôt dans le cartilage. Finalement, le collagène de type IV est une des composantes de la membrane basale.
Deux facteurs régissent l’interaction entre une intégrine et son ligand, l’affinité et l’avidité, et sont donc essentiels à la régulation de l’activité des intégrines.
5.1. La régulation des intégrines
Une intégrine peut exister en trois états d’activation : inactif, partiellement actif et actif [114]. Afin d’être en mesure de lier son ligand, l’intégrine doit d’abord être dans un état actif. C’est entre autres le cas des intégrines retrouvées sur les cellules adhérentes, telles que les cellules épithéliales ou les fibroblastes, qui maintiennent leurs intégrines dans un état d’activation constante, leur permettant ainsi de lier la matrice extracellulaire. Chez les cellules circulatoires comme les leucocytes, les intégrines sont plutôt dans un état inactif. Afin d’adhérer à la matrice, les leucocytes doivent d’abord modifier l’état d’activation de leur intégrine, un phénomène qui est souvent engendré par l’activation du leucocyte lui-même. L’activation des intégrines est le résultat d’une signalisation intracellulaire qui vient modifier la conformation de la partie extracellulaire et augmente l’affinité des intégrines pour leur ligand. C’est un phénomène de signalisation appelé « inside-out » [115].
La signalisation « inside-out » régule l’avidité des intégrines. L’avidité est la capacité des intégrines à se regrouper, formant un agrégat dans une région membranaire nommé site d’adhésion focal [116]. La formation du site d’adhésion focal nécessite l’activation de la taline, qui fait le lien entre l’intégrine et le cytosquelette. Les signaux d’activation mènent au clivage de la taline, libérant l’intégrine du cytosquelette d’actine et permettant son
18
déplacement à la surface de la cellule [117]. Ceci concentre les intégrines en plaques d’adhésion pour la migration ou dans la synapse immunologique chez les lymphocytes T. Par ailleurs, Rap-1, une protéine appartenant à la famille de GTPases, est aussi importante dans l’affinité et l’avidité des intégrines [118]. Suite à la liaison de l’intégrine à son ligand, les intégrines recrutent les protéines kinases FAK et Src. Le complexe FAK/Src est également nécessaire pour la formation de la plaque d’adhésion focale [119]. Cette forme de régulation permet d’augmenter l’activité des intégrines, mais ne demande pas l’expression de nouvelles molécules.
5.2. Fonction des intégrines
Les intégrines furent d’abord étudiées pour leur fonction dans l’adhésion cellulaire et la régulation de la migration. De nos jours, elles sont également reconnues pour leur participation à la régulation de la prolifération cellulaire et de l’apoptose ainsi que pour leur potentiel comme molécules de costimulation [110, 113].
5.2.1. Migration
La migration cellulaire est un phénomène complexe qui demande la réorganisation du cytosquelette de la cellule. Elle se divise généralement en quatre étapes : l’extension des lamellipodes, la formation de plaques d’adhésion, la contraction du corps cellulaire, et le détachement de la queue [117]. Les intégrines interviennent dans la réorganisation du cytosquelette en activant des GTPases de la famille Rho, telles que Rac et Cdc42. Ces dernières sont impliquées dans la formation des filaments d’actine et de myosine [120]. De plus, les intégrines participent à la formation des plaques d’adhésion requises pour la migration [110].
5.2.2. Prolifération et survie
En plus de la migration cellulaire, il a été démontré que les intégrines étaient importantes pour la prolifération. Les cellules adhérentes comme les cellules épithéliales sont souvent
19 dépendantes de leur ancrage à la matrice extracellulaire. Chez ces cellules, les intégrines et les facteurs de croissance collaborent afin de maintenir les cellules en vie [121]. Par exemple, certains facteurs de croissance comme le VEGF (vascular endothelial growth
factor) et le EGF (epidermal growth factor) nécessitent une signalisation des intégrines afin
d’avoir leur plein effet [122, 123]. La seule présence du facteur de croissance ne suffit pas car si on empêche les cellules d’adhérer, aucune prolifération n’est observée [124].
Les intégrines sont également importantes pour la survie de certains types cellulaires, comme les cellules épithéliales et les cellules endothéliales. En effet, lorsque ces cellules perdent leur adhérence à la matrice extracellulaire, elles entrent en apoptose. Cette forme de mort cellulaire est nommée anoïkose et elle dépend de la voie de Fas [125, 126].
5.3. Signalisation des intégrines
Bien que les intégrines servent principalement de molécules d’adhésion, on sait depuis plusieurs années qu’elles peuvent induire une signalisation intracellulaire importante. Cette dernière débute avec leur agrégation en plaques d’adhésion. La partie cytoplasmique des intégrines ne possède pas de propriétés enzymatiques. Les agrégats permettent le recrutement de nombreuses molécules de signalisation. Les principales protéines kinases recrutées sont la kinase d’adhésion focale (FAK), la tyrosine kinase riche en proline 2 (PYK2) ainsi que des kinases de la famille Src, comme Fyn et c-Src. Le complexe FAK/Src est central à la signalisation induite par les intégrines. Le recrutement de FAK au site d’adhésion focale mène à son autophosphorylation. FAK est impliquée dans la liaison et l’activation de nombreux autres intermédiaires participants aux réarrangements du cytosquelette, plus particulièrement des fibres d’actine [124, 127, 128]. Par exemple, FAK active la paxilline et la tensine [124].
FAK contribue également au recrutement et à l’activation des kinases Src, qui augmentent son activation. Le complexe FAK/Src induit le recrutement d’autres molécules de signalisation, telles que Grb2 et Sos. Ces dernières activent Ras et la voie de MAP kinase ERK [129]. La voie MAPK/ERK peut également être activée via l’activation de PLCγ, qui
20
phosphoryle PKC. Ensuite, FAK/Src peut activer d’autres molécules adaptatrices, notamment Cas et Crk, ce qui mène à l’activation de Rho et de la voie JNK. Finalement, FAK peut activer directement la voie de PI3K, induisant la production de PIP3 et l’activation d’AKT. Cette dernière peut également être phosphorylée par ILK [130].
L’activation de ces voies régit les fonctions de prolifération, migration et activation cellulaires; ce ne sont pas toutes les voies qui sont activées par toutes les intégrines et la signalisation des intégrines peut aussi être dépendante du type cellulaire. Les fonctions d’une intégrine dépendent de la spécificité de sa signalisation.
21
Schéma 4 : Signalisation des intégrines
22
5.4. Expression des intégrines par les lymphocytes T
L’expression des intégrines par les lymphocytes T varie en fonction du stade d’activation de ces derniers.
Le lymphocyte T naïf retrouvé en circulation ou dans le ganglion lymphatique exprime d’abord les intégrines de la famille β2, telle que la LFA-1. L’interaction entre LFA-1 et son ligand ICAM-1 est importante pour la formation de la synapse immunologique avec les CPAs [113]. Les lymphocytes T naïfs expriment également α4β1, liant VCAM-1 ainsi que la fibronectine. Cette intégrine et LFA-1 jouent un rôle important dans la migration transendothéliale [132]. Il y a toutefois peu d’intégrines β1 exprimées sur les lymphocytes T naïfs dans les ganglions lymphatiques [110, 133]. La MEC n’y est pas aisément accessible puisqu’elle est recouverte par les fibroblastes réticulaires [133].
De nombreuses intégrines liant la MEC sont plutôt exprimées à de très hauts niveaux suite à l’activation des lymphocytes par le TCR. Ceci coïncide généralement avec le positionnement des lymphocytes T dans les tissus inflammatoires. C’est le cas des intégrines 31 et 61 qui lient la laminine et de l’intégrine 51 qui lie la fibronectine [134, 135]. Les intégrines liant le collagène incluant 11 et 21 ne sont pas exprimées par les lymphocytes T naifs, mais seulement par les lymphocytes T activés [136]. L’intégrine α1β1 lie préférentiellement le collagène de type IV alors que α2β1 lie le collagène de type I et II [136]. Les lymphocytes Th17 expriment α2β1, mais pas α1β1. [137]. Par contre, les deux intégrines peuvent se retrouver chez les Th1 [138, 139]. Ces deux intégrines liant le collagène régulent plusieurs fonctions des lymphocytes T effecteurs.
5.5. Rôle des intégrines liant le collagène comme molécules de
costimulation
L’interaction des intégrines avec la matrice n’affecte pas uniquement l’adhésion des lymphocytes et leur migration à travers celle-ci. En effet, la signalisation induite par la
23 liaison d’une intégrine à son ligand peut affecter d’autres fonctions cellulaires, tel que la prolifération ou l’activation des cellules.
Bien que des travaux antérieurs aient rapporté que les intégrines liant la fibronectine augmentaient la production d’IL-2 et la prolifération des lymphocytes T, on sait maintenant que ceci était dû à un simple effet d’adhésion[140, 141]. En fait, les cellules ensemencées dans les puits en présence d’anticorps anti-CD3 et de fibronectine étaient beaucoup plus étalées et, de ce fait, étaient en contact avec plus d’anticorps. L’effet de la fibronectine était perdu si les cellules étaient stimulées avec des billes anti-CD3. À l’inverse, le collagène costimule les lymphocytes T aussi bien en présence d’anticorps anti-CD3 immobilisé que soluble. Les travaux des dernières années ont montré que les intégrines de costimulation des lymphocytes T les plus importantes sont celles liant le collagène.
L’intégrine α2β1 est exprimée chez les lymphocytes T effecteurs, et peut régir leurs fonctions. L’adhésion des lymphocytes T activés au collagène de type I via l’intégrine
21 protège ces lymphocytes T de l’apoptose induite par Fas [142]. Sa liaison au collagène augmente la production d’IFN-γ induite par le CD3 chez les lymphocytes T effecteurs humains [10]. L’intégrine 21 augmente la production d’IFN- en activant la voie MAPK/ERK et en augmentant la voie de JNK et d’AKT activée par le CD3. Par contre, il semblerait que le collagène qui se lie à l’intégrine 11 ne soit pas capable d’augmenter la production d’IFN- car il est inapte à augmenter la voie JNK [10]. Les Th17 humains activés par le CD3 voient leur production d’IL-17A et F être induite par la liaison au collagène [10]. Cette induction amenée par α2β1 dépend de plusieurs voies de signalisation et peut être abrogée à l’aide d’inhibiteurs dirigés contre les voies MAPK/ERK, MAPK/p38 et PI3K/AKT [143]. L’intégrine α1β1 a également la capacité d’augmenter la production de RANKL dans des lymphocytes T effecteurs [108]. Elle peut également travailler en synergie avec l’IL-7 pour favoriser la survie des lymphocytes T effecteurs [108]. De même, l’intégrine 11 est importante pour la survie des lymphocytes T CD8 spécifiques aux virus de l’influenza [144]. En fait, la réponse immune contre ces virus est dépendante de l’intégrine 11 [144]. L’intégrine 21 ne serait pas importante pour cette réponse immune antivirale [145].
24
Des modèles in vivo ont également permis de démontrer l’importance de α2β1 dans la pathogénèse de certaines maladies. Dans l’articulation, le collagène de type I est une composante majeure de l’os et du pannus, et le collagène de type II se retrouve dans le cartilage. Les propriétés costimulatrices des intégrines pouvaient donc jouer un rôle dans l’arthrite rhumatoïde. En effet, dans un modèle d’arthrite induite par le collagène (CIA, pour collagen induced arthritis), l’utilisation d’un anticorps bloquant dirigé contre l’intégrine α2β1 diminue le développement de la maladie en réduisant le nombre de Th17 dans l’articulation et en abaissant les niveaux d’IL-17 [143]. Par ailleurs, dans un modèle EAE, le blocage de l’intégrine 21 réduit aussi la maladie, mais le mécanisme n’a pas été investigué [146]. Le blocage de l’intégrine 11 réduit également l’arthrite, mais son effet serait lié à l’activation et à l’adhésion des monocytes [147].
6. But du travail
Les milieux inflammatoires chroniques imposent un stress oxydatif important sur le TCR, ce qui peut causer un défaut de signalisation dans ce dernier [73]. Afin de bien comprendre le rôle que peuvent jouer les lymphocytes Th17 dans des maladies inflammatoires chroniques telle que l’arthrite rhumatoïde, il convient donc d’investiguer quels autres récepteurs pourraient être responsables de leur activation.
Il a déjà été démontré que la liaison de l’intégrine α2β1 au collagène pouvait costimuler la production d’IL-17 par les Th17 [137] et que le blocage de l’intégrine α2β1 dans un modèle murin d’arthrite réduisait la sévérité de la maladie en diminuant l’activité des Th17 [143]. L’IL-7 est bien connu pour son rôle dans la prolifération, la différenciation et la survie des lymphocytes T [148]. Elle a également été décrite comme une cytokine immunopathogénique majeure de l’arthrite rhumatoïde [149]. De plus, nous avons démontré que l’IL-7 et l’intégrine α1β1 pouvaient costimuler la production de RANKL chez des lymphocytes T effecteurs [108]. Nous avons donc émis l’hypothèse que la coopération entre l’IL-7R et l’intégrine α2β1 peut être suffisante pour activer les Th17.
25 En utilisant le modèle de Th17 humains différenciés à partir de lymphocytes T naïfs du sang périphérique de donneurs sains (REF 23-24), nous avons d’abord déterminé l’expression des récepteurs IL-7R et α2β1 sur les Th17. Ensuite, nous avons évalué la capacité de ces deux récepteurs à induire la production d’IL-17. Enfin, nous voulions aussi déterminer l’apport de certaines voies de signalisation qui seraient activées par l’IL-7R et α2β1.
27
Chapitre II : Matériels et méthodes
Différenciation des lymphocytes Th17
Les lymphocytes T humains polarisés furent obtenus à partir du sang périphérique de donneurs sains. Les cellules mononucléées furent d’abord récoltées sur un gradient Ficoll, puis les lymphocytes CD4+ naïfs furent isolés à l’aide d’un kit de sélection négative à billes magnétiques (StemCell Technologies, Vancouver, BC, Canada) en suivant les instructions du manufacturier. Des lymphocytes Th17 furent ensuite générés en activant les cellules T CD4+ naïves pendant 6 jours avec des billes anti-CD3/CD28 (2 billes/cellules) dans du milieu X-Vivo 15 sans sérum et en présence des cytokines TGF-β (10 ng/ml), IL-1β (10 ng/ml), IL-6 (20 ng/ml) et IL-23 (100 ng/ml). Tel que précédemment rapporté, ces cellules expriment le facteur de transcription RORc, le récepteur à l’IL-23 et CCR6. De plus, elles produisent de l’IL-17 après activation. [137]
Stimulation des lymphocytes Th17 et analyse par cytométrie de flux
Les lymphocytes Th17 polarisés furent mis en culture sur une matrice de collagène I ou de fibronectine, déposée au fond du puits et incubée overnight à 4 ͦC, avec de l’IL-7 human soluble (10 ng/ml) en présence de 5 µg/ml de GolgiPlug contenant de la brefeldin A (BD Biosciences, San Diego, CA, USA) qui permet de bloquer la sécrétion de cytokines. Les cellules furent par la suite lavées, puis marquées avec un anti-α2 integrin-PE et un anti-IL-7Rα-Alexa 488. Les cellules furent relavées, fixées et perméabilisées avec un kit CytoFix/CytoPerm (BD Biosciences, San Diego, CA, USA) et marquées pour l’IL-17 intracellulaire avec un anti-IL-17-Alexa 647. Ces cellules furent analysées par cytométrie en flux (BD FACSCalibur). Des cellules marquées avec un anticorps isotypique servirent de contrôle.
28
Mesure des cytokines par test ELISA
Les cellules polarisées Th17 humaines furent également activées en absence de GolgiPlug et la production d’IL-17 fut mesurée dans le surnageant cellulaire par ELISA, suivant les instructions du manufacturier.
Mesure de la phosphorylation de STAT-5 et d’ERK par immunobuvardage
Les lymphocytes humains polarisés Th17 furent activés sur une matrice de collagène en présence ou absence d’IL-7 humain soluble, en utilisant un million de cellules par point. Après stimulation, les cellules furent récoltées, lavées puis lysées. La lyse fut effectuée en plaçant les cellules dans un tampon RIPA pour 15 minutes. Les cellules ont ensuite été centrifugées à 4 ͦC pendant 10 minutes. Les protéines étaient récupérées pour la séparation sur gel SDS-PAGE. L’activation de STAT-5, AKT et ERK fut déterminée par immunobuvardage à l’aide d’anticorps spécifiques aux formes phosphorylées de ces protéines. Un deuxième sondage fut ensuite effectué sur le gel strippé avec des anticorps anti-β-actine, anti-AKT et anti-ERK2, tel qu’indiqué, pour assurer un chargement égal des puits.
29
Chapitre III : Résultats
L’IL-7R et α2β1 sont coexprimés sur les lymphocytes humains polarisés
Th17.
Nous avons d’abord examiné l’expression de l’IL-7Rα et de la chaîne α2 intégrine sur des lymphocytes humains polarisés Th17. L’expérience de cytométrie en flux démontre qu’une proportion élevée de lymphocytes expriment à la fois l’IL-7R et l’intégrine α2. (Figure 1) Nous avons donc évalué si ces deux récepteurs étaient également coexprimés chez les cellules productrices d’IL-17. Pour ce faire, les cellules furent stimulées avec PMA et ionomycine pendant six heures afin de capturer la production d’IL-17, puis l’expression de l’IL-7R et de l’intégrine α2 fut mesurée sur ces cellules (Fig 1). Il est à noter que la stimulation par le PMA+ionomycin ne modifie pas l’expression de chacun de ces deux récepteurs sur les lymphocytes T [137]. La vaste majorité des cellules productrices d’IL-17 (Th17) expriment à la fois l’IL-7R et l’intégrine α2 (Fig 1A). Une analyse de l’expression de ces récepteurs sur cinq donneurs différents indique qu’entre 69% et 95% des lymphocytes Th17 sont positifs pour les deux récepteurs (Fig 1B). Tel qu’attendu, presque toutes les cellules exprimaient la chaîne β1 des intégrines, qui s’associe à la chaine α2 pour former l’intégrine α2β1. Ces résultats démontrent que les lymphocytes Th17 coexpriment l’IL-7R et l’intégrine α2β1.
30
Figure 1 : L’IL-7R et l’intégrine α2β1 sont coexprimés sur les lymphocytes Th17 humains.
(A) Expression de l’IL-7R/α2β1 sur des lymphocytes humains polarisés Th17. Les cellules furent marquées avec un
anticorps anti-intégrine α2-PE et anti-IL-7R-Alexa 488, puis analysées par cytométrie de flux. (B) Association entre l’IL-7R/α2β1 et les lymphocytes Th17. Les cellules humaines polarisées Th17 furent restimulées avec PMA/ionomycine en présence de Brefeldin A. Les cellules furent lavées puis marquées avec un anticorps anti-intrégrine α2-PE et anti-IL-7R-Alexa 488. Les cellules furent ensuite lavées, fixées/perméabilisées, puis marquées avec un anticorps anti-IL-17-anti-IL-7R-Alexa 647 pour détecter l’IL-17 intracellulaire. Les cellules furent analysées par cytométrie de flux. Afin de déterminer les pourcentages de Th17 double positifs, les cellules IL-17+ furent d’abord sélectionnées, et l’analyse FACS fut conduite sur ces dernières. Les profils de cytométrie de flux sont représentatifs de cinq donneurs différents. L’histogramme représente les pourcentages de cellules coexprimant l’intégrine α2β1 et l’IL-7R sur les Th17 polarisés à partir de lymphocytes T provenant du sang périphérique de cinq donneurs différents.
31
La liaison d’IL-7R et de l’intégrine α2β1 par leur ligand active les
lymphocytes Th17 humains.
Afin de déterminer la capacité de l’IL-7 et du collagène à activer les lymphocytes Th17, les cellules furent cultivées sur une matrice de collagène, en absence ou présence d’IL-7, puis le nombre de cellules productrices d’IL-17 fut déterminé par cytométrie en flux. L’IL-7 et le collagène sont tous deux capables de stimuler la production d’IL-17 chez les lymphocytes Th17. De 4 à 5% des cellules devinrent productrices suite à chacun des stimuli (Fig 2A). De plus, une combinaison d’IL-7 et de collagène menait à la détection d’environ 12% de cellules productrices d’IL-17. L’analyse des Th17 sur cinq donneurs différents indiquent que l’IL-7 ou le collagène ont une capacité d’activation des Th17 égale et qu’une combinaison des deux amenait une production 2 à 3 fois plus élevée qu’avec un stimulus seul (Fig 2A). Des résultats similaires furent obtenus lorsque nous avons mesuré par ELISA la production d’IL-17 dans le surnageant des cultures cellulaires (Fig 2B). Ces résultats montrent que l’IL-7R et l’intégrine α2β1 ont coopéré de façon additive ou synergique pour augmenter la production d’IL-17 dans des lymphocytes Th17 humains.
32
Figure 2 : Le collagène coopère avec l’IL-7 pour augmenter la production d’IL-17
(A) Des lymphocytes humains polarisés Th17 furent laissés non traités (NT) ou activés dans des puits contenant une
matrice de collagène I 10 µg/ml (Col), en présence ou absence d’IL-7 soluble (10 ng/ml) pendant douze heures, et ce en présence de Brefeldin A. Les cellules furent ensuite lavées, fixées/perméabilisées, puis marquées avec un anticorps anti-IL-17-Alexa 647 ou un anticorps contrôle isotypique, avant d’être analysées par cytométrie de flux. Le panneau de gauche représente un profil typique en cytométrie de flux et le panneau de droite représente les valeurs moyennes des cellules positives pour l’IL-17 de cinq expériences indépendantes, à partir de lymphocytes T provenant du sang péripherique de cinq donneurs différents (n=5). (B) Les niveaux d’IL-17 furent mesurés par ELISA dans des surnageants de Th17 activées par le collagène et l’IL-7 (n=5). Les données de (A; panneau de droite), (B), (C), (D) sont des valeurs moyennes +/- ESM. * p < 0.05 lorsque comparé aux échantillons NT. ** p < 0.05 lorsque comparé aux échantillons traités à l’IL-7 ou à Col.
La fibronectine n’a pas d’effet sur l’activation des lymphocytes Th17.
Puisque la fibronectine est également une composante importante de la matrice extracellulaire, nous avons comparé les effets de celle-ci avec ceux du collagène. Les résultats démontrent que le collagène peut induire une production d’IL-17 à partir de concentrations de 5 µg/ml et que son effet maximal est atteint à une concentration de 10-20 µg/ml (Fig 3A). La matrice de fibronectine n’avait au contraire aucun effet sur la
33 production d’IL-17, quelle que soit sa concentration et même en combinaison avec l’IL-7 (Fig 3B). Ces résultats indiquent un rôle majeur de la voie de signalisation du collagène via l’intégrine α2β1 dans les fonctions du Th17.
Figure 3 : La fibronectine n’a aucun effet sur l’activation des lymphocytes Th17.
(A) Le collagène (Col), mais pas la fibronectine (Fbn), induit la production d’IL-17 tel que mesuré par marquage
intracellulaire et cytométrie de flux (n=5). (B) La fibronectine n’augmente pas la production d’IL-17 induite par l’IL-7 dans des cellules Th17 humaines (n=5). Les données de (A) et (B) sont des valeurs moyennes +/- ESM. * p < 0.05 lorsque comparé aux échantillons NT ou traités à Fbn. ** p < 0.05 lorsque comparé aux échantillons traités à l’IL-7 ou à Col.
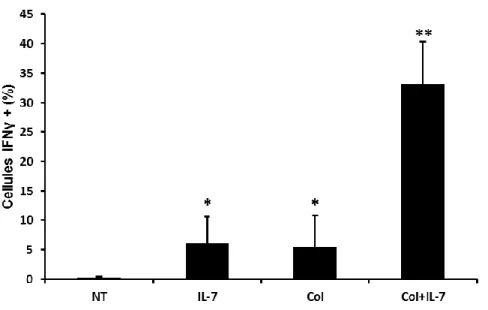
La liaison d’IL-7R et de l’intégrine α2β1 par leur ligand augmente
également la production d’IFN-γ par les lymphocytes Th17 humains.
Les Th17 ont également la capacité de produire d’autres cytokines pro-inflammatoires, tel que l’IFN-γ. Nous avons donc investigué si la coopération fonctionnelle entre l’intégrine α2β1 et l’IL-7R se limitait à l’IL-17 en étudiant la capacité de ces deux récepteurs à augmenter la production d’IFN- γ chez les lymphocytes Th17 humains. L’IL-7 et le collagène sont tous deux capables de stimuler la production d’IL-17 chez les lymphocytes Th17. Environ 10% des cellules devinrent productrices d’IFN- γ suite à chacun des stimuli (Fig 4A). De plus, une combinaison d’IL-7 et de collagène menait à la détection de 25-30% de cellules productrices (Fig 4A). La coopération fonctionnelle entre l’intégrine α2β1 et l’IL-7R peut donc mener à la production d’autres cytokines que l’IL-17, tel que l’IFN-γ.
34
Figure 4 : Le collagène coopère avec l’IL-7 pour augmenter la production d’IFN-γ.
(A) Des lymphocytes humains polarisés Th17 furent laissés non traités (NT) ou activés dans des puits contenant une
matrice de collagène I 10 µg/ml (Col), en présence ou absence d’IL-7 soluble (10 ng/ml) pendant douze heures, et ce en présence de Brefeldin A. Les cellules furent ensuite lavées, fixées/perméabilisées, puis marquées avec un anticorps anti-IFN-γ-PE ou un anticorps contrôle isotypique, avant d’être analysées par cytométrie de flux. Le graphique représente les valeurs moyennes des cellules positives pour l’IL-17 de cinq expériences indépendantes, à partir de lymphocytes T provenant du sang périphérique de quatre donneurs différents (n=4). Les données sont des valeurs moyennes +/- ESM. * p < 0.05 lorsque comparé aux échantillons NT. ** p < 0.05 lorsque comparé aux échantillons traités à l’IL-7 ou à Col.
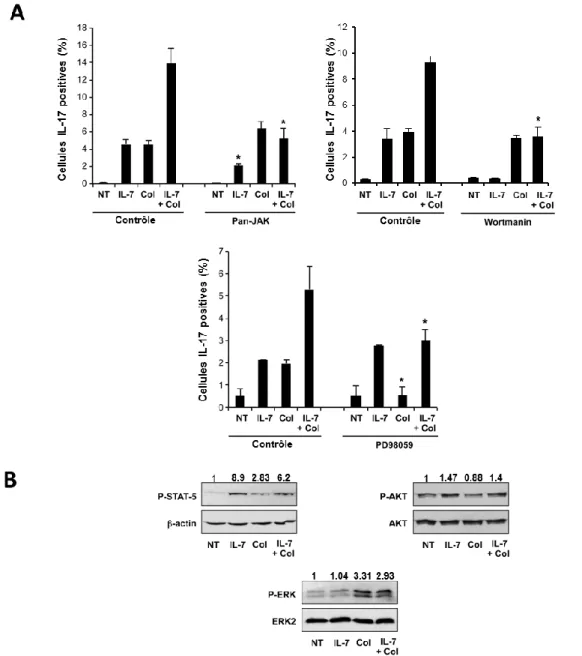
L’IL-7R et l’intégrine α2β1 augmentent la production d’IL-17 via
JAK/STAT5 et MAPK/ERK, respectivement.
Afin de déterminer les mécanismes intracellulaires par lesquels l’IL-7R et α2β1 coopèrent pour activer les Th17, nous avons étudié les voies de signalisation activées par ces deux récepteurs. Le récepteur de l’IL-7 est associé aux voies de JAK/STAT et de PI3K/AKT [91] et il a déjà été démontré que STAT5 est l’isoforme majeur activé par l’IL-7 dans les lymphocytes T mémoires ou effecteurs. [91] L’intégrine α2β1 et le collagène ont tous deux également la capacité d’activer les voies des MAPK/ERK et de PI3K/AKT [137]. Nous avons examiné la contribution de ces voies à l’aide d’inhibiteurs spécifiques à chacune de ces voies.
35 Le traitement des lymphocytes T humains polarisés Th17 avec des inhibiteurs dirigés contre JAK (pan-JAK) et contre PI3K (wortmanin) réduisait le nombre de cellules productrices d’IL-17 dans les cellules traitées à l’IL-7, mais n’eut aucun effet sur la stimulation par le collagène (Fig 5A). L’utilisation d’un inhibiteur de MAPK/ERK (PD98059) diminuait plutôt la quantité de cellules productrices d’IL-17 dans les cellules activées par le collagène, mais n’affectait pas l’effet de l’IL-7 (Fig 5A).
L’activation de STAT5, de PI3K/AKT et de MAPK/ERK a ensuite été analysée par immunobuvardage. La stimulation par l’IL-7 induit la phosphorylation de STAT5 qui est légèrement diminuée par le collagène (Fig 5B). L’IL-7, seul ou combiné au collagène, augmentait la phosphorylation d’AKT. De plus, seul le collagène augmentait la phosphorylation d’ERK. Ces résultats suggèrent que la coopération fonctionnelle entre l’intégrine α2β1 et l’IL-7R implique l’interaction de nombreuses voies de signalisation.