T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l’Université Paul Sabatier Discipline ou spécialité : Génie Civil
JURY
ARLIGUIE Ginette Professeur, Université Paul Sabatier Examinatrice BALAYSSAC Jean-Paul Professeur, Univeristé Paul Sabatier Président ESCADEILLAS Gilles Professeur, Université Paul Sabatier Examinateur FAJARDO Gerardo Docteur, Université Autonoma Nuevo Leon Examinateur GALLIAS Jean-Louis Professeur, Université de Cergy Pontoise Rapporteur PRINCE William Professeur, INSA de Rennes Rapporteur
Ecole doctorale : Mécanique, Energétique, Génie civil, Procédés (MEGeP) Unité de Recherche : Laboratoire Matériaux et Durabilité des Constructions (LMDC)
Directeurs de Thèse : Pr. ARLIGUIE Ginette et Pr. ESCADEILLAS Gilles Présentée et soutenue par AL HAJJAR Hikmat
Le 23 juin 2008
Titre :
APPLICABILITE ET EFFICACITE D’UNE PROTECTION GALVANIQUE AUX ACIERS DE PRECONTRAINTE
L’objectif de ce travail consiste à évaluer les avantages et les inconvénients de l’application d’une protection cathodique par anode sacrificielle sur des éléments en béton précontraint et de faire une comparaison avec la protection cathodique par courant imposé.
On s’intéressera particulièrement à vérifier si ces systèmes de protection peuvent vraiment protéger les aciers en diminuant leur vitesse de corrosion, et éventuellement donner la possibilité de les repassiver.
Pour réaliser cette étude, nous avons choisi deux types de corps d’épreuve : des poutrelles de béton en acier précontraint par pré-tension et des éprouvettes (modèles) de béton fabriquées au laboratoire avec des aciers d’armatures courants (HA), des aciers à haute résistance pour la précontrainte (HR), préalablement corrodés ou non et avec ou sans application de protection cathodique.
Afin d’accélérer la corrosion, une agression chimique a été simulée soit par immersion partielle des corps d’épreuve dans une solution saline de NaCl de 35g/l, soit par ajout de 2% ppc de Cl- (sous la forme NaCl).
Un courant galvanique, qui offre aux aciers un potentiel inférieur à -800 mV vs SCE et une dépolarisation supérieure à 100 mV après un temps de 4 heures, a été appliqué sur les poutrelles en béton précontraint et sur les éprouvettes modèles. Un autre système de protection par courant imposé, de densité 5mA/m² de la surface active de l’acier, a été appliqué sur les éprouvettes modèles.
Les résultats obtenus montrent que le courant galvanique appliqué sur les poutrelles en béton précontraint peut augmenter les potentiels d’acier mesurés 24 heures après la déconnexion de l’anode sacrificielle, spécialement dans la zone intermédiaire. L’application de courant galvanique aux éprouvettes modèles augmente ces potentiels seulement dans le cas où les aciers étudiés ne sont pas corrodés avant le traitement. Enfin, l’application d’un courant imposé de 5mA/m² de la surface active de l’acier aux éprouvettes modèles était, en général, plus efficace.
La prévention galvanique a diminué la vitesse de corrosion des éprouvettes modèles, et aussi des poutrelles en béton précontraint dans la zone intermédiaire et dans la zone immergée proche de l’anode. La prévention cathodique par courant imposé de 5 mA/m² appliqué sur des éprouvettes modèles diminue significativement la vitesse de corrosion. Cette diminution est beaucoup moins importante en appliquant la même densité de courant sur des éprouvettes modèles fabriquées avec des aciers corrodés.
Les réponses d’impédance électrochimique prouvent que le courant de protection peut, dans tous les cas, modifier les caractères électrochimiques de l’acier et de l’interface acier béton. L’observation visuelle montre que la prévention cathodique peut diminuer la corrosion des aciers. Cependant les valeurs des mesures électrochimiques indiquent, dans certains cas, un état de corrosion exagéré.
Mots clés : protection galvanique, protection cathodique, maintenance électrochimique, béton précontraint, corrosion, impédance électrochimique..
AUTEUR: Hikmat AL HAJJAR
TITRE : APPLICABILITE ET EFFICACITE D’UNE PROTECTION GALVANIQUE AUX ACIERS DE PRECONTRAINTE
DIRECTEURS DE THESE : Mme Ginette ARLIGUIE, Professeur à l’Université Paul Sabatier M. Gilles ESCADEILLAS, Professeur à l’Université Paul Sabatier
The objective of this work is to evaluate the advantages and disadvantages of applying a cathodic protection by sacrificial anode on elements in concrete and make a comparison with cathodic protection by imposed current. It will focus particularly to verify if these protection systems can really protect steels by reducing the corrosion rate.
To carry out this study, two types specimens were selected: beams of prestressed concrete (pre-tension ) and samples (models) of concrete produced in the laboratory with high adhesion (HA) and high-strength (HR) steels reinforcement, previously corroded or not and with or without the application of cathodic protection.
To accelerate corrosion, a chemical attack was simulated by partial immersion of specimens in a saline solution of NaCl 35 g/l, either by adding 2% ppc Cl- (in the form NaCl). A galvanic current, which offers a potential steel less than -800 mV vs SCE and a depolarization, a toff = 4 h, greater than 100 mV, was applied to prestressed beams and model
specimens. Another system of protection by imposed current, with density equal to 5mA / m² of the active surface of the steel, has been applied to test models.
The results show that the galvanic current applied to pre-stressed beams can increase the potential of steel measured 24 hours after the disconnection of sacrificial anode, especially in the intermediate zone. Thus, the application of galvanic current to model specimens increases these potential if the steel is not corroded before treatment. Moreover, applying a current of 5 mA / m² of the active surface of steel to the model specimens was in general more effective. Galvanic prevention reduces corrosion rate of model specimens and pre-stressed beams in the intermediate zone and the area submerged near the anode. Cathodic prevention applied to model specimens significantly reduces the corrosion rate. This reduction is much less important in applying the same current density on model specimens prepared with corroded steel.
Electrochemical impedance spectra prove that in any case, the current protection may modify the electrochemical characters of steel and concrete - steel interface. The visual observation shows that galvanic prevention can reduce steel corrosion. But in some cases, the electrochemical values indicate a much exaggerated state of corrosion.
Keywords: galvanic protection, cathodic protection, electrochemical maintenance, concrete, corrosion, electrochemical impedance
AUTHOR: Hikmat AL HAJJAR
TITLE: APPLICABILITY AND EFFICIENCY OF GALVANIC PROTECTION
TO PRESTRESSED STEEL
DIRECTORS OF THESIS: Mme Ginette ARLIGUIE, Professor at Paul Sabatier University M. Gilles ESCADEILLAS, Professor at Paul Sabatier University
Je voudrais en premier lieu remercier mes directeurs de thèse Mme
Mme
Mme Ginette
Mme
Ginette
Ginette
Ginette
ARLIGUIE
ARLIGUIE
ARLIGUIE
ARLIGUIE et M. Gilles ESCADEILLAS
M. Gilles ESCADEILLAS
M. Gilles ESCADEILLAS
M. Gilles ESCADEILLAS, et leur exprimer ma profonde gratitude de
m’avoir fait confiance pour mener à terme ce travail sous leur direction. Leurs
conseils scientifiques, leur soutien durant la rédaction ainsi que tout le temps qu’ils
m’ont consacré, ont été infiniment précieux.
Je remercie chaleureusement M. Jean
M. Jean
M. Jean----Paul
M. Jean
Paul
Paul
Paul BALAYSSAC
BALAYSSAC
BALAYSSAC
BALAYSSAC qui m'a fait l'honneur de
présider le jury de soutenance.
Je tiens aussi à exprimer ma reconnaissance à M.
M.
M. Jean
M.
Jean
Jean
Jean----Louis
Louis
Louis
Louis GALLIAS et M.
GALLIAS et M.
GALLIAS et M.
GALLIAS et M.
William
William
William
William PRINCE
PRINCE
PRINCE d'avoir accepté la responsabilité de rapporter et de juger ce travail.
PRINCE
Mes remerciements et ma grande gratitude s’adressent à
Gerardo FAJARDO SAN Gerardo FAJARDO SAN Gerardo FAJARDO SAN Gerardo FAJARDO SAN MIGUEMIGUEMIGUE
MIGUE, , , ,
qui
m’a fait aussi l’honneur d’être membre du jury
, , , ,pour son aide et ses
conseils judicieux depuis le stage de DEA et jusqu’ à la fin de cette thèse.
A tous les professeurs et cadres qui ont contribué à ma formation de près ou de loin.
Je remercie également le gouvernement de la Syrie pour son soutien financier ce qui
m’a donné les moyens de bien m’installer en France.
Je tiens à remercier profondément l’ensemble des membres du Laboratoire
Matériaux et Durabilité des Constructions.
Enfin, je dédie ce modeste travail à ma famille en Syrie, sans oublier mes amis qui
ont marqué ma vie : Bassim, Chadi, Houda, Darine, et ceux qui étaient toujours à
coté de moi : Sid Ahmad, Maroin, Sam, Samer, Firas.
SOMMAIRE
INTRODUCTION GENERALE………...1
CHAPITRE I : SYNTHESE BIBLIOGRAPHIQUE………...7
I. INTRODUCTION ... 8
II. CORROSION DES ACIERS DANS LE BETON... 8
II.1 INTRODUCTION... 8
II.2 NATURE ELECTROCHIMIQUE DE LA CORROSION... 10
II.2.1 Généralités ... 10
II.2.2 Conditions d'immunité [4]... 12
II.2.3 Formation d'hydrogène ... 13
II.3 PASSIVATION ET DEPASSIVATION DES ACIERS DANS LE BETON... 13
II.3.1 Passivation ... 13
II.3.2 Dépassivation ... 14
II.4 CORROSION DES OUVRAGES EN BETON PRECONTRAINT... 27
II.5 CORROSION DANS LES ENVIRONNEMENTS MARINS... 29
II.6 STRATEGIES D’INVESTIGATION D’UNE STRUCTURE EN BETON ARME CORRODE... 31
III. TECHNIQUES DE MAINTENANCE... 32
III.1 INTRODUCTION... 32
III.2 TECHNIQUES NON ELECTROCHIMIQUES... 33
III.2.1 Réparation traditionnelle ... 33
III.2.2 Revêtements de l’acier ... 33
III.2.3 Revêtements en surface du béton... 34
III.2.4 Inhibiteurs de corrosion ... 34
III.2.5 Epoxy-coatings (peinture Epoxy) ... 35
III.3 TECHNIQUES ELECTROCHIMIQUES DE MAINTENANCE ET REPARATION... 36
III.3.1 Protection cathodique ... 36
III.3.2 Extraction électrochimique des ions chlores... 45
III.3.3 Réalcalinisation du béton carbonaté... 47
III.4 EFFETS SECONDAIRES DES TECHNIQUES ELECTROCHIMIQUES... 48
III.4.1 Production d’hydrogène sur la surface d’acier ... 49
III.4.2 Diminution de l’adhérence acier-béton... 49
III.4.3 Initiation et accélération de réaction alcali-silice ... 50
IV. TECHNIQUES D’ETUDE DE LA CORROSION DES ACIERS DANS LE BETON ... 52
IV.2 METHODES TRADITIONNELLES... 53
IV.2.1 Dosages en chlorures ... 53
IV.2.2 Mesures de la résistivité ... 53
IV.2.3 Profondeur de carbonatation ... 56
IV.2.4 Potentiel de corrosion ... 56
IV.2.5 Résistance de polarisation... 59
IV.3 IMPEDANCE ELECTROCHIMIQUE DE L’INTERFACE ACIER-BETON... 64
IV.3.1 Généralités ... 64
IV.3.2 Circuit électrique équivalent ... 66
IV.3.3 Circuits électriques équivalents au système acier-béton... 67
IV.3.4 Description des spectres d’impédance du système acier–béton ... 69
IV.4 AUTRES METHODES... 76
V. CONCLUSION ... 76
CHAPITRE 2 : PROGRAMME EXPERIMENTAL………..…80
I. INTRODUCTION ... 79
II. EPROUVETTES ETUDIEES ... 79
II.1 EPROUVETTES EN BETON PRECONTRAINT... 79
II.1.1 Corps d’épreuve ... 79
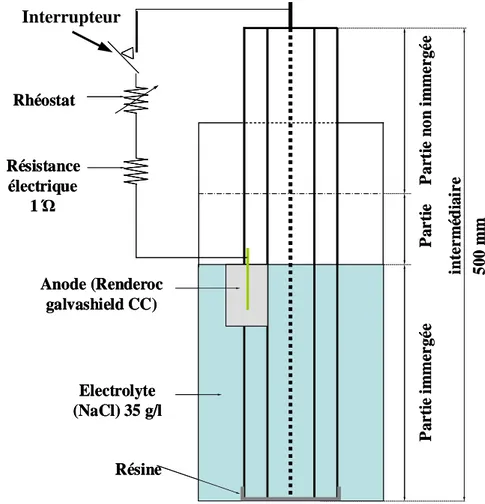
II.1.2 Application de la protection cathodique par anode sacrificielle (protection galvanique)... 80
II.1.3 Contrôle de la protection galvanique... 81
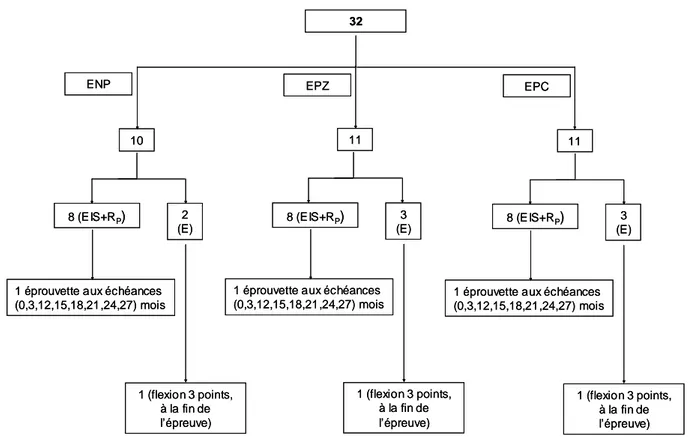
II.1.4 Références des éprouvettes... 82
II.1.5 Bilan des éprouvettes en béton précontraint utilisées ... 82
II.1.6 Préparation des éprouvettes pour effectuer les mesures ... 83
II.2 EPROUVETTES MODELES... 83
II.2.1 Matériaux utilisés ... 83
II.2.2 Formulation de béton ... 85
II.2.3 Introduction des chlorures ... 85
II.2.4 Préparation des éprouvettes... 86
II.2.5 Application de la protection cathodique ... 87
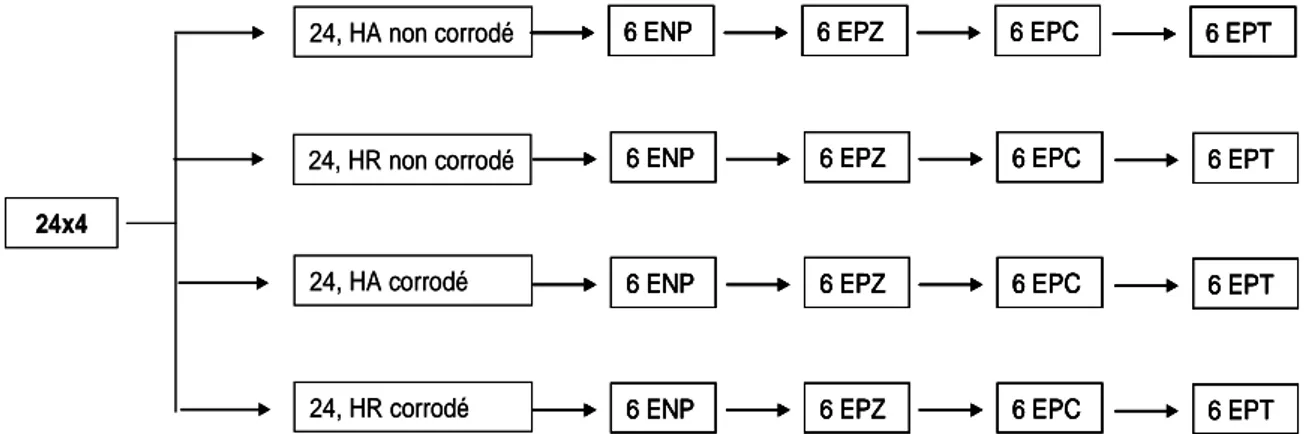
II.2.6 Références des éprouvettes... 88
II.2.7 Bilan des éprouvettes modèles utilisées ... 89
II.3 CARACTERISTIQUES DES ANODES UTILISEES... 89
II.3.1 Lame et barre de zinc ... 89
II.3.2 Renderoc Galvashield CC ... 90
II.4 TECHNIQUES EXPERIMENTALES UTILISEES... 90
II.4.1 Caractérisation du béton utilisé ... 90
III. ESSAIS PRELIMINAIRES POUR LA MISE EN ŒUVRE DE LA TECHNIQUE
D’IMPEDANCE ... 95
III.1 INTRODUCTION... 95
III.2 RESULTATS EXPERIMENTAUX PRELIMINAIRES... 98
III.2.1 Béton d’enrobage ... 98
III.2.2 Type d’aciers ... 102
III.2.3 Présence des ions chlore ... 104
III.2.4 Polarisation de l’acier ... 105
III.3 CONCLUSIONS... 106
IV. CONCLUSION ... 107
CHAPITRE 3 : EFFICACITE DE LA PROTECTION GALVANIQUE APPLIQUEE AUX ELEMENTS EN BETON PRECONTRAINT………..111
I. INTRODUCTION ... 110
II. EVOLUTION DES PARAMETRES ELECTROCHIMIQUES ... 111
II.1 POTENTIEL DE L’ACIER... 111
II.1.1 Dépolarisation des aciers... 111
II.1.2 Evolution du potentiel de l’acier ... 112
II.2 VITESSE DE CORROSION... 119
II.3 RELATION « POTENTIEL - VITESSE DE CORROSION » ... 121
II.4 IMPEDANCES ELECTROCHIMIQUES... 123
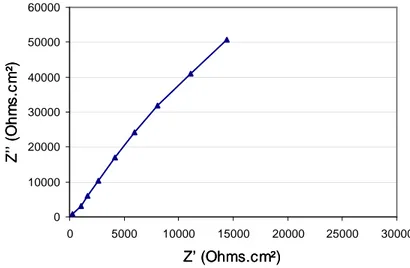
II.4.1 Diagrammes d’impédance... 123
II.4.2 Résultats obtenus... 127
II.5 COMPARAISON DE LA DENSITE DE COURANT DE CORROSION... 131
III. EFFET DU CHAMP ELECTRIQUE SUR LA CONCENTRATION EN IONS CHLORE TOTAUX A LA SURFACE DE L’ACIER ... 132
IV. OBSERVATIONS MACROSCOPIQUES ET MICROSCOPIQUES ... 133
V. EFFETS SECONDAIRES EVENTUELS LIES AUX SYSTEMES DE PROTECTION.. 135
V.1 INITIATION DE REACTION ALCALI GRANULAT ET FORMATION D’ETTRINGITE... 135
V.2 PRODUCTION D’HYDROGENE A L’ACIER... 136
V.3 CHANGEMENT DE COMPORTEMENT MECANIQUE DE POUTRELLES EN BETON PRECONTRAINT 137 VI. SYNTHESE... 138
CHAPITRE 4 : COMPARAISON DES DIFFERENTS TYPES DE PREVENTION
CATHODIQUE APPLIQUES A DES EPROUVETTES MODELES………142
I. INTRODUCTION ... 142
II. EVOLUTION DES PARAMETRES ELECTROCHIMIQUES ... 142
II.1 POTENTIEL DE L’ACIER... 142
II.1.1 Acier de type HA ... 143
II.1.2 Acier de type HR ... 144
II.2 RESISTANCE DE POLARISATION ET VITESSE DE CORROSION... 145
II.2.1 Acier de type HA ... 146
II.2.2 Acier de type HR ... 147
II.3 IMPEDANCES ELECTROCHIMIQUES... 147
II.3.1 Diagramme d’impédance ... 148
II.3.2 Principaux résultats électrochimiques ... 155
III. AUTRES ANALYSES... 159
III.1 EFFET DU CHAMP ELECTRIQUE SUR LA CONCENTRATION EN IONS CHLORE TOTAUX A LA SURFACE DE L’ACIER... 159
III.2 EXAMENS VISUELS... 159
IV. SYNTHESE... 161
CHAPITRE 5 : COMPARAISON DES DIFFERENTS TYPES DE PROTECTION CATHODIQUE POUR DES EPROUVETTES MODELES………...164
I. INTRODUCTION ... 164
II. EVOLUTION DES PARAMETRES ELECTROCHIMIQUES ... 164
II.1 POTENTIEL DE L’ACIER... 164
II.1.1 Acier de type HA ... 164
II.1.2 Acier de type HR ... 166
II.2 RESISTANCE DE POLARISATION ET VITESSE DE CORROSION... 167
II.2.1 Acier de type HA ... 167
II.2.2 Acier de type HR ... 168
II.3 IMPEDANCES ELECTROCHIMIQUES... 169
II.3.1 Diagramme d’impédance ... 169
II.3.2 Principaux résultats électrochimiques ... 174
III. EXAMENS VISUELS ... 177
IV.1 RELATION « POTENTIEL DE CORROSION - VITESSE DE CORROSION »... 179
IV.2 DENSITES DE COURANT DE CORROSION... 180
IV.3 RELATION ENTRE ICORR (RP ) FINAL ET ICORR(RP )INITIAL... 185
V. SYNTHESE... 187
SYNTHESE GENERALE ET CONCLUSION………191
BIBLIOGRAPHIE…..………...199
ANNEXES………..212
I. MESURES DE LA MASSE VOLOMIQUE APPARENTE ET DE LA POROSITE D’UN BETON DURCI (MODE OPERATOIRE AFPC-AFREM) ... 212
II. EXTRACTION ET DOSAGE DES CHLORURES LIBRES ET TOTAUX DANS LE BETON... 213
II.1 MISE EN SOLUTION DES CHLORURES TOTAUX... 213
II.2 MISE EN SOLUTION DES CHLORURES LIBRES... 213
II.3 DOSAGE... 213
III. ANODE “RENDEROC GALVASHIELD CC”... 214
IV. RESULTATS EXPERIMENTAUX (POTENTIEL D’ELECTRODE)... 215
IV.1 POUTRELLESENBETONPRECONTRAINT ... 215
IV.2 EPROUVETTESMODELES(ACIERSNONCORRODESINITIALEMENT)... 220
Table des illustrations
CHAPITRE I : SYNTHESE BIBLIOGRAPHIQUE FIGURES
Figure I. 1. Mécanisme de dissolution de l’acier dans le béton en présence d’ions chlore....9 Figure I. 2. Modèles principaux de détérioration de corrosion……… . 9 Figure I. 3. Volume relatif des produits d'oxydation du fer………. 11 Figure I. 4. Comportement anodique d’un métal (a) à l’état actif, (b) à l’état actif-passif…12 Figure I. 5. Diagramme de Pourbaix potentiel – pH du fer……… .14 Figure I. 6. Cinétique du comportement des armatures et du béton d'enrobage………….. 16 Figure I. 7. Modèle de PAGE d’attaque de l’acier par les ions chlore ……….18 Figure I. 8. Produits de corrosion du fer dans un milieu selon le rapport Cl-/OH-
(G : goethite (α-FeOOH) ; L : lépidocrocite (γ-FeOOH) ;
A : akaganéite (β- FeOOH) ; M : magnétite (Fe3O4))…...……… …18
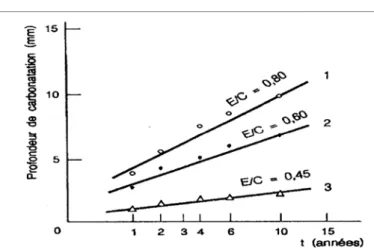
Figure I. 9. Influence du pourcentage de chlorures introduits dans le béton [E/C = 0.60] sur le courant de corrosion - après 100 jours (courbe 1) - après 1 an (courbe2)…. 19 Figure I. 10. Gradient de pH en fonction de la profondeur carbonatée……… 22 Figure I. 11. Evolution de la profondeur de carbonatation en fonction du temps
et du rapport E/C (20 °C - 50% HR)………… ……….. 23 Figure I. 12. Dépassivation des aciers d'armature suite à la carbonatation du béton
a), b), c) : dépassivation provoquée par une fissure
d) : dépassivation provoquée par un vide de ségrégation………. 24 Figure I. 13. Zones de corrosion sur une pile en béton dans un environnement marin…… ..30 Figure I. 14. Organigramme pour l’investigation d’une structure en béton armé corrodé… .31 Figure I. 15. Courbes de réaction anodique et cathodique……… ……….38 Figure I. 16. Influence de changement de diffusion d’oxygène sur les paramètres
de protection cathodique………...38 Figure I. 17. Protection cathodique par courant imposé………...40 Figure I. 18. Comportement anodique de l’acier dans le béton en présence de chlorures… .42
Figure I. 19. Valeurs des potentiels de piqûre et de protection mesurées sur l’acier immergé dans une solution saturée de Ca(OH)2 en fonction de la teneur en ions chlore..42
Figure I. 20. Comportement de l'acier dans le béton selon le potentiel de l’acier
et la teneur en ions chlore par rapport au poids de ciment……….43 Figure I. 21. Courbes cathodiques de polarisation d'acier dans le béton en conditions
aériennes (a) béton non contaminé, (b) béton contaminé par chlorure et
(c) béton immergé………..45 Figure I. 22. Schéma d’application d’un traitement d’ECE………....46 Figure I. 23. Illustration du processus électrochimique de réalcalinisation………48 Figure I. 24. Relation entre le gonflement, la densité du courant appliquée et le temps d’application de la technique électrochimique ……….52 Figure I. 25. Principe de mesure de la résistivité électrique d’un béton par la méthode de Wenner (quatre pointes ayant le même espacement)………..55 Figure I. 26. Mesure de résistivité de béton d’enrobage, par polarisation de l’armature…...55 Figure I. 27. Mesure du potentiel de corrosion………...56 Figure I. 28. Relation entre le taux de corrosion et le potentiel de demi-cellule………57 Figure I. 29. Courbe de polarisation pour calculer les pentes de Tafel selon TP………62 Figure I. 30. Mesure de la résistance de polarisation (pente de la courbe de polarisation (η-I) autour du potentiel de corrosion quand I change la polarité de négatif à positif)63
Figure I. 31. Spectre d’impédance caractéristique d’un système acier-béton………... 65 Figure I. 32. Comportement selon Randles………... 66 Figure I. 33. a) Schéma d’une réaction électrochimique et b) circuit équivalent de Randles d’un système simple où le contrôle est par activation……….…. 66 Figure I. 34. Diagramme d’impédance du circuit équivalent de Randles………..….67 Figure I. 35. Circuit équivalent avec l’impédance de Warburg………..…67 Figure I. 36. Circuits équivalents classiques pour caractériser le système acier- béton…….68 Figure I. 37. Diagramme d’impédance de système acier béton tracé par C.A. Scuderi et al.69 Figure I. 38. Représentation schématique de microstructure de béton, d’après…………...70 Figure I. 39. Microstructure simplifiée de béton………....71 Figure I. 40. Diagramme typique d’impédance selon Song. [117] (fréquences > 100 KHz)..72 TABLEAUX
Tableau I. 1. Niveaux critiques en chlorures nécessaires à l’initiation de la corrosion
de l'acier dans le béton ……….21 Tableau I. 2. Etat de corrosion d’armature selon le pH du béton………..26 Tableau I. 3. Taux probable de corrosion selon les valeurs de la résistivité électrique du béton……….54 Tableau I. 4. Probabilité de corrosion d'après les relevés de potentiel………..57 Tableau I. 5. Intervalles typiques de potentiel de corrosion selon l’état du béton………….57 Tableau I. 6. Effets des différents facteurs sur la variation du potentiel de corrosion mesuré
à l'aide d'une électrode de référence et sur la probabilité de corrosion……….60 Tableau I. 7. Classification de vitesse de corrosion……….…..64
CHAPITRE 2 : PROGRAMME EXPERIMENTAL FIGURES
Figure II. 1. Section des éprouvettes en béton précontraint……….79 Figure II. 2. Application du système de protection cathodique par anode sacrificielle
(cas de l’anode de type CC)……….81 Figure II. 3. Organigramme pour les éprouvettes en béton précontraint utilisées………82 Figure II. 4. Présentation des points de mesures pour les éprouvettes en béton précontraint...83 Figure II. 5. Présentation schématique des éprouvettes modèles sans anode sacrificielle……86 Figure II. 6. Système de protection cathodique par anode sacrificielle………87 Figure II. 7. Système de protection cathodique par courant imposé : application d’un
courant continu de 5 mA/m² d’acier de la surface active……..………...88 Figure II. 8. Organigramme des éprouvettes modèles utilisées pour les mesures par les
techniques EIS et Rp………89 Figure II. 9. Schéma du dispositif expérimental pour l’essai de flexion 3 points sur les
sections de poutrelles en béton précontraint………....91 Figure II. 10. Présentation schématique de la mesure des impédances électrochimiques……93 Figure II. 11. Circuit électrique équivalent pour simuler les spectres d’impédance.
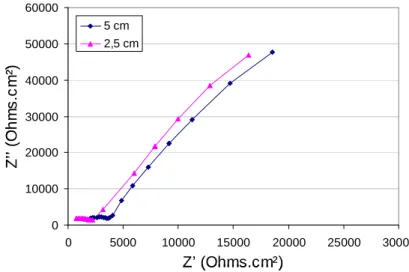
Cx.α est un élément de CPE……….93 Figure II. 12. Diagramme d’impédance tracé par Ford et al……….95 Figure II. 13. Diagrammes de Nyquist pour deux éprouvettes modèles avec acier HA,
ayant des épaisseurs de béton d’enrobage différentes………98 Figure II. 14. Diagrammes de Nyquist pour un acier HA immergé dans une solution
représentative de la solution interstitielle du béton (SSI)………...99
Figure II. 15. Diagrammes de Nyquist pour : (a) une éprouvette en béton armé avec acier HR, (b) une éprouvette de béton précontraint……….……..100
Figure II. 16. Evolution de Rb, Roxy et de Rtc en fonction de l’âge des éprouvettes modèles, sans chlorure, ayant 2.5 cm d’enrobage……….…101
Figure II. 17. Modification des diagrammes de Nyquist selon le type d’aciers non corrodés utilisés………...102
Figure II. 18. Modification des diagrammes de Nyquist en utilisant des aciers corrodés (a) enrobés dans le béton d’enrobage 2.5 cm, et (b) immergés dans la solution SSI……….103
Figure II. 19. Influence des ions chlore sur les diagrammes de Nyquist pour un acier de type HA immergé dans une solution SSI……….104
Figure II. 20. Influence des ions chlore sur les diagrammes de Nyquist pour un acier de type HA enrobé dans le béton………..105
Figure II. 21. Influence de la polarisation d’aciers immergés dans la solution SSI, (a) acier de type HA, (b) acier de type HR………105
TABLEAUX Tableau II. 1. Formulation du béton des poutrelles………..80
Tableau II. 2. Composition chimique du ciment utilisé (en %)………84
Tableau II. 3. Composition de Bogue du ciment utilisé………...………84
Tableau II. 4. Caractéristiques des granulats utilisés………84
Tableau II. 5. Formulation du béton utilisé………...85
Tableau II. 6. Valeurs de capacitances et leurs interprétations possibles………...97
CHAPITRE 3 : EFFICACITE DE LA PROTECTION GALVANIQUE APPLIQUEE AUX ELEMENTS EN BETON PRECONTRAINT FIGURES Figure III. 1. Dépolarisation des aciers en fonction du temps à partir de la déconnexion de l’anode sacrificielle (toff) – cas des éprouvette de type EPC, après 8 mois de protection………....111
Figure III. 2. Evolution des moyennes de E(toff = 0 h) et de E(toff = 24 h) en fonction de temps d’exposition au point 1………....113
Figure III. 3. Evolution des moyennes de E(toff = 0 h) et de E(toff = 24 h) en fonction de temps d’exposition au point 2……….…………115
Figure III. 4. Evolution des moyennes de E(t off = 0 h) et de E(t off = 24 h) en fonction du temps d’exposition au point 3………..……...117
Figure III. 5. Evolution de la densité de courant de corrosion icorr en fonction du temps d’exposition, point 1…………..……….……….119
Figure III. 6. Evolution de la densité de courant de corrosion icorr en fonction du temps d’exposition, point 2..………..120
Figure III. 7. Evolution de la densité de courant de corrosion icorr en fonction du temps de protection, point 3……….……….120
Figure III. 8. Relation entre E(toff = 24 h) et icorr pour les poutrelles en béton précontraint, point 3……….………...121
Figure III. 9. Effet possible d’une augmentation de polarisation anodique pour un changement de 150 mV de potentiel de l’acier vers des valeurs plus
positives………..122 Figure III. 10. Evolution en fonction du temps de traitement de la réponse d’impédance au
niveau du point 3, pour des éprouvettes ENP (a) à fréquences basses et
intermédiaires (b) à hautes fréquences………...……….124
Figure III. 11. Evolution en fonction du temps de traitement de la réponse d’impédance au niveau du point 3, pour des éprouvettes EPZ (a) à fréquences basses et intermédiaires (b) à hautes fréquences………125 Figure III. 12. Evolution en fonction du temps de traitement de la réponse d’impédance au
niveau du point 3, pour des éprouvettes EPC (a) à fréquences basses et intermédiaires (b) à hautes fréquences………126
Figure III. 13. Comparaison entre densités de courant de corrosion déterminées
par Rp ou par Rtc (EIS)……… ………..131 Figure III. 14. Evolution des teneurs en ions chlore totaux à l’interface acier-béton,
point 3. ………..……….132 Figure III. 15. Evolution des teneurs en ions chlore totaux à l’interface acier-béton,
point 2. ………...132 Figure III. 16. Evolution des teneurs en ions chlore totaux à l’interface acier-béton,
point 1. ………...………132 Figure III. 17. Etat superficiel de l’acier des poutrelles en béton précontraint au point 3 (a) ENP, (b) EPZ et (c) EPC……….133
Figure III. 18. Analyse d’une zone proche de la surface d’acier, pour une éprouvette EPZ. Photo MEB à gauche (x100), quantifications EDS à droite………....134
Figure III. 19. Analyse d’une zone proche de la surface d’acier, pour une éprouvette ENP. Photo MEB à gauche(x2000), quantification EDS à droite……….135
Figure III. 20. Photos MEB d’éprouvettes ENP (à gauche x2000) et d’éprouvettes EPC (à droite x1100), au niveau du point 3………136
Figure III. 21. Courbes Force - Flèche obtenues en flexion 3 points pour des poutrelles en béton précontraint ENP et EPC………...137
TABLEAUX
Tableau III. 1. Evolution de ∆E en fonction du temps de traitement, point 1
(avec ∆E = E(toff = 24 h) - E(toff = 0 h))………...114 Tableau III. 2. Evolution de ∆E en fonction du temps de traitement, point 2
(avec ∆E = E(toff = 24 h) - E(toff = 0 h))………...116 Tableau III. 3. Evolution de ∆E en fonction du temps de traitement, point 3
(avec ∆E = E(toff = 24 h) - E(toff = 0 h))………...118 Tableau III. 4. Evolution des valeurs de Rb et Cc aux points 2 et 3 des poutrelles
en béton précontraint………...128 Tableau III. 5. Evolution des valeurs de Roxy et Coxy des poutrelles en béton précontraint
au point 3……….129 Tableau III. 6. Evolution des valeurs de Rtc et Cdl aux points 2 et 3 des poutrelles
CHAPITRE 4 : COMPARAISON DES DIFFERENTS TYPES DE PREVENTION CATHODIQUE APPLIQUES A DES EPROUVETTES MODELES
FIGURES
Figure IV. 1. Evolution des moyennes du potentiel d’électrode de l’acier en fonction du temps de protection pour les éprouvettes avec aciers HA non corrodés…….143 Figure IV. 2. Evolution des moyennes du potentiel d’électrode de l’acier en fonction du
temps de protection pour les éprouvettes d’aciers HR non corrodés………..144
Figure IV. 3. Evolution des densités de courant de corrosion icorr en fonction du temps de traitement pour les éprouvettes avec aciers HA non corrodés………....146
Figure IV. 4. Evolution des densités de courant de corrosion icorr en fonction du temps de traitement pour les éprouvettes avec aciers HR non corrodés………… ..147 Figure IV. 5. Evolution de la réponse d’impédance en fonction du temps d’immersion pour
des éprouvettes EPNHA, (avec aciers HA initialement non corrodés), (a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences. ……….……….148
Figure IV. 6. Evolution de la réponse d’impédance en fonction du temps de traitement pour des éprouvettes EPZHA (avec aciers HA initialement non corrodés),
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences. ……….……….149
Figure IV. 7. Evolution de la réponse d’impédance en fonction du temps de traitement pour des éprouvettes EPCHA (avec aciers HA initialement non corrodés)
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences. .……….150
Figure IV. 8. Evolution de la réponse d’impédance en fonction du temps de traitement pour des éprouvettes EPTHA (avec aciers HA initialement non corrodés)
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences. ……….……….151
Figure IV. 9. Evolution de la réponse d’impédance en fonction du temps d’immersion pour des éprouvettes EPNHR, avec aciers HR non corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………....152
Figure IV. 10. Evolution de la réponse d’impédance en fonction du temps d’immersion pour des éprouvettes EPZHR, avec aciers HR non corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………....153 Figure IV. 11. Evolution de la réponse d’impédance en fonction du temps d’immersion pour
des éprouvettes EPCHR, avec aciers HR non corrodés, (a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………....154
Figure IV. 12. Evolution de la réponse d’impédance en fonction du temps d’immersion pour des éprouvettes EPTHR, avec aciers HR non corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………154 Figure IV. 13. Profil en ions chlore totaux pour les éprouvettes modèles avec aciers HA…159 Figure IV. 14. Surface du béton pour des éprouvettes modèles fabriquées avec des aciers
Figure IV. 15. Etat superficiel de l’acier des éprouvettes EPCHR présentées
Figure IV. 14 ………..160 Figure IV. 16. Etat superficiel de l’acier après 15 mois de traitement
(a) ENPHR et (b) EPTHR ………....160
TABLEAUX
Tableau IV. 1. Evolution de ∆E en fonction du temps de traitement pour les éprouvettes avec acier HA non corrodé (avec ∆E = E(toff = 24 h) - E(toff = 0 h))...144 Tableau IV. 2. Evolution de ∆E en fonction du temps de traitement pour les éprouvettes
avec acier HR non corrodé (avec ∆E = E(toff = 24 h) - E(toff = 0 h))…...145 Tableau IV. 3. Evolution des valeurs de Rb et Cc pour les éprouvettes avec aciers
HA ou HR initialement non corrodés, selon le type de protection………….155 Tableau IV. 4. Evolution des valeurs de Roxy et Coxy pour les éprouvettes avec
aciers HA ou HR initialement non corrodés, selon le type de protection…...157 Tableau IV. 5. Evolution des valeurs de Rtc et Cdl pour les éprouvettes avec
aciers HA ou HR initialement non corrodés, selon le type de protection …..158
CHAPITRE 5 : COMPARAISON DES DIFFERENTS TYPES DE PROTECTION CATHODIQUE POUR DES EPROUVETTES MODELES…
FIGURES
Figure V. 1. Evolution des moyennes du potentiel d’électrode de l’acier en fonction du temps de protection pour les éprouvettes avec des aciers HA corrodés…….164 Figure V. 2. Evolution des moyennes de potentiel d’électrode de l’acier en fonction du
temps de traitement pour les éprouvettes avec des aciers HR corrodés….…166 Figure V. 3. Evolution des densités de courant de corrosion icorr en fonction du temps
de traitement pour les éprouvettes avec aciers corrodés de type HA………..167 Figure V. 4. Evolution des densités de courant de corrosion icorr en fonction du temps
de traitement pour les éprouvettes avec des aciers corrodés de type HR……168 Figure V. 5. Evolution de la réponse d’impédance avec le temps de traitement pour les
éprouvettes ENP, avec aciers HA corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………169 Figure V. 6. Evolution de la réponse d’impédance avec le temps de protection pour les
éprouvettes EPC, avec aciers HA corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………....170 Figure V. 7. Evolution de la réponse d’impédance avec le temps de protection pour les
éprouvettes EPT, avec aciers HA corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………171 Figure V. 8. Evolution de la réponse d’impédance avec le temps de protection pour les
éprouvettes ENPHR, avec aciers HR corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
Figure V. 9. Evolution de la réponse d’impédance avec le temps de protection pour les éprouvettes EPCHR, avec aciers HR corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………....173 Figure V. 10. Evolution de la réponse d’impédance avec le temps de protection pour des
éprouvettes EPTHR, avec aciers HR corrodés,
(a) aux basses fréquences et aux fréquences intermédiaires
(b) aux hautes fréquences………....173 Figure V. 11. Aspect des éprouvettes (a) ENPHA après 10 mois d’immersion
(b) ENPHR après 8 mois d’immersion…...………...……….177 Figure V. 12. Etat superficiel de l’acier HA pour l’éprouvette de la Figure V.11 (a)....…...178 Figure V. 13. Etat superficiel de l’acier HR pour l’éprouvette de la Figure V.11(b)………178 Figure V. 14. Etat superficiel de l’acier pour (a) EPTHR et (b) EPTHA ……….179 Figure V. 15. Relation E(24h) – icorr (a) éprouvettes en béton armé acier HA et (b) éprouvettes en béton armé acier HR…..………179 Figure V. 16. Comparaison des valeurs de densité de courant de corrosion…………...…..180 Figure V. 17. Comparaison des valeurs de densité de courant de corrosion pour les
éprouvettes fabriquées avec des aciers non corrodés,
(a) acier de type HA et (b) acier de type HR………...…181 Figure V. 18. Comparaison des valeurs de densité de courant de corrosion pour les
éprouvettes fabriquées avec des aciers corrodés,
(a) acier de type HA et (b) acier de type HR………...………182 Figure V. 19. Pourcentage de répétition de chaque domaine de courant de corrosion
dans chaque intervalle de potentiel pour les éprouvettes fabriquées
avec des aciers non corrodés……….………..183 Figure V. 20. Pourcentage de répétition de chaque domaine de courant de corrosion
dans chaque intervalle de potentiel pour les éprouvettes fabriquées
avec des aciers corrodés……….……….184 Figure V. 21. Variation de icorr final en fonction de icorr initial pour
a) éprouvettes fabriquées avec des aciers non corrodés
b) éprouvettes fabriquées avec des aciers corrodés……….186 TABLEAUX
Tableau V. 1. Evolution de ∆E en fonction du temps de traitement pour les éprouvettes avec acier HA corrodé (avec ∆E = E(toff = 24 h) - E(toff = 0 h))...165 Tableau V. 2. Evolution de ∆E en fonction du temps de traitement pour les éprouvettes
avec acier HR corrodé (avec ∆E = E(toff = 24 h) - E(toff = 0 h))…………..167 Tableau V. 3. Evolution des valeurs de Rb et Cc pour les éprouvettes avec aciers HA
ou HRinitialement corrodés, selon le type de protection………175 Tableau V. 4. Evolution des valeurs de Roxy et Coxy pour les éprouvettes avec aciers
HA ou HR initialement corrodés, selon le type de protection…..…………..175 Tableau V. 5. Evolution des valeurs de Rtc et Cdl pour les éprouvettes avec aciers
Les phénomènes de corrosion des armatures du béton sont les dégradations les plus fréquentes des ouvrages en béton armé et précontraint. Ils entraînent des coûts très importants de maintenance, de réparation et peuvent dans certains cas mettre en cause la sécurité des structures et des usagers.
Les dommages dus à la corrosion commencent par des expansions au niveau des aciers qui conduisent à la formation de fissures dans le béton et provoquent éventuellement le décollement de l'enrobage. En plus de la disparition du béton d’enrobage, des dommages structuraux peuvent survenir en raison de la perte d'adhérence des barres et de la diminution de leur diamètre effectif (perte de capacité en traction).
Le béton d’enrobage, ou le mortier autour d’une armature, offre aux aciers une double protection contre la corrosion. En premier lieu, il agit comme une barrière physique qui limite la pénétration d’agents agressifs et l’accès de l’oxygène jusqu’à l’armature. Ensuite, grâce à la composition de la solution interstitielle et à son pH élevé, le béton offre une protection chimique contre la corrosion. Cependant, la porosité du béton est à l’origine de la diminution de sa capacité à isoler l’acier des substances agressives du milieu extérieur.
Le béton est un milieu très alcalin, le pH de la solution interstitielle est généralement compris entre 12.5 et 13.4. Sous ce niveau de pH, les aciers d'armature ne se corrodent pas car ils sont recouverts d'un film passif d'épaisseur comprise entre 10-3 et 10-1 µm, appelé «couche passive », le plus souvent formé de Fe3O4 - Fe2O3 γ. La corrosion des aciers d'armature ne
peut débuter que si le film passif est détruit. Les causes principales de la corrosion de l’armature sont la carbonatation du béton, qui diminue le pH de la solution interstitielle, et/ou la présence de chlorures en quantité suffisante au niveau des aciers.
La corrosion des aciers dans le béton est un processus électrochimique, qui peut être décrit d’une façon simplifiée par deux réactions électrochimiques, une réaction anodique qui est la dissolution (oxydation) de l’acier, et une réaction cathodique qui est la réduction d’une espèce dissoute (ions ou gaz) dans la solution interstitielle.
Les réactions d’oxydation conduisent dans le cas du fer à la formation de produits expansifs avec une augmentation de volume égale au minimum à deux fois celui du métal de base à partir duquel ils se sont formés. Les variations volumiques induisent des contraintes dans le
corrosion de l’acier se traduit par une diminution de sa section et, en conséquence, de la capacité portante de l’ouvrage.
Le béton précontraint a été développé afin de diminuer le poids des structures en béton et d’éviter la formation des fissures. Les barres précontraintes, se composant d’aciers à haute résistance, sont soumises à une force de traction équivalente à environ 70-80% de leur contrainte à la rupture. Ces aciers peuvent être directement au contact du béton (précontrainte par pré-tension) ou entourés d’un coulis de protection (précontrainte par post-tension). Du fait de ces contraintes élevées des barres, une attention particulière doit être apportée aux ouvrages en béton précontraint, et au risque de fragilisation des aciers.
Le processus de corrosion des aciers du béton précontraint est un processus de corrosion sous contrainte (CSC) qui se déroule en deux étapes. Dans la première phase, dit d’amorçage de fissure, l’acier n’est visiblement pas détérioré. Dans la deuxième phase, correspondant à la croissance de certaines fissures, la corrosion peut aller jusqu’à la rupture du métal.
Le mécanisme de corrosion sous contrainte met en jeu la fragilisation par l’hydrogène, souvent désignée par FPH. Cette fragilisation est par définition la diminution de la ductilité d’un acier à haute résistance.
La connaissance des conditions environnantes n’est pas suffisante pour prévenir l’évolution du processus de corrosion dès la conception. Des techniques de détection et d’observation ont été mises au point pour évaluer le niveau de corrosion d’un acier dans une structure. On peut classer ces techniques en deux types : les techniques électrochimiques comme la mesure du potentiel de corrosion, la résistance de polarisation et l’impédance électrochimique, et les techniques chimiques comme l’analyse de concentration en chlorure et du front de carbonatation.
Pour faire face à la corrosion de l’acier, le retour d’expérience montre que les méthodes de réparation conventionnelles telles que le remplacement du béton endommagé ou le changement de l’acier corrodé ne constituent pas des solutions satisfaisantes. C’est pourquoi des méthodes de maintenance sont recherchées, comme les techniques électrochimiques de réalcalinisation, d’extraction électrochimique des chlorures ou encore de protection cathodique. Ces deux dernières méthodes représentent un moyen efficace pour le traitement et
électrochimiques sont non destructives ce qui est un avantage important pour les maîtres d’ouvrages.
D’autres techniques non électrochimiques ont été développées telles que les revêtements sur la surface du béton, les revêtements sur la surface de l’acier, les inhibiteurs de corrosion et les mortiers de réparation. Malgré la facilité relative de mise en œuvre de ces techniques, elles ont un inconvénient important, qui est de ne pas prendre en compte la nature électrochimique de la corrosion. Une réparation locale pourrait conduire à aggraver la dissolution de l’armature en créant des zones anodiques et cathodiques sur la surface de cette armature, particulièrement dans le cas où la corrosion est provoquée par les ions chlore.
Les techniques électrochimiques sont basées sur le principe électrochimique du mécanisme de la corrosion d’acier. Elles peuvent être mises en œuvre en faisant passer un courant électrique continu entre une anode placée sur la surface de béton et l’acier à protéger (cathode), l’anode et la cathode étant dans le même milieu électrolytique. Il est aussi possible d’utiliser un métal moins électropositif que l’acier comme anode sacrificielle.
La protection cathodique des matériaux métalliques consiste à éviter ou réduire leur corrosion en milieux électrolytiques en provoquant l’abaissement de leur potentiel électrochimique jusqu’à un niveau suffisant, correspondant à leur domaine d’immunité. Cet abaissement du potentiel est assuré par le couplage de l’ouvrage à protéger avec des anodes sacrificielles à base de zinc, d’aluminium ou de magnésium (protection cathodique par anode sacrificielle) ou par l’injection d’un courant électrique continu, de l’ordre de 1 à 20 mA/m² d’acier à protéger, entre l’acier (cathode) et un matériau inerte placé en surface du béton d’enrobage (protection cathodique par courant imposé).
Ce système de protection est un système idéal théoriquement quand il peut être appliqué efficacement. L’ensemble de la surface de métal à protéger au contact de l’électrolyte corrosif est ainsi transformé en cathode, c'est-à-dire qu’il reçoit toujours de l’électrolyte le courant électrique continu qui correspond à la réduction des espèces oxydantes de la solution (eau, H+ ou O2).
L’analyse bibliographique montre que la protection cathodique améliore la stabilité thermodynamique de l’acier dans le béton armé même en présence d’ions chlore. Cepenadnt, cette technique doit être mise en œuvre de façon permanente.
La technique de déchloruration ou, l’extraction électrochimique des chlorures (ECE), se base sur le même principe électrochimique que la protection cathodique par courant imposé, mais avec un courant plus élevé (de 1 à 5 A/m2) et une application de façon temporaire sur une période de quelques semaines. Cette technique permet de déplacer les ions chlore, par l’effet d’électromigration, de l’armature vers la surface du béton sur laquelle est placée une anode immergée dans un électrolyte. En complément, la formation d’ions OH- à la surface de l’acier crée des conditions favorables pour renouveler la couche passive.
La technique de réalcalinisation est appliquée sur des ouvrages en béton lorsque la corrosion de l’acier est provoquée par la carbonatation du béton d’enrobage, et donc par la diminution du pH de la solution interstitielle. Le principe de cette technique est aussi d’appliquer une tension assez forte entre l’acier et une anode temporaire placée sur la surface du béton. Dans ce cas, le but de cette technique est d’augmenter le pH à une valeur qui permet de repassiver les aciers. La densité de courant utile pour ce traitement est de l’ordre de 0.1 A/m2 appliqué sur une période de quelques jours à quelques semaines. Pour la réalcalinisation, une solution basique est appliquée en plus sur le parement de façon à pénétrer à l’intérieur du béton d’enrobage. Les réactions électrochimiques qui se déroulent sur la surface de l’acier provoquent la formation des OH-, ce qui augmente le pH de la solution interstitielle du béton autour de l’armature. Les applications de cette technique pour les structures en béton sont encore limitées.
Cependant, l’application de techniques électrochimiques pourrait provoquer des effets secondaires qu’il est indispensable d’identifier et de contrôler. La fragilisation des aciers et le risque d’une alcali-réaction dans le béton sont parfois évoqués.
L’objectif de notre travail consiste à évaluer les avantages et les inconvénients de l’application d’une protection cathodique par anode sacrificielle sur des éléments en béton précontraint et de faire une comparaison avec la protection cathodique par courant imposé. On s’intéressera particulièrement à vérifier si ces systèmes de protection peuvent vraiment protéger les aciers en diminuant leur vitesse de corrosion, et éventuellement donner la possibilité de les repassiver. L’étude se divise en cinq chapitres décrivant les bases théoriques et expérimentales de notre étude.
Le premier chapitre correspond à une étude bibliographique axée sur la corrosion des aciers dans le béton, les méthodes d’étude de la corrosion de l’acier dans le béton, et les techniques de maintenance.
Le deuxième chapitre présente tout d’abord le programme expérimental avec les paramètres expérimentaux choisis pour mettre en évidence l’efficacité des techniques de protection appliquées ainsi que les méthodes de mesures qui ont été utilisées. Des essais préliminaires destinés à étudier les évolutions des réponses d’impédance du diagramme de Nyquist pour des systèmes béton-acier sont ensuite présentés afin de déterminer pour chaque demi-cercle son origine et les paramètres influents.
Le troisième chapitre est centré sur l’analyse de résultats expérimentaux obtenus lors de l’application de la protection cathodique par anode sacrificielle (protection galvanique) sur des éléments de béton précontraint, et à l’observation des effets secondaires possibles dus au courant de protection.
Le quatrième chapitre présente les résultats des essais effectués pour déterminer l’efficacité de différents types de prévention cathodique pour des éprouvettes « modèles ». Deux systèmes de protection par anode sacrificielle à base de zinc et un système de protection par courant imposé sont appliqués à des éprouvettes dont les aciers ne sont pas corrodés avant le traitement.
Dans le cinquième chapitre, une démarche analogue à celle adoptée dans le chapitre précédent est appliquée en vue d’étudier l’efficacité des systèmes de protection cathodique galvanique ou par courant imposé, sur des éprouvettes modèles dont les aciers sont déjà corrodés avant l’application du traitement.
CHAPITRE 1 :
I.
INTRODUCTION
Dans le cas des constructions en béton armé, la durabilité de l’ouvrage dépend essentiellement de la tenue des armatures à la corrosion. Afin d’étudier et éventuellement d’éviter la corrosion de l’acier dans le béton, il est nécessaire de connaître le mécanisme de corrosion des aciers dans le béton, de connaître les techniques de maintenance utilisées, et de décrire les différentes techniques d’étude permettant de diagnostiquer leur état.
Ce premier chapitre, consacré à la revue bibliographique, a été organisé en trois volets :
- 1. Corrosion des aciers dans le béton.
- 2. Techniques de maintenance.
- 3. Techniques d’étude de la corrosion des aciers dans le béton.
II.
CORROSION DES ACIERS DANS LE BETON
II.1 INTRODUCTION
La corrosion résulte d’interactions physico-chimiques entre le métal et l’environnement provoquant des modifications de ses propriétés accompagnées d’une dégradation du métal. EVANS [1] est le premier à avoir défini la corrosion comme un processus électrochimique, en présence de phase liquide.
Il existe différents types de corrosion : uniforme, galvanique (dite bimétallique), caverneuse, par piqûres et sous contrainte [2]. En général, l’origine de la corrosion est la formation d’une pile électrochimique, qui se forme lorsqu’il y a une différence de potentiel entre deux parties à la surface du métal. Ainsi, la surface de l’acier dans le béton est constituée d’une multitude de micro-piles constituées de zones anodiques et de zones cathodiques.
Les armatures dans le béton sont protégées grâce à l’alcalinité forte du béton (pH > 12). Dans ces conditions, un film protecteur très mince et adhérent, nommé film passif, se forme à la surface de l’acier. Ce film d’oxyde protège les aciers contre la corrosion dans les conditions normales. En présence d’eau et d’oxygène, ce film passif peut être détruit par des agents agressifs comme les chlorures ou les sulfates.
La corrosion des armatures dans le béton a principalement lieu à la suite de la carbonatation du béton d’enrobage et de la pénétration des chlorures [3]. Le dioxyde de carbone réagit avec les hydrates de la pâte de ciment en produisant un abaissement du pH qui conduit à une
déstabilisation de la couche passive formée sur l’acier. Les ions chlorures pénètrent dans la structure poreuse du béton et peuvent atteindre l’armature. S’ils sont présents en quantité suffisante autour de la couche passive, ils forment des complexes avec les ions métalliques et déplacent les molécules d’eau. Ces produits diffusent en suite dans la solution interstitielle. La corrosion ne se forme qu’en présence d’oxygène et d’humidité relative comprise entre 70% et 80%. Lorsque l’atmosphère est très sèche (humidité relative < 40% et donc absence d'électrolyte), ou lorsque le béton est totalement immergé dans l’eau désaérée (manque d'oxygène), la corrosion ne se produit en principe pas [4,5].
Le développement de la corrosion de l’acier dépend aussi d’autres facteurs comme le rapport E/C, le type de ciment, les additions minérales, la qualité de l’interface acier-béton, l’épaisseur d’enrobage, la température, le pH, le potentiel de l’acier, les hétérogénéités de la surface de l’acier, etc. [4, 5, 6].
La Figure I. 1 montre le mécanisme de dissolution de l’acier dans le béton en présence d’ions chlore. La Figure I. 2 montre les modèles principaux de détérioration par la corrosion consécutivement à la carbonatation et à la pénétration des ions chlores.
Figure I. 1. Mécanisme de dissolution de l’acier dans le béton en présence d’ions chlore [3]
II.2 NATURE ELECTROCHIMIQUE DE LA CORROSION
II.2.1 Généralités
La corrosion des armatures en acier dans le béton est un processus électrochimique qui implique l’existence d’une anode, d’une cathode et d’un milieu électrolytique pour constituer une pile électrochimique. La création de ces piles sur l’armature conduit à la dissolution du métal dans les zones anodiques selon la réaction d’oxydation :
Fe → Fe2+ + 2 e- (1)
Les électrons libérés par la réaction anodique sont consommés à la cathode par la réaction cathodique :
- En présence d’oxygène :
2H2O + O2 + 4 e-→ 4OH- (2)
- En absence d’oxygène :
2H+ + 2 e- → H2 (3)
Ensuite, les ions ferreux réagissent avec les ions OH- pour former de l’hydroxyde ferreux : Fe2+ + 2OH-→ Fe(OH)2 (4)
Les réactions se poursuivent :
Fe + H2O → FeOH+ + H+ + 2 e- (5)
Fe + 3H2O → Fe(OH)3 + 3H+ + 3 e- (6)
2Fe + 3H2O → Fe2O3 + 6H+ + 6 e- (7)
3Fe + 4H2O → 3Fe3O4 + 8H+ + 8 e- (8)
Fe3O4 + 5H2O → 3Fe(OH)3 + H+ + e- (9)
Puis, une oxydation lente conduit aux oxydes hydratés : γ-FeOOH (lépidocrocite) qui représente la rouille fraîchement formée, α-FeOOH (goethite) qui représente la rouille vieillie, et la magnétite Fe3O4. La rouille formée sur les armatures est un mélange de ces trois
constituants, en proportions variables dépendant de nombreux facteurs comme l’âge du béton et la nature du milieu environnant. La quantité de magnétite est toujours petite.
La corrosion des aciers d'armature peut provoquer des dommages au béton environnant du fait que la rouille est formée de produits fortement expansifs. En effet, suivant l'état d'oxydation, le fer métallique forme des oxydes dont le volume peut être jusqu'à 6 fois supérieur au volume initial, comme le montre la Figure I. 3.
Figure I. 3. Volume relatif des produits d'oxydation du fer [6]
Du point de vue électrochimique, ces réactions ne sont possibles, pour une solution donnée, qu’à partir d’un certain potentiel effectif, appelé potentiel d’anode EA, défini par la relation de Nernst (réaction 1) :
(10)
Où : E0A est le potentiel standard d’électrode à l’anode, Rc la constante des gaz parfaits, F la constante de Faraday (F = 96487 coulombs), T la température absolue, n le nombre d’électrons libérés par la réaction.
Pour le fer, la relation de Nernst devient (avec E0A = -0.44 V, Rc = 8.314 J/K°, F = 96487 coulombs, T = 25° C, n = 2 et [Fe] = 1) :
(11)
Où [Fe2+] est la concentration en Fe2+ définie par la solubilité de Fe(OH)2 qui reste faible.
Le potentiel d’électrode pour la réaction cathodique (réaction 2), EC, est défini par la relation suivante :
(12)
Où : E0c est le potentiel standard d’électrode à la cathode.
La relation devient (en substituant E0C = -0.401 V, RC = 8.314 J/°K, F = 96487 coulombs,
T = 25° C, n = 4 et log [OH-] = pH – 14) ;
(13)
A partir de EC et EA, on peut définir la force électromotrice de la corrosion comme :
e = EC - EA (14) Enfin :
e = 1.669 + 0.0148 log [O2] – 0.0591pH – 0.0296 log[Fe2+] (15) Cette force électromotrice conduit le courant de corrosion, dans l’électrolyte, de l’anode à la cathode. Elle nous indique que le taux de corrosion est influencé par le pH et la concentration en oxygène et la concentration en Fe2+.
II.2.2 Conditions d'immunité [4]
La corrosion d’un métal ne peut pas avoir lieu si le potentiel de la surface du métal (E) est inférieur au potentiel d'équilibre du processus d’oxydation (Eeq). La condition selon laquelle le métal n'a aucune tendance à passer à la forme d’oxyde (E ≤ Eeq) s’appelle la condition d’immunité. La corrosion peut donc se produire si E > Eeq.
E dépend de la nature du métal et de l'électrolyte mais il change également s’il y a un courant électrique entre le métal et l’électrode. Ainsi, la corrosion augmente quand le courant circule du métal vers l'électrolyte (courant anodique) et elle diminue quand ce courant circule de l'électrolyte vers le métal (courant cathodique). Eeq est donné par la loi de Nernst (relation 10).
Dans les cas de la corrosion active, commune à de nombreuses situations (acier dans le sol, dans l’eau de mer et aussi dans le béton carbonaté), le taux de corrosion, proportionnel au courant de corrosion, noté (ia) dans cet exemple, augmente avec l’augmentation du potentiel (Figure I. 4a).
Dans les cas où les aciers ont un comportement actif-passif (cas des aciers dans le béton ou, plus généralement, dans les environnements alcalins, mais aussi les aciers inoxydables dans des milieux neutres), le comportement du taux de corrosion devient plus compliqué (Figure I. 4b.) On constate que (ia) augmente un peu avec l’augmentation du potentiel de Eeq à Eeq.H qui est le potentiel d’équilibre de la formation d’hydrogène, puis diminue à une valeur très petite due à la formation de film d’oxyde à la surface du métal, pour finalement augmenter encore aux potentiels élevés si ce film a été détruit.
II.2.3 Formation d'hydrogène
La formation d'hydrogène étant un processus cathodique, elle peut avoir lieu quand le potentiel du métal (E) devient plus bas que le potentiel d'équilibre de la formation d'hydrogène (Eeq,H), c'est-à-dire quand E < Eeq,H. Eeq,H change avec le pH selon la loi de Nernst. Dans tous les cas, quand le pH sur la surface d’armature est supérieur à 12.5, Eeq,H sera inférieur à -950 mV vs SCE.
II.3 PASSIVATION ET DEPASSIVATION DES ACIERS DANS LE BETON
II.3.1 Passivation
Le pH de la solution interstitielle dans les pores du béton sain est compris entre 12.5 et 13.4. Avec cette valeur élevée du pH, l’acier se recouvre d’oxyde protecteur, qui forme la couche passive protégeant les aciers de la corrosion. La couche d’oxyde contient du calcium, mais des recherches ont montré que cette couche se forme même en absence de calcium [7].
Les conditions d’existence et d’équilibre de cette couche peuvent être calculées à l’aide des diagrammes de Pourbaix [8] qui représentent, en fonction du pH, le potentiel réversible des réactions d’électrode calculé par l’équation de Nernst. A l’aide de ces diagrammes, on peut distinguer les domaines d’immunité, de corrosion, de passivation et de stabilité thermodynamique de l’eau à la pression atmosphérique.
La Figure I. 5 montre un exemple de diagramme potentiel-pH pour le fer tenant compte des oxydes formés, Fe2O3 et Fe3O4. Les lignes pointillées représentent les limites de stabilité de
l'eau à la pression atmosphérique : en dessous de la ligne (a) l'eau se réduit en formant de l'hydrogène et au-dessus de la ligne (b) l'eau s'oxyde en formant de l'oxygène. L’oxyde ferrique hydraté et la magnétite sont les seuls oxydes pris en compte et la concentration en ions ferreux et ferriques dissous est de 10-6 moles par litre. Ainsi le rôle de l’oxygène dissous dans l’eau n’est pas pris en compte. Selon ce diagramme, le fer peut réagir avec les protons en
Formation d’hydrogène Formation d’oxygène Formation d’hydrogène Formation d’oxygène
milieu acide et neutre accompagné d’un dégagement d’hydrogène. Par contre en milieu alcalin, la corrosion de fer ne se produit pas car les oxydes formés par réaction avec les ions hydroxyles sont insolubles.
Figure I. 5. Diagramme de Pourbaix potentiel – pH du fer [8].
Lorsque les aciers sont dans une solution alcaline, ils se recouvrent d’un film d’oxyde d’épaisseur 1-5 nm. Dans le béton sain, ce film est homogène, continu et de 50-200 µm d’épaisseur; sa composition chimique dépend du pH, du potentiel de l’acier et aussi de l’existence de l’oxygène.
L’interface acier-béton peut être dans un état passif, semi passif ou actif (corrosion) [5]. Pour l’état passif, le film d’oxyde se fait lentement et est composé de Fe3O4-γ-Fe2O3. Pour l’état
semi-passif, le film d’oxyde est constitué de deux couches, la première est directement sur la surface d’acier et composée de Fe3O4-γ-Fe2O3, la deuxième est formé du mélange de α
-FeOOH et de Fe3O4-γ-Fe2O3. Cette couche est inhomogène et poreuse due à sa formation
rapide et est, en conséquence, moins efficace contre la corrosion. II.3.2 Dépassivation
a . Généralités
Dans la solution interstitielle du béton sain, les ions Fe2+, produit de la réaction anodique (1), peuvent rester sous la forme Fe(OH)2 ou être oxydés en ions Fe3+ (qui se trouvent sous la
forme Fe(OH)3, formant le mince film passif à la surface de l’acier). Dans ce cas, l’acier est
La dépassivation de l'acier dans le béton se produit le plus souvent par l'action de deux agents qui peuvent se présenter simultanément : le dioxyde de carbone, CO2 (carbonatation), et la
présence de chlorures au niveau des armatures.
Ces deux agents interagissent entre eux puisque la carbonatation peut affecter la diffusion des chlorures au sein du béton en changeant la structure des réseaux poreux [9]. La carbonatation pourrait provoquer une réduction de la porosité totale et une redistribution de la taille des pores. Cela pourrait rendre la pénétration des chlorures plus difficile [10].
L’état de corrosion actif fait suite à la carbonatation du béton d’enrobage qui correspond à la formation de carbonate de calcium (CaCO3) à partir de la portlandite, et à une diminution
simultanée du pH de la solution interstitielle du béton :
Ca(OH)2 + CO2→ CaCO3 + H2O (16)
pH > 12 pH < 9.5
Dans un tel béton la couche passive ne résiste pas et la corrosion démarre.
Par ailleurs, lorsque la teneur en chlorure atteint ou dépasse une valeur critique, la couche passive ne peut plus protéger l’acier. La dépassivation nécessite un taux de Cl- élevé si l’alcalinité de la solution interstitielle est suffisamment élevée. Par contre, si le pH est inférieur à 9.5, la teneur critique en chlorure nécessaire pour provoquer la dépassivation est plus faible.
La présence d’ions chlore attaque le film d’oxyde mais n’a pas d’influence sur la composition et la structure des produits de corrosion. C’est l’oxygène qui détermine la composition chimique de ces produits.
Selon Tuutti [11] le processus de corrosion des aciers dans le cas d’un béton initialement sain s'effectue généralement en deux étapes (Figure I. 6) :
- la phase d’initiation (phase A, Figure I. 6) : l'acier est stabilisé par la couche de passivation qui empêche la formation de rouille, mais au cours de cette période, les agents agressifs pénètrent dans la structures poreuse du béton d’enrobage ;
- la phase d'amorçage ou de propagation (phase B, Figure I. 6) correspondant à la dépassivation progressive de l'acier lorsque les agents agressifs ont atteint l’interface acier-béton.
Durant la deuxième phase se produit la propagation de la rouille produite par les réactions d'oxydation à la surface du métal. La formation des produits d'oxydation provoque un gonflement qui fini par provoquer la fissuration de l'enrobage (phase C, Figure I. 6).
![Figure I. 6. Cinétique du comportement des armatures et du béton d'enrobage [11]. En pratique, on doit donc faire en sorte que la période d'amorçage soit la plus longue possible](https://thumb-eu.123doks.com/thumbv2/123doknet/2224593.15307/32.892.281.649.111.367/cinetique-comportement-armatures-enrobage-pratique-periode-amorcage-possible.webp)
![Figure I. 12. Dépassivation des aciers d'armature suite à la carbonatation du béton [26] a), b), c) : dépassivation provoquée par une fissure](https://thumb-eu.123doks.com/thumbv2/123doknet/2224593.15307/40.892.246.650.120.385/figure-depassivation-aciers-armature-carbonatation-depassivation-provoquee-fissure.webp)
![Figure I. 14. Organigramme pour l’investigation d’une structure en béton armé corrodé [39]](https://thumb-eu.123doks.com/thumbv2/123doknet/2224593.15307/47.892.260.696.454.1093/figure-organigramme-l-investigation-structure-beton-arme-corrode.webp)