Le traitement de l’information et la mésestimation
du sommeil dans l’insomnie
Mémoire
Jessica Lebel
Maîtrise en psychologie Maître ès arts (M.A.)
Québec, Canada
Le traitement de l’information et la mésestimation
du sommeil dans l’insomnie
Mémoire
Jessica Lebel
Sous la direction de :
Résumé
L’insomnie est un désordre psychologique dont le diagnostic repose sur des données subjectives. Or, certaines personnes souffrant d’insomnie rapportent des difficultés bien plus importantes que ce qui est constaté objectivement. Ces personnes souffrent d’insomnie paradoxale, où le sommeil est confondu avec l’éveil, causant une mauvaise perception du sommeil. Les modèles de l’insomnie mettent en lien cette perception erronée avec, entre autres, une hyperactivation corticale pendant la nuit, ce qui explique l’impression rétrospective de n’avoir que très peu dormi. Les objectifs de l’étude sont de préciser la relation entre le traitement de l’information et la mésestimation du sommeil pour le temps passé éveillé après l’endormissement et de valider l’utilisation d’un nouvel index de mésestimation. Pour ce faire, 50 bons dormeurs, 69 personnes souffrant d’insomnie (psychophysiologique : 40; paradoxale : 29) ont dormi 4 nuits en laboratoire. La première nuit servait de dépistage et d’adaptation au contexte du laboratoire. Les nuits 2 et 3 servaient à la classification du type de dormeur. Le protocole de potentiels évoqués cognitifs était administré à la 4e nuit. Les agendas de sommeil ont permis la comparaison des données subjectives et objectives pour créer l’index de mésestimation et la séparation des groupes de mésestimation (modérée ou forte). Comme attendu, le traitement de l’information était plus important lors de sons plus rares et intrusifs. Les personnes souffrant d’insomnie paradoxale avaient une réponse P2 plus ample que les autres types de dormeurs, et ce traitement de l’information était accru au début de la nuit. Les personnes souffrant d’insomnie paradoxale qui se trouvaient classifiées dans la mésestimation modérée présentaient tout de même un traitement de l’information plus important que les autres groupes de dormeurs. L’étude valide l’utilisation de l’index de mésestimation pour le temps passé éveillé après l’endormissement et démontre l’importance d’utiliser un indice sur plusieurs nuits plutôt qu’une seule.
Abstract
Insomnia is a psychological disorder which diagnosis is based on subjective data. However, some individuals suffering from insomnia report much greater difficulties than what is objectively observed. These individuals suffer from paradoxical insomnia, where sleep is mistaken for wake, leading to a poor perception of sleep. Models of insomnia link this erroneous perception with, among others, cortical hyperactivation during the night, which explains the retrospective impression of having slept poorly. The objectives of the present study are 1) to clarify the relationship between the treatment of information and the misperception of sleep for the time spent awake after sleep onset and 2) to validate the use of a new index to quantify misperception. Participants, 50 good sleepers, 69 individuals suffering from insomnia (psychophysiological: 40; paradoxical: 29) slept 4 nights in the laboratory. The first night served as a screening and adaptation to the laboratory context. Nights 2 and 3 were used for classification in one of the three groups of sleepers. The event-related potentials protocol was administered on Night 4. Sleep diaries for laboratory nights allowed comparisons of subjective and objective data so to create the misperception index to separate subjects in two groups according to the degree of misperception (moderate or strong). As expected, information processing was more important with rare and intrusive tones. Individuals suffering from paradoxical insomnia presented a larger P2 amplitude than other types of sleepers, P2 being especially large at the beginning of the night. Individuals suffering from paradoxical insomnia who were classified in the moderate misperception group presented had increased information processing compared with other groups of sleepers. The study validates the use of the misperception index for the time spent awake after sleep onset and shows the importance of using an index over several nights rather than just one.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... viii
Liste des abréviations et des sigles ... ix
Remerciements ... x 1. Introduction ... 1 1.1. Insomnie : Définition ... 1 1.2. Types d’insomnie ... 2 1.3 Modèles théoriques ... 3 1.3.1 Modèle comportemental (3P). ... 3 1.3.2 Modèle neurocognitif. ... 4
1.3.3 Modèle d’inhibition psychobiologique. ... 5
1.3.4 Modèle cognitif de l’insomnie. ... 7
1.4 Mesures du sommeil ... 8
1.5 Mésestimation du sommeil ... 10
1.6 Activation corticale ... 13
1.7 Objectifs et hypothèses de l’étude ... 18
2. Méthode ... 20
2.1. Recrutement ... 20
2.2. Critères de sélection et d’exclusion ... 20
2.3. Échantillon final ... 21
2.4. Mesures et instruments ... 22
2.4.1. Index de Sévérité de l’Insomnie. ... 22
2.4.2. Entrevue Diagnostique de l’Insomnie. ... 22
2.4.3. Agenda du sommeil. ... 22
2.4.4. Enregistrement polysomnographique. ... 23
2.4.5. Potentiels évoqués cognitifs. ... 24
2.4.6. Procédure : le paradigme « oddball ». ... 25
2.5. Analyses statistiques ... 26
3. Résultats ... 27
3.1. Caractéristiques des participants ... 27
3.2. Données de sommeil objectives ... 28
3.4. Données de sommeil pendant la nuit expérimentale (présentation des PEC) ... 29
3.6. Mésestimation ... 31
3.7. Potentiels évoqués cognitifs ... 35
3.7.1. Traitement de l’information... 36
3.7.2. Différences entre les types de dormeurs. ... 37
3.7.3. Différences entre les groupes de mésestimation... 37
4. Discussion ... 41
4.1 Classification des groupes de dormeurs ... 41
4.2 Classification des groupes de mésestimateurs ... 41
4.3 Traitement de l’information ... 43
4.3.1 Différences selon le type de dormeurs. ... 43
4.3.2 Différences selon le type de mésestimateurs. ... 45
4.4 Implications de l’étude ... 46 4.4.1 Implications théoriques. ... 46 4.4.2 Implications méthodologiques. ... 47 4.4.3 Implications pratiques. ... 48 4.5 Limites ... 49 4.6 Avenues de recherche ... 50 Références ... 52
Annexe A : Critères diagnostiques de l’insomnie ... 63
Annexe B : Research Diagnostic Criteria for Psychophysiological Insomnia ... 65
Annexe C : Research Diagnostic Criteria for Paradoxical Insomnia ... 67
Annexe D : Index de Sévérité de l'Insomnie (ISI) ... 69
Annexe E : Entrevue diagnostique de l'insomnie (pré) ... 71
Annexe F : Questionnaire des nuits en laboratoire ... 77
Annexe G : Agenda du sommeil adapté de Carney et al., 2012 ... 79
Annexe H : Données moyennes brutes de l’amplitude des PEC selon le groupe et la mésestimation. ... 80
Liste des tableaux
Tableau 1. Caractéristiques sociodémographiques et cliniques des participants. ... 27
Tableau 2. Données de sommeil objectives (moyennes des nuits 2 et 3) ... 28
Tableau 3. Données de sommeil subjectives (moyenne nuits 2 et 3 en laboratoire). ... 29
Tableau 4. Données objectives et subjectives pour la nuit expérimentale. ... 30
Tableau 5. Degré de mésestimation des participants selon les groupes. ... 31
Tableau 6. Effectifs des catégories de mésestimation et des types de dormeur ... 32
Tableau 7 Caractéristiques sociodémographiques et cliniques selon les groupes de mésestimation ... 33
Tableau 8. Données objectives et subjectives pour la nuit expérimentale selon les groupes de mésestimation ... 34
Tableau 9. Résultats du modèle mixte linéaire ... 36
Liste des figures
Figure 1. Modèle comportemental de l’insomnie ... 3
Figure 2. Modèle neurocognitif de l’insomnie ... 5
Figure 3. Modèle neurocognitif ... 6
Figure 4. Modèle cognitif de l’insomnie ... 8
Figure 5. Schéma explicatif ... 11
Figure 9. Continuum de mésestimation selon le type de dormeur ... 34
Figure 6. Effets d’interaction pour le traitement de l’information ... 39
Figure 7. Effets d’interaction pour le type de dormeur ... 39
Liste des abréviations et des sigles BD Bon(s) dormeur(s) EEG Électroencéphalogramme ES Efficacité du sommeil EOG Électrooculographie IM Index de mésestimation
INS Individus souffrant d’insomnie
IPA Individus souffrant d’insomnie paradoxale
IPS Individus souffrant d’insomnie psychophysiologique LS Latence au sommeil
MM Mésestimateurs modérés MF Mésestimateurs forts
PEC Potentiel(s) évoqué(s) cognitif(s) PSG Polysomnographie
S2 Sommeil de stade 2
S2D Sommeil de stade 2 de début de nuit S2F Sommeil de stade 2 de fin de nuit SP Sommeil paradoxal
TCC Thérapie cognitive comportementale
TEAE Temps passé éveillé après l’endormissement TTS Temps total de sommeil
Remerciements
La première personne que j’aimerais remercier est sans aucun doute ma directrice de recherche, Célyne Bastien. Célyne, tu as été pour moi au cours de ces dernières années un mentor et un guide extraordinaire. Tu m’as toujours poussée à aller plus loin et tu as cru en moi, et je t’en remercie, je n’aurais pas pu espérer avoir un meilleur soutien. J’aimerais ensuite remercier particulièrement Tijana Ceklic, qui a accepté de m’accompagner au début de mon parcours, ainsi qu’Isabelle Turcotte qui a effectué la collecte des données utilisées dans ce mémoire dans le cadre de sa thèse doctorale. Un merci tout spécial à Geneviève Boisclair Châteauvert pour son accompagnement pendant les dernières années.
Merci à ma famille, à mes parents pour m’avoir soutenu tout le long de mon parcours étudiant et de m’avoir toujours encouragé à aller plus loin et à ma petite sœur pour les soirées passées à écouter le seigneur des anneaux pour oublier la quantité de travail à faire. Un merci particulier à mon copain Alexandre qui a vécu de près les hauts et les bas des études supérieures et qui a été présent les cinq dernières années pour me faire rire lorsque je me sentais perdue et overwhelmed. Merci à Geneviève Belleville et Charles Morin pour leurs précieux commentaires. Finalement, j’aimerais remercier mes chats, qui ne se gênaient pas à sauter sur mon clavier lorsqu’ils sentaient que je travaillais trop longtemps. Merci aussi à mon entourage, ma belle-famille, mes amis et collègues qui ont été présents lors de ce parcours.
1. Introduction
L’insomnie est une problématique dite « subjective », c’est-à-dire que le diagnostic peut être posé sans validation de données physiologiques. Pourtant, lorsque les mesures physiologiques sont disponibles, certaines personnes souffrant d’insomnie (INS) font partie d’une catégorie distincte. Alors que ces INS souffrent d’insomnie et ont une plainte bien réelle, leur problématique de sommeil reste imperceptible selon les données physiologiques, ce qui se traduit par une perception erronée de leur sommeil. Il existe plusieurs hypothèses pour expliquer cette disparité entre les mesures objectives et subjectives, la plus plausible étant qu’une plus grande activation corticale causerait ces différences. La présente étude tentera de préciser le lien entre l’estimation erronée du sommeil et l’activation corticale.
1.1. Insomnie : Définition
L’insomnie est le trouble du sommeil le plus prévalent selon l’APA (American Psychiatric Association, 2013). En effet, 20% des Canadiens ne sont pas satisfaits de leur sommeil, 40% rencontrent tous les symptômes d’insomnie alors qu’environ 13% de la population canadienne souffrirait du syndrome de l’insomnie. De plus, l’insomnie serait associée plus particulièrement au sexe féminin, au vieillissement et à une moins bonne santé subjective (Morin et al., 2011).
L’insomnie peut se manifester à travers différentes difficultés. Il peut y avoir une difficulté à initier le sommeil (perturbations initiales), à le maintenir (perturbations de maintien) ou bien à se rendormir après un éveil matinal précoce (perturbations terminales). Dans la majorité des cas, on observe une combinaison de plusieurs de ces perturbations (APA, 2013). Aussi, pour avoir un diagnostic selon le DSM-5, il faut que ces difficultés de sommeil soient présentes au moins trois nuits par semaine et durent au moins trois mois, malgré des opportunités de sommeil adéquates (DSM-5; APA, 2013 & ICSD-3; American Academy of Sleep Medicine, AASM, 2014).
Plusieurs conséquences sont rapportées par ceux qui souffrent d’insomnie. Les conséquences les plus fréquentes sont une fatigue diurne, une détresse psychologique et de l’inconfort physique (Morin, LeBlanc, Daley, Gregoire & Merette, 2006). De plus, on note
une plus faible performance cognitive (Fortier-Brochu, Beaulieu-Bonneau, Ivers & Morin 2012), des difficultés de concentration, de mémoire et d’attention ainsi que des changements d’humeur (AASM, 2014). On remarque aussi une plus forte tendance à avoir recours à l’automédication, comme l’alcool, des produits en vente libre et des produits naturels, et à la médication prescrite (Harvey, 2002; Morin et al., 2011). Finalement, l’insomnie augmente le risque de souffrir d’autres troubles mentaux, plus particulièrement la dépression majeure (Riemann & Voderholzer, 2003), et est aussi un facteur de risque pour des maladies cardiovasculaires et métaboliques qui peuvent être fatales (Spiegelhalder et al., 2011).
1.2. Types d’insomnie
Il existe plusieurs types d’insomnie. Les plus fréquents sont l’insomnie psychophysiologique (IPS) et paradoxale (IPA). L’insomnie psychophysiologique est le type d’insomnie le plus prévalent. De manière générale, pour ceux qui en souffrent, les stimuli environnementaux reliés au sommeil, comme la chambre à coucher, sont associés à de l’anxiété et à de l’appréhension à l’idée de ne pas être capable de s’endormir. Ces préoccupations exagérées augmentent le niveau de vigilance, ce qui exacerbe les difficultés de sommeil (Hauri & Fisher, 1985).
À l’inverse des individus souffrant d’IPS, ceux souffrant d’IPA ont de la difficulté à estimer leur sommeil de manière adéquate. Ce type d’insomnie est moins prévalent, et est caractérisé par une difficulté à estimer le sommeil, ce qui entraine une plainte subjective beaucoup plus importante que les difficultés de sommeil objectives (Edinger & Fins, 1995; Salin-Pascual, Roehrs, Merlotti, Zorick & Roth, 1992). Dernièrement, la nécessité de séparer ces deux types d’insomnie est questionnée, même que les versions les plus récentes du DSM (APA, 2013) et de l’ICSD (AASM, 2014) ne les distinguent plus, les données empiriques pour les distinguer faisant défaut. Cependant, plusieurs chercheurs demeurent confiants et continuent de colliger des données empiriques, entérinant l’importance de faire la distinction entre ces deux types (p. ex. Bastien, Turcotte, St-Jean, Morin, & Carrier, 2013; Edinger & Krystal, 2003; Pérusse et al. 2015; St-Jean, Turcotte, Pérusse & Bastien, 2013).
1.3 Modèles théoriques
Plusieurs modèles théoriques ont été développés pour expliquer l’insomnie. Parmi ceux-ci, quatre ont prépondérance et sont souvent cités dans la littérature scientifique : comportemental, neurocognitif, inhibition psychobiologique et activation cognitive.
1.3.1 Modèle comportemental (3P).
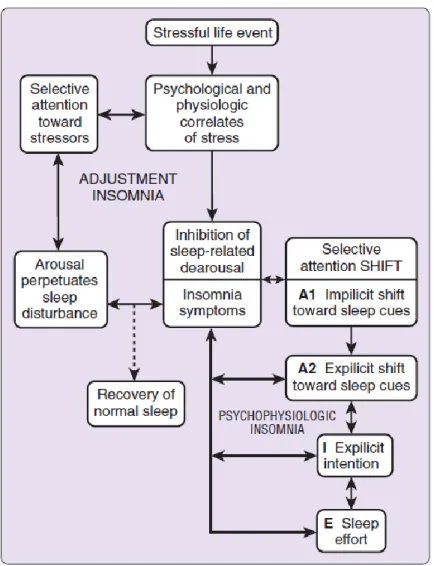
Le modèle comportemental (voir Figure 1) indique que certaines vulnérabilités (facteurs prédisposants; predisposing factors), lorsque couplées avec un facteur précipitant (precipitating factor) comme un stress, peuvent faire apparaitre une insomnie aiguë. Lorsque ceci survient, la plupart des individus auront recours à l’utilisation de stratégies d’adaptation inappropriées, telles que des siestes diurnes, pour pallier les difficultés de sommeil rencontrées. Avec le temps, ces stratégies interfèrent avec le sommeil sain, deviendraient des facteurs de maintien (facteurs perpétuants; perpetuating factors), et contribueraient à la chronicisation de l’insomnie (Spielman, Caruso & Glovinsky, 1987).
Figure 1. Modèle comportemental de l’insomnie
1.3.2 Modèle neurocognitif.
Selon le modèle neurocognitif de l’insomnie (voir Figure 2) de Perlis, Giles, Mendelson, Bootzin & Wyatt (1997), une hyperactivation corticale (cortical arousal) serait présente chez les INS. Cette activité corticale plus élevée interférerait avec l’endormissement et le processus d’amnésie mésograde (le fait qu’au réveil, le rappel de la période d’endormissement peut être difficile). L’insomnie entrainerait pendant la nuit un niveau plus élevé de traitement de l’information (information processing) et des processus mnémoniques (short-term and long-term memory formation), qui rendraient plus difficile la distinction entre le sommeil et l’éveil (perceived wakefulness vs. PSG sleep). Tous ces processus actifs pendant la nuit seraient responsables d’un jugement rétrospectif du temps d’endormissement et de sommeil erroné (sleep state misperception; Perlis et al., 1997). Ce modèle a été testé et appuyé par un très grand bassin d’études, particulièrement en utilisant l’analyse spectrale de l’EEG et démontrant des puissances élevées dans les bandes de fréquences rapides (bêta et gamma; voir Bastien, 2011, Bonnet & Arand, 2010 et Riemann et al., 2010 pour des revues).
Figure 2. Modèle neurocognitif de l’insomnie
Source : Perlis, Shaw, Cano & Espie, 2011.
1.3.3 Modèle d’inhibition psychobiologique.
Un autre modèle vient compléter les deux précédents (voir Figure 3). Il s’agit du modèle d’inhibition psychobiologique d’Espie (2002), selon lequel les INS auraient de la difficulté à ne pas traiter leur environnement (stimuli environnementaux). En fait, les INS ne se désengagent pas suffisamment des processus de l’éveil (inhibition of sleep-related
entrainerait des symptômes s’insomnie (insomnia symptoms; Espie, 2002). De plus en plus d’études utilisent ce modèle comme explication, dont une récente (Bernard, Ivers, Savard & Savard, 2016), démontrant que l’activité physique rendrait plus difficile le désengagement des processus d’éveils pendant la nuit et augmenterait le temps d’éveil après l’endormissement (TEAE). D’autres études (p. ex. Bastien, Guimond, St-Jean & Lemelin, 2008a; Scott et al., 2016; Smith et al., 2002; van Wyk, Thomas, Solms & Lipinska, 2016) ont offert un appui empirique à ce modèle.
Figure 3. Modèle d’inhibition psychobiologique
1.3.4 Modèle cognitif de l’insomnie.
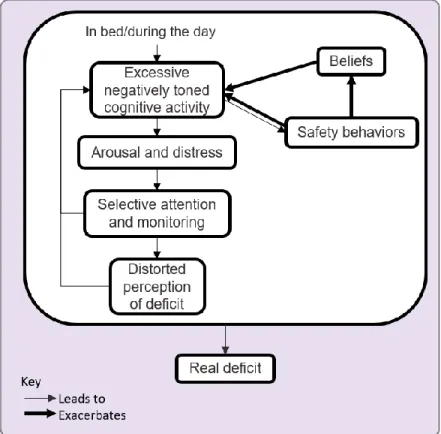
Finalement, un dernier modèle de l’insomnie a été développé par Harvey (2002). La Figure 4 fait état de ce modèle. Celui-ci met un accent plus important sur la composante d’activation cognitive (excessive negatively toned cognitive activity). Les INS sont plus anxieux par rapport à leur sommeil, ce qui engendre une attention plus sélective envers des indices reliés à celui-ci (selective attention and monitoring). L’individu serait plus à l’affût des sensations corporelles (internes) et environnementales (externes) pour détecter des menaces liées au sommeil. Le moindre signe de fatigue mènerait à une inquiétude exagérée, comme le fait de penser ne pas être en mesure de fonctionner adéquatement durant la journée (distorted perception of deficit; Harvey, 2002, Tang & Harvey 2004a). Une étude de Wuyts et al. (2012) appuie l’influence de l’activation cognitive alors que des individus qui ne souffraient pas d’insomnie, lorsque soumis à une tâche impliquant une activation cognitive, rapportaient une LS plus longue que la condition contrôle. Cette activité cognitive était aussi reliée à l’activation corticale et à de l’activation physiologique. Beaucoup d’autres études ont confirmé le rôle de l’anxiété et du biais attentionnel dans l’insomnie (e.g. Lin, Xie, Yan & Yan, 2017; Palagini, Moretto, Dell'Osso & Carney, 2017; Takano, Boddez & Raes, 2016)
Figure 4. Modèle cognitif de l’insomnie
Source : Harvey, 2002.
Le présent mémoire emprunte des concepts des modèles neurocognitif, d’inhibition psychobiologique et cognitif. En effet, le constat général de ces modèles est qu’une hyperactivation (corticale, cognitive) semble être une caractéristique primaire de l’insomnie. Le modèle d’inhibition psychobiologique précise que cette activation serait du traitement de l’information accru, ce qui est mesuré dans la présente recherche. Différentes études aux mesures variées (autonomes, neuroendocrines, neuroimmunologiques, neuroimagerie, analyse spectrale et potentiels évoqués cognitifs) appuient empiriquement la présence d’une hyperactivation corticale chez les INS durant l’éveil et l’endormissement, mais également durant le sommeil (voir Bastien, 2011 et Riemann et al, 2010 pour des revues).
1.4 Mesures du sommeil
La mesure étalon du sommeil est la polysomnographie (PSG) comportant au moins trois mesures physiologiques de base : l’électroencéphalographie, l’électrooculographie et l’électromyographie. Alors que l’électrooculographie réfère aux mouvements des yeux et que
l’électromyographie réfère à la tension musculaire, l’électroencéphalographie (EEG) pour sa part réfère à la mesure de l’activité cérébrale. Ces trois indices physiologiques permettent de codifier les stades et paramètres du sommeil qui composent la macro- et la microstructure du sommeil. L’EEG est la mesure physiologique principale dans le cadre de ce mémoire.
Le sommeil est séparé en différents stades selon les ondes EEG (caractérisées par leur amplitude (hauteur en microvolts) et leur fréquence, ou vitesse, en hertz), le tonus musculaire et les mouvements oculaires. Les différents stades de sommeil sont le sommeil léger (stades 1 et 2), le sommeil lent-profond (stades 3 et 4), et le stade de sommeil paradoxal. Pendant l’endormissement (stade 1), les ondes EEG sont de plus en plus lentes et amples et le tonus musculaire et les mouvements oculaires diminuent. Le stade 2 marque le début du sommeil en soi avec l’arrivée d’évènements phasiques tels que les complexes K et les fuseaux de sommeil, tous deux des graphoéléments indicateurs de sommeil. Le stade 2 est aussi la porte d’entrée vers le stade de sommeil paradoxal (SP), moment où l’on se souvient le plus de nos rêves. Notons que le SP est caractérisé non seulement par la présence de rêves, mais aussi par les mouvements oculaires rapides et une atonie musculaire. Finalement, les stades 3 et 4 représentent le sommeil lent-profond. La nuit est composée de phases descendantes de sommeil, ou approfondissement du sommeil (du stade 1 au stade 4) et de phases ascendantes (du stade 4 au stade 2 et accès au SP; Rechtschaffen & Kales, 1968). Chez les bons dormeurs (BD) adultes (entre 25 et 45 ans), moins de 5% de la nuit est allouée au stade 1, alors que 50% du temps de sommeil correspond au stade 2. Le sommeil lent-profond représente environ 20 à 25% de la nuit et le SP occupe le 25% restant (Ohayon, Carskadon, Guilleminault, & Vitiello, 2004).
La proportion des stades serait globalement préservée chez les individus souffrant d’insomnie, mais certaines études ont démontré que les INS passent plus de temps dans les stades de sommeil léger à défaut des stades de sommeil profond et du SP (pour des revues, voir Baglioni et al., 2014, Feige et al, 2013 et Reite, Buysse, Reynolds & Mendelson, 1995). De plus, on dénote une plus grande fréquence des microéveils (éveils d’à peine quelques millisecondes) pendant le sommeil paradoxal et non paradoxal chez les INS comparativement aux BD, ce qui se traduit en une fragmentation du sommeil (Feige et al., 2008).
L’analyse de la macrostructure permet, en plus des différents stades de sommeil, de générer plusieurs paramètres du sommeil. La PSG indique le temps et le pourcentage de la nuit passé dans chacun des stades de sommeil, le nombre d’éveils pendant la nuit, le temps total de sommeil (TTS), le temps passé au lit et l’efficacité de sommeil (ES). De plus, on peut déterminer la latence au sommeil (LS; défini comme le temps entre l’intention de dormir et la première minute continue de S2), la latence au SP (défini comme le temps entre l’endormissement et la première période de SP) et le temps passé éveillé après l’endormissement (TEAE).
Tout comme pour les stades de sommeil, certaines différences entre les BD et les INS peuvent être relevées pour certains paramètres du sommeil. D’abord, les BD adultes présentent un TTS d’environ 460 minutes (7,6 heures) et une latence au sommeil de moins de 30 minutes, passent moins de 20 minutes éveillés après l’endormissement et présentent une ES de plus de 85% (Ohayon et al., 2004). Les INS ont une plus longue période d’endormissement et prennent en moyenne 6 minutes de plus à s’endormir que les BD. Les INS présentent aussi un TTS réduit d’environ 23 minutes en moyenne par nuit et se réveillent 6 fois plus dans une nuit qu’un bon dormeur (voir la méta-analyse de Baglioni et al., 2014). De plus, l’efficacité du sommeil des INS est grandement réduite (Feige et al., 2013). Évidemment, les INS peuvent vivre différentes difficultés, donc certains peuvent avoir plus de difficulté à initier le sommeil, d’autres à le maintenir pendant la nuit ou le matin (Frankel, Coursey, Buchbinder & Snyder, 1976).
En laboratoire, la PSG est utilisée comme mesure objective des paramètres de sommeil. Des mesures subjectives comme l’agenda du sommeil (Carney et al., 2012) sont aussi utilisées pour, entre autres, déterminer la différence entre la perception du sommeil et le sommeil objectif. Ces différences de perception sont la principale caractéristique des IPA, qui ont une forte tendance à présenter une estimation de leur sommeil qui n’est pas fidèle aux mesures objectives.
1.5 Mésestimation du sommeil
Comme mentionné précédemment, les IPA ont surtout des difficultés de perception de sommeil. Plusieurs paramètres de sommeil sont touchés par cette mésestimation. D’abord,
lorsque comparés aux bons dormeurs et aux IPS, les IPA sont davantage portés à estimer à la hausse la LS et le TEAE, et estimer à la baisse le TTS et leur ES. Globalement, ils ont tendance à surestimer le temps passé éveillé et à sous-estimer le temps passé endormi (Means, Edinger, Glenn & Fins, 2003; Perlis, Smith, Andrews, Orff & Giles, 2001b).
À l’aide des données recueillies avec l’agenda et la PSG, on peut déterminer le degré de mésestimation. La mésestimation est un facteur important à considérer lors d’études sur l’insomnie puisqu’elle peut facilement être néfaste pour le dormeur. La perception d'un mauvais sommeil en l’absence de difficultés de sommeil objectives peut mener le dormeur à utiliser des stratégies d’adaptation inappropriées comme le fait de faire des siestes pendant la journée, se coucher plus tôt en pensant s’endormir plus rapidement ou annuler ses activités le lendemain d’une nuit perçue comme mauvaise. Ces stratégies inadaptées peuvent à leur tour amener l’apparition ou exacerber des difficultés de sommeil objectives (Harvey & Tang, 2012; Tang & Harvey, 2005).
Figure 5. Schéma explicatif de la mésestimation
Source : Harvey & Tang, 2012.
La figure 5 présente le modèle intégratif de la mésestimation proposé par Harvey et Tang (2012) impliquant différents processus contribuant à la mésestimation du sommeil.
Selon leur revue de littérature, les facteurs contextuels peuvent constituer un terrain fertile pour la mésestimation. À cela s’ajoute une tendance à l'inquiétude et à l'attention sélective (activation cognitive) ainsi qu’une activation corticale accrue qui contribue à un état d'activation limbique à la suite d'une altération dans les circuits neuronaux (VLPO) qui conduit à l’activation chronique du système de vigilance. Cet état de vigilance empêche ainsi le dormeur de pénétrer complètement dans un état de sommeil et peut provoquer des micros-éveils pendant la nuit et rendre plus floue la distinction de l’éveil du sommeil. Ce modèle sert de base pour la présente étude, puisqu’il fait le lien entre l’activation corticale et le fait d’avoir une mauvaise estimation de son sommeil.
Afin de quantifier la mésestimation, plusieurs formules ont été proposées. La plus simple d’utilisation et de compréhension est la soustraction de la donnée subjective de la donnée objective (ou l’inverse). Un ratio peut aussi être utilisé, donnant un résultat en pourcentage (Edinger & Fins, 1995; Vanable, Aikens, Tadimeti, Caruana-Montaldo & Mendelson 2000). Récemment, un nouvel indice a été proposé pour pallier les limites des autres formules. Ce nouvel index de mésestimation (IM) proposé par Manconi et al. (2010) est représenté par la formule suivante :
𝑜𝑇𝑆𝑇 − 𝑠𝑇𝑆𝑇 𝑜𝑇𝑆𝑇
où « o » représente objectif et « s » subjectif. Un score négatif représente la surestimation, alors qu’un score positif représente et la sous-estimation. Dans leur validation avec le TTS, les données étaient distribuées entre 1 et -1. Les résultats de leur étude ont révélé un sous-groupe d’INS qui mésestimait grandement leur TTS. Ils ont nommé ce groupe forts mésestimateurs (highly misperceptive) et émettent l’hypothèse que ces INS présentant une forte mésestimation feraient partie du sous-type d’insomnie paradoxale. Herbert, Pratt, Emsley & Kyle (2017) ont validé l’utilisation de l’IM pour le TTS et l’étude de Maes et al. (2014) a utilisé l’IM pour la latence au sommeil. Toutefois, ces deux études évaluaient les INS en général, sans différencier les IPS et les IPA, ce qui implique des scores de mésestimation plutôt faibles. Aucun groupe de recherche ne semble avoir validé l’utilisation avec le TEAE.
1.6 Activation corticale
En plus de l’analyse macrostructurelle traditionnelle, la PSG peut être évaluée plus en profondeur, ce qui correspond à la microstructure du sommeil. Quelques méthodes d’analyse microstructurelle existent, et la plus utilisée est l’analyse spectrale (voir Bastien, 2011 pour une revue). Il s’agit d’une analyse quantitative de l’EEG qui cible l’amplitude et la fréquence des ondes à l’aide de transformations rapides de fourrier (Cooley & Tukey, 1965). Les études sur l’EEG ont généré beaucoup de connaissances sur l’activation et les ondes corticales pendant le sommeil. Par exemple, l’EEG des INS présente une proportion plus élevée d’ondes dans les bandes de fréquences rapides (bêta et gamma), indiquant une activité corticale accrue pendant la nuit (Perlis et al., 1997, 2001b), et une réduction moins marquée de bêta à l’endormissement comparativement aux BD (Merica, Blois & Gaillard, 1998).
Lorsque les IPS et IPA sont comparés, on peut observer une proportion plus faible d’ondes dans la bande de fréquence delta (ondes lentes qui marquent un sommeil profond) et plus élevée d’ondes dans les fréquences bêta et gamma dans le sommeil non paradoxal chez les IPA (Krystal, Edinger, Wohlgemuth & Marsh, 2002 ; St-Jean et al., 2013). La plus grande activité corticale, mesurée par l’analyse spectrale, serait un corrélat de la perception d’un sommeil problématique en dépit d’indices objectifs de l’insomnie (Perlis et al., 2001b).
De plus, ce type d’étude a permis d’émettre plusieurs hypothèses sur les processus sous-jacents à l’hyperactivation. L’activité corticale plus élevée lors de l’endormissement serait associée à l’atténuation de l’amnésie mésograde normale du sommeil (Perlis, Smith, Orff, Andrews & Giles., 2001c; Wyatt, Bootzin, Allen & Anthony, 1997), et la tendance de l’individu à surestimer le temps d’endormissement serait attribuable à un traitement de l’information plus important (Perlis, Merica, Smith & Giles, 2001a).
Bien que l’analyse spectrale permette d’étudier le degré d’activation corticale, ce type de microanalyse ne peut expliquer que signifie cette activation. L’analyse des potentiels évoqués cognitifs (PEC), une autre méthode pour mesurer l’activation corticale, vise particulièrement le traitement de l’information et permet de différencier les différents mécanismes de ce traitement (vigilance, inhibition des stimuli, etc.). Les PEC représentent les réponses électrophysiologiques sous-corticales ou corticales à la suite de la présentation
d’un stimulus sensoriel (Luck & Kappenman, 2011). Cette méthode est utilisée pour de nombreuses études à l’éveil, mais est aussi une très bonne mesure pour étudier l’activation corticale pendant le sommeil. Elle permet de mesurer le traitement de l’information associé à un stimulus précis. Dans le cas du sommeil, il s’agit presque exclusivement de stimuli auditifs comme des sons présentés au dormeur. Toutefois, deux études récentes ont démontré qu’il est possible d’utiliser des stimulations visuelles pendant le sommeil (Sharon & Nir, 2017; Norton, Umunna & Bretl, 2017). L’utilisation des PEC dans l’étude du sommeil est idéale puisque les protocoles d’enregistrement des PEC n’exigent alors pas de réponse comportementale ou verbale. La présentation répétée d’un même type de stimulus génère plusieurs PEC qui peuvent être ensuite moyennés pour obtenir une onde qui reflète l’activité corticale. On présente deux types de stimuli; les stimuli standards, à tonalité plus basse et à fréquence élevée, et les stimuli déviants, à tonalité plus élevée et à fréquence plus rare (Colrain & Campbell, 2007).
Les ondes obtenues par le moyennage sont constituées de plusieurs composantes, qui sont nommées selon leur polarité et la latence à laquelle elles apparaissent, et catégorisées selon le moment d’apparition après le stimulus. Les PEC qui se produisent dans les 50 premières millisecondes après la présentation du stimulus sont des PEC à latence courte et moyenne. Les réponses associées à ces stimuli représentent l’activité du nerf auditif, des centres de relais du tronc cérébral, les réponses automatiques au stimulus externe, ainsi que le traitement au niveau du thalamus et du cortex auditif primaire. Ces premières réponses sont principalement exogènes. Après 50 millisecondes et pouvant aller jusqu’à 900 ms, il s’agit de PEC à latence longue. Les PEC à latence longue sont les composantes les plus utilisées dans les recherches cognitives puisqu’elles sont sensibles aux effets de l’attention et de la conscience (pour des revues, voir Campbell, 2010; Campbell & Colrain, 2002 et Muller-Gass & Campbell, 2002).
Certaines composantes des potentiels évoqués apparaissent à l’éveil et pendant le sommeil. Ces composantes sont le N1, P2 et P3. Le N1, onde négative avec un pic se situant vers 100 ms après la présentation du stimulus, est un indice de l’attention et de vigilance. À l’éveil, l’onde serait plus ample lorsque la personne est plus attentive (Näätänen, 1990). Le P2, onde positive ayant son pic à 200 ms post-stimulus, bien que moins bien compris,
représenterait l’inhibition du traitement de l’information (Crowley & Colrain, 2004). Le P3 n’apparait que lorsqu’un stimulus rare est détecté. Cette onde serait un reflet du traitement conscient de l’information, qu’il s’agisse de la discrimination du stimulus ou de la mise à jour contextuelle de la mémoire de travail. Lorsque la personne n’est pas attentive, le P3 peut être généré par des stimuli intrusifs, nouveaux ou pertinents (Campbell, Bell, & Bastien, 1992; Cote, 2002; Patel & Azzam, 2005)
Pendant l’endormissement et le sommeil, les réponses PEC sont différentes. Alors que le sommeil s’approfondit, l’amplitude de la réponse N1, représentant l’attention, est de moins en moins ample. En effet, le niveau d’attention diminue lorsque la personne s’endort. La réponse P2, au contraire, devient plus ample avec le sommeil. En effet, une plus grande inhibition du traitement de l’information serait requise pour rester endormi (Campbell & Colrain, 2002; Crowley & Colrain, 2004). Le P3 à proprement dit ne peut apparaitre qu’en SP et représente un traitement automatique des sons bruyants et rares. Finalement, une nouvelle composante apparait uniquement pendant l’endormissement, le N350. Cette composante est un indicateur du sommeil (Bastien, Crowley & Colrain, 2002) et reflète l’inhibition du traitement de l’information (Bastien, St-Jean, Morin, Turcotte & Carrier, 2008b). En général, pendant la nuit, on observe une diminution du traitement de l’information et une augmentation de son inhibition.
En plus des différences entre l’éveil et le sommeil, les réponses corticales aux stimuli diffèrent selon la période de la nuit. Pendant le SP, les composantes N1 et P2 retournent à environ 50% de leur amplitude à l’éveil (Bastuji, García-Larrea, Franc & Mauguière, 1995; Cote, Etienne & Campbell, 2001; Crowley & Colrain, 2004). Certaines hypothèses avancent que le SP serait plus semblable à l’éveil, ce qui aurait un effet sur les réponses PEC aux stimuli. (Hull & Harsh, 2001; Horne, 1988).
Quelques études ont comparé les réponses PEC des bons dormeurs et des INS. En 2006, Sforza et Haba-Rubio n’ont pas observé de différences entre les BD et INS pour l’amplitude de N1, P2 et P3 avant et après le sommeil. Cependant, ils n’ont évalué que les stimuli déviants. Les résultats de l’étude de Yang et Lo (2007) ont démontré un N1 plus ample et un P2 moins ample face aux stimuli rares et un N350 moins ample face aux stimuli standards
chez les INS comparés aux BD dans les 5 premières minutes de stade 2 continu. Ces chercheurs ont conclu qu’il y a une augmentation de l’attention et une réduction des processus d’inhibition pendant l’endormissement chez les INS. En 2008, Bastien et ses collaborateurs ont mesuré les PEC à l’éveil, et ont observé une augmentation du N1 chez les INS le soir et le matin comparé aux BD (électrodes Pz et Fz). De plus, l’amplitude du P2 était marginalement plus ample chez les INS le soir (Fz). Finalement, Kertesz et Cote (2011) n’ont pas trouvé de différences entre les INS et les BD pour le N1 (Fz, Cz, Pz). Il y avait par contre un P2 moins ample et un P3 marginalement plus ample chez les INS. Cette étude n’incluait toutefois que des IPS ayant des difficultés à initier le sommeil. Pour résumer, la composante N1 semble être plus ample chez les INS alors que plus d’information est nécessaire pour comprendre la composante P2 chez les INS.
Les études énoncées précédemment ne comparaient que les bons dormeurs avec les INS en général, qui sont majoritairement des IPS. Les études de Turcotte, St-Jean & Bastien (2011) et Bastien et al, (2013) viennent préciser ces résultats en incluant les IPA. Dans ces deux études, l’amplitude de N1 était plus large pour les IPA que les IPS et que les BD. Ces résultats sont en accord avec le modèle neurocognitif de l’insomnie, selon lequel les INS seraient plus activés corticalement, et que cela se manifesterait par plus d’attention et de traitement sensoriel et de l’information. Pour ce qui est du P2, son amplitude était augmentée chez les IPA comparés aux IPS. Il avait déjà été établi que les IPA étaient plus affectés par les stimuli auditifs présentés pendant la nuit, ce qui explique une amplitude plus large du P2. En effet, les IPA auraient un besoin d’inhibition plus important, ce qui entrainerait un P2 plus ample.
À la lumière de ces résultats, Bastien et al, (2013) émettent l’hypothèse que l’activation corticale, mesurée par les PEC, se manifesterait de manière différente chez les IPS et les IPA. L’amplitude plus ample du P2 chez les IPA pourrait être reliée à la qualité subjective de sommeil, et par le fait même, à la mésestimation du sommeil.
La grande majorité des études sur la relation entre l’activation corticale et la mésestimation du sommeil utilisent l’analyse spectrale de l’EEG comme mesure de l’activation. Les conclusions générales de ces études suggèrent que l’activité EEG accrue
dans les bandes de fréquences rapides est liée aux processus qui interfèrent avec la perception de la qualité et de la quantité du sommeil. De plus, une proportion plus faible d’ondes dans les bandes de fréquence lentes (lentes, delta) et plus élevée dans les bandes de fréquences rapides (bêta, gamma) en sommeil non paradoxal chez les IPA, qui sont les plus sujets à la mésestimation, serait un corrélat de la perception d’un sommeil problématique en dépit d’indices objectifs de l’insomnie (Krystal et al., 2002; Perlis et al., 2001b). Ces conclusions sont en accord avec le modèle neurocognitif de l’insomnie, selon lequel la mauvaise estimation du sommeil serait en lien avec l’hyperactivation corticale.
L’étude de Bastien et al. (2013) inclut une analyse de la relation entre les réponses PEC et la mésestimation du sommeil. Selon cette étude, chez les IPA, un N1 plus ample est associé à de la surestimation du TEAE pendant le SP et à de la sous-estimation du TTS. Ces résultats sont en accord avec Feige et al. (2008), qui avaient observé que la mésestimation du sommeil se manifestait particulièrement par la perception du temps éveillé, surtout pendant le SP. Étant donné que le N1 plus ample est associé à la mésestimation du temps éveillé chez les IPA, et que ce groupe est le plus affecté par les stimulations (Turcotte et al, 2011), le N1 plus ample pourrait être un reflet du caractère envahissant des stimulations. Les IPA seraient donc plus à risque de confondre le sommeil avec de l’éveil, surtout en SP.
D’un point de vue théorique et méthodologique, il est important d’étudier le lien de mésestimation et d’activation corticale pour apporter plus d’appui empirique aux écrits et affirmer le lien entre ces deux concepts. De plus, l’utilisation de mesures différentes d’activation corticale et des différentes manières de conceptualiser la mésestimation ne permet pas d’arriver à une généralisation des résultats et à un consensus scientifique. Cependant, séparer les types d’insomnie dans les études apporterait un appui empirique à l’importance de cette différentiation. D’un côté pratique, connaitre les mécanismes sous-jacents à l’activation corticale accrue et le lien avec la mésestimation du sommeil permettrait des avenues de traitement plus spécifiques aux individus souffrant d’une mauvaise perception de sommeil. Comme la mésestimation du sommeil est un facteur précipitant et perpétuant de l’insomnie, si ces patients sont traités pour une insomnie objective, mais qu’aucun travail n’est fait par rapport à leur mésestimation, la perception d’insomnie peut
refaire surface. Ce danger est bien réel et même nommé par le Dr. James Russell déjà en 1861 :
« In treating these cases [of sleeplessness], the key to success lies in the management of the patient’s mind, and unless we recognize the large share which is taken by mental disorder in producing and perpetuating the various and puzzling symptoms which present themselves, we shall not only fail in our object, but shall be in danger of actually aggravating the malady […] our chief attention must be directed to regulating and strengthening the mind, otherwise our medicines will only serve to fix the patient’s attention more closely upon the symptoms, and induce reliance upon external measures rather than upon self discipline. » (Russell, 9 November 1861, BMJ editorial, p. 489)
1.7 Objectifs et hypothèses de l’étude
Les études de Turcotte et al. (2011) et de Bastien et al. (2013) font partie des rares études qui incluent les IPA ou qui forment un groupe séparé pour ceux-ci. Aussi, rares sont les études sur la mésestimation du sommeil qui ont utilisé les PEC comme mesure de l’activation corticale, et ces études utilisent pertinemment des corrélations pour évaluer les liens avec l’activation corticale.
La présente étude a pour objectif premier de préciser la relation entre l’activation corticale, mesurée à l’aide des PEC, et la mésestimation. Deux facteurs seront ajoutés à la mesure d’activation corticale et de mésestimation, c’est-à-dire, les différents stades de sommeil et le type d’insomnie, afin de déterminer quelle importance relative ont ces facteurs. Un objectif secondaire de l’étude est de d’utiliser l’index de mésestimation avec le paramètre du TEAE.
Il est attendu qu’une plus grande activation corticale, manifestée par un N1 plus ample, sera reliée à la surestimation du TEAE. Le P2, quant à lui, devrait être moins ample chez les IPS, et plus ample chez les IPA, représentant des formes différentes d’activation corticale. Le traitement de l’information devrait être plus important (N1 et P2 plus ample) chez les participants du groupe de mésestimateurs forts. Pour tous les groupes, le traitement
de l’information devrait être plus important lors de la présentation des sons déviants. Finalement, une réponse plus forte aux stimuli standards devrait être associée à une plus forte mésestimation.
2. Méthode 2.1. Recrutement
Les participants ont été recrutés à l’aide d’annonces par le biais de journaux locaux, dans le cadre de différents projets de recherche effectués entre 2004 et 2011 au Laboratoire de Sommeil et Potentiels Évoqués Cognitifs. Une entrevue téléphonique était administrée aux intéressés pour vérifier leur éligibilité à partir de caractéristiques sociodémographiques et de sommeil. Suite à cela, les formulaires de consentement et des questionnaires étaient envoyés par la poste pour les participants éligibles. On y retrouvait entre autres l’agenda du sommeil, les Index de dépression et d’anxiété de Beck (IDB et IAB; Beck, Epstein, Brown, & Steer, 1988a; Beck, Steer, & Garbin, 1988a) et l’Index de sévérité de l’insomnie (Morin, 1993). Suite à la réception des questionnaires complétés, les participants potentiels devaient se présenter en laboratoire pour une entrevue clinique. À leur arrivée, le consentement éclairé des participants était obtenu, et étaient ensuite administrées l’Entrevue Diagnostique de l’Insomnie (EDI; Morin, 1993) et l’entrevue clinique structurée du DSM-IV (SCID-CV; First, Spitzer, Gibbon & Williams, 1996). Les participants toujours éligibles étaient alors invités à passer quatre nuits en laboratoire avec la PSG.
2.2. Critères de sélection et d’exclusion
D’après les données obtenues par les questionnaires, les agendas, et les données PSG, trois groupes ont été créés. Les bons dormeurs constituent le groupe contrôle. Ils rapportent être généralement satisfaits avec leur sommeil et dorment au moins 7h par nuit. De plus, ils ne rencontraient pas les critères de l’insomnie, ne prenaient pas de médication pour aider le sommeil, rapportaient une ES (basée sur les 2 semaines d’agenda du sommeil) de plus de 85% et un score à l’ISI de moins de 8.
Les participants souffrant d’insomnie, selon les critères du DSM-IV (APA, 1994) et de l’ICD-10 (World Health Organization, 1992), ont été divisés en deux groupes, soit les IPS et les IPA, en se basant sur leurs données PSG et leurs agendas du sommeil obtenus en laboratoire.
Les IPS rencontraient les critères d’inclusion suivants : (a) la présence d’une plainte subjective d’insomnie, définie par une difficulté à initier le sommeil (LS>30 min), à maintenir le sommeil (TEAE>30 min) ou par un éveil trop tôt le matin (avant 6h30 ou avant le réveil matin), présente au moins 3 nuits par semaine; (b) la durée de l’insomnie est d’au moins 6 mois; (c) l’insomnie ou ses conséquences perçues causent une détresse significative ou une altération du fonctionnement social ou occupationnel; et (d) la présence d’une plainte subjective d’au moins une conséquence diurne négative attribuée à l’insomnie (voir annexe A et B pour les critères détaillés).
En plus de respecter les critères de l’insomnie énumérés précédemment, les IPA avaient aussi (a) un TTS objectif >6,5 heures, une ES objective>85% et (b) une différence marquée entre les mesures de sommeil objectives et subjectives (60 minutes ou plus de différence de TTS ou au moins 15% de différence entre l’ES subjective et objective Ces critères pour les IPA ont été dérivés des critères d’Edinger et al. (2004; annexe C).
Les participants étaient exclus de l’étude s’ils présentaient un trouble médical, neurologique ou de sommeil, tels que l’apnée du sommeil (index d’apnée-hypopnée >10) ou le mouvement périodique des membres (index myoclonique avec éveil >10). Les personnes rapportant des symptômes sévères d’anxiété ou de dépression, tel que suggéré par des scores supérieurs à 21 à l’IAB (Beck et al., 1988a) ou 23 à l’IDB (Beck et al., 1988b) étaient exclus de l’étude. De plus, ils étaient exclus s’il y avait eu abus de drogues ou d’alcool durant l’année précédente ou s’ils avaient utilisé des psychotropes ou d’autres médicaments altérant le sommeil et/ou des agents induisant le sommeil. Les participants utilisant une médication facilitant le sommeil, deux fois par semaine ou moins, devaient avoir respecté une période de sevrage d’au moins 2 semaines avant l’enregistrement PSG.
2.3. Échantillon final
L’échantillon final retenu pour cette étude est constitué de 50 BD, 40 IPS et 29 IPA. L’âge moyen des BD est 34,7 ± 9,0 ans, celui des IPS est 40,9 ± 9,1 ans et celui des IPA est 39,4 ± 9,2 ans. L’étendue d’âge est de 25 à 55 ans pour l’échantillon total. La durée moyenne de l’insomnie des IPS est de 8,7 ± 7,8 ans et celui des IPA, de 10,4 ± 8,0 ans. La durée de l’insomnie dans les groupes d’INS pouvait aller de moins d’un an jusqu’à 30 ans.
2.4. Mesures et instruments
2.4.1. Index de Sévérité de l’Insomnie.
Cet index est un bref questionnaire autorapporté qui fournit un indice quantitatif de la sévérité perçue de l’insomnie (Morin, 1993; Morin, Belleville, Bélanger & Ivers, 2011). Cet index reflète en partie les critères diagnostiques du DSM-IV (APA, 1994). Des
corrélations modérées à très fortes ont été observées entre l’index de sévérité de l’insomnie et l’agenda du sommeil. (Bastien Vallières & Morin, 2001; Blais, Gendron, Mimeault & Morin, 1997 pour la validation francophone; Annexe D). Dans la présente étude, seule l’échelle de sévérité est utilisée (première question), donc le score peut totaliser 15.
2.4.2. Entrevue Diagnostique de l’Insomnie.
L’Entrevue diagnostique de l’insomnie est une entrevue semi-structurée qui sert à la détection de la présence de l’insomnie et de facteurs potentiels contribuant au désordre. Cette entrevue permet d’identifier la nature de la plainte, la sévérité de l’insomnie, les conséquences diurnes et plusieurs autres aspects concernant l’insomnie (Morin, 1993; Annexe E).
2.4.3. Agenda du sommeil.
Il s’agit d’un agenda pour évaluer la qualité et la quantité subjective du sommeil. Les participants devaient le compléter chaque matin pendant 2 semaines avant de dormir en laboratoire, et chaque matin en laboratoire. Les paramètres dérivés de l’agenda qui nous intéressent sont : la LS, le TEAE, le TTS et l’ES. L’agenda permet de récolter les données subjectives afin d’effectuer un parallèle avec les données objectives obtenues par la PSG. Il est à noter que l’ES est un score composite, créé à partir de la perception subjective du participant de son temps total de sommeil et du temps passé au lit. Comme ce score est composé de mesures subjectives, il sera considéré comme un score subjectif pour comparer avec le score objectif créé à partir des mesures de la PSG (adapté de Carney et al., 2012; Annexes F et G).
2.4.4. Enregistrement polysomnographique.
Les participants ne devaient pas avoir consommé d’alcool les journées d’enregistrement et devaient réduire leur consommation de médication, de caféine et de nicotine avant l’arrivée au laboratoire. L’horaire de sommeil des participants était adapté selon les agendas du sommeil complétés auparavant. Cependant, tous les enregistrements PSG devaient durer au minimum 8 heures. Un montage PSG standard (système 10-20) était utilisé pour toutes les nuits et incluait l’enregistrement EEG (C3, C4, O1, O2, Fz, Cz, Pz), l’électromyographie (menton) et l’électrooculographie (EOG; électrodes de chaque côté, au-dessus et au-dessous des yeux et électrodes de référence; Gasser, 1977; Keenan, 2011).
La première nuit faisait office de nuit d’adaptation (Curcio, Ferrara, Piergianni, Fratello & De Gennaro, 2004) et de nuit d’évaluation pour des troubles du sommeil nécessitant des données PSG pour le diagnostic (c.-à-d. apnée du sommeil, mouvement périodique des membres). Le montage de la première nuit avait donc moins d’électrodes corticales à cause des électrodes additionnelles pour le tibia et la respiration. Un système amplificateur Grass de modèle 15A54 a été utilisé (gain = 10 000; bande passante = 0,3-100 Hz; Astro-Med, Inc, West Warwick, USA), et les signaux ont été digitalisés à un taux d’échantillonnage de 512 Hz, en utilisant un logiciel commercial (Harmonie, Stellate System, Montréal, Canada). L’environnement ERP a été contrôlé avec InstEP SystemsTM (V4.2) avec le même taux d’échantillonnage que la PSG. Les enregistrements de sommeil ont été évalués visuellement par des techniciens qualifiés en accord avec les critères standards utilisant des époques de 20 secondes (Rechtschaffen & Kales, 1968). Un évaluateur indépendant a conduit une évaluation de la fidélité afin d’assurer un minimum de 85% d’accord interjuges pour la codification des stades de sommeil (Luna, Stellate System, Montréal, Canada).
Les mesures objectives incluaient la LS (du moment où les lumières sont éteintes avec intention de dormir jusqu’à la première minute consécutive de stade 2), le TEAE, le TTS, le temps total d’éveil, l’ES (le pourcentage de TTS/temps total d’enregistrement), les pourcentages des stades 2, 3, 4 et SP, et la latence au sommeil SP. Les données cliniques objectives et subjectives des paramètres de sommeil (LS, TEAE, TTS, ES, stades de sommeil) des nuits 2 et 3 étaient utilisées pour la classification des BD/INS, et l’ES de la 4e
nuit était utilisée pour déterminer la qualité du sommeil des participants dans le présent projet.
2.4.5. Potentiels évoqués cognitifs.
Des stimulations auditives étaient présentées le soir avant le coucher et le matin, jusqu’à 15 minutes après l’éveil, pendant la 3e et 4e nuit, et pendant l’endormissement et toute la nuit la 4e nuit. Pour la calibration, chaque participant recevait une évaluation audiométrique du niveau d’audition normal (15 dB selon l'Organisation internationale de normalisation; 500, 1,000, 2,000, et 4,000 Hz). Les sons étaient présentés dans des écouteurs internes à l’oreille rattachés à un appareil auditif «EARTONE»® de Auditory Systems (Mississauga, ONT, Canada), et leur génération était contrôlée par le logiciel Presentation (Neurobehavioral Sciences; Albany, CA).
Un EEG continu (aux sites Fz, Cz, et Pz) était enregistré et stocké pour une analyse hors-ligne avec Analyzer 1.05 (Brain Vision; Morrisville, NC). Les PEC recueillis pendant chaque stade de sommeil étaient moyennés séparément. Chaque essai PEC était regroupé selon la catégorie de stimulus (standard ou déviant) pour ensuite être moyenné hors ligne. Des balayages de 700 ms reconstruits avec 100 ms avant la présentation du stimulus (niveau de base) et 600 ms post-stimulus pour les détections de PEC. L’amplitude des PEC était mesurée pour chaque bloc de présentation de sons pour chaque stimulus (standard ou déviant) à chaque période de temps.
Les données pour N1 et P2 étaient codifiées à Fz, Cz et Pz. Seules les données Cz ont été utilisées pour la présente étude. N1 était défini comme le pic le plus négatif entre 70 et 150 ms après le début du stimulus et P2 comme le pic le plus positif entre 150 et 250 ms après le début du stimulus. L’EEG était corrigé pour les artéfacts de l’EOG (Brunner et al, 1996) et ensuite moyenné selon le moment d’apparition suite au stimulus. Les essais avec artefacts (p. ex., mouvements des yeux, de la tête ou du corps, saturation de l’amplificateur) ou complexes K étaient rejetés pendant la procédure de moyennage (>100 V). Un filtre digital était utilisé avec une bande passante de 0,01 à 30 Hz pour 12 dB. Une correction ou un rejet était appliqué pour l’EOG. Pour contrôler pour l’effet du moment de la nuit, le stade 2 de
sommeil était sous-divisé en début et fin de nuit; stade 2 début (2D) était avant la 3e période de REM, et le stade 2 fin (2F) était après la 3e période de REM.
2.4.6. Procédure : le paradigme « oddball ».
Le paradigme « oddball » (« stimulus discordant » en français; Hansenne, 2000), consiste en des stimuli standards (70 dB, 50ms, temps de montée et descente de 2ms, 2000 Hz, probabilité de 0,85) et déviants (90 dB, 50 ms, temps de montée et descente de 2ms, 1500 Hz, probabilité de 0,15), présentés au hasard. L’intervalle interstimulus était de 2 secondes. Les stimuli étaient divisés en groupes de 3 blocs, chacun incluant 180 stimuli et le temps d’intervalle entre les blocs variait d’une à trois minutes. Avant d’aller au lit, les participants étaient informés qu’ils devaient ignorer les sons et ne pas leur porter attention pendant la nuit. Étant donné que les participants ont tendance à se réveiller avec la présentation de stimuli très envahissants (90 dB), les stimuli étaient présentés seulement pendant le sommeil consolidé; les sons commençaient seulement lorsque le participant présentait au moins 10 minutes de sommeil consolidé dans chacun des stades de sommeil. De plus, les 10 dernières minutes de chaque stade de sommeil étaient exclues des analyses. Donc, les pentes ascendantes et descendantes de sommeil ne sont pas incluses dans les analyses.
2.4.7. Mésestimation.
Il existe plusieurs façons de quantifier la mésestimation. Pour cette étude, la différence absolue en minutes sera utilisée pour représenter un portait des données de mésestimation des participants. Ce score est calculé en soustrayant le temps subjectif du temps objectif. Un score positif représente donc la sous-estimation et un score négatif pour la surestimation. Pour l’analyse principale, l’index de mésestimation (IM) de Manconi et al (2010) est utilisé. Ce score est calculé de la manière suivante : (objectif – subjectif) / objectif. Les scores varient théoriquement entre 1 et -∞ puisqu’il n’existe pas de limite théorique à la surestimation. Dans leur article, Manconi et al. (2010), portent la limite inférieure à -1 pour circonscrire les scores entre 1 et -1. Toutefois, il est impossible de faire de même pour les paramètres autres que TTS lorsque les IPA sont inclus dans les échantillons testés. En effet, dans l’échantillon de la présente étude, les scores pour la LS peuvent aller jusqu’à -31 et -28 pour le TEAE. Plus de 50% des scores de la LS et 30% des scores du TEAE étaient plus petits que -1. Dans leur
article, Manconi et al. (2010) avaient identifiés deux distributions distinctes, ayant pour point de séparation une valeur de IM de 0,9. Pour la présente étude, l’IM sera alors catégorisé en deux groupes : mésestimateurs modérés (MM, IM entre 1 et -0,89) et les forts mésestimateurs (MF, IM ≤ -0,9) selon leur catégorisation. Finalement, seul le paramètre TEAE sera utilisé, puisque la mésestimation se manifesterait particulièrement par la perception du temps passé éveillé (Bastien et al., 2013; Feige et al., 2008; Manconi et al., 2010).
2.5. Analyses statistiques
Afin de déterminer s’il existe des différences entre les groupes au niveau des données sociodémographiques, cliniques ou de sommeil, des ANOVAs, chi-carrés et tests non paramétriques de Kruskal-Wallis sont effectués. Des tests de Bland-Altman sur les données objectives et subjectives justifient l’utilisation de l’index de mésestimation (Bland & Altman, 1999, 2007; Manconi et al, 2010). L’analyse principale de cette étude utilise le modèle mixte linéaire à trois facteurs intrasujets (pic, 2 niveaux, N1 et P2; son, 2 niveaux, standard et déviant; stade, 4 niveaux, 2D, 2F, 34, SP) et 2 facteurs intersujets (groupe, 3 niveaux, BD, IPS, IPA; mésestimation, 2 niveaux, mésestimateurs modérés, mésestimateurs forts) sur les données d’amplitude des PEC pour examiner les effets d’interaction pour la variable du traitement de l’information. Toutes les analyses ont été effectuées avec le logiciel statistique IMB SPSS 23. Le seuil de signification alpha est fixé à 0,05, et tous les résultats entre 0,05 et 0,10 sont considérés marginaux. Les participants ayant des données manquantes ont été conservés pour le modèle mixte puisque cette analyse permet d’utiliser le maximum des données sans faire d’imputation. Par contre, les participants ne pouvant être catégorisés dans un type de dormeur ou de mésestimateurs ne sont pas présentés pour les analyses descriptives.
Pour toutes les analyses, les postulats étaient vérifiés à l’aide des résidus. Lorsque les résidus dévoilaient un problème au niveau des postulats, des analyses non paramétriques étaient effectuées pour déterminer si la violation des postulats était la cause du résultat obtenu. Les données extrêmes univariées ont été évaluées à l’aide des scores Z et ramenées à 3 écarts-types. Tous les tests post-hoc ont une correction de Bonferroni (Kline, 2015).
3. Résultats 3.1. Caractéristiques des participants
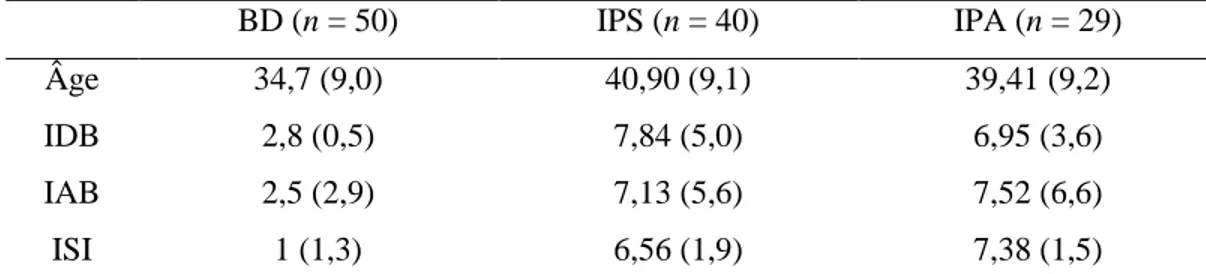
Tableau 1. Caractéristiques sociodémographiques et cliniques des participants.
BD (n = 50) IPS (n = 40) IPA (n = 29)
Âge 34,7 (9,0) 40,90 (9,1) 39,41 (9,2)
IDB 2,8 (0,5) 7,84 (5,0) 6,95 (3,6)
IAB 2,5 (2,9) 7,13 (5,6) 7,52 (6,6)
ISI 1 (1,3) 6,56 (1,9) 7,38 (1,5)
Moyenne (écart-type), IDB = Index de dépression de Beck, IAB = Index d’anxiété de Beck, ISI = Index de sévérité de l’insomnie
Le tableau 1 présente les données sociodémographiques et cliniques pour les trois groupes de dormeurs. Une ANOVA a été effectuée pour comparer les groupes sur ces variables. Les groupes différaient au niveau de l’âge F(2) = 7,8, p = 0,00, ɳ2 = 0,1, du IDB F(2) = 15,1, p = 0,00, ɳ2 = 0,2, du IAB, F(2) = 14,2, p = 0,00, ɳ2 = 0,3, et de l’ISI F(2) =
165,4, p = 0,00, ɳ2 = 0,8. Les comparaisons multiples révèlent que les différences au niveau
de l’âge, du IDB, IAB ainsi que de l’ISI se situent entre les bons dormeurs et les deux groupes d’INS. Les bons dormeurs sont plus jeunes, ont un indice moins élevé de dépression et d’anxiété, et ont un plus faible indice de sévérité d’insomnie que les deux groupes d’INS. À l’aide des indices de tailles d’effet, on remarque des différences faibles pour toutes les variables, sauf celle concernant l’ISI (ɳ2 = 0,8), ce qui est attendu. Il n’y avait aucune
différence significative entre les IPS et les IPA pour ces variables sociodémographiques et cliniques. Il est à noter que les scores au IDB et au IAB sont sous-cliniques et donc ne sont pas assez élevés pour indiquer une dépression ou un trouble d’anxiété. Finalement, aucune de ces variables (âge, IDB, IAB, ISI) n’est associée aux variables de traitement de l’information (corrélations entre -0,0 et 0,2; toutes non significatives). Ces variables ne seront donc pas utilisées comme variables contrôles. Finalement, un chi-carré a été effectué pour comparer les groupes au niveau du genre. Il n’y a pas de différence significative entre les groupes (χ2 = 4,2 (2), p = 0,12). L’analyse des résidus pour ces analyses ne suggère aucun problème de normalité.
3.2. Données de sommeil objectives
Les groupes ont ensuite été comparés au niveau de leurs données de sommeil objectives. Les nuits 2 et 3 en laboratoire ont été utilisées pour obtenir une moyenne des paramètres qui représenterait le sommeil normal des participants. Le tableau 2 représente les données pour la LS, le TEAE, le TTS ainsi que pour l’ES.
Tableau 2. Données de sommeil objectives (moyennes des nuits 2 et 3)
LS TEAE TTS ES
BD IPS IPA BD IPS IPA BD IPS IPA BD IPS IPA
Moyenne (écart-type), LS = latence au sommeil, TEAE = temps d’éveil après l’endormissement, TTS = temps total de sommeil, ES = efficacité du sommeil
Une ANOVA a été effectuée pour quantifier les différences entre les groupes. Celle-ci n’a révélé aucune différence pour la LS objective entre les groupes (F(2) = 2,0, p = 0,14, ɳ2
= 0,0). De manière objective, il n’y a pas de différences significatives pour le temps d’endormissement des bons dormeurs et des INS. On peut tout de même voir que les IPS prennent en moyenne environ 5 minutes de plus à s’endormir que les BD, alors qu’il n’y a réellement aucune différence entre les BD et IPA. Les différences entre les groupes se situaient au niveau du TEAE (F(2) = 7,5, p = 0,00, ɳ2 = 0,1), du TTS (F(2) = 3,4, p = 0,02, ɳ2 = 0,1) et de l’ES (F(2) = 7,3, p = 0,00, ɳ2 = 0,1). L’analyse des résidus démontre un
problème de normalité pour la LS objective. Un test de Kruskal-Wallis a donc été réalisé et ce dernier révèle le même résultat que l’ANOVA, les groupes ne sont significativement pas différents pour ce paramètre (KS(2) = 1,6, p = 0,44). Les comparaisons multiples révèlent que les différences se situent, pour le TEAE, entre les bons dormeurs et les groupes d’INS. Les BD passent objectivement moins de temps éveillé après l’endormissement que les INS. Pour le TTS, les différences sont entre les BD et les IPS. Les BD ont un temps total de sommeil plus élevé que les IPS. Il n’y a pas de différence entre les IPA et les deux autres groupes. Pour l’ES, les différences se situent aussi entre les BD et IPS. Les BD ont une meilleure efficacité de sommeil moyenne que les IPS, mais il n’y a pas de différence entre
les IPA et les autres groupes. Les tailles d’effets démontrent tout de même que les différences sont très minimes (ɳ2 de 0,1).
3.3. Données de sommeil subjectives
Tableau 3. Données de sommeil subjectives (moyenne nuits 2 et 3 en laboratoire).
LS TEAE TTS ES
BD IPS IPA BD IPS IPA BD IPS IPA BD IPS IPA
Moyenne (écart-type), LS = latence au sommeil, TEAE = temps d’éveil après l’endormissement, TTS = temps total de sommeil, ES = efficacité du sommeil
Le tableau 3 présente les données subjectives pour la moyenne des nuits 2 et 3. L’ANOVA a révélé des différences entre les groupes pour la LS (F(2) = 17,8, p = 0,00 , ɳ2 =
0,2), le TEAE (F(2) = 50,7, p = 0,00, ɳ2 = 0,5), le TTS (F(2) = 51,3, p = 0,00, ɳ2 = 0,5) et
l’ES (F(2) = 73,8, p = 0,00, ɳ2 = 0,6). Les comparaisons multiples révèlent que tous les
groupes diffèrent entre eux pour tous les paramètres. Les tailles d’effet démontrent que ces différences sont fortes (ɳ2 entre 0,2 et 0,6). Les résidus semblent normaux. Les IPA rapportent une plus longue LS, plus de TEAE, un TTS plus court ainsi qu’une moins bonne ES que les IPS. Les IPS rapportent les mêmes difficultés de manière plus modérée que les IPA, mais plus importante que les BD.
3.4. Données de sommeil pendant la nuit expérimentale (présentation des PEC) Le tableau 4 présente les moyennes et écarts-types pour les données objectives et subjectives pour la nuit expérimentale.