HAL Id: dumas-02432394
https://dumas.ccsd.cnrs.fr/dumas-02432394
Submitted on 8 Jan 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
La résistance aux antibiotiques des bactéries les plus
communément rencontrées dans les infections
communautaires état des lieux en 2019
Anaïs Veyssiere
To cite this version:
Anaïs Veyssiere. La résistance aux antibiotiques des bactéries les plus communément rencontrées dans les infections communautaires état des lieux en 2019. Sciences du Vivant [q-bio]. 2019. �dumas-02432394�
U.F.R. DES SCIENCES PHARMACEUTIQUES
Année 2019
Thèse n°115
THESE POUR L’OBTENTION DU
DIPLOME D’ETAT de DOCTEUR EN PHARMACIE
Présentée et soutenue publiquement
Par VEYSSIERE, Anaïs, Jennifer
Née le 1
ermars 1993 à LORMONT
Le 19 décembre 2019 à Bordeaux
LA RESISTANCE AUX ANTIBIOTIQUES DES BACTERIES
LES PLUS COMMUNEMENT RENCONTREES DANS LES
INFECTIONS COMMUNAUTAIRES
Etat des lieux en 2019Sous la direction du Professeur ARPIN Corinne
Membres du jury :
Directeur et président Pr ARPIN Corinne Juge Dr DUMARTIN Catherine
Juge Dr DEHONDT Françoise
2
R
emerciements
Aux membres du jury,
Je tiens à remercier Madame Arpin Corinne, pour avoir dirigé cette thèse et m’avoir guidé tout au long de sa rédaction mais également pour son implication tout au long de mes études de pharmacie, pour son accueil au sein de son laboratoire lors de mon stage de recherche et pour sa gentillesse et sa bienveillance en tant que personne.
Je remercie également Madame Dumartin Catherine d’avoir accepté d’être jury de ma thèse et pour son aide lors de la rédaction de celle-ci, ainsi que pour ses nombreuses heures de cours enseignées avec envie et passion.
Merci également à Mademoiselle Dehondt Françoise, d’avoir accepté de faire partie de ce jury. D’abord maître de stage puis devenue une personne chère à mes yeux, merci pour toute son implication lors de mes nombreuses années d’études et merci de m’avoir donné ma chance et de m’avoir fait aimer l’officine. Merci pour vos conseils, votre bienveillance, votre partage de savoir, vous êtes au fil des années, devenue un vrai mentor pour moi et vous le resterez, merci beaucoup.
Aux pharmaciens, maîtres de stage et collaborateurs,
Merci à l’équipe de la pharmacie du marché à St Paul de la Réunion, Monsieur Graffin Jean-Baptiste mon maître de stage durant ces six mois, Nadège, Christelle, Kaoutar, Fabienne, Catherine et Frédérique, une belle équipe dans laquelle j’ai passé des moments formidables et qui m’ont aussi beaucoup appris et fais confiance. Merci à vous.
3
Merci à l’équipe de la pharmacie des grands hommes de Bordeaux, à Monsieur Boccara et Monsieur Floirac mes titulaires qui me côtoient depuis quelques mois déjà, qui me font confiance et me permettent de m’épanouir dans ce métier. Merci également à mes collègues, bien trop nombreux pour être cités, qui m’aident à grandir un peu plus chaque jour, le « baby pharmacien » vous remercie mille fois.
A ma famille et belle famille,
Un immense merci à mes parents, sans qui tout cela n’aurait sûrement pas pu être possible. Vous m’avez aimé, soutenu et encouragé tout au long de ces nombreuses années parfois plus difficiles pour vous que pour moi mais si j’en suis là c’est en grande partie grâce à vous alors merci infiniment. Je vous aimes.
Merci à mes grands-parents, merci de toujours croire en moi, j’espère vous rendre fière.
Merci également à ma belle-famille, à mes beaux-parents, à mon beau-frère et ma belle-sœur, à papi et mamie Monique, qui m’ont toujours soutenu et cru en moi, avec qui j’ai dignement fêté mes réussites mais qui étaient aussi présents lors de mes échecs. Merci.
A mes amis,
Merci aux « Rillettes », Mallaurie, Lucie, Marion, Isabelle, Elsa, Amaia, Maylis, Chloé et Emma pour ces bons moments passés sur les bancs de la fac mais aussi en dehors, pour ces nombreux fous rires et ces nombreuses soirées, merci d’avoir rendu ces années de fac encore plus belles et inoubliables.
4
Chloé, ma binôme, merci pour ces heures de travaux pratiques mémorables et ces moments partagés.
Un remerciement particulier à Mallaurie, qui m’a accompagné deux années de suite dans cette longue épreuve du concours de l’internat en pharmacie, et même si le dénouement n’est pas celui espéré je suis fière de l’avoir fait et d’autant plus à tes côtés. Merci de faire partie, avec Lucie, Isabelle et Marion de ces amies de fac avec qui on veut partager encore de nombreuses aventures.
Merci les filles de m’avoir motivé et d’avoir été là.
Merci à Marie, qui fût d’abord une simple collègue mais qui est devenue maintenant une véritable amie sur qui je peux compter professionnellement mais aussi amicalement. Merci pour tous ces conseils, pour avoir partagé avec moi ton savoir, pour ton soutien de tous les instants, merci d’être mon amie.
A mon amour,
Enfin, merci à celui qui fait partie ma vie depuis maintenant dix belles années, Matthieu. Merci pour ton soutien sans failles, merci pour tes encouragements, merci d’avoir supporté mes humeurs, d’avoir balayé mes doutes, merci pour tes conseils, pour ta gentillesse et merci tout simplement de faire partie de mon quotidien que tu rends un peu meilleur chaque jour, je grandi à tes côtés et c’est une fierté pour moi de voir que tu es présent à chaque étape importante de ma vie. Je t’aime.
« Il n’y a rien de plus précieux que de voir la fierté dans les yeux des gens qu’on aime. »
5
T
able des matières
Introduction ... 13
1. Généralités sur les antibiotiques ... 15
1.1. Historique ... 15
1.1.1. Découverte ... 15
1.1.2. Développement ... 16
1.1.3. Critères d’efficacité d’un antibiotique ... 16
1.2. Principales classes et familles d’antibiotiques ... 17
1.2.1. Les bêta-lactamines ... 18
1.2.2. Les aminosides ... 20
1.2.3. Les macrolides et apparentés ... 20
1.2.4. Les quinolones et fluoroquinolones ... 21
1.2.5. Les cyclines ... 21
1.2.6. Les résistances chez les principales familles d’antibiotiques ... 22
1.3. Définitions ... 23
1.4. Activité des antibiotiques ... 24
1.4.1. Mesures de base de l’activité antibiotique ... 24
1.4.2. L’antibiogramme par la méthode de diffusion en milieu gélosé ... 26
1.4.3. Les spectres bactériens ... 27
1.4.3.1. Antibiotiques agissant sur la paroi ... 27
1.4.3.2. Antibiotiques actifs sur la membrane ... 28
1.4.3.3. Antibiotiques actifs sur la synthèse des protéines ... 28
1.4.3.4. Antibiotiques actifs sur la synthèse des acides nucléiques ... 29
1.4.4. Pharmacocinétique ... 30
1.4.4.1. Modèle temps-dépendant... 30
1.4.4.2. Modèle concentration-dépendant ... 31
2. Bactéries d’intérêt à l’officine ... 33
2.1. Escherichia coli ... 35
2.2. Staphylococcus aureus ... 35
2.3. Streptococcus pneumoniae ... 36
2.4. Les chiffres en ville ... 37
6
3. Résistance aux antibiotiques ... 39
3.1. Résistance acquise et résistance naturelle ... 39
3.1.1. Résistance innée ou naturelle... 40
3.1.2. Résistance acquise ... 41 3.2. Mécanismes de résistance ... 42 3.2.1. Modification de la cible ... 42 3.2.1.1. Modification qualitative ... 42 3.2.1.2. Modification quantitative ... 42 3.2.2. Inactivation de l’antibiotique ... 43
3.2.3. Diminution de la quantité d’antibiotique ... 43
3.2.3.1. L'efflux des antibiotiques ... 43
3.2.3.2. La réduction de la perméabilité membranaire ... 43
3.2.4. Autre mécanisme : « l’altruisme » ... 44
3.3. Principales bactéries multi-résistantes en ville ... 45
3.3.1. Définition de bactéries multi-résistantes (BMR) ... 45
3.3.2. Les « superbactéries » ... 48
4. Mésusage des antibiotiques et impact économique de la résistance ... 50
4.1. Définition du mésusage ... 50
4.1.1. Quelques exemples ... 50
4.1.2. Conséquences : les impasses thérapeutiques... 59
4.2. Impact économique de la résistance ... 61
4.3. Stratégies de bon usage des antibiotiques ... 62
4.4. Les institutions et référentiels ... 64
4.5. Les plans santé ... 66
5. Les stratégies d’amélioration ... 69
5.1. Exemples de mesures mises en place ... 69
5.1.1. Tests rapide d’orientation diagnostic ... 69
5.1.2. « Antibioclic » ... 69
5.2. Dispensation contrôlée : expérience de la dispensation à l’unité ... 71
5.3. Stratégies de contrôle des BMR ... 72
7
5.3.2. Des nouveaux antibiotiques prometteurs, exemples ... 74
5.3.3. Reformulation des antibiotiques ... 77
5.3.4. Bactériocines, phagothérapie, peptides antimicrobiens ... 77
5.3.5. Les médecines douces : place de l’aromathérapie et de l’apithérapie ... 81
5.3.5.1. Les huiles essentielles ... 81
5.3.5.2. L’apithérapie : le miel de Manuka ... 83
8
A
bréviations
ADN Acide Désoxyribo-Nucléique
ANSM Agence Nationale de Sécurité du Médicament et autres produits de santé
AMM Autorisation de Mise sur le Marché
ARN Acide Ribo-Nucléique
ARNm Acide Ribo-Nucléique messager
ARNt Acide Ribo -Nucléique de transfert
ASC Aire Sous la Courbe
ATP Adénosine TriPhosphate
BLSE Bêta Lactamase à Spectre Etendu
BMR Bactérie Multi-Résistante
BHRe Bactérie Hautement Résistante émergente
Cmax Concentration Maximale
Cmin Concentration Minimale
CMB Concentration Minimale Bactéricide
CMI Concentration Minimale d’Inhibition
CNR Centres Nationaux de Référence
CNRP Centre National de Référence au Pneumocoque
DCI Dénomination Commune Internationale
ECBU Examen CytoBactériologique des Urines
EUCAST European Committee for Antibiotic Susceptibility Testing
IAA Indice d’Activité Antibactérienne
9
MG/KG Milligrammes par Kilogrammes
PDR PanDrug Resistant
pH Potentiel Hydrogène
PLP Protéines Liant la Pénicilline
PSDP Pneumocoque de Sensibilité Diminuée à la Pénicilline
RCP Résumé des Caractéristiques Produit
SARM Staphylococcus aureus Résistant à la Méthicilline
SAMS Staphylococcus aureus Méthicilline-Sensible
SIDA Syndrome d’Immunodéficience Acquise
TDR Test de Diagnostic Rapide
TROD Test Rapide d’Orientation Diagnostique
UMF Unique Manuka Factor
10
L
iste des figures
Figure 1 Portrait d’Alexander Fleming... 15
Figure 2 Squelette d’une bêta lactamine ... 19
Figure 3 Erythromycine, chef de file des macrolides ... 21
Figure 4 Structure de base des cyclines ... 21
Figure 5 CMI par méthode de micro dilution en milieu liquide. Lecture en utilisant la méthode MTT (réactif d’oxydo-réduction) ... 25
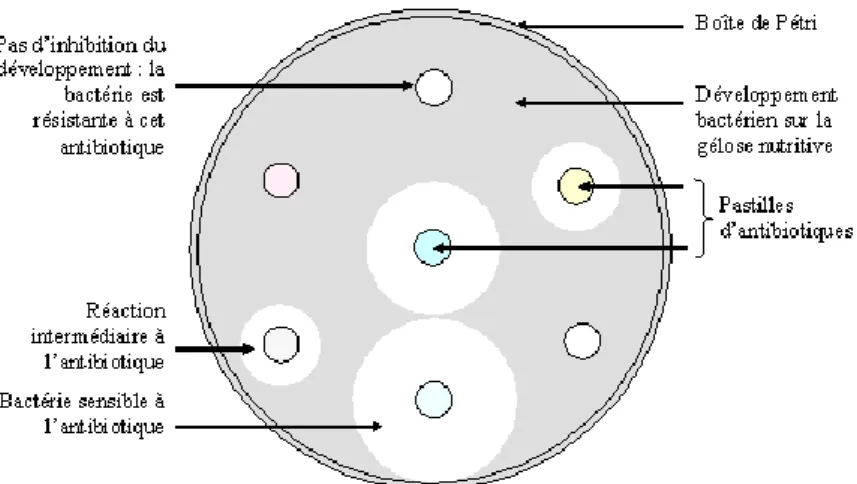
Figure 6 Schéma représentant un antibiogramme ... 26
Figure 7 Deux types de paroi bactérienne: en A, paroi des bactéries Gram positives composée de peptidoglycane, en B, paroi des bactéries Gram négatives avec une couche de peptidoglycane plus mince mais composée en plus d’une membrane externe ... 27
Figure 8 Ribosome en cours de translation ... 29
Figure 9 Représentation graphique du modèle temps-dépendant ... 30
Figure 10 Représentation graphique du modèle concentration dépendant ... 31
Figure 11 Les différents modèles de bactéries ... 34
Figure 12 Observation au microscope d’E.coli coloré au Gram ... 35
Figure 13 Observation au microscope de S. pneumoniae coloré au Gram... 36
Figure 14 Mécanismes d’action de la résistance antibiotique ... 44
Figure 15 Représentation de l’altruisme ... 45
Figure 16 Tableau des superbactéries résistantes ... 48
Figure 17 Photographie d’une coloration de gram au microscope ... 53
Figure 18 Comment les bactéries résistantes se propagent ... 68
Figure 19 Moteur de recherche sur l’outil « Antibioclic »... 70
Figure 20 - S. pneumoniae de sensibilité diminuée à la pénicilline (PSDP) en France d’après les données du CNRP ... 73
11
Figure 21 Spectre de la témocilline ... 76
Figure 22 Mécanisme d’action des différentes bactériocines ... 80
Figure 23 Mécanismes d'action des huiles essentielles sur la cellule bactérienne ... 83
Figure 24 Fleur de manuka ... 84
Figure 25 Comparaison des facteurs antibactériens du miel classique et du miel de Manuka ... 86
12
L
iste des diagrammes
Diagramme 1 : Résultats de la question n°1 « Dans quelle(s) situation(s) utiliser les antibiotiques » ... 54
Diagramme 2 : Résultats de la question n°2 : « Votre pharmacien vous indique-t-il les règles de bon usage de votre antibiotique ? » ... 55
Diagramme 3 : Résultats de la question n°3 : « Vous arrive-t-il d'arrêter plus tôt votre antibiotique? » ... 55
Diagramme 4 : Résultats aux questions n°5 et 6 : à gauche, « Faites-vous de l’automédication ? », à droite, « Que faites-vous des « cachets » en trop ? » ... 56 Diagramme 5 : Résultats de la question n°7 « Avez-vous déjà entendu parler d’antibiorésistance ? » ... 57
13
Introduction
La résistance aux antibiotiques est depuis quelques années maintenant un sujet d’actualité qui touche, malgré les nombreuses recommandations et les nombreux moyens de communication, de plus en plus de personnes en France mais aussi dans le monde entier. La résistance aux antibiotiques et plus largement aux anti-infectieux devient même une situation préoccupante mondialement car l’antibiorésistance pourrait devenir dans un futur proche l’une des causes principales de décès dans le monde.
Les actions contre la résistance sont nombreuses et se situent tout aussi bien à l’hôpital qu’en ville où les bactéries communautaires posent, elles aussi problème. Ces actions impliquent aujourd’hui le système de santé et de soins à tous les niveaux à commencer par le médecin lors de sa prescription mais aussi le pharmacien lors de sa délivrance, deux maillons très importants qui se doivent de respecter les recommandations et d’informer les patients sur l’importance de ces traitements. Pour mettre en place ces actions, l’identification des causes est primordiale et l’origine multi causale de ce problème de santé publique le rend d’autant plus difficile à combattre.
Dans un contexte économique sous tension, nous pouvons aussi souligner que l’antibiorésistance ne tend qu’à accroître les dépenses de santé, il est donc important d’agir en ce sens également.
Cependant, même si la découverte de nouveaux antibiotiques semble être au ralenti depuis de nombreuses années, de nouvelles stratégies et de nouvelles alternatives sont en train d’émerger et de fournir des réponses au fléau de la résistance bactérienne.
14
Lors de l’étude de ce sujet, nous verrons tout d’abord des généralités sur les antibiotiques en replaçant le contexte de leur découverte, les familles d’antibiotiques dans leur globalité, mais aussi en définissant ce qu’est un antibiotique, leurs caractéristiques et leurs modes d’action car il est important de bien connaître toutes ces molécules afin de les utiliser plus rationnellement. Nous ferons ensuite un focus sur les bactéries et notamment les bactéries les plus rencontrées en ville ou encore appelées bactéries communautaires pour lesquelles nous associerons quelques chiffres notables. Dans une troisième partie nous parlerons de la résistance, des types de résistance et de leurs mécanismes principaux pour ensuite aboutir sur le mésusage et une partie économie. Afin d’illustrer ces propos et notamment la partie mésusage, nous avons inclus une étude personnelle reflétant les habitudes et les idées préconçues de la population générale sur la résistance antibiotique. La dernière partie nous permettra d’exposer quelques stratégies d’amélioration, certaines ayant fait leurs preuves d’autres étant encore en « expérimentation » mais présentant des avantages considérables.
15
1. Généralités sur les antibiotiques
1.1. Historique
1.1.1. Découverte
Les antibiotiques sont des substances naturelles, hémi-synthétiques ou synthétiques qui sont capables d’inhiber la croissance bactérienne ou de tuer les bactéries. Le tout premier d’entre eux fut la pénicilline, découverte en 1928, par Alexander Fleming[1], médecin, biologiste et pharmacologue britannique qui a découvert, par hasard, qu’une ou des substances produites par un champignon, Penicillium notatum, avaient la faculté d’inhiber la croissance bactérienne.
Figure 1 Portrait d’Alexander Fleming (Nobel foundation, Alexander Fleming 1945)
Il faut ensuite attendre 1932 pour voir apparaître sur le marché le premier antibiotique de l’histoire commercialisé par les laboratoires Bayer, le Prontosil[2], un sulfamide utilisé comme antibactérien contre certaines infections à streptocoque.
Ce n’est qu’en 1945, à la fin de la seconde guerre mondiale que la pénicilline est fabriquée industriellement en grande quantité et commercialisés.
Quelques années plus tard en 1942, la première résistance aux sulfamines est décrite suivie en 1946 de la résistance à la pénicilline G mais c’est le japonais T.Watanabe qui démontre pour la première fois l’origine génétique de l’antibiorésistance en montrant que le gène responsable est porté par un plasmide bactérien.
16 1.1.2. Développement
Depuis Alexander Fleming et la commercialisation du Ponstyl® de nombreuses autres molécules produites par des souches bactériennes ou fongiques ont été isolées telles que l’actinomycine en 1940 et la streptomycine en 1943 (toutes deux découvertes par Selman A.Waksman), puis ce fût la tétracycline en 1949.
A la suite de la première mise en évidence de résistances comme vu précédemment, les antibiotiques semi-synthétiques et synthétiques ont été développés à partir de 1965. Entre 1990 et 2000 peu de molécules ont été commercialisées et il faudra attendre les années 2000, et le linézolide pour voir apparaître une nouvelle classe d’antibiotique.
1.1.3. Critères d’efficacité d’un antibiotique
Pour que l’antibiotique choisi puisse être actif sur la ou les bactéries à l’origine de l’infection, il faut[3] :
- qu’il possède un mode d’action qui lui permette d’agir sur cette bactérie
- qu’il parvienne là où est la bactérie et à des concentrations suffisamment élevées - qu’il y reste le temps suffisant pour lui permettre soit de la détruire, c’est ce que l’on
appelle la bactéricidie soit d’en arrêter la multiplication, c’est la bactériostase.
L’objectif usuel de l’antibiothérapie est de diminuer suffisamment le nombre de bactéries présentes pour que le système immunitaire puisse éliminer les bactéries restantes. Cependant, si le système immunitaire est altéré (exemples : maladies auto-immune, infection par le virus du SIDA, immunodépression suite à une chimiothérapie…) ou si l’infection fait courir un risque vital, il devient nécessaire que l’antibiotique détruise toutes les bactéries.
Il faut aussi que dans les conditions d’administration qui permettent d’obtenir l’effet antibactérien, l’antibiotique n’induise pas ou peu d’effets indésirables inacceptables voire toxiques à d’autres niveaux et dégrade les autres organes sains.
17
1.2. Principales classes et familles d’antibiotiques
On distingue cinq classes principales d’antibiotiques[4] pour certaines divisées en sous-classes:
- Les bêta-lactamines comprenant les pénicillines des groupes G/V, M, A, les carboxypénicillines, les uréidopénicillines et les amidinopénicillines, les carbapénèmes, un monobactam et les céphalosporines
- Les aminosides
- Les macrolides et apparentés - Les quinolones et fluoroquinolones - Les cyclines
En dehors de ces cinq classes [5] on retrouve aussi (Annexe 1) les glycopeptides ou lipoglycopeptides (vancomycine, teicoplanine, dalbavancine), la fosfomycine, un lipopeptide (daptomycine), les polymyxines, les phénicols, l’acide fusidique, les oxazolidinones, les quinoléines, la mupirocine, les sulfamides et triméthoprine, les produits nitrés et les antituberculeux.
Le spectre d’activité antibactérien regroupe l’ensemble des bactéries sur lesquelles l’antibiotique est habituellement actif. Leurs indications sont liées au spectre d’activité et aux caractéristiques pharmacocinétiques et pharmacodynamiques. Ces paramètres pharmacocinétiques et pharmacodynamiques conditionnent leur mode d’emploi et leur fréquence d’utilisation. Par exemple Il existe pour certaines infections des traitements monodoses.
18
Le choix de l’antibiotique à utiliser repose sur plusieurs critères :
- La ou les bactéries dont le spectre d’activité a été documenté ou suspecté
- Le foyer infectieux avec la nécessité d’obtenir une concentration efficace à ce niveau, la connaissance des propriétés pharmacocinétiques de chaque antibiotique est indispensable et notamment la diffusion tissulaire. Certains antibiotiques se concentrent dans les urines et sont particulièrement intéressants en cas d’infection urinaire. Cela conditionne leur voie d’utilisation. Par exemple, les aminosides ne sont pas absorbés au niveau de l’intestin et ne peuvent pas être pris par voie. Il existe également des collyres, des solutions auriculaires ou nasales et des pommades contenant des antibiotiques. Ces formes locales sont parfois suffisantes pour combattre des certaines infections.
Enfin leurs contre-indications et leurs effets indésirables tels que réaction allergique, diarrhée, photosensibilisation, tendinite, toxicité rénale caractérisent aussi certaines familles d’antibiotiques. A noter que l’apparition d’un effet indésirable grave limite l’utilisation ultérieure des médicaments appartenant à la même famille.
Au fil des années et des recherches de nouvelles classes d’antibiotiques apparaissent dans un souci constant de lutte contre les mécanismes de résistance mis en place par les bactéries. Des inhibiteurs de mécanisme de résistance sont aussi développés. C’est le cas des inhibiteurs de bêta-lactamases qui ne sont pas à proprement parlé des antibiotiques mais agissent en association avec une bêta-lactamine dans le but de lutter contre la production de bêta-lactamases par certaines bactéries qui tendent à rendre l’antibiotique moins ou plus du tout efficace.
1.2.1. Les bêta-lactamines
Dans cette famille on retrouve des sous-familles elles-mêmes subdivisées pour certaines en sous-groupe. Toutes les molécules de cette famille possèdent un noyau bêta-lactame[6] (en rouge sur la figure 2) qui est la partie efficace de la molécule. Des variations au niveau de la chaîne latérale naturelle ou greffée permettent de modifier les propriétés de la molécule antibiotique.
19
Figure 2 Squelette d’une bêta lactamine (culturescience.chimie.fr, La pénicilline, 2019)
Le groupe principal et le plus ancien est celui des pénicillines qui comprend le groupe des pénicillines G et V et les formes retard (benzathine benzylpénicilline), les pénicillines du groupe A (amoxicilline), celles du groupe M (cloxacilline, oxacilline), les carboxypénicillines (ticarcilline), les uréidopénicillines (pipéracilline), les aminidopénicillines (pivmécillinam), la témocilline (dérivé de la ticarcilline).
Le second sous-groupe principal derrière les pénicillines, est celui des céphalosporines avec les céphalosporines de 1ère génération ou C1G (céfalexine, céfalotine, céfazoline…), les céphalosporines de 2ème génération ou C2G (céfuroximes, céfoxitine…), les céphalosporines de 3ème génération ou C3G divisées en forme orale (céfixime, cefpodoxime, céfotiam) et forme injectable (céfépime, céfotaxime, ceftazidime, ceftriaxone). Des nouvelles céphalosporines anti-SARM rentrent dans ce groupe, il s’agit de ceftaroline et ceftobiprole.
Dans les bêta-lactamines on a ensuite les carbapénèmes avec l’ertapénem, l’imipénem et le méropénem ainsi qu’un monobactam, l’aztréonam.
Certains inhibiteurs de bêta-lactamases (acide clavulanique, sulbactam, tazobactam) possèdent également un noyau bêta-lactame. Ces inhibiteurs sont toujours utilisés en association. L’avibactam est également un inhibiteur des bêta-lactamases mais ne possède pas de noyau bêta lactame comme les précédents.
20 1.2.2. Les aminosides
Dans cette famille, on distingue des sous-groupes en fonction de la substitution sur l’aminocyclitol (génine). L’amikacine et la tobramycine (dérivés de la kanamycine), ainsi que la gentamicine et ses dérivés (nétilmicine) appartiennent au sous-groupe des désoxystreptamines substitués en 4,6. La néomycine appartient au sous-groupe des désoxystreptamines substitués en 4,5. La streptomycine est un dérivé non substitué de la streptamine.
Cette famille d’antibiotique n’est jamais utilisée seule en thérapeutique mais toujours associée à au moins une autre famille d’antibiotiques (bêta-lactamines par exemple), sauf en cas d’infection urinaire.
Le traitement par aminoside ne doit pas excéder 7 jours et la dose journalière doit être unique.
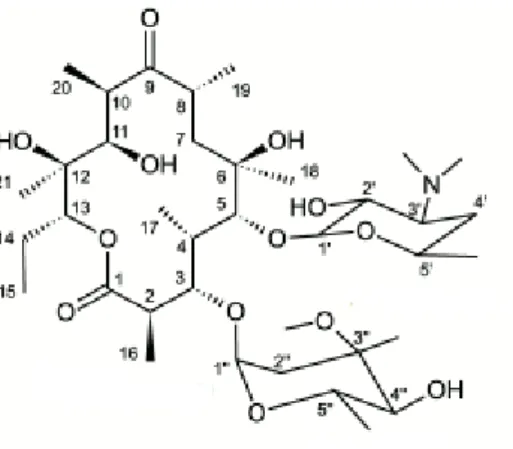
1.2.3. Les macrolides et apparentés
On va distinguer les macrolides vrais ou macrolides à 14 chaînons ou C14 (clarithromycine, érythromycine qui est le chef de file, roxithromycine, diritromycine), les macrolides particuliers avec les azalides à 15 chaînons (azithromycine) et les kétolides à 15 chaînons également (télithromycine dont la commercialisation a cessé récemment) ainsi que les macrolides à 16 chaînons (spiramycine et ses dérivés : josamycine, midécamycine).
Dans la catégorie des apparentés, on retrouve des molécules de structures chimiques différentes, mais dont l’activité anti-bactérienne est proche, que sont les lincosamides (clindamycine, lincomycine) et les synergistines (dalfopristine, quinupristine et pristinamycine étant la seule disponible actuellement).
21
Figure 3 Erythromycine, chef de file des macrolides (Pharmacorama, eryhtromycine, 2019)
1.2.4. Les quinolones et fluoroquinolones
Dans cette famille, plusieurs sous divisions sont acceptées, ici nous les subdiviserons en quinolones urinaires avec les quinolones de 1ère génération (acide pipémidique, fluméquine) déremboursées en 2018 et dont l’arrêt de commercialisation date du début d’année 2019 et fluoroquinolones (énoxacine, loméfloxacine, norfloxacine qui est à visée urinaire), les fluoroquinolones à visée systémique (ciprofloxacine, ofloxacine, péfloxacine qui a été supprimé) et enfin les fluoroquinolones dites anti-pneumococciques qui vont agir essentiellement sur le pneumocoque (lévofloxacine, moxifloxacine).
Cette famille d’antibiotique est à utiliser avec précaution car elle présente de nombreuses résistances et sera donc à éviter en première intention.
1.2.5. Les cyclines
Ou tétracyclines sont appelées ainsi à cause de leurs quatre cycles accolés. Dans cette famille on retrouve la doxycycline, lymécycline, minocycline et tigécycline (disponible seulement à l’hôpital).
22 1.2.6. Les résistances chez les principales familles d’antibiotiques
D’après le dernier rapport de novembre 2018[7] de l’Agence Nationale du Médicament, en 2017, 759 tonnes d’antibiotiques ont été vendues. Cette consommation peut être calculée à partir des déclarations de ventes des laboratoires pharmaceutiques et s’inscrit à la hausse sur 10 ans. On sait que 93% des antibiotiques sont prescrits en ville mais les conséquences à l’hôpital ne sont pas moindres.
En ville, l’amoxicilline représente 41,4 % de la consommation d’antibiotiques, l’association amoxicilline-acide clavulanique 23,8 %, les macrolides 10,4 % et les tétracyclines 10,3 %. Les fluoroquinolones représentent 4,7 % de cette même consommation et les céphalosporines de 3ème et 4ème génération 4,2 %. La part de la colistine (antibiotique de dernier recours) est très faible et représente moins de 0,1 %. La consommation a diminué dans presque toutes les classes, dont les fluoroquinolones. Les seules exceptions notables concernent deux antibiotiques qui ont contribué à l’augmentation de la consommation globale en ville depuis 10 ans : l’association amoxicilline-acide clavulanique (antibiotique particulièrement générateur d’antibiorésistance figurant sur la liste des antibiotiques « critiques » définie par l’ANSM) et l’amoxicilline, qui n’appartient pas à cette liste.
En établissements de santé, les antibiotiques les plus utilisés sont aussi l’association amoxicilline-acide clavulanique (30,9 %) et l’amoxicilline (20 %) ; viennent ensuite les quinolones (11,0 %). Les céphalosporines de 3ème et 4ème génération représentent 8,9 % des consommations en établissements de santé. La part de la colistine est de 0,2 %. Les carbapénèmes et les antibiotiques ciblant les staphylocoques résistants à la méticilline, figurant eux aussi sur la liste d'antibiotiques « critiques » [8] définie par l’ANSM présentée en annexe 2, sont essentiellement utilisés dans les services de réanimation.
23
1.3. Définitions
Avant de parler de résistance et de ses conséquences il convient de définir ce qu’est un antibiotique et les notions qui en découlent.
Le terme d’antibiotique [9] vient du grec « bios » qui signifie la vie et « anti » qui signifie contre. Le rôle d’un antibiotique vient de son nom : c’est donc littéralement « agir contre la vie ». Un antibiotique est donc une substance naturelle, semi-synthétique ou synthétique qui détruit ou bloque la croissance des bactéries. Dans le langage médical, un antibiotique est « une substance chimique organique d’origine naturelle ou synthétique, inhibant ou tuant les bactéries pathogènes à faible concentration et possédant une toxicité sélective ». Par toxicité sélective, on entend que celle-ci est spécifique des bactéries et que la molécule antibiotique n'affecte pas l'hôte infecté, au moins aux doses utilisées pour le traitement.
Plus généralement, un antibiotique est une substance antibactérienne.
L’antibiotique est différent de l’antiseptique [10], ce dernier ayant pour but de détruire un maximum de microbes (bactéries, virus, champignons), de manière non spécifique, à concentration élevée et ne s’utilise qu’en usage externe.
Les antibiotiques ne sont pas actifs sur les virus. Un antimicrobien qui agit contre les virus est dit antiviral.
L’antibiothérapie peut être prophylactique, curative, probabiliste ou documentée. L’antibioprophylaxie ou antibiothérapie préventive vise à prévenir une infection précise, dans des circonstances définies. On peut faire une antibioprophylaxie par exemple, pour la prévention des infections post-opératoires, ou suite à une intervention ou un acte chez le dentiste. Elle s’adresse à des personnes, à priori non infectées, mais qui ont une forte probabilité de l’être.
L’antibiothérapie probabiliste vise à prévenir une infection non caractérisée sur le plan microbiologique, mais est effectuée du fait d’un diagnostic clinique, ou en attente d’un résultat bactériologique.
24
L’antibiothérapie documentée quant à elle repose sur des référentiels et des stratégies thérapeutiques associant une bactérie à sa pathologie, ou est mise en place lorsque l’infection est caractérisée sur le plan bactériologique (bactérie et antibiogramme associés).
1.4. Activité des antibiotiques
La détermination de la sensibilité d’une bactérie à différents antibiotiques est réalisée par l’antibiogramme qui évalue l’inhibition de la croissance bactérienne. L’antibiogramme est classiquement réalisé par la méthode de diffusion en milieu gélosé utilisant des disques (en dehors de certaines bactéries, comme les bactéries intracellulaires strictes), mais aussi de plus en plus en milieu liquide, en utilisant des automates (par exemple le Système Vitek 2, BioMérieux).
1.4.1. Mesures de base de l’activité antibiotique
La CMI ou concentration minimale inhibitrice est la plus petite concentration d'antibiotique qui inhibe toute croissance visible d'une souche bactérienne après 20 ± 4 heures de culture à 35°C ± 2°C. Cette valeur caractérise l'effet bactériostatique d'un antibiotique et permet de déterminer si une souche est sensible ou résistante à l’antibiotique testé.
La CMB ou concentration minimale bactéricide est la plus petite concentration d'antibiotique laissant 0,01% ou moins de survivants de l'inoculum initial après 20 ± 4 heures de culture à 35°C ± 2°C. Cette valeur caractérise l'effet bactéricide d'un antibiotique. On considère que si la CMB est ≤ à 4 CMI l’antibiotique est bactéricide et donc très efficace et au contraire si la CMB > à 10 CMI, on le considère comme peu efficace, donc bactériostatique.
25
La détermination de la CMI ou CMB peut se faire par différentes méthodes. La détermination de la CMI est souvent réalisée en routine par la méthode des dilutions en milieu liquide en utilisant des concentrations croissantes d’antibiotiques (soit par la microméthode à l’aide de microplaques 96 puits, ou à l’aide de systèmes semi-automatisés ou semi-automatisés) ou par la méthode de diffusion en milieu gélosé à l’aide de bandelettes imprégnées de concentrations croissantes d’antibiotiques (E-tests).
Figure 5 CMI par méthode de micro dilution en milieu liquide (Rapport de stage d’initiation à la recherche personnel, 2017). Lecture en utilisant la méthode MTT (réactif d’oxydo-réduction)
Dans la pratique courante, pour connaître ces valeurs on se fie aux normes de l’European Committee for Antibiotic Susceptibility (EUCAST) sur le site de la Société Française de Microbiologie ou SFM.
La mesure de la bactéricidie n’est pas réalisée en routine, mais est caractérisée lorsqu’on veut étudier l’efficacité d’un antibiotique et/ou d’une association d’antibiotiques sur une bactérie.
26 1.4.2. L’antibiogramme par la méthode de diffusion en milieu gélosé
L’antibiogramme [11] est l’analyse permettant de déterminer la sensibilité d’une bactérie à un panel d’antibiotiques. L’une des techniques de base utilisée est l’antibiogramme par la méthode de diffusion en milieu gélosé utilisant des disques calibrés imbibés d’antibiotique.
Pour se faire, on dépose un inoculum standardisé de la bactérie à étudier sur une gélose Mueller-Hinton (MH). La composition de ce milieu (que ce soit pour les méthodes en milieu gélosé qu’en milieu liquide) est standardisé, notamment en ions calcium, magnésium et en thymine. Cette gélose peut être additionnée de sang de cheval défibriné et bêta-NAD pour les bactéries de croissance exigeante comme le pneumocoque ou les streptocoques Haemophilus influenzae. Pour certaines bactéries, un milieu différent que le milieu MH est utilisé : Neisseria gonorrhoeae avec une gélose chocolat Polyvitex® et pour les anaérobies, avec une gélose additionnée de sang de mouton, vitamine K1 et hémine.
Pour certaines bactéries, un milieu différent que le milieu MH est utilisé (Neisseria
gonorrhoeae : gélose chocolat Polyvitex® et pour les anaérobies, gélose Brucella
additionnée de sang de mouton, vitamine K et hémine).
La gélose imprégnée de disques est ensuite mise à incuber dans une étuve à 35°C ± 2°C pendant 20h ± 4h. Les diamètres d’inhibition présents autour du disque sont mesurés, lus et interprétés selon les recommandations et les critères de l’EUCAST, par comparaison avec des diamètres critiques.
27
Au quotidien, l’antibiogramme (méthode de diffusion en milieu gélosé, ou détermination des CMI en milieu liquide utilisant des systèmes automatisés) est demandé par le praticien dans le cas de doute ou si celui-ci ne désire pas faire d’antibiothérapie probabiliste ou s’il désire contrôler une antibiothérapie probabiliste.
Un antibiogramme est notamment demandé lors d’infections urinaires récidivantes ou à risque de complication. Pour une cystite simple, seule la réalisation d’une bandelette urinaire révélant la présence de nitrites et leucocytes est nécessaire au diagnostic.
1.4.3. Les spectres bactériens
Les antibiotiques agissent de manière spécifique sur les bactéries, en bloquant une ou des étapes essentielle(s) de leur développement : synthèse de leur paroi, de l'ADN, des protéines, ou la production d'énergie… Ce blocage se produit lorsque l'antibiotique se fixe sur sa cible, une molécule de la bactérie qui participe à l'un de ces processus métaboliques essentiels.
1.4.3.1. Antibiotiques agissant sur la paroi
Figure 7 Deux types de paroi bactérienne [12 ]: en A, paroi des bactéries Gram positives composée de peptidoglycane, en
B, paroi des bactéries Gram négatives avec une couche de peptidoglycane plus mince mais composée en plus d’une membrane externe. (Cours de bactériologie, 4ème année Université de Bordeaux, 2016)
28
Parmi les mécanismes d’action, on retrouve donc les antibiotiques agissant sur la paroi :
- Les bêta lactamines : se fixent sur les protéines liant la pénicilline (PLPs) qui sont des enzymes (D-D carboxypeptidases, transpeptidases) qui sert à fabriquer les ponts peptidiques du peptidoglycane, et vont donc ainsi provoquer un arrêt de synthèse du peptidoglycane. L’effet bactéricide des bêta-lactamines résulte de la dérégulation des autolysines, qui entraine la lyse de la bactérie.
- Les glycopeptides : agissent aussi en arrêtant la synthèse du peptidoglycane mais cette fois-ci en créant des liaisons avec l’extrémité D-Ala-D-Ala, dès que le disaccharide peptapeptide est relargué de la membrane cytoplasmique par le transporteur lipidique.
- La fosfomycine : agit sur une enzyme précurseur du peptidoglycane (phase cytoplasmique)
1.4.3.2. Antibiotiques actifs sur la membrane
- La daptomycine : elle va s’intégrer progressivement à la membrane et créer une dépolarisation rapide par fuite de potassium, associée à des dysfonctionnements cellulaires entrainant sa mort.
- La colistine : polypeptide cationique qui déplacent les ions magnésium et calcium qui stabilisent le lipopolysaccharide (LPS) et modifie la perméabilité de la membrane externe des bactéries à Gram négatif, puis agit au niveau de la membrane cytoplasmique. Il s’ensuit ensuite une fuite des constituants cellulaires
1.4.3.3. Antibiotiques actifs sur la synthèse des protéines
Les antibiotiques actifs sur la synthèse protéique le sont plus particulièrement sur le ribosome qui est un complexe composé de protéines et d’ARN, permettant ainsi la fabrication de protéines par décodage de l’ARN messager. Il est composé de deux sous-unités : la petite appelée 30S (ARNr 16S + 21 protéines) et la grosse sous-unité 50S (ARNr 23S et 5S + 34 protéines) :
- Les aminosides : ils créent une mauvaise reconnaissance du codon de l’ARN messager (ARNm) par l’ARN de transfert (ARNt) chargé, conduisant à des erreurs de traduction
29
- Les macrolides : en raison de leur taille imposante ils se placent au début du tunnel de sortie du peptide en formation et bloquent ainsi la chaîne peptidique. Le ribosome se dissocie du peptide en formation
- Les cyclines et tigécycline : inhibe la synthèse des protéines en se liant à la sous-unité 16S, près du site de décodage (= site « A »). Ceci bloque l’accès au site « A » pour l’ARNt
- Le linézolide: crée une liaison à la sous-unité l’ARNr 23S, au niveau du site de décodage (= site « A »). Cela induit un mauvais positionnement de l’ARNt au site « A » et bloque la traduction
Figure 8 Ribosome en cours de translation (Microscope master, Ribosome : définition et structure, 2019)
1.4.3.4. Antibiotiques actifs sur la synthèse des acides nucléiques
La synthèse de l’ADN met en jeu des complexes enzymatiques dont des topoisomérases de type II (ADN gyrase et topoisomérase IV). L’ADN gyrase permet la création des surenroulements négatifs dans l’ADN, favorisant ainsi un déroulement local de la double hélice d’ADN permettant la réplication. Les toposisomérases de type II sont composées de deux sous-unités GyrA ou ParC et de deux sous-unités GyrB ou ParE. Les quinolones se placent au centre de ces sous-unités empêchant ainsi l’action de ces enzymes
Parmi ces antibiotiques actifs sur la synthèse des acides nucléiques, on retrouve :
- La rifampicine : bloque l’ARN polymérase qui participe à la transcription de l’ADN en ARN
30
- Sulfamides-triméthoprime : agissent eux en amont de la synthèse des acides nucléiques. Les sulfamides agissent comme inhibiteurs compétitifs sur la DHsP ou dihydroptéroate synthétase tandis que le triméthoprime agit sur la DHFR ou dihydrofolate réductase.
1.4.4. Pharmacocinétique
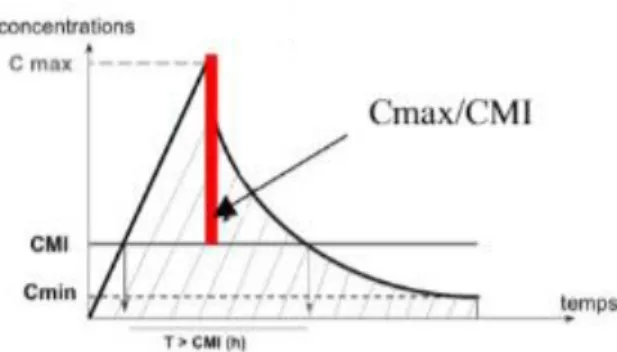
Les antibiotiques des familles citées précédemment peuvent avoir une activité bactéricide c’est-à-dire tuer les bactéries selon un modèle temps-dépendant ou concentration-dépendant. Ces modèles [13] sont important à connaitre car ils vont déterminer la fréquence d’administration de l’antibiotique et parfois même sa forme galénique et ainsi sa voie d’administration.
1.4.4.1. Modèle temps-dépendant
Avec ce modèle, l'intensité de la bactéricidie est corrélée avec la durée pendant laquelle la concentration dépasse la CMI, allant jusqu’à la concentration maximale ou Cmax. Dans ce cas l’effet bactéricide est lent et souvent moins marqué, dépendant principalement du temps de contact avec la bactérie. Cette observation est à la base du mode d'administration proposé en doses fractionnées ou en continu pour les antibiotiques temps-dépendants.
Figure 9 Représentation graphique du modèle temps-dépendant (Sciencedirect, pharmacocinétique et
pharmacodynamie des antibiotiques, 2019)
Les antibiotiques suivant ce modèle sont par exemple les bêta-lactamines ou encore les glycopeptides.
31
Leurs propriétés sont donc :
- Effet bactéricide lent
- Effet indépendant de la dose et de la concentration maximale - Importance des concentrations minimales
1.4.4.2. Modèle concentration-dépendant
Se dit d’un antibiotique dont l’activité bactéricide est fonction de la concentration, c’est-à-dire que plus on augmente la concentration d’antibiotique en présence de la culture bactérienne moins on dénombre de bactéries. Cet effet est assez rapide et l'obtention in vivo d’une concentration élevée semble déterminante. Cette observation est à la base du mode d'administration proposé à dose journalière pour les antibiotiques concentration-dépendants.
Dans les exemples de familles appartenant à ce modèle on retrouve les aminosides et les fluoroquinolones.
Figure 10 Représentation graphique du modèle concentration dépendant (Sciencedirect, pharmacocinétique et
pharmacodynamie des antibiotiques, 2019)
Leurs propriétés sont donc :
- Effet bactéricide rapide
- Effet fonction de la dose, effet de « pic »
- Peu d’importance des concentrations minimales - Peu d’importance de la durée d’exposition - Effet post-antibiotique dépendant
32
Qu’est-ce que « l’effet post-antibiotique » ?
L’effet post-antibiotique est la rémanence de l’activité antibiotique même après que la majeure partie de la dose ait été éliminée de l'organisme, et qu'il ne reste que de faibles traces d’antibiotique dans le corps, on observe une inhibition durable de la croissance bactérienne. Plus la concentration initiale de l’antibiotique sera importante plus l’effet post-antibiotique sera long. Cet effet est observé pour des post-antibiotiques ayant une action irréversible ou lentement réversible sur la synthèse bactérienne comme par exemple les aminosides ou les quinolones.
Les mécanismes de cet effet sont les suivant :
- Persistance de l’antibiotique sur ses sites de fixation - Temps de diffusion en dehors de la bactérie
- Temps de régénération des enzymes de la bactérie - Temps de régénération des ribosomes
Il est important de prendre en considération cet effet pour éviter des dosages sanguins trop élevés en antibiotiques qui pourraient aboutir à des effets indésirables graves.
33
2. Bactéries d’intérêt à l’officine
Les bactéries sont des micro-organismes vivants au même titre que les virus et les champignons. Elles ont été découvertes à la fin du 17ème siècle par Anthoni Van Leeuwenhoek, naturaliste hollandais, qui inventa le premier microscope assez puissant pour leur observation. Elles sont très nombreuses et ont souvent été considérées comme des agents pathogènes et agressifs, responsables de maladies plus ou moins graves. Mais les bactéries ne sont pas toujours synonymes de maladie. En effet, le corps humain est colonisé par de nombreuses bactéries qui constituent la « flore commensale». Le terme de commensale signifie que ce sont des micro-organismes qui colonisent l’organisme, la peau ou les muqueuses le plus souvent, sans provoquer de maladies. Ce terme de commensalisme est de plus en plus remplacé par le terme de mutualisme car la flore est nécessaire à l’hôte et une dysbiose entraine des pathologies telles que des maladies inflammatoires. Par exemple au niveau du système digestif, le microbiote intestinal [14], largement impliqué dans les processus de digestion et de défense de l’organisme, est composé d’environ mille milliards de bactéries. Certaines de ces bactéries sont utilisées dans l’alimentation ou dans certains médicaments pour rééquilibrer le microbiote et rétablir une fonction digestive normale (suite à des épisodes de diarrhées par exemple…).
Un microbiote désigne une communauté complexe de micro-organismes qui peut être constituée de levures, d’archées, de champignons, de virus et de bactéries, mais les bactéries étant les plus abondantes, le raccourci entre microbiote et bactéries est souvent fait à tort.
Chaque espèce bactérienne se distingue par des caractéristiques métaboliques et morphologiques : les cocci seront plutôt courts et sphériques, les bacilles en forme de bâtonnets, d’autres peuvent être incurvées ou spiralées… En ce qui concerne les noms, le premier mot (en italique et commençant par une majuscule) correspond au genre, le deuxième (en minuscule et aussi en italique) correspond à l’espèce : Streptococcus
pneumoniae, Streptococcus pyogenes, Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae...
34
Figure 11 Les différents modèles de bactéries (Antibioresponsable, modèles bactériens Dr Albert Hauteville, 2013)
Une autre classification, fréquemment utilisée, correspond à leur réaction au contact de la coloration de Gram. Il s’agit d’une méthode permettant de différencier les bactéries en fonction de leur capacité de coloration variant selon la composition de leur paroi. Ainsi, les bactéries colorées en violet seront dites à Gram positif et celles en rose à Gram négatif.
Enfin, elles peuvent être classées en fonction de leur besoin en oxygène pour survivre, on parle alors de bactéries aérobies, de bactéries anaérobies, microaérophiles, captophiles ou encore aéro-anaérobies.
Il est fréquent d’utiliser tous ces éléments de classification pour décrire les bactéries et constituer leur « carte d’identité ».
Escherichia coli ou E. coli [15], entérobactérie du tube digestif, est fréquemment responsable d’infections en santé humaine (en particulier des infections urinaires communautaires) et en santé animale. Staphylococcus aureus est souvent à l’origine d’affections de la peau, le plus souvent suppuratives comme des panaris, furoncles ou impétigo mais on le retrouve également incriminé dans les intoxications alimentaires. À l’inverse, Streptococcus pneumoniae[16] (S. pneumoniae) est principalement responsable
d’infections acquises notamment en ville telles que des otites et pneumonies, mais aussi des bactériémies et méningites. Ces trois bactéries sont les plus présentes et les plus incriminées dans les infections que l’on retrouve à l’officine.
35
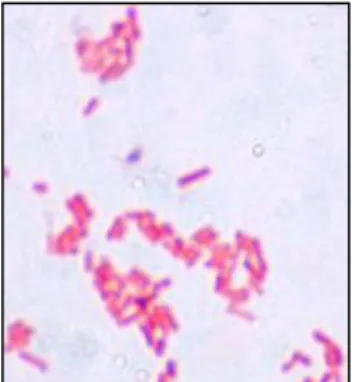
2.1. Escherichia coli
Figure 12 Observation au microscope d’E.coli coloré au Gram (Article Soza TH baban, Prevalence and antimicrobial
susceptibility, Août 2017)
Escherichia coli ou E.coli ou colibacille est une bactérie Gram négatif,
essentiellement intestinale car elle compose en grande partie notre flore intestinale, elle fait partie du microbiote de l’humain mais aussi des animaux en s’établissant au niveau du tractus digestif. Elle appartient à la famille des entérobactéries. E. coli est une bactérie commensale, c’est-à-dire qu’elle vie au sein de son hôte mais elle est aussi pathogène et donc associée à des pathologies diverses chez l’Homme et l’animal à type de diarrhées, gastro-entérites, infections urinaires, méningites, septicémies…
La transmission se fait par contact direct ou via des contaminations fécales.
2.2. Staphylococcus aureus
36
Staphylococcus aureus ou S. aureus ou encore staphylocoque doré est un coccus
Gram positif, présenté en amas ou « grappe de raisin » et c’est l’espèce la plus pathogène du genre staphylocoque. 15 à 30% des individus sont porteurs sains et S. aureus se révèle donc comme un pathogène opportuniste dans certaines circonstances mais n’est pas considéré comme commensal à proprement parlé contrairement à Staphylococcus
epidermidis. Cette bactérie a une porte d’entrée essentiellement cutanée et les infections
que l’on peut rencontrer en officine de ville, se traduisent par des infections cutanées suppuratives à type de panaris ou de furoncles par exemple, par des otites ou sinusites mais aussi des intoxications alimentaires.
La transmission est inter humaine par contact direct ou via une source environnementale.
2.3. Streptococcus pneumoniae
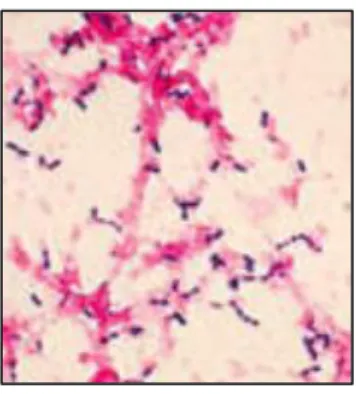
Figure 13 Observation au microscope de S. pneumoniae coloré au Gram (Text book of bacteriology, page 1, Streptococcus pneumoniae, 2019)
Streptococcus pneumoniae ou pneumocoque ou streptocoque est un coccus à
Gram positif capsulé, regroupé sous forme de diplocoques, avec un aspect lancéolé en « flamme de bougie ». Cette bactérie fait partie de la flore naturelle des muqueuses respiratoires et colonise le rhino-pharynx dont elle est commensale. Sous l’influence de certains facteurs, le streptocoque peut devenir pathogène et être responsable d’infections respiratoires à type de pneumonies, bronchites, pleurésies, otites, sinusites… La contamination se fait par voie respiratoire à partir de porteurs sains ou malades et les infections touchent surtout les âges extrêmes de la vie : jeunes enfants jusqu’à 4 ans et personnes âgées à partir de 70 ans.
37
2.4. Les chiffres en ville
En 7 ans, la proportion de souches d’Escherichia coli (E. coli) résistantes aux céphalosporines de 3ème génération (C3G) a été multipliée par 3,7 (de 1,3 % à 4,8 %,) mais diminue depuis (3,6 % en 2017) cependant la proportion de souches résistantes augmente avec l’âge (6% chez les plus de 75 ans) et est plus élevée chez les hommes que chez les femmes (5,7 % contre 3,4 %). La diminution observée depuis 2015 succède à la diminution des consommations de céphalosporines de 3ème génération (-40 %) et de fluoroquinolones (-30 %) en ville [17].
Après une diminution quasi-constante de 2003 jusqu’en 2014, la résistance à la pénicilline et la résistance aux macrolides chez le pneumocoque (Streptococcus
pneumoniae ou S. pneumoniae) montrent une tendance à la hausse depuis 2015. Elle
reste néanmoins entre 23 % et 26 % et donc inférieure aux valeurs rapportées au début des années 2000. Ces données sont produites par le CNR des pneumocoques (CNRP). Bien qu’elle n’occupe plus le 1er rang, la France se situe encore parmi les pays européens où les résistances à la pénicilline ou aux macrolides sont les plus élevées.[18]
38
2.5. Conséquences à l’hôpital
La résistance aux céphalosporines de 3ème génération (C3G) chez E. coli a régulièrement augmentée, de 2,0 % à 10,2 % en 10 ans, parmi les souches isolées d’infections graves. La résistance aux céphalosporines de 3ème génération (C3G) chez K.
pneumoniae, autre entérobactérie fréquemment responsable d’infections nosocomiales, a
également fortement augmenté, de 10,0 % à 28,8 % en 10 ans. Une infection nosocomiale fait partie des infections associées aux soins, contractée au cours ou au décours d’une hospitalisation. L’infection est donc absente au moment de l’admission du patient dans l’établissement et se déclare au minimum 48 heures après l'admission, ou au-delà si la période d'incubation est connue et plus longue. Toutefois, la possibilité d’un lien entre hospitalisation et infection est évaluée dans chaque cas douteux. Pour les infections de plaie opératoire, le délai de 48 heures communément accepté pour distinguer une infection acquise en dehors de l’hôpital d’une infection nosocomiale est repoussé à 30 jours après l'intervention, même si le patient est sorti de l'hôpital. En cas de mise en place d'une prothèse ou d'un implant, ce délai coure alors sur l'année qui suit l'intervention. En France, un patient sur cinq qui rentre pour une hospitalisation, contracte une infection associée aux soins, les plus nombreuses étant les infections urinaires notamment dues à
E.coli, devant les pneumonies ou les bactériémies voir septicémies souvent à Staphylococcus aureus.
39
3. Résistance aux antibiotiques
Les antibiotiques sont des médicaments utilisés pour traiter et prévenir les infections dues à des bactéries telles que les pneumonies, bronchites, otites, méningites, infections urinaires, septicémies, maladies sexuellement transmissibles…. C'est une des découvertes les plus importantes de la médecine qui a sauvé et qui sauve des millions de vies chaque année, mais leur efficacité est menacée car les bactéries peuvent s’adapter et résister aux traitements. Ce sont les bactéries, et non les êtres humains ou les animaux, qui deviennent résistantes. C’est donc lorsque les bactéries sont devenues insensibles aux antibiotiques que l’on parle de résistance, tandis que celles répondant aux antibiotiques sont qualifiées de sensibles. Les bactéries résistantes peuvent alors provoquer chez l’homme ou l’animal des infections plus difficiles à traiter que celles dues à des bactéries non résistantes ou sensibles, et à terme la mort si aucune solution n’est trouvée.
3.1. Résistance acquise et résistance naturelle
La résistance [19] aux antibiotiques est un phénomène naturel. Certaines bactéries sont résistantes à des antibiotiques de manière innée. On parle de résistance naturelle. Celle-ci constitue également un marqueur d’identification de la bactérie. D’autres échappent, par des modifications génétiques, à l’action d'antibiotiques auxquels elles étaient jusqu’alors sensibles : on parle de résistance acquise. Elle constitue un marqueur épidémiologique.
40 3.1.1. Résistance innée ou naturelle
On parle de résistance naturelle [20] lorsque toutes les souches d’une même espèce bactérienne sont résistantes à un antibiotique donné. Il s’agit en fait de bactéries qui sont insensibles au mode d’action de l’antibiotique, c’est un caractère d’espèce. Certaines bactéries sont naturellement résistantes à de nombreuses molécules par exemple K.
pneumoniae est naturellement résistant aux pénicillines (amoxicilline, ticarcilline) par
production d’une bêta-lactamase de classe A (type SHV-1), S. pneumoniae aux quinolones de 1ère génération et certaines fluoroquinolones (lévofloxacine et moxifloxacine) ainsi que les bactéries anaérobies qui sont naturellement résistantes aux aminosides car le passage des aminosides à travers la membrane cytoplasmique nécessite un système de transport actif absent chez les anaérobies.
Pour un antibiotique donné, l’ensemble des espèces bactériennes qui y sont sensibles représente son spectre d’activité. Ces notions de résistance naturelle et de spectre sont importantes : elles expliquent pourquoi certains antibiotiques sont incapables de combattre certaines bactéries.
La résistance naturelle est stable, transmise à la descendance (elle a pour support génétique le chromosome bactérien) mais elle n'est pas ou peu transmissible sur un mode horizontal c’est-à-dire d’une bactérie à l’autre au sein d’une même espèce ou entre espèces différentes. La résistance naturelle est connue et peut donc être contournée en élargissant le spectre des antibiotiques par modification de leur structure chimique car il s’agit en fait de bactéries qui sont insensibles au mode d’action de l’antibiotique.
Exemple de résistance naturelle : le bacille de la tuberculose qui n’est sensible qu’à quelques antibiotiques bien précis, la cible peut n’être que peu accessible : bactéries à Gram négatif, la plupart macrolides et mycoplasmes sans paroi.
Pour un antibiotique donné, l’ensemble des espèces bactériennes qui y sont sensibles représente son spectre d’activité.
41 3.1.2. Résistance acquise
On parle de résistance acquise lorsqu’une ou plusieurs souches d’une espèce bactérienne naturellement sensible à un antibiotique y deviennent résistantes. La résistance acquise se caractérise donc par l’apparition subite d’une résistance à un ou plusieurs antibiotiques chez certaines bactéries qui étaient auparavant sensibles.
La résistance acquise résulte de mécanismes qui sont liés à l’ADN de la bactérie et sont donc caractérisés par des mutations ou des transferts de gènes résistant d’une bactérie résistante vers une bactérie sensible, via un plasmide par exemple. Un plasmide désigne une molécule d'ADN distincte de l'ADN chromosomique, capable de réplication autonome et non essentielle à la survie de la cellule. [21]
Les mutations peuvent survenir au niveau du chromosome bactérien, ce sont des évènements ponctuels qui permettent de contourner l’effet délétère de l’antibiotique cependant ce phénomène ne concerne qu’un antibiotique ou qu’une famille d’antibiotiques à la fois.
L’acquisition de gènes de résistance peut résulter du transfert de matériel génétique porteur d’un ou plusieurs gènes de résistance venant d’une bactérie résistante. Ce deuxième mécanisme est le plus répandu et le plus préoccupant car il peut simultanément concerner plusieurs antibiotiques, voire plusieurs familles d’antibiotiques.
Une même souche bactérienne peut accumuler les mécanismes de résistance, mutation ou acquisition de gènes, on parle alors de multi résistance. Les bactéries multi résistantes ou BMR, résistantes à plusieurs familles d’antibiotiques et les bactéries pan-résistantes sont celles qui conduisent à des impasses thérapeutiques.
Ce ne sont pas les antibiotiques qui provoquent les mutations, les mutations sont un phénomène rare mais naturel cependant la présence des antibiotiques tend à favoriser la souche résistante : en effet, les antibiotiques éliminent les bactéries non mutées tandis que celles mutées résistent et peuvent se multiplier rendant alors le traitement antibiotique inefficace.
42
3.2. Mécanismes de résistance
La résistance aux antibiotiques peut résulter de plusieurs mécanismes : production d’une enzyme modifiant ou détruisant l’antibiotique, modification de la cible de l’antibiotique, imperméabilisation de la membrane de la bactérie… Tous ces mécanismes peuvent être isolés ou associés et c’est dans ce dernier cas de figure qu’ils vont être difficiles à contourner.
3.2.1. Modification de la cible 3.2.1.1. Modification qualitative
Cette modification qualitative peut se faire par mutation de la cible de l'antibiotique, en effet les antibiotiques se fixent sur une cible précise dans la cellule : paroi, ribosome... Une modification consécutive à une mutation ou par des protéines empêchant l’accès au site de fixation suffit souvent à empêcher la liaison. C'est l'un des mécanismes de résistance à la streptomycine, qui fût l'un des premiers antibiotiques utilisé pour traiter la tuberculose devenu obsolète aujourd’hui.
En ce qui concerne la modification de la cible, les bactéries peuvent aussi sécréter une enzyme spécifique qui effectue une modification chimique covalente de la cible, par exemple par une méthylation qui inhibera la fixation de l'antibiotique. Ce type de mécanisme est rencontré dans la résistance aux macrolides, où une méthylase confère une résistance en modifiant l'ARN ribosomique au niveau du site de liaison de l'antibiotique.
Un dernier cas de figure peut aussi se présenter et relève de la résistance innée, c’est l’absence de paroi chez les bactéries du genre Mycoplasma qui est responsable de leur résistance naturelle aux β-lactamines car ces antibiotiques agissent sur la paroi au niveau des PLPs.
3.2.1.2. Modification quantitative
Cette modification se traduit par la surexpression de la cible de l'antibiotique. En produisant davantage de la macromolécule ciblée, la bactérie arrive à maintenir suffisamment d'activité biologique pour se développer, malgré la présence de l'antibiotique qui est alors dépassé et l’augmentation des concentrations ne peut contrer ce phénomène.
43 3.2.2. Inactivation de l’antibiotique
De nombreuses souches résistantes fabriquent une enzyme qui modifie ou qui clive la molécule d'antibiotique, la rendant inactive. C'est le mécanisme principal de résistance aux β-lactamines (famille de la pénicilline et des céphalosporines) qui implique les enzymes de la famille des β-lactamases. Les scientifiques ont ainsi tenté de contourner ce phénomène en synthétisant des inhibiteurs de bêta-lactamases qu’ils ont associés aux pénicillines ou céphalosporines (pour l’avibactam) déjà existantes par exemple l’association amoxicilline-acide clavulanique. Ce mécanisme d’inactivation est le plus fréquent.
3.2.3. Diminution de la quantité d’antibiotique
Dans ce cas l’antibiotique n’est pas modifié mais il ne peut plus atteindre sa cible en quantité suffisante.
3.2.3.1. L'efflux des antibiotiques
Les bactéries sont capables d'éliminer les antibiotiques par pompage actif hors de la cellule, qui efflue les composés toxiques au dehors. C'est l'un des mécanismes de résistance de Pseudomonas aeruginosa, pathogène opportuniste responsable de nombreuses infections nosocomiales.
3.2.3.2. La réduction de la perméabilité membranaire
La bactérie empêche la pénétration de l’antibiotique dans la cellule dans laquelle celui-ci doit entrer pour atteindre sa cible. La « porte d’entrée » est représentée par des pores sont normalement constitués de protéines qui forment des canaux et que l'on appelle des porines. Les bactéries résistantes réduisent leur nombre de porines et déstabilisent ainsi ces canaux.
44
Figure 14 Mécanismes d’action de la résistance antibiotique (Développement & santé, Pascale Lesseur, Antibiotiques :
mode d’action et mécanismes de résistance, 2019)
3.2.4. Autre mécanisme : « l’altruisme »
Outre ces mécanismes très bien décris, les bactéries très résistantes sont capables de synthétiser l’indole en très grande quantité pour subvenir aux besoins des bactéries sensibles. Seule une minorité d’individus hautement résistants se distinguent, et ces mutants (moins de 1% de l’ensemble) aident les autres en produisant ainsi l’indole, qui aide les cellules à lutter contre le stress oxydatif et à se débarrasser des antibiotiques. Cela évite aux plus faibles de mourir et leur donne du temps pour acquérir à leur tour des résistances. Ce composé organique possède une double fonction de résistance : efflux des antibiotiques et activation d’une voie métabolique empêchant la synthèse de radicaux libres qui peut être favorisée par l’antibiotique.


![Figure 7 Deux types de paroi bactérienne [12 ] : en A, paroi des bactéries Gram positives composée de peptidoglycane, en B, paroi des bactéries Gram négatives avec une couche de peptidoglycane plus mince mais composée en plus d’une](https://thumb-eu.123doks.com/thumbv2/123doknet/6391444.169128/28.892.225.724.628.1030/bactérienne-bactéries-positives-peptidoglycane-bactéries-négatives-peptidoglycane-composée.webp)