Identification de biomarqueurs du syndrome
métabolique par une approche métabolomique chez
l’humain
Mémoire
Marie Michèle Boulet
Maîtrise en nutrition
Maître ès sciences (M.Sc.)
Québec, Canada
© Marie Michèle Boulet, 2014
iii
Résumé
Les profils métabolomiques d’acides aminés (AA) sanguins d’individus obèses présentent des niveaux élevés d’acides aminés à chaîne ramifiée (AACR) possiblement en lien avec une altération des enzymes de leur catabolisme dans le tissu adipeux. Nous avons étudié les profils d’AA sanguins associés à l’obésité viscérale et aux facteurs de risque cardiométabolique ainsi que l’expression des gènes et l’abondance protéique des enzymes du catabolisme des AACR dans les tissus adipeux d’un échantillon de femmes ayant divers degrés d’adiposité. Nous avons démontré que les femmes obèses présentaient des niveaux d’AACR, de glutamate et de tyrosine augmentés. De plus, les taux circulants d’AACR étaient associés positivement aux marqueurs d’homéostasie du glucose et d’adiposité totale et sous-cutanée tandis que le glutamate et l’acylcarnitine C3 étaient associés positivement à l’aire de tissu adipeux viscéral et aux niveaux de triglycérides sanguins. L’expression et l’abondance protéique des enzymes du catabolisme des AACR étaient abaissées dans le tissu adipeux omental des femmes obèses. Les résultats de cette étude suggèrent que les concentrations sanguines d’AACR, de tyrosine et de glutamate sont plus élevées chez les individus obèses. Cette élévation des taux plasmatiques pourrait être associée à une diminution de l’expression et de l’abondance protéique des enzymes responsables du catabolisme des AACR, principalement observée dans les tissus adipeux omentaux des individus obèses.
v
Abstract
Metabolomic profiling of obese individuals revealed high blood levels of branched-chain amino acids (BCAA) possibly linked to altered adipose tissue BCAA catabolism. We examined plasmatic AA profiling linked with visceral obesity and cardiometabolic risk factors as well as gene expression and protein abundance of BCAA-catabolizing enzymes in adipose tissue of lean-to-obese women. We showed that obese women had significantly higher circulating BCAA, glutamate and tyrosine levels. Moreover, circulating BCAA levels were positively related to glucose homeostasis variables in addition to total and subcutaneous adiposity markers while glutamate and C3 acylcarnitine levels were positively associated with visceral adipose tissue area and triglycerides. Obese women had lower expression and protein levels of BCAA-catabolizing enzymes in visceral adipose tissue specifically. The results of this study suggest that plasma concentrations of BCAA, tyrosine and glutamate are elevated in obese individuals. This could be associated with a reduction in expression and protein abundance of BCAA-catabolizing enzymes mainly observed in omental adipose tissue of obese individuals.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Introduction ... ix
Chapitre 1 ... ix
Liste des figures ... xi
Introduction ... xi Chapitre 1 ... xi Annexe ... xi Avant-propos ... xv Introduction ... 1 1. La problématique de l’obésité ... 1
1.1. Classification, prévalence et éthiologie ... 1
1.2. Dimorphisme sexuel de la distribution des graisses ... 2
1.3. Accumulation de tissu adipeux au niveau viscéral ... 4
1.4. Complications métaboliques associées à l’obésité abdominale ... 5
1.4.1. Dyslipidémies ... 6
1.4.2. Altération de l’homéostasie du glucose ... 7
1.4.3. Syndrome métabolique ... 7
2. Étiologie de la dysfonction du tissu adipeux ... 8
2.1. Taille adipocytaire ... 9
2.2. Lipolyse altérée ... 10
2.3. Débordement d’acides gras ... 11
3. Une technique d’analyse émergente : la métabolomique ... 12
3.1. Qu’est-ce que la métabolomique? ... 12
3.1.1. Applications ... 12
3.1.2. Méthodes ... 13
3.1.3. Intérêt dans un contexte d’obésité ... 15
4. Altérations des profils d’acides aminés plasmatiques et obésité ... 16
4.1. Élévation des taux sanguins d’acides aminés et d’acylcarnitines ... 16
4.2. Catabolisme des acides aminés à chaîne ramifiée ... 18
4.3. Dysfonction du catabolisme des acides aminés à chaîne ramifiée dans le tissu adipeux .. 20
Objectifs et hypothèses ... 23
Chapitre 1 : Profil métabolomique d’acides aminés sanguins dans le contexte de l’obésité et du risque cardiométabolique chez l’humain ... 25
Résumé ... 26
Conclusion ... 57
Bibliographie ... 63
Annexe : Enzymes de conversion des stéroïdes dans les tissus adipeux : mise à jour de la littérature ... 73
ix
Liste des tableaux
Introduction
Tableau 1: Catégories d'IMC en fonction du poids et de la taille ... 2 Tableau 2: Critères cliniques de diagnostic du syndrome métabolique du NCEP ATP III ... 8
Chapitre 1
Table 1. Anthropometrics, body fat distribution and metabolic characteristics of study participants (n=59) ... 50 Table 2. Pearson correlations between blood levels of amino acids and adiposity markers ... 51 Table 3. Pearson correlations between blood levels of amino acids and cardiometabolic risk factors52
xi
Liste des figures
Introduction
Figure 1. Patrons de distribution des graisses chez l’humain et risque cardiométabolique associé. ... 3 Figure 2. Revue de la littérature sur l’obésité et les profils d’acides aminés plasmatiques ... 17 Figure 3: Catabolisme des acides aminés à chaîne ramifiée ... 20
Chapitre 1
Figure 1. Plasma levels of glutamate, branched-chain and aromatic amino acid as well as C3 or C5 acylcarnitine among patients stratified for BMI ... 54 Figure 2. Pearson correlations between factor scores obtained from PCA and adiposity, cell size or cardiometabolic risk factors ... 55 Figure 3. Gene expression and protein abundance of BCAA catabolizing enzymes in visceral adipose tissue among patients stratified for BMI ... 56
Annexe
Figure 1. Summary of documented androgen, estrogen, progesterone and glucocorticoid effects on adipose tissue function and metabolism ... 118 Figure 2. Pathways of steroid hormone metabolism in adipose tissue... 119
xiii À ma famille et mes amis
xv
Avant-propos
Au cours de ma maîtrise, j’ai eu l’opportunité de travailler sur deux projets traitant de sujets très intéressants. Le premier projet auquel j’ai participé portait sur les enzymes de conversion des stéroïdes dans le tissu adipeux. Notre équipe de recherche travaille depuis de nombreuses années dans ce domaine et avait déjà publié une revue de la littérature sur ce sujet qui datait d’environ dix ans. Notre objectif était d’écrire un article afin de mettre à jour cette revue de littérature. J’ai donc effectué une partie de la recherche de références ainsi que l’écriture du manuscrit en tant que co-auteure avec l’aide d’une de nos professionnelles de recherche, Mélanie Nadeau, et de mon directeur de maîtrise, Dr. André Tchernof. Notre article s’intitule Updated survey of the
steroid-converting enzymes in human adipose tissues. Il a été accepté pour publication dans la revue The Journal of Steroid Biochemistry and Molecular Biology. J’aimerais remercier Mélanie
Nadeau et le Dr. Tchernof pour le travail d’équipe que nous avons fait pour cet article. Je souhaite aussi remercier Mohamed Mansour qui a effectué la révision et les modifications du texte.
Le projet principal de ma maîtrise portait sur des analyses métabolomiques de plasma et de tissus adipeux d’un échantillon de femmes ayant divers degrés d’adiposité dans le but d’identifier de nouveaux biomarqueurs de l’obésité viscérale et du syndrome métabolique. Nous avons également ajouté des données sur les enzymes du catabolisme des acides aminés à chaîne ramifiée et des analyses de journaux alimentaires. Ce projet m’a permis d’écrire un article en tant que première auteure intitulé Branched-chain amino acid-related signature of visceral obesity
and cardiometabolic risk factors en collaboration avec l’équipe de recherche du Dr. Jerzy
Adamski spécialisée en métabolomique et située à Munich, de même qu’avec le Dr. André Marette et son étudiante au doctorat Geneviève Chevrier. Je remercie donc tous ces collaborateurs de même que la professionnelle de recherche Mélissa Pelletier et le Dr. André Tchernof. L’article a été soumis à la revue Metabolism - Clinical and Experimental.
J’aimerais particulièrement remercier mon directeur de recherche, Dr. André Tchernof, qui représente une grande source d’inspiration pour moi. Il est rare de voir quelqu’un travailler avec une telle passion et un aussi grand dévouement. De plus, l’encadrement qu’il offre à ses étudiants est extrêmement apprécié puisqu’il nous supporte dans tout ce que nous réalisons. Le Dr. Tchernof m’a permis de découvrir le monde de la science et je n’aurais pas pu avoir meilleur
xvi
mentor. Il nous guide vers le développement de notre capacité d’analyse, l’amélioration de nos méthodes de travail, l’application de la rigueur scientifique et j’en passe. Pour toutes ces raisons, je me sens plus que privilégiée d’avoir pu réaliser ma maîtrise sous sa direction.
Ensuite, je remercie sincèrement tous les membres de l’équipe du Dr. Tchernof avec lesquels j’ai pu travailler au cours de ma maîtrise : Julie Lessard, Andréanne Michaud, Julie-Anne Côté, Mélanie Nadeau, Mélissa Pelletier, Thomas Grenier-Larouche, Marc Lapointe, Mohamed Mansour, Pascalin Roy, Sofia Laforest et Geneviève B. Marchand. Étant la seule étudiante à la maîtrise lors de mon arrivée dans l’équipe, j’ai reçu beaucoup d’aide, de conseils et d’encouragements de la part des autres étudiants gradués. En plus de l’aide au niveau professionnel, j’ai aussi découvert des personnes extraordinaires, toujours prêtes à s’entraider et qui ont d’une certaine façon, tous contribué à la réalisation de ma maîtrise. Leur aide et leur amitié m’ont tellement été précieuses et je les remercie de tout cœur.
En plus de l’aide d’une équipe de recherche exceptionnelle, la réalisation de cette maîtrise aurait été impossible sans le support financier du projet par les Instituts de Recherche en Santé du Canada et une bourse d’étude du Centre de Recherche en Endocrinologie Moléculaire et Oncologie et Génomique Humaine du CHU de Québec. Une bourse d’été de Diabète Québec m’a également permis de réaliser un stage d’initiation à la recherche et une bourse des IRSC m’a permis de présenter mes résultats au congrès international Obesity Week. Je tiens à remercier tous ces organismes pour leur soutien majeur.
Je souhaite aussi remercier mes parents, qui sont toujours présents pour moi et qui m’offrent un amour inconditionnel. Nous sommes très proches et ils ne cessent de m’encourager et de m’aider dans toutes les sphères de ma vie. Ils m’ont toujours stimulé à développer mes capacités au maximum et ils ont toujours cru en moi même lorsque je pensais en être incapable. Je ne saurais mettre en mot toute l’affection que je leur porte et à quel point ils sont importants pour moi. J’en profite également pour remercier mes amies les plus proches autant ceux que je côtoie depuis l’enfance que ceux avec qui j’ai créé des liens lors de mon baccalauréat. Encore une fois, les mots me manquent pour exprimer à quel point ces personnes comptent dans ma vie. Elles me permettent d’être moi-même et m’acceptent comme je suis et pour cela je les remercie infiniment.
xvii Finalement, la réalisation de cette maîtrise m’aura offert de nombreuses opportunités et de très beaux défis au plan professionnel et la possibilité de m’épanouir et d’avoir plus confiance en mes capacités.
1
Introduction
1. La problématique de l’obésité
1.1. Classification, prévalence et éthiologie
Les taux d’embonpoint et d’obésité ont connu une augmentation importante depuis les années 1980 (1). L’Organisation Mondiale de la Santé estimait, en 2008, que 35% de la population mondiale d’adulte de plus de vingt ans présentait un embonpoint. De ce 35%, la proportion d’hommes et de femmes obèses était de 10% et 14% respectivement (2). Au Canada, en 2008 également, les statistiques basées sur des données auto-rapportées estimaient que 18.3% des hommes étaient obèses et 40.3% présentaient de l’embonpoint. Chez les femmes, 16.2% étaient considérées obèses et 27.4% présentaient de l’embonpoint (3). Un aspect inquiétant lié à l’augmentation de la croissance de l’embonpoint et de l’obésité est que ces conditions sont aussi de plus en plus observées chez les enfants et les adolescents (4, 5). Ogden et coll. ont mesuré que la prévalence de l’obésité chez les enfants de 2 à 19 ans et les adultes de 20 ans et plus était de 16.9% et 34.9% respectivement (6). Selon eux, la prévalence n’aurait pas significativement varié depuis les années 2003-2004 autant chez les enfants que les adultes, mais elle reste tout de même élevée (6).
L’obésité est définie comme étant une accumulation anormale ou excessive de graisse sous forme de tissus adipeux, pouvant engendrer des problèmes de santé (7). Simplement parlant, elle est le résultat du déséquilibre entre les apports alimentaires et la dépense calorique. Cependant, de nombreux autres facteurs internes, par exemple génétiques et hormonaux, et externes, tels que l’environnement et les habitudes de vie, doivent être pris en compte dans cette problématique, ce qui la rend beaucoup plus complexe (8). L’obésité est également fortement associée à plusieurs pathologies : l’hypertension, les dyslipidémies, le diabète de type 2, la goutte, les maladies cardiovasculaires, l’apnée du sommeil et même certains cancers (9-11). En plus des conséquences métaboliques, l’obésité peut aussi affecter l’état psychologique des personnes atteintes (12, 13).
2
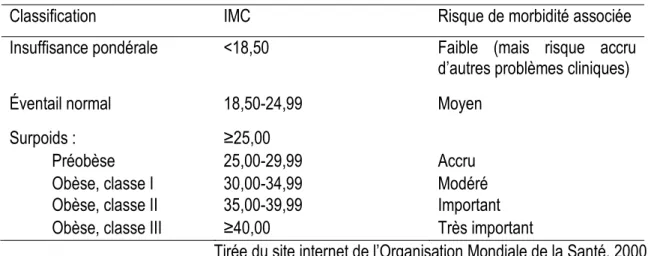
L’indicateur le plus utilisé pour quantifier le degré d’obésité est l’indice de masse corporelle (IMC) se calculant à l’aide du poids en kilogrammes divisé par la taille en mètres au carré (Tableau 1) (7). Cette mesure permet de calculer rapidement le risque individuel à peu de coût (14). Cependant, elle ne devrait pas être utilisée pour les enfants de moins de 18 ans, les personnes âgées de plus de 65 ans et les femmes enceintes ou allaitantes (15). De plus, l’IMC ne considère pas la masse musculaire et la distribution des graisses en plus de nécessiter des valeurs limites différentes selon l’ethnie (14, 16). D’autres méthodes, telles que l’absorptiométrie aux rayons X, la bioimpédance ou la mesure des plis cutanés, permettent de déterminer la quantité de masse grasse de façon plus précise, mais elles comportent également certaines limites.
Tableau 1: Catégories d'IMC en fonction du poids et de la taille Classification des adultes en fonction de l’IMC
Classification IMC Risque de morbidité associée
Insuffisance pondérale <18,50 Faible (mais risque accru d’autres problèmes cliniques)
Éventail normal 18,50-24,99 Moyen
Surpoids : ≥25,00
Préobèse 25,00-29,99 Accru
Obèse, classe I 30,00-34,99 Modéré
Obèse, classe II 35,00-39,99 Important
Obèse, classe III ≥40,00 Très important
Tirée du site internet de l’Organisation Mondiale de la Santé, 2000
1.2. Dimorphisme sexuel de la distribution des graisses
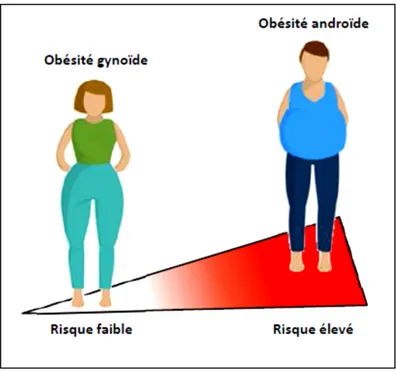
Le dimorphisme sexuel de la distribution des graisses est une caractéristique observée principalement chez l’humain comparativement aux autres mammifères et ce phénomène a un impact majeur au niveau métabolique. Bien que cette différence de morphologie ne soit pas apparente durant l’enfance, elle devient frappante lors de la puberté jusqu’à l’âge adulte (17). Jean Vague a été le premier à proposer une classification de ces patrons de distribution du tissu adipeux. Il a suggéré que les femmes acquièrent généralement une forme dite gynoïde, où les graisses sont accumulées au niveau des hanches et des cuisses tandis que les hommes ont tendance à présenter une forme androïde, c’est-à-dire une accumulation de tissu adipeux au niveau du tronc et de l’abdomen (Figure 1) (18). Par contre, certains facteurs peuvent contribuer à
3 atténuer le dimorphisme sexuel. Par exemple, il tend à diminuer avec l’augmentation de l’âge principalement en raison de changements corporels chez la femme (19). La quantité de graisse totale a aussi un impact, puisque la différence morphologique est également plus difficile à observer chez des individus dont l’indice de masse corporelle serait aux extrêmes de la classification (moins de 18,5 ou 40 et plus) (17). Finalement, il existe également une variation interindividuelle non-négligeable au niveau de la répartition des graisses. Entre les deux phénotypes, l’obésité de type androïde est la plus fortement associée aux complications métaboliques. Il a été démontré que même en l’absence d’obésité selon la classification clinique, les individus présentant une accumulation de graisse viscérale étaient les plus résistants à l’insuline alors qu’il est suggéré que l’obésité de type gynoïde aurait plutôt un effet « protecteur » sur les altérations métaboliques (20). En effet, les femmes pré-ménopausées présentent généralement moins de graisse viscérale que les hommes et ce, même après ajustement pour la masse adipeuse totale (21). Ces observations démontrent donc l’importance du dimorphisme sexuel de la distribution des graisses sur le profil métabolique chez l’humain.
Figure 1. Patrons de distribution des graisses chez l’humain et risque cardiométabolique associé.
4
1.3. Accumulation de tissu adipeux au niveau viscéral
L’accumulation de tissu adipeux au niveau de l’abdomen peut s’effectuer dans deux compartiments adipeux distincts, soit les dépôts sous-cutané et intra-abdominal, ce dernier comprenant les tissus non-viscéral et viscéral. Les tissus non-viscéraux incluent le tissu inter-, peri- et intra-musculaire de même que le para-osseux tandis que le dépôt viscéral contient les tissus adipeux accumulés dans les trois principales cavités corporelles soit thoracique, abdominal et intra-abdominopelvien. Chez l’humain, le tissu intra-abdominopelvien peut se déposer au niveau extra- ou intra-péritonéal, ce dernier englobant les dépôts mésentérique et omental (22). Le mésentère est un volumineux repli du péritoine qui fixe le jéjunum et l’iléon à la partie postérieure de la paroi abdominale tandis que le grand omentum est un tablier graisseux formé de deux feuillets qui recouvre les intestins (23, 24). Notre laboratoire s’intéresse particulièrement aux différences physiologiques et métaboliques entre les graisses abdominales sous-cutanée et intra-abdominale localisées au niveau du mésentère et de l’omentum. Il est possible d’observer la distribution des graisses de l’abdomen des individus à l’aide de techniques d’imagerie telles que la résonance magnétique et la tomographie axiale ainsi que par absorptiométrie (25, 26). La tomographie axiale est la technique la plus couramment utilisée et permet d’obtenir des images radiologiques transversales des compartiments adipeux au niveau des vertèbres lombaires 4 et 5. Il est ensuite possible de distinguer les dépôts sous-cutané et intra-abdominal ou viscéral et d’estimer leurs surfaces respectives (27).
L’intérêt d’étudier les dépôts adipeux sous-cutané et intra-abdominal (omental) découle du fait que ceux-ci présentent de multiples différences au niveau de leur biologie cellulaire, leur capacité de stockage et leur impact sur la santé cardiométabolique, entres autres. D’abord, la proportion de graisse retrouvée dans la cavité abdominale n’est que de 10-20% et de 5-10% chez les hommes et les femmes, respectivement. Il y a donc 80% et plus de tissu adipeux qui se retrouve dans les dépôts sous-cutanés (28). De plus, la contribution des graisses viscérales à la circulation systémique totale d’acides gras libres n’est que d’environ 15% puisque la majorité de ceux-ci est distribuée par des tissus adipeux non-spléniques (portaux) (29). Ensuite, la composition cellulaire varie d’un dépôt à l’autre, bien que plusieurs types cellulaires soient communs aux deux dépôts. Les adipocytes sont le principal constituant du tissu adipeux puisqu’ils occupent environ 90% de son volume. La gouttelette lipidique contenue dans les adipocytes remplit 95% de l’espace
5 cellulaire et par conséquent détermine leur taille. Le tissu adipeux renferme également des cellules de la fraction stroma vasculaire, qui englobe les préadipocytes, les cellules endothéliales et immunitaires (les macrophages, les cellules T, les neutrophiles et les lymphocytes). Finalement, des cellules souches multipotentes sont aussi retrouvées dans les deux dépôts adipeux. La particularité du tissu viscéral est qu’il contient de nombreux noyaux lymphatiques où peuvent s’accumuler des lymphocytes, de même que des cellules mésothéliales. La présence de ces types cellulaires dans le dépôt viscéral suggère qu’il pourrait jouer un rôle dans l’immunité (28). Des études sur des individus atteints du VIH supportent cette hypothèse puisqu’il est possible d’observer une obésité centrale combinée à une lipodystrophie périphérique chez environs 50% des patients traités aux antirétroviraux. Ceux-ci présentent également une inflammation systémique plus importante et une prévalence augmentée de complications métaboliques (30). Des études démontrent également des phénotypes métaboliques similaires chez des modèles animaux de lipodystrophie. Plus la perte de masse grasse est grande, plus les complications métaboliques sont sévères (31).
L’effet délétère d’une accumulation de graisse viscérale sur le métabolisme est très bien documenté, mais les mécanismes impliqués dans cette pathophysiologie ne sont pas tous bien compris. Plusieurs théories ont été suggérées pour expliquer le lien entre des altérations métaboliques telles que la résistance à l’insuline et le diabète de type 2, les dyslipidémies et l’hypertension artérielle et seront discutées ultérieurement.
1.4. Complications métaboliques associées à l’obésité abdominale
Cette section a pour but de décrire les principales anomalies métaboliques associées à l’accumulation de graisse intra-abdominale. Ces défauts englobent des altérations au niveau du métabolisme des lipides et du glucose, de même qu’un ensemble de facteurs de risque cardiométaboliques associés à l’obésité viscérale.
6
1.4.1. Dyslipidémies
L’obésité viscérale a un impact délétère sur le profil lipidique pouvant entraîner l’accumulation de plaque d’athérosclérose dans les vaisseaux sanguins et augmenter le risque de maladies cardiovasculaires (32). Les principales altérations cliniques observées sont une augmentation des niveaux plasmatiques de cholestérol total et LDL (lipoprotéine de faible densité), de l’apolipoprotéine B (ApoB) ainsi que des triglycérides et une diminution du cholestérol HDL (lipoprotéine de haute densité) (33). La taille des particules LDL a également un impact important sur la formation de plaque athéromateuse, puisque les particules plus petites et denses sont reconnues comme étant plus dommageables au niveau métabolique comparativement aux molécules de plus gros diamètre (34, 35). Certaines études suggèrent que la présence de particules LDL petites et denses serait un facteur de risque cardiovasculaire indépendant des niveaux de cholestérol total (35-37). Le mécanisme impliqué dans le développement des dyslipidémies inclut l’augmentation du flux d’acides gras au foie conduisant à une sécrétion plus importante de lipoprotéines riches en triglycérides. Les acides gras pouvant soit être oxydés par les tissus comme le cœur ou le muscle squelettique comme source d’énergie ou estérifiés en triglycérides au foie pour la production des VLDL. La sécrétion des VLDL étant associée à l’arrivée des acides gras libres et des triglycérides au foie en période postprandiale, une augmentation de la présence de ces composés dans le plasma entraîne donc une production de VLDL accrue (33). Cette hypertriglycéridémie pourrait alors provoquer un délai dans la clairance des particules riches en triglycérides et contribuer non seulement à la formation de LDL petites et denses, mais également à la production de HDL de plus petit diamètre (10, 38). Ce phénomène se produit à la suite d’une augmentation des échanges de triglycérides et de particules de cholestérol estérifié entre les nombreux VLDL avec les LDL et les HDL sous l’action de la protéine de transfert cholesteryl ester
transfert protein (CETP) (10). Ces lipoprotéines enrichies en triglycérides sont alors une cible de choix
pour la lipoprotéine lipase et la lipase hépatique, des enzymes qui effectuent l’hydrolyse des triglycérides (38). Les particules LDL de plus petite taille sont plus dommageables, car elles peuvent pénétrer plus facilement l’intima des vaisseaux sanguins et perdent leur capacité antioxydante. Les particules HDL de petit diamètre, quant à elles, sont retirées plus facilement de la circulation et leur concentration s’en retrouve donc réduite (39). Ces anomalies au niveau du métabolisme des lipides sont fortement associées à la présence d’obésité viscérale.
7 1.4.2. Altération de l’homéostasie du glucose
La relation entre la résistance à l’insuline et l’obésité abdominale a été très bien démontrée dans la littérature. La présence d’une accumulation des graisses au niveau viscéral aurait même un impact plus important que l’obésité totale dans le développement de la résistance à l’insuline et, éventuellement, du diabète de type 2 (40). Même des individus catégorisés comme étant minces selon leur IMC, mais présentant une obésité viscérale, sont plus à risque de développer une résistance à l’insuline (41). La fonction du tissu adipeux joue un rôle central dans ce processus, puisqu’il représente une importante source de substrat énergétique sous forme des acides gras libres qu’il peut relâcher en circulation. Les adipocytes peuvent également produire et sécréter des substances telles que les cytokines ou les adipokines. En présence d’obésité, le tissu adipeux libère plus d’acides gras et génère un profil altéré d’adipokines, ce qui peut affecter les mécanismes d’action de l’insuline (40). L’exposition des organes tels que le pancréas, le foie et le muscle squelettique à des concentrations élevées d’acides gras, d’adipokines et de cytokines inflammatoires comme l’IL-6 et le TNF-α a un impact délétère sur la cascade de signalisation de l’insuline. En effet, cette situation peut provoquer un débalancement au niveau des principaux sentiers métaboliques impliqués qui sont les voies de la phosphoinositide 3-kinase (PI3K) et de la
mitogen activated protein kinase (MAPK). Une des conséquences de cette altération est la
diminution de la translocation du transporteur du glucose GLUT-4 (42). En combinaison, ces défauts de transport du glucose et d’action de l’insuline provoquent alors une résistance à l’insuline systémique qui peut conduire au diabète de type 2.
1.4.3. Syndrome métabolique
L’expression « syndrome métabolique » peut être utilisée pour désigner un ensemble de complications métaboliques associées à l’obésité totale ou abdominale et ainsi cibler les individus les plus à risque (43). Il existe une association bien documentée entre la quantité de graisses viscérales, le développement du syndrome métabolique et le risque cardiovasculaire (44-47). À la fin des années 1970, Haller a décrit le syndrome métabolique comme étant la présence d’obésité, de diabète de type 2, d’hyperlipoprotéinémie, d’hyperuricémie et de stéatose hépatique et ayant un impact sur la viscosité du sang et du plasma, sur la coagulation et sur le développement de l’athérosclérose (48). Présentement, plusieurs organisations telles que l’Organisation mondiale de la santé (49), la Fédération internationale de diabète (50) et l’American Heart Association/US National Cholesterol Education Program Adult Treatment Panel III ont proposé des critères
8
diagnostics du syndrome métabolique (51) (Tableau 2). Les critères diffèrent quelque peu selon chaque association, mais en général ils contiennent tous une composante liée aux niveaux de triglycérides sanguins, de cholestérol HDL, de pression artérielle, de glucose sanguin et de tour de taille. Chaque organisation propose un critère de base obligatoire basé soit sur la résistance à l’insuline ou au taux de glucose à jeun, soit sur la circonférence de la taille. Deux à trois critères de plus doivent être ajoutés à la condition de base dépendamment de l’organisation. Le dépistage et le traitement du syndrome métabolique sont d’intérêt puisque cet ensemble de facteurs augmente le risque de développer un diabète de type 2 de 5 fois et le risque de développer une maladie cardiovasculaire de 2 fois sur une période de cinq à dix ans (pour revue (42)). De plus, la prévalence du syndrome est très variable allant de moins de 10% jusqu’à 84% selon la région, le sexe, l’âge et l’ethnicité de même que la définition utilisée (52, 53). L’impact de l’obésité viscérale sur le développement de comorbidités est donc non-négligeable.
Tableau 2: Critères cliniques de diagnostic du syndrome métabolique du NCEP ATP III Facteurs de risque Valeurs diagnostiques
Obésité abdominale Circonférence de taille
Femmes >88 cm Hommes >102 cm Triglycérides ≥1.69 mmol/L Cholestérol HDL Femmes <1.29 mmol/L Hommes <1.04 mmol/L Pression artérielle ≥130/≥85 mmHg
Glucose à jeun ≥6.1 mmol/L
Adapté du NCEP : ATP III Guidelines At-A-Glance Quick Desk Reference, 2001
2. Étiologie de la dysfonction du tissu adipeux
Le tissu adipeux a longtemps été considéré comme un compartiment dont la seule et unique fonction était le stockage des lipides. Depuis les années 1990, les recherches ont mené à l’identification de plus de 600 facteurs produits et sécrétés par les adipocytes (54). Il a également
9 été déterminé que le tissu adipeux était un organe complexe renfermant plusieurs types cellulaires et ayant un impact majeur sur la régulation énergétique et la pathophysiologie (55). L’accumulation de masse grasse est un phénomène hétérogène dans la population et auquel contribuent des facteurs génétiques, physiques, comportementaux et environnementaux, par exemple, ce qui rend la problématique de l’obésité d’autant plus complexe (56). Les principaux processus physiologiques associés à l’obésité et à la dysfonction du tissu adipeux sont : l’accumulation de graisse au niveau viscéral, l’augmentation du volume des adipocytes et la capacité d’expansion du tissu, une modification de sa composition cellulaire entre autres par une augmentation de l’infiltration des cellules immunitaires, une sécrétion plus élevée d’adipokines pro-inflammatoires, pouvant être impliquées dans le processus athérosclérotique, le développement du diabète de type 2 et une altération de l’expression de certains gènes et de protéines (54). Puisque les complications métaboliques associées à l’obésité ont été discutés dans la section 1, cette section portera sur la dysfonction du tissu adipeux qui entre en compte dans la physiopathologie de ces comorbidités.
2.1. Taille adipocytaire
L’augmentation de la masse de tissu adipeux se produit par deux mécanismes, soit par l’augmentation du volume des adipocytes (hypertrophie) ou de leur nombre (hyperplasie). Il a été démontré que l’hypertrophie est un élément clé de la pathogénèse d’un tissu adipeux dysfonctionnel (57). La mort cellulaire et la capacité réduite d’adipogenèse résultant en partie de l’hypertrophie des cellules adipeuses en présence d’obésité de long terme contribuent à limiter la capacité de stockage du tissu (58). De plus, il existe des différences interindividuelles et régionales au niveau de la taille des adipocytes. D’abord, de façon générale la taille des adipocytes s’accroît avec l’augmentation de l’adiposité chez les hommes et les femmes. Par contre, des études ont montré que les tissus adipeux du bas du corps ont tendance à se développer par hyperplasie chez la femme, mais plutôt par hypertrophie chez l’homme. Les adipocytes sous-cutanés de la même région anatomique sont également plus gros chez la femme que chez l’homme et ce à tous les degrés d’obésité (20).
Le volume des adipocytes est fortement corrélé avec la présence d’altérations métaboliques en lien avec le profil lipidique et l’homéostasie du glucose (59, 60). La présence d’adipocytes hypertrophiés dans l’un ou l’autre des compartiments adipeux chez des femmes appariées pour
10
leur composition corporelle et leur distribution des graisses entraîne des modifications au niveau de la lipolyse, des concentrations plasmatiques d’adiponectine ainsi que de l’expression de certains gènes codant pour des enzymes impliquées dans le métabolisme adipocytaire et l’inflammation (61). Plus précisément, chez des femmes atteintes d’obésité morbide, le volume des adipocytes viscéraux semble avoir un impact important sur des paramètres du profil lipidique tels que le cholestérol total et LDL de même que les niveaux d’ApoB et de triglycérides sanguins. L’hypertrophie au niveau sous-cutané aurait plutôt un effet sur la variation du taux de captation du glucose par l’insuline et sur les niveaux plasmatiques d’insuline (62). Les gros adipocytes sécrèteraient également plus d’adipokines pro-inflammatoires, par exemple les interleukines-6 et 8 ainsi que le tumor necrosis factor alpha 1 (63). L’hypertrophie adipocytaire contribue donc à l’apparition d’un profil métabolique défavorable et à l’altération du fonctionnement de la cellule adipeuse.
2.2. Lipolyse altérée
La fonction classique du tissu adipeux est le stockage et la libération de l’énergie sous forme de triglycérides, d’acides gras et de glycérol. La lipolyse est le processus de mobilisation des réserves adipeuses en réponse à divers stimuli hormonaux et métaboliques, par exemple le stress, le jeûne ou l’exercice physique. Le relâchement d’acides gras dans la circulation permet à des organes tels que le cœur, le muscle squelettique ou le foie de les utiliser comme substrats énergétiques. Le glycérol est plutôt transporté directement au foie et peut servir de substrat pour la production endogène de glucose. Les principaux régulateurs de la lipolyse chez l’humain sont la famille des catécholamines, incluant l’épinéphrine, la norépinéphrine et l’insuline (64). Lorsque l’épinéphrine ou la norépinéphrine se lient aux récepteurs β-adrénergiques 1, 2 et 3, une cascade de réactions mène à l’augmentation des niveaux d’AMP cyclique dans la cellule adipeuse. L’une des enzymes responsable de la libération des acides gras, la lipase hormono-sensible, est alors phosphorylée, ce qui lui permet d’accéder au contenu en triglycérides de l’adipocyte. Inversement, l’effet antilipolytique de l’insuline consiste en sa capacité à réduire les niveaux d’AMP cyclique et conséquemment, de diminuer la phosphorylation de la lipase par l’activation de la phosphodiestérase (65).
En présence d’obésité, il est fréquent d’observer des altérations à plusieurs niveaux de la cascade lipolytique. Plus précisément, un défaut de la lipolyse induite par les cathécholamines est une
11 caractéristique souvent présente dans le tissu adipeux sous-cutané de patients obèses. De plus, puisque la masse adipeuse est plus importante, la lipolyse basale s’en retrouve également augmentée, ce qui conduit à une augmentation des niveaux circulants d’acides gras libres (66). Les conséquences métaboliques d’une élévation d’acides gras plasmatiques sur l’entreposage des graisses seront discutées dans la prochaine section. Il existerait des différences entre les adipocytes omentaux et sous-cutanés en ce qui a trait aux taux basal et stimulé de lipolyse. Chez les hommes, la réponse des adipocyte omentaux à la lipolyse stimulée serait plus importante tandis que l’inverse est observé chez la femme. Par contre, chez les obèses des deux sexes, la lipolyse des adipocytes omentaux stimulée in vitro de même qu’in vivo entraîne une augmentation plus importante de libération d’acides gras comparativement aux individus minces (67). Il semble donc que la lipolyse pourrait être influencée par le sexe ainsi que la région anatomique des adipocytes, de même que la taille des cellules adipeuse, le degré d’obésité et la sécrétion d’adipokines (68).
2.3. Débordement d’acides gras
Tel que mentionné dans la section précédente, une des fonctions importantes du tissu adipeux est la mise en réserve d’énergie sous forme de lipides et le relâchement de cette source d’énergie en période de besoin et en présence de stimuli appropriés. En présence d’obésité, l’équilibre entre les apports énergétiques et la dépense est altéré, ce qui contribue à l’augmentation des quantités de triglycérides qui devront être entreposées dans les tissus adipeux. Dans cette situation, il est préférable pour le métabolisme que les triglycérides soient entreposés dans de petits adipocytes périphériques. Par contre, lorsque leur capacité d’entreposage maximale est atteinte, le surplus de lipides peut alors s’accumuler au niveau viscéral et dans les organes ectopiques comme le foie ou le muscle squelettique. Cet excès de triglycérides contribuerait au développement de la résistance à l’insuline hépatique et périphérique et cette hypothèse est appelée « l’overflow hypothesis » (39). La contribution d’une élévation des acides gras libres dans le plasma a aussi des effets délétères sur le métabolisme et pourrait contribuer à la résistance à l’insuline. Il a été démontré que l’induction d’une hyperlipidémie à la suite d’une infusion de lipides et d’héparine provoquait le développement d’une résistance à l’insuline qui se résorbait par la suite avec la résolution de l’hyperlipidémie (69). Le mécanisme potentiel serait que les acides gras libres inhibent la
12
signalisation de l’insuline en activant des cascades sérine-kinase. De plus, lorsque la concentration en acides gras est trop importante et dépasse la capacité d’oxydation et de stockage, il est possible que des intermédiaires tels que l’acide linoléique, le diacyl glycérol, l’acide phosphatidique et des céramides s’accumulent. Ces composés pourraient également activer des sérine-kinases, ce qui amplifierait l’effet négatif sur l’action de l’insuline (70).
Ainsi, la première partie de cette introduction résume les complications métaboliques et les dysfonctions du tissu adipeux en lien avec l’obésité et la distribution des graisses, particulièrement l’accumulation de graisse intra-abdominale. Afin de pousser encore plus loin les recherches sur les mécanismes en cause, l’utilisation de nouvelles techniques d’analyse s’avère d’intérêt et la prochaine partie portera sur la métabolomique et son utilité pour la recherche sur l’obésité et ses complications.
3. Une technique d’analyse émergente : la métabolomique
3.1. Qu’est-ce que la métabolomique?
Le développement de nouvelles technologies d’analyse du métabolisme permet de mesurer de plus petites molécules que les biomarqueurs utilisés actuellement. L’engouement pour ce type d’analyse est en plein essor et s’avère d’intérêt dans de nombreuses pathologies. Cette section décrit de façon détaillée les applications et les techniques de la métabolomique ainsi que l’intérêt d’utiliser cette ressource en contexte d’obésité et de risque cardiométabolique.
3.1.1. Applications
La métabolomique est une technique pouvant être utilisée pour l’analyse de composés ou de groupes de composés impliqués dans un processus métabolique chez l’animal ou l’humain. Son utilisation permet d’étudier les changements métaboliques liés à certaines pathologies et leur progression en permettant l’identification d’« empreintes » chimiques qui leur sont uniques. Ainsi, la métabolomique permet de quantifier des petites molécules (métabolites) contenues dans des cellules, des tissus ou des organes et les résultats de cette analyse fournissent des informations très précieuses en lien avec des processus physiologiques et pathophysiologiques (71). Par définition, les métabolites analysés par métabolomique peuvent être considérés comme des
13 biomarqueurs, qui sont « des indicateurs des processus biologiques normaux et pathologiques ou des réponses pharmacologiques à une intervention thérapeutique mesurés objectivement et qui ont pour but de prédire un bénéfice ou un dommage, ceci basé sur des données épidémiologiques, pathophysiologiques ou sur d’autres études scientifiques (72) ». La découverte de nouveaux biomarqueurs est d’intérêt en raison de leurs nombreuses applications potentielles et leur impact majeur sur l’industrie pharmaceutique et les services de santé courants. Il est suggéré que l’implantation de biomarqueurs au niveau du développement des médicaments pourrait réduire le temps et les coûts engendrés. De plus, le diagnostic moléculaire des pathologies pourrait améliorer la compliance des patients et réduire les coûts résultants des faux-positifs et de la détection tardive (73-75). La métabolomique est une technique considérée prometteuse en termes d’observation de la progression des maladies, de mieux comprendre leur physiopathologies et de déterminer l’effet de composés exogènes sur certaines conditions pathologiques. Plus précisément, cette technique pourrait être utilisée pour identifier et stratifier les maladies de même que de déterminer l’efficacité, la sécurité et les doses des traitements (76). Finalement, la métabolomique permet également d’étudier les interactions des métabolites entre eux ainsi que les rôles de régulateurs potentiels qu’ont ces molécules avec les gènes, les transcrits et les protéines. Il est maintenant indéniable que la mesure des métabolites de faible poids moléculaire par métabolomique offre des opportunités de mieux comprendre les mécanismes de l’impact qu’ont le mode de vie et les facteurs nutritionnels en lien avec des pathologies spécifiques (77).
3.1.2. Méthodes
La métabolomique est considérée comme une technique interdisciplinaire, puisqu’elle combine la chimie analytique, des plateformes technologiques, la spectrométrie de masse ou la résonance magnétique nucléaire avec des analyses statistiques avancées. Elle permet d’obtenir les profils des métabolites contenus dans divers fluides biologiques ou tissus à l’aide d’outils analytiques précis (77). Les principales techniques utilisées en métabolomiques sont la résonance magnétique nucléaire (RMN) ainsi que la chromatographie en phase gazeuse ou liquide combinée à la spectrométrie de masse (CG-SM ou CL-SM). L’analyse peut cibler des groupes de composés ou être exploratoire et les échantillons biologiques pouvant être analysés sont nombreux : du sang, des cultures de cellules, de la salive, des larmes, de l’urine, du sérum, du plasma, de la sueur, des fluides vaginaux, du sperme, des selles, du mucus, du lait maternel, du liquide d’ascite, de la lymphe, du liquide pleural, synovial ou cérébrospinal, de la moelle osseuse, des cheveux, des
14
tissus, des os ou des dents. La méthode utilisée pour ce projet de maîtrise étant la chromatographie en phase liquide combinée à la spectrométrie de masse ciblée, seule cette technique sera présentée dans cette section.
Concrètement, cette méthode permet de rechercher et de quantifier des petites molécules connues à l’aide du « multiple reaction monitoring », de précurseurs ou du balayage des pertes neutres. Des classes de composés sont visées par l’analyse, par exemple les acides aminés, les peptides, les acylcarnitines, les monosaccharides, les lipides et phospholipides, etc. Par la suite il est possible de mettre en lien ces composés et certaines pathologies (71). La quantification est effectuée avec les standards internes de référence appropriés. Les échantillons sont divisés en de multiples aliquots, puisqu’une petite quantité de matériel est nécessaire. Une quantité connue de standard interne est ajoutée à l’échantillon et donc, chaque échantillon contient de multiples standards identifiés et quantifiés pour les métabolites d’intérêt. Chacun d’entre eux est préparé de façon standardisée selon des critères provenant d’un guide de procédures de préparation standard. L’analyse de spectrométrie de masse est alors effectuée sur chaque extrait et les résultats générés fournissent les pics des métabolites étudiés et des concentrations connues de standards internes. Le traitement des données est ensuite effectué sur les résultats des analyses de spectrométrie de masse. Cette étape peut impliquer des techniques chimiométriques et statistiques telles que la correction par isotope, du filtrage, de la normalisation, de la mise à l’échelle et de la quantification nécessitant les caractéristiques connues des standards internes et les informations déjà notées dans la base de données. La comparaison entre les résultats et les valeurs de références de la base de données permet de déterminer si le métabolite provient d’un sujet sain ou atteint d’une pathologie, par exemple (71).
Les avantages de la méthode par chromatographie en phase liquide en association avec la spectrométrie de masse sont multiples. D’abord, cette technique permet l’analyse de nombreux composés semi-polaires de même que des métabolites secondaires. La CL-SM permet d’éviter que les composés changent de conformation chimique durant la procédure, ce qui rend son utilisation d’autant plus intéressante. De plus, elle offre une sélectivité et une sensibilité élevée lors de l’identification et la quantification des métabolites ce qui fait que la CL-SM est devenue la technique de choix en métabolomique. Il est également facile de reproduire les résultats et
15 d’analyser des fluides biologiques contenant des molécules très complexes. Un désavantage de la méthode est que les techniques basées sur la spectrométrie de masse nécessitent une préparation des échantillons qui pourraient entraîner la perte de métabolites (77, 78).
3.1.3. Intérêt dans un contexte d’obésité
Un des intérêts certains d’utiliser la métabolomique dans un contexte d’obésité est que les profils de métabolites obtenus peuvent démontrer des patrons pouvant potentiellement suggérer des signes précurseurs de certaines pathologies associées à l’obésité, même avant l’apparition de symptômes liés à la maladie. De plus, des études récentes ont évalué les profils métabolomique en lien avec la distribution des graisses, afin d’identifier de possibles biomarqueurs de l’obésité viscérale, qui est particulièrement associée aux complications métaboliques (43, 79-82). L’identification de métabolites prédicteurs de l’obésité viscérale et du syndrome métabolique était aussi un des objectifs de mon projet de maîtrise. La recherche de profils métabolomiques pouvant prédire les types d’obésité et les complications associées concorde avec une optique de dépistage précoce et de prévention des maladies. Cet aspect s’imbrique dans la recherche de solutions pour rendre le système de santé plus efficace et surtout réduire les coûts engendrés par des traitements donnés après une détection tardive. Par exemple, Wang et collaborateurs ont montré que les profils d’acides aminés sanguins pouvaient être altérés jusqu’à douze ans avant l’apparition d’un diabète de type 2 (83). Plus particulièrement, de nombreuses études ont observé des associations entre les taux sanguins d’acides aminés à chaîne ramifiée (AACR) et aromatiques et l’obésité, de même qu’avec le diabète de type 2 (84-88). L’obésité et la résistance à l’insuline pouvant mener au diabète de type 2 et étant étroitement liés, peu d’études se sont concentrées sur des marqueurs métabolomiques spécifiques à l’obésité indépendamment de l’insulino-résistance ou de la présence de diabète de type 2 et d’autres facteurs de risque cardiométabolique.
En plus des AACR, d’autres métabolites ont une implication potentielle au niveau de l’obésité et du diabète de type 2. Cheng et collaborateurs ont identifié la glutamine, le glutamate et le ratio glutamine/glutamate comme étant associés avec le risque de développer un diabète de type 2 et ce après ajustement pour l’âge, le sexe, l’IMC et les taux de glucose sanguin à jeun (89). Le ratio glutamine/glutamate était aussi associé de façon négative avec l’incidence du diabète de type 2, même après ajustement pour les niveaux d’AACR. Le glutamate était aussi corrélé positivement
16
avec l’IMC, la circonférence de la taille, le glucose à jeun, l’insuline, l’indice HOMA, les triglycérides transformés, et négativement associé au cholestérol HDL (89).
D’autres pathologies associées à l’obésité font également l’objet d’études impliquant la métabolomique. Coppola et collaborateurs ont démontré que les symptômes dépressifs et anxieux de rats obèses étaient augmentés en présence de taux sanguins élevés d’AACR. Ces symptômes ne se résorbaient pas à l’aide d’un traitement aux antidépresseurs classiques, mais s’amélioraient avec une supplémentation en tryptophane (90). Le lien entre l’obésité et la dépression est bien documenté et altère beaucoup la qualité de vie des individus souffrant de surpoids et d’obésité (12, 91, 92). Les niveaux sanguins de métabolites sont aussi étudiés chez des femmes atteintes du syndrome des ovaires polykystiques. Ce syndrome implique une obésité androïde, des niveaux d’androgènes élevés et un profil métabolique très défavorable. Ainsi, l’utilisation de la métabolomique pourrait s’avérer utile dans le but de mieux comprendre cette pathologie et d’éventuellement offrir de meilleurs traitements (93). La découverte de nouveaux biomarqueurs qui varient rapidement est aussi d’intérêt au niveau des pathologies cardiaques, de l’hypertension et du cancer, des conditions pouvant toutes être associées à l’obésité.
4. Altérations des profils d’acides aminés plasmatiques et
obésité
4.1. Élévation des taux sanguins d’acides aminés et d’acylcarnitines
Puisque la métabolomique semble être une technique d’analyse prometteuse pour l’identification de profils de métabolites associés à certaines pathologies, son utilisation pour l’étude de la problématique de l’obésité et ses complications allait de soi. En effet, les marqueurs métaboliques actuels ne permettent pas la prévention des altérations métaboliques causées par l’obésité, ils servent plutôt au traitement tardif des maladies. Il est donc nécessaire de trouver des biomarqueurs plus sensibles, qui permettraient de prévenir, ou du moins prévoir, l’apparition des pathologies dans une optique de réorienter le système de santé vers des soins préventifs de première ligne et vers la médecine personnalisée. Malgré l’engouement récent pour les analyses de métabolomiques et plus particulièrement les profils d’acides aminés plasmatiques, la relation
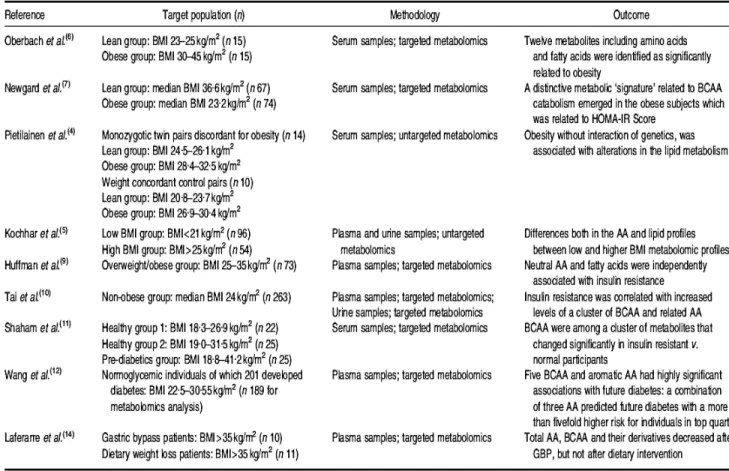
17 entre l’obésité et les acides aminés sanguins a été étudiée il y a quelques décennies par le groupe de Felig et collaborateurs (94). Par la suite, au début des années 2000, d’autres équipes de recherche se sont penchées sur la question et ont commencé à utiliser la métabolomique comme technique d’analyse chez les souris et ensuite les humains (95-98). Actuellement, il est de plus en plus accepté que les niveaux d’acides aminés, particulièrement les AACR, de même que les concentrations de certains autres composés tels que les acides aminé aromatiques (tyrosine, phénylalanine et tryptophane) et certaines acylcarnitines à chaînes courtes (C3 et C5) sont élevés dans le sang des individus obèses (84, 85, 87, 99-101) (Figure 2).
Figure 2. Revue de la littérature sur l’obésité et les profils d’acides aminés plasmatiques Tiré de Morris et al, 2012
Les mécanismes contribuant à l’élévation des taux d’acides aminés et d’acylcarnitines sanguins sont encore inconnus à ce jour. Cependant, des hypothèses ont été suggérées. Newgard et collaborateurs proposaient que ce phénomène soit étroitement lié à l’alimentation et qu’une diète
18
élevée en gras et en protéines combinée avec une déficience en insulin growth factor 1 (IGF-1) chez les personnes obèses provoqueraient un détournement des AACR vers des voies cataboliques plutôt que vers les voies de synthèse protéique (84). L’augmentation du catabolisme des AACR causerait l’accumulation d’acylcarnitines de type C3 et C5, ainsi que l’augmentation des niveaux sanguins de glutamate (84). Le groupe de Delany et collaborateurs a démontré que les acylcarnitines à longues chaînes s’accumulaient dans le plasma des individus obèses et/ou diabétiques (102). De plus, chez les diabétiques, une augmentation sanguine des concentrations d’acides gras à courtes chaînes a également été notée. L’accumulation de ces métabolites dans le sang des individus obèses et diabétiques pourrait être causée par un défaut d’oxydation des acides gras au niveau de la mitochondrie cellulaire (102). D’autres groupes suggèrent que les niveaux d’AACR retrouvés chez les obèses seraient une conséquence d’un défaut des enzymes de leur catabolisme au niveau du tissu adipeux omental, plus particulièrement (103-105). Le catabolisme des AACR sera discuté plus en détail dans la section suivante. Seules quelques études se sont intéressées aux profils d’acides aminés plasmatiques en fonction de la distribution des graisses et des complications métaboliques associées spécifiquement à l’obésité viscérale (79-82).
4.2. Catabolisme des acides aminés à chaîne ramifiée
L’ingestion et la digestion des protéines alimentaires mènent à la libération de leur contenu en acides aminés dans la circulation sanguine. Le corps humain est également en mesure de synthétiser onze acides aminés, soit l’alanine, l’asparagine, l’acide aspartique, l’acide glutamique, l’arginine, la cystéine, la glutamine, la tyrosine, la glycine, l’ornithine, la proline et la sérine. Les autres acides aminés nécessaires à la synthèse protéique doivent être obtenus par l’alimentation. Parmi ceux-ci se retrouvent les AACR, l’isoleucine, la leucine et la valine qui constituent environ vingt pourcent des protéines alimentaires (106). Ces acides aminés, en plus de contribuer à la synthèse protéique, accomplissent des fonctions au niveau de l’homéostasie du glucose en participant à la régulation de la cascade de signalisation de l’insuline, entre autres. Cette activité est dépendante de la disponibilité et de l’apport alimentaire en AACR (106).
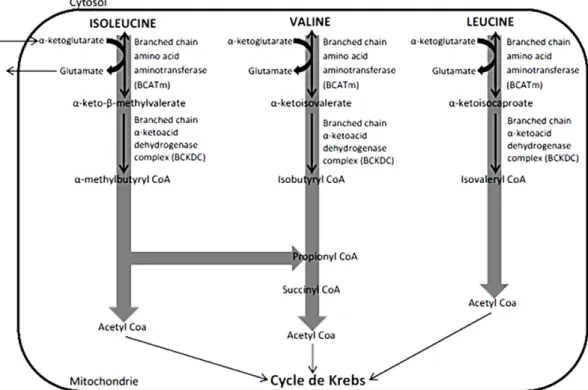
Le catabolisme des AACR s’effectue différemment de celui des autres types d’acides aminés ayant plutôt une ressemblance avec la β-oxydation des acides gras (Figure 2). Plusieurs tissus et
19 organes tels que le foie et les muscles sont connus pour leur participation à l’oxydation des AACR. Depuis quelques années, il devient de plus en plus apparent que le tissu adipeux aurait également cette capacité (103-105, 107, 108). Les réactions du catabolisme des AACR sont effectuées par des enzymes spécifiques en trois étapes principales. D’abord les AACR sont transaminés en acides cétoniques alpha par la branched-chain amino acid aminotransferase (BCATm) dans la mitochondrie. Cette première réaction se produit principalement dans les tissus périphériques, nécessite la présence d’α-cétoglutarate et entraine la formation de glutamate. Les AACR ne sont que faiblement métabolisés au foie lors de leur premier passage dans cet organe puisqu’il exprime très peu l’enzyme BCATm (109). Ensuite, ces acides sont acétylés en leurs esters d’acyl CoA respectifs sous l’action d’un complexe d’enzymes appelé le branched-chain α-keotacid
dehydrogenase complex. Ce complexe contient un polypeptide E1 alpha et beta (BCKDE1α et β)
ainsi que deux autres enzymes, la dyhydrolipoamide branched-chain transacylase E2 et la
dihydrolipoamide dehydrogenase. Cette réaction est finement régulée grâce à la présence de la branched-chain ketoacid dehydrogenase kinase (BCKDK) qui inactive le complexe BCKD
lorsqu’elle le phosphoryle. Contrairement à la première étape du catabolisme, la deuxième partie de la réaction est effectuée dans le foie. Les esters d’acyl CoA résultants sont transformés en acétyl CoA par plusieurs autres enzymes pour finalement permettre l’entrée de leur métabolites dans le cycle de Krebs (110).
20
Figure 3: Catabolisme des acides aminés à chaîne ramifiée Adapté de Salway, 2004
4.3. Dysfonction du catabolisme des acides aminés à chaîne ramifiée dans
le tissu adipeux
Tel que mentionné à la section 4.1, des études suggèrent que l’augmentation des concentrations sanguines d’acides aminés dans l’obésité seraient secondaires à une altération des enzymes responsables de leur catabolisme dans les tissus adipeux, particulièrement dans le dépôt omental. Cette hypothèse est émergente et a peu été étudiée chez l’humain. D’abord, il a récemment été démontré que le tissu adipeux possède la capacité non-négligeable de métaboliser les acides aminés. En premier lieu, les recherches se sont intéressées au catabolisme des protéines en période post-prandiale chez les individus obèses en comparaison avec les individus minces. Les résultats des études étaient divergents, certains travaux démontraient que le catabolisme des protéines était augmenté chez les obèses alors que d’autres n’observaient pas de différence (pour revue (108)). Par la suite, puisque les protéines sont constituées d’acides aminés et que ce sont ces molécules qui se retrouvent en circulation après la digestion et l’absorption des nutriments, des techniques plus précises permettant de mesurer les flux d’acides aminés à travers des tissus ont été utilisées (111, 112). Grâce à ces méthodes, il était également possible d’observer le
21 métabolisme des acides aminés au niveau d’un organe ou d’un tissu spécifique. Au niveau du tissu adipeux, les études d’Herman et collaborateurs et de Zimmerman et collaborateurs ont démontré de façon simple à l’aide de transplantations de tissu adipeux chez la souris que celui-ci réalisait effectivement le catabolisme des acides aminés (104, 107). Dans la première étude, un groupe de souris dont le gène codant pour l’enzyme BCATm avait été désactivé et un groupe de souris contrôles ont été utilisés. Les premiers animaux avaient alors des taux très élevés d’AACR sanguins et ont subi une transplantation de tissu adipeux alors que les contrôles ont subi une fausse opération. Suite à la transplantation, les souris BCATm -/- avaient des taux d’AACR plasmatiques inférieurs aux souris contrôles (104). Cette démonstration a permis de confirmer le rôle majeur du tissu adipeux au niveau du métabolisme périphérique des acides aminés.
Considérant que le tissu adipeux a une grande capacité de cataboliser les acides aminés, il serait logique de penser que les individus obèses effectueraient un catabolisme accru de ces composés puisqu’ils ont une masse adipeuse supérieure. Cependant, nos résultats et ceux de d’autres groupes suggèrent plutôt l’inverse, c’est-à-dire que les personnes obèses ont des niveaux d’acides aminés plus élevés dans le sang. Aussi, l’étude de Lackey et collaborateurs a démontré que l’expression des gènes du catabolisme des AACR était abaissée dans le tissu adipeux omental des femmes obèses avec syndrome métabolique comparativement aux femmes obèses sans complications associées (103). Tel que démontré dans les pages qui suivent, nos résultats ont permis de démontrer pour la première fois que l’expression et l’abondance protéique des enzymes du catabolisme des AACR étaient diminuées dans le tissu adipeux omental de femmes obèses comparativement à des femmes de poids normal et en surpoids et ce indépendamment de l’aire de tissu adipeux viscéral et des altérations métaboliques. Nos travaux démontrent que la diminution de l’expression et de l’activité des enzymes est associée à l’augmentation de la masse grasse plutôt que d’être spécifique à l’aire de tissu adipeux d’un dépôt seulement.
23
Objectifs et hypothèses
L’obésité viscérale est associée à de nombreuses complications métaboliques chez l’humain. Une technique d’analyse relativement récente, la métabolomique, permet l’étude des molécules de faibles poids moléculaires produites par les différents métabolismes du corps, tels que les métabolismes des glucides, des lipides ou des protéines. Certaines études ont démontré une altération des profils d’acides aminés sanguins, particulièrement une augmentation des niveaux d’acides aminés à chaîne ramifiée (AACR) en présence d’obésité. Jusqu’à maintenant, seulement quelques études se sont intéressées aux profils d’acides aminés plasmatiques dans un contexte d’obésité viscérale et de facteurs de risque cardiométabolique. L’objectif général de ce projet était d’étudier le lien entre l’obésité viscérale et les profils d’acides aminés sanguins mesurés par métabolomique. Dans un premier temps, notre objectif était d’identifier des profils métabolomiques d’acides aminés associés à l’obésité viscérale et aux facteurs de risque du syndrome métabolique. Nous avons émis l’hypothèse que certains métabolites altérés en présence d’obésité seraient également étroitement associés à l’obésité viscérale et à certains facteurs de risque cardiométabolique. D’autre part, quelques groupes ont cherché à caractériser l’expression et l’activité des enzymes du catabolisme des AACR en présence d’obésité et ont montré que leur expression pouvait être diminuée chez les individus obèses comparativement aux personnes minces. Notre deuxième objectif était donc de caractériser l’expression et l’abondance protéique de ces enzymes chez les individus présentant une obésité viscérale. Notre hypothèse était que l’expression et l’abondance protéique de certaines enzymes du catabolisme des AACR seraient altérées dans le tissu adipeux omental de patientes obèses comparativement aux femmes minces.
25
Chapitre 1 : Profil métabolomique d’acides aminés sanguins
dans le contexte de l’obésité et du risque cardiométabolique
chez l’humain
Marie Michèle Boulet, Geneviève Chevrier, Mélissa Pelletier, Julia Scarpa, Cornelia Prehn, André Marette, Jerzy Adamski, André Tchernof
L’article composant ce chapitre s’intitule :
Branched-chain amino acid-related signature of visceral obesity and
cardiometabolic risk factors
26
Résumé
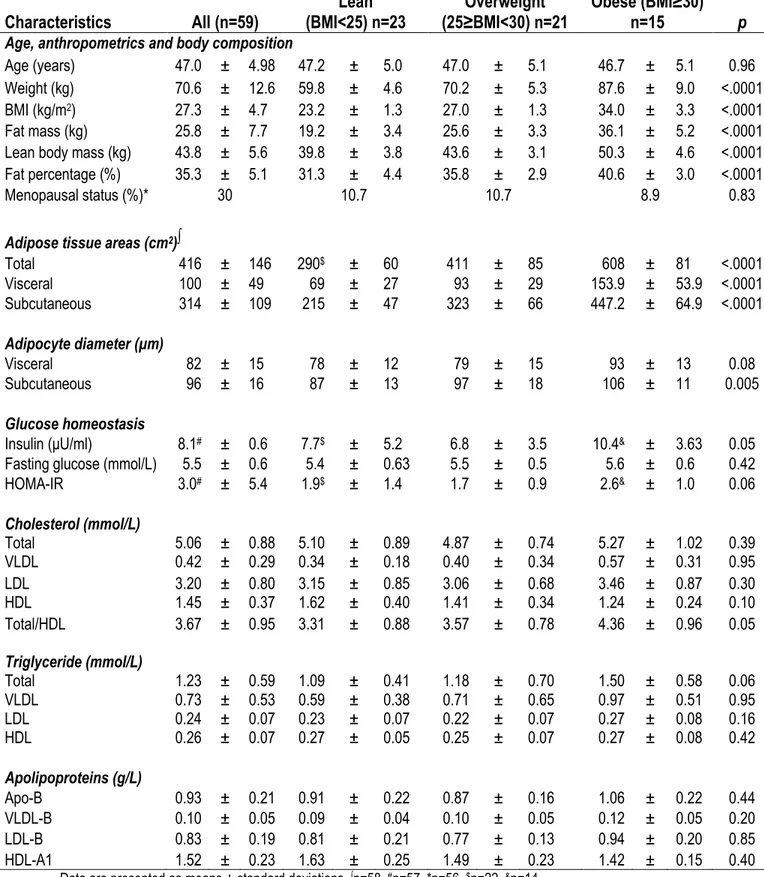
Les profils métabolomiques des individus obèses présentent des concentrations sanguines plus élevées d’acides aminés à chaîne ramifiée et aromatiques (AACR et AAA) possiblement en lien avec une altération de leur catabolisme dans le tissu adipeux. Objectif. Nous avons testé l’hypothèse que certains marqueurs des profils métabolomiques d’AA sanguins associés à l’obésité allaient également être identifiés en contexte d’obésité viscérale et de facteurs de risque cardiométabolique. Nous avons également postulé que les altérations au niveau des enzymes du catabolisme des AACR allaient être observées dans le tissu adipeux omental des individus obèses. Méthodes. 59 femmes minces à obèses (IMC 20-41 kg/m2) caractérisées pour leur
adiposité totale et régionale devant subir une chirurgie gynécologique ont été recrutées. Des échantillons de sang (n=59) et de tissu adipeux sous-cutané et omental (n=20) ont été obtenus. Les analyses métabolomiques ont été effectuées à l’aide de la trousse AbsoluteIDQTM p180.
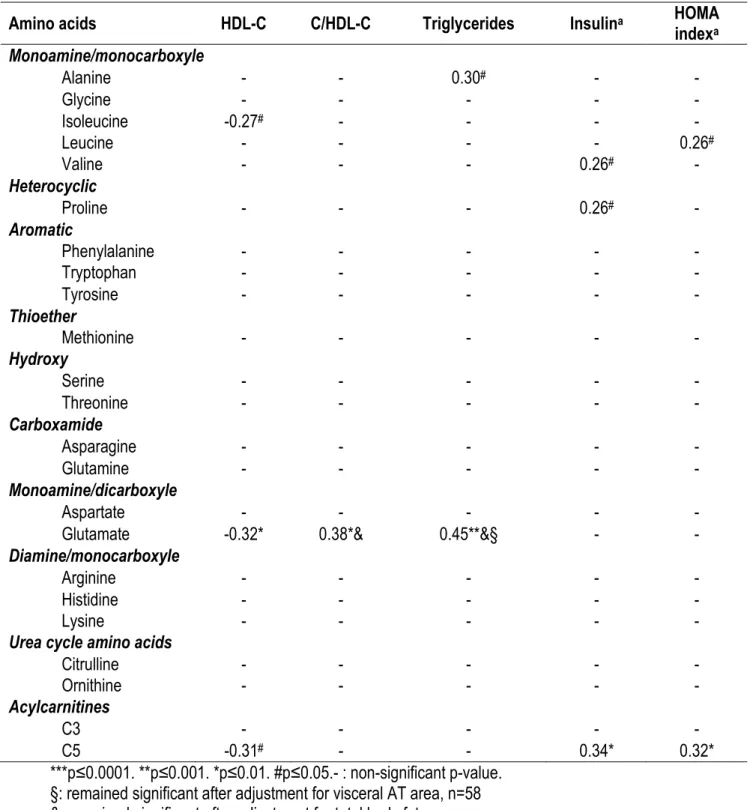
Résultats. Les femmes obèses présentaient des concentrations sanguines plus élevées d’AACR, de glutamate et de tyrosine (p<0.05 pour tous). Le glutamate sanguin s’est avéré le meilleur prédicteur indépendant de l’aire de tissu adipeux viscéral (21.3% de la variance expliquée, p<0.0005). L’analyse de composantes principales a montré que les niveaux circulants d’AACR et d’AAA étaient corrélés positivement avec les variables d’adiposité totale et sous-cutanée de même que des marqueurs d’homéostasie du glucose. Les taux sanguins de glutamate et d’acylcarnitine C3 étaient plutôt associés à l’aire de tissu adipeux viscéral et aux taux de triglycérides sanguins. Chez les femmes obèses, l’expression et l’abondance protéique des enzymes du catabolisme des AACR étaient abaissées. Conclusion. Parmi les AA altérés en contexte d’obésité, le glutamate sanguin était le meilleur prédicteur d’obésité viscérale tandis que les AACR étaient associés à l’adiposité totale et sous-cutanée. Des niveaux sanguins élevés de tous ces métabolites étaient corrélés avec des facteurs de risque cardiométabolique. Les altérations d’expression et d’abondance protéique des enzymes du catabolisme des AACR étaient principalement spécifiques au dépôt viscéral.
27
Branched-chain amino acid-related signature of
visceral obesity and cardiometabolic risk factors
Marie Michèle Boulet 1,2,3, Geneviève Chevrier 3, Mélissa Pelletier 2, Julia Scarpa 4, Cornelia Prehn 4, André Marette 3, Jerzy Adamski 4,5,6, André Tchernof 1,2,31 Endocrinology and Nephrology, CHU de Quebec Medical Center, 2 Department of Food Science
and Nutrition, Laval University, 3 Quebec Heart and Lung Institute, Quebec City, Canada; 4
Helmholtz Zentrum München, Institute of Experimental Genetics, Genome Analysis Center, Neuherberg, 5 Lehrstuhl für Experimentelle Genetik, Technische Universität München, 85356
Freising-Weihenstephan, 6 German Center for Diabetes Research, 85764 Neuherberg, Germany
Running Title: Branched-chain amino acids and visceral obesity Word count: 3599
Address for correspondence and reprint requests: Andre Tchernof, Ph.D.
Endocrinology and Nephrology, CHU de Quebec Medical Center 2705 Laurier Blvd, R-4779, Quebec City, Que, Canada G1V 4G2 Tel: 418-654-2296
Fax: 418-654-2761
Email: andre.tchernof@crchul.ulaval.ca
Conflict-of-interest/financial disclosure statement: Andre Marette is Director of a CIHR/Pfizer Research
Chair in the pathogenesis of insulin resistance and cardiovascular diseases. Andre Tchernof is the recipient of a research grant from Johnson & Johnson.
28
ABSTRACT
Context. Metabolomic profiling of obese individuals revealed high blood levels of branched-chain and aromatic amino acids (BCAA and AAA) possibly linked to altered adipose tissue BCAA catabolism. Objective. We tested the hypothesis that some markers of the amino acid signature of obesity relate closely to visceral obesity and cardiometabolic risk factors. We also postulated that alterations in BCAA-catabolizing enzymes are predominant in visceral adipose tissue. Methods. 59 women (BMI 20-41 kg/m2) undergoing gynecologic surgery and exempt of diabetes, cancer,
Cushing syndrome or thyroid dysfunction were recruited. Women were characterized for overall and regional adiposity, for blood and adipose tissue amino acid and acylcarnitine levels with targeted metabolomics using mass spectrometry, and for cardiometabolic risk factors. Blood and adipose samples (visceral and subcutaneous) were obtained and used for gene expression and western blotting analysis. Results. Obese women had significantly higher circulating BCAA, glutamate and tyrosine levels (p<0.05 for all). Glutamate level was the strongest independent predictor of visceral adipose tissue area (21.3% variance explained, p<0.0005). Principal component analysis showed that circulating BCAA and aromatic AA levels were positively related to glucose homeostasis variables while glutamate and propionyl-L-carnitine (C3 acylcarnitine) levels were associated with visceral adipose tissue area, triglycerides and the cholesterol/HDL-cholesterol ratio. Obese women had lower expression and protein levels of BCAA-catabolizing enzymes in visceral adipose tissue. Conclusions. Among amino acids altered in obesity, glutamate concentration was the best predictor of visceral obesity. Alterations in expression and protein levels of BCAA-catabolizing enzymes were predominant in visceral adipose tissue.