HAL Id: dumas-01714632
https://dumas.ccsd.cnrs.fr/dumas-01714632
Submitted on 21 Feb 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
du syndrome néphrotique : implication d’un nouveau
canal à sodium
Michel Gennaoui
To cite this version:
Michel Gennaoui. Mécanisme de la réabsorption rénale du sodium au cours du syndrome néphrotique : implication d’un nouveau canal à sodium. Urologie et Néphrologie. 2017. �dumas-01714632�
FACULTE DE MEDECINE HYACINTHE BASTARAUD
Année 2017
N°2017ANTI0217
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN MEDECINE
Présentée et soutenue publiquement
Le 17 octobre 2017
Par Michel GENNAOUI
MECANISME DE LA REABSORPTION RENALE
DU SODIUM AU COURS DU SYNDROME
NEPHROTIQUE: IMPLICATION D’UN
NOUVEAU CANAL A SODIUM
Directeurs de thèse
Docteur Alain DOUCET et Professeur Pascal HOUILLIER
Jury
Mr le Professeur Bertrand KNEBELMANN (PU-PH), Président
Mr le Professeur Georges DESCHENES (PU-PH), Membre
Mr le Professeur Eric RONDEAU (PU-PH), Membre
A Monsieur le Docteur Alain DOUCET,
Merci d’avoir accepté de diriger mon travail et de m’avoir accordé votre confiance. La rigueur de vos analyses et la pertinence de vos réflexions m’ont ouvert l’esprit.
A Monsieur le Professeur Pascal HOUILLIER,
Merci d’avoir accepté de diriger et juger mon travail de thèse. Et pour vos précieux conseils et votre aide durant cette année. Votre acharnement dans la recherche scientifique est une leçon de vie.
A Monsieur le Professeur Bertrand KNEBELMANN,
Merci d’avoir accepté de me faire l‘honneur de présider cette thèse. Veuillez trouver ici le témoignage de ma plus profonde reconnaissance.
A Monsieur le Docteur Eric RONDEAU,
Merci d’avoir accepté d’être membre du jury et de juger ce travail. Veuillez croire en ma grande reconnaissance.
A Monsieur le Docteur Georges DESCHENES,
Merci d’avoir accepté d’être membre du jury et de juger ce travail. Veuillez croire en ma sincère reconnaissance.
Le syndrome néphrotique est défini par une protéinurie massive constamment accompagnée d’une rétention de sodium conduisant à la constitution d’œdèmes. L’utilisation de rats injectés à l’aminonucléoside de puromycine (PAN) comme modèle d’étude de la rétention de sodium a permis d’identifier ENaC comme responsable de cette réabsorption de sodium. Cependant, ce modèle présente une aldostéronémie élevée, caractéristique rare chez le patient néphrotique. Le développement d’un modèle de rat néphrotique présentant des signes cliniques plus proches de ceux des patients (aldostéronémie normale) a permis d’identifier un autre canal (ASIC2b) possiblement responsable de la réabsorption du sodium dans le tubule collecteur cortical (CCD). L’objectif de l’étude est d’évaluer l’implication ASIC2b dans la rétention de sodium ainsi que les mécanismes responsables de son induction.
La génération de la lignée de rats transgéniques KO ASIC2b est toujours en cours et son phénotypage ne pourra débuter que dans quelques semaines.
Le traitement des rats par un inhibiteur de la phosphorylation de ERK (U0126) a prouvé l’implication de cette MAP kinase dans l’expression d’ASIC2b. L’utilisation de rats analbuminémiques (rats NAR) a permis de démontrer le rôle premier de l’endocytose de l’albumine comme facteur déclencheur de l’activation de ERK et de l’expression d’ASIC2b dans le CCD.
Dans un second temps, l’analyse des excrétions rénales de sodium des différents groupes de rats a montré que la rétention de sodium se maintient dans tous les groupes malgré la nette diminution du flux de réabsorption dans le CCD, mesuré par microperfusion in vitro, secondaire à l’absence d’ENaC et d’ASIC2b. L’implication du tubule contourné distal dans la persistance de la rétention a été exclue du fait de l’absence d’expression protéique de NCC chez les rats néphrotiques.
Syndrome néphrotique Rétention de sodium ASIC2b Phosphorylation de ERK Albuminurie Microperfusion
ADN : Acide désoxyribonucléique ADNc : ADN complémentaire ARN : Acide ribonucléique ARNm : ARN messager
CCD : Cortical Collecting Duct : tubule collecteur cortical DFG : Débit de filtration glomérulaire
ENaC : Epithelial sodium channel HCTZ : Hydrochlorothiazide KO : Knock out
NAR : Nagase analbuminemic rats NCC : Sodium-chlore cotransporteur Pb : Paire de bases
PAN : Aminonucléoside de puromycine PCR : Polymerase chain reaction
qPCR : Quantification real-time PCR RT-PCR : Reverse transcriptase PCR SEM : Standard error of the mean
U0126 : inhibiteur de la phosphorylation de ERK WT : Wild type
I. INTRODUCTION ... 1 A. Le syndrome néphrotique ... 1 1. Définition, signes et symptômes ... 1 2. Etiologie ... 1 3. Epidémiologie ... 2 4. Mécanisme de la protéinurie ... 2 5. Voies de réabsorption du sodium par le tubule. ... 4 6. Intérêt général et scientifique du projet ... 6 B. Le rat PAN, modèle d’étude de la physiopathologie du syndrome oedémato-ascitique ... 7 C. Limites du modèle PAN ... 9 D. Objectifs du travail ... 11 1. Evaluation du rôle d’ASIC2b dans la rétention de sodium. ... 11 2. Implication de la voie de signalisation Phospho-ERK dans l’induction ASIC2b. ... 11 3. Implication de l’albuminurie dans l’induction d’ASIC2b. ... 11 II. RESULTATS ... 12 A. Génotypage des rats KO ASIC 2b ... 12 B. Implication de la voie de signalisation phospho-ERK dans l’induction d’ASIC2b. ... 14 C. Implication de l’albuminurie dans l’induction d’ASIC2b. ... 18 D. Exploration d’autres voies et sites de rétention du sodium. ... 22 III. DISCUSSION ... 26 IV. MATERIELS ET METHODES ... 28 1. Animaux ... 28 2. Etudes métaboliques ... 28 3. Procédures chirurgicales ... 28 4. Microdissection avec collagénase ... 30 5. PCR quantitative en temps réel (qPCR) ... 30 6. Immunohistologie ... 30 7. Western blot ... 31 8. Microperfusion in vitro ... 32 9. Statistiques ... 33 V. BIBLIOGRAPHIE: ... 34
I.
INTRODUCTION
A.
Le syndrome néphrotique
1.
Définition, signes et symptômes
Le syndrome néphrotique est une maladie rénale définie par la présence d’une excrétion urinaire massive de protéines plasmatiques responsable d’une hypoprotidémie. La majeure partie de la protéinurie est composée d’albumine.
Le diagnostic, strictement biologique, se fait par la mesure de la protéinurie supérieure à 3g/24h (50mg/kg/24h chez l’enfant) sur recueil des urines durant 24h ou par mesure du rapport protéinurie/créatininurie sur échantillon d’urine supérieur à 0,3 g/mmol (ou > 3 g/g). De plus, l’albuminémie doit être inferieure à 30 g/l et la protidémie inférieure à 50 g/l pour poser le diagnostic.
En plus de la protéinurie et de l’hypoalbuminémie, le syndrome néphrotique est constamment accompagné d’œdèmes généralisés résultant d’une accumulation de fluide dans le secteur interstitiel. La prise de poids peut atteindre 30% du poids corporel. Les œdèmes peuvent se manifester par un gonflement des paupières dans la forme la plus modérée jusqu’à l’anasarque dans la forme la plus sévère résultant d’une accumulation de liquide dans les membres inférieurs, les lombes et les cavités virtuelles (plèvre, péritoine et péricarde). Ces œdèmes peuvent entraîner la mort par asphyxie en cas d’œdème aigu du poumon.
Le syndrome néphrotique se manifeste par des épisodes de crises, suivis de périodes plus ou moins longues de rémission.
2.
Etiologie
Les étiologies du syndrome néphrotique se divisent en deux parties : primitives et secondaires. Les étiologies primitives touchent exclusivement le rein. Les étiologies secondaires sont des maladies systémiques avec une atteinte rénale. Elles sont dominées par le diabète, le lupus érythémateux disséminé, certains médicaments, des maladies infectieuses (VIH, VHB, Syphilis)… Seules les étiologies primitives seront abordées.
Trois formes histologiques de néphropathies glomérulaires primitives peuvent être responsables d’un syndrome néphrotique :
- Le syndrome néphrotique à lésions glomérulaires minimes (LGM) - La hyalinose segmentaire et focale (HSF)
- La glomérulopathie extra membraneuse (GEM)
L’étiologie de ces maladies primitives reste confuse, on parle de maladies idiopathiques, même si le rôle de la réponse immunitaire et de son interaction avec le milieu environnant sont des facteurs importants. Le traitement de première ligne du syndrome néphrotique primitif et idiopathique reste souvent la corticothérapie, mais celle-ci présente de nombreux effets indésirables, surtout chez l’enfant.
3.
Epidémiologie
Le syndrome néphrotique peut toucher tous les âges avec une incidence différente chez l’adulte et l’enfant. Chez l’enfant, le syndrome néphrotique est primitif et idiopathique dans 90% des cas, au moins entre les âges de 2 et 10 ans avec une incidence annuelle entre 1,7 et 3,4 pour 100 000 enfants/an (1). Chez l’adulte, le syndrome néphrotique est primitif et idiopathique dans 40% des cas. L’incidence est toute de même entre 3 et 7 cas/100 000 d’habitants/an (2). La maladie est plus fréquente chez l’homme que chez la femme avec un sexe ratio de 2/1 en moyenne.
4.
Mécanisme de la protéinurie
La barrière de filtration glomérulaire a comme fonction essentielle d’assurer à la fois une haute perméabilité à l’eau et aux solutés de faible PM ainsi qu’une restriction sélective au passage des molécules de PM plus important (au-delà de 60 kDa) et aux éléments figurés du sang (3). Sur le plan fonctionnel et anatomique, la barrière de filtration glomérulaire entre la lumière capillaire et l’urine primitive dans la capsule de Bowman est définie par trois couches successives :
- La première est formée par l’endothélium capillaire glomérulaire, largement fenêtré, qui n’assure aucune restriction au passage des protéines.
- La seconde est composée par la membrane basale glomérulaire (MBG), assemblage complexe de glycoprotéines, perforée de pores d’environ 40 nanomètres de rayon. Alors que cette membrane assure environ 30% de la restriction au passage de taille, sa composition chimique, riche en glycoprotéines anioniques, garantit une partie importante de la restriction au passage des molécules chargées négativement, en particulier des protéines.
- La troisième couche est formée par des cellules épithéliales (podocytes) qui recouvrent le versant externe de la membrane basale glomérulaire. Ces cellules
hautement différenciées ont des prolongements ou pédicelles, eux-mêmes à l’origine d’interdigitations extrêmement fines, entrecroisées entre elles et recouvrant entièrement la MBG. L’architecture de ces interdigitations est hautement organisée grâce à des protéines membranaires (Nephrin, NEPH1, Podocin, CD2AP) qui permettent la constitution de pores rectangulaires d’environ 60 sur 40 nanomètres constituant les diaphragmes de fente. Les pédicelles sont aussi ancrés à la membrane basale glomérulaire par de multiples systèmes d’adhésion (Integrin, Dystroglycan). Toutes ces protéines d’adhésion cellules-cellules ou cellules-membrane basale glomérulaire sont elles mêmes arrimées au cytosquelette d’actine du podocyte. Cette couche épithéliale assurerait l’essentiel de la restriction au passage des macromolécules, empêchant notamment le passage des protéines de PM supérieur à 60 kDa. Les pédicelles sont également recouverts de glycoprotéines polyanioniques qui assurent une restriction au passage des charges négatives. De nombreuses mutations touchant les protéines composant le diaphragme de fente sont associées à une protéinurie (4).
Ainsi les protéines traversent la barrière de filtration glomérulaire de manière inversement proportionnelle à leur taille et à leur charge négative. Les protéines avec un PM de moins de 20 kDa passent facilement la barrière de filtration glomérulaire. A l’inverse, l’albumine avec un PM de 65 kDa et chargée négativement ne passe pas cette barrière dans des conditions normales.
La composition de l’urine définitive dépend de plusieurs mécanismes :
- La filtration glomérulaire, conditionnée par les protéines elles-mêmes (poids moléculaire, le seuil de filtration étant d’environ 60 kDa, taille et charge électrique de la protéine), les conditions hémodynamiques rénales (pression de filtration) et l’intégrité des structures glomérulaires ;
- La réabsorption tubulaire qui, pour une protéine, est conditionnée par son Tm ou capacité maximale de réabsorption. Une fois celle-ci atteinte, l’excrétion urinaire augmente parallèlement à la quantité filtrée. Les plus petites protéines (Béta-2
microglobuline, lysosyme, RBP, chaines légères libres, α 1-microglobuline) sont
largement réabsorbées au niveau du tubule proximal, et seule une petite quantité est excrétée.
- La sécrétion par les cellules tubulaires de protéines (glycoprotéine de
Au cours du syndrome néphrotique, la barrière de filtration glomérulaire est altérée et laisse passer dans l’urine des quantités importantes de macromolécules dont notamment des protéines comme l’albumine et les immunoglobulines. Celle-ci provoque d’importantes pertes responsables de l’hypoalbuminémie et de l’hypoprotidémie une fois les capacités de production et de compensation du foie dépassées.
5.
Voies de réabsorption du sodium par le tubule.
Dans l’organisme, le sodium est le cation le plus abondant du secteur extracellulaire. La quantité totale de sodium dans l’organisme détermine directement le volume extracellulaire et la pression de perfusion tissulaire. Comme démontré par Guyton (5), le rein a un rôle majeur dans le contrôle de la pression artérielle via l’homéostasie du sodium.
Chez l’Homme, chaque jour, plus de 180 litres d’urines primitives contenant 25 moles de sodium sont filtrées par les glomérules. 99% du sodium filtré est réabsorbé lors de son écoulement à travers la lumière tubulaire. Cette réabsorption du sodium à travers l’épithélium est possible grâce à deux mécanismes, la sortie active du sodium au pôle basolatéral vers le sang via la pompe ATPase et son entrée passive par le pôle apical. La pompe Na,K-ATPase maintient une concentration intracellulaire de sodium environ 10 fois inférieure à sa concentration extracellulaire. L’activité de la Na,K-ATPase génère donc un gradient électrochimique favorable à l’entrée du sodium, et ce dans toutes les cellules de l’organisme. A ce titre, les différents segments du néphron se caractérisent par leurs mécanismes d’entrée apicale du sodium.
Le tube contourné proximal réabsorbe 70% du sodium filtré. Dans ces cellules 90% de l’entrée du sodium est couplée à la sortie de protons grâce à l’échangeur NHE3 apical électroneutre, le reste étant assuré par des cotransporteurs (Na/glucose, Na/Phosphate, etc).
L’anse ascendante de Henle rend compte de la réabsorption d’environ 20 % du NaCl filtré. Dans ces cellules, le NaCl luminal entre par un cotransporteur Na-K-2Cl électroneutre (NKCC2), cible moléculaire des diurétiques de l’anse comme le furosémide. Au pôle basolatéral, le chlore est extrudé via des canaux chlorures (CLC-KB). Le potassium est recyclé dans la lumière tubulaire par des canaux potassiques apicaux (ROMK). Le recyclage apical du potassium est nécessaire pour le fonctionnement de NKCC2 car la concentration de potassium dans la lumière tubulaire est très inférieure à celle du sodium. Par ailleurs, le recyclage du potassium luminal génère un potentiel transépithélial positif du coté luminal qui favorise la réabsorption paracellulaire des cations (sodium, calcium et magnésium)(6). Ce
segment est imperméable à l’eau est constitue le segment de dilution de l’urine.
Le tube contourné distal réabsorbe environ 5 à 7 % du NaCl filtré par l’intermédiaire d’un cotransporteur NaCl électroneutre apical (NCC), cible moléculaire des diurétiques thiazidiques. Au pôle basolatéral, le chlore est extrudé par des canaux chlorures. Ce segment forme un épithélium à haute résistance électrique qui fait barrière au passage des solutés par voie paracellulaire (6).
Le tubule connecteur et le canal collecteur cortical sont les derniers segments permettant le contrôle de l’homéostasie du sodium. C’est dans ces segments que la régulation est la plus fine et sous contrôle hormonal. La réabsorption va de 0 à 5 % du sodium filtré. A la différence des autres segments, deux types cellulaires composent le canal collecteur: les cellules principales et les cellules intercalaires. Les cellules principales permettent la réabsorption de sodium via un canal sodique épithélial apical (ENaC), cible moléculaire de l’amiloride. La réabsorption active de sodium génère un gradient électrique transépithélial avec une lumière négative, ce qui favorise la sécrétion transcellulaire de potassium par des canaux potassiques apicaux de type ROMK. L’adressage de ENaC à la membrane apicale et l’activité de la Na,K-ATPase basolatérale sont sous le contrôle de l’aldostérone.
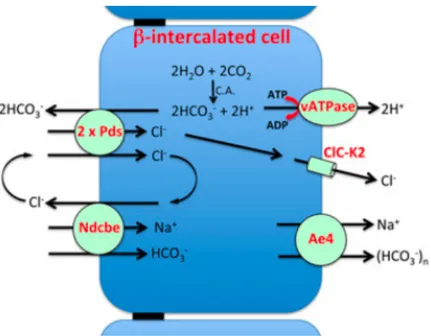
Le NaCl est également réabsorbé par les cellules intercalaires de type β (dans le modèle murin du moins) par l’intermédiaire d’un échangeur Cl/bicarbonate-Na (NDBCE), sensible aux diurétiques thiazidiques (7) et qui fonctionne en coopération avec un échangeur Cl/bicarbonate apical nommé pendrine. Le couplage des deux échangeurs permet au final l’entrée conjointe d’un ion sodium et d’un ion chlore de manière électroneutre. Cette réabsorption dépend de l’activité d’une H-ATPase basolatérale (8) qui permet la sortie des protons au pôle basolatéral vers le compartiment sanguin, créant un gradient électrique propice à la sortie de bicarbonate qui s'effectue de manière conjointe au sodium via le cotransporteur Na/HCO3- (AE4). Le chlore initialement réabsorbé avec le sodium, est ensuite transporté par des canaux chlorures (CLC-KB) au pôle basolatéral (9). Les cellules intercalaires de type β ont la particularité d’avoir un potentiel de membrane généré par la pompe H-ATPase. (Figure 1)
Figure 1 : Schéma de la réabsorption électroneutre de NaCl dans les cellules intercalaires de type β du tubule collecteur.
6.
Intérêt général et scientifique du projet
Quel que soit l’étiologie, le syndrome néphrotique est toujours associé à une rétention de sodium aboutissant à une augmentation du secteur extracellulaire et à la formation d’oedèmes et d’ascite. Ce syndrome oedémato-ascitique est très handicapant et amène les patients à consulter. La pathogénie de la rétention de sodium et la constitution d’œdèmes au cours du syndrome néphrotique n’est pas entièrement élucidée. Ces dernières années, plusieurs observations conduisent à l’émergence d’un nouveau paradigme. La théorie la plus communément acceptée explique la rétention de sodium comme une conséquence de l’hypovolémie induite par la fuite capillaire de plasma du secteur vasculaire vers l’interstitium ; cette fuite serait secondaire à la diminution de la pression oncotique due à la perte rénale massive de protéines. L’hypovolémie conduit, in fine, à la stimulation du système rénine-angiotensine-aldostérone (SRAA) et à la rétention de sel via le tubule collecteur. Si cette théorie à l’avantage d’être parfaitement logique et compréhensible par le plus grand nombre, elle souffre néanmoins de lacunes majeures ; en effet la majorité des patients souffrant d’un syndrome néphrotique ne présentent pas les principaux symptômes permettant de la soutenir :
- Le gradient de pression oncotique entre le compartiment vasculaire et l’interstitium est similaire chez les patients néphrotiques comparé à une population non néphrotique.
- Pendant les périodes de rémission, les œdèmes se résorbent avant un retour à la normale de l’albuminémie (10) et la perfusion d’albumine ne permet pas de rétablir une natriurèse normale, même transitoirement (11).
- Ni les patients néphrotiques ni les modèles animaux mimant le syndrome néphrotique ne sont hypovolémiques (12,13).
- La plupart des patients néphrotiques sont normo-aldostéronémiques. Le traitement avec des inhibiteurs du récepteur aux minéralocorticoïdes ne permet pas de retrouver une natriurèse normale. Ainsi, l’aldostérone n’est pas un élément déterminant de la réabsorption hydro-sodée lors du syndrome néphrotique.
Il est aujourd’hui admis que la rétention rénale de sodium est un évènement primaire indépendant de la fuite capillaire et de l’activation du SRAA (14).
Ceci conduit à la nécessité d’étudier plus en détail les mécanismes d’induction de la rétention sodée rénale et d’identifier les différents mécanismes impliqués dans ce processus afin de pouvoir proposer une stratégie thérapeutique adéquate.
B.
Le rat PAN, modèle d’étude de la physiopathologie du
syndrome oedémato-ascitique
La rétention de sodium au cours du syndrome néphrotique a principalement été étudié en utilisant un modèle de rats (souche Spray Dawley) traités à l’aminonucléoside de puromycine (rat-PAN) (15) qui mime et reproduit la plupart des signes et symptômes observés au cours de la maladie (protéinurie massive, hypoalbuminémie, rétention rénale de sel et d’eau, constitution d’œdèmes et d’ascite). Les lésions histologiques observées suite à l’injection intraveineuse d’aminonucléoside de puromycine (PAN) sont la rétraction des pédicelles des podocytes (semblable à la lésion glomérulaire minime) et l’endocytose de l’albumine dans le tubule contourné proximal.
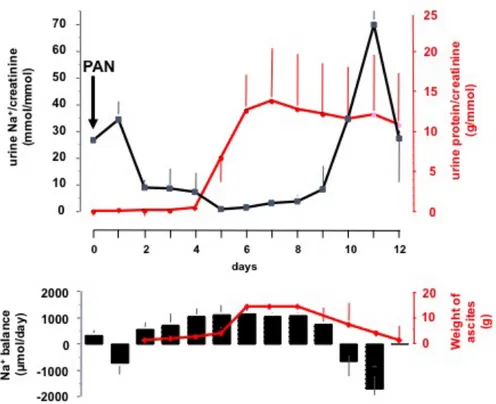
Suite à l’injection intraveineuse de PAN à J0, on constate l’apparition d’une protéinurie à partir de J4, qui augmente progressivement jusqu’à J6 pour devenir massive. Elle se prolonge durant 15 jours à 3 semaines. L’excrétion rénale de sodium (mesurée par le rapport natriurèse/créatininurie en mmol/mmol) évolue différemment avec à J1 une petite excrétion transitoire suivi dès J2 d’une rétention qui s’installe en plateau jusqu’à J4. A J5, on constate une nouvelle diminution de l’excrétion de sodium qui devient quasi nulle (proche de 0). Cette rétention se prolonge au neuvième jour. La balance sodée, mesurée par le bilan des
entrées et des sorties, est inversement proportionnelle à l’excrétion du sodium. Il y a une perte de sel transitoire à J1 puis une rétention de sel à partir de J2 qui se prolonge jusqu’à J9. L’ascite suit la rétention en sodium avec un léger retard. Elle apparaît à J2 pour atteindre un pic à J6, puis diminue à partir de J9 et disparaît à J12 (Figure 2).
Figure 2 : Excrétion rénale du sodium et des protéines, bilan sodé et ascite durant les 12 jours qui suivent l’induction du syndrome néphrotique par injection intraveineuse de PAN chez des rats males Sprague Dawley « clampés ».
Mesure de la créatinine, du sodium et des protéines sur les urines collectées durant 24h. Les résultats à J0 correspondent au recueil des 24h précédent l’injection de PAN. L’ascite est mesurée aux différents jours après l’injection du PAN. Valeurs moyennes +/- SEM de 3 à 8 rats.
Dans le modèle de rat-PAN, la rétention de sel a lieu au niveau du néphron distal sensible à l’aldostérone, plus particulièrement, dans les cellules principales du tubule collecteur cortical, suite à l’activation de la Na,K-ATPase basolatérale et du canal à sodium apical ENaC, tous deux cibles de l’aldostérone (16–18).
Dans ce modèle, une perméabilisation endothéliale périphérique fut également décrite, mesurée par une augmentation marquée de la perméabilité à l’eau et à une diminution du coefficient de réflexion des protéines dans le péritoine. Ces modifications, déclenchées par le
stress oxydatif (voie des ROS), sont responsables d’environ deux tiers du volume d’ascite chez le rat-PAN (19).
C.
Limites du modèle PAN
Cependant, à l’inverse des rats PAN, la grande majorité des patients atteints de syndrome néphrotique ne présente pas une aldostéronémie élevée (20). Ainsi, chez la plupart des patients (70-75%), l’aldostérone ne peut expliquer l’activation de la rétention rénale de sel. Afin de mimer au plus près le syndrome néphrotique du patient, l’équipe de recherche des Cordeliers a fait évoluer le modèle de rat-PAN en maintenant la concentration d’aldostérone fixe par surrénalectomie bilatérale et installation de mini pompes osmotiques sous cutanées délivrant de l’aldostérone et de la déxaméthasone à doses physiologiques. Le clamp surrénalien permet de maintenir une aldostéronémie normale comme dans la pathologie humaine.
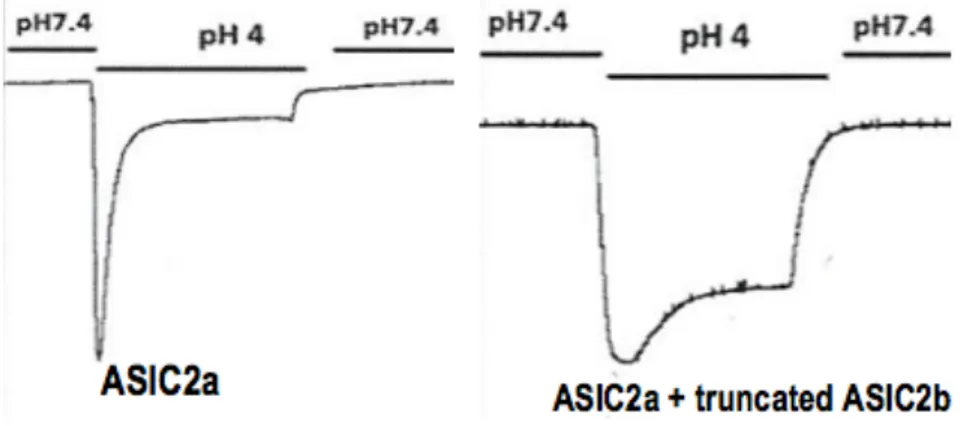
Dans ce modèle (rat-PAN « clampé »), les rats continuent à retenir du sodium et à développer de l’ascite (21, 22). Cependant, le mécanisme de rétention de sodium est différent de celui observé chez le rat-PAN classique puisqu’il ne fait plus intervenir l’activation d’ENaC (18). De plus, l’équipe de recherche a montré par micro perfusion que cette rétention de sel est toujours localisée dans le tubule collecteur cortical (CCD) et qu’elle est entièrement réversible sous amiloride. Cette sensibilité à l’amiloride a poussé l’équipe du Dr Alain Doucet à explorer l’expression d’autres canaux connus pour être sensibles à l’amiloride. Ces travaux ont montré une sur expression de l’ARNm d’un canal à sodium de type ASIC2 dans le tubule collecteur cortical avec une cinétique corrélée à la rétention de sodium (sur expression à J6 et retour au niveau basal à J12) (données non publiées). Les canaux ASIC (Acid-Sensitive Ion Channel) font partie de la même famille de protéines que les canaux ENaC (famille des dégénérines (23)). Présents principalement dans les cellules excitables, ils sont activés par la baisse du pH extracellulaire et induisent une conduction massive et transitoire permettant l’induction de potentiels d’action, en particulier dans le contexte de la nociception. Ces canaux sont des oligomères composés de sous-unités conductrices et de sous-unités régulatrices. A priori, ils ne possèdent pas les caractéristiques nécessaires permettant de soutenir un transport transépithélial de sodium puisqu’ils s’ouvrent et se ferment très rapidement. Cependant, la sous-unité dont l’expression est stimulée dans le CCD des rats PAN « clampés » est une version tronquée d’ASIC2b, une sous-unité régulatrice sans
fonction de conduction. Cette sous-unité s’associe à une sous-unité conductrice (ASIC 2a) et en modifie certaines propriétés. Ainsi, en associant à ASIC2a la sous unité ASIC2b tronquée, on permet la transformation d’un canal à ouverture transitoire en un canal à ouverture continue, plus apte à soutenir une fonction de transport transcellulaire de sodium (Figure 3). Ces données ont été obtenues par expression hétérologue dans des ovocytes de Xénope.
Figure 3 : Courant sodique sensible au pH mesuré dans des ovocytes exprimant ASIC2a seul ou ASIC2a et la version tronquée d’ASIC2b.
Les canaux ASIC2 ne sont pas exprimés chez les rats PAN classiques qui expriment uniquement ENaC. Nous formulons donc l’hypothèse qu’en absence d’hyperaldostéronémie, la rétention rénale de sodium n’est pas médiée par ENaC mais par un canal ASIC2 formé par ASIC2a et une sous unité ASIC2b tronquée.
Il est à noter que l’expression d’ASIC2 est présente dans les biopsies rénales de 5 patients sur 8 présentant un syndrome néphrotique idiopathique alors qu’elle est nulle dans 26 patients non-néphrotiques sur 26 (Figure 4).
Figure 4 : Expression d’ASIC2 dans des biopsies rénales de patients néphrotiques (INS) et de patients atteints d’autres pathologies rénales. BBS : syndrome de Bartet Biedl ; BN :
néphropathie diabétique ; MGN : glomérulonéphrite extra-membranaire ; IgA : néphropathie à dépôts d’IgA ; LN : néphropathie lupique ; TIN : néphropathie tubulo-interstitielle.
D.
Objectifs du travail
1.
Evaluation du rôle d’ASIC2b dans la rétention de sodium.
Pour évaluer l’implication d’ASIC2b dans la rétention de sodium induite au cours du syndrome néphrotique nous avons décidé de générer une lignée de rats invalidés pour le gène codant ASIC2b.
2.
Implication de la voie de signalisation Phospho-ERK dans l’induction
ASIC2b.
De précédents travaux indiquent que les cellules du CCD des rats PAN endocytent d’albumine et que cette endocytose induit plusieurs voies de signalisation dont celle des MAP kinases (phosphorylation de ERK) (24, 25). Cette voie est connue pour inhiber l’activation d’ENaC et stimuler la Na,K-ATPase (26). De plus, Phospho-ERK peut induire l’expression d’ASIC3 via le facteur de transcription AP1 (27, 28) et des sites de régulation pour AP1 sont également présents dans le promoteur d’ASIC2 (29). Cette voie de transduction présente donc toutes les qualités pour expliquer l’induction d’ASIC2 et de la Na,K-ATPase et l’inhibition d’ENaC observées dans le tubule collecteur de rats PAN « clampés ».
Notre objectif est de démontrer le rôle de l’activation de la voie ERK dans l’expression d’ASIC2 chez le rat PAN « clampé ».
3.
Implication de l’albuminurie dans l’induction d’ASIC2b.
Nous avons montré que la rétention de sodium et l’expression d’ASIC2 chez le rat PAN « clampé » sont indépendantes de l’aldostérone. En fait, elles sont indépendantes de tout facteur plasmatique circulant puisque dans un modèle de rat PAN unilatéral, seul le rein protéinurique retient du sodium (17). Nous formulons l’hypothèse que la rétention de sodium est induite par un facteur intra-rénal, la protéinurie, et en premier lieu l’albuminurie, anormalement présente dans la lumière du néphron distal au cours du syndrome néphrotique.
Notre objectif est d’évaluer le rôle de l’endocytose de l’albumine au niveau du tubule collecteur dans le déclenchement de la rétention de sodiumchez le rat PAN « clampé ».
II. RESULTATS
A.
Génotypage des rats KO ASIC 2b
La lignée de rats invalidés pour le gène codant ASIC2b a été réalisée via la technique CRISPR-Cas9 par la plate-forme de transgénèse Biogen/Ouest/TRIP à Nantes. Cette technique a permis d’obtenir 15 rats au total dont 5 avaient hérité de mutations potentiellement exploitables pour générer une lignée :
- Un mâle KO 2.6 hétérozygote porteur d’une mutation complexe sur un seul allèle : WT / Del 15pb+Ins 8pb.
- Une femelle KO 2.1 hétérozygote porteuse de deux mutations distinctes sur les deux allèles : Del 13pb / Del 20pb.
- Un mâle KO 2.5 hétérozygote double mutations : Del 4pb / Del 124pb. - Un mâle KO 1.16 hétérozygote simple mutation : WT / Del 20pb.
- Un mâle KO 1.14 hétérozygote double mutations : Del 20pb / Del 176pb.
Afin de valider le rôle d’ASIC2b, nous avons souhaité développer deux lignées homozygotes porteuses de mutations différentes et notre choix s’est porté sur les mutations Del 20 pb et Del 176 pb au vu des premiers résultats des croisements.
Deux couples de primers ont été créés pour permettre le génotypage des descendants porteurs de ces deux mutations :
- Couple délétion longue (DL) avec un produit de PCR de 953 paires de bases englobant toutes les mutations mais permettant de discriminer uniquement des délétions supérieures à 100 paires de bases après migration.
- Couple délétion courte (DC) avec un produit de PCR de 150 paires de bases englobant la Del 20pb des rats KO1.16 et KO 1.14 (délétion identique chez ces deux rats) et permettant de discriminer les délétions inférieure à 100 paires de bases après migration.
Le mâle KO 2.6 a été sacrifié en raison de la complexité génétique potentielle de sa descendance.
La femelle KO 2.1 a été mise en accouplement avec le male KO 1.14 dans le but d’obtenir des petits homozygotes Del 20pb sans résultat de grossesse. Elle a été sacrifiée.
Le mâle KO 2.5 a été mis en accouplement avec une femelle WT et a donné naissance à 15 petits le 07/05/17. Les primers DL ont permis de reconnaitre la mutation Del 176 pb du
père KO 2.5 mais aucun de ses descendants ne l’avaient hérité, indiquant probablement le caractère en mosaïque de la mutation du père (lors de l’embryologie, les gamètes ne semblent pas avoir hérités des mutations). Les 15 petits et le père ont été sacrifiés.
Le mâle KO 1.16 a été mis en accouplement avec une femelle WT et a donné naissance à 13 petits le 06/05/17. Le génotypage, obtenu en utilisant le primer DC, a permis d’identifier 8 petits hétérozygotes porteurs de la mutations Del 20 pb (deux mâles : 1, 3 et six femelles : 7, 8, 9, 10, 11, 13). Plusieurs croisements ont été réalisés :
o Mise en accouplement du mâle 1 avec la femelle 7 et du mâle 3 avec la femelle 8. Obtention de 30 petits. Le génotypage, obtenu en utilisant les primers DC, a permis d’identifier sept petits homozygotes Del 20 pb (cinq mâles : 32, 38, 41, 42 et 50 et deux femelles : 46 et 55).
o Mise en accouplement du mâle 1 avec la femelle 9 et du mâle 3 avec la femelle 10. Obtention de 29 petits. Le génotypage, obtenu en utilisant les
primers DC, a permis d’identifier quatre petits homozygotes Del 20 pb.
Le mâle KO 1.14 a été mis en accouplement avec deux femelles WT et a donné naissance à 18 petits nés le 07/07/17. Le génotypage, obtenu en utilisant les primers DL, a permis d’identifier 6 petits ayant hérité de la délétion 176 pb (Deux mâles : 17, 18 et quatre femelles : 22, 25, 27 et 29). Mise en accouplement des males 17 et 18 avec les femelles 22 et 25 fin aout.
Le phénotypage des descendants homozygotes Del 20 pb pourra débuter un fois l’âge adulte atteint (fin septembre).
B.
Implication de la voie de signalisation
phospho-ERK dans l’induction d’ASIC2b.
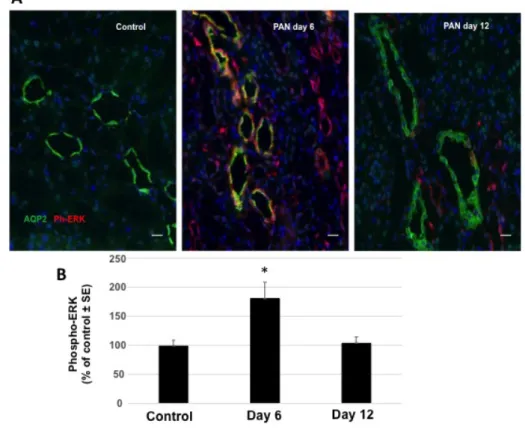
Dans un premier temps nous avons recherché si la phosphorylation de ERK corrélait temporairement avec la rétention de sodium. Effectivement, l’augmentation de la phosphorylation de ERK dans le CCD des rats « clampés » observée à J6 disparaît à J12 (Figure 5).
Figure 5 : Phosphorylation de ERK dans le tubule collecteur cortical de rats contrôles et néphrotiques à J6 et à J12. A. Immunomarquage obtenue sur coupes de rein de rats contrôles ou injectés avec du PAN à J6 et à J12 avec un anticorps anti-phospho-ERK (rouge). Les CCD sont identifiés par la présence d’un marquage avec l’anticorps anti-aquaporines 2 (vert). Les images ont été choisies dans la région corticale. Barre d’échelle : 20µm. B.
Quantification des immunomarquages. Valeurs moyennes +/- SEM de 4-6 rats par groupe. *, p < 0,005 par rapport aux contrôles.
Le rôle de la phosphorylation de ERK dans l’induction d’ASIC2b a ensuite été étudié par une approche pharmacologique chez des rats PAN « clampés » qui ont été traités avec le U0126, un inhibiteur de la phosphorylation de ERK. Le U0126 a été utilisé à la dose de 30 mg/kg/jour en injection sous-cutanée à partir de J0 (jour de l’induction du syndrome
néphrotique par injection de PAN) jusqu’au sacrifice (31). L’efficacité de ce traitement est attestée par le fait qu’il abolit l’augmentation de la phosphorylation de ERK observée chez les rats néphrotiques à J6 (Figure 6).
Figure 6 : Phosphorylation de ERK dans le CCD chez des rats contrôles et traités au U0126 après injectés de PAN.
A. Immunomarquage obtenue sur coupes de rein de rats contrôles, traités au U0126 et
néphrotiques traités au U0126 à J6 avec un anticorps anti-phospho-ERK (rouge). Les CCD sont identifiés par la présence d’un marquage avec l’anticorps anti-aquaporines 2 (vert). Les images ont été choisies dans la région corticale. Barre d’échelle : 20µm. B. Quantification des immunomarquages. Valeurs moyennes +/- SEM de six rats par groupe. *, p < 0,005 par rapport aux contrôles.
Nous avons évalué l’inhibition de la phosphorylation de ERK sur l’activation des transporteurs dans le tubule collecteur cortical. Le traitement par U0126 n’affecte pas les profils d’expression en ARNm ASIC2b chez les rats normaux mais abolit leur sur expression induite par le PAN (Figure 7A). Il en est de même pour sous unité α et β la pompe Na,K-ATPase (Figure 7B).
De plus, ENaC étant activé et rendu fonctionnel par son seul adressage à la membrane, une analyse immunohistologique sur coupe de rein a été entreprise pour vérifier sa localisation cellulaire. Chez les rats néphrotiques traités au U0126, il n’y a pas d’adressage membranaire de la sous unité β d’ENaC, contrairement à des rats soumis à un régime carencé en sodium utilisés comme contrôles positifs (Figure 7C et 7D).
Figure 7 : Effet du traitement au U0126 sur l’expression d’ASIC2b et des sous unités de la Na,K-ATPase et l’adressage membranaire d’ENaC dans le canal collecteur cortical. A et B. Expression des ARNm d’ASIC2b et des sous-unité α et β de la Na,K-ATPase dans le
CCD de rats contrôles et de rats traités au U0126 à l’état basal et après injection de PAN. Valeurs moyennes +/- SEM de 11 rats. *, p < 0,005 par rapport aux contrôles correspondants.
C et D. Immunomarquage avec un anticorps anti sous-unité β du canal ENaC (rouge) dans le
cortex rénal de rats traités au U0126. On n’observe pas de localisation membranaire d’ENaC ni à l’état normal ni en réponse au PAN (C) contrairement à ce qui est observé chez des animaux rendus hyperaldostéronémiques par carence en sodium (D, Contrôles positifs). Barre d’échelle: 20µm.
La microperfusion in vitro de CCD de rats néphrotiques traités au U0126 montre l’existence d’un flux de réabsorption de sodium mais de faible amplitude (environ 20%) en comparaison à celui mesuré chez des rats contrôles non traités (Figure 8). Il faut signaler que nous avons été dans l’impossibilité de microperfuser les tubules collecteurs corticaux des rats non néphrotiques traités au U0126 en raison de leur fragilité excessive.
Figure 8 : Flux de réabsorption du sodium à travers le CCD.
Flux de sodium mesuré par microperfusion de CCD de rats contrôles et de rats traités au U0126 à l’état basal et après injection de PAN. Le flux positif reflète une réabsorption. Valeurs de moyenne +/- SEM de 6 rats. *, p<0,005 par rapport aux contrôles correspondants.
En l’absence de sur expression d’ASIC2b et de la Na,K-ATPase et d’ENaC membranaire, on observe donc une nette diminution de la réabsorption du sodium dans le CCD des rats néphrotiques. La réabsorption résiduelle de sodium, de l’ordre de 20%, pourrait être engendrée par la voie de réabsorption électroneutre dans les cellules intercalaires (voir chapitre C).
C.
Implication
de
l’albuminurie
dans
l’induction
d’ASIC2b.
A l’état normal, il n’y a ni albumine dans la lumière du néphron distal ni endocytose de l’albumine par les cellules du tubule collecteur cortical. En revanche, il y a une endocytose importante d’albumine à J6 après l’injection du PAN, et celle-ci disparaît à J12. Il existe donc une concordance temporaire entre la rétention de sodium et l’endocytose de l’albumine dans le CCD (Figure 9).
Figure 9 : Endocytose de l’albumine dans le CCD de rats néphrotiques.
Immunomarquage avec un anticorps anti-albumine (vert) sur des coupes de rein de rats contrôles et de rats néphrotiques à J6 et à J12. Les canaux collecteurs sont identifiés par la présence d’un co-marquage avec l’anticorps anti-AE1 (rouge), une protéine exclusivement exprimée au pôle basolatéral des cellules intercalaires de type α. A J6, on constate la présence d’une endocytose de l’albumine dans le tubule collecteur cortical (*) ainsi que dans d’autres structures tubulaires, probablement des tubules contournés proximaux ($). A J12, l’endocytose de l’albumine disparaît dans le CCD mais pas dans les autres structures. Images choisies dans la région corticale. Barre d’échelle: 20µm.
Afin d’évaluer le rôle de l’albumine tubulaire dans l’expression d’ASIC2b et la rétention de sodium, nous avons étudié une souche de rats naturellement analbuminémiques (rats NAR ou Nagases). Ces rats, issus de la souche Sprague-Dawley, possèdent une mutation
spontanée entraînant un changement de cadre de lecture du gène de l’albumine et l’apparition d’un codon stop très précoce (30). Il faut noter que si ces rats ne deviennent pas albuminuriques en réponse au PAN, ils développent bien une protéinurie massive (équivalente en quantité) mais principalement composée de chaînes d’immunoglobulines, de transferrine, d’haptoglobine…
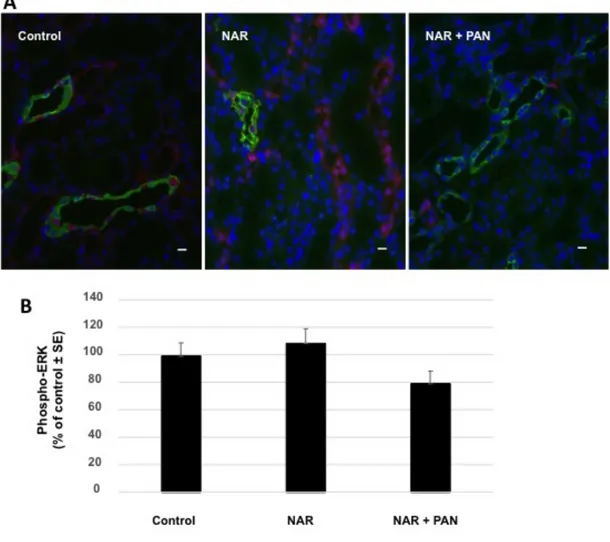
Chez ces rats NAR, on ne retrouve pas de phosphorylation de ERK dans le tubule collecteur cortical en réponse au PAN (Figure 10).
Figure 10 : Phosphorylation de ERK dans le CCD des rats NAR.
A. Immunomarquage sur coupes de rein de rats contrôles, NAR et NAR néphrotiques à J6
avec un anticorps anti-phospho-ERK (rouge). Les CCD sont identifiés par le marquage avec l’anticorps anti-aquaporines de type 2 (vert). Les images ont été choisies dans la région corticale. Barre d’échelle: 20µm. B. Quantification des immunomarquages. Valeurs moyennes +/- SEM de cinq rats.
Chez les rats NAR, il n’y a pas de surexpression d’ASIC2b en réponse au PAN (Figure 11A). En revanche, la surexpression des sous unités de la Na,K-ATPase n’est pas altérée (Figure 11B).
Figure 11 : Expression d’ASIC2b et des sous unités de la Na,K-ATPase chez les rats NAR.
Expression des ARNm d’ASIC2b (A) et des sous-unité α et β de la Na,K-ATPase (B) dans le CCD de rats contrôles et de rats NAR à l’état basal et après injection de PAN. Les valeurs sont des moyennes +/- SEM de 6 rats. *, p < 0,005 ; **, p < 0,001 par rapport aux contrôles correspondants.
A l’état basal, les CCD des rats NAR présentent un important flux de réabsorption de sodium, contrairement aux rats WT. Ce flux n’est pas augmenté en réponse au PAN, il est même réduit de moitié, mais la différence n’est pas statistiquement significative
Figure 12 : Flux de réabsorption du sodium à travers le CCD.
Flux de sodium mesuré par microperfusion de CCD de rats NAR et leurs contrôles WT à l’état basal et après injection de PAN. Le flux positif reflète une réabsorption. Valeurs moyennes +/- SEM de 6 rats. *, p < 0,005 par rapport aux contrôles correspondants.
D.
Exploration d’autres voies et sites de rétention du
sodium.
Les rats néphrotiques traités au U0126 ou analbuminémiques présentent une diminution de la réabsorption de sodium dans le CCD de respectivement 80% et 50% par rapport à des rats néphrotiques contrôles, mais néanmoins cette réabsorption n’est pas nulle. En absence d’évidence d’une activation/induction d’ENaC et d’ASIC2b, cela pose la question du mécanisme de cette réabsorption de sodium.
D’autre part, en dépit de cette diminution du transport de sodium dans le CCD, ces rats retiennent du sodium de façon identique aux rats néphrotiques « normaux » (Figure 13). Cela pose la question de l’origine tubulaire de cette rétention.
Figure 13 : Flux de réabsorption du sodium dans le CCD et natriurèse chez les rats contrôles, traités au U0126 et NAR avant et après l’injection de PAN. Les valeurs de flux
sont celles présentées dans les Figure 8 et 12. Les natriurèses ont été mesurées avant (C) et 6
jours après l’administration du PAN (PAN). Les valeurs sont des moyennes +/- SEM de 6 rats. *, p<0,005 par rapport aux contrôles correspondants.
Pour tenter de répondre à la question de l’origine tubulaire de cette rétention, nous nous sommes focalisés sur le rôle éventuel du tubule contourné distal (DCT) compte tenu de son rôle important (au même titre que le CCD) dans le maintien de la balance du sodium. Dans ce segment, l’entrée apicale de sodium se fait grâce au cotransporteur sodium-chlore NCC sensible aux diurétiques thiazidiques. Il est admis que l’activation de NCC résulte de son adressage à la membrane apicale des cellules du DCT en réponse à sa phosphorylation. Nous avons donc étudié les niveaux d’expression de NCC et de phospho-NCC par Western blot dans les différents groupes de rats.
Les résultats nous montrent que quelque soit le groupe de rats (contrôle, traité au U0126 ou NAR), l’injection de PAN inhibe l’expression protéique de NCC et de phospho-NCC (Figure 15). Le DCT n’est donc probablement pas un site de rétention du sodium chez les rats néphrotiques ; son inhibition serait une adaptation visant à limiter la réabsorption massive et inadaptée de sodium dans le CCD.
Figure 14 : Expression protéique de NCC et phospho-NCC dans le tube contourné distal. Images de Western Blot via la révélation de NCC et phospho-NCC chez trois groupes
Par la suite, nous avons exploité l’apparente inhibition totale de l’activité de NCC dans le DCT des rats néphrotiques pour tenter de comprendre par quel mécanisme la réabsorption de sodium persiste dans le CCD. En effet, l’hydrochlorothiazide (HCTZ) est un inhibiteur de NCC dans le tube contourné distal et de la voie électroneutre dans les cellules intercalaires de type β du canal collecteur. Lorsqu’il est administré in vivo, il est donc difficile d’attribuer le rôle respectif de ces deux mécanismes de transport dans la natriurèse qu’il engendre. En revanche, chez les animaux néphrotiques, l’effet natriurétique de l’HCTZ serait quasi totalement dû à l’inhibition de la voie électroneutre du CCD et pourrait permettre ainsi d’évaluer son activité de réabsorption du sodium.
Figure 15 : Réponse natriurétique à l’injection d’une dose unique
d’hydrochlorothiazide. Natriurèse à 2, 24 et 48 heures après l’injection l’HCTZ chez des
rats à l’état basal et chez trois groupes de rats néphrotiques (contrôles, U0126 et NAR). Les valeurs sont des moyennes de 6-7 rats par groupe.
Cette hypothèse est corroborée par l’observation que l’effet natriurétique de l’HCTZ est réduite d’environ moitié chez les rats « normaux » traités au PAN (Figure 15, haut), suggérant une contribution de la voie électroneutre à la réabsorption massive de sodium dans le CCD, en plus de la stimulation de la voie électrogénique (ENaC ou ASIC2b).
Chez les rats PAN-U0126, la réponse natriurétique à l’HCTZ est similaire à celle observée chez les rats PAN « normaux » suggérant la persistance d’une stimulation de la voie électroneutre qui expliquerait le flux de sodium mesuré par microperfusion (Figure 15, PAN+U0126).
Chez les rats PAN-NAR, il n’y a en revanche aucune réponse natriurétique à l’HCTZ malgré la présence d’un flux de réabsorption en microperfusion (Figure 15, PAN+NAR). Une explication pourrait être que la protéinurie singulière des rats PAN-NAR modifierait la pharmacocinétique de l’HCTZ dans le CCD et empêcherait son action.
III. DISCUSSION
Le syndrome néphrotique idiopathique avec une aldostéronémie maintenue dans les normes physiologiques est le modèle le plus fréquemment retrouvé chez les patients. Dans les conditions similaires des rats PAN clampés en corticostéroïdes, un nouveau variant d’ASIC2b a été décrit dans le CCD en remplacement du canal classique ENaC. L’analyse phénotypique de la lignée de rats transgéniques KO ASIC2b permettra d’évaluer le rôle de ce nouveau canal dans la rétention de sodium, mais cette étude ne débutera que fin septembre. Au vu des résultats de notre étude, il est à prévoir que la réabsorption de sodium dans le CCD sera effectivement abolie (ou du moins réduite) mais que les animaux développeront une rétention de sodium et de l’ascite.
Concernant l’élément déclencheur de l’induction d’ASIC2b, nos expériences ont démontré que l’albumine dans la lumière tubulaire est indispensable à l’activation de la phosphorylation de ERK intracellulaire et que la phosphorylation de ERK est elle même indispensable à l’expression d’ASIC2b. C’est donc bien l’endocytose de l’albumine qui aboutit à l’expression d’ASIC2b dans le CCD.
La voie de ERK est également décrite comme activatrice de la Na,K-ATPase basolatérale des cellules principales du CCD. L’ensemble de ces effets (induction ASIC2b apical et activation de la Na,K-ATPase basolatérale) désigne la voie de signalisation ERK comme candidate idéale responsable de la réabsorption du sodium, et nos expériences le confirment puisque en absence d’ASIC2b (rats NAR et rats U0126), il y a une nette diminution de la réabsorption du sodium dans le CCD.
La réabsorption résiduelle mesurée en microperfusion en l’absence d’ASIC2b semble se faire via la voie électroneutre originaire des cellules intercalaires devant la persistance d’une réponse à l’HCTZ constatée en l’absence de NCC. Une façon simple de le confirmer serait de refaire les mesures de flux de sodium par microperfusion de CCD en présence HCTZ dans le bain de microperfusion. Une inhibition de cette réabsorption résiduelle signerait l’implication de la voie électroneutre.
Malgré la nette diminution de la réabsorption du sodium dans le CCD en l’absence d’ASIC2b, les rats continuent à retenir du sodium et la quantité d’ascite au sacrifice reste dans les mêmes proportions. Nos expériences suggèrent que le tubule contourné distal n’est pas impliqué dans cette rétention puisque tous les groupes d’animaux néphrotiques ont une expression de NCC quasi abolie. L’implication d’un autre segment tubulaire, en particulier
l’anse de Henle, pourrait être évaluée en étudiant la réponse natriurétique au furosémide, un inhibiteur de la réabsorption de sodium dans ce segment: une majoration de cette réponse indiquerait la stimulation de la réabsorption dans ce segment.
Quel que soit la situation, l’induction du syndrome néphrotique aboutit constamment à la rétention du sodium. En l’absence d’ENaC, ASIC2b prend le relais, en l’absence d’ASIC2b d’autres mécanismes se mettent en place. Ces observations suggèrent que les animaux néphrotiques ont besoin de retenir du sodium : pourquoi ? Une hypothèse peut être formulée au vu de l’incapacité que présentent les rats néphrotiques à excréter une charge en potassium observée précédemment (24). En effet, l’inhibition de la réabsorption du sodium dans le DCT au profit de sa stimulation dans le CCD est une observation classique dans les conditions où il faut excréter une charge en potassium. Pour tester cette hypothèse, il est envisagé de rechercher si le syndrome néphrotique induit une rétention de sodium chez des animaux carencés en potassium.
IV. MATERIELS ET METHODES
1.
Animaux
Les rats utilisés pour cette étude étaient de fond génétique Sprague Dawley, souche sauvage ou transgénique (rats NAR et rats KO ASIC2b). Ils ont été hébergés au sein du centre d’exploration fonctionnelle du centre de recherche des Cordeliers (structure agrée par la direction départementale de la protection des populations (DDPP)). Ils ont résidé dans des cages associées à un système de ventilation individuelle et de traitement de l’air ainsi qu’un éclairage réglé sur un cycle jour/nuit de 12h/12h. Chaque cage possèdait un abreuvage automatique d’eau distillée ainsi qu’une nourriture standard (A04-10 - Safe) mise en libre-service pour l’animal. L’ensemble des procédures expérimentales a été réalisé en accord avec les bonnes pratiques de l’expérimentation animale et par le comité d’éthique «Darwin» de l’université Pierre et Marie Curie (8242). Les rats utilisés étaient des mâles adultes avec un poids compris entre 160 et 210 grammes.
2.
Etudes métaboliques
Les rats ont été placés dans des cages métaboliques individuelles qui permettent de réaliser un bilan individuel et quotidien des apports (alimentaires et hydriques) et des excrétions urinaires. L’installation en cage à métabolisme a été réalisée deux jours avant le début de l’expérimentation pour permettre l’acclimatation des rats. Tous les rats avaient un libre accès à l’eau et à la nourriture. Les urines ont été récoltées toutes les 24h depuis la veille de l’injection de PAN jusqu’au jour du sacrifice à J6. Le volume urinaire a été mesuré en pesant les urines.
Les urines recueillies dans les cages métaboliques ont subi une centrifugation à 3300 g/min durant 10 minutes à 4°C afin d’en retirer tous les débris. Après homogénéisation, un aliquot de 150 μL est utilisé pour mesurer les concentrations urinaires en sodium et potassium par photométrie de flamme (SHERWOOD, modèle 420). La protéinurie et la créatininurie sont mesurées grâce à l’appareil KONELAB 20i ; La créatininurie est mesurée par la méthode enzymatique (Jaffé).
3.
Procédures chirurgicales
L’anesthésie générale a été réalisée grâce à l’injection intra-péritonéale d’un mélange de Kétamine 86 mg/kg (Kétamine 1000, Virbac France) et Xylazine 13,2 mg/kg (Rompun 2%,
Bayer France). La dose administrée a été de 1 ml/kg de poids corporel en intra péritonéal. La surrénalectomie et l’installation des minipompes ont été réalisées sous anesthésie générale. Après désinfection locale de la peau (Bétadine diluée) une incision cutanée dorsale axiale (environ 1 cm) a été réalisée. Une incision musculaire latérale (environ 0,5 cm) a été ensuite réalisée au niveau du pôle supérieur d’un rein. La surrénale a été excisée. Le plan musculaire a été suturé puis la même opération est réalisée de l’autre côté de l’animal. Par la suite une mini-pompe osmotique (Alzet 2001 ou 2002) a été introduite sous la peau jusqu’à la région inter-scapulaire, via l’incision dorsale. Les taux d’aldostérone (10 μg/kg/jour) et de déxaméthasone (14 μg/kg/jour) restaurent un statut cortico-surrénalien normal. Le plan cutané a été refermé avec 3-4 agrafes. L’opération dure environ 20 min depuis l’endormissement du rat. Les animaux ont été maintenus dans un environnement chaud et sont surveillés jusqu’à leur réveil complet, puis ont été replacés en cage à métabolisme.
Le lendemain de la surrénalectomie, les animaux ont été de nouveau anesthésiés et l’induction du syndrome néphrotique a été réalisé par l’injection intraveineuse (par voie jugulaire) d’aminonucléoside de puromycine (PAN, 150 mg/Kg de poids corporel, diluée dans du sérum physiologique). Après désinfection locale (Bétadine diluée), une incision cutanée (0,5 cm) a été réalisée à la face antérieure du cou, la jugulaire externe a été visualisée et l’injection a été réalisée et le plan cutané a été suturé. L’intervention dure environ 5 min à partir de l’endormissement du rat. Les animaux ont été maintenus dans un environnement chaud et ont été surveillés jusqu’à leur réveil complet, puis ont été replacés en cage à métabolisme.
Durant l’opération jusqu’au réveil, les rats ont été placés sur un coussin chauffant puis sous une lampe chauffante afin de maintenir leur température constante. Nous nous sommes assurés de placer un gel oculaire afin de prévenir toute sécheresse oculaire. Les animaux ont reçu un traitement analgésique pendant 48h (Buprénorphine, 0,05 mg/kg, injection sous cutanée) après le clamp stéroïdien.
U0126 a été administré quotidiennement depuis le jour du clamp stéroïdien jusqu'au jour du sacrifice (7 jours) à la dose de 30 mg/Kg/jour par voie sous cutanée (31). L’hydrochlorothiazide a été utilisé de façon aiguë par injection intra péritonéale à la dose de 100 mg/Kg. Ces traitements n’occasionnent aucun effet indésirable détectable.
En fin d'expérimentation, les animaux ont été anesthésiés (Pentobarbital, 50 mg/kg (200μl/rat), IP), les reins ont été prélevés et les animaux ont succombé à l'hémorragie consécutive à la section des artères rénales. La mort a été confirmée par l'arrêt des mouvements respiratoires et cardiaques (plus d'une minute).
4.
Microdissection avec collagénase
Le jour du sacrifice une laparotomie a été réalisée et le rein gauche a été perfusé par cathétérisme de l’aorte pour infusion d’une solution contenant de la liberase. Le rein a été ensuite prélevé et coupé en pyramide selon l’axe cortico-papillaire. La microdissection des tubules collecteurs corticaux a été faite sous loupe binoculaire dans un bain à 4°C. Les tubules collecteurs corticaux sont reconnus par leur morphologie et leur localisation. Un pool de cinquante tubules collecteurs corticaux a été isolé et transféré dans une solution contenant de l’albumine. Une photographie de ce pool a été prise afin de déterminer la longueur totale des tubules de chaque pool qui a servi de référentiel pour l’expression de certains résultats.
5.
PCR quantitative en temps réel (qPCR)
Les ADNc issus de la transcription inverse ont été utilisés pour quantifier l’expression en ARNm des gènes. La technique repose sur le SYBR Green (LightCycler 480 Sybr Green I Master) qui se lie aux acides nucléiques doubles brins. La fluorescence émise par le SYBR Green permet le suivi de l’amplification de l’ADN et déterminer ainsi le « Cycle threshold » (Ct) représentant le seuil de détection des produits de qPCR. La méthode de qPCR utilisée est celle de la quantification relative. Elle consiste à utiliser une gamme ainsi qu’un gène de référence (RPS 23), dont l’expression n’est pas modifiée dans nos conditions d’études. La gamme a été réalisée à partir d’un échantillon d’ADNc de rein total de rats (point 1), puis on a réalisé des dilutions en série au dixième pour obtenir jusqu’à quatre points de gamme. On a associé une concentration arbitraire (1, 1/10, 1/100, 1/500) pour chacun de nos points de gamme, dont le Ct a été déterminé. Les concentrations initialement obtenues ont été normalisées à partir des concentrations du gène de référence (RPS 23) puis les résultats obtenus ont ensuite été normalisés par rapport à la condition contrôle.
6.
Immunohistologie
Les reins prélevés sur les rats ont préalablement été fixés par perfusion aortique d’une solution de PBS / Paraformaldéhyde 4%. Chaque rein a été sectionné en trois parties et congelé dans un bain d’azote liquide à -80°C. Ils ont ultérieurement été coupés en sections transversales à l’aide d’un cryomicrotome Leica RM 2145 (Leica Microsystems, Wetzlar, Allemagne) à une épaisseur de 5 μm, coupes réalisées entre -22 et -24°C. Les coupes ont été ensuite disposées sur lames super Frost. Un démasquage a été réalisé par immersion des lames à 90°C dans un tampon citrate PH6 durant 10 minutes. Pour réduire les marquages non
spécifiques, les sections ont été saturées pendant 30 minutes par une solution de sérum d’âne à 10%. Les sections ont ensuite été incubées pendant la nuit en chambre humide, en présence d’anticorps primaire. Nous avons utilisé un anticorps primaire anti-AQP2 produit chez la chèvre (dilution 1/500) révélé par un anticorps secondaire anti-chèvre fluorescent (488) produit chez l’âne. L’anticorps anti-Phospho-ERK produit chez le lapin (dilution 1/400) a été révélé par un anticorps secondaire fluorescent (555) anti-lapin produit chez l’âne. L’anticorps anti-βENaC produit chez le lapin (dilution 1/500) a été révélé par un anticorps secondaire fluorescent (555) anti-lapin produit chez l’âne. L’anticorps anti-AE1 produit chez le lapin (dilution 1/00) a été révélé par un anticorps secondaire fluorescent (555) anti-lapin produit chez l’âne. L’anticorps anti-albumine (dilution 1/100) produit chez le singe présente directement le fluorophore (488) au niveau de sa partie constante. Le DAPI à la dilution 1/2000 a permis de révéler les noyaux des cellules en bleu. Les anticorps secondaires et le DAPI (dilués dans du PBS-0,05% BSA) ont été incubés sur les lames pendant une heure le lendemain après un rinçage des lames de l’anticorps primaire pendant 30 min avec du PBS. Une dernière étape de rinçage de 30min des anticorps secondaires et du DAPI dans du PBS a été réalisée puis les sections de rein ont été montées entre lame et lamelle en utilisant le milieu de montage Glycergel (Dako). L’examen microscopique a été fait à l’aide d’un microscope confocal à fluorescence.
La quantification des images a été réalisée grâce au programme informatique ImageJ. Pour chaque section tubulaire, la fluorescence présente dans la lumière a été soustraite à la fluorescence totale pour calculer la fluorescence cellulaire, et celle-ci a été normalisée par rapport à la surface cellulaire (densité de fluorescence). Pour normaliser les valeurs entre expériences, nous avons utilisé un animal témoin qui a été analysé dans chaque expérience et sa valeur a été arbitrairement fixée à 100.
7.
Western blot
Les cortex rénaux ont été broyés grâce à un homogénéiseur Ultra-turrax (IKA 24 000 rpm 3x10s) dans un tampon de lyse froid contenant 250 mM de sucrose, 20 mM de Tris-Hepes à pH 7.4, des inhibiteurs de protéases et de phosphatases (tablettes Complete et PhosSTOP, Roche Diagnostics) et 50 μL de Pepstatine à 1,5 μg/ml. Puis, les homogénats ont été centrifugés à 1000 g pendant 15 minutes à 4°C. Les surnageants ont ensuite été centrifugés 30 minutes à 17 000 g (Beckman, 70.1 Ti rotor) à 4°C. Les culots (qui correspondent aux protéines de membranes) sont isolés et mélangés à 200 μL de tampon de lyse. Suite à la
centrifugation, la concentration en protéines est déterminée par un dosage colorimétrique de Bradford (MicroBradford protein assay, Bio-Rad). Une dilution a ensuite été réalisée pour obtenir 20 μg de protéine de membrane par puit de migration. Les protéines ont ensuite été dénaturées 30 min à température ambiante dans un tampon dit de Laemmli contenant 62,5mM de Tris Hcl pH 6,8, 2% de SDS, 10% de glycérol, 0,0025% de bleu de bromophénol, et 0,1M de DTT.
Les protéines ont été séparées par électrophorèse sur un gel dénaturant SDS-PAGE à 8% d’acrylamide pendant 2 heures à 125 volts. La quantité de protéines chargées par puit a initialement été vérifiée par une série de colorations au rouge monceau. Les protéines ont ensuite été transférées sur une membrane de nitrocellulose (Transfert Pack nitrocellulose membrane, Bio-Rad, nom précis), par migration horizontale durant plus de 2 heures à 30 volts dans un appareil de transfert semi-sec (Trans-Blot, Turbo Transfer System bio-rad). Les membranes ont été bloquées dans du lait 5%-PBS. Les anticorps primaires (NCC et anti-Phospho-NCC produits chez le lapin) ont été dilués à 1/5000 dans du lait 1%-PBS pour être incubés durant la nuit avec les membranes de nitrocellulose à 4°C. Les membranes ont ensuite été lavées trois fois 10 minutes avec une solution de PBS Tween 0.1%. Les anticorps secondaires ont été couplés à l’enzyme HRP (Horse Raddish Peroxydase). Une solution d’anticorps secondaires reconnaissant les immunoglobulines de lapin (dilution au 1/10 000 dans du lait 5%-PBS) a été incubée sur la membrane pendant 2h à température ambiante. La membrane a ensuite été lavée trois fois 10 minutes avec une solution de PBS Tween 0.1%. L’activité enzymatique a été révélée grâce au kit "Clarity Western ECL Substrate" (BIO-RAD) sur un film photographique (Amersham Hyperfilm ECL, GE Heathcare).
8.
Microperfusion in vitro
La microdissection des CCD destinée à la microperfusion a été réalisée sur coupe de rein frais immédiatement après le sacrifice. Les CCD ont été reconnus par leur morphologie sous loupe binoculaire. Pour chaque mesure un unique CCD est choisi puis transféré dans la chambre de microperfusion. La perfusion de la lumière tubulaire a été réalisée à un débit de 2 nl/min et le débit du bain péritubulaire était de 12 ml/min pour maintenir la température constante à 37°C et le renouvellement du bain. Les CCD ont été perfusés dans des conditions symétriques avec un même bain luminal et péri tubulaire contenant (en mM) : 121 NaCl, 23 NaHCO3, 1.2MgSO4, 2 K2HPO4, 2 calcium lactate, 1 sodium citrate, 5.5 glucose, 5 alanine, et
9.
Statistiques
Les comparaisons entre groupes ont été réalisées par le test t de Student (comparaison de 2 groupes) ou par analyse de variance suivie d’un test PLSD de Fischer (comparaison multi groupes).
Les valeurs sont exprimées en moyenne +/- SEM (standard Error of the Mean). La significativité statistique des résultats de qPCR a été déterminée par un test paramétrique t de Student. La significativité statistique des autres résultats a été déterminée par le test one-way ANOVA, suivi d’un post-test de Tukey-Kramer. Une valeur de P inférieure à 0,05 étant considérée comme statistiquement significative avec : *P<0.05, **P<0.01 et ***P<0.001.