يولعلا ثحبلاو يلاعلا نيلعتلا ةرازو
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique جيريرعوب جرب يويهاربلإا ريشبلا دوحه تعهاـج
Université Mohamed El Bachir El Ibrahimi B.B.A. ىوكلاو ضرلاا مولعو ةايحلاو تعيبطلا مولع تيلك
Faculté des Sciences de la Nature et de la Vie et des Sciences de la Terre et de l’Univers تيجولويبلا مولعلا نسق
Département des Sciences Biologiques
Mémoire
En vue de l’obtention du Diplôme de Master
Domaine : Sciences de la Nature et de la Vie
Filière : Sciences Biologiques
Spécialité : Toxicologie
Thème
Présenté par : BOUDIA Walid
Devant le jury :
Président : Mme ROUAIGUIA Nadia MAA Université Mohamed El Bachir El Ibrahimi BBA
Encadrant : Mr Sid Nassim MAB Université Mohamed El Bachir El Ibrahimi BBA
Examinateur : MrSLIMANI Ourdia MAA Université Mohamed El Bachir El Ibrahimi BBA
Année universitaire : 2019/2020
Etude histopathologique d'un cas de
tumeur vénérienne transmissible canine
A "ALLAH", pour m'avoir donné la force dans les moments difficiles
d'éditer ce mémoire.
Je dédie ce travail à :
Ma mère Zohra, qui a œuvré pour ma réussite, de par son amour, son
soutien, tous les sacrifices consentis et ses précieux conseils, pour toute
son assistance et sa présence dans ma vie, reçois à travers ce travail
aussi modeste soit-il, l'expression de mes sentiments et de mon éternelle
gratitude; Que dieu tout puissant vous garde et vous accorde santé,
bonheur et longue vie.
Mon père Bouallam, en témoigne de mon profound amour, puisse le
miséricordieux te preserve ta santé et t'accorde une longue vie plein de
bonheur.
Mes sœurs, Amel Messaouda qui n'ont cessé d'être pour moi des exemples
de persévérance, de courage et de générosité; Je vous aime très fort.
Mes frères, Mourad Amar Thameur qui m'avez toujours soutenu et
encouragé durant ces années d'études.
Nous remercions "ALLAH" le tout puissant qui nous a donné le courage
et la volonté de mener à bien notre travail.
Un grand merci,
A Monsieur le promoteur Sid Nassim
Professeur à l'université Mohamed El bachir El ibrahimi BBA
d'avoir accepté, de prendre en charge cet encadrement. Sa compétence,
Sa rigueur scientifique et sa clairvoyance m'ont beaucoup appris.
J'adresse mes vifs remerciements à l'ensemble des membres du jury :
Mme ROUAIGUIA Nadia MAA Université Mohamed El Bachir El
Ibrahimi BBA
Mr SLIMANI Ourdia MAA Université Mohamed El Bachir El
Ibrahimi BBA
Qui nous ont fait honneur d'accepter de jurer ce travail.
Je remercie également Dr vet charif toufik pour leur aide ainsi que Benbacha
faycel pour leur aide à la réalisation des analyses histopathologiques.
J'adresse mes profonds respects et remerciements à mes très chers parents,
mes sœurs et frères qui m'ont manifesté leur soutien et leur intérêt tout au long
de mon curcus universitaire.
A toutes personnes qui nous a aidés de près ou de loin.
Liste des tableaux Liste des figures Liste des photos
Introduction
PARTIE THEORIQUE
Chapitre 1 : Rappels sur l'anatomie de l'appareil genital
1. Anatomie de l'appareil génital de la chienne ... 1
1.1 Ovaires : ... 1 1.2. Trompes utérines : ... 2 1.3. L'utérus : ... 3 1.4. Le vagin : ... 3 1.5. Le vestibule du vagin :... 4 1.6. La vulve : ... 5 1.7. Les mamelles : ... 5
2. Anatomie de l'appareil génital du chien : ... 5
2.1 Les testicules : ... 6
2.2 Les voies de stockage et de transport du sperme: ... 7
2.3 L'urètre : ... 8
2.4 Le pénis : ... 8
Chapitre 2 : La tumeur vénérienne transmissible canine 1. Défénition ... 10
2. Origine et répartition géographique ... 10
3. Épidémiologie ... 11 4. Transmission ... 12 5. Présentation Clinique ... 14 6. Caractéristique anatomo-pathologique ... 15 6.1. Caractéristiques macroscopiques ... 15 6.2. Caractéristiques cytologiques ... 16 6.3. Caractéristiques histologiques ... 16 7. Diagnostic ... 17
9.1. Radiothérapie : ... 19
9.2. Chimiothérapie : ... 19
9.3. L'immunothérapie : ... 19
9.4. L’exérèse chirurgicale : ... 20
Partie Pratique
Chapitre 1 : Matériels et méthodes 1.1 Matériels ... 211.1.1. Lieu de l'expérimentation ... 21
1.1.2. Animaux ... 21
1.1.3. Matériels de chirurgie ... 21
1.1.4. Produits pour la chirurgie ... 23
1.1.5. Matériels d'histopathologie ... 24
1.1.6. Produits pour la confection des coupes histologiques : ... 24
1.2. Méthodes ... 25
1.2.1. Examen clinique ... 25
1.2.1.1. Anamnèse et commémoratifs ... 25
1.2.1.2. Examen clinique générale ... 25
1.2.1.3. Examen spéciale de l'appareil génitale: ... 25
1.2.1.4. Exérèse des masses tumorales ... 25
1.2.2. Réalisation des prélèvements... 28
1.2.3. Acheminement et conservation des prélèvements ... 29
1.2.4. Analyses de laboratoire : Examen histopathologique: ... 29
1.4.2.1. Enregistrement des prélèvements ... 29
1.4.2.2. Recoupe et de fixation des prélèvements ... 29
1.4.2.3. Inclusion en paraffine (circulation) ... 30
1.4.2.4. Technique d'enrobage en blocs de paraffine ... 31
1.4.2.5. Technique de coupe et étalement sur lame porte-objet ... 32
1.4.2.6. Préparatoires à la coloration ... 33
1.4.2.7. Montage des lames et des lamelles ... 34
2.1 Résultats... 35
2.1.1. Recueil des commémoratifs... 35
2.1.1.1. Concernent l’animal ... 35
2.1.1.2. Examen clinique générale ... 35
2.1.1.3. Aspect macroscopique de la tumeur ... 35
2.1.2. Résultat de l'intervention chirurgical ... 37
2.1.3. Observation microscopiques des lames histologiques... 38
2.2. Discussion ... 40
CONCLUSION... ... 42 REFERENCES BIBLIOGRAPHIQUES
Tableau I : Protocole de coloration à l’hématoxyline éosine ... 34
Tableau II : Commémoratifs... 31
Tableau III : Résultat de l'examen général du chien ... 32
Figure 01: Appareil génital de la chienne en place ... 1
Figure 02: Bourse ovarique et moyens de fixité de l'ovaire ... 2
Figure 03 : Viscères en place chez la chienne, vue latérale droite ... 4
Figure 04 : Appareil génital du chien ... 6
Figure 05 : Anatomie du testicule de chien ... 7
Figure 06 : Prévalences estimées de la TVTC dans le monde ... 11
Photo 1 : Chien mal de race Dogue argentin ... 21
Photo 2 : Les instruments chirurgicales ... 22
Photo 3 : Incision de la peau et des tissus sous-jacents en contrôlant de l’hémostase ... 23
Photo 4 : Tranquilisant (acépromazine) COMBISTRESS ... 23
Photo 5 : Chien en décubitus lateral ... 26
Photo 6 : Extérioration du pénis ... 26
Photo 7 : exérèse minutieuse ... 27
Photo 8 : l'hémostase ... 27
Photo 9 : Cautérisation électrique ... 28
Photo 10 : Pièces opératoires ... 28
Photo 11: (A) Recoupe de la tumeur et (B) placement des frayements dans une cassette...30
Photo 12 : Automates à déshydratation et inclusion ... 31
Photo 13 : Appareil d’enrobage ... 31
Photo 14 : Microtome ... 32
Photo 15: Etalement des coupes...32
Photo 16 : Étuve ... 33
Photo 17: Automate de coloration ... 33
Photo 18 : Microscope ... 34
Photo 19: Trois masses tumorales en chou-fleur sur le pénis...36
Photo 20 : Tumeur très vascularisée ... 37
Photo 21 :Aspect du pénis après l'exérèse chirurgicale ... 37
Photo 22 : Aspect histologique du sarcome de Sticker chez un Dog argentian (HEx10) ... 38
Photo 23 : Cellules présentant un noyau rond et un cytoplasme basophile et vacuolé (HEx40) ... 39
Depuis plusieurs décennies, l’évolution de la place de l’animal domestique dans notre société a permis d’importants progrès en médecine vétérinaire. Grace à l’amélioration de leurs soins et de leur qualité de vie, les espèces canines ont connu une augmentation de leur espérance de vie et, en contrepartie, une augmentation de l’incidence de certaines maladies, notamment dégénératives et néoplasiques.
Il existe actuellement plusieurs cancers transmissibles qui se propagent naturellement au sein de populations animales, Il s’agit de la tumeur vénérienne transmissible canine.
La tumeur vénérienne transmissible canine (TVTC), également appelée sarcome de Sticker, est une tumeur réticulo-endothéliale maligne du chien qui affecte principalement les organes génitaux externes et parfois les organes génitaux internes. Elle se transmet généralement lors du coït. La TVTC affecte également les canidés sauvages. Les cellules tumorales vénériennes transmissibles contiennent un nombre anormal de chromosomes, allant de 57 à 64 avec une moyenne de 59, contrairement au nombre normal de chromosomes de l'espèce qui est de 78. La capacité de réponse immunitaire de l'hôte joue un rôle déterminant dans l'expansion de ces tumeurs avec une augmentation de la sévérité observée chez les animaux immunologiquement compromise.
Notre travail a pour objectifs :
La description de l'aspect clinique, morphologique d'un cas de tumeur vénérienne transmissible canine.
La présentation des étapes de l'exérèse chirurgical
La confirmation de la suspicion clinique par l'analyse histopathologique
la description des caractéristiques histopathologique de la tumeur vénérienne transmissible canine.
La présentation de ce travail s’articule autour de deux parties :
La première partie est une synthèse bibliographique. Elle est divisée en deux chapitres : le premier est consacré à la présentation de l'anatomie et la physiologie de l'appareil génital et le second abordera la tumeur vénérienne transmissible canine.
La deuxième partie est consacrée à l’étude pratique qui se subdivise en deux chapitres : matériels et méthodes, résultats et discussion.
PARTIE
1
Chapitre 1 : Rappels sur l'anatomie de l'appareil génital
1. Anatomie de l'appareil génital de la chienne
L’appareil génital comprend une portion glandulaire (les ovaires, à fonctionnement cyclique et limité dans le temps), une portion tubulaire (trompes utérines, utérus, vagin) et une portion urogénitale (vestibule du vagin, vulve) (Marossero, 2012).
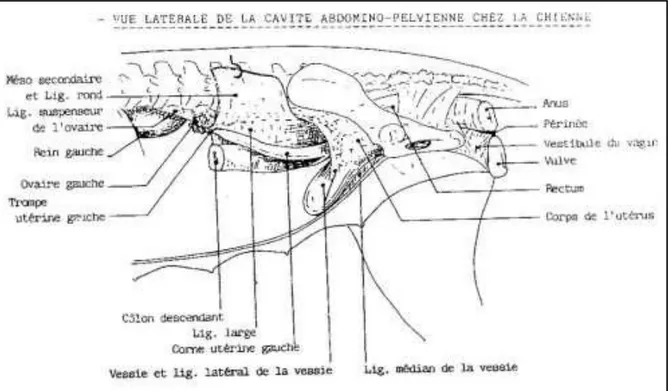
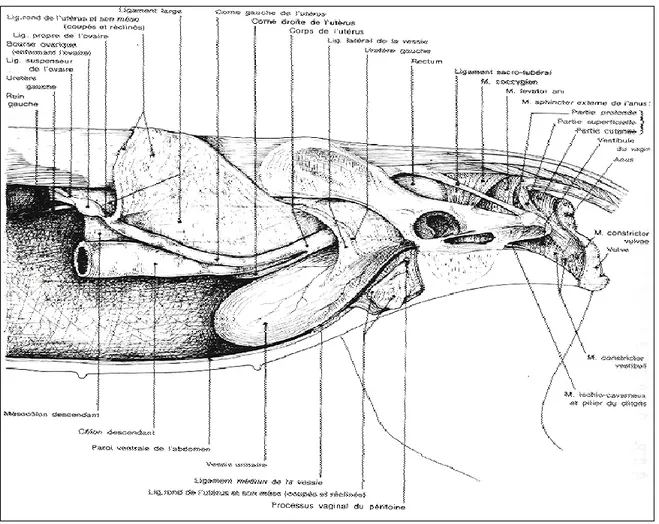
Figure 01: Appareil génital de la chienne en place (Châtelain, 1996).
1.1. Ovaires
Chaque ovaire forme une structure dense de 1 à 2 cm de long. Sa conformation varie au cours du cycle sexuel, en fonction du nombre et de la taille des follicules et des corps jaunes qui émergent a sa surface (Barone, 1990).
les ovaires sont situés au voisinage immédiat du pôle caudal de chaque rein. L’ovaire droit est donc plus crâniale que l’ovaire gauche. Ils correspondent approximativement à la troisième (à droite) et à la quatrième (à gauche) vertèbre lombaire (Barone, 1990).
Le mesovarium est la portion crâniale du ligament large. Il est assez court et suspend l’ovaire à la voûte lombaire latéralement au pôle caudal de chaque rein. Deux autres ligaments l’accompagnent :
2
Le ligament suspenseur de l’ovaire qui renforce sons bord crâniale.
Le ligament propre de l’ovaire qui unit ce dernier a l’extrémité crâniale de l’utérus. Ainsi, l’attache des ovaires est suffisamment courte et dense pour maintenir chaque glande en position fixe au pôle caudal de chaque rein. Le mésosalpinx et le mesovarium forme une bourse séreuse largement infiltrée de graisse qui englobe l’ovaire et l’oviducte (Barone, 1990).
Les hormones produites par ces deux ovaires sont la progestérone et les œstrogènes. Elles jouent un rôle primordial dans les modifications physiques et comportementales liées au cycle sexuel, le maintien de la gestation et le déclenchement de la mise bas (Corre et Rozenbaum, 2014).
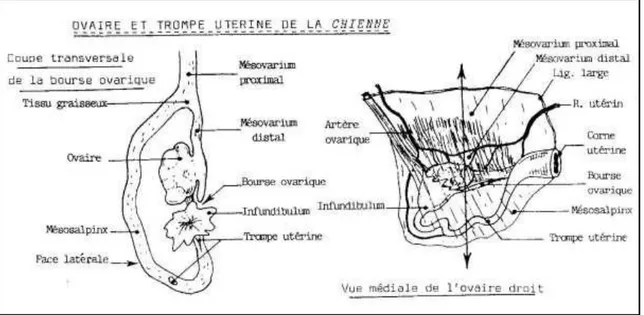
Figure 02: Bourse ovarique et moyens de fixité de l'ovaire (Châtelain, 1995).
1.2. Trompes utérines
Presque dépourvue de flexuosités, est longue de 6 a 10 cm. L’infundibulum, en forme d’entonnoir, n’a que 5 à 8 mm de diamètre. Il s’ouvre médialement à l’ovaire, au bord ventral de l’étroit orifice de la bourse ovarique, a travers lequel se voient souvent quelques-unes de ses franges. L’ampoule se porte d’abord en direction crâniale dans la paroi de la bourse ovarique, puis en direction ventrale avant de remonter dans la paroi latérale pour revenir en regard de l’ovaire, ou l’isthme lui succède. La terminaison de celui-ci est marquée par une implantation nette sur l’extrémité de la corne utérine (Barone, 1990).
3
1.3. L'utérus
La chienne a un utérus bipartitus, avec des cornes étroites et longues. Chez une chienne de taille moyenne, celle-ci ont 12 à 16 cm de long sur 8 ou 9 mm de large, alors que le corps n’excède pas 3 à 4 cm et le col, 1,5 à 2 cm de long, ces deux dernières parties ayant environ 1 cm de diamètre (Barone, 1978). En générale, la corne droite est légèrement plus longue que la gauche.
Les cornes de l’utérus ont un calibre uniforme et s’étendent en dessinant une légère courbe a concavité dorsale du voisinage du reins a la face dorsale de la vessie, crânialement a l’entrée du bassin. La base des deux cornes s’unit à angle aigu. Le corps constitue avec le col un ensemble cylindroïde, de calibre uniforme.
La paroi de ces cornes a une structure particulière composée de deux couches principales : l’endomètre et le myomètre (Barone, 1978).
Le myométre est relativement mince et l’endomètre épais. L’utérus communique avec le vagin par le col de l’utérus.
1.4. Le vagin
Il est très long, situé en arrière de l’utérus, accueille -avec le vestibule-le pénis du mâle lors de l’accouplement. Il atteint de 12 à 15 cm sur des sujets de taille moyenne. Sa muqueuse est pale, pourvue de plis ineffaçable, nombreux et sinueux, principalement longitudinaux.
L’hymen est en générale rudimentaire et paraît un peu mieux représenté dans les petites races. L’urètre fort long, détermine un relief longitudinal sur le plancher du vaginal. Le péritoine couvre à peu prés la moitié crâniale de l’organe (Barone, 1990).
4
Figure 03 : Viscères en place chez la chienne, vue latérale droite (England et Allen, 1990).
1.5. Le vestibule du vagin
Le vestibule du vagin est la partie des voies génitales située entre le vagin et la vulve. Il fait partie (avec la vulve) du sinus uro-génital, c’est-à-dire de la partie commune des appareils urinaire et génital. En effet, c’est au niveau du plancher du vestibule que débouche l’urètre, par un petit orifice appelé méa urinaire.
Le vestibule est coudé : sa partie terminale, située proche de la vulve, est orientée presque verticalement vers le haut. Il fait ensuite un coude et devient horizontal. Lorsqu’un vétérinaire introduit un instrument (pour réaliser un frottis vaginal par exemple) dans le vagin, il s’oriente donc verticalement en direction du dos.
Le vestibule du vagin possède un muscle constricteur puissant qui se resserre en arrière du pénis du mâle lors de l’accouplement. Cela présente l’intérêt de prolonger l’érection et de favoriser les contractions du vagin qui aident à la remontée des spermatozoïdes. Du fait de cette particularité anatomique et de la présence de bulbes érectiles à la base du pénis, le mâle et la femelle restent accrochés l’un à l’autre et ne peuvent plus se séparer en fin
5
d’accouplement, pour une durée variant de quelques minutes à une heure (cf. phase d’accolement). C’est pourquoi il ne faut jamais séparer deux chiens qui s’accouplent, sous peine de les blesser sérieusement (Landry, 2008).
1.6. La vulve
Correspond à la partie externe des organes génitaux. Elle est composée de deux lèvres verticales réunies au niveau des commissures. La commissure ventrale (celle du bas) abrite le clitoris. La vulve gonfle lors des chaleurs. Chez une chienne stérilisée elle reste petite. A l’inverse, chez une chienne multipare, elle peut rester volumineuse tout au long de l’année (Landry, 2008).
1.7. Les mamelles
Ne font pas partie de l’appareil génital à proprement parler mais jouent un rôle dans la fonction de reproduction (Landry, 2008).
Chez la chienne, il existe le plus souvent cinq paires de mamelles : deux thoraciques, deux abdominales et une inguinale. Toutefois, on peut en trouver six paires, surtout dans les grandes races, et plus rarement quatre paires, les variations pouvant porter sur l’une ou l’autre des extrémités de la série. Elles forment deux rangées parallèles, étendues du thorax à la région prépubienne et dont la symétrie n’est pas toujours régulière. Il n’est pas rare de trouver une mamelle de plus d’un côté que de l’autre et la disposition devient alors souvent alternante (Barone, 1990).
2. Anatomie de l'appareil génital du chien
Le système génital mâle est formé de trois grandes parties : 1. Les testicules : qui forment la section glandulaire;
2. Les voies spermatiques stockent et transportent le sperme jusqu'au sinus uro-génital (section tubulaire);
3. L'urètre (section uro-génitale) conduit le sperme a l'extérieur du corps et compose avec ses annexes (annexes de l'urètre) une grande partie du pénis, organe copulateur mâle. Le pénis et le scrotum forment les organes génitaux externes.
Des glandes annexes, comme la prostate ou les glandes bulbo-urétrales, complètent cet ensemble (Anonyme 1).
6
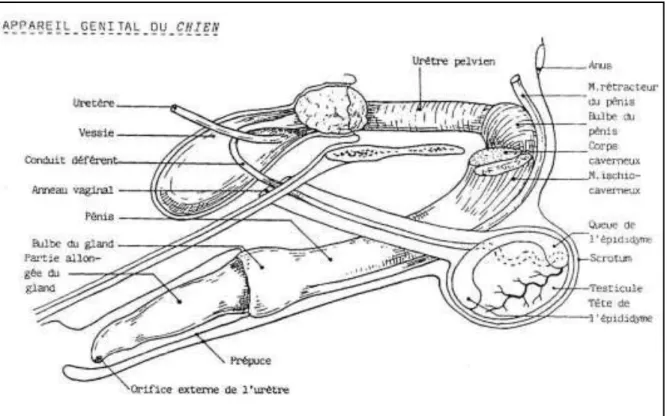
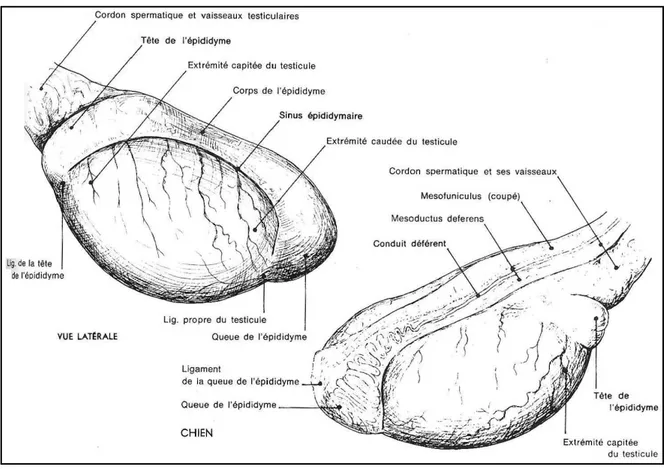
Figure 04 : Appareil génital du chien (Châtelain, 1995).
2.1 Les testicules
De forme ovoïde à sphérique, blanc rosé, le testicule est aplati latéro-latéralement. Il reçoit sur son bord dorsal l’épididyme et au niveau de l’extrémité capitée l’attache du cône vasculaire. Le testicule est uni par le ligament propre du testicule à la queue de l’épididyme qui elle-même est unie à la tunique vaginale par le ligament de la queue de l’épididyme (Collin, 2003).
Le tissu ou plutôt les tissus propres du testicule (que nous ne détaillerons pas) sont contenus dans la tunique albuginée qui est une membrane fibreuse épaisse logeant des divisions sinueuses des vaisseaux testiculaires (Collin, 2003).
Ces gonades fabriquent les spermatozoïdes ainsi que des hormones dont la testostérone est la principale. Chez le fœtus, les testicules sont situés dans l'abdomen, en arrière des reins. Ils migrent pour atteindre leur position définitive dans le scrotum vers l'âge de 7 semaines après la naissance. Au cours de la migration, les testicules franchissent la paroi abdominale (constituée du péritoine et des muscles abdominaux) au travers de brèches appelées anneaux inguinaux. Un chiot nouveau-né peut donc avoir des testicules intra-abdominaux ou scrotaux. A 42 jours, 97% des chiots ont leurs testicules en place mais ils peuvent descendre
7
spontanément jusqu'à l'âge de 6 mois. Le défaut de descente d'un ou des deux testicules se nomme l’ectopie testiculaire (ou cryptorchidie) (Landry, 2008).
Figure 05 : Anatomie du testicule de chien (Barone,2001).
2.2 Les voies de stockage et de transport du sperme
sont constituées, à droite comme à gauche, de l'épididyme, du conduit déférent ainsi que d’une partie de l'urètre. Les spermatozoïdes subissent une maturation pendant leur trajet dans l'épididyme puis ils sont stockés dans la partie terminale de celui-ci. Pendant la phase préliminaire de l'éjaculation, les spermatozoïdes sont chassés dans le conduit déférent qui s'abouche à l'urètre au niveau de la prostate.
Il y a donc une convergence des voies génitales et urinaires (Landry, 2008).
L'épididyme
Il s’agit du système de stockage et de maturation des spermatozoïdes qu’il reçoit des canalicules efférents au niveau de l’extrémité capitée du testicule (Barone, 2001).
8
Enfermé dans une tunique albuginée recouverte de séreuse, l’épididyme s’étend jusqu’à l’extrémité caudée. Il est classiquement divisé en trois parties : la tête, le corps et la queue de l’épididyme (Collin, 2003).
Le conduit déférent
Le conduit ou canal déférent s’étend de la queue de l’épididyme jusqu’à l’urètre ou il s’abouche au niveau de l’orifice éjaculateur. Pour ce faire, il longe l’épididyme puis remonte dans le cordon testiculaire. Après son passage dans l’anneau vaginal, il se dirige crânialement puis s’infléchit rapidement pour contourner le ligament latéral de la vessie afin de rejoindre l’urètre en traversant la prostate (Barone, 2001).
2.3 L'urètre
L’urètre est un long conduit qui fait communiquer la vessie et les voies spermatiques avec le milieu extérieur. Il sert à l’évacuation de l’urine et des produits génitaux. On lui reconnaît deux parties, une partie pelvienne puis une partie pénienne.
La partie pelvienne commence par l’ostium interne de l’urètre, juste caudalement à la vessie, et se prolonge jusqu’à l’arcade ischiatique où elle marque un léger rétrécissement, l’isthme de l’urètre. Cette partie est elle-même subdivisée en deux sous-parties : la partie prostatique, entourée par la prostate, et la partie membranacée. La partie pelvienne de l’urètre est séparée ventralement des muscles obturateurs internes et de la symphyse pelvienne par un abondant tissu conjonctivoadipeux le plus souvent. Elle traverse le diaphragme pelvien pour se prolonger par la partie pénienne.
La partie pénienne se continue au-delà du diaphragme pelvien dans le pénis et s’ouvre au milieu extérieur par l’ostium externe de l’urètre (Barone, 1990).
2.4 Le pénis
Le pénis, organe copulateur, est constitué de deux parties.
La première, proximale, est fixe. Elle s’attache au niveau de l’arcade ischiatique, passe entre le dartos droit et gauche pour finir au delà du scrotum.
La seconde, distale et mobile, peut être introduite dans les voies génitales femelles. Elle est située au niveau sous pubien et protégée au repos par un pli cutané : le prépuce (Barone, 2001).
9
Classiquement le pénis est subdivisé en trois: le corps du pénis et les deux extrémités, la racine et le gland.
Le prépuce, protégeant le gland, est une enveloppe cutanée élastique formée de deux lames tégumentaires séparées par un tissu conjonctif lâche et élastique (Barone, 2001).
Le gland comporte un os pénien au centre et deux bulbes érectiles qui forment des renflements à sa base. L’os pénien permet la pénétration du pénis dans le vagin alors que l'érection est incomplète. En cas de traumatisme (par exemple un accouplement violent), cet os pénien peut être fracturé. Cette fracture à fréquemment des conséquences désastreuses sur l'avenir reproducteur du chien (incapacité à saillir).
Les bulbes érectiles augmentent de volume pendant la phase d'accolement de l'accouplement, ce qui empêche la séparation des deux partenaires. Il est donc déconseillé de chercher à séparer deux chiens lors de l'accouplement (Landry, 2008).
10
Chapitre 2 : La tumeur vénérienne transmissible canine (TVTC)
1. Défénition
La tumeur vénérienne transmissible canine (TVTC), également connue sous le nom de sarcome de Sticker, est une tumeur transplantable, à transmission horizontale, dans l’espèce canine. Elle est, le plus souvent, transmise lors du coït par transmission de cellules néoplasiques de chien à chien et non pas par transformations de cellules chez l’hôte affecté. Des localisations cutanées et sous-cutanées, primaires et secondaires, de tumeurs vénériennes transmissibles sont régulièrement rapportée (Gurel et al., 2002).
2. Origine et répartition géographique
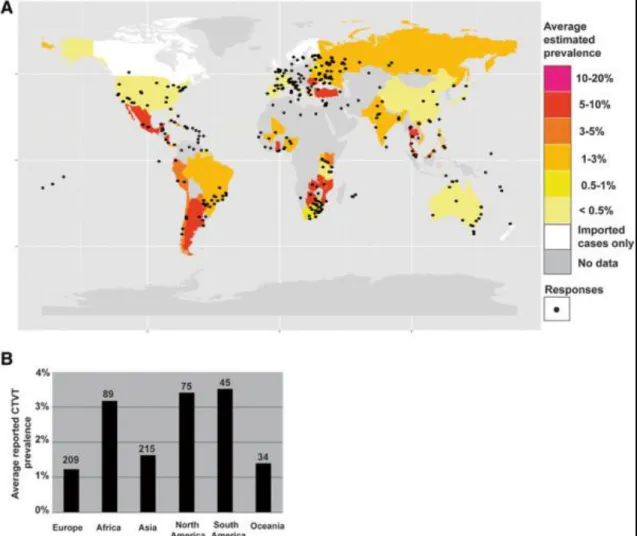
La tumeur vénérienne transmissible canine a pour la première fois été décrite en 1810 par un vétérinaire londonien. De nos jours, la fréquence du TVTC dans la population canine se situe entre 1 % et 10 % dans la plupart des pays d'Amérique du sud et centrale, de même que dans certains pays d’Afrique et d’Asie. Elle dépasse rarement les 10 %. La TVTC est endémique dans au moins 90 pays à travers le monde, notamment en région tropicale ou subtropicale (Amérique du sud, Afrique, Asie). Aux Bahamas, au Japon et en Inde, ce cancer représente la tumeur du chien la plus fréquente (Strakova et Murchison, 2014).
De plus, une carte distincte affiche l'estimation de la prévalence du TVTC. La prévalence moyenne déclarée par continent est présentée dans la figure 6B. La prévalence estimée la plus élevée du TVTC que nous avons enregistrée était au Belize, où la prévalence moyenne du TVTC était estimée entre 10 et 20%. Plusieurs pays (Canada, République tchèque, Finlande, Pays-Bas, Nouvelle-Zélande, Suède, Suisse et Royaume-Uni) ont été systématiquement déclarés comme indemnes de TVTC endémique; dans ces pays, les seuls cas de TVTC ont été spécifiquement signalés comme étant importés de l'étranger (voir la figure 6 A). La TVTC a été signalé comme absent de nombreuses régions des États-Unis et d'Australie, mais était présent dans les communautés autochtones éloignées, y compris les réserves indiennes de l'Arizona et du Dakota du Nord, ainsi que dans les communautés autochtones australiennes du Territoire du Nord et de l'Australie occidentale. Il y avait aussi une variation géographique dans la prévalence estimée du TVTC en Europe; la maladie a été signalée comme absente, sauf pour des cas importés occasionnels dans de nombreux pays d'Europe du Nord et de l'Ouest, mais elle a été estimée à moins de dix pour cent de prévalence dans les pays d'Europe du Sud et de l'Est (Strakova et Murchison, 2014).
11
Figure 06 : Prévalences estimées de la tumeur vénérienne transmissible canine dans le monde (STRAKOVA et MURCHISON, 2014).
3. Épidémiologie
La TVTC est une maladie naturelle strictement canine. Les femelles semblent plus fréquemment affectées que les mâles (64,5 % contre 35,5 % sur une série de plus de 500 cas) et 80 % des individus ont entre deux et huit ans (Boscos et Ververidis, 2004; Scarpelli et al., 2010).
Sa distribution est mondiale mais sa prévalence est supérieure dans les climats tempérés : les zones d’enzooties comprennent le sud des Etats Unis, l’Amérique Centrale et du Sud, certaines parties de l’Afrique, le Moyen Orient, l’Extrême Orient et l’Europe du Sud Est. Dans certaines régions, où la reproduction canine est peu contrôlée et où les chiens
(A) Distribution mondiale du CTVT par pays. La couleur de chaque pays représente la moyenne de
toutes les estimations de prévalence du CTVT obtenues dans ce pays. L'emplacement de chaque réponse est indiqué par un point noir. Les pays dont moins de trois réponses ont été reçues sont colorés en gris. Les ensembles de données complets sont inclus dans le fichier supplémentaire 6 et le fichier supplémentaire 7 . La carte a été créée à l'aide des packages maptools et ggmap , implémentés dans R. (B) Moyenne de la prévalence du CTVT rapportée par continent. Le nombre de réponses estimant la prévalence dans chaque continent est indiqué au-dessus de chaque barre.
12
errants sont en concentration importante (zones urbaines), le sarcome de Sticker est la tumeur canine la plus fréquente. Les précipitations importantes et la température annuelle moyenne sont corrélées positivement à la prevalence (Lorimier et fan, 2007).
Les sarcomes de Sticker des chiens possèdent un caryotype original et relativement constant de 59 chromosomes contrairement au caryotype normal canin de 78 chromosomes. Ceci est également vrai dans les lésions métastatiques ou après de nombreux passages in vivo ou in vitro (MacLachlan et Kennedy, 2002).
Une autre preuve d’une origine cellulaire commune toutes les tumeurs est la présence d’un réarrangement commun des oncogènes dans des tumeurs provenant de diverses origines géographiques (MacLachlan et Kennedy, 2002). La présence de ces anomalies, spécifiques et constantes, est en faveur d’un mode de transmission cellulaire(Lorimier et fan, 2007). Il a été
observé qu’un seul mâle atteint de TVTC pouvait s’accoupler et transmettre la maladie à 11 femelles sur 12, ce qui explique la prévalence plus élevée chez ces dernières (Karlson et Mann, 1952; Murchison, 2008).
4. Transmission
Le sarcome de Sticker est transmis de chien à chien à travers les barrières du complexe majeur d’histocompatibilité et via la transplantation de cellules tumorales sur des surfaces muqueuses endommagées, durant le rapport sexuel ou d’autres comportements sociaux tells que le reniflement ou le léchage. Ce mode de transmission, par allogreffe de la tumeur vénérienne transmissible est unique. Le comportement de cette tumeur a d’ailleurs été comparé à celui des parasites (Lorimier et fan, 2007).
Dans les conditions naturelles, la TVTC se transmet majoritairement via des muqueuses génitales. La famille des Canidés, à laquelle appartient le chien, est caractérisée par un accouplement très long avec, pendant l’érection, un blocage du pénis dans le vagin dont la durée peut atteindre 30 minutes. Cette particularité favorise les lésions de la muqueuse génitale qui semblent nécessaires à la transmission de la TVTC. À l’inverse, une barrière épithéliale intègre limite l’infection (Ganguly et al., 2016; Strakova et Murchison, 2015). À cela s’ajoute le fait que la transmission vénérienne ne semble pas exclusive car des cas de TVTC affectant primitivement la conjonctive, les muqueuses orale, nasale ou anale, les amygdales ou la peau ont été rapportés et ce, sans atteinte génitale (Mozos et al., 1996).
Les cellules tumorales sont, généralement, rondes et le sarcome de Sticker est suspecté d’être d’origine histiocytaire. Ceci est étayé par des réactions positives au lysosyme, l’alpha-1-antitrypsine, la vimentine et à l’immunomarquage spécifique des macrophages, et une absence
13
de coloration avec les immunocolorations spécifiques d’autres types cellulaires (MacLachlan et Kennedy, 2002).
Cohen, en 1973, a montré que le comportement de la tumeur était influencé par l’immunocompétence de l’individu. En effet, les tumeurs développées sur des chiens irradiés présentaient un taux de croissance plus élevé ainsi qu’une incidence plus élevée de métastases par rapport à des chiens non irradiés. Ces éléments ont montré, que le comportement de la TVTC et son développement étaient en lien étroit avec le système immunitaire de l’hôte, ce dernier ayant un rôle inhibiteur (Cohen, 1973).
Des études ont été établi par la mutation de la protéine p53 (codée par le gène TP53 (gène suppresseur de tumeur) et surnommée la « gardienne du génome », intervient dans la régulation du cycle cellulaire, de l’apoptose et de la sénescence. Le gène TP53 est fréquemment muté dans les cancers humains et les chercheurs se sont donc intéressés à ce gène dans le cadre de la TVTC. C’est ainsi qu’une mutation affectant TP53 (T964C) a été mise en évidence en 2002 dans le génome de TVTC en Asie (Choi et kim, 2002). Dans une autre étude (Mexique), cette mutation n’a pas été retrouvée alors que quatre nouvelles mutations ont été identifiées: C147G, A625G, A83G, A680G (Sánchez-Servín et al., 2009). La protéine p63, un membre de la famille de p53 qui joue un rôle dans l’induction de l’apoptose et dans l’arrêt du cycle cellulaire, est exprimée de façon plus importante dans la phase de régression de la tumeur. Cette découverte va ainsi dans le sens d’un pronostic favorable puisque la perte d’expression de cette protéine est en général en lien avec la progression d’une tumeur invasive avec présence de métastases (Stockmann et al., 2011).
Selon (BLOOM,1954), les tumeurs TVTC expérimentalement transférées ont trois phases de croissance distinctes, décrites comme progressives, stables et régressives. Les tumeurs deviennent généralement palpables 10 à 20 jours après le transfert éxperimental.
La phase progressive initiale, qui dure généralement quelques semaines, se caractérise par une augmentation rapide du volume tumoral avec un temps de doublement compris entre 4 et 7 jours et une perte estimée de 50% des cellules.
Au cours de la phase stable subséquente, il y a une croissance tumorale nettement plus lente avec un temps de doublement d'environ 20 jours et une perte de cellules estimée de 80 à 90% . Après la phase stable, qui peut durer de plusieurs semaines à des mois indéfiniment, jusqu'à 80% des tumeurs TVTC entrent dans une phase régressive au cours de laquelle la tumeur se rétrécit et finit par disparaître.
14
La phase régressive dure généralement entre 2 et 12 semaines, période au cours de laquelle des tumeurs atteignant 100 cm3 peuvent disparaître complètement.
Une régression spontanée de la tumeur peut survenir, probablement due à une réponse du système immunitaire. Les antécédents de TVTC d'origine naturelle sont moins bien compris. Bien qu'une phase progressive initiale et une phase stable subséquente puissent être observées, la régression spontanée n'a pas été bien documentée dans le TVTC naturel (Feldman, 1929).
5. Présentation Clinique
Les chiens atteints sont, fréquemment, de jeunes adultes non stérilisés, vivant dans un zone endémique ou ayant voyagé en zone endémique, et ayant eu des contacts sociaux avec des chiens de signalement similaire (Lorimier et fan, 2007).
Les organes génitaux externes représentent les sites de localisation primaire les plus communs. La présence de la tumeur se manifeste souvent par des signes d’inconfort chronique ou par des écoulements sanguinolents, par la vulve ou le fourreau, pendant des semaines ou des mois avant le diagnostic. Chez les chiennes, la tumeur est habituellement localisée caudalement dans le vagin ou dans le vestibule. Chez les mâles, la localisation classique se situe à la base du pénis et sa visualisation nécessite une rétraction caudale complète du fourreau (Lorimier et fan, 2007).
Si la tumeur se développe le plus souvent sur l’appareil genital externe, elle peut également
être implantée sur les muqueuses orales, nasales et conjonctivales, ou, moins communément, la peau (MacLachlan et Kennedy, 2002).
La tumeur peut se présenter sous la forme d’une masse unique ou sous celle de multiples nodules. Si la tumeur a été implantée dans une muqueuse, elle croît dans la sous-muqueuse et étire l’épithélium de couverture, qui peut être ulcéré. Une tumeur vénérienne transmissible peut devenir de grande taille au site primaire d’implantation (jusqu’à environ 10 centimètres de diamètre) et envahir les tissus adjacent (MacLachlan et Kennedy, 2002).
La masse, en forme de chou-fleur, est friable et vascularisée. Un signe clinique commun, indépendant du site de localisation de la tumeur, est un écoulement hémorragique. Les chiens, avec une localisation génitale, présentent un risque augmenté d’infection du tractus urinaire (Lorimier et fan, 2007).
Bien que d’importantes variations entre individus soient présentes :
Une phase de progression (phase P) durant laquelle la lésion tumorale s’étend jusqu’à recouvrir tous les organes génitaux externes;
15
Une phase de développement plus lente au cours de laquelle alternent des phases de croissance progressive et des phases de régression. Les rémissions complètes n’interviennent pas et les tumeurs persistent durant au moins 3-4 ans sans conséquence majeuresur l’état général de l’animal (Boscos et Ververidis, 2004).
La période de latence, pour le développement tumoral, est de 2 à 6 mois. La croissance est rapide en 1 ou 2 mois après lesquels de nombreuses tumeurs subissent une remission spontanée. Les tumeurs persistent rarement plus de 6 mois chez des animaux immunocompétents. La régression est suivie par une immunité de transplantation. Si la tumeur est présente depuis 6 mois ou plus, la régression sans thérapie est peu probable (MacLachlan et Kennedy, 2002).
De nombreuses études ont montré que diverses réponses immunes sont opérationnelles à
chaque étape de développement et de régression tumorale. Il semble donc rationnel qu’une immunosuppression soit un facteur de risque d’acquisition et de maintien de la tumeur et puisse mener à un potentiel de prolifération plus élevé (Lorimier et fan, 2007).
Quand elle affecte des animaux immunodéprimés ou des chiots, la tumeur vénérienne transmissible peut métastaser et sa régression spontanée est peu probable. De nombreux articles rapportent des cas de tumeur vénérienne transmissible métastasée et l’incidence des cas, avec dissémination à distance au moment du diagnostic, peut atteindre 17% (Lorimier et fan, 2007).Les sites primaires et de métastase sont les noeuds lymphatiques régionaux, la peau et le tissue sous-cutané, l’anus, le cerveau, les yeux, moins fréquemment les os, les reins, l’orbite, le foie, les poumons, la rate, les amygdales sont rapportés. Lors de métastase cutanée, les localisations rapportées sont fréquemment la region inguinale, la région abdominale ventrale, le thorax et la région cervicale ventra. Les sites primaires sont alors génitaux ou dans la cavité nasale (Lorimier et fan, 2007).
6. Caractéristique anatomo-pathologique
6.1. Caractéristiques macroscopiques
Les tumeurs sur les organes génitaux externes apparaissent initialement comme de petites papules hyperhémiques évoluant ensuite vers un nodule jusqu’à des stades où les tumeurs peuvent se présenter sous forme de masse lobulées. Les masses sont de consistance ferme mais friables avec de très fréquentes zones d’inflammation et d’ulcération superficielle associées à des saignements. La triade « chou-fleur/friable/saignement facile » peut ainsi être retenue comme un élément important du diagnostic clinique (Das et Das, 2000; Ganguly et al., 2016).
16
6.2. Caractéristiques cytologiques
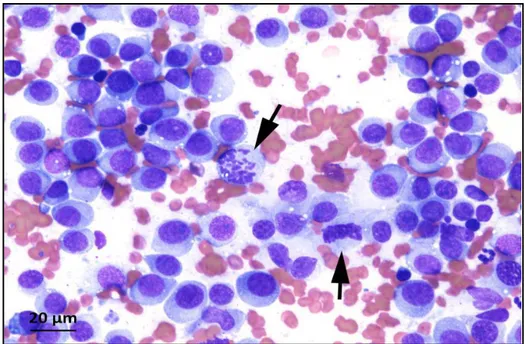
La cytologie se révèle être une technique parfaitement indiquée et contributive pour le diagnostic de TVTC. Elle est de plus peu onéreuse, facile à mettre en oeuvre et peu invasive. Les prélèvements sont généralement riches en matériel et comprennent des cellules rondes à ovales mesurant entre 14 et 30 μm avec des cytoplasmes bien délimités. Les noyaux sont ronds ou ovoïdes, souvent excentrés et de taille variable. La chromatine apparaît granuleuse et un à deux nucléoles basophiles de grande taille sont présents. Le rapport nucléocytoplasmique est légèrement inférieur à 1 et les figures de mitoses sont fréquentes. Le cytoplasme apparait basophile pâle, sans granulations, et contient souvent de petites vacuoles claires à contours nets, « à l’emporte-pièce » (figure 07). Dans les descriptions initiales, les cellules apparaissaient toutes identiques, peu importaient la localisation et le statut métastatique (Do Amaral et al., 2007; Duncan et Prasse, 1979).
Figure 07 : Aspect cytologique de la tumeur vénérienne transmissible canine (Laboratoire d'anatomo-cytopathologie, BioPôle Alfort, EnvA).
6.3. Caractéristiques histologiques
Histologiquement, la TVTC se caractérise par une prolifération en nappes de cellules rondes à polyédriques séparées par un stroma conjonctif contenant de fréquents lymphocytes, plasmocytes et macrophages. Les cellules tumorales sont en général disposées de façon radiale par rapport aux vaisseaux sanguins et lymphatiques. Elles présentent un rapport nucléocytoplasmique assez élevé avec un noyau rond et une chromatine organisée de façon variable : elle peut être poussiéreuse ou bien présenter des nucléoles bien définis. Le
17
cytoplasme est acidophile avec des limites mal définies et contient des vacuoles. Durant la phase de progression qui dure environ quatre à six mois, les cellules tumorales sont arrangées de façon relativement diffuse et de nombreuses figures de mitoses sont présentes. En début de phase de régression, les lymphocytes envahissent toute la tumeur ou peuvent être associés au stroma. En fin de phase de régression, un effondrement du parenchyme tumoral est observé. Il est associé à la présence de cellules apoptotiques et à un remplacement par un stroma fibreux (Das et Das, 2000 ; Mukaratirwa et al., 2004 ; Stockmann et al., 2011).
7. Diagnostic
Le diagnostic définitif est obtenu par examen cytologique ou examen histopathologique des cellules tumorales ou des tissus tumoraux. Les cellules sont, souvent, rondes et séparées, avec une apparence morphologique caractéristique à l’examen cytologique. Les tumeurs vénériennes transmissibles sont, donc, le plus souvent diagnostiquées avec certitude par cet examen, sans qu’un examen histopathologique soit nécessaire. La cytologie exfoliative met en évidence des cellules individualisées, rondes à ovales, avec un cytoplasme bleu pale abondant et un noyau excentré, présentant occasionnellement des binucléations ou des figures de mitose. Un ou plusieurs nucléoles peuvent être observés, entourés d’une chromatine dense. L’aspect le plus caractéristique de ces cellules est la présence de nombreuses vacuoles cytoplasmiques nettes (Lorimier et fan, 2007).
L'histopathologie peut être utilisée pour confirmer le diagnostic. Les cellules sont
organisées en plages ou en cordons. Le stroma fibrovasculaire est peu abondant en début d’évolution et devient plus important dans les tumeurs plus vieilles. Des lymphocytes et d’autres cellules inflammatoires infiltrent les tumeurs en phase de régression spontanée (Lorimier et fan, 2007).
L’immunohistochimie a permis de diagnostiquer des tumeurs vénériennes transmissibles
impliquant des sites métastatiques inhabituels(Lorimier et fan, 2007).
Des techniques de biologie moléculaire peuvent également se révéler intéressantes. La PCR, au travers de différentes études, s’est montrée un outil de choix du fait de sa sensibilité à identifier des cellules tumorales de TVTC. En effet, la recherche de la séquence LINE-MYC, c'est-à-dire le fragment inséré en 5’ du premier exon de l’oncogène MYC (élément caractéristique du génome cette tumeur) veut dire le réarrangéement de la séquence du gène LINE-MYC a été utilisée avec la polymérase réaction en chaîne (PCR) pour diagnostiquer TVTC) permet un diagnostic de certitude et peut être réalisée à partir d’une simple
18
cytoponction (Castro et al., 2016; Setthawongsin et al., 2016). Cette method est particulièrement utile lors de formes extra-génitales pour lesquelles la suspicion clinique peut être faible et le diagnostic différentiel anatomo-pathologique plus large.
8. Immunité
Des études immunologiques ont établi que la TVT est antigénique chez le chien car des anticorps spécifiques peuvent être mis en évidence dans la circulation ainsi qu'à la surface des cellules tumorales, et la réponse immunitaire contre la tumeur joue un rôle majeur dans la détermination de l'évolution de la maladie. Chez la plupart des chiens adultes, la tumeur régresse spontanément après une période de croissance logarithmique; après une régression complète, le développement de l'immunité tumorale empêche les occurrences successives. La régression spontanée est due à la formation d'immunoglobuline de type IgG dans le sérum des chiens après environ 40 jours de croissance tumorale. Les nouveau-nés issus de mères immunitaires sont plus résistants au développement de la tumeur et présentent une rémission plus rapide. En revanche, la tumeur évolue vers une ulcération et une métastase chez l'hôte immunologiquement incompétent ou compromis. Les lymphocytes de chiens chez lesquels la TVT a régressé sont cytotoxiques pour les cellules TVT; les sérums de ces chiens assurent la médiation de la cytotoxicité cellulaire dépendante des anticorps avec les lymphocytes normaux de chien sur les cellules TVT (Ganguly et al. 2016).
La TVTC a développé plusieurs mécanismes pour esquiver la réponse immunitaire de l'hôte. Les cellules tumorales régulent à la baisse l'expression de leurs gènes DLA qui codent pour des marqueurs qui identifient la cellule. Alors que l' expression de DLA de classe II est complètement inhibée, une certaine expression des gènes de DLA de classe I est autorisée jusqu'à 10%. Ceci est d'une importance stratégique pour que la tumeur échappe à l'immunité de l'hôte. Le masquage complet du DLA de classe I tend à activer l'activité des cellules tueuses naturelles; un faible niveau de fond d'expression de classe I empêche efficacement cette activation tout en rendant les cellules pratiquement invisibles pour le système immunitaire de l'hôte (Ganguly et al. 2016).
Les cellules TVTCT sécrètent également le facteur de croissance transformant (TGF)-β1 pour supprimer le système immunitaire de l'hôte. L'immunosuppression induite par le TGF-β1 est antagonisée par l'interleukine (IL)-6 et l'IL-15. Au cours de la régression
19
tumorale, l'IL-6 hôte, dérivée de lymphocytes infiltrant la tumeur, fonctionne en association avec l'interféron hôte (IFN)-γ pour restaurer l'expression du DLA (Ganguly et al. 2016).
9. Traitement et pronostic
Une partie des chiens présente une régression spontanée de la tumeur après un ou deux mois de croissance. Après deux mois, plus le temps de présence de la tumeur est long, moins les chances de régression spontanées sont grandes (Lorimier et fan, 2007).
9.1. Radiothérapie
La radiothérapie a également montré une efficacité dans le traitement du sarcome de Sticker. L’utilisation de la radiothérapie pour traiter les tumeurs vénériennes transmissible devrait être envisagée comme une alternative au traitement de chimiothérapie pour des lésions montrant une résistance aux agents systémiques ou localisées dans des sites sanctuaires (cerveau, testicules, yeux) (Lorimier et fan, 2007).
9.2.Chimiothérapie
Bien que de nombreux traitements aient montré leur efficacité dans le traitement de la tumeur vénérienne transmissible du chien, le traitement le plus décrit et avec les meilleurs résultats est une monochimiothérapie à base de vincristine (Lorimier et fan, 2007). La vincristine est généralement administrée à la dose de 0,5 à 0,75 mg/m2, par voie intraveineuse, une fois par semaine, pendant 3 à 8 injections. La doxorubicine, à la dose de 25 à 30 mg/m2, par voie intraveineuse tous les 21 jours pendant 3 cycles, a été utilisée avec succès sur des tumeurs montrant une résistance à la vincristine (Roger et al., 1998).
9.3. L'immunothérapie
L’immunothérapie peut constituer une option dans le traitement de la TVTC. Initialement, il s’agissait de transférer du sérum ou du sang total de chiens ayant présenté une rémission complète de la tumeur, dans le but d’obtenir un transfert d’immunité passive (Ganguly et al., 2016). Des études d'immunothérapie ont également été rapportées. Il y a rapports montrant que la forme généralisée de TVTC peut régresser après transfusion de sang total ou de sérum d'un animal récupéré ou après traitement avec un homogène de tumeur utilisé comme vaccin autocthonien. La biothérapie a malheureusement aussi entraîné un taux élevé de récidive .
20
9.4. L’exérèse chirurgicale
La chirurgie a été rapportée pour des tumeurs solitaires ou métastatique et peut être efficace, dans certains cas, mais des récidives se produisent dans 30 à 75% des cas. On suspecte que l’essaimage par les instruments chirurgicaux est en partie responsable du taux de récidive. Il s’agit donc d’une alternative thérapeutique peu intéressante (Rogers et al., 1998).
21
Chapitre 1: Matériels et méthodes
L’objectif de notre travail est de décrire les manifestations cliniques et l'aspect anatomopathologique d'un cas de tumeur vénérienne transmissible chez un chien. L’histologie a été utilisée pour la confirmation de la suspicion clinique et la mise en évidence des caractéristiques de la tumeur étudiée. Cette étude s’est étalée sur une période de 15 jours (01.03.2020 jusqu’au 12.03.2020).
1.1 Matériels
1.1.1. Lieu de l'expérimentation
Notre expérimentation a été déroulée au niveau de la clinique vétérinaire privé du docteur "Charif Toufik" et aux niveaux du laboratoire d'anatomie pathologique de l'hôpital principal de la wilaya de Bordj Bou Arréridj.
1.1.2. Animaux
Au cours de cette étude, nous avons enregistré un seul cas clinique présentant une tumeur au niveau de l'appareil génital. Il s'agit d'un chien mal de race Dogue argentin.
Photo 01 : Chien mal de race Dogue argentin
1.1.3. Matériels de chirurgie
Lame de Bistouri pour l’intervention chirurgicale;
Seringue de 5ml d’administration d’anesthésie et autre pour l’antibiotique; Aiguille pour la suture de la plaie chirurgicale;
22
Pince à préhension permettant le rapprochement des 2 lèvres de la plaie chirurgicale; Porte aguille;
Porte lame; Ciseaux;
Ciseaux a dissection;
Fil résorbable et non résorbable pour la suture; Des compresse de gaze;
Gants en latex; Stéthoscope; Thermomètre.
23
1.1.4. Produits pour la chirurgie
Kétamine; Xylocaine; Acépromazine pour anesthésier le chien.
Prémédication : Tous les animaux ont été prémédiqués au moyen d’acépromazine
(combistresse laboratoire KELLA) à raison de 4-10 mg pour chaque 10 kg de poids vif par voie intraveineuse.
Photos 03 : Tranquilisant (acépromazine) COMBISTRESS
Induction de l’anesthésie : Pour chaque animal, l’induction de l’anesthésie est réalisée au
moyen de Kétamine (IMALGENE 1000) a dose de 10mg/kg par voie intraveineuse.
Photos 04 : Anesthésique IMALGENE 1000
Antibiotiques pour éviter les surinfections.
24
1.1.5. Matériels d'histopathologie
Il est constitué de :
Pinces;
Porte-bloc;
Automates à déshydratation et inclusion;
Station d'enrobage;
Microtome de type rotatif;
Automate de coloration;
Platine;
Pipettes de 5 ml;
Lames et lamelles;
Etuve (pour séchage);
Cassettes;
Moules métalliques;
Crayon (pour numérotation des coupes);
Microscope optique.
1.1.6. Produits pour la confection des coupes histologiques
Ils comprennent : Eau courante; Formol à 10%; Alcools (à 85°, 95° et 100°); Xylène; Toluène; Paraffine; Albumine de MAYER; l'hématoxyline; l'éosine; Colle (EukittR ).
25
1.2. Méthodes
Notre étude s’est déroulée, du 1 Mars au 12 Mars 2020, s’est effectuée en deux étapes:
Enquête réalisée sur le terrain : cet étape consiste à la collecte de données sur les chiens présentant une tumeur de l'appareil génital. C'est aussi au cours de cette étape que le prélèvement d'une masse tumorale a été effectuée.
Analyse des prélèvements : Elle est réalisé aux niveau du laboratoire d'anatomie pathologique de l'hôpital de Bordj Bou Arreridj.
1.2.1. Examen clinique
1.2.1.1. Anamnèse et commémoratifs
Méthode de renseignement se basant sur un questionnaire vocabulaire, durant lequel le propriétaire répond à des questions ciblant des points spécifiques permettant d’orienter le diagnostic. Les principales questions ont porté sur l’âge, délai d’apparition de la tumeur, stérilisation, antécédents médicaux et maladies intercurrentes, et le traitement déjà reçu.
1.2.1.2. Examen clinique générale
C'est l’examen de routine effectué lors de chaque consultation, permettant d’évaluer les constantes de la triade à savoir fréquence respiratoire, fréquence cardiaque, température rectale, et vérification de la nature des muqueuses oculaire et buccale.
1.2.1.3. Examen spéciale de l'appareil génitale
Examen effectué sur la région de l'appareil présentant l'anomalie. Une palpation de la masse permet de mettre en évidence la structure, la taille, la consistance, la couleur, des ulcérations, une hyperthermie locale et de déceler une sensibilité ou une éventuelle douleur, et d’apprécier l’adhérence aux tissus avoisinants et les adénopathies.
1.2.1.4. Exérèse des masses tumorales
Les principales étapes de l’intervention chirurgical est le suivant :
Chien sous anesthésie générale, en décubitus dorsale, membres postérieures en extension et fixés à la table,
26
Photo 05 : Chien en décubitus latéral
Extériorisation du pénis et désinfection du champ par la Bétadine,
27
Exérèse minutieusedes parties exophytique (Tumeurs superficielles)
Photo 07: Exérèse minutieuse
Contrôle de l’hémostase à l'aide des pinces hémostatiques.
28 Cautérisation électrique
Photo 09: Cautérisation électrique (flèche)
1.2.2. Réalisation des prélèvements
Pour l’analyse histopathologique, les pièces opératoires prélevées était immédiatement placés dans une solution de formol à 10%, dans un pot à prélèvement.
29
1.2.3. Acheminement et conservation des prélèvements
La tumeur prélevé a été identifiée et fixée dans du formol à 10%. Elle est transportée vers le laboratoire d'anatomie pathologique de l'hôpital "Bouzidi Lakhdar". Ce dernier est le principale hôpital de la wilaya de Bordj Bou Arréridj.
1.2.4. Analyses de laboratoire : Examen histopathologique
Cet examen est basé sur la technique histologique classique à l’Hémalum-éosine. La confection des coupes histologiques obéit aux différentes étapes de techniques histologiques de routine quoi sont :
Enregistrement des prélèvements ;
Méthode de recoupe et de fixation des prélèvements ; Techniques d’inclusion en paraffine ;
Technique de coulage en blocs de paraffine ;
Technique de coupes et étalement sur lame porte-objet ; Technique de montage et de coloration à l’Hémalum-Eosine ; Montage des lames et lamelles au Eukit ;
Observation au microscope (lecture et interprétation).
1.4.2.1. Enregistrement des prélèvements
Le prélèvements est inscrit dans un registre et pourvus d’un numéro d’ordre. Ce dernier sera reporté sur la cassette et la lame correspondante.
1.4.2.2. Recoupe et de fixation des prélèvements
La tumeur prélevée a été placés dans un volume de fixateur équivalent à 10 fois le volume de la pièce : du formol 10%. Ella a été laissé en place dans le liquide fixateur au minimum pendant 48 heures. Les pièces sont recoupés en de petits fragments de 2 à 3 cm, ils sont placées ensuite dans des cassettes perforées, en plastique afin de faciliter la circulation des liquides et assurer un drainage correct au cours des étapes d’imprégnation dans un automate.
30
Photo 11: (A) Recoupe de la tumeur et (B) placement des frayements dans une cassette
1.4.2.3. Inclusion en paraffine (circulation)
L’imprégnation repose sur la substitution de l’eau qui est dans les tissus par la paraffine.
La post-fixation permet le passage des fixateurs aqueux aux alcools. Elle correspond à un bain fixateur formolé (formol tamponné).
La déshydratation consiste à débarrasser le tissu de l’eau qu’il contient. Elle se fait par le passage dans des bains d’éthanol de concentration croissante jusqu’à l’éthanol absolu.
La substitution consiste à remplacer l’éthanol par un solvant xylène. Ce dernier est miscible à la fois au déshydratant et à l’agent d’inclusion.
L’imprégnation correspond à la substitution du solvant par la paraffine. Cette étape terminale est relativement agressive car la paraffine n’est liquide qu’à partir de 58ºC et à cette température les protéines sont altérées.
À la fin du cycle, les paniers contenant les cassettes se trouvent dans un bain de paraffine chaude (liquide). L’ensemble de la circulation a été réalisée à l’aide d’un automate.
31
Photo 12: Automates à déshydratation et inclusion.
1.4.2.4. Technique d'enrobage en blocs de paraffine
Pour la réalisation des blocs (enrobage), les pièces ont été retirés des cassettes et
déposés à l’aide d’une pince dans des moules métalliques préalablement chauffés, et le tout recouvert de paraffine liquide. Les moules ont ensuite été placés sur une plaque réfrigérante à - 4°C afin d’obtenir un durcissement de la paraffine. Une fois la paraffine devient solide, les blocs ont été démoulés.
32
1.4.2.5. Technique de coupe et étalement sur lame porte-objet :
La microtomie a pour but d’obtenir des rubans de qualité très fins de 2 à 5μm
(micron). Cette épaisseur permet aux rayons lumineux du microscope de traverser la préparation et d’éviter les superpositions tissulaires.
Photo 14 : Microtome
Les tissus inclus en paraffine sont très comprimés pendant la coupe. Afin d’atténuer cette compression et d’enlever du tissu les plis, il faut procéder au ramollissement de la paraffine sous l’action de la chaleur. L’étalement des coupes est effectué sur une platine chauffante. La gélatine permet une meilleure adhérence des coupes sur les lames de verre.
33
1.4.2.6. Préparatoires à la coloration
Pour faciliter l’adhérence des coupes sur la lame de verre avant l’étape de déparaffinage, les lames sont placées dans une étuve ventilée à 58ºC pendant 1 heure. Cette étape permet élimination (par évaporation) de la pellicule d’eau qui se trouve entre la coupe et la lame.
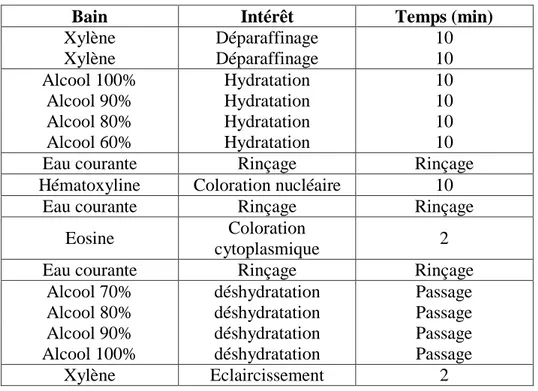
Les coupes ainsi obtenues ont été colorées à l’Hématoxyline éosine (Photo 17) selon le protocole présenté dans le tableau I.
Photo 17: Automate de coloration Photo 16 : Etuve
34
Tableau I : Protocole de coloration à l’hématoxyline éosine
Bain Intérêt Temps (min)
Xylène Déparaffinage 10 Xylène Déparaffinage 10 Alcool 100% Hydratation 10 Alcool 90% Hydratation 10 Alcool 80% Hydratation 10 Alcool 60% Hydratation 10
Eau courante Rinçage Rinçage
Hématoxyline Coloration nucléaire 10
Eau courante Rinçage Rinçage
Eosine Coloration
cytoplasmique 2
Eau courante Rinçage Rinçage
Alcool 70% déshydratation Passage
Alcool 80% déshydratation Passage
Alcool 90% déshydratation Passage
Alcool 100% déshydratation Passage
Xylène Eclaircissement 2
1.4.2.7. Montage des lames et des lamelles
Cette opération consiste à fixer à l’aide d’une résine synthétique une lamelle couvre-objet sur la coupe afin de la protéger de la dégradation chimique des colorants qui s’oxydent à l’air et des bris mécaniques. En fin les coupes sont observées par la suite à l'aide d'un microscope optique.
1.4.2.8. Observation des coupes histologiques
Les lames sont examinées au microscope optique à différents objectifs. Tout d’abord aux faibles grossissements (objectif 4 et 10) pour apprécier l’architecture de la tumeur, puis aux forts grossissements (objectifs 40 et 100), afin de mieux observer la forme du noyau et du nucléole.
35
Chapitre 2: Résultats et discussion
2.1 Résultats
2.1.1. Recueil des commémoratifs 2.1.1.1. Concernent l’animal
D'après les réponses du propriétaire aux questions du vétérinaire on a collecté les informations suivantes (le tableau II) :
Tableau II : Commémoratifs
Nom de l’animal /
Age 6 ans
Espèce Canine
Race Dog Argentin
Robe Blanc
Castration Non
Vaccination Effectuée
2.1.1.2. Examen clinique générale
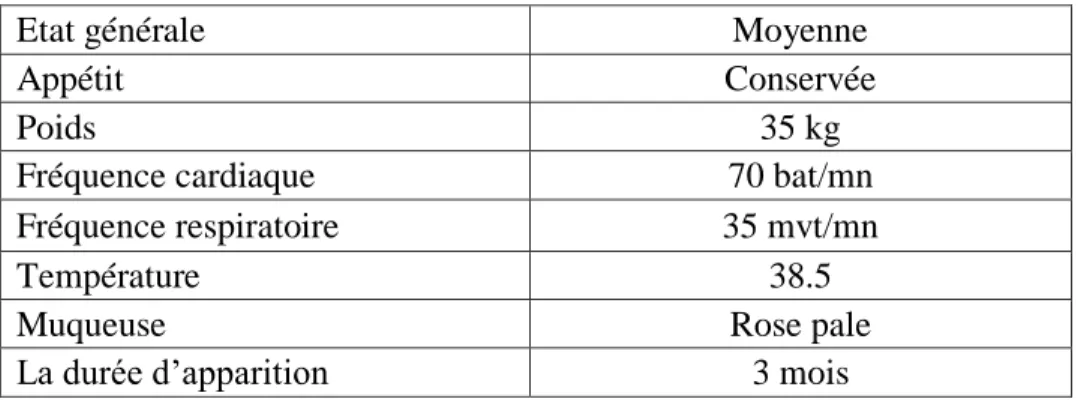
Au cours de l'examen clinique générale du chien réalisé par le vétérinaire on a enregistré les paramètres physiologiques suivants (tableau III):
Tableau III : Résultat de l'examen général du chien
Etat générale Moyenne
Appétit Conservée
Poids 35 kg
Fréquence cardiaque 70 bat/mn
Fréquence respiratoire 35 mvt/mn
Température 38.5
Muqueuse Rose pale
La durée d’apparition 3 mois
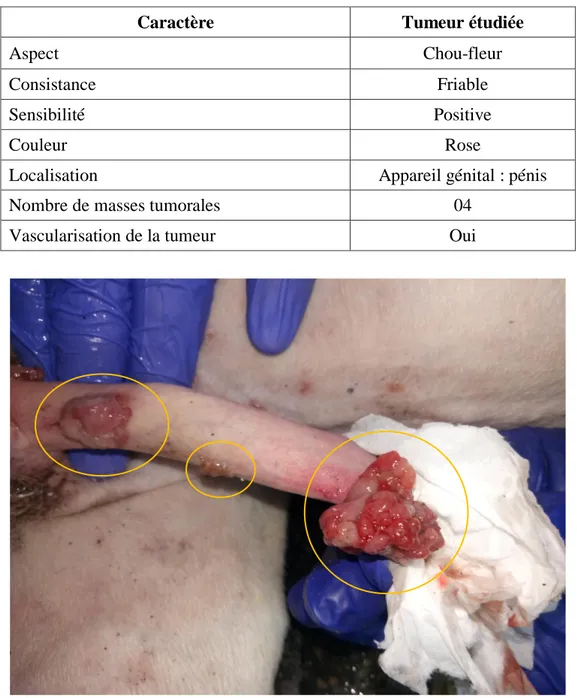
2.1.1.3. Aspect macroscopique de la tumeur
L'examen clinique spécial du chien a montré la présence des masses tumorales multiples. 04 masses tumorales ont été observées au niveau de l'appareil génital. Les tumeurs ont une forme de chou-fleur mesurant de 1 à 3 cm de diamètre (Photo 19). Ces masses sont
36
dconsistance friables et se saignent facilement au contact. Elles sont très vascularisées (Photo 20).
La plus grande masse tumorale (3 cm) est observé sur la partie distale du pénis (sur le gland). Elle a obstrué l'orifice externe de l'urètre. Le chien a présenté des difficultés et des douleurs lors de la miction. Les autres masses tumorales ont été situés en région proximale du pénis (2 masses) et sur le corps du pénis (une seule masse).
Les principaux résultats de l'examen spéciale sont présentés dans le tableau IV :
Tableau IV : Caractéristique de la tumeur
Caractère Tumeur étudiée
Aspect Chou-fleur
Consistance Friable
Sensibilité Positive
Couleur Rose
Localisation Appareil génital : pénis
Nombre de masses tumorales 04
Vascularisation de la tumeur Oui
37
Photo 20 : Tumeur très vascularisée
2.1.2. Résultat de l'intervention chirurgical
Une exérèse chirurgicale superficielle a été effectué. Les masses tumorales péniennes ont été retirées sans affecté l'intégrité des tissus du pénis. Une cautérisation a l'aide d'un cautérisateur électrique a été appliqué pour éliminé toute les cellules tumorales et pour arrêté le saignement.
38
2.1.3. Observation microscopiques des lames histologiques
L'examen histologique a montré des cellules rondes, plus ou moins homogènes, à noyau hyperchromatique et à cytoplasme relativement faible. L’index mitotique est élevé, le stroma est grêle et bien vascularisé. Les cellules tumorales forment des amas avec présence par endroit de cellules lymphoïdes. Le stroma fibrovasculaire est peu abondant (Photo 22).
Photo 22 : Aspect histologique du sarcome de Sticker chez un Dog argentian (HE x100)
39
Photo 23 : Cellules présentant un noyau rond (flèche noir) et un cytoplasme basophile et vacuolé (flèche rouge), stroma peu abondant (flèche jaune) (HE x400)