HAL Id: hal-02799219
https://hal.inrae.fr/hal-02799219
Submitted on 5 Jun 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Observation du fonctionnement de l’Unité de
Recherches Zootechniques de L’INRA de Guadeloupe
Claire Berel
To cite this version:
Claire Berel. Observation du fonctionnement de l’Unité de Recherches Zootechniques de L’INRA de Guadeloupe. [Stage] Ecole Polytechnique de l’Université de Tours (Polytech Tours), FRA. 2016, 12 p. �hal-02799219�
Mai à Juin 2016
Rapport de stage
Observation du fonctionnement de
l’Unité de Recherches
Zootechniques de L’INRA de
Guadeloupe
Claire Bérel
UNIVERSITE DE TOURSTUTEUR DE STAGE : PEINEAU NICOLAS TUTEUR INRA : MARIE-MAGDELEINE CARINE
1
Table des matières
I. Remerciement ... 2
II. Introduction ... 2
III. Présentation de l’Unité de Recherches Zootechniques ... 2
A. Généralités ... 2
B. L’équipe ... 2
C. La réglementation et la sécurité en laboratoire ... 3
D. La journée du développement durable : activité transversale au sein d’une entreprise ... 3
IV. Les activités de recherches de l’URZ ... 3
A. La valorisation des tanins condensés de plantes ... 3
1. Les objectifs de cette étude ... 3
2. Les protocoles mis en place... 4
a) Le dosage des tanins condensés ... 4
b) L’extraction d’un acide aminé, la mimosine ... 5
c) Le test de dégainement ... 6
B. L’augmentation de la capacité immunitaire des caprins ... 6
1. Les objectifs de cette étude ... 6
2. Le protocole général ... 6
a) Description ... 6
b) Le cycle du nématode Haemonchus contortus ... 7
3. Les modes opératoires observés ... 7
a) Coproscopie ... 7
b) Mesure de l’Hématocrite ... 8
c) Comptage des leucocytes éosinophiles chez les ruminants ... 9
d) Détermination de la concentration en pepsinogène ... 10
e) Dosage de l’azote avec un analyseur élémentaire ... 10
C. Le traitement des données expérimentales ... 11
V. Bilan personnel ... 11
2
I.
Remerciement
Je remercie toute l’équipe et le personnel de l’INRA de Guadeloupe pour son accueil. Je remercie particulièrement Madame Carine Marie-Magdeleine pour avoir accepté d’être mon maître de stage, pour ses conseils dans la rédaction de ce rapport et pour son attention. Je remercie toute l’équipe du laboratoire avec qui j’ai travaillé pendant un mois et qui m’a fait confiance : Suzitte Calif, Dalila Feuillet, Yohan Félicité, Lucien Philibert, Tatiana Silou-Etienne. Je remercie également Monsieur Bambou et Monsieur Maurice Mahieu. Je remercie les stagiaires avec qui j’ai travaillé et discuté : Steve, Célia, Anaïs, Clériana, Yoan.
II.
Introduction
Ce stage, d’une durée d’un mois, se déroule à l’INRA de Guadeloupe, dans l’unité de Recherches de Zootechnique. Plusieurs objectifs ont motivé ma demande de stage. Je veux connaître l’organisation d’une entreprise faisant de la recherche appliquée. Je souhaite travailler dans l’agronomie. L’INRA, Institut National de Recherche Agronomique, est donc l’entreprise idéale. Ma troisième année de licence se passant en ERASMUS, ce stage me permet de m’orienter entre un Master Recherche ou un Master Professionnel. De plus, la découverte du fonctionnement d’un laboratoire me semble importante. Techniciens de laboratoire et chercheurs travaillent sur un même projet. Connaître ces deux métiers et la coopération qu’il peut y avoir me semblent essentiel. Enfin, découvrir de nouveaux modes opératoires en dehors du cadre universitaire m’attire. Je souhaite voir les applications concrètes des manipulations menées.
Premièrement, je vais présenter l’Unité de Recherches de Zootechniques (URZ). Le fonctionnement d’une unité INRA est particulier, je vais donc poser le cadre dans lequel mon stage s’est déroulé. Deuxièmement, j’ai choisis de décrire deux activités de recherche : la valorisation des tanins condensés des plantes et l’effet de la qualité des protéines sur la résistance des caprins. J’ai, en effet, assisté et participé aux protocoles menés sur ces sujets.
III. Présentation de l’Unité de Recherches Zootechniques
A.
Généralités
L’unité de Recherches de Zootechniques de Guadeloupe se situe au Domaine Duclos. Elle appartient au Département Génétique Animale du Centre INRA Antilles-Guyane. Son objectif principal est l’amélioration des productions animales en zone tropicale humide (d’après le Conseil Scientifique URZ et UE PTEA, 9-11 novembre 2015). Ces recherches et leurs applications concernent donc la Guadeloupe, la Martinique mais aussi plus généralement la zone Caraïbe.
B.
L’équipe
Il y a 3 équipes de recherches à l’URZ. L’unité de Recherches Zootechniques est donc pluridisciplinaire. La première équipe travaille sur l’adaptation et la résilience des animaux pour les systèmes d’élevage tropicaux durables. La deuxième étudie l’optimisation de fonctions en vue de l’efficience des systèmes d’élevage tropicaux et enfin la troisième équipe cible la valorisation des savoirs, les expertises et l’innovation.
Le laboratoire s’occupe de toutes les manipulations de contrôle et la mise en application de protocoles de recherche. Il est constitué de 5 techniciens de laboratoire et d’une responsable.
3 Une zone d’élevage existe aussi sur ce site. On y conduit les expérimentations. Une vingtaine de personnes travaille sur cette Plateforme Tropicale d’Expérimentation sur l’Animal (PTEA) avec un troupeau de cabris créoles et un troupeau de porcs.
C.
La réglementation et la sécurité en laboratoire
L’organisation d’un laboratoire de recherche est réglementée. Par sécurité, le port de la blouse est obligatoire. En cas de manipulation de produits dangereux il est nécessaire de porter des chaussures fermées ainsi que des gants nitriles pour les manipulations en chimie. Les gants en latex sont utilisés pour toutes autres manipulations. La Guadeloupe étant une île à risque sismique et cyclonique, il y a des consignes d’évacuation spécifiques en plus des règles basiques. Le matériel est nettoyé et rangé à chaque fin de manipulation. Il pourra ainsi être réutilisé directement ou après rinçage à l’eau, eau distillée ou éthanol. Des poubelles spécifiques sont mises à disposition : bouteilles de déchets azotés, poubelles spécifiques pour le matériel étant souillé par du sang, poubelles pour gants…. Aucuns produits chimiques toxiques ne doivent être déversés dans les éviers.
D.
La journée du développement durable : activité transversale au sein
d’une entreprise
Dans une entreprise, les salariés peuvent avoir plusieurs fonctions. Suzitte Calif est technicienne de laboratoire en chimie mais elle a aussi une fonction transversale reconnue dans l’unité. Elle coordonne l’atelier jardin partagé et la gestion du recyclage des déchets du laboratoire. Elle fait donc partie de la Commission développement durable. Durant la journée du développement durable, nous avons fait une randonnée organisée autour des grands arbres remarquables aux abords du centre de l‘INRA. Des panneaux sont disposés tout au long du parcours. Ils renseignent sur le nom créole, scientifique de l’arbre ainsi que sur la famille à laquelle il appartient. Cela permettra au personnel ainsi qu’aux randonneurs de reconnaitre les arbres de leur île. Deux personnes de l’ONF (Office National des Forêts) ont participé à la détermination des arbres. Nous avons également découvert le jardin partagé, mis en place par plusieurs personnes travaillant au Centre. Chacun peut, dans ce jardin, cultiver et partager son savoir sur des plantes.
IV. Les activités de recherches de l’URZ
A.
La valorisation des tanins condensés de plantes
1.
Les objectifs de cette étude
Les tanins sont des métabolites secondaires des plantes. Ils servent à la défense de la plante et ont un potentiel thérapeutique. Depuis 2010, l’URZ étudie les tanins condensés plutôt que les tanins hydrolysables. En effet, les plantes riches en protéines et donc bénéfiques pour les animaux contiennent plus de tanins condensés. Les tanins ont un effet indirect sur la protection des protéines by pass pour leur passage dans l’intestin. Ils les protègent des attaques bactériennes. Les protéines assimilées pourront servir à la fabrication des muscles, à l’immunité etc. De plus, les tanins ont un effet ciblé sur les stades de développement et le dégainement des larves d’Haemonchus contortus. Après une étude des tanins sur tous les stades du nématode on a pu voir que :
- Les tanins bloquent le développement des larves L1 et L2 ;
- ils ont un effet sur le dégainement des larves L3 dans la caillette ;
- ils ont aussi un effet sur la mobilité de ces larves ;
4 Les effets des tanins sont différents selon la plante utilisée. Il y a donc différents types de tanins selon les plantes. Les tanins sont des molécules complexes, des polymères. Une partie de l’étude cherche à caractériser ces tanins condensés, à connaitre leur composition finale. Des manipulations par chromatographie sur couche mince (CCM) ou liquide sont alors nécessaires. Une thiolyse permet d’identifier chaque monomère de la molécule. Le but final est de déterminer quel tanin agit particulièrement sur Haemonchus contortus. L’URZ travaille maintenant sur des extraits de tanins purifiés (vérifiés grâce à des inhibiteurs tels que le PEG, Polyéthylène Glycol).
Les plantes utilisées sont choisies pour être accessibles aux éleveurs si une solution est proposée. L’équipe travaille donc sur la leucène (Lucaena leucocephala), les pois d’angole (Cajanus cajan) et le manioc (Manihot esculenta).
2.
Les protocoles mis en place
a) Le dosage des tanins condensés
Les tanins condensés peuvent s’extraire avec de la vanilline. Elle réagit avec les complexes monomères catéchiques. Le complexe devient alors visible au spectrophotomètre.
Pour ce mode opératoire il faut préparer les solutions, les gammes des différents échantillons à différentes concentrations. Il est nécessaire d’extraire les tanins libres et faire préparer le filtrat. Il faut alors dépigmenter, faire évaporer le solvant et diluer la solution obtenue. L’évaporation du solvant se fait grâce au MIVAC. Cet appareil est utilisé pour condenser les tanins. C’est une centrifuge couplée à un appareil à faire du vide. A la sortie du MIVAC on a donc un extrait aqueux contenant les tanins. On dilue alors les extraits à différentes concentrations. On utilise un spectrophotomètre à aspiration car on a mis nos tanins et nos gammes dans de l’acide. A chaque gamme, il faut faire le blanc de l’appareil.
Les densités optiques sont alors utilisées pour connaitre la quantité de tanins condensés dans l’échantillon. Ce mode opératoire est long et incertain. Il n’a pas encore été validé.
5 Figure : MIVAC (C. Bérel)
b) L’extraction d’un acide aminé, la mimosine
J’ai assisté au premier essai de mise en place d’un protocole pour extraire un acide aminé de la plante Leucaena. La mimosine est un acide aminé non protéique. On voudrait l’enlever des aliments car à forte dose elle semble être toxique et elle n’est pas utile à l’animal. Nous avons chauffé les extraits, nous les avons filtrés difficilement car la solution est gluante. J’ai pesé la résine de synthèse, l’Amberlite qui capte la mimosine. Cette résine est un échangeur de cation. Nous avons recommencé ce procédé en essayant d’être plus fidèle à l’article sur lequel nous nous appuyons.
L’équipe du laboratoire pèse toujours la matière sèche et la matière fraîche des échantillons analysés. Il y a deux méthodes pour peser la matière sèche : une méthode classique et longue ou une méthode rapide. Les échantillons sont pesés dans une capsule en porcelaine puis mis à l’étuve pendant une nuit et passés four pendant 6 heures pour avoir la matière minérale. Dans l’étuve on utilise un tube rempli d’eau comme témoin. On place ensuite l’échantillon dans un dessiccateur sous vide et avec de la silice contre l’humidité. Cette technique est faite en Guadeloupe car c’est une région très humide et ce gain en eau peut fausser les données. Avec la méthode rapide, une balance avec étuve (humidimètre) fait le %R, c’est-à-dire l’humidité résiduelle.
6
c) Le test de dégainement
Le but de ce protocole est de montrer quels aliments à base de plantes peuvent lutter contre le développement parasitaire. Les tanins semblent avoir un effet sur le dégainage des larves au stade larvaire L3.
On agite pendant 3h les tubes avec les larves et les tanins. Plus tard, on ajoute de la Javel qui active le dégainage des larves. En présence des tanins, les larves devront rester gainées. On compte alors le nombre de larves gainées ou pas, suivant leur stade sur une plaque de comptage.
Je n’ai pas assisté à ce mode opératoire mais j’ai pu observer les larves gainées ou dégainées et suivant leur stade sur lame.
B.
L’augmentation de la capacité immunitaire des caprins
1.
Les objectifs de cette étude
L’étude de Mr Harry Archimède et de Mr Jean-Christophe Bambou est mise en place par Steve Ceriac. Elle porte sur les effets de la qualité des protéines sur la résistance et/ou résilience de caprins créoles aux nématodes gastro-intestinaux. Le protocole expérimental n’est pas encore finalisé. La résistance est la capacité à limiter le nombre de parasites hébergés ou leur taux de reproduction. La résilience ou tolérance permet à l’hôte de compenser la présence de parasites (par la nutrition…) et de continuer à produire.
Cette mission a pour but de trouver une solution aux traitements systématiques et chimiques des petits ruminants contre les nématodes gastro-intestinaux (NGI). En effet, une résistance a été observée et la mortalité des petits ruminants est trop élevée pour un mode de production agricole.
Les ruminants sont plus sensibles aux NGI à deux stades de leur développement : avant le sevrage et les mères en parturition. Ces animaux ont un système immunitaire plus fragile qu’au stade adulte. L’un est immature et l’autre est moins efficace pour permettre la mise bas. On observe une augmentation du nombre d’œufs de parasites dans les fèces des cabris. On peut augmenter la résistance des animaux en jouant sur deux facteurs. Le premier est facteur génétique, on sélectionne une lignée résistante de cabris. Le deuxième facteur est alimentaire, une meilleure nutrition diminue les carences en énergie et en protéine qui augmentent la sensibilité des animaux.
Cette étude étudie ces deux aspects. Une étude préalable a été menée et nous donne qu’avec une alimentation complémentée en pellette à 12% de protéines, un grammage de 200g est aussi efficace qu’un grammage de 300g de concentré. Les rations de complément ne dépasseront donc pas ce poids.
2.
Le protocole général
a) Description
L’expérimentation dure environ 4 mois et se fait sur 48 caprins mâles. Les animaux sont séparés en deux groupes, dont les animaux infestés artificiellement le seront à une semaine d’intervalle. Les animaux sont traités avant le début de l’expérience. Les cabris sont séparés dans des loges individuelles. Ils sont également munis de sac pour récolter leurs fèces. Les animaux sont infestés selon leurs poids.
La forme granulée pour les compléments alimentaires a été retenue car elle est facilement conservable et sa distribution est simple. Il faut, en parallèle, évaluer si les protéines et les tanins des plantes sont dénaturés ou non.
7 Plusieurs analyses sont faites au cours de ce protocole pour déterminer le niveau de l’infestation des animaux et son impact sur leur physiologie. On observera ainsi les résultats des coproscopies, des analyses sanguines, du dosage des éosinophiles, de la mesure de l’hématocrite, de la concentration en pepsinogène du sang et du dosage en azote des aliments, fèces et urine.
Les récoltes des fèces et de l’urine se font tous les jours. Les refus de foin de la semaine sont cumulés. Le poids total et par jour est noté et des échantillons sont prélevés.
b) Le cycle du nématode Haemonchus contortus
Le nématode Haemonchus contortus est un parasite gastro-intestinal. Il est très présent en zone tropicale (100% de prévalence) et il est nuisible dans les élevages des petits ruminants.
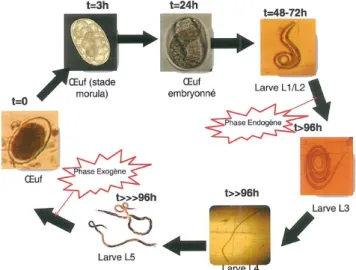
Le nématode est au stade adulte dans la caillette de l’animal. Il est hématophage. Il conduit donc à une anémie de l’animal qui peut être mortelle. L’adulte pond ses œufs dans les intestins et ces œufs sont émis vers l’extérieur dans les fèces. Les larves L1 et L2 se développent dans les fèces. Elles passent au stade L3 en allant à l’extérieur. C’est le stade infestant. Les larves sont alors dans l’herbe et les ruminants peuvent les ingérer. Les larves infestantes ne se nourrissent pas. Elles ont une gaine et s’en libère dans l’animal. Si les conditions sont défavorables, les larves se bloquent en L4. C’est l’hypobiose. Il y a alors une modification des synthèses protéiques et de l’expression de certains gènes. Il n’y a pas de stade L5 (erreur dans la figure ci-dessous) car les nématodes deviennent alors adultes. Les parasites peuvent pondre dès le stade L3, c’est la période prépatante.
Figure : Cycle du parasite gastro-intestinal Heamonchus contortus
3.
Les modes opératoires observés
a) Coproscopie
Cette technique permet de compter le nombre d’œufs par gramme de fèces (OPG). On peut alors observer la ponte du parasite Haemonchus contortus et le stade de l’infestation de l’animal.
Les fèces sont récoltées à l’élevage, pesés et mis dans de l’eau dans un tube Falcon identifié. On les met une nuit dans la chambre froide à agiter. Cela permet de déliter les fèces. La conservation au froid permet d’éviter le développement des œufs en larves. Le lendemain on les agite au vortex et à la centrifugeuse. On centrifuge les tubes à 2800 tours/min pendant 15 minutes à 4°C. A chaque utilisation de la centrifugeuse il faut équilibrer les portoirs. On peut les équilibrer en ajoutant de l’eau dans les portoirs. On vide ensuite le surnageant, l’eau. On le remplace par une solution concentrée en NaCl à la zipette (35 mL) pour faire flotter les œufs. On agite pour homogénéiser à
8 l’aide du vortex puis on replace les tubes à la centrifugeuse. On récupère le surnageant dans un bécher et on peut prélever le liquide à placer sous une lame McMaster pour observation grâce à une pipette.
Il faut alors compter les œufs d’Haemonchus contortus. On observe au grossissement 10X4 ou 10X10. On dénombre les œufs à l’aide d’un compteur manuel. Deux réseaux sont lus. Quand sur les deux réseaux, il y a moins d’une dizaine d’œufs, on compte les œufs du champ total. On peut aussi repérer un autre type d’œufs : les coccidies. On consigne les résultats dans un cahier référençant les échantillons. La lame McMaster a un volume en solution connue. On peut donc déterminer le nombre d’œufs par gramme de fèces par une formule.
Figure : Schéma d’une lame McMaster (droite) et photo de lame à analyser
Figure : Centrifugeuse (C. Bérel)
b) Mesure de l’Hématocrite
La mesure de l’hématocrite complète les coproscopies. Haemonchus contortus est hématophage et peut provoquer une anémie plus ou moins grave. L’Hématocrite permet de mesurer la réponse des animaux observés à l’infestation.
L’hématocrite est un calcul du volume des hématies par rapport au volume total de sang. L’animal est normal si son taux d’hématocrite est en moyenne à 28,5%. L’animal est traité à l’élevage si son taux d’hématocrite est à 15%. On sépare les cellules sanguines du plasma. Cette méthode doit être faite rapidement (en 4 heures environ). Il faut homogénéiser le sang au vortex puis à l’aide de la capillarité remplir les micro-tubes. Les boucher avec une pâte à sceller. Les micro-tubes sont placés
9 dans une centrifugeuse à hématocrites. La lecture se fait grâce à une carte hématocrite. Il faut alors positionner le micro-tube sur cette carte et lire le pourcentage obtenu.
Figure : Dessin de la méthode de lecture du micro-tube d’hématocrite
Figure : Agitateur de micro-tubes (C. Bérel)
c) Comptage des leucocytes éosinophiles chez les ruminants
Heamonchus contortus est hématophage, si l’animal est infesté des globules blancs sont libérés. Les éosinophiles traduisent la réponse immunitaire de l’animal. Elles sont visibles par coloration à l’éosine.
Les sangs collectés sont conservés au froid. Les sangs sont constamment sous agitation avec un agitateur rotatoire ou un agitateur spécifique pour les tubes de sang. Le laboratoire possède un automate d’hématologie. Cette machine permet de connaitre la teneur en globules rouges, blancs, en plaquettes et en hémoglobine de différents sangs. L’automate fait ses analyses en se basant sur un sang de synthèse. Le sang de cabri possède de très petits éosinophiles. La machine ne les reconnait donc pas tous. On fait alors un comptage manuel de ces cellules sur lame de Malassez. On peut ainsi revenir au nombre d’éosinophiles par millilitre de sang.
ménisque Lecture base de la colonne pâte à sceller plasma cellules sanguines capillaire ménisque Lecture base de la colonne pâte à sceller ménisque Lecture ménisque Lecture base de la colonne base de la colonne pâte à sceller plasma cellules sanguines capillaire
10 Figure : Schéma d'une lame de Malassez
Figure : Automate d’analyse sanguine (C. Bérel)
d) Détermination de la concentration en pepsinogène
Quand un animal est infesté, sa muqueuse intestinale est lésée. Cette barrière est donc fragilisée et les pepsinogènes peuvent alors passer dans le sang. Avec une détermination de la concentration en pepsinogène, on observe l’impact physiologique du parasite sur les animaux infestés.
On observe la concentration en pepsinogène de manière indirecte. En milieu acide, le pepsinogène devient pepsine. Cette molécule dégrade l’albumine sérique bovine (BSA) par protéolyse. On précipite alors les protéines non attaquées. Dans le surnageant récupéré, la tyrosine est libérée par la protéolyse et peut colorer suivant sa concentration le réactif de Folin. Grâce à un spectrophotomètre, on peut alors obtenir la densité optique de la solution et doser la tyrosine.
Cette technique est longue, doit se faire rapidement. Le réactif de Folin doit être conservé à l’obscurité et doit être préparé au dernier moment. Les manipulations sont très précises car on utilise de très petits volumes. De plus, il y a un temps d’incubation à respecter pour calculer le facteur de correction de la tyrosine.
e) Dosage de l’azote avec un analyseur élémentaire
Pour paramétrer cette étude il faut également connaitre le niveau protéique des aliments et la quantité de protéines ingérées. Les aliments, les urines et les fèces sont donc dosés en azote. On pourra alors calculer la Matière Azotée Totale (MAT) et donc la quantité de protéines.
Lamelle
11 Pour faire ce dosage, l’URZ a acquis un analyseur élémentaire RapideN Cube (société Elementar). Cette machine brûle les échantillons grâce à de l’oxygène et récupère les gaz. Ces gaz sont séparés et purifiés. Le gaz azoté est transporté via un gaz vecteur composé de CO2. Un détecteur
thermo-conductible composé de 2 cellules de mesure peut alors analyser la teneur en azote du gaz. En effet, il y a une cellule de référence du CO2 et une cellule de mesure qui quantifie la quantité
d’azote sur le principe d’une conductivité thermique. L’analyse prend en compte le poids de l’échantillon, le daily factor (calcul sur de l’acide aspartique dont la teneur en azote est connue) et un moyenne de blanc pour mettre les aires à zéro.
J’ai pesé des échantillons solides et liquides pour ce dosage. La technique est différente. On ajoute les échantillons liquides dans un creuset et on chasse l’azote atmosphérique via un flux de CO2. L’inconvénient avec les échantillons liquides est que leurs cendres sont très fines et peuvent
remonter dans le circuit des gaz. Pour les échantillons solides, la pesée se fait dans un papier spécifique. La granulométrie des solides à analyser peut être un désavantage. J’ai assisté à la maintenance de la machine par la technicienne et au test de fuite (on tolère maximum 20 mbar de fuite). Connaître la machine avec laquelle un technicien travaille me semble essentiel. Une formation est donnée à tout le personnel de l’unité mais généralement le technicien l’utilisant le plus sait résoudre les problèmes.
C.
Le traitement des données expérimentales
Le protocole de Steve Ceriac est prévu pour une durée de 4 mois. Il faudra traiter les données expérimentales en données statistiques.
Les données récoltées sont consignées dans un tableau Excel. Pour ce protocole, les paramètres sont : la date, la semaine, l’état infesté ou non de l’animal, son identifiant, son poids, l’hématocrite, les globules rouges, blancs, les éosinophiles, les OPG etc. On utilise le logiciel statistique SAS. On travaille sur le modèle d’une loi normale. Certaines données doivent être converties grâce au logarithme. La règle de Fischer est communément admise même si on peut la nuancer (marge d’erreur à 5%). On débute l’analyse par une observation globale des données statistiques obtenues et de leurs possibles interactions entre elles. On affinera ensuite les analyses.
La notation doit être rigoureuse dans la prise en note des données et la rédaction du script statistique. Il faut être critique sur les résultats à donner. La représentation des résultats (les figures types graphiques, histogrammes etc.) doit être cohérente avec les données présentées. Même si l’expérience ne démontre pas les hypothèses de départ (même si l’expérience est reconduite 1 ou 2 semaines), les résultats peuvent être utiles (utilisation de compléments plus fort en protéines).
V.
Bilan personnel
Le travail de chercheur est composé de 4 phases :
- la définition de la question de recherche à traiter (analyse biblio, besoins de connaissances nouvelles…)
- la conception de l'expérimentation permettant de répondre à la question de recherche (ou à une partie de)
- le protocole
- la publication des résultats
Au cours de ce stage j’ai pu assister à la réalisation du protocole et à la production des données analysées. J’ai également pu voir à quoi ressemble le traitement de ces données.
12 Durant ce stage, j’ai assisté 3 fois à la mise en place du dosage des tanins et il n’a pas toujours fonctionné (problème de spectrophotomètre, de MIVAC, de dosage, fatigue et erreur de manipulation). Cette manipulation a beaucoup de contraintes à respecter et elles peuvent compliquer sa mise en place (température). Cela m’a montré que conduire une expérience n’est pas toujours simple et qu’il faut avoir de la patience et persévérer. Beaucoup de manipulations doivent aussi être répétées maintes fois pour un protocole.
Durant les premiers essais d’extraction de la mimosine, j’ai appris que les standards universels utilisés pour des manipulations peuvent être faux. De plus, les articles présentant des protocoles ne sont pas toujours très précis et il faut souvent tâtonner pour trouver la bonne méthode. Cela peut être long et fastidieux.
J’ai appris à utiliser l’automate d’analyse, mis en route la centrifugeuse, les vortex, de nouvelles pipettes (micropipettes à multicanaux, zipette, pipette distributrice…). J’ai fait des lectures sur lame de Malassez et McMaster. J’ai cassé une lame et j’ai fait des erreurs de calculs, il faut être très soigneux surtout lors des manipulations. Cela peut être fatiguant et il faut être attentif à ne pas faire d’erreur même si c’est répétitif. J’ai également appris à lire des étiquettes d’échantillons. Tout ceci fait partie du travail de technicien de laboratoire.
VI. Conclusion
Ce stage m’a beaucoup appris. J’ai découvert le métier de technicien de laboratoire. Ce métier est intéressant et essentiel mais je ne souhaite pas le faire. J’ai pu confirmer mon envie de devenir chercheur agronome. J’ai également découvert de nouvelles manipulations, ce qu’est un mode opératoire, un protocole. Ce stage en production animale m’a plu même si je veux continuer à étudier la physiologie végétale. L’Unité de Recherches Zootechniques s’organise continuellement pour avoir un projet cohérent et commun entre équipes et cela correspond parfaitement avec ma vision du travail de recherche. Travailler dans une entreprise comme l’INRA semble me convenir.