Isomérisation du lactose en lactulose en solution modèle
de lactose et dans du perméat de lactosérum par
électro-activation supportée par échange ionique sur résine
Mémoire
Lenny Maritza Quiroga Espitia
Maîtrise en génie agroalimentaire
Maître ès sciences (M. Sc.)
Québec, Canada
Isomérisation du lactose en lactulose en solution
modèle de lactose et dans du perméat de lactosérum
par électro-activation supportée par échange ionique
sur résine
Mémoire
Lenny Maritza Quiroga Espitia
Sous la direction de :
Mohammed Aider, directeur de recherche
Mohamed Khelifi, codirecteur de recherche
Résumé
L'isomérisation alcaline du lactose en lactulose a été effectuée électro-chimiquement à l’aide d’un réacteur d'électro-activation en combinaison avec des résines échangeuses d'anions de polystyrène de trois types; à savoir Lewatit VP-OC-1065 faible-acide, Lewatit MP-64 moyenne-acide et Lewatit Monoplus M500 forte-moyenne-acide. Les paramètres opératoires qui ont fait l’objet de cette étude ont été étudiés sur trois blocs expérimentaux pour optimiser le système. Dans le
Premier bloc, les paramètres étudiés sont : (1) ratio lactose-5%(p/v) : résine échangeuse
d'anions (1:0.5, 1:1 et 1:2), (2) intensité du champ électrique : 50 mA, 100 mA et 200 mA et (3) type de résines : faible, moyenne et forte. Dans le Deuxième bloc, les paramètres mis à l’étude comprenaient : (1) l’intensité du champ électrique : 300 mA, 450 mA et 550 mA, (2) le débit de la solution traitée : 25 ml / min, 50 ml/ min et 100 ml/min et (3) la surface active de la membrane adjacente au compartiment cathodique : 0.78 cm2, 7.06 cm2 et 18.1 cm2. Le Troisième bloc expérimental a été effectué sur la base de la distance entre la membrane et l'électrode : 3.1 cm, 5.6 cm et 9 cm. Le même modèle expérimental a était également réalisé avec du perméat du lactosérum d’une concentration de 7% (p/v). Les résultats obtenus ont révélé que le meilleur rendement de l’isomérisation du lactose en lactulose était obtenu après 30 minutes d’électro-activation en utilisant une solution modèle de lactose-5% avec une valeur d’environ 20.1%. Les conditions opératoires qui ont permis d’avoir ce taux de conversion sont une intensité du courant de 550 mA, un débit de la solution de 25 ml/min, une surface active de la membrane de 7.06 cm2 et une distance de 9 cm entre la cathode et la membrane qui lui y est adjacente. En utilisant le perméat de lactosérum-7%, un taux de conversion de lactose en lactulose de 8.34% a était obtenu avec une intensité du courant de 200 mA, un débit de 120 ml/min, une surface active de de 18.1cm2 et une distance de 9 cm entre la membrane et l’électrode dans le compartiment cathodique. Les analyses de variance ont indiqué un effet catalytique significatif du type de la résine. En effet, la résine-forte a permis d’avoir les plus hauts rendements de la réaction d’isomérisation par électro-activation. La résistance électrique globale du système d’électro-activation dépendait de la valeur de l’intensité du courant. Le produit final était d’une grande pureté, car il ne présentait que quelques traces de galactose (< 4%).
iv
Abstract
The isomerization of lactose to lactulose in alkaline conditions was carried out electrochemically using an electro-activation reactor in combination with three types of anion-exchange polystyrene resins, namely Lewatit VPOC 1065 weak acid, Lewatit MP-64 medium acid, and Lewatit
Monoplus M500 strong acid. The operational parameters evaluated in this study have been
adjusted to three blocks to optimize the system: first block: a) ratio lactose- 5% (w /v): anion-exchange resin (1:0.5, 1:1 and 1:2), b) electric field intensity of 50 mA, 100 mA, and 200 mA, and c) resin type; second block: a) electric field intensity of 300 mA, 450 mA, and 550 mA, b) flow rate (25 ml / min, 50 ml / min, and 100 ml / min); and c) area of the membrane adjacent to the cathode compartment (0.78 cm2,7.06 cm2, and 18.1 cm2); and third block: distance between the membrane and the electrode (3.1 cm, 5.6 cm, and 9 cm). The same experimental model was used with whey permeat at a concentration of 7% (w/v). Obtained results revealed that the best yield was obtained after 30 minutes of electro-activation using a typical solution based on 20.1% of lactose-5% under a current intensity of 550 mA, a flow rate of 25 ml / min, a membrane area of 7.06 cm2, and a distance of 9 cm between the membrane and the electrode. The use of whey permeate-7% resulted in 8.34% of lactulose under a current intensity of 200 mA, a flow rate of 120 ml / min, a membrane area of 18.1 cm2, and a distance of 9 cm in the cathodic compartment. The analysis of variance indicated a significant catalytic effect on the resin type since the strong acid resin allowed obtaining the highest yields of the isomerization reaction by electro-activation. The overall electrical resistance of the electro-activation system depends on the current intensity. The final product was of high purity since it contains only few traces of galactose (<4%).
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Dédicaces ... x
Remerciements ... xi
Avant-propos ... xii
INTRODUCTION ... 1
CHAPITRE 1 : REVUE DE LITTÉRATURE ... 3
1. ISOMÉRISATION DU LACTOSE EN LACTULOSE... 3
1.1. Mécanisme de base de la réaction d’isomérisation ... 3
1.2. Méthodes de production conventionnelles ... 4
1.2.1. Isomérisation du lactose par des agents alcalins ... 4
1.2.2. Isomérisation du lactose par les sulphites et les phosphates ... 5
1.2.3. Isomérisation du lactose par des sépiolites ... 5
1.2.4. Isomérisation du lactose par des aluminates et des borates comme agents complexants ... 6
1.2.5. Effet de la concentration du lactose et du pH ... 7
1.3. Lactulose : Généralités et applications ... 8
1.3.1. Application dans le domaine alimentaire ... 9
1.3.2. Application dans le domaine pharmaceutique... 9
1.3.3. Constipation et encéphalopathie hépatique ... 10
1.3.4. Porteurs de Salmonella ... 10
1.3.5. Maladie inflammatoire de l'intestin ... 10
1.4. Lactosérum : Généralités et applications ... 11
1.4.1. Valorisation du lactosérum ... 11
1.4.2. Perméat du lactosérum ... 12
1.4.3. Effet du pH sur le lactosérum et son perméat... 12
1.5. Généralités de l’électro-activation ... 14
1.5.1. Principe électrochimique de l’électro-activation ... 15
1.6. ÉXCHANGE IONIQUE ... 17
vi
1.6.2. Matrice d’échange ionique macroporeuse ... 18
1.6.3. Matrice échangeuse d’ions en forme de gel ... 18
1.7. Production de lactulose par des résines d’échange ionique ... 19
CHAPITRE 2 : HYPOTHÈSE DE RECHERCHE ET OBJECTIFS ... 20
2.1. FORMULATION DE L’HYPOTHÈSE ... 20
2.2. Objectif principal ... 21
CHAPITRE 3 : MATÉRIEL ET MÉTHODES ... 22
3.1. Matériel et réactifs ... 22
3.2. Réacteur d’électro-activation ... 22
3.3. Système d’électro-activation supporté par des résines échangeuses d’ions à flux continu 24 3.3.1. Résines échangeuses d’ions ... 24
3.3.2. Résines échangeuse d’anions ... 24
3.4. Protocole général d’isomérisation du lactose en lactulose ... 27
3.5. Concentration du lactose vs Concentration du perméat du lactosérum ... 27
3.6. PRISE DES DONNÉES EXPÉRIMENTALES ET ANALYSES ... 27
3.6.1. Acidité des solutions (pH) et conductivité électrique ... 27
3.6.2. Résistance électrique globale du système ... 28
3.6.3. Analyse chromatographique (HPLC) des sucres ... 28
3.7. PLAN ÉXPÉRIMENTAL ET ANALYSE STATISTIQUE DES DONNÉES ... 29
CHAPITRE 4 : RÉSULTATS ET DISCUSSION ... 30
4.1. Cinétique de la réaction d’isomérisation et effet catalytique de la résine échangeuse d’anions ... 30
4.1.1 Électro-activation d’une solution modèle de lactose ... 30
4.1.2 Électro-activation d’une solution de perméat de lactosérum ... 34
4.2 Effet du débit volumique et de la surface de la membrane ... 38
4.3 Effet des sels et des traces de protéines du perméat ... 42
4.4. Impact de la distance entre la membrane et l'électrode dans la réaction d’isomérisation du lactose en lactulose ... 44
4.5 Variation du pH dans la solution soumise à l’électro-activation ... 46
4.6. Résistance électrique globale du système d’électro-activation ... 60
4.7 Pureté du produit final ... 65
CONCLUSIONS ... 69
Liste des tableaux
Tableau.3.1 : Propriétés physico-chimiques de la Résine-faible échangeuse d’anion Lewatit® VP OC 106
(Source : http://www.sigmaaldrich.com) ... 25 Tableau 3.2 : Propriétés physico-chimiques de la Résine-moyenne échangeuse d’anion (source :
http://www.sigmaaldrich.com) ... 25 Tableau 3.3 : Propriétés physico-chimiques de la Résine-forte échangeuse d’anion (Source :
http://www.sigmaaldrich.com; Hidalgo et al. (2006)) ... 25 Tableau 4.1 : Analyse de variance (ANOVA) de l’effet catalytique des variables indépendantes appliquées au procédé d’électro-activation du lactose. ... 30 Tableau 4.2 : Analyse de variance (ANOVA) de l’effet catalytique des variables indépendantes appliquées au procédé d’électro-activation du perméat de lactosérum. ... 34
viii
Liste des figures
Fig. 1.1 : Réaction de Lobry de Bruyn-Alberda van Ekenstein (Aider Gimenez-Vidal, 2012). ... 3
Fig. 1.2 : Schéma de la réaction d’isomérisation du lactose en lactulose (Gimenez-Vidal, 2013). ... 4
Fig. 1.3 : Schéma de la réaction de réarangement d’Amadori (Aider de Halleux, 2007). ... 4
Fig. 1.4 : Représentation schématique du principe électrochimique d’un réacteur d’électro-activation. ... 15
Fig. 3.1 : Représentation schématique de la configuration du réacteur d’électro-activation avec membranes échangeuses d’ions. AEM : membrane échangeuse d’anions; CEM : membrane échangeuse de cations; A- : anion; C+ : cation (Aider Gimene-Vidal, 2012). ... 23
Fig. 3.2 : Représentation schématique d’un système d’électro-activation à flux continu : AEM : membrane échangeuse d’anions; CEM : membrane échangeuse de cations. ... 26
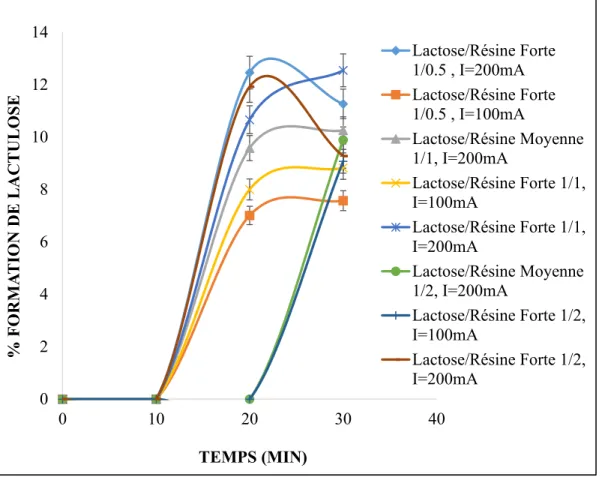
Fig. 4.1 : Évolution de la formation de lactulose durant la réaction d’isomérisation du lactose 5% supportée par la résine-faible en fonction du temps d’électro-activation et de différentes intensités du courant électrique. ... 32
Fig. 4.2 : Évolution de la formation de lactulose durant la réaction d’isomérisation du lactose 5% supportée par la résine-moyenne et résine-forte en fonction du temps d’électro-activation et de différentes intensités du courant électrique. ... 33
Fig. 4.3 : Évolution de la formation du lactulose durant la réaction d’électro-activation dans du perméat de lactosérum à une concentration de 5% en fonction du temps et de l’intensité du courant avec les trois types de résine échangeuse d’anions. ... 36
Fig. 4.4 : Évolution de la formation du lactulose durant la réaction d’électro-activation dans une solution de lactose-5% en fonction du temps, de l’intensité du courant et du débit volumique de la solution. La surface active de la membrane est au niveau minimal (1). ... 39
Fig. 4.5 : Évolution de la formation du lactulose durant la réaction d’électro-activation dans une solution de lactose-5% en fonction du temps, de l’intensité du courant et du débit volumique de la solution. La surface active de la membrane est au niveau moyen (2). ... 40
Fig. 4.7 : Évolution de la formation du galactose durant la réaction d’électro-activation dans du preméat de lactosérum en fonction du temps, de l’intensité du courant électrique, du débit de la solution et de la surface active de la membrane. ... 44
Fig. 4.8 : Évolution de la formation du lactulose durant la réaction d’électrio-activation du lactose-5% en fonction du temps et de la distance entre la membrane et la cathode. ... 45
Fig. 4.9a : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du lactose-5% en fonction du type de résine, du temps d’électro-activation et de l’intensité du courant électrique au ratio lactose/résine de 1/0.5. ... 46
Fig. 4.9b : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du lactose-5% en fonction du type de résine, du temps d’électro-activation et de l’intensité du courant électrique au ratio lactose/résine de 1/1. ... 47
Fig. 4.9c : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du lactose-5% en fonction du type de résine, du temps d’électro-activation et de l’intensité du courant électrique au ratio lactose/résine de 1/2. ... 48
Fig. 4.10a : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du perméat de lactosérum-5% en fonction du type de résine, temps du traitement et intensité du courant électrique au ratio perméat/résine de 1/0.5. ... 49
Fig. 4.10b : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du perméat de lactosérum-5% en fonction du type de résine, temps du traitement et intensité du courant électrique au ratio perméat/résine de 1/1. ... 50
Fig. 4.10c : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du perméat de lactosérum-5% en fonction du type de résine, temps du traitement et intensité du courant électrique au ratio perméat/résine de 1/2. ... 51 Fig. 4.11a : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du lactose-5% en fonction de l’intensité du courant électrique, du débit volumique de la solution avec la surface active de la membrane-1 (0,78 cm2). ... 53
Fig. 4.11b : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du lactose-5% en fonction de l’intensité du courant électrique, du débit volumique de la solution avec la surface active de la membrane-2 (7,06 cm2). ... 54
Fig. 4.11c : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du lactose-5% en fonction de l’intensité du courant électrique, du débit volumique de la solution avec la surface active de la membrane-3 (18,1 cm2). ... 55
Fig. 4.12a : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du perméat de lactosérum en fonction de l’intensité du courant électrique, du débit volumique de la solution avec la surface active de la membrane-1 (0,78 cm2). ... 56
Fig. 4.12b : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du perméat de lactosérum en fonction de l’intensité du courant électrique, du débit volumique de la solution avec la surface active de la membrane-2 (7,06 cm2). ... 57
Fig. 4.12c : Évolution du pH dans la section cathodique durant la réaction d’électro-activation du perméat de lactosérum en fonction de l’intensité du courant électrique, du débit volumique de la solution avec la surface active de la membrane-3 (18,1 cm2). ... 58
Fig. 4.13 : Évolution du pH mesuré dans le compartiment cathodique du réacteur d’électro-activation durant le traitement du lactose-5% et du perméat de lactosérum en fonction du temps et de différentes distances entre la membrane et la cathode. ... 59 Fig. 4.14 : Évolution de la résistance électrique globale du réacteur d’électro-activation combinée avec la résine échangeuse d’anions de type forte en fonction du temps et de l’intensité du courant électrique. Solutions utilisées : lactose-5% et perméat de lactosérum. Ratio perméat/résine-forte 1:1. ... 61 Fig. 4.15 : Résistance électrique globale du réacteur d’électro-activation combinée avec la résine
échangeuse d’anions de type forte en fonction du temps et du débit volumique de la solution. Surface moyenne-2 (7.06 cm2), I = 550 mA. ... 62
Fig. 4.16 : Résistance électrique globale du réacteur d’électro-activation combinée avec la résine échangeuse d’anions de type-forte en fonction du temps et de la surface de la membrane du côté de la cathode. Débit 25 ml/min, I = 550 mA. ... 63 Fig. 4.17 : Résistance électrique globale du réacteur d’électro-activation combinée avec la résine
échangeuse d’anions de type-forte en fonction du temps et de la distance entre la membrane et la cathode. ... 64 Fig. 4.18 : Chromatogrammes HPLC du mélange lactose/lactulose après le traitement par
électro-activation dans du lactose-5% et du perméat de lactosérum-7% aux ratios avec la résine de 1/1 et 1/0.5. Intensité du courant électrique : 200 mA. ... 66 Fig. 4.19 : Comparaison des rendements de lactulose en fonction des méthodes de synthèse. ... 67
x
Dédicaces
D'abord, je dédie ce mémoire à Jésus-Christ tout-puissant et à la Vierge Marie qui m'a couvert avec sa sainte grande cape, à travers des événements et des personnes ils m'ont aidé à effectuer ce projet.
À ma mère Graciela Espitia qui, avec l’amour, m'a donné le courage de continuer et atteindre la finalisation du projet.
À mon père Reinaldo Quiroga qui m'a guidé et m'a supporté avec humour dans les moments difficiles.
À mon frère Ronald Augusto Quiroga qui s'est armé de patience pour affronter sa maladie. Il a été un modèle de force pour moi.
À mes amis à l’intérieur et à l'extérieur du Québec qui m'ont toujours donné un mot d'encouragement.
Souvent, nous ne manquons pas de courage d'entreprendre le chemin du succès, Sinon la persévérance pour l’atteindre.
Remerciements
Je veux exprimer mes remerciements à mon directeur, Dr Mohammed Aider, pour son grand support, son orientation et sa motivation afin d'effectuer ce projet de maîtrise. Je tiens également à exprimer ma profonde gratitude à mon co-directeur, Dr Mohamed Khelifi, pour sa confiance en moi et qui m’a donné cette grande possibilité d'approfondir mes connaissances.
Je remercie Pascal Dubé qui était toujours prêt à me fournir l’aide dans l'analyse HPLC des échantillons.
Je ne pourrais passer sous silence la contribution du groupe d'étudiants du programme de maîtrise en génie agroalimentaire. Merci pour l’aide et surtout l’amitié; notamment à Angela Maria Trivino qui m’a proposé de bonnes suggestions et d’avoir partagé avec elle une belle expérience de vie.
Enfin, mes plus sincères reconnaissances aux enseignants de l'Université Laval qui m’ont transmis leurs connaissances en sciences tout au long de la période de mes études.
xii
Avant-propos
Ce mémoire qui a fait l’objet d’une maîtrise en génie agroalimentaire intitulé «Isomérisation du
lactose en lactulose en solution modèle de lactose et dans du perméat de lactosérum par électro-activation supportée par échange ionique sur résine » comporte quatre chapitres. Le premier
chapitre constitue une revue de littérature sur la synthèse du lactulose et l’utilisation du produit (lactulose) dans le domaine alimentaire et pharmaceutique, ainsi qu’une synthèse de certaines méthodes de production utilisées dans l’industrie. Également, cette section aborde la composition du lactosérum et ses applications agricoles, alimentaires et biopharmaceutiques. Une description détaillée du réacteur d’électro-activation, qui constitue une technologie novatrice basée sur le principe de l’électrochimie avec une capacité d’auto-génération des conditions alcalines pour permettre la réaction d’isomérisation du lactose en lactulose, est aussi détaillée dans cette partie du mémoire. Enfin, la classification des résines échangeuses d’ions et l’apport dans la formation du lactulose a fait l’objet d’une brève discussion. Le deuxième chapitre met l’emphase sur la formulation de l’hypothèse sur laquelle ce projet de recherche est basé, l’objectif principal et les objectifs spécifiques qui supporteront la viabilité de l’hypothèse. Dans le chapitre trois, les matériaux utilisés, la description du déroulement du protocole d’isomérisation et la description de l’usage des résines échangeuse d’anions dans le schéma d’électro-activation sont présentés. Le chapitre quatre résume les résultats obtenus ainsi que la discussion qui s’y rattache. Tous les résultats obtenus ont été présentés suite à une analyse de variance (ANOVA). Finalement, les conclusions fournissent une synthèse des principaux résultats obtenus par la combinaison de plusieurs paramètres opératoires ajustés au système d’électro-isomérisation à flux continu supportée par l’échange anionique. Par la suite, les perspectives issues de la présente recherche pour l’amélioration du rendement de la réaction d’électro-activation et pour obtenir un produit d'une haute pureté sont présentées. Une liste de références bibliographiques est consignée à la fin du présent mémoire de maîtrise.
INTRODUCTION
Le lactose est un disaccharide dérivé de la condensation du galactose avec du glucose (aldose). Il est utilisé pour la synthèse du lactulose dont la formule chimique est (4-O-- D-galactopyranosyl-D-fructose (cétose). Le lactulose est un sucre bifidogénique, car il est prouvé qu’il stimule la croissance des probiotiques, tant en milieu modèle que dans l’intestin humain et animal. On le retrouve en très petites quantités dans le lait maternel. À grande échelle, le lactulose est produit par voie synthétique en milieu alcalin. D’un point de vue pratique, le lactulose est principalement utilisé dans le domaine pharmaceutique dans différentes applications; notamment pour le traitement de la constipation chronique et de l’encéphalopathie hépatique. Il est également utilisé dans le domaine alimentaire comme un faible édulcorant, mais aussi pour ses effets bénéfiques sur la santé. Grâce aux bénéfices ci-dessus mentionnés, la production mondiale du lactulose a augmenté d’une manière significative dans les trois dernières décennies. Dans l’ordre chronologique, la réaction d'isomérisation de l’aldose a été effectuée pour la première fois par Lobry de Bryn-Alberda van Ekenstein dans un milieu alcalin. Par la suite, d’autres auteurs ont développé diverses méthodes de production de cétose. Cependant, il est nécessaire de contrôler les conditions opératoires; notamment la concentration du substrat, le pH du milieu réactionnaire, la température et le temps de la réaction et ce pour atteindre la conversion de l’aldose à un cétose. Pour ce qui est du lactulose, il a était produit pour la première fois par Montgomery en 1929 par isomérisation alcaline du lactose. Depuis cette première synthèse, les recherches se sont multipliées pour comprendre les mécanismes de la réaction, optimiser les conditions opératoires et améliorer le rendement de la réaction et la qualité (pureté) du produit final.
La synthèse des connaissances et des travaux rapportés sur le lactulose ont démontré que les chercheurs ont été capables d’obtenir des rendements élevés du lactulose, mais la formation de sous-produits de la réaction comme le galactose, le glucose, le fructose, l’epilactose et autres produits reste un problème qui entraîne des coûts élevés liés au processus de séparation et de purification, sans compter les coûts directs de production qui sont également non négligeables. En raison de la nécessité d’implémenter une nouvelle technologie qui répond aux exigences de l'industrie en termes d’efficacité globale, une approche novatrice a été développée dans les dernières années et sa preuve du concept démontrée. Il s’agit d’une technologie utilisant un réacteur d’électro-activation basée sur le principe de l'électrolyse de l'eau qui permet une auto-génération des conditions alcalines nécessaires à la réaction catalytique permettant d’obtenir de
2
très hauts rendements en lactulose (proches des méthodes conventionnelles) avec une très haute pureté. Cependant, les résultats rapportés ont mis en évidence la présence de quelques traces de fructose, de glucose et de galactose comme sous-produits principalement de la réaction de conversion du lactose en lactulose par électro-activation. Ainsi, il est nécessaire d'améliorer le système pour une production efficiente du lactulose. C’est dans cette optique que le présent projet de maîtrise a était initié dont le but principal est de modifier le système d'électro-activation par une adaptation à la configuration de base d’un sous-système de résines échangeuses d'anions supportées sur une colonne à flux continu. Ce nouveau système d’électro-activation supporté par échange anionique permettrait de créer des réactions d'oxydation/réduction pour obtenir des résultats satisfaisants en matière de qualité du produit; notamment la diminution de la teneur en galactose dans le produit final.
Dans le présent projet, le schéma du système utilisé pour la conversion du lactose en lactulose s’opère à flux continu en utilisant comme substrat le lactose en solution ou du perméat de lactosérum. Différentes variables indépendantes ont fait l’objet de cette étude et leur effet sur le taux de conversion du lactose en lactulose a était déterminé. Leur impact sur la performance électrique globale du système a également était déterminée. Ces variables incluaient la variation du ratio du substrat par rapport à la résine échangeuse d’anions, l’intensité du courant électrique, la surface active d'échange de la membrane adjacente au compartiment cathodique, la distance entre la membrane et l'électrode dans la section cathodique et la vitesse de recirculation du liquide dans le système (flux volumique). La résistance électrique globale du réacteur et le potentiel d'hydrogène ont été mesurés pour monitorer les conditions requises pour la réaction d’électro-activation en vue de l’isomérisation du lactose en lactulose. Une analyse de variance (ANOVA) a été effectuée sur les données et les résultats ont été interprétés et discutés. Les conclusions et les perspectives sont consignées à la fin du mémoire.
CHAPITRE 1 : REVUE DE LITTÉRATURE
1. ISOMÉRISATION DU LACTOSE EN LACTULOSE
1.1.
Mécanisme de base de la réaction d’isomérisation
Le processus est principalement basé sur l’énolisation des composés carbonylés connus en milieu basique comme la transformation de Lobry de Bryn-Alberda Van Ekenstein. Il s’agit de la migration d’un ion d’hydrogène accompagnée du changement d’une double liaison (Fig. 1.1). La réaction atteint une phase quasi stationnaire (réaction intermédiaire, forme enediol) en finissant sous forme d’un cétose. Les réactions sont possibles par la présence d’un catalyseur. Cependant, différents paramètres comme la température, la concentration du sucre, le temps de réaction et le pH doivent être contrôlés pour maîtriser la réaction (Fonseca, 2009).
Fig. 1.1 : Réaction de Lobry de Bruyn-Alberda van Ekenstein (Aider Gimenez-Vidal, 2012). Le lactulose (Fig. 1.2) a été synthétisé pour première fois par Montgomery et Hudson en 1930 (Aït-Aissa & Aïder, 2013a). La réaction est basée sur l’isomérisation du lactose en utilisant le Ca(OH)2 comme catalyseur. Cette isomérisation est commune pour tous les aldoses qui se transforment sur l’équilibre en cétones épimères dans des conditions alcalines. Il a été considéré que la proportion du lactulose présent dans le milieu à l’équilibre oscille entre 20 et 40% (Patent en espagnol Nº 397810 1971). Suite à cette découverte, de nombreuses techniques d’isomérisation ont été développées et étudiées pour la production de cette molécule (Gimenez-Vidal, 2013).
4
Fig. 1.2 : Schéma de la réaction d’isomérisation du lactose en lactulose (Gimenez-Vidal, 2013).
Il existe d'autres mécanismes impliquant des composés azotés synthétiques qui sont connus sous le nom de réarrangement d’Amadori (1953). Ce mécanisme obéit à la loi selon laquelle il y a une transposition des produits de condensation lors de la conversion de l'aldose en glucosamine et en 1-amino-1deoxi-cétose (Fonseca, 2009) (Fig. 1.3).
Fig. 1.3 : Schéma de la réaction de réarangement d’Amadori (Aider de Halleux, 2007).
1.2.
Méthodes de production conventionnelles
1.2.1. Isomérisation du lactose par des agents alcalinsIl est important de mentionner que la transformation du lactose en lactulose implique la participation d’un accepteur de protons et que celui-ci est essentiel à la réaction. Les méthodes conventionnelles usent des catalyseurs forts comme le Ca(OH)2, NaOH, KOH, les sulfites et phosphates. Cependant, l’effet de tels catalyseurs a comme conséquence de donner des taux élevés de galactose qui sont dûs à la décomposition des disaccharides; à savoir le lactose et son isomère lactulose (Aider de Halleux, 2007).
À partir des résultats montrés dans Patent of Germany No 2224680 (1976), il est possible de tirer les conclusions suivantes:
Indépendamment de la quantité de NaOH employée, il existe une dépendance linéaire entre la génération du galactose comme sous-produit de la réaction et le taux de lactulose obtenu (qui représente le taux d’isomérisation de la réaction). Il semblerait que cette relation augmente considérablement lorsque les taux d’isomérisation sont de 21,4% ou plus.
Le ratio galactose/lactulose reste constant pour un même ratio NaOH/lactose, indépendamment du temps d’isomérisation ou de la température.
1.2.2. Isomérisation du lactose par les sulphites et les phosphates
Les sulfites et les phosphates ont la caractéristique de prévenir l’oxydation des disaccharides. C’est pour cette raison qu’ils peuvent être utilisés comme catalyseurs de la réaction d’isomérisation du lactose en lactulose à de hautes températures ou en présence de concentrations élevées de lactose afin d’éviter la génération de sous-produits. D’après les données publiées dans (Patent of Austria No 288595, 1971), des solutions de lactose d’un concentration de 60-65% à des températures de 80-100ºC peuvent être utilisées comme conditions opératoires pour la production de lactulose. Les sulfites doivent être ajoutés en proportion de 0,05-0,5 M par kg de lactose monohydrate. Par la suite, le mélange (solution de lactose et catalyseur) est chauffé à la température de réaction. Quand la réaction arrive à la fin, la solution est refroidie pour que le lactose résiduel soit cristallisé. Après la cristallisation, la solution de lactose/lactulose est traitée dans une résine d’échange ionique pour séparer le catalyseur (sulfites) et les acides organiques qui se sont formés durant la réaction. Après cette opération, une autre partie du lactose est cristallisée par refroidissement. Le produit final est un sirop avec 38,7% de lactulose. La teneur finale en galactose et lactose est aux alentours de 8,2% et 3,8%, respectivement.
1.2.3. Isomérisation du lactose par des sépiolites
De la Fuente et al. (1999) ont rapporté des études dans lesquelles ils indiquent que les bases fortes obtenues à partir de la substitution du l’ion Mg2+ des sépiolites par des ions alcalins (Li+, Na+, K+ et Cs+) peuvent être utilisées comme catalyseurs pour l’isomérisation du lactose en lactulose et en épilactose. L’activité exhibée par ces sépiolites alcalines est significativement plus élevée que celle des sépiolites naturelles. Avec cette approche, il est possible d’arriver à des taux de 20% de conversion de lactose en lactulose à une température de 90ºC avec une charge de catalyseur de 15 g/L. D’autre part, Villamiel et al. (2002) indiquent dans leurs études que les
6
sépiolites alcalines (Na+, K+) ont aussi été utilisées comme catalyseurs pour la synthèse de lactulose à partir du perméat de lait. En plus du lactose et du lactulose, d’autres hydrates de carbone tels que le galactose et l’épilactose ont été déterminés dans le produit final. En général, l’activité de la sépiolite de sodium est plus importante que celle sous forme de potassium. Un taux de 20% de formation de lactulose (1000 mg/100 mL), par rapport à la concentration initiale de lactose a été obtenu après 150 minutes de réaction en utilisant les sépiolites de sodium. Dans ces conditions, 25% de dégradation de lactose a été détecté, alors que des petites quantités d’épilactose et de galactose étaient formées. Ce travail présente une méthode appropriée pour l’obtention de lactulose à partir du perméat du lait avec des rendements acceptables et des étapes de purification non compliquées.
1.2.4. Isomérisation du lactose par des aluminates et des borates comme agents
complexants
En utilisant des électrolytes amphotériques comme l’hydroxyde d’aluminium ou borique, il est possible d’atteindre des taux d’isomérisation de 60-70% (Mendicino, 1960). Dans ce cas, le catalyseur doit être ajouté dans une proportion de 0,5-4 M par mole de lactose; tel qu’indiqué dans US patent No 4957564 (1990). Dans U.S. Patent No 3546206 (1970), le catalyseur (aluminate) doit être ajouté à la solution de lactose et par la suite, le mélange doit être chauffé. Le catalyseur est enlevé du milieu par cristallisation lors du refroidissement. À cet effet, le pH est ajusté avec du HCl ou de l’hydroxyde d’aluminium. À la fin du procédé, il est conseillé de séparer le lactulose en utilisant du méthanol, car celui-ci n’est pas soluble dans cet alcool. On a également proposé l’utilisation d’une membrane pour enlever le catalyseur après l’isomérisation (U.S. Patent No 4957564, 1990). Dans ce brevet, des solutions de lactose à une concentration de 25-50% sont utilisées. Le catalyseur (aluminate de sodium) est ajouté sous forme de solution concentrée à 35-45%. Le rapport aluminate/lactose est compris entre 0,3/1 et 1/1; selon la concentration du lactose. L’isomérisation s’effectue à des températures de 50-70ºC pendant 30-60 minutes. À la fin de la réaction, la solution est neutralisée avec 3-4 N d’acide sulfurique pour maintenir le pH entre 4,5 et 8. Il y a formation d’une suspension d’hydroxyde d’aluminium qui est retirée par centrifugation après avoir été traitée par une membrane de filtration. Des rendements d’environ 75% sont obtenus pour la réaction d’isomérisation du lactose. D’autres auteurs soulignent l’utilisation possible de tetraborate de sodium, d’hydroxyde de sodium ou du triméthylamine mélangé avec de l’acide borique comme catalyseurs (Hicks et al., 1984; 1987; Hramtvov et al., 2004). Des opérations de purification par échange ionique, cristallisation et
pasteurisation sont nécessaires. Dans ces cas, des rendements d’isomérisation de 87% peuvent être obtenus.
1.2.5. Effet de la concentration du lactose et du pH
Selon les principes de la cinétique de réaction chimique, la réaction d’isomérisation du lactose en lactulose sera dépendante de la concentration du lactose dans la solution initiale. Les analyses des données sur la production du lactulose montrent une grande variation de ce paramètre; pouvant osciller entre 5 et 60%. De plus, la concentration optimale initiale de lactose choisie dépend du type de catalyseur utiliséé dans la réaction. L’utilisation d’hydroxydes de sodium, de potassium ou de calcium comme catalyseurs dans la formation du lactulose a été étudiée (Ryabtsova, 1992). De cette façon, on cherche à obtenir les concentrations optimales de lactose initiales pour obtenir un minimum de coloration (présence de sous-produits) avec un rendement maximal. À cet effet, des concentrations de lactose entre 5 et 30% ont été utilisées. Le lactose utilisé était de qualité alimentaire mais non raffiné. Il a été purifié afin d’enlever les protéines pour éviter une éventuelle réaction entre le lactose ou lactulose avec les groupes aminés des protéines. L’isomérisation en utilisant de l’hydroxyde de sodium avec un pH initial de 11,0 ± 0,2 à 70 ± 2ºC pendant 20 ± 2 minutes montre que la concentration initiale de lactose comprise entre 5 et 30% n’a pas d’effet significatif sur le taux d’isomérisation. Cependant, la même étude montre qu’à des concentrations initiales de lactose jusqu’à 20% comporte un taux d’apparition de sous-produits plus élevé que lorsque la concentration de lactose est plus basse. En utilisant l’hydroxyde de calcium comme catalyseur, les mêmes résultats sont obtenus. En outre, il est important d'utiliser une concentration initiale comprise entre 20 et 25% pour les réactions d’isomérisation alcaline afin d’éviter la cristallisation du lactose après le refroidissement de la solution.
Dans une autre étude (Montilla et al., 2005); des concentrés de lactosérum et des ultra-filtrats pour la production de lactulose ont été utilisés. es résultats indiquent que la quantité de lactulose produite augmente lorsque le facteur de concentration de la matière première augmente. En effet, des teneurs de 0,388 et 1,17 g/100 mL ont été obtenues après 30 et 120 minutes, respectivement, et ce en utilisant le lait, alors que pour une concentration d’un facteur de 5,2 de lactosérum, les quantités de lactulose obtenues étaient de 3,41 et 4,80 g/100 mL après 30 et 120 minutes, respectivement. De plus, une concentration de lactosérum d’un facteur de 7,6 permet d’obtenir des quantités de lactulose de 5,33 et 7,15 g/100 mL après 30 et 120 minutes de traitement, respectivement (Montilla et al., 2005).
8
Il a été également rapporté qu’il y a un effet de la concentration de lactose et du catalyseur sur le pH de la solution. Dans le cas de l’isomérisation du lactose en lactulose, le pH de la solution déterminera la concentration d’accepteurs de protons, ce qui peut être considéré comme un des facteurs les plus importants lors de l’isomérisation (Aider de Halleux, 2007). Les résultats expérimentaux montrent qu’il n’existe pas une différence significative entre les valeurs de pH des solutions composées de lactose de haute pureté et celles contenant du lactose raffiné. De plus, ces analyses montrent qu’indépendamment de la concentration de lactose, la courbe d’évolution du pH a un comportement logarithmique. Pendant la première étape de la réaction, le pH de la solution augmente de façon abrupte. Des données montrent que pour augmenter le pH d’une solution de lactose de 5,5 ± 0,5 jusqu’à 9,0 ± 0,2, la concentration de NaOH requise est la même, indépendamment de la concentration de lactose. Dans une deuxième étape, une évolution différente de la courbe de pH est appréciée. Dans cette situation, l’augmentation du pH est beaucoup plus lente. Pendant cette étape, la concentration de lactose a un effet très significatif lors de l’augmentation du pH. Il est beaucoup plus difficile d’augmenter le pH dans les solutions avec du lactose plus concentré. Pour la relation entre la concentration de lactose et celle du catalyseur, il est possible de conclure ce qui suit : à un pH 11,0 pour chaque mole de NaOH, il faut 10 moles de solution initiale de lactose, indépendamment de la concentration de celle-ci ; 3-7 moles de NaOH dans le cas des solutions de lactose concentrées à partir de lactosérum (dépendamment du procédé utilisé pour la production du fromage d’où le lactosérum est issu) et, finalement, 1-2 moles de NaOH pour les solutions de lactose non raffiné de haute qualité. On peut donc constater que lorsqu’on augmente la capacité de tampon de la solution de lactose, la relation lactose/catalyseur diminue. Il est donc important de connaitre la pureté du lactose à utiliser pour choisir la concentration optimale du catalyseur utilisé pour la réaction d’isomérisation du lactose en lactulose (Ryabtsova, 1992).
1.3.
Lactulose : Généralités et applications
Le lactulose (4-0-β-D-galactopyranosyl-D-fructofuranose) est un disaccharide synthétique obtenu par l’isomérisation alcaline du lactose. Il est composé de deux molécules, le fructose et le galactose, qui sont liées ensemble avec une liaison β-1,4-glycosidique (Panesar Kumari 2011). Ce galacto-oligosaccharides est peu soluble et ne peut être décomposé par les enzymes digestives humaines. Il est décomposé au niveau du gros intestin par les bactéries. Il a attiré beaucoup d'attention en raison de ses nombreuses utilisations, y compris le traitement de
l'hyperammoniémie et comme un laxatif doux en application pharmaceutique (Conn & Floch 1970 ; loguercio et al., 1995). Le lactulose est également appliqué dans des préparations commerciales pour nourrissons et dans divers produits laitiers, car il favorise la prolifération de bactéries utiles pour la santé humaine comme les bifidobacteries intestinales et les bactéries lactiques. Sa décomposition bactérienne crée un milieu acide qui inhibe la croissance des bactéries indésirables ou nuisibles à la santé humaine ou animale (Seo et al., 2016).
1.3.1. Application dans le domaine alimentaire
Le lactulose est appliqué dans une grande variété d'aliments en tant que facteur bifidus ou comme ingrédient fonctionnel pour la régulation intestinale. En plus de fournir des modifications utiles pour aromatiser des aliments et modifier des caractéristiques physico-chimiques, ce sucre possède des propriétés qui sont bénéfiques pour la santé des consommateurs, notamment la capacité à améliorer la santé intestinale. En outre, le lactulose peut être utilisé comme édulcorant pour les diabétiques, en tant que substitut du sucre dans des produits de confiserie, des boissons, des poudres de lait pour nourrissons et des produits de boulangerie. Il est également utilisé dans d’autres produits comme les yaourts, les desserts lactés et dans diverses préparations alimentaires liquides ou sêches qui sont fabriquées de façon régulière pour les personnes âgées (Crittenden Payne 1996; Strohmaier, 1998;Tamura et al., 1993). Le lactulose a aussi des propriétés avec des effets souhaitables dans les produits alimentaires tels que les propriétés améliorant la saveur, le comportement de brunissement favorable et une bonne solubilité dans l'eau. De nombreux tests ont été effectués sur des yaourts, biscuits, gâteaux et chocolat pour examiner le changement de comportement du lactulose au cours du traitement des produits (Battermann, 1997). Le lactulose a également été considéré utile pour améliorer la survie des souches probiotiques disponibles dans le yaourt (Tabatabaie Mortazavi, 2008). La survie des souches probiotiques a été surveillée pendant cinq semaines à 4°C. Il a été observé que Lactobacillus rhamnosus et Bifidobacterium bifidum étaient extrêmement stables et ont une survie légèrement meilleure en présence de lactulose.
1.3.2. Application dans le domaine pharmaceutique
Dans le domaine pharmaceutique, le lactulose est principalement utilisé pour le traitement de la constipation, de l'encéphalopathie hépatique, des complications de la maladie du foie et du syndrome du transporteur de Salmonella ainsi que pour la prévention des tumeurs et pour stimuler le système immunologique. Également, le lactulose a des effets anti-endotoxine; il
10
permet de maintenir des niveaux optimaux de la glycémie et du taux d'insuline dans le sang (Schumann, 2002).
1.3.3. Constipation et encéphalopathie hépatique
Le lactulose est utilisé avec succès comme traitement physiologique contre la constipation occasionnelle ou chronique. En raison de son profil chimique sécuritaire et de son efficacité, le lactulose est utilisé dans tous les groupes d'âge, y compris pour des nourrissons et des patients âgés. Dans ces cas, il est considéré comme le médicament de choix. Le lactulose est largement utilisé dans le traitement de l'encéphalopathie hépatique et constitue un outil de choix contre cette maladie (Paik et al., 2005;. Sharma et al., 2009).
1.3.4. Porteurs de Salmonella
Le lactulose est utilisé pour traiter des patients porteurs de la bactérie pathogène Salmonella. Sa dégradation biochimique conduit à une forte baisse du pH colique, ce qui rend Salmonella incapable de survivre. Il a été démontré que le lactulose agit comme un prébiotique puissant (non typhoïde) chez des gens porteurs de Salmonella (Hoffmann, 1975). La thérapie au lactulose est prouvée (démontrée) pour être très efficace contre des espèces de Salmonella fécales et de
Shigella et réduit la prévalence de l'infection urinaire et les infections des voies respiratoires (Liao
et al., 1994).
1.3.5. Maladie inflammatoire de l'intestin
L'administration orale du lactulose supprime ou empêche l’apparition des symptômes d’endotoxémie systémique d'origine intestinale. Par conséquent, le lactulose peut être utilisé pour le traitement des maladies inflammatoires de l'intestin qui sont causées par des bactéries et des endotoxines qui ont un rôle important dans la pathogenèse de cette maladie. L’ictère obstructif est souvent accompagné par la translocation bactérienne et la septicémie subséquente. Il est démontré que l'administration de lactulose peut empêcher l’endotoxémie systémique de provoquer une réponse inflammatoire ultérieure dans un modèle expérimental d'ictère obstructif (Koutelidakis et al., 2003). La fermentation de lactulose par les bactéries du tractus gastro-intestinal peut produire une quantité considérable d'hydrogène endogène qui est une source de protection de la colite. Dans ce cas, il agit comme un antioxydant unique qui peut réduire le stress oxydatif et améliorer les symptômes d'inflammation de la maladie de l'intestin chez l’humain et l’animal (Chen et al., 2011; Panesar & Kumari, 2011; Knox et al., 2004) .
1.4.
Lactosérum : Généralités et applications
Le lactosérum est la partie liquide issue de la coagulation du lait pendant la fabrication du fromage (la partie solide est le caillé). Il existe deux types de lactosérum qui sont obtenus à partir de deux types de transformations du fromage: le lactosérum doux et le lactosérum acide. Le lactosérum doux, également appelé lactosérum de fromagerie, est produit au cours de l´élaboration des fromages qui sont obtenus au moyen de la présure. Les compositions des lactosérums appartenant à ce groupe sont proches d’un lactosérum à un autre, mais les propriétés de chacun varient beaucoup. Le pH de ces lactosérums doux peut varier de 5,2 à 6,7. Le lactosérum acide regroupe l´ensemble des sous-produits de l´élaboration des caséines, de la caillebotte ou du fromage frais. Le lactosérum de caséine provient de la fabrication par coagulation par l´acide lactique ou l´acide chlorhydrique. L’origine du lactosérum de caillebotte ou de fromage frais est indiquée par le nom lui-même. La fermentation naturelle produit de l’acide lactique, ce qui confère une acidité élevée au lactosérum. Le pH de cette gamme de produits varie de 3,8 à 4,6. Lorsque le lactosérum de fromagerie n´est pas traité avec toutes les précautions nécessaires, la poursuite de la fermentation naturelle augmente son acidité. Ce phénomène n´est pas souhaitable, car le lactosérum acidifié (et non acide) ne peut pas être considéré comme un produit naturel (Pymtet al., 2011).
1.4.1. Valorisation du lactosérum
Le lactosérum peut être valorisé de différentes manières. En effet, ce liquide est riche en lactose (sucre) et en protéines. Il contient également beaucoup de minéraux. Plusieurs voies peuvent être utilisées pour l´utilisation du lactosérum à différentes fins, tant industrielle que biotechnologique. Parmi les plus connues, le lactosérum peut servir de nourriture aux animaux. C’est la voie la plus facile de son utilisation, mais c’est aussi la moins rentable. La réincorporation du lactosérum dans des aliments peut être utilisée pour les enrichir en protéines et diminuer leurs taux de matières grasses. À cet effet, le lactosérum est soit concentré soit séché avant d´être incorporé à une matrice alimentaire. Cette manière de le valoriser comporte des limites significatives en termes de quantités utilisables dans des formulations alimentaires. Trop de lactosérum dans la matrice affecte également ses propriétés technologiques et fonctionnelles. Par exemple, une forte teneur en protéines hydrosolubles dans le lactosérum (concentré ou isolat) entraîne une grande rétention d’eau, ce qui modifie la texture du produit en la rendant beaucoup plus molle. Il faut donc trouver un compromis entre l’enrichissement et la texture du
12
produit. Une autre utilisation peut être la création d´un nouveau produit. D´un point de vue pharmaceutique, il est possible d’extraire le lactose pour la formation d’excipients ou le transformer en un produit ayant une valeur ajoutée comme le lactulose. Dans le domaine alimentaire, la création de boissons hyper-protéinées ou sucrées pour sportifs peut être envisagée en utilisant du lactosérum ou ses dérivées. Le lactosérum peut être également utilisé pour la production du lactose qui est très utilisé en tant que milieux de culture pour la production de certaines levures (Pymt et al., 2011).
1.4.2.
Perméat du lactosérum
Le perméat du lactosérum est le liquide résultant de l'ultrafiltration du lactosérum. Il est principalement composé d’eau, de lactose et de minéraux. Il contient beaucoup de cations monovalents (Na+ et K+), d’anions monovalents Cl-, de cations polyvalents (Ca2+ et Mg2+) et d’anions polyvalents minéraux tels que les anions phosphate et/ou les anions d'acides organiques aptes à former des complexes avec des cations polyvalents, tels que le lactate et le citrate (U.S.A patent Nº 006/0278217 A1, 2006). Le perméat de lactosérum est produit en grande quantité et résulte principalement des procédés de valorisation du lactosérum qui visent à produire des concentrés de protéines de lactosérum. Son utilisation est très limitée, car il contient deux fractions (lactose et minéraux) qui n’ont pas une grande valeur technologique. Par conséquent, il serait très intéressant dans une perspective industrielle de donner une valeur ajoutée au perméat de lactosérum via une transformation in situ qui consisterait à convertir le lactose en lactulose. De cette manière, le produit final pourrait être séché et commercialisé pour différentes applications, tant en alimentation humaine qu’animale. Il pourrait aussi trouver d’autres applications dans le domaine biopharmaceutique.
1.4.3. Effet du pH sur le lactosérum et son perméat
L’effet du pH sur la dénaturation et l’agrégation des protéines du lactosérum est le facteur le plus complexe, car son importance dépend de la concentration protéique qui, à son tour, agit sur l’importance de la teneur en calcium et en lactose du perméat. Bien que la formation d’agrégats soit en grande partie attribuable à la formation de liens disulfures intermoléculaires, elle est aussi grandement influencée par la formation de liens non covalents comme les ponts hydrogènes, les interactions ioniques, les interactions hydrophobiques et les forces de Van der Waals. Toutes ces liaisons sont grandement influencées par le pH et l’environnement électrostatique du liquide (Havea et al., 2004; Havea et al., 2002). Toute protéine possède un point isoélectrique (pI) qui lui
est propre et qui correspond au pH auquel la charge nette de la protéine est nulle. Aux pH inférieurs au pI, la protéine porte une charge nette positive alors qu’aux pH supérieurs au pI, elle porte une charge nette négative. Une charge nette importante occasionne une répulsion entre les protéines et nuit à l’agrégation des protéines. Au contraire, au pI, les interactions intermoléculaires non covalentes sont facilitées (Xiong, 1992). La modification de la densité de charge des protéines de part et d’autre du point isoélectrique entraîne également de légers changements dans la conformation moléculaire. Ce phénomène serait confirmé par les études de Boye et al. (1995) qui ont noté que les gels acides étaient plus mous que les gels alcalins. Ces observations mettent en évidence les effets combinés du pH et de la présence de calcium ionique. Aux bas pH, les protéines sont chargées positivement et sont en présence de Ca2+ sans toutefois interagir fortement avec ces cations. Par contre, aux pH supérieurs au pl, les protéines sont chargées négativement et se lient facilement au Ca2+ en solution par échange ionique pour former un gel plus rigide. Il y a donc un pH optimal lié à la concentration en calcium où la protéine est chargée négativement, mais neutralisée par les ions divalents (Emond, 2014). Pour ce qui est du perméat de lactosérum, l’absence de protéines expose les minéraux aux effets du pH. Ainsi, un milieu acide serait favorable à la formation d’une solution quasi idéale dans laquelle les cations divalents sont très solubles. Par contre, une augmentation du pH entraine une facilité de formation de complexes ioniques dont la solubilité est nettement amoindrie. Cette situation est critique dans le processus de réactions chimiques nécessitant un milieu basique comme c’est le cas dans l’isomérisation du lactose en lactulose où le pH doit être au-dessus de 10. Donc, il est très important de connaître les conditions acido-basiques du perméat de lactosérum pour mieux l’utiliser dans un processus de valorisation. Dans notre travail de recherche, l’intérêt est particulièrement centré sur la teneur en lactose dans le perméat de lactosérum, car il est caractérisé par une quantité de lactose très appréciable pour la synthèse du lactulose, tel que montré dans le Tableau 1.1 qui illustre la composition moyenne du lactosérum.
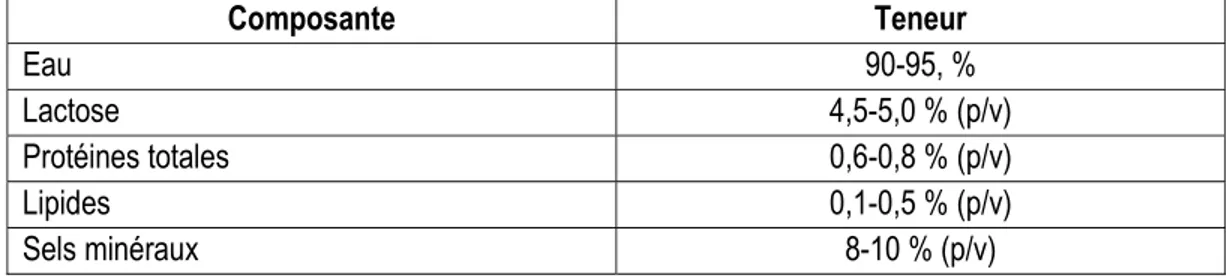
Tableau 1.1 : Composition générale du lactosérum (Kosikowski Wzorek, 1977).
Composante Teneur Eau 90-95, % Lactose 4,5-5,0 % (p/v) Protéines totales 0,6-0,8 % (p/v) Lipides 0,1-0,5 % (p/v) Sels minéraux 8-10 % (p/v)
14
La teneur en lactose, le niveau de minéralisation et le pH initial du perméat de lactosérum sont tous des éléments essentiels dans la réaction de conversion du lactose en lactulose, en particulier, en utilisant la technologie d’électro-activation qui est un système dynamique.
1.5.
Généralités de l’électro‐activation
L’électro-activation en solution est principalement basée sur des réactions qui ont lieu dans un milieu aqueux dont l’eau joue un rôle de premier plan et d’une grande importance. En effet, l’eau est un composant vital de tous les systèmes biologiques et joue un rôle très important sur les propriétés chimiques et physiques des solutions aqueuses. Dans les années 70 du dernier siècle, on a découvert la possibilité d’utiliser les propriétés de l’eau et des substances aqueuses pour effectuer différents types de réactions sans ajout d’agents chimiques et que ce principe est applicable dans plusieurs procédés technologiques. Il y a eu donc une augmentation de l’intérêt scientifique à propos de l’utilisation de l’eau comme substrat dans des réactions chimiques non conventionnelles (Kirpichnikov et al., 1986). De nombreuses études récentes ont mis en évidence que les connaissances des propriétés de l’eau et des solutions aqueuses ne sont pas complètement satisfaisantes et, par conséquent, plusieurs paramètres et caractéristiques de son utilité biologique et chimique restent à découvrir. Les propriétés physiologiques de l’eau sont affectées par sa composition chimique, son degré de pureté et d’autres paramètres physiques complexes tel que le niveau d’excitation électronique de la molécule d’eau. Ceci caractérise l’eau comme un système structuré de façon complexe, plus particulièrement sous un point de vue énergétique (Kloss, 1988). Ce système est plus évident lorsque l’eau est dans un état thermodynamique déséquilibré (Petrushanko Lobyshev, 2001). L’activation de l’eau et son passage à un stade thermodynamiquement non équilibré peut se faire par voie chimique, physique ou biologique. L’eau activée est caractérisée par une réactivité physico-chimique et biologique élevée (Kim et al., 2000). Un des plus importants paramètres est son potentiel d’oxydoréduction qui, pour l’eau potable, est moyennement positif. Les propriétés physico-chimiques de l’eau et des solutions aqueuses peuvent être modifiées au moyen de l’électro-activation. Généralement, ces modifications ont lieu dans l’interface proche de l’électrode dans un système basé sur l’électrolyse. L’eau passe à un stade métastable grâce au principe de l’électrolyse de l’eau dans des conditions minimales de chauffage. L’eau activée à proximité de la cathode présente une activité d’électrons élevée et des capacités réductrices, tandis qu’à proximité de l’anode, l’activité des électrons est inhibée et présente des capacités oxydatives. La modification du potentiel d’oxydoréduction et le pH critique des solutions électro-activées dans un
stade métastable font en sorte que ces dernières soient très réactives et convenables pour des réactions chimiques applicables à l’industrie alimentaire et à la biotechnologie (Izumi, 1999; Pastukhov Morozov, 2000; Suzuki et al., 2002).
1.5.1. Principe électrochimique de l’électro‐activation
L’électro-activation des solutions aqueuses est basée sur un phénomène appelé électrolyse (Shaponoshnik Kesore, 1977). Lorsqu’on applique un champ électrique à une solution aqueuse, les électrons et les espèces ioniques chargées se déplacent vers l’électrode de charge opposée. Dans l’électrolyse, deux phénomènes ont lieu simultanément. D’une part, une réaction de réduction s’effectue à la cathode (électrode chargée négativement); ce qui fait que les électrons (e-) de la cathode soient transférés à des ions de charge positive (comme l’hydrogène pour former du gaz) (Fig.1.4).
Réactions à la cathode : → ↑
→
D’autre part, une oxydation a lieu à l’anode (électrode chargée positivement). C’est alors que les électrons libres migrent vers la cathode. L’oxygène chargé négativement migrera vers l’anode, ce qui génère de l’oxygène sous forme de gaz à cause du transfert d’électrons.
Réaction à l’anode : → ↑
Fig. 1.4 : Représentation schématique du principe électrochimique d’un réacteur
16
Ces réactions seraient impossibles sans l’apport externe d’énergie qui est généralement appliquée sous forme électrique par le passage d’un courant électrique généré par une source externe. L’électro-activation est une science relativement récente (le terme activation électrochimique a été inventé par Bahkir (1975), ce qui fait que la thermodynamique du procédé reste encore inconnue (Shirahata et al., 2012). Il faut svoir que l’intensité maximale de l’effet électro-physique sur les molécules d’eau se donne, de façon prédominante, à l’interface électrode/solution (donc à proximité de la surface de l’électrode). Le réacteur d’électro-activation doit donc être conçu de façon à assurer un traitement maximal des solutions à cette interphase. Il faut savoir, quand même, que la génération de solutions électro-activées dépend aussi d’autres facteurs comme la température, le débit de la solution et la concentration des sels en solution (Hsu, 2003). L’électro-activation se fait généralement dans un dispositif d’électrolyse que l’on appelle cellule d’électro-activation. Sous un point de vue fondamental, une cellule d’électrolyse peut être considérée comme un dispositif qui est composé d’une paire d’électrodes submergées dans un électrolyte qui permet d’assurer la conduction d’ions lorsque l’on applique un courant électrique au système. La connexion entre l’anode et la cathode est essentielle pour la continuité du circuit. Dans le système d’électrolyse, les ions migreront de façon continue vers l’électrode de signe opposé. Pour s’assurer de la production d’une solution électro-activée avec des propriétés métastables, il est impératif de maintenir les ions visés dans une des sections (Aider Gimenez-Vidal, 2012). Un dispositif d’électro-activation peut permettre de produire au moins deux types de solutions. D’une part, des solutions avec des propriétés oxydatives (anolytes). Pour ces dispositifs, la solution visée est traitée dans l’anode. D’autre part, la versatilité du dispositif permet d’obtenir aussi des solutions avec des propriétés réductrices (catholytes). Dans ce cas, la solution visée sera obtenue à la cathode. N’importe quel type de solution que l’on cherche à obtenir (à l’anode et à la cathode) doit être séparé par un diaphragme qui pourra être une membrane mono-polaire ou neutre et qui permet d’assurer le maintien des propriétés ciblées comme le pH et le potentiel redox. Les premiers dispositifs d’électro-activation utilisaient des diaphragmes avec une structure qui est caractérisée par une perméabilité non sélective (céramiques, nylon, polyvinyles, etc.). Les développements en matière de membranes ioniques sélectives ont permis d’augmenter les performances de l’électro-activation. Ces membranes peuvent donc remplacer les diaphragmes inertes de façon à moduler facilement les propriétés physico-chimiques et la composition structurelle des solutions électro-activées. Cependant, il y a certaines restrictions qu’il faut tenir en compte en ce qui concerne le matériel de la membrane et il faut aussi assurer certaines exigences (Yahagi et al., 2000) comme:
Le matériel utilisé pour fabriquer les électrodes doit posséder une bonne conductivité électrique, une activité catalytique élevée et être sélectif envers la réaction électrochimique visée.
Le matériel des électrodes doit être suffisamment résistant pour maintenir ses propriétés originales pendant une longue période de temps.
Le matériel doit avoir un coût le plus économique possible.
La position et la forme des électrodes doivent assurer une distribution uniforme du courant appliqué.
L’électrode doit être inerte et insoluble lorsque le voltage est appliqué au système et ce pour les applications alimentaires, (Gimenez-Vidal, 2013).
Dans certains cas, il est important de maintenir la capacité d’échange des membranes pour permettre à l’électro-activation de fournir le résultat escompté. Pour cela, il est possible de combiner le réacteur d’électro-activation avec un système d’échange ionique. De cette manière, il serait possible de créer des conditions de régénération continue, tant de la membrane que du matériau échangeur d’ions qui peut être une résine.
1.6.
ÉXCHANGE IONIQUE
Ce procédé consiste à exploiter la capacité des résines échangeuses d'ions entre une phase solide et une phase liquide de manière réversible, à savoir être en mesure de retourner à son état d'origine sans modification permanente de la structure du solide. En règle générale, la grande utilité de l'échange d'ions repose sur le fait qu’à plusieurs reprises, il est possible d’utiliser les matériaux échangeurs d'ions qui peuvent être régénérés suite au changement qu’ils ont subis dans la phase opérationnelle dite non permanente. Les résines échangeuses d'ions sont composées de deux parties principales: une partie de structure (matrice de polymère) et une partie fonctionnelle, qui comprend le groupe ionique actif ayant un ion fixe et un ion mobile (échangeable). Les matériaux d'échangeurs d'ions du commerce sont faits en matière plastique synthétique tels que les polymères de styrène et de divinylbenzène (Hidalgo et al., 2006). Ces matériaux se retrouvent souvent sous forme de billes qui peuvent servir de lit dans une colonne d’échange ionique.
18
1.6.1. Classification des résines échangeuse d’ions
Les résines polymériques sont classées selon le grade de réticulation de la matrice (polymère) de structure. Toutefois, ce principe ne s’applique pas pour les résines faibles d'acides qui sont faites en une seule étape. La synthèse des résines est une opération à deux ou à trois étapes impliquant la polymérisation, des réactions intermédiaires et la fonctionnarisation (Miller et al., 1981). Toutes ces étapes sont déterminantes quant aux propriétés de base et à la performance globale de la résine. Il est donc très important de bien comprendre les propriétés des milieux réactionnaires dans lesquels on voudrait intégrer un système d’échange ionique.
1.6.2. Matrice d’échange ionique macroporeuse
Les résines macroporeuses sont habituellement fabriquées avec des niveaux élevés de réticulation du polymère de base. Il existe cependant des résines macroporeuses produites par une réticulation à des niveaux similaires à ceux des résines du type gel. Dans les deux cas, les résines macroporeuses ont légèrement moins de capacité d’échange que les résines de gel correspondantes. Les résines macroporeuses, avec leur surface effective élevée, peuvent faciliter l'échange d'ions dans un processus continu ou en batch. De plus, elles donnent accès à des sites d'échange d'ions plus gros et peuvent être utilisées avec pratiquement n'importe quel solvant, indépendamment du fait qu'il est un bon solvant pour le polymère non réticulé ou non. En général, le solvant a un effet non significatif sur le changement du volume des billes de la matrice échangeuse d’ions. On les trouve sous forme de perles plus ou moins rigides, ce qui facilite leur élimination à partir du système de réaction (Miller et al., 1981). Par conséquent, ce genre de matrice échangeuse d’ions serait compatible avec un réacteur d’électro-activation.
1.6.3. Matrice échangeuse d’ions en forme de gel
Les résines échangeuses d'ions en forme de gel sont fortement ioniques, réticulées par covalence, poly-électrolytes insolubles et sont à l’origine fournies sous forme de perles. Les perles ont soit une structure interne dense avec très peu de pores (résines de gel, également appelées résines microporeuses) ou soit ont une structure poreuse canalisée (état macroporeux ou macro-réticulaire). Elles sont généralement préparées à partir de styrène et différents niveaux de réticulation. C’est le divinyl-benzène qui détermine le niveau de la porosité des particules. Les perles poreuses peuvent être faites aussi par l'ajout d’homopolystyrène qui est soluble dans le mélange de monomères. Par la suite, il subit une opération de lessivage avec le toluène. Les
perles de précurseurs PS-DVB sont post-fonctionnalisées pour produire la résine finie. Ainsi, il existe quatre types primaires de résines d'échange ionique:
1. Résines-fortes échangeuses de cations qui contiennent des groupes fonctionnels à base
d’acide sulfonique ou des sels correspondants.
2. Résines-faibles échangeuses de cations contenant des groupes fonctionnels d'acides
carboxyliques ou les sels correspondants.
3. Résines-fortes échangeuses d'anions contenant des groupes ammonium quaternaire. Parmi
ces groupes, il existe deux types: résines qui contiennent du trialkyl-chlorure d'ammonium ou de l'hydroxyde (type I) et résines qui contiennent du dialkyl-ammonium, de chlorure ou de l'hydroxyde de 2-hydroxyéthyle (type II).
4. Résines-faibles échangeuses d'anions contenant du chlorure ou de l'hydroxyde d'ammonium
(Resins, n.d. catalogue Sigma-Aldrich).
1.7.
Production de lactulose par des résines d’échange ionique
La production de lactulose conventionnelle requiert l’utilisation de divers produits chimiques comme de l’hydroxyde de sodium ou de potassium, des borates et des aluminates. Des procédés de purification par des résines d’échange ionique sont également utilisés pour assurer une bonne pureté du produit final. Comme les résines échangeuses d’anions fournissent des conditions semblables à un milieu alcalin conventionnel, certaines études ont été rapportées quant à leur utilisation dans la conversion du lactose en lactulose. Ainsi, des résines d’échange d’anion ont été utilisées pour intensifier l’isomérisation du lactose en lactulose en exploitant l’échange des ions hydroxyle OH- entre les solutions en réaction et les résines (Russian Patent No 2101358, 1998). Les avantages de l’utilisation des résines d’échange ionique au lieu des réactions chimiques conventionnelles sont les suivantes :
Pas besoin d’ajouter un catalyseur pour le procédé d’isomérisation. Pas besoin de l’étape de déminéralisation.
Pas besoin d’opérations de purification additionnelles pour séparer les colorants du produit final.
Le processus est plus rentable par comparaison aux méthodes traditionnelles. Le lactulose produit par cette technologie peut être utilisé dans les aliments pour enfants et dans certains produits alimentaires spécialisés qui contiennent des probiotiques comme les bifidobactéries qui sont connues pour leur effet positif sur la santé intestinale, tant chez l’humain que l’animal (Hramtsov et al., 2004).