HAL Id: dumas-01699589
https://dumas.ccsd.cnrs.fr/dumas-01699589
Submitted on 5 Feb 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
échantillons collectés
Jean-Michel Drevait
To cite this version:
Jean-Michel Drevait. Approche épidémiologique de la toxoplasmose à Port-Gentil (Gabon) : étude comparée de trois coffrets Elisa pour le sérodiagnostic de la toxoplasmose sur les échantillons collectés. Sciences pharmaceutiques. 1988. �dumas-01699589�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
Domaine de laMerci
ANNÉE
1988
TITRE DE LA THESE
APPROCHE
EPIDEMIOLOGIQUE
DE LA TOXOPLASMOSE
A
PORT
-GENT
IL
(GABQN
)
Etude comparêe de troiscoffrets ELISA pour lesêrodiagnostic de latoxoplasmose sur les êchantillons collectês.
T
H
E
S
E
Prêsentêeà l'UNIVERSITE SCIENTIFIQUE TECHNOLOGIQUE, ET MEDICALE de GRENOBLE,
pour obtenir le grade de DOCTEUR EN PHARMACIE
par Monsieur DREVAIT Jean Michel
Cette thèse sera soutenue publiquement le13 dêcembre 1988 devant Monsieur leProfesseur A. FAVIER, Prêsident du Jury,
Madame leProfesseur A. GOULLIER-FLEURET, Monsieur le Docteur P. REYNIER
[Données à caractère personnel]
A notre Président de Thèse :
Monsieur le Professeur A.~.· -eA_viER
Nous le remercions de l'accueil et de la chaleureuse sympathie qu'il nous a toujours témoignés et de 1 'ha:meur qu 'il nous a fait en voulant bien accepter de présider notre Jury de Thèse.
Nous souhaitons que ce travail soit pour lui le témoignage le plus sincère de notre reconnaissance.
Nous la prions de trouver ici l'expression de notre reconnaissance pour l'intérêt qu'elle a manifesté pour
ce travail et pour l'honneur qu'elle nous fait en acceptant de juger cette thèse.
Monsieur le Docteur P. REYNIER
Il nous a inspiré ce travail et a su nous
guider tout au long de cette étude. Nous tenons tout
particuliè-rement à lui adresser nos remerciements sincères pour les conseils qu'il nous a prodigués au cours de la rédaction de ce travail et lui témoigner de toute notre amitié.
Nous 1:enons à remercier :
Le Personnel du Labora-toire de PARASITOLOGIE pour sa collabora-tion e1: sa gen-tillesse.
Le personnel du.Labora1:oire de l'Hôpi-tal Général de PORT-GENTIL, ainsi que leur responsable,
Monsieur L. N'KOGHO EDZANG, pour l'accueil chaleureux qu'ils
A mes parent:s,
- INTRODUCTION
- TOXOPLASMOSE : CARACTERES GENERAUX
1 -
RAPPEL EPIDEMIOLOGIQUE ET CLINIQUE
1 -
1 -
HISTORIQUE
1- 2-
LE "PARASITE:
1 - 3 -
LE CYCLE
1 - 4 -
EPIDÉMIOLOGIE
1 - 5 -
RAPPEL CLINIQUE
II - SERODIAGNOSTIC
II -
1-
TEST DE LYSE
ou
DYE .TEST:
DE SABIN ET FELDMAN
II -
2 -
RÉACTION DE FIXATION DU
COMPLÉMENT
II -
3-
RÉACTION D'AGGLUTINATION
DIRECTE
II -
4 -
RÉACTION D
1HÉMAGGLUTINATION
PASSIVE
II -
5 -
RÉACTION AU LATEX
Il -
6 -
IMMUNOFLUORESCENCE
p. 1 p. 2 p. 2 p. 3 p. 6 p. 8 p. 9 p. 14 p. 14 p. 15 p. 16 p. 16 p. 16II -
8 -
!SAGA
- COMPARAISON DES TROIS COFFRETS ELISA
I - DESCRIPTION DES COFFRETS
I - 1 -
ABBOTT
1 - 2 -
BoEHRINGER
I -
3 -
0RGÉNIC
II - RESULTATS
III - DISCUSSION
III -
1 -
PRÉLIMINAIRE A LA
DISCUSSION
III -
2 -
DISCUSSION SUR LE
MATÉRIEL
p. 22 p. 23 p. 27 p. 34 p. 42 p. 45 p. 56 p. 57III -
3 -
DISCUSSION SUR LES
p. 61SÉROLOGIES IGG
III -
4 -
DISCUSSION SUR LES
p. 65-APPROCHE EPIDEMIOLOGIQUE DE LA TOXOPLASMOSE
P· 73A
PORT-GENTIL (GABON)
GENERALITES SUR LE GABON ET PORT-GENTIL
p. 73I
-LE GABON.
I
-
1
-
GÉNÉRALITÉS GÉOGRAPHIQUES
p. 73I
-
2
-
GÉNÉRALITÉS ÉCONOMIQUES
p. 75I
-
3
-
GÉNÉRALITÉSDÉMOGRAPHIQUES
p. 75ET SANITAIRES
I
I
-
PORT -GENTIL
1
-
1
-LA VILLE
p. 76I
I
-
2
-
LES HÔPITAUX
p. 78 A ~ ~METHODES
p.79I
-ECHANTILLON TESTE ·
·
II
-METHODES
RESULTATS
p. 80I - 1 -
COMPARAISON/AFRIQUE
I - 2 -
CoMPARAISON/GABON
I - 3 -
FACTEURS ÉPIDÉMIOLOGIQUES
1 NFLUENCANTS.
II - ANALYSE PAR TRANCHE D'AGE
III - ANALYSE SELON LE SEXE
IV - ANALYSE DES FEMMES ENCEINTES
V - ETRANGERS
VI - ANALYSE SELON LES ETHNIES
VII - IMPACT CLINIQUE DE LA TOXOPLASMOSE
- CONCLUSION
- ANNEXES
- BIBLIOGRAPHIE
p. 90 p. 92 p. 93 p. 97 p. 98 p. 98 p. 99 p. 99 p. lOO p. 101La Toxoplamose est une parasitose ~ ~
dans les pays ~ et notamment laFRANCE, où elle fait.
l'objetd'un soin attentif, et dont le ~ est ~
par une ~ ~ ~ .
Ainsi, apparaissent chaque
~ .
de nombreuses techniques nouvelles
~ dans le but constant ~ ce
A ~ sur le continent Africain, cette maladie ne represente pas une ~ sanitaire, son impact
semble peu connu, lesétudes ~ sont rares et disparates.
Nous avons eu lachance d'effectuer un séjour de seize mois ~ sein du Laboratoire de l'HÔpital Général de
PORT-GENTIL (GABON), qui nous a permi de rassembler un
~ de 298 ~ .
Les buts de ce travail sont les suivants
- Dans une ~ partie, nous comparons
troiscoffrets ELISA, pour le ~ de laToxoplasmose
(ABBOTT, BOEHRINGER, ~ sur notre~ ~.
A travers cette comparaison globale, nous envisageons les avantages et les ~ des ~
ELISA, ainsi que les ~ ~ ~ chaque
technique ~ .
- La ~ partie consiste en
une approche~ ~ de laToxoplasmose ~ ~ ~
partir des ~ obtenus. Nous les analysons en les
comparant aux ~ ~ ~ ~ dans ce domaine sur le continent Africain.
T 0 X 0 P L A S M 0 S E
I - R A P P E L E P I D E MI 0 L 0 G I Q U E E T
C L I N I Q U E (3, 8, 19, 26, 47, 48)
La Toxoplasmose est une anthropozoonose cosmopolite due
à
Toxoplasma gondii, protozoaire intracellulaire, et dont le diagnostic repose essentiellement sur des techniques sérologiques, sans cesse améliorées.I - 1 - H I S T 0 R I Q U E
C'est en 1908,
à
l'InstitutPasteur de TUNIS, que NICOLLE & MANCEAUX isolentun protozoaire chez un petit rongeur, leGondi, lorsde travaux sur laLeishmaniose.Ilsl'appellent tout d'abord Leishmania gondii, puis, en référence
à
sa forme arquée, Toxoplasma gondii.Le premier cas humain ne sera décrit qu'en 1923 par JANKI.
'
C'est surtout a partir de descriptions cliniques se multiplient, aussi formes acquises que congénitales.
1937, que
bien pour lleess
mis au point d'apprécier la
Le premier test sérologique apparait en 1948, par SABIN et FELDMANN, test qui permettra fréquence des formes inapparentes (68).
Une grande ~ est franchie en 1970, avec la
mise en évidence du cycle sexue chez lechat, et son incidence dans l'épidémiologie de laToxoplasmose (29).
Depuis 1963, les techniques sont multipliées, avec en particulier, l'immunofluorescence, l'agglutinationdirecte lestechniques ELISA.
sérologiques se l'apparition de et plus récemment
- 3.
I - 2 - L
-
-
E-
-
P-
-
-
-
-
A-
-
-
R-
-
A-
-
-
S-
I-
-
-
T-
-
-
E-
-
Morphologie et Cycle (26) Toxoplasma gondiiintracellulaire existant sous différentes :
est
trois formesun évoparluatsiveites - la forme végétative,
encore tachyzoïte, appelée ~ ou
- lekyste (et pseudokyste) - l'oocyste
I - 2 - 1 -Forme ~ (figure·l)
Appelée tachyzoïte du faitde sa multiplication trèsrapide, cette forme ne s'observe que dans laphase aiguë du parasitisme.
long sur effilé et
C'est un élément en forme d'arc 2
à
4~ large, nucléé, présentant unun pÔle postérieur plus arrondi.
de 4
à
7fl de pÔle antérieur Son développement est obligatoirement intracellulaire (système réticula-endothélial).Sa multiplication, rapide, se fait par endodyogénie, aboutissant
à
ladestruction de lacellule-hôte, les·tachyzoftes libérés, après un bref passage dans leplasma, vont paraslter une autre cellule.Cette forme végétative est très fragile et est facilement détruite par les anticorps circulants, ainsi que par l'acidechlorhydrique gastrique.
I - 2 - 2 - Le pseudo-kyste
' '
Ilmesure 15 a 30~ et renferme lOO a 200
retournement du ~~ ~~~···~~ d6part des micro-tubules interne
~ . ... ~~ .. couo!de avec sa gq.ine externe
5~ de vacuo les .... ~.. ..
dans le cono!de
~
cytoplasmique complexe
trimembranaire
réticulum
endoplasmique ~~~~ .
densification du complexe
interne au niveau de la dfpression di te ~
extrémité
~~~~~~
plurimembranaire(?)
~ du
complexe interne
~ ~ vacuo1e
posté-rieure
..•r:IH---devenir des micro-tubules
?
invagination dite postérieure
TOXOPLASMA GONOII: TROPHOZOITE d'après VIVIERS (78)
'
Ilcorrespond a une multipiication active du paraslte.
Il caractérise la phase l'infectionet n'a qu'une durée ephémère. I - 2 - 3 - Le kyste proliférative - 5 -de Elément sphérique ou (15 à 20~ de diamètre, pouvant
contient quelques centaines à trophozoïtes à multiplication lente, ovoÏde de taillevariable ~ jusqu'à ~ il plusieurs milliers de appelés bradyzoïtes. Le kyste représente la forme de résistance du toxoplasme. Il persiste pendant la ph ase chronique de l'affection, durant toute la vie de l'hÔte contaminé. On les retrouve principalement dans lesmasses musculaires et letissu nerveux.
Ilrésiste à des températures allant jusqu'à 66°,
à
l'acide ~~ et n'est détruit que par lacongélation prolongée et la déssication. La paroi du kyste constitue une barrière contre les anticorps et lesmédicaments antitoxoplasmiques. Elle ne laisse passer que de trèsfaibles quantités d' antigènes apportant ainsi un stimulus répété permettant une immunité totale et définitive contre le toxoplasme.
Ce kyste aura une tripleincidence
- épidémiologique (contamination par ingestion de viande parasitée)
pathogénique (localisation nerveuse occulaire).
- immunologique (diagnostic sérologique). 1 - 2 - 4 - L'oocyste
ou
Autre forme de résistance du toxoplasme, l'oocysteest un élément ovoÏde de 9 à 14~ résultant d'une reproduction sexuée se déroulant uniquement chez lechat.
Les trophozoïtes ingeres avec la chair d'un animal parasité pénètrent dans les cellules de ~ grêle
où ils s'y multiplient et produisent ainsi des formes multinucléées : les schizontes. Ceux-ci donnent naissance
à
des mérozoïtes qui pénètrent dans une autre cellule de l'épithélium intestinalet se transforment en cellule mâle ou femelle, dont laconjugaison donne naissanceà
l'oocyste.Ces oocystes sont rejetés avec les fèces du chat, et après une maturation de 2
à
3 jours, deviennent infestants. Ils survivent longtemps dans le milieu extérieur s'ilest humide, et representent l'autremode de contamination dans laToxoplasmose acquise.I - 3 - L E C Y C L E (figure 2) (3) Ilest double
I - 3 - 1 - Cycle incomplet
Ilse déroule chez tous les homéothermes. La contamination s'effectue par ingestion de kystes contenus dans laviande parasitée.
La membrane kystique est digérée dans lalumière intestinaleet libere les bradyzoïtes qui vont pénétrer dans les cellules du système réticula-endothélial et s'ymultiplier
(tachyzoïtes).
Après quelques jours, circulants empêcherait lepassage provoquerait l'enkystement.
I - 3 - 2 - Cycle complet
Ilnécessite un hÔte produit une multiplication sexuée contamine par voie digestive et les alors parallèlement :
l'apparitiondes anticorps d'une cellule
à
l'autreetdéfinitif chez qui se : le chat. Le chat se deux cycles se développent
, '
- Le cycle asexue qui aboutit a laformation de kystes.
['
Hô
te
dé
f
in
i
t
i
f
(mu
l
t
ip
l
ica
t
ion
pa
ra
-s
i
ta
i
re
sexuéé)
i
'
Hô
tes
in
te
rméd
ia
i
res
(mu
l
t
ip
l
ica
t
ion
pa
ra
-s
i
ta
i
re
asexuée
.
)
l
~
A
l
imen
ts
sou
i
l
lés
l
V
iande
pa
ras
i
tée
consommée
,_
sa
ignan
te
·
t
-.
.
.. -"
'
't
~
[(
Jn
·
-j
~
-.
.,->
r>
Toxop
lasmose
.
..
acqU
ise
-··
Toxop
lasmose
;
congén
i
ta
l
(
-_
Figure 2 : d'après EMC Maladies infectieuses (3)
1
Cyc
les
du
Toxop
lasme
.
-Le cycle sexué qui conduit
à
l'élimination d'oocystes 3à
10 jours après la contamination, et ceci pendant uneà
trois semaines.Il fait aussi intervenir comme précédemment les hÔtes intermédiaires, chez lesquels se produira uniquement une multiplication parasitaire asexuée, mais qui se contamineront aussi bien en ingérant des kystes (carnivores, omnivores) que des oocystes (herbivores, omnivores).
I - 4 - E P I D E M I 0 L 0 G I E I - 4 - 1 - Généralités
La Toxoplasmose est une affection cosmopolite. Sa fréquence est cependant variable selon les pays, voinles régions en fonction de l'alimentation, du mode de vie et du niveau d'hygiène.
En France, cette prévalence est de 50
à
60 %. Le réservoir de germe est double, tellurique et animal, correspondantà
chacune des formes infestantes.Le réservoir animal comprend toutes les espèces homéothermes. Certaines espèces, représentant une part importante de notre alimentation, sont particulièrement infestées :ovins, bovins (78 %), porcins (25 %).
I - 4 - 2 - Mode de transmission On en décrit deux,
des formes de la maladie. correspondant chacun a) Toxoplasmose acquise
'
a une
La contamination se fait par voie digestive après ingestion de viande rarasitée (consommée srue 9u saignante) ou d'aliments souilles par les oocystes elimines avec les déjections de chats parasités.
9
-b) Toxoplasmose congénitale (4)
Elle va résulter d'une toxoplasmose maternelle. La transmission au foetus se fera pendant la phase parasitémique de la mère, les parasites se développant alors dans différents tissus, notamment au niveau du placenta.
foetale sans placentaires. lieu que dans
Il ne peut y avoir une contamination qu'il y ait des lésions ou des anomalies Ceci explique que la transmission in utéro n'ait 30
à
40 % des toxoplasmoses maternelles.Il est par ailleurs admis que le risque de contamination de l'enfant augmente en fréquence avec la taille du placenta et donc l'âge de la grossesse, et qu'inversement une toxoplasmose congénitale est plus grave si elle est contractée en début de grossesse.
La figure (3) montre bien qu'en cas de toxoplasmoe congénitale contractée au 1er trimestre de la grossesse, 83 % des enfants sont sains, mais que la plupart des contaminés présentent une atteinte clinique grave.
Si la contamination a lieu pendant le 2ème trimestre de la grossesse, on ne retrouve que 75 % d'enfants
indemnes.
Enfin, si elle se produit au cours du 3ème trimestre, seuls 35 % sont sains, mais la plupart des enfants atteints ne présentent qu'une infection subclinique.
I - 5 - R A P P E L C L I N I Q U E I - 5 - 1 - Toxoplasmose acquise
Les formes inapparentes sont de loin les plus nombreuses.
Les formes apparentes, présentant une d'incubation et d'invasion cliniquement muette, caractérisées
à
la phase d'état par :phase sont - une polyadénopathie (principalement cervicale) - une fébricule
à
38 - 38°5Il faut noter quelques formes cliniques exceptionnelles, comme la méningite toxoplasmique, des formes occulaires ou des formes exanthématiques.
I - 5 - 2 - Toxoplasmose congénitale (4) la maladie.
contractée en foetale varie
Elle constitue l'aspect le plus préoccupant de Elle fait suite
à
une toxoplasmose maternellecours de grossesse. La gravité de l'infestation selon 1 'âge de la grossesse (Voir figure 3).
a) Avortement spontané
Il peut survenir lors d'une toxoplasmose aiguë maternelle au tout début d'une grossesse.
b) Toxoplasmose neuro-occulaire
C'est la forme majeure. Elle s'observe dès la naissance et correspond
à
une contamination maternelle du premier trimestre de la grossesse.Elle est caractérisée par
-des anomalies de l'aspect et du volume du crâne macrocéphalie avec hydrocéphalie externe, bombement des fontanelles et des sutures.
-des signes neurologiques variés (convulsions généralisées, troubles du tonus, modifications des réflexes, troubles végétatifs).
- des calcifications intracrâniennes. - des signes occulaires
*
microphtalmie, strabisme,*
choriorétinite pigmentaire maculaire très caractéristique.11
- 11
-ENFANT SAIN= 61%
839o
75%
35%GRAVITE DE LA TOXOPLASMOSE CONGENITALE AUCOURS DE LA GROSSESSE
~ congénitale avec atteinte clinique plus ou moins
grave
~ infecté sans signes cliniques
c
:
:
J
:
enfant indemneL'évolution de cette forme est severe, aboutissant
à
lamort, ou1par passageà
lachronicité, amenantdes retards psychomoteurs très importants. c) Formes viscérales
La contamination in utéro est souvent plus tardive. Elles sont caractérisées par :
-un ictèrenéonatal avec hépatosplénomé -galie.
- des hémorragies muqueuses. - des atteintes digestives.
Leur évolution est habituellement mortelle. d) Formes dégradées ou retardées
La contamination in utéro est encore plus tardive.
Elles peuvent être reconnues
naissance, ou quelquefois après plusieurs années. dès la Elles comprennent l'un ou l'autre des signes suivants
- retardpsychomoteur,
- augmentation du ~ cr;nien
plus rapide que lanormale.
- crises convulsives,
13
-' e) Formes inapparentes ou infracliniques a la naissance
Elles sont tres nombreuses. Leur seule traduction est sérologique. Il convient de les dépister et de les traiter pour éviter une éventuelle décompensation avec passage aux fo·rmes décri tes précédemment.
I - 5 - 3 - Toxoplasmose chez les immunodéprimés (18, 45)
Cet aspect particulier est de plus en plus mis en avant du fait de l'apparition de nouvelles situations d'immunodépression severe telles les greffes d'organes et le SIDA.
Sa principale forme
localisation cérébrale (50 % des cas) clinique est une Son évolution spontanée est fatale en quelques mois.
Il faut aussi noter que la physiopathologie de la maladie dans ce cas est particulière, puisqu'il s'agit essentiellement de reviviscence d'infections anciennes.
'I'oxoplasma gondii se comporte alors comme un germe opportuniste.
II - S E R 0 D I A G N 0 S T I C La mise
extrêmement difficile, essentiellement sur des
en évidence du parasite étant le diagnostic de latoxoplasmose repose techniques sérologiques.
Nous nous efforcerons, dans ce paragraphe, d'en faire le tour, en développant particulièrement lesprincipes des techniques utilisées dans notre étude.
II - 1 - TEST DE LYSE OU DYE TEST DE SABIN ET FELDMAN (68) - C'est leplus ancien des sérodiagnostics.
- Les antigènes sont des ~ entiers vivants.
et lysent, qui perdent de phase.
- Les anticorps apportés en présence de complément,
alors leur réfringence au
par le sérum se fixent laparoi des parasites microscope en contraste - C'est un testprécoce, sensible et spécifique, mais complexe d'éxécution.
- C'est le test de référence qui a servi étalonner le sérum OMS titréen unités internationales. II - 2 - LA REACTION DE FIXATION DU COMPLEMENT (52)
~
a
Elle fut décrite en 1937 par NICOLAU ET RAVELO. Sa spécificité trèsvariable selon les antigènes utilisés, et son manque de sensibilité par rapport ~ techniques de
référence, font qu'elle n'est plus guere utilisee maintenant. II - 3 - LES REACTIONS D'AGGLUTINATION DIRECTE
Elles utilisent letoxoplasme entier, traitéde deux manières possibles.
- 15
-- antigènes formolés
Ces techniques ont été proposes par FULTON dès 1959~ et par PELOUX et COUZINEAU en 1973 ~. Le principe repose sur la formation d'un immuno-complexe antigène -anticorps, visualisé, si la réaction est positive, pdr la présence d'un voile d'agglutination.
Cette réaction est trèssensible aux IgM. Si le sérum est traitépar le 2 Mercapto-éthanol (2 ME), les IgM sont dissociées, et ilne reste plus que les IgG pour réagir avec l'antigène.
Une différence de titre dilutions avant et après traitement possibilité de présence d'IgM.
supérieure
à
deux au 2 ME indique la- antigènes sensibilisés
Cette technique plus récente a été proposée par DESMONTS (21).
C'est un testde dépistage.
Les sérums sont sytématiquement traités au 2 ME.
L'agglutination ne mettra en évidence que les IgG spécifiques. testée sur d'étiqueter positif en Cette réaction deux dilutions le sérum comme IgG. sera donc très sensible, et, (l/40 et l/4000) permettra négatif, faiblement positif ou
II - 4 LES REACTIONS D'HEMAGGLUTINATION PASSIVE
L'antigène toxoplasmique (de nature cytoplasmique essentiellement) est fixé sur des globules rouges. Mises en présence de diverses dilutions de sérum, les hématies agglutineront si des anticorps spécifiques sont présents.
- Cette technïque a JACOBS et Coll. (40) mais a été
SEGUELA et SENET (70, 72). introduite en France par - Sa sensibilité est variable selon lanature de l'antigène, et sa spécificité différente selon les réactifs commerciaux.
II - 5 - LES REACTIONS AU LATEX Il
l'hémagglutination, billes de latex.
s'agit du même type de réaction que les hématies étant remplacées par des L'antigène est mixte (membranaire et cytoplasmique) apportant une bonne sensibilité
à
laréaction.- Cependant, on ne peut différencier IgG et IgM, et des phénomènes de zone sont ~ lorsque le taux d'anticorps est élevé.
II - 6 - L'IMMUNOFLUORESCENCE INDIRECTE (Figure 4)
Nous détaillerons particulièrement cette technique, l'ayantutilisée, en tantque technique de référence dans notre étude.
~
L'immunofluorescence indirecte, proposee par GOLDMAN (35) en 1957, par KELEN (42) en 1962, fut surtout introduiteen FRANCE par GARIN et AMBROISE-THOMAS (2, 31).
Sa très bonne sensibilité et précocité en font laréaction encore laplus utilisée actuellement.
II - 6 - 1 - Principe
L'antigène utilisé est le toxoplasme entier formolé, fixé
à
lachaleur sur des lames.Les anticorps
17 -'' / - INCUBATION 30 mn à 37° - LAVAGE - AJOUT CONJUGUE ... - INCUBATION 30 mn à 37° LECTURE AU MICROSCOPE A FLUORESCENCE
fluoresceïne.
II - 6 - 2 - Technique - L'antigène
Toxoplasmes recueillis souris inoculées 48 H auparavant.
..
a partir d'ascites de One suspension parasitaire est ensuite répartie sur des lames siliconées, conservées après séchage
à
-70°- Dosage des IgG
~
On dilue les serums dans du tampon PBS pH 7,2
*
au 1/20 ce qui correspondà
8 UI/ml*
au 1/200 ce qui correspondà
80 UI/ml~
-
..
Tout serum positif au 1/200 est pousse de 1/20 a 1/3200.
Les dilutions de sérums
à
tester,positifs et négatifs sont déposés sur les lames. des témoins Les plaques sont mises
à
l'étuve 30 mnà
37° C. Après lavage et séchage, on dépose le conjugué (anti IgG humaine) dilué dans du bleu d'EVANS, afin de masquer les fluorescences non spécifiques.Après une mise
à
l'étuveà
37° pendant 30 mn, et lavage, les plaques sont prêtes pour la lecture.- Dosage des IgM
La technique est identique, mais en pratique courante, on ne dépose qu'une seule dilution, le 1/20.
Les sérums positifs sont dilutions de 1/2 en 1/2
à
partir du 1/20.- 19
-testés avec des Le conjugué est une
lafluorescéïne.
~ ~
anti-IgM humaine marquee a
- Lecture
Elle se fait
à
l'aide d'un miscroscopeà
fluorescence. Une fluorescence verte sur tout lepourtour des toxoplasmes signe la présence d'anticorps ~. A l'inverse, une sérologie négative se traduit par une fluorescence rouge peu intense.
Les florescences polaires (extrêmité des toxoplasmes) ne sont pas
à
prendre en compte.II -6 - 3 - Avantages
C'est une méthode simple, capable de détecter individuellement les IgG et les IgM.
Elle est spécifique pour les IgG. Elle est trèssensible
Les taux internationales, comme étalon international.
d'IgG peuvent être donnés en unités pour leDye Test, en référence au serum
seuil de descendre
On admet pour les IgG, un protection, mais lasensibilité
jusqu'à2
ur
.
II - 6 - 4 Inconvénientstaux de
de lamé8thode
u
r
peucommetUne certaine subjectivité de lalecture.
L'existence de quelques taux négatifs (moins de 10 %) qui sont dépistés par d'autres techniques utilisant des antigènes cytoplasmiques et non uniquement membranaires.
Pour les IgM présence d'IgM
polaire) ( 7 3) .
*
existencenaturelles (donnant de faux positifs par la une fluorescence
*
existence de faux;
presence de certaines immunoglobulines anticorps anti-noyaux •... )
positifs, (facteur
*
existence de faux négatifs, ... exces d'IgG. dusà
la rhumatoÏde, ... dus a unII - 7 LES REACTIONS IMMUNOENZYMATIQUES (ELISA) (Figure 5)
Elles concernent directement notre travail. Nous aborderons dans ce paragraphe le principe général de ces techniques.
Chacun des trois coffrets commerciaux comparés (ABBOTT, BOEHRINGER, ORGENIC) fera l'objet d'un développement particulier par la suite.
Ces réactions assez nouvelles, utilisées dans de nombreux domaines, ont été appliquées
à
la toxoplasmose en 1976 par SEGUELA (71) et VOLLER (79).II - 7 - 1 - Principe général
Un antigène (membranaire et cytoplasmique) est fixé sur un support solide en plastique ou en verre (plaques de polystyrène, tubes, billes, etc ... )
l'antigène. Le sérum du malade dilué est mis en présence de Les anticorps présents dans le sérum, se fixant sur l'antigène, forment des immuns-complexes, révélés ultérieurement par une antiglobuline anti-IgG ou IgM marquée par une enzyme.
Après incubation et lavage, l'enzyme est révélée par son substrat en donnant une réaction colorée proportionnelle
à
la quantité d'anticorps fixés.21
-II - 7 - 2 - Avantages
Ces techniques sont automatisables, extrêmement sensibles, actuellement bien reproductibles ët spécifiques.
Il existe de nombreux coffrets commerciaux disponibles.
II - 7 - 3 - Inconvénients
La très bonne sensibilité de ces techniques impose une rigueur d'éxécution particulière.
La corrélation entre les D.O. optiques obtenues en ELISA et les UI semblent difficiles, les antigènes utilisés en ELISA et en immunofluorescence étant différents.
Enfin, cette les mêmes inconvénients détection des IgM,
à
savoirtechnique ainsi décrite,
que l'immunofluorescence possède pour la - L'interférence avec les facteurs rhumatoÏdes,
Le phénomène de compétition de sites en présence d'excès d'IgG.
C'est pourquoi ont été proposées, pour la détection des IgM, des techniques ELISA reverse, dites par immunocapture.
II - 7 - 4 - Elisa reverse
Le but de la manipulation consiste
à
éliminer les IgG avant la révélation des IgM, supprimant les deux inconvénients vus précédemment.Le principe en est le suivant
Une antiglobuline anti-IgM, fixée sur un support solide, capte dans un premier temps les IgM du sérum.
Une étape de lavage élmimine les IgG.
Les IgM ~ seront alors révélées soit
en ajoutant un antigene toxoplasmique, puis du ~
~ anti-toxoplasmose ,marqué avec une enzyme) soit par un antigene directement marque par l'enzyme.
La spécificité de ces réactions est donc très grande, voisine de lOO %et d'autre part, lasensibilité est considérablement accrue, notamment dans le diagnostic de la Toxoplasmose congénitale.
Inversement, cette très grande sensibilité permet de détecter des IgM longtemps après laséroconversion dans latoxoplasmose acquise.
La découverte d'IgM avec ces méthodes n'est donc plus systématiquement synonyme de toxoplasmose récente.
II - 8 - LA REACTION D'AGGLUTINATION REVERSE OU ISAGA (Immuno Sorbent Agglutination Assay)
Comme l'immunofluorescence, nous insisterons sur leprincipe et laréalisationpratique de cette technique.
Elle nous servira de technique de référence pour contrÔler les sérums trouvés positifs en IgM avec les coffrets ELISA comparés.
II - 8 - 1 - Principe
Décrite par DESMONT (21), cette réaction utilise dans un premier temps une technique d'immunocapture. Les IgM
~ sont ~ l'antigène ~ entier formolé),
l'agglutinationentre anticorps et antigene formant un voile au fond de lacupule.
II - 8 - 2 - Réalisation pratique
La technique se fait sur plaques de microtitration en polystyrène, présensibilisées avec un anticorps monoclonal anti-IgM humaines.
Les sérums sont dilués au 1/100 dans du tampon PBS pH= 7,4.
La même dilution est distribuée dans troispuits consécutifs (lOO~ par puit).
La réaction est étalonnée avec troistémoins un sérum positif, un sérum négatif, un témoin PBS seul.
- 23
-lavages de réalisés.
Après une incubation de 2 heures
à
37° C, deux 5 mn en PBS Tween et deux de 5 mn en PBS seul sont~ figuré (suspension de toxoplasmes
formolés obtenue a partir d'ascite de souris) dilué au 1/5 dans du tampon BABS coloré pH
=
8,95, est ajouté en quantité variable pour un même sérum.- lOO ~ dans lepremier puit.
- 150 ~
· dans ledeuxième puit. - 200 ~
dans le troisème puit.
(environ 1,5 millions de Toxoplasmes) (environ 2 millions de Toxoplasmes) (environ 2,5 millions de Toxoplasmes) La plaque est ensuite incubée une nuit
à
37°c
.
II - 8 - 3 - Lecture'
Elle se fait a l'aided'un miroir grossissant. En l'absence d'IgM, il se forme un culot de sédimentation des toxoplasmes.
l'antigèneet lacupule. 4
Une réaction
l'anticorps)se tposirtaduive (aggitpar unlu votinailetion au en fondt dere L'agglutination de chaque puit est cotée de 0
à
- 0=
aucune agglutination,Chaque sérum reçoit un chiftre de 0
à
12 correspondantà
la somme des chiffres attribuésà
chacun des 3puits.
La valeur seuil est fixée
à
7.II - 8 - 4 - Avantages
Cette technlque est remarquable sensibilité. Du fait de l'immunocapture, il d'interférence avec le Facteur RhumatoÏde.
II - 8 - 5 - Inconvénients
par
n'y a pâ.S sa
Une lecture un peu délicate, et sensibilité peuvent jouer en sa défaveur dans particuliers.
son extrême quelques cas
~
>-
:>----
-T
('>--l'>
>---(
>-ELISA- antigènetoxoplasmique (mixte} fixé sur un support - 1ère incubation formation de complexes antigène-anticorps rajout du conjugué - 2ème incubation Action du substrat Lecture au spectrophotomètre
Technique Sandwich (Fig. 5}
-Sérum
IgM antitoxoplasrnique
Anti IgM fixé
IgM antitoxoplasrnique
Réaction positive adhésion en voile
INCUBATION 2 HEURES A 37°C
LAVAGE PUIS AJOUT DE L'ANTIGENE A 3 DILUTIONS DIFFERENTES
INCUBATION UNE NUIT A 37° C
C 0 M P A R A I S 0 N D E S T R 0 I S
C 0 F F R E T S E L 1 S A
- A B B 0 T T
- B 0 E H R 1 N G E R
I - D E S C R I P T I 0 N D E S C 0 F F R E T S
I - 1 - ABBOTT (Figure n° 7 et 8) I - 1 - 1 - Principe
La sérologie IgG fait appel a une réaction ELISA type .sandwich.
La sérologie IgM utilise un procédé
d'immunocapture ELISA double sandwich
I - 1 - 2 - Appareillage - Automate
Les dilutions des sérums sont réalisées manuellement. Ensuite, toutes les étapes de la réaction
(lavages, dispensation de réactifs, incubations, lecture, expression et édition des résultats) peùvent être effectuées par l'appareil QUANTUMATIC.
REMARQUE : L'utilisation de l'appareil QUANTUM II ne permet que la lecture, l'expression et l'édition des résultats.
- Composition du coffret Toxo-G EIA L'antigène, mixte
cytoplasmique pour 1/3 de composant nature précise inconnue, est fixé
à
polystyrène.(2/3 de composant membranaire), mais de la surface de billes de Le conjugué est une anti IgG humaine couplée
à
la péroxydase de Raifort.Le (négatif, positif titré
à
12 UI/ml.coffret comprend 3 sérums de contrôle faible, et positif fort) et un sérum étalon
- 28
-- Composition du coffret Toxo-M EIA
Le support de laréaction est aussi une bille de polystyrène recouverte d'anticorps de chèvre anti-IgM humaine. Le conjugué est composé d'antigène Toxoplasma qondii et d'anticorps de lapin anti-Toxoplasma gondii marques a lapêroxydase de Raifort. Enfin, on utilisera 3 sérums de ~ (négatif, positif faible, et positif fort). TRIS pour substrat comprimés
Les deux coffrets comprennent les dilutions des sérums et des de la réaction enzymatique, en d'ortho-phénylénediamine (OPD).
aussi du tampon contrôles, et le
l'occurence des
I - 1 - 3 - Méthodologie
Comme nous l'avons rappelé precedemment, les étapes réactionnelles, hormis les dilutions de peuvent être effectuées par l'appareilQUANTUMATIC. - ABBOTT TOXO G EIA
*
Première incubationtou~ tes serums,
Les sérums et les témoins (positifs et négatifs sont dilués manuellement au 1/101 dans le tampon TRIS. 200~ de chaque échantillon dilué sont pipetés dans lepuit correspondant de laplaque de réaction.
Une bille est ajoutée
à
chaque puit. La plaque, recouverteadhésive, incube 60 mn au bain-marie
à
37°C. d'une feuille Chaque bille est ensuite lavée 3 fois avec 4à
6 ml d'eau distillée ou désionisée pour un volume totalde lavage de 12à
18 ml.*
Seconde incubationOn introduit 200~ du conjugué enzymatique
à
chaque puit de réaction.Le plaque est incubée pendant 60 minutes au
'
bain-marie a 37°C.
Puis les billes sont lavées 3 façon analogue
à
l'étape précédente. (Tout excès trouvant sur ledessus de la plaque doit être essuyé).*
Chromogénèse fois, de d'eau se aspiré ouLes billes sont immédiatement transférées
'
dans des tubes a essais EIA.
On introduit 300~ de solution substrat
(OPD) dans chaque tube, ainsi que dans deux tubes vides (blancs substrat).
, ,
Le substrat est prepare en diluant un comprimé d'orthophénylènediamine (OPD) dans 5 ml de tampon phosphate citraté contenant 0,02 p lOO d'eau oxygènée.
Les tubes sont incubés
température ambiante (15
à
30°C). 30 minutes chaque tube. On ajoute ensuite 1,0 ml ~ lN'
a la
' a Les densi!és ~ des échantillons sont
- 30
-- ABBOTT TOXO M EIA
*
Première incubation Les sérums positif, fortement positif et dans letampon TRIS. et les contrÔles (faibLement négatif) sont dilués au 1/101 , Les sérumsfoetus sont dilués au 1/20. provenant de nouveau-nes ou de 200~ de chaque échantillon dilué sont pipetés dans lepuit correspondant de laplaque de réaction.
Une bille , recouverte d'anticorps anti -chaine~ humaine est ajoutée a chaque puit.
La plaque, recouverte d'une
adhésive, incube 120 mn au bain-marie
à
37°C. feuille Chaque bille est ensuite lavée 3 fois avec4
à
6ml d'eau distillée ou désionisée pour un volume totalde lavage de 12à
18 ml.*
Seconde incubation200~ du conjugué enzymatique (complexe
immunologique composé de 1:antigene et d'IgG de lapin anti -toxoplasme marquée
à
la peroxydase de RAIFORT) est introduit dans chaque puit de réaction.Après une incubation billes sont
à
nouveau lavées 3 fois, l'étapeprécédente.de
de façon60mn ana
à
37°Clogue, l aes, 5à
10 mn avant l'étape suivante, la solution substrat OPD est préparée (préparation décrite dans la méthodologie IgG).*
ChromogénèseLes billes sont immédiatement transférées dans des tubes à essais EIA.
(OPD) dans substrat).
On introduit 300~ de solution substrat
chaque tube ainsi que dans deux tubes vides (blanc ' Les tubes
température ambiante. sont incubés 30 minutes a La réaction est ensuite bloquée par ajout de 1 ml ~ ~ 1 N dans chaque tube.
proportionnelle à sur labille, est
La coloration orangée qui se développe, laquantité d'IgM anti-toxoplasmique fixée évaluée par lecture de DO.à 492 nm - 600 nm. I - 1 - 4 - Expression des résultats
- ABBOTT TOXO G EIA
Les résultats sont exprimés en UI/ml.
Les mesures de DO des étalons et leurs activités toxoplasmiques exprimées en UI/ml permettent à l'appareil de lecture de construire une courbe d'étalonnage point par point, en portant sur un papier semi-logarythmique en abscisse laDO moyenne des différents contrÔles (négatif, positif faible, positif) et en ordonnée leur concentration en anticorps (0,12, 300 UI/ml).
doit être UI/ml.
La relation entre laDO et l'activitéanticorps linéaireet couvre des valeurs allant de 12 à 300
affiche une détermine la
Pour chaque échantillon, le ~
DO et, par référence à la courbe d'etalonnage concentration en IgG antitoxoplasmique.
Bille cotée avec Ag Toxo gondii
TECHNIQUE QUALITATIVE OU QUANTITATIVE EN U.I. Principe de la réaction - Mode opératoire
Fixation des IgG anti Toxo gondii du sérum
200
tl
60' 37°c LAVAGE
Fixation du conjugué anti-IgG humaine de chèvre marquée à la peroxydase
200
t-I
60' 37°c LAVAGE
PRINCIPE ET MODE OPERATOIRE DE LA TECHNIQUE SANDWICH TOXO G ElA (Fig. N°7)
Chromogénèse + OPD 300 {;'- 1 30' température ambiante
l2
liyo)
(ù 1\)Bille cotée avec une anti IgM humaine
Fixation des IgM du sérum
200 t"I
120' 37°c LAVAGE
-<•>-E
Fixation du complexe Ag Toxo-IgG de lapinanti Toxo marquée àlapéroxydase
200 ~ :·601 37°c
LAVAGE
PRINCIPE ET MODE OPERATOIRE DE LA METHODE D'IMMUNOCAPTURE TOXO MElA (Fig. N° 8}
Chromogénèse + OPD 300 ~ 30' température ambiante 13H30] (JJ (JJ
Le seuil de positivité a été fixée
à
12 UI/ml. Les sérums dont les taux sont ) 300 UI/ml doivent être dilués et repassés.- ABBOTT TOXO M EIA
34
-Les valeurs obtenues lors du dosage sur les échantillons provenant des patients sont comparées au contrÔle positif faible sous forme d'indice.
DO MALADE Indice du malade
=
DO MOYENNE DES CONTROLES POSITIFS FAIBLES Un indice TOXO-M inférieur
à
0,400 est négatif pour l'anticorps IgM anti-Toxoplasma gondii.Un indice TOXO M supérieur ou égal
à
0,500 est positif pour l'anticorps IgM anti-Toxoplasma gondii.Un indice TOXO M EIA entre dans la zone limite et l'échantillon doit deuxième prelevement. Les contrôles fort apprécier la valeur de la manipulation.
0,400 et 0,499 est être contrôlé par un et négatif servent
à
REMARQUE : Une valeur, inférieure
à
0,400, mais apparaissant comme nettement supérieureà
la moyenne des négatifs, doit être considéré comme positive en IgM et faire suspecter un début de seroconversion.1 - 2 - BOEHRINGER (Figure n° 9 et 10) 1 - 2 - 1 - Principe général
Les sérologies IgG et IgM réaction ELISA classique, type sandwich, II. 7.
'
font appel a une décrite paragraphe
I - 2 - 2 - Appareillage
réalisé
- Automate
La dilution des sérums Rt des témoins
à
l'aidedu diluteur ~ de GILSON. a étéToutes les étapes de la réaction ELISA sont ensuite prises en charge par le système ES 22, couplé au micro -ordinateur EPSON.
Ilréalisera les incubations, dispensation de réactifs, lavages, lecture spectrophotométrique, traitement et édition des résultats sur une imprimante.
- Contenu du coffret ENZYMUN( TEST TOXO IgG L'antigene est
inactivés provenant de liquide mixte).
un ultrasonnat de parasites péritonéal de souris (antigène Ilest fixé sur laparoi de tubes plastiques. Le conjugué est un anticorps de porc anti-IgG humaines marqué ~ laphosphatase alcaline.
Le coffret comprend trois sérums de négatif, faiblement positif et positif), titrés rapport~ l'étaloninternational.
contrôles en
ur
par - Contenu du coffret ENZYMUN - TEST TOXO IgML'antigène est identique ENZYMUN - TEST TOXO IgG.
~
a celui du cof±ret
~ est un anticorps de lapin anti-IgM
humaines marque a laphosphatase alcaline. La réaction utilise
(négatif et positif).
~
- 36
-Les deux coffrets comprennent du tampon phospha!e (0,1 mol/1) pour les dilutions des sérums et du conjugue, et le substrat de laréaction enzymatique, lepara -nitrophénylphosphate (PNP).
I - 2 - 3 .-:- Méthodologie
- ENZYMUN - TEST TOXO IgG
- lere incubation
Les échantillons
à
tester sont dilués au 1/101 dans le .~ phosphate 0,1 mo1/là
l'aide du diluteurDILUTRENDQ9, airectement dans les tubes tapisséspar l'antigène toxoplasmique.
Les standards
donc pas dilués sont prêts
~
a l'emploi et ne sont
REMARQUE : Le pipetage et l'aspiration des solutions doivent avoir lieu~ même cadence puur que les durées d'incubation
soient les memes pour tous les tubes.
Cette première incubation dure 90 minutes et se déroule, comme toute laréaction
à
20-25° C.Le contenu des tubes est ensuite aspiré, puis lavé troisfois avec lasolution de lavage (Tween).
- 2ème incubation
1 ml de_solutionooconjugué (anticorps anti IgG humainemarqué
à
laphosphatase alcaline) est ajouté dans chaque tube.Cette deuxième incubation dure 60 minutes
à
20 -250C. Une deuxième opération de lavage est réalisée dans les mêmes conditions que lapremière.- Chromogénèse
Le substrat, préparé une heure avant en dissolvant un comprimé de paranitrophénylphosphate dans 5 ml de tampon diethanolamine, est rajoutéàraison de 1 ml par tube.
L'incubation dure 30 mn.
Elle est bloquée par addition de lOO~ de NaOH
1 M dans latechnique manuelle.
L'appareil ES 22 permet une lecture en continue des DO de chaque échantillon.
la lecture spectrophotomètre
à
405 nm. - ENZYMUN TEST TOXO IgMse
- lere incubation
fait a
-
l'aide d'unLes échantillons
à
tester sont dilués au 1/101 dans le tampon phosphate 0,1 moles/1, comme pour la sérologie IgG, dans les tubes sensibilisés par l'antigene.Les contrôles positifs et négatifs sont prêts
à
l'emploi.
L'incubation dure 120 minutes
à
température ambiante.Les tubes sont ensuite lavés 3 fois avec la solution de TWEEN.
- 2ème incubation
1 ml, de conjugué (anticorps de humaines marqués a la phosphatase alcaline) chaque tube.
lapLn anti IgM est rajouté dans
Les tubes incubent 120 minutes .~
a température ambiante.
Puis on réalise une opération de lavage en tout point similaire
à
laprécédente.- Chromogénèse
Le substrat est toujours le
~ .
- On rajoute 1 ml par tube. Après une incubation de 30 minutes
à
température ambiante, lacoloration obtenue, pr9portionnelleà
laquantité d'IgM seécif!que présent dansl'echantillon, est lue au spectrophotometre a 405 nm. I - 2 - 4 - EXPRESSION DES RESULTATS
- ENZYMUN -TEST TOXO IgG
Les standards utilisés dans latechnique sont étalonnés par rapport au sérum de référence (2ème préparation internationale - 1980 - Laboratoire International de l'OMS -COPENHAGUE).
Les taux sont donc exprimés en UI/ml.
Une courbe d'étalonnage est établie en portant en ordonnée les valeurs moyennes des DO des standards et en abscisse les titresen IgG correspondant (UI/ml).
On se reporte ensuite sur cette courbe pour lire lestitresen IgG correspondant aux DO de chaque échantillon.
Les valeurs seuils ~ par le fabricant sont
les suivantes
-<
15 UI/ml 15 - 30 UI/ml - ) 30 UI/mlsérologie négative sérologie
à
suivre sérologie positive-- ENZYMUM --TEST IgM
Les résultats sont ici exprimés en unités EIU (enzyme immunoassay units) ) l'aide de la formule suivante
EESSAI - EBLANC-REACTIF
T ( E I 0) = x 100
ESERUM DE CONTROLE POSITIF - EBLANC - REACTIF
Les valeurs .seuils données par le fabricant sont
<
25 EIU :. Négatif- 25-40 EIU Domaine intermédiaire
- >
40 EIU Positif.Tube tapissé avec Ag Toxo gondii
TECHNIQUE QUALITATIVE OU QUANTITATIVE EN U.I. Principe de la réaction - Mode opératoire
Fixation des IgG anti Toxo gondii du sérum
90' température ambiante LAVAGE
Fixation du conjugué anti IgG humaine marquée
à la PAL 60' température ambiante LAVAGE Chromogénèse 30' + PNPP température ambiante
~
PRINCIPE ET MODE OPERATOIRE DE LA TECHNIQUE SANDWICH ENZYMUN TEST TOXO IgG (Fig. N° 9)
.1>-0
Tube tapissé avec Ag Toxo-gondii
Fixation des Ig anti-Toxo gondii du sérum 1 ml 120' LAVAGE Température ambiante Fixation du conjugué Anti IgM humaine marquée
à la PAL
1 ml
1201 Température
ambiante LAVAGE
PRINCIPE ET MODE OPERATOIRE DE LA TECHNIQUE SANDWICH ENZYMUN TEST TOXO IgM (Fig. N° 10)
Chromogénèse + PNPP 1ml 30' Température ambiante
14H30)
.t:>-1-'- 42
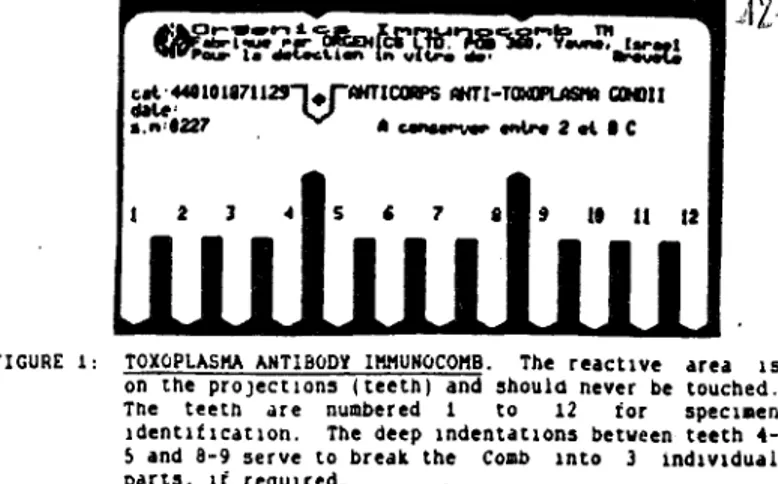
-I - 3 - ORGENICS IMMUNOCOMB (Figuren°11)
I - 3 - 1 - Principe générai
C' 'estun dosage ELISA sur phase solide type sandwich.
I - 3 - 2 - Appareillage inconnue) est
(fig. 1).
L'antigène
fixé sur ltoxopes 12 denlasmiquets d (de'un pe naignetu enre p plarécstiquisee Les différentes étapes de la réaction se déroulent
à
l'aide d'un bacà
développement, composé de plusieurs compartiments réactifspré-remplis.I - 3 - 3 - Méthodologie
Les sérums
à
tester sont déposés dans la première rangée du bac (10~ .Un témoin négatif et un témoin positif UI/ml sont testés au cours de chaque série (fig. 2).
..
a 10
Ensuite toutes lesétapes de la réaction sont réalisées par simple transfert du peigne d'un compartiment
à
Les différentes étapes se schématisent ainsi
BLOCAGE 2 Mn
REVELATION Chromogénèse-PNP 10 Mn
LAVAGE Solution de lavage 2 Mn
ACTION DU CONJUGUE An tiIgG - phosphatase 20 Mn alcaline
LAVAGE Solution de lavage 2 Mn
INCUBATION 10 f-Ll de ~
10 Mn serum
I - 3 - 4 -Expression des résultats
La lecturesemi-quantitative est visuelle en
comparant l'intensitéde coloration des échantillons
à
celle du disque calibré avec le ~ de titreconnu passé dans la série (Fig. 5).Le seuil est donc fixé par ce contrÔle
à
10 UI/ml.Les valeurs possibles sont
<
101 lO1 lO.501 501a J ~ 1 ' .,
Orgenic:l ~ ••
~ ~
Anti ToxoplasMa Condii -laC
Color ~ ..Solo• lor
[ : Sale1 lcM2 wCLPurpeegqy.gN-(8C (1CII')if'·N8T) Scate3
{,
1 1 il U Il .1 -44-Fig.l':Les antigènes sont fixés sur lesdents du peigne
Fig. 2
Fig. 3
Fig. 4
Fig. 5
On dépose 10
p
1 d'échantillondans chaque compartiment de la première rangée
Phase d'incubation
Les étapes de laréaction se déroulent en déplaçant lepeigne d'une rangéeà
~
Lectureàl'aidedu Combkey
No A B 0 T T B M H A B 0 T T B MF 1 140 161 0,173 26 2 .::::. 0' 10 17 0,134 16 3 129 180 0,468 34 4 252 252 0,143 15 5 51 101 0,315 27 6
<
0,10 10 0,202 15 7 146 152 0,157 20 8 40 94 0,107 8 9<
0,10 9 0,106 12 10 101 117 0,118 5 11 144 234 0,091 10 12 31 99 0,175 12 13 < 0,10 7 0,102 9 14 < 0,10 16 0,476 74 15 < 0,10 17 0,098 15 16 82 145 0,099 7 17 36 53 0,219 21 18 65 95 0,466 51 19 > 300 197 0,320 39 20 < 0,10 8 0,110 12 21 186 126 0,107 8 22 117 180 0,098 15 23 120 181 0,047 28 24 > 300 196 0,225 31 25 70 117 0,109 10 26 < 0,10 13 0,655 65 27 22 32 0,249 31 28 < 0,10 11 0,129 19 29 184 117 0,099 9 30 51 68 0,222 28 31 < 0,10 10 0,157 24 32 61 64 0,244 20 33 < 0,10 7o,
180 32 34 < 0,10 5 0,205 11 35 34 46 0,258 12 36 253 158 0,238 15 37 120 88 0,124 14 38 56 62 0,106 21 39 20 42 0,258 36 40 64 70 0,099 10 41 33 41 0,173 14 42 < 0,10 8 0,113 11 43 19 40 0,131 21 44 85 94 0,164 14 45 < 0,10 11 0,220 45 46 < 0,10 5 0,235 30 47 < 0,10 7 0,104 10 48 99 59 0,208 25 49 172 207 0,110 28 50 ( 0,10 6 0,194 36 TABLEAU N° 146 -S E R 0 L 0 G I E I g G S E R 0 L 0 G I E I g M No ABOTT B M H A B 0 T T BMF 51 117 125 0,216 34 52 < 0,10 9 0,294 41 53 135 123 0,685 68 54 233 150 0,161 21 55 116 82 0,231 31 56 213 107 0,189 5 57 261 203 0,169 16 58 229 95 0,157 38 59 162 85 0,246 35 60 84 84 0,098 29 61 64 54 0,241 18 62
<
0,10 5" 0,175 22 63 < 0,10 5 0,427 56 64 < 0,10 4 0,154 5 65 92 105 0,183 35 66 > 300 306 0,231 28 67 < 0,10 6 0,183 35 68 < 0,10 4 0,154 26 69 < 0,10 3 0,024 32 70 < 0,10 3 0,101 10 71 73 91 0,192 14 72 0,10 8 0,110 10 73 0,10 9 0,208 14 74 300 193 0,164 21 75 155 123 0,252 19 76 < 0,10 7 0,107 12 77 43 84 0,257 25 78 188 118 0,340 37 79 62 61 0,080 13 80<
0,10 2 0,255 17 81 111 128 0,134 20 82 131 161 0,417 34 83 115 99 0,271 24 84 14 31 0,318 23 85 164 180 0,120 17 86 219 283 0,257 26 87 < 0,10 8 0,135 7 88 82 88 0,120 11 89 138 109 0,113 16 90 <" 0,10 6 0,104 12 91 77 96 0,098 14 92 112 120 0,066 4 93 < 0,10 5 0,183 27 94 13 26 0,135 15 95 131 124 0,102 12 96 276 311 0,137 14 97 <" 0,10 8 0,090 8 98 201 275 0,156 11 99 45 97 0,214 37 100<
0,10 13 0,121 15 TABLEAU N° 2NO A B 0 T T B MF A B 0 T T B MF 101
<
0,10 9 0,135 20 102 16 40 0,176 25 103 69 101 0,356" 32 104<
0,10 23 0,239 20 105 139 260 0,239 21 106 31 96 0,265 71 107 75 169 0,093 8 108 < 0,10 15 0,198 25 109 0,13 11 0,310 54 110 < 0,10 15 0,339 39 111 102 92 0,219 32 112 > 300 299 0,072 16 113<
0,10 12 0,096 8 114<
0,10 14 0,398 74 115 < 0,1C 9 0,140 10 116 > 300 527 0,203 16 117 78 144 0,655 77 118 152 195 0,339 42 119 134 126 0,116 14 120 142 243 0,194 19 121 159 179 0,690 70 122 67 113 0,077 6 123 18 28 0,183 18 124 83 99 0,202 13 125 122 117 0,145 18 126 <" 0' 10 7 0,110 21 127 < U,lO 8 0,290. 23 128<
U,10 21 0,211 49 129 22 42 0,172 14 130 < 0,10 15o,
157 27 131<
0,10 12 0,186 35 132<
0,10 4 0,121 6 133 216 187 0,236 25 134 59 78 0,143 15 135<
0,10 59 0,255 64 136 291 114 0,173 10 137< o,
10 17 0,109 17 138 102 103 0,172 32 139<
0,10 10 0,238 29 140 < 0,10 6 0,154 13 141 > 300 352 u,236 30 142 87 96 0,184 23 143 128 138 0,134 13 144 > 300 266 0,361 18 145 0,12 18 0,145 20 1.46 128 165 0,165 3::3 147 295 205 0,106 4 148< o,
10 8 0,110 22 149 33 61 0,252 29 150 < 0, lU 10 0,115 27 TABLEAU N° 348 -S E R 0 L 0 G I E I g G S E R 0 L 0 G I E I g M No A B 0 T T BMH 0 R G E N I CS A B 0 T T AMF 151 256 153 0,164 1 152
<
0,10 11 0,128 17 153 125 125 0,406 50 154 > 300 182 0,124 10 155 < 0,10 15 0,206 20 156 < 0,10 8 0,099 7 157 118 96 0,186 22 158 253 153 0,090 21 159 72 84 0,206 16 160 > 300 346 0,317 51 161 0,11 19 0,424 32 162 > 300 386 0,200 52 163 190 113 0,154 11 164 116 127 0,183 10 165 254 212 0,090 16 166 182 172 0,074 8 167 202 174 0,109 11 168 69 119 1,219 107 169>
300 367 0,635 40 170 245 187 0,063 6 171 111 154 0,320 46 172 < 0,10 16 0,110 21 173 58 75 0,200 9 174 56 68 0,304 22 175 154 184 0,384 17 176 109 148 0,235 10 17/ 134 123 0,358 21 178 > 300 255 0,391 27 179 116 109 100-150 0,190 20 180 189 143 150 0,266 19 181 > 300 350>
150 0,236 18 182 > 300 402>
150 0,361 23 183 < 0,10 18<
10 0,163 4 184<
0,10 16 .( 10 0,200 10 18b 219 210 > 150 0,346 30 186 0,11 20<
10 0,497 40 187 122 158 /' 150 0,373 13 188 O,E4 24 10 O,G91 3 189 < 0,10 16 <. 10 0,421 44 190 152 140 /' 150 0,201 11 191 278 190>
150 0,103 9 192<
0,10 14<
10 0,131 10 193 90 122 150 0,271 30 194 143 156 .. 150 0,161 12 191=; <. 0,10 12<
10 0,096 3 196 199 164 50-100 0,190 13 197 44 92 50 0,141 14 198 > 300 280 .)150 0,151 10 199 221. 233>
150 0,166 14 200 215 207 ;>150 0,118 1 TABLEAU N° 4No A B 0 T T BMH 0 R G E N I CS A B 0 T T BMF 201 296 161 >150 0,118 19 202 < 0,10 10
<
10o,
105 0,3 203 < 0,10 23<
10 0,208 29 204 <o,
10 12 < 10 0,116 25 205 <' 0,10 8<
10 0,076 6 206 248 189 )'-"150 0,183 15 207<
o,
10 18<
10 0,198 25 208 < 0,10 8<
10 0,171 10 209>
300 231 :? 150 0,236 25 210 74 74 50 0,449 45 211 /' 300 308 >150 0,175 22 212 0,11 24<
10 0,208 32 213 < 0,10 9<
10 0,248 7 214 270 237 150 0,096 15 215 .,. 300 423 150 0,281 37 216 0,11 15 <10 0,188 17 217<
0,10 19<
10 0,323 20 218 < 0,10 17<
10 0,301 28 219 80 101 7:150 0,146 11 220 201 162 >150 0,161 6 221 '? 300 272 "'> 150 0,329 14 222 :> 300 430>
150 0,064 72 . 223< o,
10 17<
10 0,161 29 224 252 273 150 0,136 19 225 105 195 150 0,225 25 226 222 191 :::> 150 0,256 8 227 85 166 150 0,090 42 228<
0,10 17<
10 0,088 3 229<
0,10 10 <10 0,196 46 230>
300 321 :::> 150 0,210 38 231<
0,10 28 10-50 0,213 20 232<
0,10 6<
10 0,351 19 233<
0,10 10<
10 0,123 8 234 57 76 50-150 0,412 41 235 96 118 150 0,110 23 236<
0,10 23<
10 0,183 6 237 <o,
10 42 .(. 10 0,125 20 238 0,36 25 .( 10 0,120 7 239 98 125 150 0,188 12 240 300 232 "> 150 0,156 20 241<
0,10 15 .( 10o,
128 9 242 176 171 150 0,103 7 243 202 241 150 0,294 15 244 / 300 358 150 0,221 44 245 55 179 50-150 0,105 22 246>
300 267 100-150 0,449 37 247 39 74 10-50 0,126 18 248 25 73 10-50 0,221 27 249 32 130 50 0,110 35 250 0,25 49<
10 0,155 28 TABLEAU N° 550 -S E R 0 L 0 G I E I g G S E R 0 L 0 G I E I g M No A B 0 T T B MF 0 R G E N I CS' AB 0 TT BMF 251 300 423