ﺎﻨﺘﻤﻠﻋ ﺎﻣ ﻻﺇ ﺎﻨﻟ ﻢﻠﻋ ﻻ ﻚﻧﺎﺤﺒﺳ
ﻢﻴﻜﳊﺍ ﻢﻴﻠﻌﻟﺍ ﺖﻧﺃ ﻚﻧﺇ
:ﺔﻳﻵﺍ :ﺓﺮﻘﺒﻟﺍ ﺓﺭﻮﺳ
31
A mes chers Parents El Yousfi Said et Zniber Amina
Qui m’ont soutenu et encouragé durant ces longues années d’étude, merci pour votre amour, pour tout l’enseignement que vous m’avez transmis, pour vos sacrifices, pour l’encouragement que vous ne cessez de m’offrir et
pour votre patience. Les mots seuls ne pourraient exprimer tout mon amour ni mon estime pour vous. Ce travail est le vôtre.
Puisse dieu le tout puissant vous combler de bonne santé et vous accorder longue vie pleine de bonheur et prospérité.
A ma chère sœur, ma complice, ma deuxième maman, El Yousfi Salma
Je ne peux exprimer à travers ces lignes tous mes sentiments d’amour et de tendresse envers toi.
Tu as été à mes côtés pendant toutes les étapes de ma vie, je t’en suis très reconnaissante.
Que ce travail soit l’expression de ma gratitude pour tout moment de joie partagé ensemble.
A ma meilleure amie Hala,
Merci pour ton soutien et ton amitié́. J'aurais bien voulu que tu sois parmi nous en ce jour mémorable.
Je te remercie d’avoir parcouru avec moi toutes les étapes, nous avons joué ensemble, grandi ensemble, souffert ensemble pour au final gagné
ensemble.
Je te souhaite une longue vie pleine de bonheur et de prospérité́. Puisse ce travail être le témoignage de ma reconnaissance et de mon grand amour
A Hamza,
Aucune dédicace ne pourrait exprimer mon affection. Depuis que je t’ai connu, tu n'as cessé de me soutenir et de m'épauler. Ta présence et ton
aide m’ont procuré que confiance et stabilité.
Je te remercie pour ton soutien inconditionnel durant toute cette période.
En témoignage de toute l'affection que je te porte, ainsi que les souvenirs innombrables que nous avons partagé, je te dédie ce travail. Puisse le bon
A tous les internes du CHU promotion 2017 : ALF NIBA W 3NIBA
Merci pour ces deux belles années passées à vos côtés, l’internat ne serait pas le même sans vous.
Mention Spéciale au maitre et rapporteur de thèse Monsieur le professeur Azlarab Masrar
Professeur d’Hématologie Biologique
Chef de service du laboratoire central d’hématologie CHU Ibn Sina Rabat
Je tiens à vous adresser mes plus vifs remerciements. Nous sommes très sensibles à votre gentillesse et vos conseils. Que ce travail soit pour nous l’occasion de vous exprimer notre
admiration ainsi que notre gratitude.
A notre maitre et président de thèse Madame le Professeur Souad Benkirane
Professeur D’hématologie clinique
Vous nous avez accordé un immense honneur et un grand privilège en acceptant la présidence de notre jury de thèse.
Nous vous remercions aussi pour la gentillesse et La spontanéité avec lesquelles vous avez bien voulu diriger Ce travail. Nous vous prions,
cher Maître, D’accepter dans ce travail le témoignage de notre haute considération, de notre profonde reconnaissance Et de notre
A notre maitre et juge de thèse Madame le Professeur Mona NAZIH
Professeur d’Hématologie Biologique
Nous tenons à vous exprimer toute gratitude Pour l’honneur que vous nous faites en vous Intéressant à ce travail et acceptant de le juger.
Nous vous exprimons nos plus vifs Remerciements et nous vous prions de trouver, ici Le témoignage de notre reconnaissance et notre
A notre maitre et juge de thèse Monsieur le professeur Anass JEAIDI
Professeur d’Hématologie Biologique
C’est pour nous un grand plaisir de vous compter parmi Le jury de cette thèse.
Nous tenons à vous témoigner notre profonde Reconnaissance pour avoir aimablement accepté de
Juger ce travail
Liste des abréviations
Liste des abréviations
BF : Body fluid
CCMH : Concentration corpusculaire moyenne en Hb
CEQ : Contrôle externe de qualité
CIL : Comparaison inter laboratoires
CIQ : Contrôle interne de qualité
CNQ : Contrôle qualité national
COFRAC : Comité francais d’accréditation
COMAC : Comité marocain d’accréditation
CQ : Contrôle de qualité
CV : Coefficient de variation
DM DIV : Dispositifs médicaux de diagnostic in vitro
EDTA : A éthylène-diamine-tétraacétique
EEQ : Evaluation externe de qualité
ET : Ecart-type
GB : Globules blancs.
GBEA : Guide de bonne exécution des analyses
GR : Globules rouges
Hb : Taux d'hémoglobine
Ht : Hématocrite
LABM : Laboratoire d’analyse de biologie médicale LJ : Tableaux de Levey-Jennings Ly : Polynucléaires lymphocytes Mo : Monocytes PB : Polynucléaires basophiles PE : Polynucléaires éosinophiles Pl : Plaquettes.
PLTF : Comptage des plaquettes par fluorescence
PN : Polynucléaires neutrophiles
TCMH : Teneur corpusculaire en Hb
VGM : Volume globulaire moyen
VPN : Valeur prédictive négative
VPP : Valeur prédictive positive
WDF : White cell differential channel
WNR : White cell nucleated channel
Liste des figures
Figure 1: Calcul de la moyenne [x] ... 22 Figure 2: Répartitions des valeurs de contrôles autour de la valeur cible. ... 23 Figure 3: Calcul de l’écart-type. ... 24 Figure 4: calcul du coefficient de variation ... 24 Figure 5 : Graphique de Levey-Jennings. ... 25 Figure 6: Règles 12ET ... 26
Figure 7: Règles 13ET ... 26
Figure 8: Règles 22ET ... 27
Figure 9: Règles R4ET ... 27
Figure 10: Règles 41ET ... 28
Figure 11: Règles 10X ... 29
Figure 12: Caractéristiques de l'EEQ ... 35 Figure 13: Intervalles de référence des paramètres de la numération formule
en fonction du sexe... 45
Figure 14: Réactifs de XN-Series ... 50 Figure 15 : Image des notions de justesse et de fidélité ... 54 Figure 16: La distribution de la variation décrite comme z-score pour
Hémoglobine. ... 65
Figure 17: La distribution de la variation décrite comme z-score pour
Hématocrite. ... 65
Figure 18: La distribution de la variation décrite comme z-score pour
Erythrocyte... 66
Figure 19: La distribution de la variation décrite comme z-score pour GB. ... 66 Figure 20: La distribution de la variation décrite comme z-score pour
Liste des tableaux
Tableau 1: Exigences de la Norme NF ISO 15189 ... 7 Tableau 2: la liste des paramètres mesurés et calculés pour les automates
SYSMEX ... 48
Tableau 3: Différents réactifs utilisés par l’appareil Sysmex et leurs rôles. ... 49 Tableau 4: Système international d'évaluation externe de la qualité en
hématologie: exemple de fiche de résultats retournée a un participant ... 63
Tableau 5: Système international d'évaluation externe de la qualité en
hématologie: comparaison entre les valeurs de référence et les résultats des participants (médianes et écarts types (σ) ) ... 64
I- Contexte d’accréditation des laboratoires de biologie médicale ... 2 II- Normes et référentiels qualité applicable aux laboratoires de biologie médicale ... 4
1-Guide de bonne exécution des analyses (GBEA) ... 4 2- Normes ISO ... 5 2.1. Concept et système qualité : les normes ISO ... 5 2.2. Normes ISO applicables aux laboratoires de biologie médicale ... 5 2.2.1. La norme ISO 9001 ... 5 2.2.2. Norme ISO/CEI 17025 ... 6 2.2.3. La norme ISO 15189 ... 6
III- Bonnes pratiques pour la validation analytique en biologie médicale selon la norme ISO 15189 ... 10
1- Généralité ... 10 2- Personnel ... 10 2.1. Qualifications du personnel ... 10 2.2. Définitions des fonctions ... 10 2.2.1. Techniciens de laboratoire ... 11 2.2.2. Fonction du biologiste ... 11 2.3. Formation ... 12 2.4. Formation continue et développement professionnel ... 13 3- Matériel de laboratoire, réactifs et consommables ... 13 3.1. Equipement ... 13
3.2. Réactifs et consommables ... 14 3.3. Maintenance des analyseurs ... 15 3.4. Etalonnage des équipements et traçabilité métrologique ... 16 3.4.1. Métrologie et biologie médicale ... 16 3.4.2. Etalonnage des équipements ... 17 4- Contrôle de qualité ... 18 4.1-Contrôle interne de qualité ... 19 4.1.1. Objectifs du CIQ ... 20 4.1.2. Contrôles ... 20 4.1.3. Calibrage ... 21 4.1.4. Calculs et utilisation des statistiques ... 21 Calculer une moyenne [x] ... 22 Calculer un écart-type ... 23 Le coefficient de variation [CV] ... 24 Créer un tableau de Levey-Jennings ... 25 Règles de Westgard ... 25 4.2. Contrôle externe de qualité ... 30 4.2.1. Définition ... 30 4.2.2. L’EEQ selon la norme ISO 15189 ... 31 4.2.3. Intérêt et objectifs ... 33 4.2.4. Caractéristiques ... 34 4.2.5. Formes d’EEQ... 35 4.2.5.1-Evaluation par enquête ... 35
a- Principe ... 35 b-Démarche de l'évaluation ... 36 c- Difficultés et objections ... 37 4.2.5. 2- Evaluation par inspection sur terrain ... 38 4.2.5.3- Contrôle qualité national ... 38
IV-Validation analytique de l’hémogramme ... 40
1- Description de la méthode ... 40 1.1 . Principe de mesure des automates ... 40 1.1.1 Examens quantitatives ... 40 1.1.1.1-Analyse par impédance ... 41 1.1.1.2-Analyse par diffraction laser ... 42 1.1.1.3-Analyse par cytochimie ... 42 1.1.1.4-Réaction des peroxydases... 42 1.1.1.5-Analyse par un courant à haute fréquence ... 43 1.1.1.6-Lyse chimique ... 43 1.1.2-Examen qualitative : L’automatisation de confection et de coloration des frottis ... 43 1.2- Prélèvement, type d’échantillon primaire et de récipients et additifs .. 44 1.3-Unités et les intervalles de références ... 45 1.4. Automates : Configuration modulaire des automates ... 46 a-Description de la série XN de Sysmex ... 46 b- Paramètres mesurés et calculés pour les automates SYSMEX ... 48 1.5. Réactifs et colorants ... 49
a-Réactifs ... 49 b-Colorants ... 50 1.6. Les matériaux d’étalonnage-contrôle-calibrage ... 51 2- CIQ :Evaluation des performances de la méthode analytique ... 51 2.1. Evaluation de la fidélité ... 51 a-Répétabilité ... 52 b-Reproductibilité ... 52 2.2. Evaluation de la justesse ou le biais ... 53 2.3. Etude de la linéarité ... 55 2.4. Etude de la contamination inter-échantillons ... 55 2.5. Sensibilité et spécificité ... 56 2.6. Comparaison avec une autre méthode ... 57 3- L’évaluation externe de la qualité ... 59 a-Matériel de contrôle et son acheminement ... 60 b-Détermination des valeurs cibles ... 60 c-Interprétation des résultats et limites d’acceptabilité ... 61 d-Actions curatives et correctives ... 67 e-Limites de l’EEQ ... 68
Conclusion ... 69 Résumés ... 71 Référence ... 75
1
Contexte d’accréditation
des laboratoires
2
I- Contexte d’accréditation des laboratoires de biologie
médicale :
L’accréditation est définie comme une attestation délivrée par une tierce partie, ayant rapport à un organisme d’évaluation de la conformité, constituant une reconnaissance formelle de la compétence de ce dernier à réaliser des activités spécifiques d’évaluation de la conformité. Son concept clef est : reconnaissance formelle de la compétence. [1]
L’accréditation en biologie médicale permet de garantir la fiabilité des examens de biologie médicale réalisés et la qualité de la prestation médicale offerte par un laboratoire de biologie médicale (LABM). Au Maroc, cette accréditation est délivrée par le Comité marocain d’accréditation (COMAC) et repose sur des normes harmonisées : la norme ISO 15189 pour les laboratoires de biologie médicale (LABM) [2]
3
Normes et référentiels
qualité applicable
aux laboratoires
de biologie médicale
4
II- Normes et référentiels qualité applicable aux laboratoires de
biologie médicale :
1-Guide de bonne exécution des analyses (GBEA) :
Le GBEA est le référentiel opposable en matière de qualité dans les LABM. En France, la première version a été publiée dans l'annexe de l'arrêté du 02 novembre 1994 relatif aux analyses de biologie médicale. Elle a été révisée à deux reprises en 1999 et 2002. Les textes du GBEA instaurent la mise en place d'un système d'assurance de la qualité dans tous les laboratoires d'analyses et de biologie médicale publics et privés. Il fixe les règles qui s'imposent aux laboratoires et comporte les points suivants :
Règles de fonctionnement (organisation, installation, instrumentation, matériels et réactifs, informatique et élimination des déchets)
Exécution des analyses (procédures et modes opératoires, prélèvements, identification, conservation et élimination des échantillons, validation des résultats, expression des résultats et comptes rendus d’analyses, transmission des résultats) ;
L’assurance de qualité (responsabilité de la personne chargée de l'assurance de qualité, l’évaluation externe de la qualité (E.E.Q.) et contrôle de qualité interne) ;
Stockage et conservation des archives. [3]
Cependant, toujours en France, cette législation a été modifiée et elle impose depuis le 16 janvier 2010 la mise en place de l'accréditation de tous les LABM, sur toutes leurs activités. L'accréditation délivrée par le COFRAC est basée sur la norme ISO 15189, complétée par la norme ISO 22870 pour les cas d'examens délocalisés.
5
2- Normes ISO :
2.1. Concept et système qualité : les normes ISO
La série des normes ISO a été élaborée par la fédération internationale de normalisation pour harmoniser le grand nombre de normes développées à travers le monde et dont la multiplication avait entrainé une confusion dans les milieux industriels. ISO n’est pas un sigle mais un nom dérivé du grec isos, signifiant "égal". Les normes sont des accords documentés contenant des spécifications techniques ou autres critères précis destinés à être utilisés systématiquement en tant que règles, lignes directrices ou définition des caractéristiques.
Contrairement au GBEA, les normes ISO applicables aux laboratoires de biologie médicale (ISO 17025 et ISO 15189) sont de portée internationale. Elles sont élaborées par l'Organisation internationale de normalisation (ISO) puis adoptées au niveau communautaire et national. [4]
2.2. Normes ISO applicables aux laboratoires de biologie médicale :
2.2.1. La norme ISO 9001:
Intitulée « Systèmes de management de la qualité –Exigences », la présente Norme internationale spécifie les exigences relatives au système de management de la qualité lorsqu'un organisme :
doit démontrer son aptitude à fournir régulièrement un produit conforme aux exigences des clients et aux exigences légales et réglementaires applicables ;
vise à accroître la satisfaction de ses clients par l'application efficace du système, y compris les processus pour l'amélioration continue du système et l'assurance de la conformité aux exigences des clients et aux exigences légales et réglementaires applicables.
6
La présente Norme internationale peut être utilisée aussi bien par l'organisme en interne que par des parties externes, y compris des organismes de certification, pour évaluer sa capacité à satisfaire les exigences des clients, les exigences légales et réglementaires applicables au produit, ainsi que les exigences de l'organisme lui-même. [5]
2.2.2. Norme ISO/CEI 17025:
Intitulée «Exigences générales concernant la compétence des laboratoires d'étalonnages et d'essais », elle est née en mai 2000 de la fusion de la norme EN33 45001 et du guide ISO/CEI 25.
Ses dispositions générales sont très voisines de la norme ISO 9001. Cette Norme internationale est destinée à être utilisée par les laboratoires qui élaborent leur système de management pour la qualité et les activités administratives et techniques. Elle peut également être utilisée par les clients des laboratoires, les autorités réglementaires et les organismes d'accréditation engagés dans des activités de confirmation ou de reconnaissance de la compétence des laboratoires. Cependant elle n'est pas destinée à être utilisée comme référentiel pour la certification des laboratoires. [6]
2.2.3. La norme ISO 15189 :
Cette Norme internationale, fondée sur l’ISO/CEI 17025 « Exigences générales concernant la compétence des laboratoires d’étalonnages et d’essais » et sur l’ISO 9001 : « système de management de la qualité, exigences », fournit les exigences de compétence et de qualité propres aux LABM. La norme ISO 15189 est intitulée « Laboratoires d’analyses de biologie médicale : Exigences particulières concernant la qualité et la compétence » elle est parue dans sa
7
version française en octobre 2003. Cette norme est divisée en deux parties majeures :
Une partie qui intègre les exigences relatives au management appelée «partie qualité ». Une autre partie « exigences techniques » qui prend en compte l’ensemble de l’analyse y compris les phases pré- et post-analytiques.
Les exigences de cette norme sont résumées comme suit :
Chapitre 4 : Exigences relatives au management
1. Responsabilités en matière d’organisation et de management
2. Système de management de la qualité 3. Maîtrise des documents
4. Contrats de prestations
5. Examens transmis à des laboratoires sous-traitants 6. Services externes et approvisionnements
7. Prestations de conseils 8. Traitement des réclamations
9. Identification et maîtrise des non conformités 10. Actions correctives
11. Actions préventives 12. Amélioration continue 13. Maîtrise des enregistrements 14. Evaluations et audits
15. Revue de direction
Chapitre 5 : Exigences techniques
1. Personnel
2. Locaux et conditions environnementales 3. Matériel de laboratoire, réactifs et consommables
4. Processus pré analytiques 5. Processus analytiques
6. Garantie de qualité des résultats 7. Processus post analytique 8. Compte rendu des résultats 9. Diffusion des résultats
10. Gestion des informations de laboratoire
Tableau 1: Exigences de la Norme NF ISO 15189
Le chapitre 4 : énonce les différentes exigences relatives au management.
Cela concerne l’organisation générale du LABM et la mise en place du système de management de la qualité ainsi que les exigences à satisfaire pour que le système soit maîtrisé. Un point important réside sur le fait que le système qualité mis en place doit être un processus dynamique en amélioration constante et qui doit être régulièrement évalué.
8
Le chapitre 5 : traite des exigences d’ordre technique, qui constitue le
cœur du métier, du pré-analytique jusqu’au post-analytique.
La norme ISO 15189 encadre donc les différentes étapes de l’acte de biologie médicale : pré-analytique, analytique et post-analytique mais porte aussi sur l’organisation, le management et la compétence du personnel. [7]
Dans le cadre de ce travail nous nous intéresserons particulièrement à l’étape analytique et aux exigences des paragraphes « Personnel », « Matériel de laboratoire », « Processus analytique » et « Garantie de qualité des résultats ».
9
Bonnes pratiques pour
la validation analytique
en biologie médicale selon
10
III- Bonnes pratiques pour la validation analytique en biologie
médicale selon la norme iso 15189 :
1- Généralité :
La phase analytique est un processus technique permettant l'obtention d'un résultat d'analyse biologique. Une assurance qualité appropriée peut permettre à un laboratoire de montrer qu’il dispose des équipements et du matériel adéquat lui permettant d’effectuer des analyses biologiques et que le travail est réalisé en toute maîtrise par un personnel compétent en se conformant à une méthode documentée et validée .
2- Personnel :
Le laboratoire doit disposer d’une procédure documentée pour la gestion du personnel et tenir à jour les enregistrements correspondants pour tout le personnel afin de prouver la conformité aux exigences.
2.1. Qualifications du personnel
La direction du laboratoire doit documenter les qualifications du personnel pour chaque poste. Les qualifications doivent refléter la formation, les aptitudes requises et l’expérience appropriées, ainsi que les compétences démontrées nécessaires et appropriées pour les tâches réalisées. Le personnel donnant un avis sur les examens pratiqués doit avoir des connaissances théoriques et pratiques adaptées ainsi qu’une expérience correspondante.
2.2. Définitions des fonctions :
Le laboratoire doit disposer de fiches de poste qui décrivent les responsabilités, les autorités et les tâches de l’ensemble du personnel en respectant les bonnes pratiques professionnelles selon les référentiels en vigueur. [7]
11
2.2.1. Techniciens de laboratoire :
o Réceptionne, vérifie la conformité et enregistre les bilans urgents sur le système informatique.
o Prépare les automates avant passage des prélèvements (maintenance, calibrations).
o Exécute les analyses médicales selon la prescription.
o Apporte son expertise technique à l’interprétation du contrôle de qualité et des résultats par la validation technique.
o Transmet rapidement les résultats aux médecins ;
o Prend en charge la distribution des produits sanguins labiles o Respecte les règles d’hygiène et de sécurité
o Participe à la formation continue pour actualiser ses connaissances en vue de l’acquisition de nouvelles compétences liées aux besoins du secteur de la santé et aux exigences de la médecine moderne.
2.2.2. Fonction du biologiste :
o La coordination du service de biologie médicale. o La supervision technique du personnel.
o S'assurer que les mesures concernant la santé et la sécurité des personnels et la protection de l'environnement sont appliquées et que les installations des équipements, l'instrumentation et les réactifs soient fonctionnels, appropriés et conformes.
o L’enregistrement écrit des procédures et des modes opératoires de toutes les étapes de l'analyse, depuis le prélèvement de l'échantillon biologique jusqu'à la remise des résultats.
12
o Le suivi des analyses depuis le prélèvement jusqu’au traitement informatique et au rendu des résultats, du contrôle et de la validation des résultats, de la signature électronique des examens biologiques, du contact avec les prescripteurs et les patients.
o La réalisation de certains prélèvements réservés (microbiologie, cytologie)
o La poursuite de la préparation des dossiers de validation de méthode en vue de l’obtention de l’accréditation du laboratoire.
2.3. Formation :
Le laboratoire doit assurer la formation pour l’ensemble du personnel, qui inclut les domaines suivants :
le système de management de la qualité
les processus de travail et procédures attribuées ; le système d’information applicable au laboratoire;
la santé et la sécurité, y compris la prévention ou la limitation des effets des événements indésirables;
l’éthique;
la confidentialité des informations des patients.
Le personnel qui est en cours de formation doit être supervisé à tout moment.
L’efficacité du programme de formation doit être périodiquement revue. [7]
13
2.4. Formation continue et développement professionnel :
Un programme de formation continue doit être mis à disposition du personnel participant aux processus managériaux et techniques. Le personnel doit participer à la formation continue. L’efficacité du programme de formation continue doit être périodiquement revue.
Le personnel doit participer à des programmes réguliers de développement professionnel ou autre type d’activité professionnelle. [7]
3- Matériel de laboratoire, réactifs et consommables :
3.1. Equipement :
La norme exige que le responsable du laboratoire vérifie, lors de l’installation et avant utilisation, que le matériel est capable d’atteindre la performance nécessaire et qu’il est conforme aux exigences relatives aux examens concernés.
Le matériel doit être utilisé à tout moment par du personnel formé et autorisé.
Des instructions sur l’utilisation, la sécurité et la maintenance du matériel (y compris tous les manuels et toutes les instructions d’utilisation fournis par le fabricant) doivent être disponibles.
Le laboratoire doit disposer de procédures garantissant la manipulation, le transport, le stockage et l’utilisation en toute sécurité du matériel d’analyse afin d’empêcher toute contamination ou détérioration. [7]
14
3.2. Réactifs et consommables :
Le laboratoire doit établir un système de gestion du stock des réactifs et consommables.
Les modes d’emploi des réactifs et consommables, y compris ceux fournis par les fabricants, doivent être facilement accessibles.
Les événements indésirables et les accidents qui peuvent être attribués directement à des réactifs ou consommables spécifiques doivent être étudiés et signalés au fabricant et aux autorités compétentes, le cas échéant.
Des enregistrements doivent être conservés pour chaque réactif et consommable, contribuant ainsi au niveau de performance des examens. Ils doivent comprendre, sans y être limité, les renseignements suivants:
- l’identité du réactif ou consommable;
- le nom du fabricant, le code et le numéro de lot; - les coordonnées du fournisseur ou du fabricant;
- la date de réception, la date d’expiration, la date de mise en service et, le cas échéant, la date de mise hors service du matériau
- l’état à la réception (par exemple acceptable ou endommagé) - les instructions du fabricant
- les enregistrements confirmant l’aptitude initiale à l’utilisation du réactif ou consommable;
- les enregistrements de performance confirmant l’aptitude à l’utilisation du réactif ou consommable.
15
Si le laboratoire utilise des réactifs préparés ou réalisés en interne, les enregistrements doivent comprendre, outre les informations ci-dessus, une référence à la ou aux personnes effectuant leur préparation et la date de préparation. [7]
3.3. Maintenance des analyseurs :
Maintenance des analyseurs et la documentation associée constituent une exigence de la norme ISO 15189 et de la réglementation en vigueur et, à ce titre, elles doivent être définies dans la politique qualité du laboratoire.
Il existe deux types de maintenance :
-Maintenance périodique préventive : Maintenance exécutée à des intervalles prédéterminés ou selon des critères prescrits et destinés à réduire la probabilité de défaillance ou la dégradation du fonctionnement d’un bien
-Maintenance périodique corrective : Maintenance exécutée après détection d’une panne et destinée à remettre un bien dans un état dans lequel il peut accomplir une fonction requise.
Les appareils doivent être périodiquement et efficacement inspectés, nettoyés, entretenus et vérifiés.
Le laboratoire doit définir clairement une politique relative à la gestion de la maintenance et celle de la documentation afférente. La durée de conservation des enregistrements en fonction de leur nature est précisée dans un document.
16
Ces éléments peuvent être classés en quatre groupes : - Identification des matériels incluant les analyseurs ;
- Conditions environnementales indispensables pour un bon fonctionnement de l'analyseur ;
- Documentation produite par le fournisseur, conformément à la directive européenne;
- Documentation préparée par le laboratoire incluant toutes les procédures en lien direct avec la maintenance de l'analyseur [8]
3.4. Etalonnage des équipements et traçabilité métrologique :
3.4.1. Métrologie et biologie médicale :
La métrologie est la science des mesurages et ses applications. Elle comprend tous les aspects théoriques et pratiques des mesurages, quels que soient l'incertitude de mesure et le domaine d’application. [9]
La métrologie peut participer au développement de la médecine de laboratoire en contribuant à l'amélioration de la qualité des mesures, de leur fiabilité et de leur justesse. Avec ses concepts et ses pratiques elle peut avoir un impact important dans le secteur de la santé si elle est abordée avec discernement, notamment grâce :
-A l'apport des concepts de métrologie dans les analyses de biologie médicale par l'établissement de la traçabilité et l'évaluation des incertitudes de mesure utilisant des résultats des contrôles internes et externes de qualité ainsi que des résultats de validation de méthodes,
17
- Au développement de méthodes et de matériaux de référence pour les composés concernés par les analyses médicales [10] . Les référentiels de qualité applicables aux LABM précisent les exigences métrologiques. [11]
3.4.2. Etalonnage des équipements :
L'étalonnage des instruments de mesure permet d'assurer la traçabilité métrologique des mesures, comme exigé par les normes ISO 15189 et 17511, ainsi que la directive 98/79/CE relative aux dispositifs médicaux de diagnostic in vitro (DM DIV). Le chapitre 5 de la norme exige que :
Le laboratoire doit disposer d’une procédure documentée pour l’étalonnage de l’équipement susceptible d’affecter directement ou indirectement les résultats d’examens:
En tenant compte des conditions d’utilisation et des instructions du fabricant.
En enregistrant la traçabilité métrologique du matériau d’étalonnage et l’étalonnage traçable de l’élément du matériel
En vérifiant l’exactitude de mesure requise et le fonctionnement du système de mesure à différents stades
En enregistrant l’état et la date d’étalonnage
En s’assurant que, si l’étalonnage donne lieu à un certain nombre de facteurs de correction, les facteurs d’étalonnage précédents sont correctement mis à jour
En prévoyant des sauvegardes afin d’éviter les réglages ou les falsifications susceptibles d’invalider les résultats d’analyse. [7]
18
La traçabilité métrologique doit porter sur un matériau ou une procédure de référence jusqu’à un matériau de référence de qualité supérieure.
L’objectif de ce paragraphe de la norme est de s’assurer de la justesse en termes de métrologie des résultats rendus par le laboratoire.
Cela concerne les équipements de mesures et les équipements métrologiques. Les analyseurs sont également concernés par ce paragraphe ainsi que les étalons utilisés avec leurs incertitudes associées.
Les opérations de métrologie sont différentes de celles des contrôles de qualité, les unes permettant la maîtrise des conditions de réalisation du processus analytique et les autres permettant le contrôle final de ce processus. Le contrôle qualité ne saurait garantir à lui seul la maitrise métrologique de l’intégralité du processus analytique.
4- Contrôle de qualité :
Le laboratoire doit concevoir des procédures de contrôle de qualité permettant de vérifier que la qualité prévue des résultats est bien obtenue.
Il existe de différents types de contrôle de qualité :
Contrôle interne de qualité (CIQ) : réalisé au sein du laboratoire à l’aide
d’échantillons de contrôle lors de la mesure d’échantillons biologiques de patients pour vérifier la maîtrise du processus analytique. L’interprétation se fera en fonction des limites de tolérance déterminées selon un protocole préétabli.
Comparaison inter laboratoires (CIL) : organisation, exécution et
évaluation de mesurages ou d'essais sur la même entité ou sur des entités similaires par deux laboratoires ou plus selon des conditions prédéterminées (NF EN ISO/CEI 17043). Le paragraphe 5.6.4 de la norme ISO 15189 précise : « Le laboratoire doit participer à des comparaisons inter-laboratoires, telles que celles organisées dans le cadre de programmes d’évaluation externe de la qualité ».
19
- Evaluation externe de qualité (EEQ) : Procédure d'évaluation des
performances d'un laboratoire par le biais d'une comparaison inter-laboratoires réalisée par un organisateur respectant substantiellement les exigences de l’ISO 43-11et la réglementation en vigueur à l’aide d’échantillon de contrôles inconnus.
-Contrôle interne de qualité externalisé : CIQ réalisé par plusieurs
laboratoires sur un même lot d’échantillons de contrôles confrontés entre eux par établissement périodique des moyennes (généralement mensuel) permettant d’estimer la justesse (biais). Le CIQ externalisé n’est pas considéré comme un EEQ. [12]
4.1-Contrôle interne de qualité :
C’est une procédure réalisée en même temps que la mesure quantitative ou l’évaluation qualitative d’analytes dans des échantillons de patients. Il implique l’utilisation de matériaux de contrôle de valeurs connues analysés, à une fréquence déterminée, par un processus analytique identique à celui utilisé pour les échantillons de patients. Il permet de surveiller en continue, tel un film, la qualité des résultats produits en évaluant des indicateurs de performance tels l’exactitude, la fidélité et la justesse des processus analytiques et en validant la calibration des instruments. Il suppose l’application de concepts statistiques pour l’établissement des valeurs cibles et des écarts acceptables, le suivi sur des supports tels le graphique de Levey-Jennings et la mise en place de règles telles que celles de Westgard pour déterminer l’acceptabilité des résultats produits. Il permet de détecter les erreurs aléatoires et systématiques (biais) et de prendre action pour prévenir la transmission de résultats erronés. [13]
20
Le contrôle de qualité interne (CQI) permet la surveillance constante et la documentation de la qualité des processus analytiques. Il doit garantir des résultats d’analyses fiables, qui seront utilisés à des fins diagnostiques et thérapeutiques.
4.1.1. Objectifs du CIQ :
Il est indispensable pour permettre de déceler les anomalies et les erreurs des mesures pour y remédier immédiatement. Il est organisé par le biologiste.
Il comporte toutes les mesures destinées à vérifier les différentes phases de l'activité permettant l'obtention des résultats, et notamment l'analyse d'échantillons de contrôle effectuée dans les mêmes conditions que celles appliquées aux échantillons biologiques.
Les procédures opératoires doivent préciser la fréquence de passage des échantillons de contrôle et les valeurs acceptables pour chaque constituant. Elles doivent également comporter les instructions concernant les mesures à prendre en cas d'anomalies constatées.
Il est rappelé que les échantillons de contrôle ne peuvent en aucun cas se substituer aux échantillons de calibrage des mesures et, inversement, les échantillons de calibrage ne peuvent être utilisés en même temps comme échantillon de contrôle. [14] [15]
4.1.2. Contrôles :
Ce sont des matériels qui contiennent une quantité connue de la substance à analyser ou analyte, « Echantillon, adapté à la méthode utilisée, destiné à apprécier l'exactitude et la précision des résultats ». Les contrôles doivent être testés en même temps et comme les échantillons des patients. Le but du contrôle
21
est de valider la fiabilité du système du test et d'évaluer les performances de l'opérateur et les conditions environnementales qui pourraient affecter les résultats. Ces contrôles doivent être utilisés après chaque calibration de l'instrument et de façon régulière lors du déroulement des tests [16]. Des contrôles à 2 ou 3 niveaux différents de concentration doivent être utilisés pour chacune des analyses effectuées afin de couvrir tous les niveaux de valeurs possibles.
4.1.3. Calibrage :
En cytohématologie, le calibrage est le plus souvent réalisé lors de l’installation ou des visites de dépannage ou maintenance, lorsque le système analytique a été déréglé ou lors du changement d’une pièce de l’automate. Le principe de cette calibration est à décrire. La configuration des calibrateurs est à détailler : multiple (le plus souvent), ou unique, monoanalyte (le plus souvent) ou multianalyte. De façon habituelle, le calibrateur est imposé par le fabricant: il importe de décrire la température de stockage, le type de tube, s’il est code-barré, le nombre de niveaux par paramètre, et le nombre de prélèvements à effectuer par paramètre. [17] Après calibration, la validation s’impose à partir des algorithmes d’acquisition des données.
4.1.4. Calculs et utilisation des statistiques :
Pour chaque test effectué au laboratoire, les statistiques de CQ sont calculées à partir de la base de données de CQ recueillies lors des passages réguliers des contrôles. Les données recueillies sont spécifiques à chaque niveau de contrôle. Par conséquent, les statistiques et les limites calculées à partir de ces données sont également spécifiques à chaque niveau de contrôle et reflètent le comportement du test à des concentrations spécifiques. [18] Les statistiques
22
les plus fondamentales utilisées par le laboratoire sont la moyenne [x], l’écart-type [ET] et le coefficient de variation [CV] :
Calculer une moyenne [x] :
La moyenne correspond à la meilleure estimation par le laboratoire de la valeur vraie d’un analyte pour un niveau de contrôle spécifique. Pour calculer la moyenne d’un niveau de contrôles spécifique, faire la somme de toutes les valeurs recueillies pour ce contrôle. Ensuite, diviser la somme de ces valeurs par le nombre total des valeurs. [18]
Formule 1 : calculer la m
] Figure 1: Calcul de la moyenne [x] [18]
23
Calculer un écart-type
L’écart-type [ET] est un paramètre qui quantifie la dispersion des valeurs entre elles (c’est-à-dire les valeurs de CQ). Le terme précision est souvent utilisé. Un autre terme, l’imprécision, est aussi utilisé pour exprimer la dispersion des valeurs numériques. L’écart-type est calculé pour les contrôles à partir des mêmes données utilisées pour calculer la moyenne.
Le laboratoire peut avoir une estimation des performances du test à des niveaux de concentration spécifiques. La répétabilité d’un test peut être bonne (écart-type faible, imprécision faible) ou mauvaise (écart-type élevé, imprécision élevée). La répétabilité médiocre peut être due au réactif concerné ou à un fonctionnement défectueux. Dans ce cas, le laboratoire doit résoudre le problème. Dans un laps de temps court, les valeurs des mesures répétées doivent être aussi proches que possible. Il est nécessaire d’être particulièrement précis pour les tests qui sont répétés régulièrement pour le suivi des patients. [18]
24
Figure 3: Calcul de l’écart-type. [18]
Le coefficient de variation [CV] :
Est le rapport entre l’écart-type et la moyenne et est exprimé en pourcentage. Cette statistique permet au biologiste de comparer plus facilement la précision globale. En effet, l’écart-type augmente en général en même temps que la concentration de l’analyte, alors le CV peut être considéré comme un pondérateur de statistiques. Si le biologiste ou le technicien compare la précision de deux méthodes différentes et utilise seulement l’écart type, cela peut facilement l’induire en erreur. [18]
25
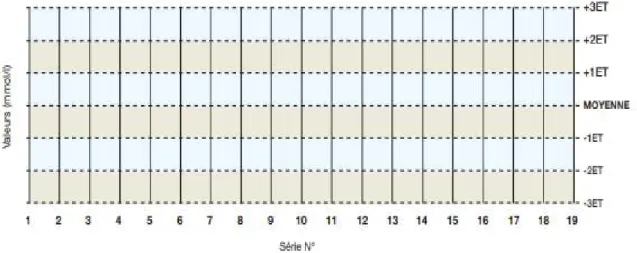
Créer un tableau de Levey-Jennings
L’écart-type est communément utilisé pour préparer des tableaux de Levey-Jennings (L-J ou LJ). Le tableau de Levey-Levey-Jennings présente les valeurs de contrôle de qualité (série par série ou jour après jour) chronologiquement sous forme de graphique. Chaque test et chaque niveau de contrôle possèdent son tableau. La première étape est de calculer les limites de décision. Ces limites sont de plus ou moins 1, 2 ou 3 ET par rapport à la moyenne. [18]
Figure 5 : Graphique de Levey-Jennings.
Règles de Westgard :
Elles permettent de définir un critère de jugement de la performance (bonne ou mauvaise) du déroulement de la série analytique. Le but est donc de signaler à partir de quand le contrôle ne suit plus la distribution normale [117]. Le système de Westgard comporte six règles élémentaires qui sont utilisées individuellement ou en combinaison afin d'évaluer la qualité des séries analytiques. En dehors de ces cas, les résultats sont considérés comme conformes. [19]
26
Règle 12ET : C’est une règle d’alarme qui est violée lorsqu’une seule valeur de contrôle est en dehors des limites de ± 2ET. Cette règle signale simplement qu’une erreur aléatoire ou systématique peut être présente dans le système analytique. Les valeurs des contrôles des séries antérieures et en cours doivent être prises en compte. Si aucune relation ne peut être trouvée et ni aucune source d’erreur identifiée, une seule valeur de contrôle en dehors des limites de 2ET est une erreur aléatoire acceptable. Alors, les résultats de patients peuvent être validés.
Figure 6: Règles 12ET [18]
Règle 13ET : Cette règle détecte les erreurs aléatoires inacceptables et peut aussi indiquer le début d’une erreur systématique importante. Tout résultat de CQ en dehors des ±3ET viole cette règle.
27
Règle 22ET : Cette règle détecte uniquement les erreurs systématiques. Les critères d’infraction sont : • Deux résultats de CQ consécutifs
• Supérieurs à 2ET
• Du même côté de la moyenne
Figure 8: Règles 22ET [18]
Règle R4ET : Cette règle détecte uniquement les erreurs aléatoires et s'applique seulement à la série en cours. S'il y a au moins une différence de 4S entre les valeurs de contrôle dans une série, la règle est violée pour cause d'erreur aléatoire.
28
Règle 31ET : Les critères d’infraction sont : Trois résultats consécutifs Supérieurs à 1ET
Du même côté de la moyenne
Règle 41ET : Les critères d’infraction sont : • Quatre résultats consécutifs • Supérieurs à 1ET
• Du même côté de la moyenne
29
Règles 7x, 8x, 9x, 10x et 12x : ces règles sont enfreintes lorsqu’il y a :
• 7ou 8 ou 9 ou 10 ou 12 résultats de contrôle
• du même côté de la moyenne, indépendamment de l’écart-type.
Les infractions indiquent un biais systématique dans une zone unique de la courbe de calibration. [18]
30
4.2. Contrôle externe de qualité :
4.2.1. Définition :
Le terme CEQ ou évaluation externe de la qualité (EEQ) est utilisé pour décrire une méthode permettant de comparer les analyses des laboratoires à une référence externe. Cette comparaison peut être menée pour comparer les performances d’un groupe de laboratoires similaires ou pour estimer les performances d’un laboratoire de référence. [20]
L’EEQ représente un moyen efficace pour repérer les problèmes et vérifier objectivement les performances du laboratoire par rapport à d’autres laboratoires en utilisant des agences externes.
La participation à l’EEQ comporte l’analyse d’une série d’échantillons connus de l’organisme évaluateur, mais inconnus du laboratoire, envoyés aux centres participants au programme EEQ. Chaque laboratoire participant reçoit une série identique d’échantillons qui doivent être analysés selon les méthodes utilisées en routine pour les prélèvements cliniques, pour garantir que les résultats obtenus lors de l’EEQ reflètent exactement la performance habituelle. Une fois les résultats recueillis et analysés, chaque centre reçoit ses propres résultats ainsi que ceux des autres laboratoires participants anonymisés, ce qui lui permet de comparer sa performance à celle des autres centres. L’information obtenue grâce à l’EEQ permet ainsi d’améliorer la qualité globale des activités des laboratoires de biologie médicale. [21]
31
4.2.2. L’EEQ selon la norme ISO 15189 :
D’après la norme, le laboratoire doit garantir la qualité des examens en les réalisant dans des conditions définies. Il doit concevoir des procédures de contrôle de qualité permettant de vérifier que la qualité prévue des résultats est bien obtenue de manière à éviter de libérer les résultats des patients en cas de défaillance du contrôle qualité.
Le laboratoire doit participer à des programmes de comparaison inter-laboratoires (programme d’évaluation externe de la qualité, programme d’essais d’aptitude...) appropriés aux analyses et interprétations des résultats d’analyse.
Le laboratoire doit surveiller les résultats des programmes de comparaison inter-laboratoires et participer à la mise en œuvre des actions correctives lorsque les critères de performances préalablement déterminés ne sont pas satisfaits. Le laboratoire doit établir une procédure documentée de sa participation à des programmes de comparaison inter-laboratoires
Les programmes choisis par le laboratoire doivent, dans la mesure du possible, fournir des échantillons cliniques qui imitent les échantillons de patient et qui ont pour effet de contrôler l’ensemble du processus analytique, ainsi que les procédures pré-analytiques et post-analytiques.
Si une comparaison inter-laboratoires n’est pas disponible, le laboratoire doit développer d’autres approches et fournir la preuve objective permettant de déterminer l’acceptabilité des résultats d’analyse.
32
La norme exige que la comparaison inter-laboratoires se fasse selon les règles suivantes :
• Le laboratoire doit intégrer les échantillons des comparaisons inter-laboratoires dans les séries régulières de manière à ce qu’ils suivent, autant que possible, le même traitement que les échantillons de patients.
• Les échantillons de comparaison inter-laboratoires doivent être analysés par le personnel qui analyse régulièrement les échantillons de patients selon les mêmes procédures que celles utilisées pour les échantillons de patients.
• Le laboratoire ne doit pas communiquer avec les autres participants du programme de comparaison inter-laboratoires concernant les données des échantillons avant la date de soumission des données.
• Le laboratoire ne doit pas sous-traiter les échantillons de comparaison inter-laboratoires pour confirmation avant la soumission des données, même si cela est effectué régulièrement avec les échantillons de patients.
• Les performances des comparaisons inter-laboratoires doivent être revues et abordées avec le personnel concerné.
Si les critères de performances prédéterminés ne sont pas remplis (c'est-à-dire présence de non-conformité), le personnel doit participer à la mise en œuvre et à l’enregistrement des actions correctives. L’efficacité des actions correctives doit être surveillée. Les résultats obtenus doivent être évalués pour connaitre les tendances qui indiquent les non-conformités potentielles et des actions préventives doivent être prises. [7]
33
4.2.3. Intérêt et objectifs :
L’EEQ permet avant tout de montrer que le laboratoire ayant participé à ce contrôle fournit des résultats comparables aux autres laboratoires. Sa fonction première est de vérifier donc l'exactitude des résultats du laboratoire examiné. Ces contrôles ponctuels (ou enquêtes), de sondages permettent aux biologistes, régulièrement et en aveugle, de confronter leurs résultats, et surtout de savoir si la réponse fournie est « bonne » ou «mauvaise » en appréciant la différence constatée entre cette réponse et la valeur théorique, ou du moins la « valeur cible». [22]
L'objectif de l'EEQ est de fournir aux laboratoires participants une mesure de comparaison des résultats, de manière à les assurer que le résultat obtenu sur un échantillon dans leur laboratoire ne diffère pas significativement des résultats obtenus par les autres laboratoires pour le même échantillon. La finalité de cette comparaison est d'harmoniser les différents laboratoires, l'idée étant que si un même échantillon de patient était analysé simultanément dans plusieurs laboratoires, les différences entre les résultats obtenus ne devraient en aucune manière conduire à des interprétations ou à des décisions médicales contradictoires. Autres objectifs : Effectuer des comparaisons entre les DMDIV; démontrer la transférabilité des procédures analytiques entre laboratoires; mettre en évidence les difficultés et déficiences dans leur fonctionnement et enfin assurer l'éducation des fournisseurs et utilisateurs quant aux avantages et limites des différentes méthodes, instruments et automates. [23]
34
4.2.4. Caractéristiques :
Les programmes d’EEQ partagent tous les caractéristiques générales suivantes
• Les programmes EEQ peuvent être soit gratuits soit payants. Les programmes gratuits incluent ceux offerts par un fabricant pour s’assurer que son équipement fonctionne correctement et ceux organisés par un programme régional ou national pour l’amélioration de la qualité.
• Certains programmes d’EEQ sont obligatoires : ils sont soit requis par une agence d’accréditation, soit par la loi. D’autres sont volontaires, et le responsable qualité peut choisir d’y participer dans le but d’améliorer la qualité des performances de son laboratoire.
• Le programme d’EEQ peut être organisé à différents niveaux : régional, national ou international.
• Les résultats du laboratoire sont confidentiels et généralement ne sont connus que du laboratoire participant et du fournisseur d’EEQ. Un résumé est généralement fournit et permet des comparaisons dans le groupe.
• Certains programmes d’EEQ peuvent ne s’intéresser qu’à une seule maladie.
Des résultats couronnés de succès lors d’un programme d’EEQ sont le reflet de l’efficacité de la gestion de la qualité au laboratoire et entraînent une reconnaissance de cette qualité par des groupes et personnes extérieures au laboratoire. [24]
35
Les caractéristiques d’une EEQ sont résumées dans la figure ci-dessous :
Figure 12: Caractéristiques de l'EEQ [24]
4.2.5. Formes d’EEQ
4.2.5.1-Evaluation par enquête a- Principe :
L’enquête est la forme d’EEQ la plus courante. Des échantillons aussi identiques que possibles, sont envoyés aux laboratoires participants, qui les analysent ou les soumettent à un autre processus; les résultats sont alors adressés à l’organisateur de l’EEQ. Les résultats sont évalués en fonction d’un étalon
EEQ
Confidentiel Gratuit/ Payant Obligatoire / Volontaire Régional/ National/ International Mono/ Multi Centrique Reconnaissance / Education36
absolu (cas très rare) ou d’un résultat obtenu par un ou plusieurs laboratoires de références. Ils peuvent aussi être soumis à un groupe de contrôle (pour une évaluation subjective) ou être jugés selon une « moyenne de consensus » (pour ce qui concerne les dosages). [25]
b-Démarche de l'évaluation :
Le principe est simple et présente des similitudes avec le schéma de CIQ : chaque laboratoire participant à une enquête reçoit de l'évaluateur un échantillon contrôle (de concentration inconnue) à analyser; il s'agit du même échantillon pour tous les laboratoires. Le laboratoire réalise les analyses demandées, recopie les résultats sur des formulaires appropriés et renvoie les résultats à l'évaluateur ou introduit les résultats on-line via un site web qui est géré par le service. L'ensemble des résultats fournis par les laboratoires fait l'objet d'une analyse statistique, grâce à laquelle les caractéristiques de distribution sont déterminées, en particulier la moyenne et l'écart type des résultats. A l'issue du traitement statistique, chaque laboratoire reçoit un rapport où sont repris ses propres résultats, localisés par rapport à la moyenne de l'ensemble des laboratoires. Le responsable peut ainsi apprécier la qualité de son travail et prendre les mesures adéquates si ses résultats s’écartent nettement de l'ensemble des résultats des autres laboratoires, en particulier des laboratoires utilisant la même méthode analytique. Les paramètres les plus importants sont les renseignements donnés au centre de contrôle concernant les méthodes utilisées. En effet, la méthode de détermination, son étalonnage et même l'appareil utilisé peut influencer un résultat. Chaque centre de contrôle demandera donc au minimum les renseignements suivants : le principe de la méthode; le principe et la nature de l'étalonnage; l’appareillage utilisé et les fabricants des réactifs (ou trousses) utilisés. Au terme de l'exercice annuel, chaque laboratoire peut avoir fourni plus
37
d'une centaine de résultats, ce qui constitue une quantité considérable d'informations permettant à l'évaluateur et au laboratoire évalué de se faire une idée de la qualité globale et de relever les lacunes éventuelles. L'EEQ doit être perçue de manière « éducative » plutôt que « répressive », car en fin de compte c'est l'intérêt du patient qui importe. [26]
c- Difficultés et objections :
EEQ n'est pas un substitut de CQI car sa fréquence est trop faible et les résultats trop tardifs pour engager des actions correctives immédiates.
L'échantillon peut être traité par les laboratoires participants autrement que dans la pratique journalière, de sorte que l'impression recueillie lors de l'enquête ne correspond guère au niveau de qualité normal des résultats (dans l'idéal, l'EEQ devrait être effectuée « à l'aveugle », les spécimens distribués étant reçus et traités exactement de la même façon que les spécimens ordinaires, mais cela n'est pas toujours facile à réaliser et peut même être impossible).
Les laboratoires peuvent se consulter sur les résultats des analyses des spécimens distribués avant de les soumettre à l'organisateur, donnant ainsi une impression faussement favorable de leur cohérence (on peut faire échec à cela en distribuant des spécimens différents, encore que voisins, ou des paires de spécimens).
Et enfin les enquêtes peuvent ne porter que sur un nombre limité d'épreuves, qui ne constituent parfois qu'une fraction si minime des activités du laboratoire qu'elles ne sont pas représentatives de l'ensemble de ses travaux (pour faire face à ce problème, les organisateurs s'efforcent de choisir des séries d'épreuves aussi représentatives que possible, compte tenu des contraintes imposées par la disponibilité des échantillons à analyser).
38
4.2.5. 2- Evaluation par inspection sur terrain :
Cette méthode est employée en différentes localités des Etats-Unis d'Amérique. Un inspecteur se rend au laboratoire pour enquêter sans avertissement préalable et demande que l'on analyse un groupe d'échantillons. Les caractéristiques des spécimens ont été déterminées peu auparavant (ou sont déterminées simultanément) par un laboratoire de référence de l'Etat. L'inspecteur s'efforce d'assurer l'application des procédures habituelles. Les échantillons à analyser proviennent fréquemment de malades et n'ont pas encore eu le temps de se détériorer. En outre, le système est évidemment très coûteux et les contrôles ne sont effectués qu'à des intervalles forts espacés. [27]
4.2.5.3- Contrôle qualité national :
Dans le cadre de l’EEQ, les laboratoires de biologie médicale français sont dans l’obligation légale de participer au contrôle national de qualité (CNQ) organisé par l’Afssaps. Le nombre élevé de participants (environ 5 200 laboratoires inscrits en 2009) qui, bien qu’il rende l’organisation complexe, fait de ce contrôle un outil important pour la biologie médicale. Le CNQ permet à la fois d’avoir une vision globale de la qualité de la biologie médicale en France et d’évaluer la qualité de chaque laboratoire par rapport à un nombre significatif d’autres laboratoires. C’est également un moyen d’évaluer les DMDIV.
L’observation d’anomalies permet de mettre en place des actions à visée corrective soit au niveau des participants, soit au niveau des DMDIV, et ainsi d’améliorer la qualité des résultats des analyses de la biologie médicale.
39
Validation analytique
de l’hémogramme
40
IV-Validation analytique de l’hémogramme :
La validation des méthodes d’analyse est une exigence forte de la norme. L’accréditation d’un laboratoire passe forcément par cette étape qui permet d’avoir une bonne connaissance des méthodes d’analyses, de leurs performances et de leurs limites
1- Description de la méthode :
1.1 . Principe de mesure des automates :
1.1.1 Examens quantitatives :
Effectuer un hémogramme automatisé consiste à analyser les caractéristiques des cellules circulantes du sang périphérique puis à les quantifier. Il comprend dans tous les cas des données quantitatives qui étaient obtenues autrefois par des techniques manuelles longues, fastidieuses et peu reproductibles. Il s'agit :
• des paramètres érythrocytaires - nombre d'hématies ou globules rouges (GR), taux d'hémoglobine (Hb), hématocrite (Ht), volume globulaire moyen (VGM), teneur corpusculaire en Hb (TCMH), concentration corpusculaire moyenne en Hb (CCMH);
• du nombre des leucocytes ou globules blancs (GB); • du nombre des plaquettes (Pl).
Depuis les années 1960, des automates de plus en plus performants ont été mis au point. Ce sont des cytomètres en flux qui utilisent différentes méthodes physiques et chimiques pour caractériser puis décompter les éléments du sang. D'abord limités aux paramètres quantitatifs précédents, ils proposent maintenant
41
une formule leucocytaire complète - polynucléaires neutrophiles (PN), éosinophiles (PE), basophiles (PB), lymphocytes (Ly) et monocytes (Mo) et, pour certains, la numération des réticulocytes.
La diffusion des automates dans les laboratoires d'analyse a permis d'améliorer la reproductibilité et la précision des mesures sous réserve d'un calibrage et d'un suivi rigoureux des instruments. Néanmoins, ces techniques automatisées ont des limites et des causes d’erreur, et le biologiste doit rester vigilant et poser l'indication de contrôles manuels dans certaines circonstances.
Différentes méthodes d'analyse physique des cellules sont utilisées, seules ou associées à des techniques cytochimiques ou à des marqueurs fluorescents [28]
1.1.1.1-Analyse par impédance
L'analyse par impédance permet de compter les hématies, les leucocytes et les plaquettes. Elle utilise le « principe Coulter ». Les cellules mises en suspension dans un liquide conducteur et guidées à travers un petit orifice cylindrique vont déclencher lors de leur passage entre deux électrodes immergées dans ce liquide une augmentation de la résistance électrique (variation d'impédance) qui génère une impulsion électrique :
• le nombre d'impulsions correspond au nombre de cellules ayant franchi l'orifice;
• l'amplitude de l'impulsion est proportionnelle au volume de la cellule. Les instruments permettent d'éviter les artefacts liés à la recirculation des cellules déjà comptées dans la zone de détection (flux de balayage par le diluant) ou au passage simultané de deux cellules (correction de coïncidence). Les impulsions aberrantes par la taille ou la forme sont écartées de l'analyse ultérieure.
42
Les impulsions sont ensuite classées dans différents canaux selon leur amplitude, ce qui permet la construction d'histogrammes de distribution volumétrique.
1.1.1.2-Analyse par diffraction laser
Les cellules en suspension sont acheminées dans une gaine liquide et hydrofocalisées afin de les aligner. Chaque cellule passe ainsi individuellement devant un faisceau laser dont elle diffracte la lumière. La lumière diffractée peut alors être analysée sous différents angles :
• aux petits angles (0-3°), dans l'axe du faisceau incident, la mesure de la lumière diffractée par la cellule donne des indications sur le volume de la cellule;
• aux grands angles (15°, 90°), la lumière traverse la membrane cellulaire et est diffusée par les organites intracellulaires. La mesure de cette lumière renseigne sur la granularité du cytoplasme et la densité chromatinienne de la cellule.
De plus, les polynucléaires éosinophiles peuvent être décomptés grâce à leur propriété de dépolariser la lumière laser à 90°.
1.1.1.3-Analyse par cytochimie
Ces techniques sont utilisées par certains constructeurs pour identifier ou sélectionner les populations leucocytaires.
1.1.1.4-Réaction des peroxydases
Elle repose sur la mise en évidence de la peroxydase contenue dans les granulations primaires de certains leucocytes. Les lymphocytes sont négatifs pour cette réaction. En présence d'eau oxygénée et d'un substrat
![Figure 1: Calcul de la moyenne [x] ...............................................................](https://thumb-eu.123doks.com/thumbv2/123doknet/15038274.690924/31.892.109.797.134.846/figure-calcul-moyenne.webp)
![Figure 2: Répartitions des valeurs de contrôles autour de la valeur cible. [18]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038274.690924/60.892.202.690.683.906/figure-répartitions-valeurs-contrôles-valeur-cible.webp)
![Figure 3: Calcul de l’écart-type. [18]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038274.690924/61.892.116.776.114.293/figure-calcul-de-l-écart-type.webp)
![Figure 6: Règles 1 2ET [18]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038274.690924/63.892.301.591.390.598/figure-règles-et.webp)
![Figure 8: Règles 2 2ET [18]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038274.690924/64.892.299.589.273.592/figure-règles-et.webp)
![Figure 10: Règles 4 1ET [18]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038274.690924/65.892.311.579.559.923/figure-règles-et.webp)
![Figure 11: Règles 10 X [18]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038274.690924/66.892.290.604.418.841/figure-règles-x.webp)
![Figure 12: Caractéristiques de l'EEQ [24]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038274.690924/72.892.179.714.158.675/figure-caractéristiques-de-l-eeq.webp)
