I
L’objectif de la vaccination est de permettre à l’individu de développer une protection active spécifique vis-à-vis d’un agent infectieux: le procédé consiste à introduire dans l’organisme une substance immunogène dont les caractéristiques structurales sont proches de celles de l’agent infectieux. Elle exploite la mémoire immunitaire [1; 2].
La vaccination est l’une des grandes victoires de la médecine moderne et constitue un outil essentiel de prévention et de lutte contre les maladies infectieuses dans le monde [3]. C’est un moyen rentable et économique puisqu’il coûte beaucoup moins cher que le coût de la maladie (selon l’OMS, 1 DH investi permettra d’épargner de 500 à 6.000 DH pour toutes les vaccinations recommandées dans les programmes de vaccination) [4].
La vaccination confère au vacciné une protection individuelle. De plus, quand le nombre des vaccinés est important, la circulation de l’agent pathogène dans le milieu extérieur est ralentie, et par là même les chances d’être infecté diminuent pour tous, y compris les non vaccinés. C’est ce qu’on appelle une immunité collective, obtenue pour une proportion de vaccinés variable selon la contagiosité de l’agent pathogène. Enfin, lorsque l’agent pathogène ne circule plus, stoppé dans sa progression par l’absence de sujets réceptifs, on peut aboutir à l’éradication mondiale d’une maladie. C’est ce qui s’est produit pour la variole en 1977, et qui promet dans l’avenir d’arriver pour la poliomyélite, la rougeole, etc [5].
Actuellement la vaccination est devenue une science à part entière débutant par l’isolement de l’agent pathogène, sa culture, son atténuation ou son inactivation pour fabriquer un vaccin. Les étapes suivantes comportent l’étude de l’efficacité clinique et biologique, des effets indésirables et de l’acceptabilité par la population cible. Les techniques de conjugaison des vaccins polyosidiques
à des protéines ont fait progresser la vaccination précoce des nourrissons. Des vaccins recombinants, réassortants, ou sous forme de pseudoparticules virales ont été conçus, permettant d’étendre l’éventail des vaccins disponibles [6].
Le Maroc a réalisé des performances importantes dans le domaine de la vaccination contre les maladies cibles qui étaient responsables autrefois d’une mortalité et morbidité élevées chez les enfants de moins de cinq ans. Ainsi, notre pays n’a plus enregistré de cas de poliomyélite depuis 1987 et aucun cas de diphtérie depuis 1992.
Cependant, malgré les bénéfices sanitaires prouvés de la vaccination, la faible utilisation des services de vaccination surtout en milieu rural, se pose comme une véritable problématique à l’atteinte des objectifs visés.
L’Organisation mondiale de la santé (OMS) a recommandé depuis 1978 la mise en œuvre de programmes nationaux de vaccination (PNI). Celui du Maroc a l’objectif d’assurer une couverture vaccinale contre les neufs maladies infectieuses, cibles des vaccins du calendrier du Ministère de la santé :
La tuberculose, la poliomyélite, l’hépatite B, la diphtérie, le tétanos, la coqueluche, la rougeole, la rubéole et la méningite à Haemophilus Influenzae type b. La majorité des citoyens marocains se font vacciner dans le secteur public [4; 7; 8].
L’objectif de ce travail est de faire le point sur le programme national de vaccination et de mesurer les résultats acquis.
Pour cela nous rappelons dans une première partie les bases immunologiques de la vaccination, ensuite les maladies cibles, puis le protocole de la vaccination et le rappel de l’épidémiologie et de la couverture vaccinale au Maroc. Nous terminons avec la pharmacologie des vaccins utilisés dans le
H
H
I
I
S
S
T
T
O
O
I
I
R
R
E
E
D
Deux cents ans après la découverte du vaccin antivariolique, la vaccination reste un des piliers de la médecine préventive.
Dans différentes civilisations, le constat empirique de la protection conférée à des individus par des maladies aiguës ainsi que la mithridatisation ont poussé les hommes à vouloir imiter la nature en provoquant de façon artificielle des formes atténuées de certaines maladies [9].
1. La variole et les premières inoculations délibérées :
Dès le V ème siècle, la variole est mentionnée dans les textes médicaux chinois et il semble que l’inoculation était déjà pratiquée. Toutefois c’est seulement au XI ème siècle que l’on retrouve la description précise de la pratique de la variolisation en Chine, utilisant le pus ou les squames broyées d’un patient qui étaient alors placés dans les narines d’un sujet sain. Une autre pratique consistait à faire porter par un enfant sain, pendant plusieurs jours, les sous-vêtements d’un enfant infecté.
Dès le XVI ème siècle, en Inde, la variolisation était une pratique régulière chez les brahmanes. Il en était de même pour différents groupes ethniques de l’Empire ottoman. Bartholin signale la variolisation en Europe occidentale dès 1673. En 1715, Lady Mary Wortley Montagu, épouse de l’ambassadeur anglais en Turquie inocule du pus variolique desséché à son fils pour le protéger de la maladie. En 1720, la variolisation fut introduite en Angleterre et pratiquée dans deux milieux sociaux diamétralement opposés: les aristocrates proches d’une avant-garde médicale et les couches défavorisées de la population, servant de cobayes à des expériences.
Bien que la variolisation soit souvent efficace pour prévenir la variole, les résultats étaient irréguliers et 2 à 3 % des personnes mouraient d’une variole
ainsi contractée. En France, Doyen de la faculté de Paris, en recommandait les avantages dès 1717 et Voltaire lui consacrait quelques lignes dans ses lettres sur les anglais en 1728. Cependant, la méthode ne se répandit que lentement en France et l’inoculation de Louis-XVI et de plusieurs membres de la famille royale au château de Marly, le 18 juin 1774, fut considérée comme un événement et fit l’objet d’un rapport à l’Académie des sciences le 20 juillet 1774. Rappelons que la même année, Louis XV est mort de la variole [10].
En 1774, un éleveur nommé Benjamin Jesty, ayant lui-même contracté un vaccin transmis par son troupeau atteint de variole bovine, décida d’inoculer le vaccin à sa femme et ses enfants afin de les protéger d’une épidémie de variole [11]. L’immunité des deux enfants persista au moins 15 ans au bout desquels ils furent volontairement inoculés avec la variole.
Le 14 mai 1796, Edward Jenner inocule dans la peau d’un enfant de paysan de huit ans, James Philipps, du pus de vache souffrant de la variole bovine, et un mois plus tard vérifie que le sujet est immunisé en lui inoculant cette fois-ci du pus humain. Le travail de Jenner est sans aucun doute la première approche scientifique de contrôle d’une maladie infectieuse au moyen d’une inoculation délibérée, et s’il s’est vraisemblablement inspiré des tentatives empiriques précédentes, il est le premier à avoir situé ses recherches dans une perspective clinique et épidémiologique. Ses observations ont fait l’objet de deux traités publiés successivement en 1798 et 1799.
Jenner conclut en 1810 que l’immunité conférée ne durait pas toute la vie, sans identifier pour quelle raison. Les concepts de virulence, d’atténuation, de revaccination voyaient le jour.
Grâce aux efforts de la vaccination, la variole a pu être éliminée du monde en 1977, le dernier cas sauvage étant survenu en août 1977 en Somalie [12; 13; 14].
2. Pasteur et le concept de l’atténuation :
L’œuvre de Jenner ne fut pas suivie immédiatement par la découverte de nouveaux vaccins. Il a fallu attendre près d’un siècle pour pouvoir comprendre la problématique de la vaccination, grâce à Pasteur. Il a démontré l’origine des maladies infectieuses, mais a aussi prouvé qu’il était possible de se protéger contre elles par l’injection de germes atténués, provoquant une maladie bénigne inapparente et permettant de développer une immunité solide et durable. Il a commencé d’appliquer ses vaccins atténués sur les animaux avant de les pratiquer à l’Homme [15].
Le 4 juillet 1885, Pasteur appliqua au petit Joseph Meister, pour la première fois le vaccin antirabique [16; 17].
En 1884, Robert Koch découvre le vibrion cholérique et Jaime Ferran en Espagne puis Waldemar Haffkine en France, en 1892 tentent d’immuniser les sujets par des bacilles vivants.
En 1896, Wright, expérimente le premier vaccin contre la typhoïde.
En 1923, le danois Thorvald Madsen rapporte les premiers résultats de vaccination anticoquelucheuse.
En 1921, Calmette et Guérin mettent au point le vaccin tuberculeux.
En 1937, Le premier vaccin préparé sur œuf embryonné est le vaccin contre la fièvre jaune mis au point par Max Theiler, suivi par le vaccin antigrippal inactivé de Jonas Salk et en 1949 un vaccin vivant atténué contre les oreillons par Anatol Smorodintsev.
En 1957, Albert Sabin développe un vaccin antipoliomyélitique oral.
Grâce aux possibilités de reproduire les virus sur cultures cellulaires puis de les atténuer, se sont ensuite développés successivement les vaccins contre la rougeole (Edmonston, Schwarz) à partir de virus cultivé sur embryon de poulet ou de cellules diploïdes humaines (John Enders en 1960), contre la rubéole (Tom Weller, Paul Parkmann en 1962, puis Prinzie, Huygelen, Plotkin en 1970) et contre les oreillons, cultivé également sur embryon de poulet (Maurice Hillemann en 1966) [18].
P
P
R
R
E
E
M
M
I
I
E
E
R
R
C
C
H
H
A
A
P
P
I
I
T
T
R
R
E
E
R
R
A
A
P
P
P
P
E
E
L
L
S
S
E
E
T
T
G
G
E
E
N
N
E
E
R
R
A
A
L
L
I
I
T
T
E
E
S
S
S
S
U
U
R
R
L
L
’
’
I
I
M
M
M
M
U
U
N
N
I
I
S
S
A
A
T
T
I
I
O
O
N
N
A. La relation : Femme enceinte-fœtus :
Les mères protègent leur fœtus, des pathogènes vis-à-vis des quels elles sont elles mêmes immunisées, par deux mécanismes :
Le transfert actif d’anticorps spécifiques au cours du troisième trimestre de la grossesse assure une immunité passive (équivalent des sérothérapies préventives) chez le fœtus; l’immunité humorale maternelle joue donc un rôle important du côté fœtal;
L’immunité protectrice de la mère assure la clairance des pathogènes du côté maternel, et en conséquence diminue la quantité de pathogènes transmissibles par voie hématogène et/ou transplacentaire; l’immunité cellulaire joue donc, indirectement, un rôle primordial dans la prévention de la transmission des pathogènes de la mère à l’enfant [19].
En plus, le liquide amniotique contient plusieurs facteurs s’opposant à la croissance bactérienne. Larsen et al [20; 21], ont identifié un inhibiteur spécifique, peptide de faible poids moléculaire, contenant du zinc et dont l’activité est inhibée par le phosphate [22; 23].
Cinq facteurs rendent compte du passage de la contamination simple à l’infection: [24; 25]
Le niveau de défense immunitaire du foetus, plus immature chez le prématuré que chez le nouveau-né à terme ;
Le caractère pathogène du germe et sa virulence ; L’importance quantitative de la contamination ;
L’existence ou non d’anticorps spécifiques d’origine maternelle apportant une séroprotection passive ;
1. Voies de la contamination :
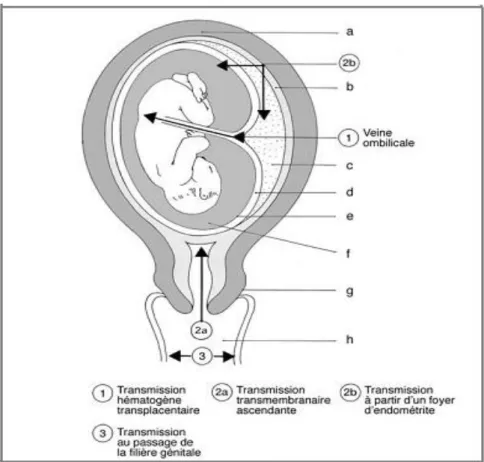
Il y’a trois voies de la contamination (Figure 1).
1.1. Voie hématogène placentaire :
Elle est à l’origine d’une contamination massive au cours d’une septicémie ou bactériémie maternelle, ou à partir d’un foyer d’endométrite qui joue le rôle de foyer intermédiaire et inocule le placenta. L’envahissement infectieux se fait par la veine ombilicale. C’est rarement le mode de contamination du fœtus [26].
1.2. Voie ascendante :
Elle est beaucoup plus fréquente. Elle est due à l’ensemencement du liquide amniotique par des germes provenant du tractus génital, et peut survenir que les membranes soient rompues ou non [27].
Lorsque les membranes sont intactes, leur altération par l’infection entraîne leur rupture secondaire. Une endométrite peut être responsable d’une infection du liquide amniotique par contiguïté. Quand le fœtus est atteint par voie amniotique, les bactéries peuvent être inhalées et/ou dégluties. La colonisation des voies respiratoires et/ou digestives peut être à l’origine d’une infection centrale (sepsis) ou locale [28].
1.3. Contamination au passage dans la filière génitale :
Une colonisation par inhalation ou ingestion des sécrétions vaginales peut être à l’origine d’une infection centrale. Une fois cette colonisation faite, ce sont les capacités de défense du fœtus et/ou du nouveau né, la charge et la virulence bactériennes, qui vont déterminer le développement ou non d’une infection [29].
Figure 1 : Mode de contamination maternofoetal : a. Muscle utérin; b. muqueuse utérine; c. placenta; d. chorion; e. amnios; f. liquide amniotique; g. col utérin; h. vagin [30].
2. Ontogenèse du système immunitaire embryonnaire et
fœtal :
Les divers moyens de défense de l’immunité se mettent en place progressivement au cours de la vie intra-utérine.
La réponse immune non spécifique (ou immunité naturelle) concerne les cellules phagocytaires (polynucléaires et macrophages, capables de fonctions de bactéricidie et de production de cytokines), les cellules douées de cytotoxicité naturelle (cellules natural killer [NK] et cellules responsables de la cytotoxicité
dépendante d’anticorps) et le système du complément impliqué dans la bactéricidie et l’opsonisation.
La réponse immune spécifique met en jeu les lymphocytes T responsables de l’immunité cellulaire (cytotoxicité directe des cellules infectées, activation des macrophages et des lymphocytes B), les lymphocytes B responsables de l’immunité humorale (production d’anticorps capables de neutralisation et
d’opsonisation). Cette réponse, spécifique de l’antigène, nécessite une «éducation» des lymphocytes T et B. Elle requiert également une cellule capable de présenter l’antigène (cellule monocytaire-dendritique) aux cellules T effectrices.
Les différents effecteurs de l’immunité non spécifique et spécifique se développent progressivement durant la vie intra-utérine. Cependant, ils n’ont pas acquis une maturation complète à la naissance; ceci rend compte de la susceptibilité particulière du nouveau-né et particulièrement du prématuré aux infections bactériennes et virales.
Les cellules souches pluripotentes, à l’origine des différentes lignées hématopoïétiques, sont présentes dans le sac vitellin entre 3, 5 et 8 semaines de développement, où seule une différenciation myélomonocytaire est observée. Le foie fœtal est ensuite le principal organe hématopoïétique (1,5-7,5mois), relayé à partir du troisième trimestre par la moelle osseuse [31]. (Figure 2)
Figure 2 : Principales étapes du développement immunitaire [31].
B. Nouveau-né :
1. L’infection néonatale :
L’infection néonatale est un problème de santé publique mondial. Son incidence est proche de 1 % des naissances dans les pays industriels mais elle est plus élevée dans les pays en voie de développement.
En 1996, les infections survenant dans le premier mois de la vie ont été responsables de cinq millions de morts.
Presque tous les agents pathogènes (bactéries, champignons et virus) peuvent être responsables d’infection chez le nouveau né [32; 33].
2. Immunité néonatale et moyens de défense antibactériens
du nouveau-né :
Le développement des défenses immunitaires chez le nouveau-né est caractérisé par une double immaturité, humorale et cellulaire. Au sang du cordon, les tests de la fonction T sont normaux. En revanche, la production de lymphotoxines, de facteurs inhibiteurs de migration (MIF pour migration inhibitory factor), d’acide Adénosine monophosphorique (AMP) cyclique et la phagocytose sont déficientes [34; 35].
L’immunité humorale est dépendante de l’état immunitaire maternel. En effet, si le foetus est capable de produire des immunoglobulines (Ig) dés la 13 ème semaine à un taux très faible, ses IgG à la naissance sont essentiellement d’origine maternelle, transmises par voie transplacentaire. Leur taux augmente au cours de la grossesse, atteignant un taux de 120 % du taux maternel à terme, grâce à un passage actif en fin de grossesse. A l’inverse, les IgM et les IgA ne traversent pas le placenta, donc la découverte d’IgM dans le sang du cordon témoigne de leur origine foetale. Enfin, le taux de complément est bas, 50 % pour le CH5O chez le nouveau-né à terme.
L’absence d’anticorps spécifiques chez la mère et donc chez le nouveau-né contre un germe pathogène (en particulier le streptocoque B) favorise la survenue d’une infection chez un enfant colonisé, ces anticorps induisant une immunité passive chez le fœtus. Le taux protecteur des anticorps spécifiques est variable selon les sérotypes [36].
L’immunité cellulaire néonatale est potentielle car elle n’a pas encore en mémoire, les réponses aux stimuli antigéniques bactériens qui vont être induits par la colonisation bactérienne, en particulier digestive [32].
C. Bases immunologiques :
L’immunité est la capacité à ne pas payer le « tribut » pathologique de l’infection. Les processus qui permettent de protéger l’individu des infections s’intègrent dans le système immunitaire, qui a la capacité de reconnaître le « soi » du « non-soi » et de contribuer à assurer l’intégrité de l’organisme [37].
1. Analyse de la réponse immune :
1.1. Anticorps :
Les vaccins stimulent la production d’anticorps protecteurs. La mesure du titre de certains anticorps est le moyen le plus utilisé en pratique pour évaluer l’immunisation induite par les vaccins (exemple : anticorps anti-HBs pour la vaccination contre l’hépatite B). Ces anticorps ont la propriété de « reconnaître » certains épitopes de l’agent infectieux et de s’y assembler spécifiquement par leur « site anticorps ». La neutralisation de l’effet pathogène peut s’effectuer de différentes façons : certains anticorps s’associent au complément pour agglutiner et lyser des bactéries, certains vont « armer » des phagocytes ou des lymphocytes et les rendre capables de lyser des cellules infectées par des agents à développement intracellulaire (virus). Les anticorps sont produits par les plasmocytes et lymphocytes B après une succession de réactions cellulaires et tissulaires provoquées par les stimulations antigéniques [38; 39].
1.2. Evénements cellulaires :
Les cellules présentatrices d’antigène (macrophages, cellules dendritiques) captent les protéines antigéniques des bactéries à développement extracellulaire et les dégradent en peptides dans leurs phagolysosomes: certains vont se lier
spécifiquement aux antigènes de classe II du complexe majeur d’histocompatibilité (CMH2). Au contraire, les virus ou bactéries qui « infectent » les cellules phagiques ont leurs peptides constitutifs exprimés associés aux antigènes de classe I du CMH (CMH1).
Les lymphocytes T auxiliaires (Ta) CD4 sont activés soit par des peptides antigéniques associés à des molécules antigène leucocytaire humain (HLA) de classe II, soit par l’interleukine 1 (IL1) produite par les macrophages sensibilisés. Il s’ensuit une production autocrine d’interleukines, notamment d’IL2 et d’interféron gamma qui jouent un rôle important dans la réponse immune.
Les lymphocytes T cytotoxiques (Tc) CD8 reconnaissent les fragments protéiques présentés par les molécules de classe I du complexe majeur d’histocompatibilité (CMH1) : ils possèdent un récepteur (RTL) pour l’antigène; ils sont susceptibles de détruire in vitro comme in vivo des cellules infectées par des virus ou des bactéries à développement intracellulaire. Les lymphocytes CD4 qui sécrètent de l’IL2 et l’interféron gamma stimulent leur réponse aux antigènes viraux et leur potentiel cytolytique.
Les lymphocytes B comportent des immunoglobulines de surface capables de distinguer la conformation des antigènes. Le complexe antigène-immunoglobulines est internalisé par endocytose. Puis, ces lymphocytes vont exprimer à leur surface un peptide (issu de l’antigène) associé au récepteur de classe II du complexe majeur d’histocompatibilité (CMH2). La présence de ces complexes est reconnue par des lymphocytes Ta qui contribuent à la différenciation de ces lymphocytes B en plasmocytes sécrétant des anticorps (sur tout au début immunoglobuline M [IgM] et IgD). Des cellules B à mémoire sont
également produites : elles expriment des récepteurs IgG et IgA très spécifiques permettant une réponse secondaire plus rapide et plus adaptée.
La réponse immunitaire dépend du complexe majeur d’histocompatibilité (CMH) et des caractéristiques génétiques de l’individu : ceci expliquerait la variabilité des réponses obtenues chez différents sujets [40].
1.3. Place respective des principaux mécanismes de défense :
Les anticorps combinés au complément ou les lymphocytes «armés» par les anticorps neutralisent des virus ou détruisent des cellules infectées exprimant à leur surface des peptides d’origine virale. Les cellules T cytotoxiques sont actives sur différentes structures de l’agent infectieux et sont moins sensibles aux variations antigéniques.
Les lymphocytes Ta et les lymphokines mis en jeu au cours du processus de stimulation du système immunitaire régulent la réponse immune.
La connaissance des mécanismes de régulation devrait contribuer à améliorer la réponse à certains vaccins.
1.4. Réponse anamnestique :
La vaccination tire parti de la mémoire immunitaire.
Lors de la première inoculation d’un antigène, la réponse humorale est lente, peu spécifique au début, s’exprimant plutôt par des IgM. Lors d’un nouveau contact, le délai de la réponse se raccourcit, le titre des anticorps augmente: ce sont des IgG de spécificité plus grande.
Chez un sujet neuf, les cellules effectrices, T ou B, sont des cellules à vie courte (quelques jours) dont la population est maximale au bout de 1 semaine pour disparaître en 2 semaines. Le nombre des cellules T à mémoire est maximal
2 à 6 semaines après l’inoculation et ne diminue ensuite que très lentement. Les cellules productrices d’anticorps (IgM puis IgA et IgG) augmentent lentement jusqu’à la sixième semaine puis décroissent. Le nombre des cellules B à mémoire est maximal au bout de 10 à 15 semaines avant de diminuer lentement: certaines sont détectées plus de 1 an et demi après l’inoculation. Ces cellules à mémoire sont le support de la réponse anamnestique.
La présence d’anticorps spécifiques (IgG), l’existence de cellules à mémoire est ce que l’on cherche à obtenir par la vaccination pour anticiper sur le développement de l’infection et protéger le sujet [38; 39].
1.5. Caractéristiques des pathogènes et des immunogènes :
L’expression de l’infection est la résultante de la pathogénicité directe de l’agent infectieux et de son immunogénicité. Un bon vaccin est immunogène sans être pathogène.1.5.1. Pathogénicité des agents infectieux :
Elle est liée à la multiplication des agents infectieux ou à la production d’exotoxines (tétanos, diphtérie), aux propriétés délétères de certains constituants (endotoxine des bacilles à Gram négatif, capsule des pneumocoques …); elle peut être en rapport avec les réactions de l’hôte (dengue hémorragique) [38].
1.5.2. Classification des principaux vaccins :
a. Vaccins inactivés ou inertes :
L’agent bactérien ou viral, est soit entier et seulement inactivé, soit des fractions antigéniques ou sous unités vaccinantes : particules virales déshabitées
pneumocoques ou de méningocoques) ou membranaires (protéines bactériennes ou virales).
b. Vaccins « vivants » atténués :
L’agent infectieux est atténué par différents procédés de culture (BCG, vaccin antipoliomyélitique oral type Sabin), mais il reste capable de se multiplier chez l’hôte naturel où il créera une infection inapparente ou atténuée. Mais la possibilité de réversion à des formes virulentes est possible (exemple du vaccin antipoliomyélitique oral).
c. Avantages et inconvénients respectifs :
Les vaccins atténués sont plus proches de l’immunité naturelle que les vaccins inertes; une dose unique est habituellement suffisante. Mais ils doivent franchir les défenses primaires de l’organisme (barrières muqueuses et sous muqueuses) qui rendent l’immunisation aléatoire. Ils ne sont pas dépourvus de risques infectieux. Des virus naturels peuvent interférer avec le virus vaccinal (interférence entérovirus naturels/vaccin antipoliomyélitique oral rendant incertaine l’immunisation des enfants en pays tropical). En général, les personnes immunodéprimées, ou dont le statut immunitaire est douteux, ne doivent pas recevoir de vaccins vivants, viraux ou bactériens [37].
Les vaccins inactivés sont, en principe, plus surs, exempts de tout risque infectieux. Mais ils nécessitent plusieurs injections pour obtenir une immunisation suffisante qui doit être entretenue par des injections de rappel (vaccin antipoliomyélitique injectable type Salk-Lépine) [4; 38].
d. Adjuvants et conservateurs :
Des adjuvants sont souvent nécessaires pour potentialiser la réaction immunitaire induite par des vaccins inactivés ou sub-unitaires. De nombreux vaccins sont adsorbés sur hydroxyde ou phosphate d’aluminium. Ces adsorbants agiraient en maintenant l’antigène à proximité du site d’injection et en activant les cellules présentatrices favorisant la reconnaissance immune et la production d’interleukines.
Les conservateurs sont utiles pour maintenir la qualité biologique des vaccins et pour les rendre aptes à supporter des variations physiques (par exemple, thermiques) [37].
Tableau I : les principaux vaccins actuellement disponibles selon leur composition et les maladies évitables correspondantes [4].
Composition du vaccin Maladies bactériennes à éviter
Maladies virales à éviter
Vivants atténués -Tuberculose
-Fièvre jaune -Oreillons -Rougeole -Rubéole -Poliomyélite Inactivés entiers -Choléra
-Coqueluche -Grippe -Poliomyélite -Rage -Encéphalite japonaise -Hépatite A Polysaccharides Protéines purifiées -Méningococcie -Pneumococcie -Typhoïde -Tétanos -Diphtérie -Coqueluche -Hépatite B -Influenzae Conjugués (polysaccharides et protéines) -Méningite à Haemophilus influenzae type b -Pneumococcie
D
D
E
E
U
U
X
X
I
I
E
E
M
M
E
E
C
C
H
H
A
A
P
P
I
I
T
T
R
R
E
E
L
L
A
A
V
V
A
A
C
C
C
C
I
I
N
N
A
A
T
T
I
I
O
O
N
N
A
A
U
U
M
M
A
A
R
R
O
O
C
C
A. La vaccination au Maroc :
1. Introduction de la vaccination au Maroc :
Depuis la première loi insérée dans le Bulletin Officiel du 2 décembre 1918, décrets et circulaires se succédés pour instituer vaccins et campagnes de vaccination au Maroc.
Ainsi, le vaccin anti-variolique a été introduit en 1929, le BCG en 1949 et l’anti-diphtérique, l’anti-tétanique et l’anti-coquelucheux en 1963. Entre 1964 et 1967 furent organisées des campagnes de vaccination contre la poliomyélite et 1967 fut l’année du lancement des premières activités de vaccination de masse et de vaccination au niveau de points fixes [41; 42; 43].
L’évaluation en 1980 de ces stratégies vaccinales souligna leur faible efficacité d’où l’adhésion en 1981 au Programme Elargi de Vaccination ou PEV de l’OMS établi dans le cadre du plan quinquennal de développement 1981-1985.
Cependant, l’évaluation en 1986, bien qu’encourageante, a mis en exergue l’insuffisance de la couverture vaccinale nationale fixée, pour les enfants âgés de 1 à 5 ans, à 60 % répartis en 83 % en milieu urbain et 42 % seulement en milieu rural. D’où la restructuration du PEV en PNI ou Programme National d’Immunisation.
Ce PNI a évolué par le lancement en 1995 d’une stratégie nationale d’éradication de la poliomyélite et par l’introduction d’autres vaccins comme l’anti-hépatite B en 1999, la vaccination combinée Rougeole-Rubéole en 2003, année d’introduction aussi dans le calendrier du premier rappel DTCP. Plus récemment a été introduite la vaccination anti-haemophilus influenzae b en 2006 et le deuxième rappel DTCP en 2009 [4].
2. Budget alloué à l’achat des vaccins :
Le Maroc réserve chaque année un budget important pour l’achat des vaccins [44]. 2000 : 38 millions de Dirhams. 2002 : 36 millions de Dirhams. 2003 : 29 millions de Dirhams. 2004 : 31 millions de Dirhams. 2005 : 45 millions de Dirhams. 2006 : 45 millions de Dirhams. 2007 : 66 millions de Dirhams. 2008 : 82 millions de Dirhams.
3. Le calendrier national de vaccination :
Le calendrier vaccinal est élaboré par le comité technique et scientifique des vaccinations (CTSV), groupe de travail permanent du programme national d’immunisation (PNI) de la division de la santé maternelle et infantile (SMI), Direction de population du Ministère de la santé ; qui regroupe des experts de différentes disciplines (infectiologie, pédiatrie, microbiologie, immunologie, épidémiologie...).
D’une manière générale, les recommandations des experts résultent de l’évolution de l’épidémiologie des maladies [45], de l’actualisation des connaissances sur l’efficacité des vaccins, des recommandations émises dans d’autres pays et de la mise sur le marché de nouveaux vaccins.
De plus, elles tiennent compte des orientations générales de l’OMS et de l’UNICEF, en matière d’élimination de certaines maladies notamment de
l’objectif de l’éradication de la poliomyélite dans le monde, et de maintenir une couverture vaccinale optimale [4; 46].
3.1. Présentation du programme nationale d’immunisation
(PNI) :
En 1981, était instauré le Programme Elargie de Vaccination (PEV), qui a été restructuré en 1987, en Programme National d’Immunisation (PNI), la mise en place de l’organisation des journées nationales de vaccination (JNV) a permis chaque année de prendre en charge les enfants et les femmes ayant échappé au programme permanent ou ayant abandonné leur vaccination.
Depuis que ce programme a été mis en place, des résultats satisfaisants ont été obtenus en matière de couverture vaccinale et de réduction de l’incidence des maladies cibles. En effet, le Maroc est le premier pays du Bureau Régional de l’OMS pour la Méditerranée Orientale (région EMRO) qui a validé l’élimination du tétanos néonatal (enquête OMS/UNICEF mars 2002).
Les objectifs du PNI :
Contribuer à la réduction de la mortalité et de la morbidité néonatale et infanto-juvénile ;
Eradiquer et éliminer certaines maladies cibles;
Atteindre et maintenir une couverture vaccinale uniforme supérieure ou égale à 95 % ;
Obtenir, avec les autres pays de la région EMRO/OMS, la certification de l’éradication de la poliomyélite vers l’an 2010;
Maintenir l’élimination du tétanos néonatal (TNN);
Introduire les autres rappels et les nouveaux antigènes dans le calendrier de vaccination;
Impliquer d’avantage le secteur privé dans les activités de vaccination et de surveillance épidémiologique ; (le ministre de la santé et tous les responsables sont en train de préparer un calendrier de vaccination unique prévu pour janvier 2009) [4].
3.2. Calendrier national de vaccination de l’enfant en
vigueur :
Les enfants commencent leur vaccination par groupe d’âge le plus jeune possible, dès qu’ils peuvent développer une réponse immunitaire satisfaisante compte tenu de leur risque de contracter la maladie. De plus, l’administration des vaccins en bas âge facilite l’atteinte des niveaux de couverture vaccinale élevés.
Tous les enfants doivent recevoir le vaccin BCG contre la tuberculose, trois doses du vaccin HB contre l’hépatite B, trois doses et deux rappels de DTC contre la diphtérie, le tétanos et la coqueluche, quatre doses et deux rappels du vaccin VPO contre la poliomyélite, trois doses du vaccin Hib contre l’hémophilus influenzae de type b, une dose de VAR contre la rougeole et le vaccin RR contre la rougeole et la rubéole. Les enfants doivent avoir reçu tous ces vaccins avant l’âge de 6 ans.
Le calendrier de vaccination des enfants recommandé par l’OMS et l'UNICEF, appliqué actuellement au Maroc par le Ministère de la Santé est le suivant:
Tableau II : Calendrier actuellement en vigueur dans le secteur public [4].
Age de l’enfant Antigènes
A la naissance BCG + VPO (Zéro) + HB1
6 semaines DTC1-Hib1 + VPO1 + HB2
10 semaines DTC2-Hib2 + VPO2
14 semaines DTC3-Hib3 + VPO3
9 mois VAR + HB3
18 mois DTC + VPO (premier rappel)
5 ans DTC + VPO (deuxième rappel)
6 ans (rentrée scolaire) RR (vaccin combiné contre la rougeole et la rubéole)
BCG : Bacille de Calmette et Guérin (Vaccin Anti-Tuberculeux). VPO : Vaccin Anti-Poliomyélitique oral.
HB : Vaccin Anti-Hépatite B.
DTC : Vaccin Anti-Diphtérique, Anti-Tétanique et Anti-Coquelucheux. Hib : Vaccin Contre l’Hémophilus influenzae de type b.
VAR : VaccinAnti-Rougeoleux.
RR : Vaccin Anti-Rougeoleux, Anti-Rubéoleux.
3.3. Les autres vaccins fortement recommandés : [4]
Tout professionnel de santé (public ou privé) doit informer et sensibiliser les parents sur l’importance des vaccins suivants et doit faciliter leur prise : Vaccin Hib :
Pour les enfants‚ âgés de moins de 6 mois, trois prises à un mois d’intervalle (2ème, 3ème et 4ème mois) sont nécessaires;
Entre 6 et 12 mois, 2 doses sont nécessaires à un mois d’intervalle ; Au delà de 12 mois, une seule dose suffit.
Vaccin anti-rougeoleux/anti-oreillons/anti-rubéoleux (ROR) :
Il faut tenir compte des vaccins VAR et RR du calendrier. Une 2ème dose est nécessaire pour rattraper les enfants non encore vaccinés et renforcer l’immunité des enfants déjà vaccinés.
Autres rappels :
DTCP : à l’âge de 5 ans ; dTP : tous les 10 ans ;
Les autres vaccins pouvant être indiqués : Vaccin contre le rotavirus ;
Vaccin contre la grippe ;
Vaccin contre le pneumocoque, méningocoque ; Vaccin contre la varicelle ;...
3.4. Vaccination des prématurés :
Les prématurés sont des enfants à haut risque de contracter des infections bactériennes et virales. Ce risque accru résulte d’une part de l’immaturité de leur système immunitaire (d’autant plus grande que la prématurité est importante) et d’autre part d’un défaut relatif de transmission des IgG maternelles.
En effet la vaccination des enfants prématurés doit commencer au même âge chronologique recommandé pour les enfants nés à terme [37; 47; 48; 49].
3.5. Vaccination anti-tétanique (VAT) des femmes en âge de
procréer :
Pour la prévention du tétanos néonatal le PNI a programmé un calendrier vaccinal antitétanique spécifique pour la femme en âge de procréer.
En effet, leur vaccination doit inclure une première dose au premier contact, une deuxième quatre semaines après et une troisième six mois après la deuxième. Des titres protecteurs en anticorps sont obtenus chez 80 à 90 % des femmes à la suite de l’administration de la deuxième dose et chez 95 à 98 % des femmes après la troisième dose. Cette vaccination offre une protection pour environ cinq ans. La quatrième et la cinquième dose prolongent la durée d’immunité d’environ 10 et 20 ans respectivement.
Il faut tenir compte des vaccinations données durant l’enfance si elles sont documentées. Les deux premières doses de DTC sont valides, mais non la troisième car l’intervalle est insuffisant. Ainsi, une femme qui aurait complété sa vaccination de l’enfance commencera sa vaccination VAT au niveau de VAT3 [4; 37].
Tableau III : Calendrier de vaccination anti-tétanique des femmes en âge de procréer préconisée au Maroc [4].
Doses Quand ? Durée de protection
VAT1
Dès que possible chez la femme en âge de procréer ou le plus tôt possible au cours de la grossesse.
0 VAT2 Au moins quatre semaines après le
VAT1 3 ans
VAT3 Au moins six mois après le VAT2 ou au cours d’une grossesse ultérieure 5 ans VAT4 Au moins un an après le VAT3 ou au
cours d’une grossesse ultérieure. 10 ans VAT5 Au moins un an après le VAT4 ou au cours d’une grossesse ultérieure. 20 ans et plus
4. Les maladies cibles des vaccins :
Tout professionnel de santé doit être capable de reconnaître les maladies cibles du Programme National d’Immunisation (PNI).
4.1. La tuberculose :
Caractéristiques de la maladie :La tuberculose est une maladie bactérienne, contagieuse dont l’infection est due au bacille tuberculeux appelé Mycobacterium tuberculosis ou bacille de Koch (BK) (Figure 3), et plus rarement au Mycobacterium bovis.
Cette maladie peut se présenter sous diverses formes: pulmonaires dans deux tiers à trois quarts des cas, et/ou extrapulmonaires, tous les organes pouvant être potentiellement atteints (ganglions, méninges, os, etc.). Seule la forme pulmonaire de la tuberculose est contagieuse, lorsque le BK est présent dans l’expectoration, surtout s’il est détecté dès l’examen microscopique direct.
La transmission, essentiellement interhumaine, se fait par voie aérienne directe. Les gouttelettes de salive et d’expectorations, produites en particulier par la toux d’un malade, servent de support aux BK. Projetées dans l’air expiré, elles restent en suspension sous forme d’aérosol et peuvent être inhalées par d’autres sujets à proximité. Cette contamination par inhalation peut entraîner une primo-infection tuberculeuse qui est souvent asymptomatique, ou entraîne une altération discrète de l’état général avec asthénie et fièvre modérée, la période d’incubation est très lente (4 à 12 semaines). Le risque de développer une maladie grave est plus important chez les nourrissons [50].
Figure 3: Mycobacterium tuberculosis [51].
En 2005, l’OMS a estimé à 8,8 millions le nombre de nouveaux cas de tuberculose dans le monde et à 1,6 millions le nombre de décès dus à cette maladie [52].
Au Maroc la tuberculose et toutes les maladies cibles des vaccins sont à déclaration obligatoire (décret royal n° 554-65 du 17 rabii I 1367 (26 juin 1967) [53]. (ANNEXE I ; ANNEXE II)
4.2. La diphtérie :
Caractéristiques de la maladie :La diphtérie est une maladie bactérienne toxi-infectieuse contagieuse liée à un bacille à Gram positif [54], le Corynebacterium diphtheriae, ou bacille de Klebs-Löffler (Figure 4), affectant essentiellement les voies respiratoires supérieures, et parfois la peau.
L’exotoxine de cette bactérie est responsable d’une angine à fausses membranes qui peuvent obstruer le larynx : c’est le croup. La toxine produite par le bacille diphtérique peut provoquer des paralysies et des myocardites.
L’incubation dure de 2 à 10 jours, et la contagion se fait par les gouttelettes de Flügge et par contact avec les objets souillés par les personnes infectées [37; 55].
Figure 4 : Corynebacterium diphtheriae [51].
La généralisation de la vaccination dans l’enfance a conduit à la quasi disparition de la maladie. Cependant, le germe continu de se propager, comme en témoigne la survenue de cas sporadiques ou d’épidémies telles que celles qui ont sévi et sévissent encore actuellement en ex-Union soviétique, et dans les pays d’Afrique et d’Amérique du Sud [37; 55].
4.3. Le tétanos :
Caractéristiques de la maladie :Le tétanos est une toxi-infection aiguë grave, non contagieuse, souvent mortelle, due à une neurotoxine extrêmement puissante produite par un bacille à Gram positif, le Clostridium tetani : généralement très mobile, anaérobie stricte qui produit une spore terminale, ovale, incolore lui donnant une forme de
Cette bactérie est ubiquitaire, commensale du tube digestif des animaux. Elle persiste dans les déjections animales et dans le sol sous forme sporulée, extrêmement résistante. La source étant tellurique et inépuisable, l’éradication du tétanos est impossible. Elle pénètre dans l’organisme via une plaie cutanée. Quand les conditions d’anaérobiose sont réunies, il y a alors, au site de la plaie, germination des spores et production de toxines. Disséminées dans la circulation générale ces toxines vont interférer avec les neurotransmetteurs et entraîner, après une période d’incubation de 4 à 20 jours, une atteinte neuromusculaire avec contractures, spasmes musculaires et convulsions. La maladie peut se présenter sous trois formes : généralisée (la plus fréquente et la plus grave : 80 % des cas), localisée (région anatomique proche de la plaie) ou céphalique, avec atteinte de nerfs crâniens [37; 56; 57].
Différentes portes d’entrée sont possibles :
Plaies souillées par de la terre, le plus souvent après une blessure, une brûlure, même s’il s’agit d’une plaie minime;
Pratiques traditionnelles : circoncision, excision, percing, scarification, si les mesures d’asepsie ne sont pas respectées;
Contamination ombilicale : c’est la principale cause de tétanos néonatal par section du cordon ombilical par du matériel souillé ou par application ultérieure de pansements à base de terre ou de végétaux souillés;
Contamination lors d’interventions chirurgicales : en particulier la chirurgie digestive, les fractures ouvertes;
Injections intramusculaires ou toute injection avec du matériel souillé; Plaies non traumatiques : ulcères, maux perforants, escarres.
Dans environ 10 % des cas, aucune porte d’entrée n’est retrouvée. Dans ces cas là, la porte d’entrée est considérée comme digestive [57].
Le tétanos ne se transmet pas de personne à personne, et les patients atteints de tétanos ne développent aucune immunité à la suite de l’infection, ainsi la seule prévention possible est la vaccination avec une politique de rappels bien conduite [37].
Figure 5: Clostridium tétani [51].
Bien que nous disposions, depuis 1923, d’une vaccination efficace et sans danger grâce à l’anatoxine tétanique de Ramon, le nombre de cas de tétanos dans le monde reste beaucoup trop élevé [58]. Certes, il s’agit d’une affection rencontrée essentiellement dans les pays en voie de développement où elle touche surtout les enfants, néanmoins elle n’a pas non plus disparu dans les pays à haut niveau de vie où l’accès à la vaccination est simple [59].
La forme néonatale est un tétanos généralisé survenant chez le nouveau-né ; s’il a quasiment disparu des pays industrialisés à couverture vaccinale élevée, le tétanos néonatal reste une cause importante de mortalité dans de nombreux pays d’Asie et d’Afrique.
En 1999, l’Organisation Mondiale de la Santé a dénombré 289 000 cas de TNN/an dont 215 000 décès [60]. (Figure 6)
Figure 6 : Cas de tétanos néonatal dénombrés chaque année dans le monde, [60].
4.4. La coqueluche :
Caractéristiques de la maladie :La coqueluche est une maladie infectieuse bactérienne des voies respiratoires causée par un coccobacille à Gram négatif, Bordetella pertussis (Figure 7) isolé par Bordet et Gengou en 1906. Trois autres espèces peuvent être responsables de coqueluche chez l’homme : B. parapertussis, B. bronchiseptica et plus rarement B. holmesii [61].
La transmission se fait par les gouttelettes émises lors de la toux; la durée d’incubation est de 7 à 10 jours. La période initiale catarrhale débute insidieusement et est la période la plus contagieuse. La toux d’irritation devient progressivement paroxystique et peut durer 2 à 3 mois. Chez les très jeunes enfants, la reprise typique, ou chant du coq, peut ne jamais être présente et les séries de toux peuvent être suivies de périodes d’apnées. Les complications sont
les bronchopneumonies, les vomissements répétés conduisant à une perte de poids, des hypoxies cérébrales menant à des encéphalopathies. Les complications graves et les décès surviennent surtout chez les nourrissons de moins de 6 mois [62; 63].
Figure 7: Bordetella pertussis [51].
La coqueluche est une maladie respiratoire qui demeure de première importance en santé publique. Elle atteint 60 millions de personnes et provoque 400 000 décès par an dans le monde, en particulier dans les pays en voie de développement [64; 65].
L’épidémiologie actuelle : les jeunes adultes contaminent les nourrissons. Malgré une excellente couverture vaccinale, puisqu’elle atteint dans certains pays plus de 90 % des enfants en bas âge, la coqueluche tue encore chaque année, et surtout les enfants trop jeunes pour avoir été complètement vaccinés [66; 67].
Depuis une dizaine d’années, il a clairement été mis en évidence des changements épidémiologiques de la transmission de la maladie. Celle-ci frappe désormais les adolescents et les jeunes adultes antérieurement vaccinés. Ils ont
perdu leur immunité protectrice et redeviennent sensibles à l’infection. Ils constituent un réservoir pour la maladie avec un risque de contamination des enfants les plus jeunes non encore vaccinés ou incomplètement vaccinés (<3mois), chez lesquels la maladie est la plus grave. Ainsi, la coqueluche devient une maladie familiale où le jeune parent atteint, transmet la maladie à son enfant non protégé [68; 69].
4.5. La poliomyélite :
Caractéristiques de la maladie :La poliomyélite (paralysie infantile, maladie de Heine-Medin, poliomyélite antérieure aiguë) est une maladie infectieuse aiguë cosmopolite, endémoépidémique, contagieuse, immunisante, dont la dissémination dans une communauté est très rapide, due aux poliovirus 1, 2 ou 3. Ce sont des virus à acide ribonucléique (ARN) appartenant à la famille des picornavirus (Picornaviridae) et au genre entérovirus [70; 71]. (Figure 8)
L’homme est le seul réservoir naturel de poliovirus. S’agissant d’une infection entérique, la contamination est essentiellement orale. La possibilité d’une contamination aérienne a aussi été évoquée. La transmission généralement féco-orale, manuportée, éventuellement oro-orale est surtout directe, de personne à personne [72; 73]. Comme elle peut être indirecte, par consommation d’eau [74] ou d’aliments contaminés, dans lesquels le virus peut survivre, de quelques jours à plusieurs semaines. Il peut survivre quelques semaines dans l’environnement, notamment dans les eaux contaminées par les déjections humaines. Mais le rôle des baignades dans la contamination semble mineur [75].
Les poliovirus sont présents dans le rhinopharynx et la salive pendant les 2 à 3 premiers jours de l’infection aiguë, puis dans les selles, où ils persistent quelques semaines, plus rarement quelques mois [73].
Environ 95 % des cas de poliomyélite sont asymptomatiques ; ces cas inapparents sont aussi considérés infectieux [76]. La forme abortive (d’intensité mineure) de la poliomyélite survient dans 4 à 8 % des infections et se manifeste par de la fièvre, des maux de tête, des maux de gorge, de l’apathie, de l’anorexie, des vomissements et des douleurs abdominales. L’examen neurologique est normal.
En termes de santé publique, la gravité de la poliomyélite, maladie paralysante, est surtout liée aux séquelles motrices définitives qu’elle entraîne [77], par atteinte des neurones de la corne antérieure de la moelle. Les formes les plus graves atteignent la motilité respiratoire.
Figure 8: Entérovirus [51].
Depuis 1988, l’OMS a fixé un objectif d’éradication de la poliomyélite, initialement prévu pour 2000, puis repoussé à 2005, et actuellement à
2008-2010, en raison notamment des difficultés d’application de la vaccination dans le sous-continent indien et au Nigeria [37].
Le bilan inquiétant de 2005 a été le suivant : 1948 cas enregistrés dans le monde, avec d’importantes flambées épidémiques dans quatre pays, le Nigeria (799 cas), la Somalie (185 cas), le Yémen (478 cas), l’Indonésie (303 cas). En 2006, grâce à la remise en œuvre de nombreuses campagnes de vaccination, la maladie a beaucoup reculé, et il ne reste plus, en principe, que quatre pays endémiques, le Nigeria, l’Inde, le Pakistan, l’Afghanistan [78].
4.6. L’hépatite B :
Caractéristiques de la maladie :L’hépatite B est une maladie virale contagieuse, le virus (VHB) a été identifié en 1967; il appartient au groupe des héparnavirus. La particule complète est composée d’une enveloppe portant l’antigène majeur de surface (Ag HBs), d’une nucléocapside centrale ou «core» portant les spécificités antigéniques HBc et HBe, et d’un génome a ADN. (Figure 9)
L’Ag HBs a été retrouvé dans toutes les sécrétions et excrétions du corps mais seuls le sang, la salive, le sperme et les sécrétions vaginales transmettent le virus et cette présence explique les principaux modes de transmission.
La durée d’incubation va de 45 à 180 jours. Le début de la maladie est généralement insidieux avec anorexie, nausées, vomissements, douleurs abdominales, parfois arthralgies et rash, conduisant progressivement à l’apparition d’un ictère cytolytique. L’atteinte hépatique dure quelques semaines à quelques mois.
La gravité de la maladie va de la forme asymptomatique (détectable seulement par les tests hépatiques) à la forme fulminante avec nécrose hépatique aiguë, syndrome hémorragique sévère entraînant souvent la mort [5].
Figure 9 : Virus de l’hépatite B [51].
Le VHB reste un problème de santé mondiale avec deux milliards de personnes exposées et 350 millions de porteurs-transmetteurs de l’antigène de surface (Ag HBs), et 2 millions de morts par an, avec un taux de prévalence élevé en Afrique sub-saharienne [79; 80]. (Tableau IV)
Tableau IV: Estimation du taux de prévalence du portage de l’Ag HBs selon le continent de naissance [79; 80]. % Europe Afrique du nord Moyen orient Afrique sub-saharienne Asie-Pacifique
Amerique (nord sud)
0.58 0.36 1.61 3.75 1.36 0.22 Source : Institut de veille sanitaire, janvier 2005 [79; 80].
4.7. L’Haemophilus influenzae de type b :
Caractéristiques de la maladie :L’Haemophilus influenzae de type b (Hib) est un petit bacille, très polymorphe, encapsulé, immobile, non sporulé [81]. (Figure 10)
Hib est la cause principale des méningites purulentes de l’enfant au cours des cinq premières années de vie, il est aussi responsable des épiglottites, des bactériémies, des cellulites, des arthrites, des pneumopathies et des éthmoïdites.
Les bactéries Hib se transmettent d’un enfant à un autre par les gouttes de salive expulsées lorsqu’un enfant infecté tousse ou éternue. Hib se propage également quand les enfants partagent des jouets et autres objets qu’ils ont mis à la bouche. La transmission est accrue quand de nombreux enfants passent ensemble des périodes prolongées, dans des environnements tels que les garderies ou les crèches [82].
L’introduction du vaccin Hib dans le calendrier vaccinal, a pour but de prévenir les redoutables formes invasives, tout particulièrement les infections méningées. En revanche, il permet de diminuer le portage pharyngé chez les vaccinés et, donc, de diminuer la circulation de Haemophilus inluenzae b dans la population [5; 37].
Au niveau mondial, 300 000 à 500 000 enfants meurent chaque année de ces pathologies à Haemophilus influenzae type b (Hib) [82].
4.8. La rougeole :
Caractéristiques de la maladie :La rougeole est une maladie virale fortement contagieuse, Le virus appartient à la famille des Paramyxoviridae, sous-famille des Paramyxovirinae, au genre Morbillivirus, dont il est le seul pathogène pour l’homme [83]. (Figure 11)
La transmission de la maladie d’un sujet à l’autre se fait essentiellement par les gouttelettes salivaires ou sécrétions respiratoires, mais le virus peut également se propager sous forme d’aérosol, la contagion est maximale durant le prodrome de la maladie [84].
L’incubation dure de 10 à 12 jours depuis le contage jusqu’aux prodromes. L’intervalle entre contage et éruption dure en moyenne 14 jours (entre 7 et 18). La phase prodromique dure 2 à 4 jours et est caractérisée par de la fièvre qui augmente par paliers avec des pics à 39 ou 40°C. Elle est suivie de toux et de catarrhe oculonasal. Le signe caractéristique de Koplick doit être recherché dans la bouche : c’est un semis de petites taches blanc bleuâtre, localisées surtout sur la face interne des joues. Après trois ou quatre jours survient l’éruption maculopapuleuse qui débute à la racine des cheveux, puis gagne tout le visage et le haut du cou, se généralise en 3 ou 4 jours et dure 3 ou 4 jours. Une fine desquamation se produit enfin sur les parties les plus touchées. L’éruption disparaît dans le même ordre qu’elle est apparue, depuis la tête jusqu’aux extrémités. La convalescence est souvent associée à une asthénie et à une
défaillance immunitaire transitoire [85]. La rougeole se transmet de 4 jours avant à 4 jours après l’installation de l’éruption [86; 87].
La rougeole se complique dans 30 % des cas, et les complications surviennent surtout chez les enfants de moins de 5 ans et les adultes de plus de 20 ans. Les plus fréquentes sont la diarrhée, les otites moyennes (7 à 9 %) et les pneumonies (1 à 6 %) qu’elles soient virales ou liées à une surinfection et qui sont la cause de décès la plus fréquente (60 %). Les complications neurologiques : encéphalites, et la redoutable panencéphalite sclérosante subaiguë (PESS) qui survient en moyenne 8 ans après l’épisode aigu, sont rares [88].
Figure 11 : Morbillivirus [51].
La rougeole demeure l’un des grands fléaux infectieux mondiaux encore responsable chaque année, d’après les estimations de l’OMS, d’environ un demi-million de décès d’enfants [37].
En 2000, elle était cause de 39,9 millions de cas, avec 800 000 morts [89]. C’est la principale cause, 50 à 60 %, des 1,6 million de morts attribuables aux maladies de l’enfant que l’on peut prévenir par vaccination, la cinquième
cause de décès des enfants de moins de 5 ans. Les pays en développement payent le plus lourd tribut à cette maladie : 70 % des cas et 84 % des morts par rougeole dans le monde se produisent en Afrique et Asie du Sud-Est. La rougeole était mortelle dans ces pays pour 1 à 5 % des cas, pouvant aller de 10 à 30 %, surtout en cas d’hypovitaminose A [90].
4.9. La rubéole :
Caractéristiques de la maladie :La rubéole et une maladie virale bénigne de l’enfance, Le virus a été isolé en 1962. Ils s’agit d’un virus à acide rhibonuclique (ARN) de 58 nm, appartenant à la famille Togaviridae, genre Rubivirus [91]. (Figure 12)
La rubéole est extrêmement grave pour l’embryon quand elle atteint la femme enceinte. Depuis 1984, l’élimination de la rubéole congénitale fait partie des objectifs de l’OMS.
La transmission se fait par contact direct (porte d’entrée nasopharyngée). La période d’incubation est de 14 à 21 jours. Le sujet est contagieux une semaine avant et une semaine après l’éruption.
L’incidence réelle de la rubéole est mal connue, compte tenu de la discrétion des symptômes de la maladie. Environ 25 à 50 % des formes sont asymptomatiques. La rubéole atteint le plus souvent les enfants âgés de 4 à 9 ans. Quand les signes cliniques existent, il peut s’agir d’une éruption érythémateuse transitoire avec adénopathies, conjonctivite ou arthrite. Mais le vrai problème est celui des infections rubéoleuses diagnostiquées chez les femmes enceintes aboutissant à des rubéoles congénitales et des interruptions thérapeutiques de grossesse. L’embryopathie rubéoleuse associe cardiopathie (80 % des cas), atteinte oculaire (50 % des cas), le plus souvent sous forme de
cataracte, et enfin de surdité. La rubéole congénitale peut également être découverte au cours des cinq premières années de vie, sous forme d’une surdité, une atteinte neuropsychique ou une pneumopathie [5; 92; 93].
T
T
R
R
O
O
I
I
S
S
I
I
E
E
M
M
E
E
C
C
H
H
A
A
P
P
I
I
T
T
R
R
E
E
G
G
E
E
N
N
E
E
R
R
A
A
L
L
I
I
T
T
E
E
S
S
S
S
U
U
R
R
L
L
E
E
S
S
V
V
A
A
C
C
C
C
I
I
N
N
S
S
A. Modalités pratiques de vaccinations :
1. Les associations vaccinales :
De nombreuses vaccinations peuvent être associées, ce qui limite le nombre d’injections et de séances vaccinales par individu sans nuire à l’efficacité respective des antigènes vaccinaux.
On peut avoir recours à deux types d’association :
les vaccinations simultanées qui sont administrées en deux voies ou sites différents ;
la vaccination combinée où différents vaccins sont mélangés dans la même seringue (soit au moment de la fabrication, soit extemporanément par le vaccinateur) et administrés en une seule injection [94; 95].
Les associations occasionnelles :
Elles sont utilisées en cas de retard dans l’exécution du calendrier ou de risque particulier, et les vaccins sont injectés le même jour dans des sites séparés : le vaccin contre la rougeole, les oreillons et la rubéole, d’une part, et les vaccins D, T, coqueluche, poliomyélite inactivé, Hib et hépatite B, d’autre part ; les vaccins D, T, coqueluche, poliomyélite inactivé, Hib et hépatite B, d’une part, et le vaccin heptavalent pneumococcique conjugué, d’autre part ;
le vaccin BCG peut être administré le même jour que n’importe quel autre vaccin [37].
2. Intervalles et rattrapage :
Un intervalle minimum de 1 mois doit être respecté entre deux doses itératives d’un même vaccin pour permettre une réponse immunitaire correcte. En revanche, un retard n’implique pas de recommencer la série vaccinale au départ, mais simplement de la compléter là où elle a été interrompue [96; 97].
L’inconvénient d’allonger les délais entre deux doses est de retarder la protection complète du vacciné.
Cette notion s’appuie sur l’existence d’une mémoire immunitaire qui permet à l’organisme, dans la plupart des cas, de répondre rapidement à une dose de rappel, même si la dose précédente est très éloignée dans le temps.
Un problème fréquemment rencontré est celui des enfants dont le statut vaccinal est incertain ou inconnu (immigration, adoption internationale, etc.). Il n’y a pas d’inconvénient à administrer un vaccin rougeole-oreillons-rubéole, Hib, hépatite B ou polio à une personne éventuellement déjà immune. Pour la vaccination DTC, il peut être intéressant, en cas de doute sur la réalité d’une série vaccinale antérieure, d’administrer une première dose de vaccin et de titrer ensuite, un mois plus tard, les anticorps tétaniques. Si la réponse après cette dose unique est faible, inférieure à 1 UI/ml, l’enfant n’a probablement jamais été vacciné et il faut compléter le schéma vaccinal. Si la réponse en antitoxine tétanique est élevée, supérieure à 1 UI/ml, de type anamnestique, l’enfant a sûrement été vacciné auparavant, et son schéma vaccinal peut être considéré comme complet [37; 98].
3. Voies d’administration des vaccins :
a. Voie parentérale :
La majorité des vaccins sont inoculés par voie parentérale, intramusculaire (deltoïde ou fesse) ou sous-cutanée (région sous épineuse ou deltoïde). La voie intradermique (injection, scarification, inoculation percutanée) produit une stimulation immunitaire intense mais la dose de vaccin inoculée est difficile à quantifier.
b. Voie muqueuse :
La voie muqueuse serait, en principe, la voie la plus appropriée pour les vaccins vivants atténués des infections des voies respiratoires ou digestives (vaccin antipoliomyélitique). Mais les défenses locales peuvent s’opposer à la pénétration du vaccin: on envisage alors l’utilisation de «vecteurs» pour introduire les antigènes vaccinants (salmonelle non pathogène pour une immunisation digestive) [38].
c. Mise en garde : ne pas injecter de vaccin par voie
intravasculaire !
Précautions particulières : chez les sujets thrombocytopéniques ou hémophiles ou les personnes sous anticoagulants, il est recommandé d’administrer le vaccin par voie sous-cutanée dans la mesure où l’injection intramusculaire peut provoquer des saignements. Une pression locale directe doit être exercée pendant au moins deux minutes [37].
![Figure 2 : Principales étapes du développement immunitaire [31].](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/14.892.179.714.114.449/figure-principales-étapes-développement-immunitaire.webp)
![Tableau I : les principaux vaccins actuellement disponibles selon leur composition et les maladies évitables correspondantes [4]](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/22.892.96.791.172.734/tableau-principaux-actuellement-disponibles-composition-maladies-évitables-correspondantes.webp)
![Tableau II : Calendrier actuellement en vigueur dans le secteur public [4].](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/28.892.96.792.156.570/tableau-ii-calendrier-actuellement-vigueur-secteur-public.webp)
![Tableau III : Calendrier de vaccination anti-tétanique des femmes en âge de procréer préconisée au Maroc [4]](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/30.892.122.773.775.1011/tableau-calendrier-vaccination-tétanique-femmes-procréer-préconisée-maroc.webp)
![Figure 3: Mycobacterium tuberculosis [51].](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/32.892.291.603.103.347/figure-mycobacterium-tuberculosis.webp)
![Figure 4 : Corynebacterium diphtheriae [51].](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/33.892.271.623.214.460/figure-corynebacterium-diphtheriae.webp)
![Figure 5: Clostridium tétani [51].](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/35.892.172.726.287.507/figure-clostridium-tétani.webp)
![Figure 6 : Cas de tétanos néonatal dénombrés chaque année dans le monde, [60]](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/36.892.153.726.107.401/figure-cas-tétanos-néonatal-dénombrés-année-monde.webp)
![Figure 7: Bordetella pertussis [51].](https://thumb-eu.123doks.com/thumbv2/123doknet/14437557.708688/37.892.201.692.250.501/figure-bordetella-pertussis.webp)