31
UNIVERSITE MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH
1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI
2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI
ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général : Mr. Mohamed KARRA
1- ENSEIGNANTS-CHERCHEURS MEDECINS
ET
PHARMACIENS
PROFESSEURS :
Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. CHAHED OUAZZANI Houria Gastro-Entérologie Pr. LACHKAR Hassan Médecine Interne Pr. YAHYAOUI Mohamed Neurologie
Décembre 1988
Pr. BENHAMAMOUCH Mohamed Najib Chirurgie Pédiatrique Pr. DAFIRI Rachida Radiologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. CHAD Bouziane Pathologie Chirurgicale Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique Pr. MANSOURI Fatima Anatomie-Pathologique Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AL HAMANY Zaîtounia Anatomie-Pathologique
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale Pr. BENSOUDA Yahia Pharmacie galénique Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique Pr. CHABRAOUI Layachi Biochimie et Chimie Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV
Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir du CEDOC
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale V.D Aff. Acad. et Estud Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. BOUJIDA Mohamed Najib Radiologie
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie Pr. CHRAIBI Chafiq Gynécologie Obstétrique Pr. DEHAYNI Mohamed* Gynécologie Obstétrique Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie Pr. GHAFIR Driss* Médecine Interne Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie Pr. BEN RAIS Nozha Biophysique Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Doyen de la FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique Pr. HADRI Larbi* Médecine Interne
Pr. JELTHI Ahmed Anatomie Pathologique Pr. MAHFOUD Mustapha Traumatologie – Orthopédie Pr. RHRAB Brahim Gynécologie –Obstétrique Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique Pr. BELAIDI Halima Neurologie
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie Pr. CHAMI Ilham Radiologie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie Pr. JALIL Abdelouahed Chirurgie Générale Pr. LAKHDAR Amina Gynécologie Obstétrique Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique Pr. BARGACH Samir Gynécologie Obstétrique Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie - Directeur HMI Med V
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie Pr. OUAZZANI CHAHDI Bahia Ophtalmologie Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie Pr. ERREIMI Naima Pédiatrie Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation Pr. KADDOURI Noureddine Chirurgie Pédiatrique Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. AFIFI RAJAA Gastro-Entérologie
Pr. BENOMAR ALI Neurologie – Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale Pr. ER RIHANI Hassan Oncologie Médicale Pr. BENKIRANE Majid* Hématologie
Pr. KHATOURI ALI* Cardiologie
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie- Dir. Hop. Av. Marr.
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Inspecteur du SSM
Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie Pr. BENAMR Said Chirurgie Générale Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie Directeur Hop. Chekikh Zaied
Pr. EL KHADER Khalid Urologie Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. MAHASSINI Najat Anatomie Pathologique
Pr. MDAGHRI ALAOUI Asmae Pédiatrie Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie Pr. BENELBARHDADI Imane Gastro-Entérologie Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie Pr. BEZZA Ahmed* Rhumatologie Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie Directeur. Hop.d’Enfants
Pr. GAZZAZ Miloudi* Neuro-Chirurgie Pr. HRORA Abdelmalek Chirurgie Générale Pr. KABBAJ Saad Anesthésie-Réanimation Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale Pr. MIKDAME Mohammed* Hématologie Clinique Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAOURI Mohamed * Dermatologie
Pr. HAJJI Zakia Ophtalmologie Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie Pr. RACHID Khalid * Traumatologie Orthopédie Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie Pr. CHERRADI Nadia Anatomie Pathologique Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie Pr. HACHI Hafid Chirurgie Générale Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique Pr. TIJAMI Fouad Chirurgie Générale Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie Pr. AMAZOUZI Abdellah Ophtalmologie Pr. AZIZ Noureddine* Radiologie Pr. BAHIRI Rachid Rhumatologie Pr. BARKAT Amina Pédiatrie Pr. BENYASS Aatif Cardiologie Pr. BERNOUSSI Abdelghani Ophtalmologie Pr. DOUDOUH Abderrahim* Biophysique
Pr. HESSISSEN Leila Pédiatrie Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005
Pr. CHANI Mohamed Anesthésie Réanimation
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie Pr. AKJOUJ Said* Radiologie Pr. BELMEKKI Abdelkader* Hématologie Pr. BENCHEIKH Razika O.R.L Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation Pr. HARMOUCHE Hicham Médecine Interne Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie Pr. KARMOUNI Tariq Urologie Pr. KILI Amina Pédiatrie Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie Pr. OUANASS Abderrazzak Psychiatrie Pr. SAFI Soumaya* Endocrinologie Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale Pr. ACHACHI Leila Pneumo phtisiologie Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire Pr. AMHAJJI Larbi* Traumatologie orthopédie Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation Directeur ERSM
Pr. BENZIANE Hamid* Pharmacie clinique Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHARKAOUI Naoual* Pharmacie galénique Pr. EHIRCHIOU Abdelkader* Chirurgie générale Pr. ELABSI Mohamed Chirurgie générale Pr. EL MOUSSAOUI Rachid Anesthésie réanimation Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale Pr. ISMAILI Nadia Dermatologie Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie Pr. MASRAR Azlarab Hématologie biologique
Pr. MRABET Mustapha* Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie Pr. RABHI Monsef* Médecine interne Pr. RADOUANE Bouchaib* Radiologie Pr. SEFFAR Myriame Microbiologie Pr. SEKHSOKH Yessine* Microbiologie Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2007
Pr. DOUHAL ABDERRAHMAN Ophtalmologie
Décembre 2008
Pr ZOUBIR Mohamed* Anesthésie Réanimation Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AMINE Bouchra Rhumatologie Pr. ARKHA Yassir Neuro-chirurgie
Pr. BELYAMANI Lahcen* Anesthésie Réanimation Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie Pr. BOUI Mohammed* Dermatologie Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique Pr. CHAKOUR Mohammed * Hématologie biologique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. L’KASSIMI Hachemi* Microbiologie Directeur Hôpital My Ismail
Pr. LAMSAOURI Jamal* Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique Pr. MSSROURI Rahal Chirurgie Générale Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
PROFESSEURS AGREGES :
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation Pr. AMEZIANE Taoufiq* Médecine interne Pr. BELAGUID Abdelaziz Physiologie Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique Pr. DAMI Abdellah* Biochimie chimie Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie Pr. LAMALMI Najat Anatomie pathologique Pr. MOSADIK Ahlam Anesthésie Réanimation Pr. MOUJAHID Mountassir* Chirurgie générale Pr. NAZIH Mouna* Hématologie biologique Pr. ZOUAIDIA Fouad Anatomie pathologique
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique Pr. ABOUELALAA Khalil* Anesthésie Réanimation Pr. BELAIZI Mohamed* Psychiatrie
Pr. BENCHEBBA Driss* Traumatologie Orthopédique Pr. DRISSI Mohamed* Anesthésie Réanimation Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne Pr. EL OUAZZANI Hanane* Pneumophtisiologie Pr. ER-RAJI Mounir Chirurgie Pédiatrique Pr. JAHID Ahmed Anatomie pathologique Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie Pr. AMOUR Mourad Anesthésie Réanimation Pr. AWAB Almahdi Anesthésie Réanimation Pr. BELAYACHI Jihane Réanimation Médicale Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation Pr. BENCHEKROUN Laila Biochimie-Chimie Pr. BENKIRANE Souad Hématologie biologique Pr. BENNANA Ahmed* Informatique Pharmaceutique 0.
Pr. BENSGHIR Mustapha* Anesthésie Réanimation Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie Pr. EL GUERROUJ Hasnae Médecine Nucléaire Pr. EL HARTI Jaouad Chimie Thérapeutique Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation Pr. EN-NOUALI Hassane* Radiologie
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie Pr. LATIB Rachida Radiologie Pr. MAAMAR Mouna Fatima Zahra Médecine Interne Pr. MEDDAH Bouchra Pharmacologie Pr. MELHAOUI Adyl Neuro-chirurgie Pr. MRABTI Hind Oncologie Médicale Pr. NEJJARI Rachid Pharmacognosie Pr. OUBEJJA Houda Chirurgie Pédiatrique Pr. OUKABLI Mohamed* Anatomie Pathologique Pr. RAHALI Younes Pharmacie Galénique Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie Pr. REDA Karim* Ophtalmologie Pr. REGRAGUI Wafa Neurologie Pr. RKAIN Hanan Physiologie Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique Pr. ROUIBAA Fedoua* Gastro-Entérologie Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale Pr. GHOUNDALE Omar* Urologie
Pr. ZYANI Mohammad* Médecine Interne
MARS 2014
ACHIR ABDELLAH Chirurgie Thoracique BENCHAKROUN MOHAMMED Traumatologie- Orthopédie BOUCHIKH MOHAMMED Chirurgie Thoracique EL KABBAJ DRISS Néphrologie
EL MACHTANI IDRISSI SAMIRA Biochimie-Chimie
HARDIZI HOUYAM Histologie- Embryologie-Cytogénétique HASSANI AMALE Pédiatrie
HERRAK LAILA Pneumologie JANANE ABDELLA TIF Urologie
JEAIDI ANASS Hématologie Biologique KOUACH JAOUAD Génécologie-Obstétrique LEMNOUER ABDELHAY Microbiologie
MAKRAM SANAA Pharmacologie OULAHYANE RACHID Chirurgie Pédiatrique RHISSASSI MOHAMED JMFAR CCV
SABRY MOHAMED Cardiologie SEKKACH YOUSSEF Médecine Interne
TAZL MOUKBA. :LA.KLA. Génécologie-Obstétrique
*
Enseignants MilitairesDECEMBRE 2014
ABILKACEM RACHID' Pédiatrie
AIT BOUGHIMA FADILA Médecine Légale
BEKKALI HICHAM Anesthésie-Réanimation BENAZZOU SALMA Chirurgie Maxillo-Faciale BOUABDELLAH MOUNYA Biochimie-Chimie
BOUCHRIK MOURAD Parasitologie DERRAJI SOUFIANE Pharmacie Clinique DOBLALI TAOUFIK Microbiologie EL AYOUBI EL IDRISSI ALI Anatomie
EL GHADBANE ABDEDAIM HATIM Anesthésie-Réanimation EL MARJANY MOHAMMED Radiothérapie
FE]JAL NAWFAL Chirurgie Réparatrice et Plastique JAHIDI MOHAMED O.R.L
LAKHAL ZOUHAIR Cardiologie
OUDGHIRI NEZHA Anesthésie-Réanimation Rami Mohamed Chirurgie Pédiatrique SABIR MARIA Psychiatrie
AOUT 2015
Meziane meryem Dermatologie Tahri latifa Rhumatologie
JANVIER 2016
BENKABBOU AMINE Chirurgie Générale EL ASRI FOUAD Ophtalmologie ERRAMI NOUREDDINE O.R.L
NITASSI SOPHIA O.R.L
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. BOURJOUANE Mohamed Microbiologie
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique Pr. EL GUESSABI Lahcen Pharmacognosie Pr. ETTAIB Abdelkader Zootechnie Pr. FAOUZI Moulay El Abbes Pharmacologie Pr. HAMZAOUI Laila Biophysique Pr. HMAMOUCHI Mohamed Chimie Organique Pr. IBRAHIMI Azeddine Biologie moléculaire Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie Pr. ZAHIDI Ahmed Pharmacologie Pr. ZELLOU Amina Chimie Organique
Mise à jour le 14/12/2016 par le
A Allah
Tout puissant
Qui m’a inspiré
Qui m’a guidé dans le bon chemin
Je vous dois ce que je suis devenu
Louanges et remerciements
Pour votre clémence et miséricorde
A ma chère mère EL Hassania M’HARRECH
C’est pour moi un jour d’une grande importance, car je sais que tu es à la fois fière et
heureuse de voir le fruit de ton éducation et de tes efforts inlassables se concrétiser.
Aucun mot, aussi expressif qu’il soit, ne saurait remercier à sa justice valeur, l’être qui a
consacré sa vie à parfaire mon éducation avec un dévouement inégal.
C’est grâce à ALLAH puis à toi que je suis devenue ce que je suis aujourd’hui.
Accepte ce travail comme le témoignage de ma reconnaissance, ma gratitude et mon profond
amour.
Puisse ALLAH m’aider pour rendre un peu soit-il de ce que tu m’as donné.
Puisse ALLAH t’accorder santé, bonheur et longue vie.
A mon cher père Mohammed HDIOUD
Tu m’as toujours incité à étudier et à aller de l’avant. Grâce à ta bienveillance, à ton
encouragement et à ta générosité, j’ai pu terminer mes études dans l’enthousiasme.
Toutes les encres du monde ne me suffisent pour t’exprimer mon immense gratitude.
Que ce travail puisse être le résultat de tes efforts et de tes sacrifices.
Puisse le bon dieu te protéger et t’accorder longue vie.
A mes très chers sœurs et mon frère Saad,
Vous avoir tous à mes côtés est le baume de mon existence.
Je vous dédie ce travail en témoignage de l’amour et de la gratitude pour l’épaule
inconditionnelle que vous représentez pour moi.
Je ne saurais exprimer mes sentiments fraternels et chers que j’éprouve pour vous
tous.
Que dieu vous protège et consolide les liens sacrés qui nous unissent.
A ma grande famille
Vous avez été une bouffé d’oxygène. Merci pour votre soutien moral, merci pour
vos soirées et surtout merci pour vos douaas.
A toute personne qui a contribué de près ou de loin à la
réalisation de ce travail, spécialement à notre chère Soumiya
LAALOU
Je vous dédie ce travail en témoignage de mon affection, ma reconnaissance et
mon grand attachement.
A
NOTRE MAITRE ET Président DE THESE
Madame Le Professeur S.BENKIRANE
Professeur d’Hématologie Biologique
Nous vous remercions vivement de l’honneur que vous nous faites en acceptant
de siéger parmi notre jury de thèse.
Nous sommes très reconnaissants de la spontanéité avec laquelle vous avez
accepté de juger notre travail.
Qu’il me soit permis, madame, de vous exprimer ma profonde gratitude et mes
sincères remerciements.
À
NOTRE MAITRE ET Rapporteur DE THESE
Monsieur le Professeur A.MASRAR
Professeur d’Hématologie Biologique
Permettez-nous de vous remercier pour l’honneur que vous nous avez fait en
acceptant de présider ce jury, malgré vos multiples occupations.
Nous avons eu la chance et le privilège d’être parmi vos étudiants, votre
simplicité, votre rigueur scientifique, votre souci de transmettre vos immenses
connaissances aux autres font de vous un exemple à suivre.
Que ce travail soit un témoignage de notre profonde gratitude.
A
NOTRE MAITRE ET JUGE DE THESE
Madame Le Professeur M.NAZIH
Professeur d’Hématologie Biologique
Je vous remercie, madame, de m’avoir fait l’honneur d’accepter de faire partie de
mon jury de thèse.
Qu’il me soit permis, madame, de vous exprimer toute ma reconnaissance, mon
respect et mon estime.
A
NOTRE MAITRE ET JUGE DE THESE
Monsieur Le Professeur A. DAMI
Professeur de Biochimie
Nous avons été touchés par la bienveillance et la cordialité de votre accueil.
Nous sommes très sensibles à l’honneur que vous nous faites en acceptant de
juger notre travail.
LISTE DES ABREVIATIONS
FXIII : Facteur de coagulation sanguine XIII FXIIID : Déficit en facteur XIII
RBD : Trouble de saignement rare RPL : Perte de grossesse récurrente CNS : Système nerveux central FFP : Plasma congelé frais rFXIII : FXIII recombinant BT : Temps de saignement PT : temps de prothrombine
APTT : Temps de thromboplastine partielle activée CaCl 2 : Chlorure de calcium
MCA : Monochloroacétique
ISTH : Société internationale de thrombose et d'hémostase IgG : Immunoglobuline G
ELISA : Dosage immuno-enzymatique SDS : Dodécylsulfate de sodium
PAGE : Electrophorèse sur gel de polyacrylamide PND : Diagnostic prénatal
PPP : Plasma pauvre en plaquettes FXIIIa : FXIII activé
NADPH : Nicotinamide adénine dinucléotide phosphate hydrogène NADP : Nicotinamide adénine dinucléotide phosphate
ICH : Hémorragie intracrânienne Le MCA : Acide monochloroacétique PPP : Plasma pauvre en plaquettes PT : Temps de prothrombine
PTT : Temps de thromboplastine partielle Dakota du Sud : Déviation standard
UCB : Saignement du cordon ombilical; vWD, maladie de von Willebrand IMC : Indice de masse corporelle
FXIII-A : FXIII A sous-unité
FXIII-B : Sous-unité FXIII B
tFXIII-B : Sous-unité FXIII-B totale
α 2 –PI : Inhibiteur de la α 2 -plasmine
APC : Protéine C activée
FVa : Facteur V activé
FV Leiden : Mutation du facteur V Leiden
FXIII-A ' : Facteur XIII A activé par protéolyse
PDP : Plasma appauvri en plaquettes
PPACK : D-phénylalanyl-L-prolyl-L-arginine chlorométhylcétone
rhTM : Thrombomoduline humaine recombinante
T ½ : Temps requis pour la moitié de l'activation maximale de la formation du
dimère de la chaîne FXIII ou de la fibrine gamma
Tafi : Inhibiteur de fibrinolyse activable par la thrombine
TF : Facteur tissulaire
TM : Thrombomoduline.
ANOVA : Analyse de la variance
AP-FXIII : Peptide d'activation du facteur XIII
GOUJAT : Maladie de l'artère coronaire
CS : Sclérose coronaire
FXIII-A 2 B 2 : Facteur XIII plasmatique
MI : Infarctus du myocarde
HWE : Équilibre de Hardy-Weinberg
CAA : Angiopathie amyloide cérèbrale OU : Rapport de cotes
CI : Intervalle de confiance
PB : Basé sur la population
NOS : Échelle de Newcastle-Ottawa
PDI : Protéine disulfure isomérase
I-FXIII : FXIII traité à l'iodoacétamide
PRP : plasma riche en plaquettes
Abz : acide ortho-aminobenzoïque
GOUJAT : La cadavérine
DNP : 2,4-dinitrophényle
tBu : Ester tert-butylique
Trt : Trityl
Fmoc : Fluorénylméthyloxycarbonyle
DMF : Diméthylformamide
TBTU : Tétrafluoroborate de O- (benzotriazol-1-yl) -N, N, N ', N'-tétraméthyluronium
HOBt : Hydroxybenzotriazole
DIPEA : N, N-diisopropyléthylamine
ClTrt : Chlorotrityl
HAUT : Hexafluorophosphate de 2- (7-aza-1H-benzotriazole-1-yl) -1, 1, 3,3-tétraméthyluronium
Boc : Tert-butyloxycarbonyle
TFA : L’acide trifluoroacétique
CARTE : Michael Acceptor Pharmacophore
GPRP : Gly- L -Pro- L -Arg- L -Pro
PPACK : L -Phe- L -Pro- L -Ala chlorométhylcétone
Fbg : Fibrinogène Fbn : Fibrine
AP : Peptide d'activation de FXIII-A rFXIII-A : FXIII-A recombinant
rFXIII-B : FXIII-B recombinant.
ACE : Enzymedeconversiondel’angiotensine;
COAT :Activéparlecollagèneetlathrombine FV : Facteur V
FVa : FV activé FXa : facteur X activé
PA : Activateur du plasminogène; PAI : Inhibiteur de PA
TAFI : Inhibiteur de fibrinolyse activable par la thrombine; TAFIa : TAFI activé;
TG2 : Transglutaminase tissulaire 2
LISTE DES FIGURES
Figure 1: Activation de l'hétérotétramère plasmatique du facteur XIII. ...7 Figure 2: Facteur XIII A: gène ( F13A ) et structure protéique...8 Figure 3: Polypeptide de fibrinogène. ...9 Figure 4: La réticulation des polypeptides de fibrinogène. ...9 Figure 5: Facteur XIIIB: gène (F13B ) et structure protéique. ... 11 Figure 6: Structure du sous-unité A du facteur XIII et localisation des polymorphismes de codage communs ... 12 Figure 7: Représentation schématique de la molécule de fibrinogène. ... 15 Figure 8: Réaction de réticulation catalysée par le facteur XIII activé. ... 17 Figure 9: Effet du polymorphisme du facteur XIII Val34Leu sur la structure de la fibrine réticulée. 27 Figure 10: Diagramme de mutations sélectionnées dans le gène de la sous-unité a du facteur XIII. . 41 Figure 11: Clivage de criblage des peptides d'activation du facteur XIII V34X par les mutants de la thrombine. ... 47 Figure 12: Algorithme suggéré par la Société internationale pour la thrombose et l'hémostase (ISTH) pour le diagnostic et la classification appropriés du déficit en facteur XIII. FXIII indique le facteur XIII; FXIIID, trouble FXIII. ... 83 Figure 13: Provinces iraniennes dans lesquelles on trouve le plus grand nombre de cas de déficience en facteur XIII. ... 90 Figure 14: Algorithme suggéré pour le diagnostic moléculaire du déficit en facteur XIII en Iran. .... 91 Figure 15: Algorithme suggéré pour le diagnostic du déficit en facteur XIII en Iran. ... 93
LISTE DES TABLEAUX
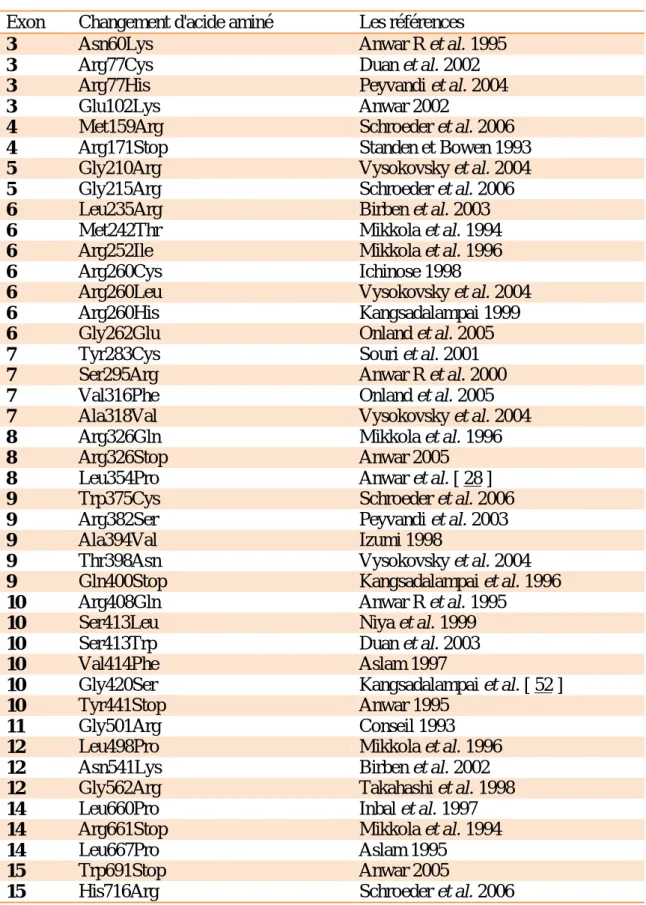
Tableau I: Mutations faux-sens / non-sens du facteur XIII-A. ... 40 Tableau II: Les sites hémorragiques les plus fréquents dans 90 cas de déficit congénital en F XIII . 77 Tableau III: Mutations détectées chez des patients iraniens présentant une déficience en facteur XIII et des amorces suggérées ... 88 Tableau IV: Principales caractéristiques des MDS utilisés dans le traitement des maladies hémorragiques et thrombotiques en France ... 106 Tableau V: Labory and clinical findings in patients with Henoch-Schonlein purpura. ... 117
I. Introduction
...1II. Physiopathologie
...5 1. Génétique ...6 1.1. Structure et fonction du facteur XIII :...6 1.2. Localisation du facteur XIII en fibrine : ... 14 1.3. Site de liaison de la thrombine ... 16 2. Gènes et polymorphismes du facteur XIII : ... 23 2.1. Structure des gènes du facteur XIII ... 23 2.2. Polymorphismes du gène de la sous-unité A du facteur XIII... 24 2.3. Facteur XIII Val34Leu ... 24 3. Polymorphismes génétiques du facteur XIII et troubles thrombotiques : ... 28 3.1. Physiopathologie des troubles thrombotiques ... 28 3.2. Facteur XIII Val34Leu et maladie coronarienne ... 29 3.3. Facteur XIII Val34Leu et troubles thrombotiques veineux ... 30 3.4. Facteur XIII Val34Leu, maladie cérébrovasculaire et autres associations ... 30 3.5. Conclusion ... 31 4. Facteur XIII: Déficience héréditaire et acquise : ... 32 5. Nouveaux aspects de la fonction du facteur XIII plaquettaire : ... 35 6. Biosynthèse du facteur XIII plasmatique: preuve de la transcription et de la traduction dans les cellules d'hépatome : ... 37 7. Déficit en facteur XIII ... 39 8. Mutations ... 39 9. Substrats du FXIIIA roles dans la thrombose et la cicatrisation des plaies : ... 54 10. Déficit léger en facteur XIII et hypofibrinogénémie concomitante: effet de la grossesse... 55 11. F XIII dans la gestion de la coagulation périopératoire ... 57 12. Déficience auto-immune acquise en facteur XIII due à des anticorps anti-facteur XIII . 68
III. Diagnostique
... 71 1. Dosages du facteur XIII et problèmes associés pour le diagnostic en laboratoire de la carence en facteur XIII: analyse des résultats des tests de compétence internationaux : 80 2. Diagnostic en laboratoire de la déficience en facteur XIII dans les pays en développement: une expérience iranienne ... 82 3. Diagnostic du déficit en facteur XIII en Iran : ... 84 4. Diathèses hémorragiques sévères chez un patient âgé présentant un autoanticorps de type combiné à la sous-unité du facteur XIII A; nouvelle approche pour le diagnostic et la classification des anticorps anti-facteur XIII : ... 101 5. Discussion : ... 102IV. Traitement
... 104 1. Le co-traitement du facteur XIII avec des agents hémostatiques dans l'hémophilie A augmente la réticulation de la chaîne α de la fibrine : ... 108 2. Intérêt de la transfusion de facteur XIII dans les formes hyperalgiques du purpura rhumatoïde de l'enfant : ... 115 3. Activité du facteur XIII de coagulation sanguine en tant qu'indicateur pronostique chez les patients atteints de purpura d'Henoch-Schönlein : ... 118 4. Traitement par facteur XIII recombinant ... 120 5. Prophylaxie et saignement ... 124V. Conclusion
... 125VI. Résumés
VII.Références
Pendant longtemps, le facteur de coagulation (F) XIII a été considéré comme un facteur de coagulation négligé à l'extrémité «moins intéressante» de la cascade de la coagulation, au-delà de la génération de thrombine et de la polymérisation de la fibrine plus pertinentes. La recherche sur le FXIII a connu un renouveau lorsqu'un rôle dans les maladies cardio-vasculaires et cérébrocardio-vasculaires a été suggéré pour la première fois .Depuis lors, de plus en plus de groupes de recherche de différents horizons ont étudié le FXIII et, grâce à leur excellent travail au cours de la dernière décennie, le FXIII est maintenant reconnu comme une protéine multifonctionnelle impliquée dans de nombreux processus de réglementation et de construction [1]
Le déficit en facteur XIII de la coagulation est une anomalie rare. Le risque d’hémorragie intracrânienne est particulièrement élevé à tout âge, spontanément ou lors de traumatismes mineurs. Nous rapportons un cas d’hémorragie intracérébrale spontanée chez un enfant connu porteur d’un déficit en facteur XIII. [2]
Le rôle du facteur XIII ou le facteur stabilisant la fibrine dans la coagulation est parfaitement connu, c’est la résistance du caillot contre la fibrinolyse, rôle suggéré dès 1923, date à laquelle ce facteur fut identifié et purifié. Il prit toute son importance clinique lorsque fut découverte la première patiente atteinte d’un déficit congénital en facteur XIII en 1960. Les symptômes observés ont permis de définir les fonctions de cette enzyme, qui vont bien au-delà de son rôle dans la solidité du caillot de fibrine. En effet, la patiente avait en plus des symptômes hémorragiques un problème de cicatrices hypertrophiques des plaies postopératoires. Le rôle dans la cicatrisation du facteur XIII de coagulation, en particulier dans la formation de la matrice provisoire indispensable à la réparation tissulaire, fut soulevé puis ultérieurement démontré.
Pour comprendre ce rôle méconnu par la plupart des médecins et en l’occurrence ceux qui s’intéressent à l’hémostase, il est important de rappeler les différentes étapes de la cicatrisation. La cicatrisation constitue la dernière étape du processus inflammatoire, qui se déroule en quatre phases: la phase inflammatoire vasculaire, la phase inflammatoire granulomatose, la phase de bourgeon charnu et la phase de cicatrisation proprement dite. Des facteurs humoraux et cellulaires multiples permettent le recrutement et l’activation des
différentes cellules intervenant dans ce processus. Parmi ces cellules on trouve les fibroblastes et les myofibroblastes, qui synthétisent les collagènes et les éléments non fibrillaires de la matrice extracellulaire tels la ténascéine, la fibronectine et les protéoglycanes.
L’incorporation de collagène à la fibrine formée sur le site d’une plaie vasculaire pourrait jouer un rôle important en empêchant la fibrine de se détacher de la paroi vasculaire. En effet le facteur XIII activé (XIIIa) peut lier la fibrine à la fibronectine in vivo et il a été démontré que les collagènes de types I, II, III et V peuvent se lier à la fibronectine in vivo alors que le collagène de type IV n’est pas un substrat convenable. Dans ces réactions, le collagène fournit la lysine pour former une liaison avec un résidu glutamine de la fibronectine. Ainsi le caillot dont la solidité et la persistance sur la paroi vasculaire dépendent de l’action du facteur XIII précède la réparation tissulaire. Celle-ci est dépendante de la fibrine réticulée par le facteur XIII qui fournit un environnement indispensable à la croissance des fibroblastes.
De même la migration des monocytes dans le gel de fibrine est influencée par le degré de réticulation de la fibrine par le facteur XIII. La migration des fibroblastes est accélérée lorsque le facteur XIIIa a lié la fibrine et cet effet positif est dépendant de la réticulation des chaînes A alpha. Par contre, la réticulation des chaînes gamma n’a aucun effet sur la migration des fibroblastes dans la fibrine. Retenons l’importance de la réticulation des chaînes A alpha qui n’a lieu qu’en concentration normale de facteur stabilisant de la fibrine. Ceci pourrait bien expliquer la fragilité du caillot et la cicatrisation anormale chez les patients qui n’ont qu’un déficit modéré en facteur XIII. [3]
L’étude de Burckhardt et al. en 1973 portant sur 34 brûlés a montré une rapide baisse du taux du facteur XIII atteignant 30% de la normale dans les quatre premiers jours suivant la brûlure et pouvant rester très bas pendant 20 jours. Après des brûlures expérimentales chez les rats, des injections intraveineuses répétées de facteur XIII restaurent une vitesse normale de cicatrisation des brûlures. Quant à l’application chez l’homme il y a encore beaucoup de progrès à faire dans ce domaine en sachant que même l’action du facteur XIII de la coagulation sur la cicatrisation et sur la croissance des fibroblastes reste encore incomplètement élucidée. [4]
Au cours de la dernière décennie, de plus en plus de groupes de recherche de différents milieux ont étudié le FXIII et ont dévoilé de nouvelles fonctions supposées pour le FXIII. Le FXIII, avec son rôle unique de transglutaminase parmi les autres facteurs de coagulation de la sérine protéase, est maintenant reconnu comme une protéine multifonctionnelle impliquée dans les mécanismes de régulation et les processus de construction et de réparation au-delà de l'hémostase.
Le but de ce travail est de donner un aperçu des découvertes passionnantes et de souligner la remarquable diversité des fonctions attribuées au FXIII. Bien entendu, davantage de recherches sur les mécanismes sous-jacents et la pertinence (pathologique) physiologique, diagnostique et traitement des nombreuses fonctions décrites du FXIII sont nécessaires. Il sera intéressant d'observer les développements futurs dans ce domaine et de voir si et comment ces résultats intéressants pourraient être traduits en pratique clinique à l'avenir.
Le facteur XIII (FXIII) est une protéine plasmatique connue de longue date pour son rôle stabilisateur du caillot de fibrine. Le déficit héréditaire en FXIII, lorsqu’il est présent à l’état homozygote, est un facteur de risque classique de maladie hémorragique. Il est aussi à l’origine de troubles de la cicatrisation et de fausses couches. Très récemment, quelques équipes se sont intéressées aux polymorphismes génétiques de ce facteur, à leurs possibles conséquences fonctionnelles et à leur retentissement clinique. Le polymorphisme Val34Leu pourrait avoir des conséquences cliniques non négligeables. En effet, l’allèle Leu pourrait être protecteur de la survenue de thromboses artérielles et veineuses, et favoriser la survenue d’hémorragies cérébrales primitives. [5]
1. Génétique
Le facteur XIII permet la stabilisation du caillot de fibrine nouvellement formé en le protégeant d’une élimination trop rapide du système de fibrinolyse. Le facteur XIII est un zymogène qui va former 2 sous-unités après clivage : FXIII-A, qui est la forme active, et FXIII-B. Il a été identifié dans les macrophages du tissu implantatoire, les histiocytes utérins et dans le placenta, ce qui suggère son implication lors de la grossesse. Il va être essentiel pour le maintien de la grossesse, la déficience sévère en facteur XIII peut se traduire par des saignements hémorragiques ou des fausses couches spontanées à répétition durant le premier trimestre chez les patientes ne bénéficiant pas de thérapie de substitution. Le facteur XIII est une protéine hautement polymorphique, avec pas moins de 10 polymorphismes codant sur la sous unité A, l’un d’entre eux (VAL34LEU) étant présent chez près de 20% des Européens. Ce polymorphisme s’accompagne d’une modification de la structure du caillot de fibrine. Ces polymorphismes peuvent ainsi modifier l’action du facteur XIII. [6]
1.1. Structure et fonction du facteur XIII :
Plasma FXIII, la hétérotétramère (FXIII-A 2 B 2 ), joue un rôle essentiel dans
l' hémostase par catalyser la réticulation de la fibrine, une variété d'intégrines dans les protéines de la membrane plaquettaire et de la matrice tout au long de la formation de thrombus, ce qui renforce et stabiliser le sang caillot.
Le FXIII plasmatique est converti à partir de pro-transglutaminase en FXIII activé (FXIIIa *) par la thrombine en présence d'ions calcium et de fibrine, comme le montre la (Figure 1) .Le FXIII-A contient à la fois le site de clivage activation .Le gène codant pour la sous-unité FXIII-A ( F13A ) est situé sur le chromosome 6p24–25, couvrant 160 kb et comprend 15 exons interrompus par 14 introns codant pour une protéine mature de 731 acides aminés ( Figure 2 ) [ 7 ].
Factor XIII deficiency
Factor XIII deficiency, Volume: 14, Issue: 6, Pages: 1190-1200, First published: 30 October 2008, DOI: (10.1111/j.1365-2516.2008.01857.x)
Factor XIII deficiency
Factor XIII deficiency, Volume: 14, Issue: 6, Pages: 1190-1200, First published: 30 October 2008, DOI: (10.1111/j.1365-2516.2008.01857.x)
Figure 2: Facteur XIII A: gène ( F13A ) et structure protéique.
Le FXIII-A est divisé en peptide d'activation, β-sandwich, cœur catalytique, β-barrel 1 et β-barrel 2 ( Figure3 ). La structure cristalline de la sous-unité A a révélé une triade catalytique dans le domaine central formé par les interactions des liaisons hydrogène entre Cys314, His373 et Asp396
Au cours de la première étape de l'activation du FXIII, la thrombine coupe le peptide d'activation N-terminal FXIII (AP-FXIII) de 37 résidus d'acides aminés à la position Arg37, formant le FXIIIa 'plasmatique. En présence de Ca 2+ et de fibrine, les sous-unités B se dissocient alors des sous-unités A, entraînant un changement conformationnel laissant le site actif de la cystéine accessible pour le substrat ( Figure 2). FXIII-A 2 activé (FXIII-A 2)*)
catalyse ensuite la réticulation de la fibrine ou d'autres protéines cibles contenant des résidus appropriés de glutamine et de lysine. Le FXIII activé lie de manière covalente la fibrine à travers un lien ε (glutamyl) lysine. Le FXIII peut lier les polymères de fibrine par γ-dimérisation, Gln 398 dans une molécule de fibrine et Lys406 de la molécule de fibrine suivante. La polymérisation peut également se produire à travers les chaînes alpha de Gln328, Gln366 et Lys508 dans de multiples molécules de fibrine (voir les figures 3 et 4 ) Le site actif contient un résidu de cystéine (Cys311) qui se trouve dans la séquence Tyr-Gly-Gln-Cys-Trp. Le FXIII forme également une liaison covalente avec α 2 -antiplasmine et l'inhibiteur de
fibrinolyse activable par la thrombine, stabilisant davantage le thrombus, le rendant plus résistant à la dégradation protéolytique par la plasmine [ 8 ].
Factor XIII deficiency
Factor XIII deficiency, Volume: 14, Issue: 6, Pages: 1190-1200, First published: 30 October 2008, DOI: (10.1111/j.1365-2516.2008.01857.x)
Figure 3: Polypeptide de fibrinogène.
Factor XIII deficiency
De plus, le FXIII lie également plusieurs autres substrats protéiques du plasma et du sous-endothélium, notamment la fibronectine, le facteur von Willebrand, la vitronectine, le collagène, le facteur de coagulation V, la thrombospondine et l'inhibiteur de l'activateur de type 1 .
Contrairement au FXIII plasmatique, la thrombine ne joue aucun rôle dans l'activation du FXIII intracellulaire. Lorsque le taux de calcium intracellulaire augmente en présence du substrat cible, le FXIII plaquettaire subit un changement de conformation non protéolytique en sa forme active .
Le foie est le principal site de synthèse du FXIII-B, alors qu'il semble que les cellules hématopoïétiques soient responsables de la production du FXIII-A. Très tôt, les preuves les plus solides à l'appui des origines hépatiques de la sous-unité B provenaient de la transplantation d'organes et de cellules souches. Wolpl et al. ont montré qu'après transplantation hépatique, le phénotype FXIII-B du receveur a changé pour le phénotype du donneur, alors que le FXIII-A est resté inchangé. De plus, le phénotype FXIII-A n'a été converti en phénotype du donneur qu'après une greffe de moelle osseuse Le FXIII A2 est produit dans les mégacaryocytes et les monocytes dès les premiers stades du développement myéloïde avec des plaquettes circulantes contenant environ 50% du FXIII total présent dans le sang total. Intracellulaire FXIII-A 2(pas FXIII-B) peuvent être trouvés dans les plaquettes, les
mégacaryocytes, les monocytes, les macrophages tissulaires et le placenta. Cellular FXIII-A 2 est immunochimiquement identique à plasma FXIII-A 2 et peut se combiner avec
FXIII-B 2 pour former le complexe tétramère lorsqu'il est libéré dans le plasma.
Le gène de la sous - unité FXIII-B ( F13B ) est situé sur le chromosome 1q31-32.1 et couvre environ 28 kb de longueur et est composé de 12 exons interrompus par 11 introns codant pour la protéine mature de 641 acides aminés ( Figure 5 ). La sous-unité B du FXIII est composée de 10 séquences répétées en tandem appelées structures glycoprotéine-1 ou domaines sushi en raison de leur forme. Une fonction importante de la sous-unité B est la stabilisation et le transport de la sous-unité hydrophobe A2 dans l'environnement aqueux du plasma humain, prolongeant ainsi la circulation de FXIII-A2. Bien que de plus en plus de documents décrivent le rôle de la sous-unité B dans la diminution de la dégradation et de
l’inactivation de la sous-unité A2 par les protéases, son rôle le plus important est la localisation du FXIII dans le polymère fibrineux en croissance. initier le processus de réticulation. La localisation est facilitée lorsque la partie FXIII-B de la molécule du facteur XIII A2B2 se lie spécifiquement aux chaînes gamma du fibrinogène, conduisant à la polymérisation, à la réticulation et à la régulation de l'activité de FXIII [9 ].
Factor XIII deficiency
Factor XIII deficiency, Volume: 14, Issue: 6, Pages: 1190-1200, First published: 30 October 2008, DOI: (10.1111/j.1365-2516.2008.01857.x)
Figure 5: Facteur XIIIB: gène (F13B ) et structure protéique.
Le facteur plasmatique XIII est une molécule tétramère composée de 2 sous-unités A de 83,2 kd et de 2 sous-unités B de 79,7 kd maintenues ensemble de manière non covalente dans un tétramère hétérologue de 325,8 kd. En outre, 50% de l'activité stabilisante totale de la fibrine dans le sang se trouve dans les plaquettes où le facteur XIII existe sous forme de molécule dimère composée uniquement de sous-unités A. La sous-unité A contient le site actif de l'enzyme et est synthétisée par les hépatocytes, les monocytes et les mégacaryocytes. L'analyse du phénotype de la protéine après une greffe de foie et de moelle osseuse a montré que la sous-unité A circulant dans le plasma provient à la fois du foie et de la moelle osseuse. La sous-unité B sert de support à la sous-unité catalytique A du plasma, est synthétisée par le foie et est sécrétée sous forme de monomère qui se lie au A libre dans le
La sous-unité A est divisée en 4 domaines, appelés sandwichs β, cœur catalytique, baril 1 et baril 2 (figure 6 ). Il contient un peptide d'activation de 37 acides aminés qui limite l'accès du substrat à la cystéine du site actif. Le peptide d'activation d'une sous-unité de la molécule traverse l'ouverture du site actif de l'autre. Cette structure est stabilisée par plusieurs liaisons hydrogène et ponts de sel entre le peptide d'activation, le β-sandwich et le coeur catalytique d'une sous-unité et le coeur catalytique et le β-tonneau de la deuxième sous-unité.
Figure 6: Structure du sous-unité A du facteur XIII et localisation des polymorphismes de codage communs
La structure présentée est celle du dimère de la sous-unité A du facteur recombinant, modélisée par l'utilisation de coordonnées de cristallographie aux rayons X de Weiss et al. La région centrale du catalyseur est de couleur orange; le bêta-sandwich, jaune; les 2 tonneaux bêta, verts; et le peptide d'activation, le cyan. Les résidus mis en évidence sont les résidus de cystéine au site actif et 5 résidus (Val34, Tyr204, Pro564, Val650 et Glu651) qui présentent des variations communes dans la population générale
Des études récentes par cristallographie aux rayons X de la sous-unité A du facteur XIII traitée à la thrombine ont suggéré que les peptides d'activation ne se dissocient pas lors du clivage. Des études antérieures ont décrit la cinétique de la libération du peptide d'activation par la thrombine et ont suggéré que cette réaction était renforcée par la fibrine. Cependant, dans ces études, les échantillons ont été acidifiés avant l'analyse par chromatographie liquide à haute pression et la libération du peptide d'activation peut avoir été une conséquence de cette acidification. Des études supplémentaires sont nécessaires pour déterminer si le peptide d'activation est réellement libéré pendant l'activation et si les substrats peuvent moduler cette réaction.
Considérant que la sous-unité A contient 6 sites de glycosylation liés à l' asparagine potentiels, aucun d' entre eux ont des attachements d' hydrate de carbone, comme jugé par coloration à l' acide périodique Schiff réactif de base ou par spectrométrie de masse. En revanche, les glucides contribuent à environ 8,5% du poids moléculaire total de la sous-unité B du facteur XIII. La sous-unité B est une protéine modulaire composée de 10 domaines répétés de Sushi ou de glycoprotéine-1.Chaque domaine de sushi contient 2 ponts disulfure qui soutiennent sa structure tertiaire, soit au total 40 résidus de cystéine et 20 ponts disulfure dans la protéine mature de la sous-unité B. La fonction principale de la sous-unité B est la stabilisation et le transport de la sous-unité A hydrophobe dans l'environnement aqueux du plasma humain.
En ce qui concerne la structure du FXIII, de nombreux progrès ont été réalisés récemment pour comprendre comment ses sous-unités sont maintenues. Dans la sous-unité A, le peptide d'activation joue un rôle crucial dans la formation des dimères de FXIII-A2. Dans la sous-unité B, les domaines sushi qui sont impliqués dans la liaison à la sous-unité A et dans la formation du dimère B2 ont été identifiés. En ce qui concerne la fonction FXIII, les interactions avec les cellules immunitaires et le système du complément ont été décrites. Une nouvelle fonction de FXIII-A dans l'adipogenèse a été suggérée. Le rôle de FXIII-A dans la différenciation des ostéoblastes a été étudié plus avant; cependant, une nouvelle souris à double inactivation déficiente à la fois en FXIII-A et en transglutaminase 2 a montré une formation osseuse normale. Ainsi, plus de recherches, en particulier sur les fonctions cellulaires de FXIII-A sont encore nécessaires. [10]
La structure tridimensionnelle du facteur XIII a 2 recombinant humain après clivage par
la thrombine a été déterminée par cristallographie aux rayons X. Le zymogène du facteur XIII a été traité avec de l'alpha-thrombine bovine en présence de 3 mM de CaCl 2.et la protéine
clivée a été cristallisée à partir de Tris tamponné à pH 6,5 en utilisant de l'éthanol comme agent précipitant. L'affinement du modèle moléculaire du facteur XIII clivé par la thrombine contre les données de diffraction à une résolution de 10,0 à 2,5 Å a été effectué pour donner un facteur R cristallographique de 18,2%. La structure du facteur XIII clivé par la thrombine est remarquablement similaire à celle du zymogène: il n'y a pas de changements conformationnels importants dans la protéine et le peptide d'activation de l'extrémité amino-terminale à 37 résidus reste associé au reste de la molécule. Ce travail montre que le peptide d'activation, lors du clivage de la thrombine, a la même conformation et occupe la même position par rapport au reste de la molécule que dans la structure du zymogène. [11]
1.2. Localisation du facteur XIII en fibrine :
Le facteur XIII activé par la thrombine (FXIIIa) lie la fibrine par une interaction avec les domaines aC. Le domaine αC est constitué des résidus Aα220 à Aα610, qui dépassent de la région distale (région D) de la fibrine et se terminent dans un domaine globulaire (figure 7). Au total, les deux domaines αC contribuent à environ 25% de la masse de la protéine. Dans le fibrinogène, les polypeptides de liaison au domaine αC apportent un quatrième brin à la bobine enroulée tandis que les structures terminales globulaires sont positionnées près de la région centrale (région E). Lors de la formation de la fibrine, cette conformation des domaines αC change de façon drastique: les portions globulaires se dissocient de la région centrale pour être disponibles pour les interactions intermoléculaires. Le site de liaison pour FXIIIa dans le domaine aC a été localisé sur les résidus 241 à 476 avec l'utilisation d'un fragment produit par clivage au bromure de cyanogène. Laliaison de FXIIIa à cette région a été confirmée par l'inhibition de l'interaction avec un anticorps dirigé contre les résidus 389 à 402. Dans une étude antérieure, un fragment similaire de la chaîne α produite par digestion par la plasmine (résidus 242-424) était trouvé pour réguler la dissociation de la sous-unité B du facteur XIII plasmatique clivé par la thrombine. Combinées, ces études suggèrent que FXIIIa se lie à la fibrine dans le polypeptide de liaison au domaine αC et que cette interaction améliore la dissociation des sous-unités du facteur XIII.
Figure 7: Représentation schématique de la molécule de fibrinogène.
Le fibrinogène consiste en 6 chaînes polypeptidiques maintenues ensemble par des liaisons disulfure dans une molécule à symétrie bilatérale. Sur la figure, on a représenté la région centrale (E) qui contient les fibrinopeptides; la région distale (D); segments hélicoïdaux hélicoïdaux dont certaines parties sont incluses dans les régions D et E; domaine αC; et le segment γ ', qui contient un site de liaison à la thrombine et au facteur XIII.
Le facteur zymogène XIII se lie au fibrinogène dans un site différent de celui de l'enzyme active. Cette liaison se produit par une interaction entre la sous-unité B et le fibrinogène γ '(Figure 7 ). fibrinogène γ 'est le produit d'un traitement alternatif de la transcription de la chaîne γ conduisant à la relecture de la jonction d'épissage exon IX / intron I. Le résultat de ce traitement alternatif est le remplacement des 4 derniers acides aminés à l'extrémité carboxy du polypeptide γ par 20 résidus différents. L'extension γ ′ est chargée négativement et se trouve dans environ 10% du fibrinogène du plasma. En plus d'un site de liaison pour la sous-unité B du facteur XIII, le fibrinogène γ contient également un site de liaison à la thrombine. La liaison du facteur XIII à γ ′ peut avoir des conséquences physiologiques importantes, car une augmentation de la concentration de la chaîne γ augmentera la quantité de facteur XIII introduite dans le caillot et il a été postulé que des altérations des concentrations de γ′- la chaîne pourrait être un facteur de risque potentiel de thrombose.
1.3. Site de liaison de la thrombine
Les domaines de liaison réciproques sur le facteur XIII et la thrombine ne sont pas bien établis. Les sérine-protéases utilisent souvent un exosite pour orienter le substrat et faciliter la protéolyse. Des études récentes suggèrent que des exosites existent à la fois sur la thrombine et la sous-unité A du facteur XIII qui jouent un rôle dans la liaison et l'activation du facteur XIII par la thrombine. Les sous - unités B peuvent stériquement interférer avec le clivage de la sous-unité A par la thrombine , car ils peuvent inhiber la protéolyse du peptide d'activation. Il est possible que la dissociation des sous-unités B par des complexes solubles de fibrinogène ou de fibrine soit impliquée dans l'exposition du site de clivage de la thrombine sur les sous-unités A. On pourrait supposer que lorsque la fibrine se polymérise, le facteur XIII attaché à l'extension de la chaîne γ 'sur la région D s'aligne avec la thrombine sur la région E pour favoriser le clivage du facteur XIII par la thrombine. Des études supplémentaires sont nécessaires pour définir le ou les domaines structurels responsables de cette réaction bien contrôlée.
Mécanisme catalytique
La réaction enzymatique catalysée par le facteur XIIIa est classée comme réaction de transglutaminase et l'enzyme est appelée peptide R-glutaminyl-amine-y-glutamyltransférase . Une triade catalytique est formée par les résidus Cys314, His373 et Asp396 et participe à la formation de la liaison isopeptidique. La première étape de la catalyse est la reconnaissance d'un groupe choisi de résidus de glutamine liés aux protéines , suivi de la formation d'une liaison thioester qui libère l'ammoniac de la glutamine (Figure 8 ). La seconde étape de la réaction implique la liaison du complexe enzyme-substrat de glutamine à une amine primaire, qui est soit une lysine liée aux protéines, une polyamine ou une autre amine primaire. L'intermédiaire thioester est hautement réactif et la liaison isopeptidique se forme rapidement (Figure 8 ). S'il n'y a pas d'aminés primaires dans la poche du site actif, le complexe enzyme-substrat réagit avec l'eau, libérant l'enzyme et convertissant la glutamine en acide glutamique.
Figure 8: Réaction de réticulation catalysée par le facteur XIII activé.
Le facteur XIII activé forme d'abord une liaison thioester avec un résidu de glutamine lié à une protéine sélectionnée, libérant de l'ammoniac. L'intermédiaire thioester réagit alors avec une amine primaire provenant d'un résidu lysine lié à une protéine, une polyamine ou d'autres amines primaires, conduisant à une liaison amide ou isopeptide.
Il a été montré qu'il existe des cis- liaisons de nonproline dans la molécule aux résidus Arg310-Tyr311 et Gln425-Phe426. Sur la base de ces découvertes, Weiss et ses collaborateurs ont proposé que le facteur XIII puisse exister dans deux états conformationnels et que la conversion de ces liaisons peptides non- proline en configuration trans pourrait fournir le changement de conformation nécessaire pour exposer le site actif. catalyse. La mutagenèse dirigée de Arg310 ou Tyr311 sur Ala conduit à une molécule mutante de facteur XIII inactive , ce qui suggère qu'une catalyse productive ne peut pas se produire lorsque cette nonproline cis-la liaison peptidique est perturbée. L’importance de ces liaisons dans l’activation du facteur XIII fait l’objet de recherches ultérieures.
L'orientation des résidus spécifiques dans le site actif commence à être appréciée au fur et à mesure que davantage de formes mutantes du facteur XIII sont exprimées et analysées. La mutagenèse des résidus de chaque côté de la cystéine au site actif entraîne une perte
à se lier à la fibrine. Ceci suggère que les sites utilisés pour la liaison au substrat sont différents ou sont moins susceptibles d'être perturbés par les mutations ponctuelles autour de la cystéine du site actif (résidus d'acides aminés 310-317) que ceux requis pour l'activité catalytique.
Calcium et catalyse
Les ions calcium sont nécessaires à l'activation du facteur XIII plasmatique après le clivage de la thrombine. Il existe un changement de conformation dépendant du calcium qui entraîne la dissociation des sous-unités B du facteur XIII clivé par la thrombine. Les ions calcium sont également nécessaires pour la première étape de la catalyse. La proximité de la triade catalytique au site de fixation du calcium suggère que les ions calcium régulent les changements conformationnels qui accélèrent la catalyse. Le mécanisme catalytique utilise les ions calcium comme cofacteur pour maintenir le site actif en conformation appropriée pour déclencher la formation de l'intermédiaire thioester avec la glutamine.
La sous-unité A du facteur plaquettaire XIII est rapidement activée aux concentrations plasmatiques de calcium (2,5 mM). En revanche, des concentrations de calcium supérieures à 10 mM sont nécessaires pour une expression complète de l'activité plasmatique du facteur XIII. Cette concentration est significativement plus élevée que celle qui existe dans le plasma et suggère qu'un autre cofacteur régule l'activation du facteur XIII plasmatique. En effet, le fibrinogène réduit la concentration en calcium nécessaire à la dissociation des sous-unités B et facilite l'activation du facteur XIII.
Régulation de l'oxyde nitrique de l'activité du facteur XIII
Un rapport récent de Catani et al. démontre que les donneurs d'oxyde nitrique peuvent inhiber l'activité du facteur XIII par la S-nitrosylation de la cystéine du site actif. La régulation de l'activité du facteur XIII par l'oxyde nitrique sur les sites de lésion vasculaire pourrait influencer la formation de caillots et pourrait fournir un mécanisme de régulation pour inhiber la stabilisation de la fibrine et améliorer la dégradation de la fibrine.