Détection et quantification du BKvirus chez les greffés rénaux Expérience du laboratoire central de Virologie, Centre hospitalier Ibn Sina, Rabat
Texte intégral
(2) UNIVERSITE MOHAMMED V DE RABAT FACULTE DE MEDECINE ET DE PHARMACIE - RABAT. DOYENS HONORAIRES : 1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI 1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI ADMINISTRATION : Doyen : Professeur Mohamed ADNAOUI Vice Doyen chargé des Affaires Académiques et estudiantines Professeur Mohammed AHALLAT Vice Doyen chargé de la Recherche et de la Coopération Professeur Taoufiq DAKKA Vice Doyen chargé des Affaires Spécifiques à la Pharmacie Professeur Jamal TAOUFIK Secrétaire Général : Mr. El Hassane AHALLAT. 1- ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS PROFESSEURS : Mai et Octobre 1981 Pr. MAAZOUZI Ahmed Wajih Pr. TAOBANE Hamid*. Chirurgie Cardio-Vasculaire Chirurgie Thoracique. Mai et Novembre 1982 Pr. BENOSMAN Abdellatif. Chirurgie Thoracique. Novembre 1983 Pr. HAJJAJ Najia ép. HASSOUNI. Rhumatologie. Décembre 1984 Pr. MAAOUNI Abdelaziz Pr. MAAZOUZI Ahmed Wajdi. Médecine Interne – Clinique Royale Anesthésie -Réanimation. Pr. SETTAF Abdellatif. pathologie Chirurgicale.
(3) Novembre et Décembre 1985 Pr. BENJELLOUN Halima Pr. BENSAID Younes Pr. EL ALAOUI Faris Moulay El Mostafa. Cardiologie Pathologie Chirurgicale Neurologie. Janvier, Février et Décembre 1987 Pr. AJANA Ali Pr. CHAHED OUAZZANI Houria Pr. EL YAACOUBI Moradh Pr. ESSAID EL FEYDI Abdellah Pr. LACHKAR Hassan Pr. YAHYAOUI Mohamed. Radiologie Gastro-Entérologie Traumatologie Orthopédie Gastro-Entérologie Médecine Interne Neurologie. Décembre 1988 Pr. BENHAMAMOUCH Mohamed Najib Pr. DAFIRI Rachida Pr. HERMAS Mohamed. Chirurgie Pédiatrique Radiologie Traumatologie Orthopédie. Décembre 1989 Pr. ADNAOUI Mohamed Pr. BOUKILI MAKHOUKHI Abdelali* Pr. CHAD Bouziane Pr. OUAZZANI Taïbi Mohamed Réda. Médecine Interne –Doyen de la FMPR Cardiologie Pathologie Chirurgicale Neurologie. Janvier et Novembre 1990 Pr. CHKOFF Rachid Pr. HACHIM Mohammed* Pr. KHARBACH Aîcha Pr. MANSOURI Fatima Pr. TAZI Saoud Anas. Pathologie Chirurgicale Médecine-Interne Gynécologie -Obstétrique Anatomie-Pathologique Anesthésie Réanimation. Février Avril Juillet et Décembre 1991 Pr. AL HAMANY Zaîtounia Pr. AZZOUZI Abderrahim Pr. BAYAHIA Rabéa Pr. BELKOUCHI Abdelkader Pr. BENCHEKROUN Belabbes Abdellatif Pr. BENSOUDA Yahia Pr. BERRAHO Amina Pr. BEZZAD Rachid Pr. CHABRAOUI Layachi Pr. CHERRAH Yahia Pr. CHOKAIRI Omar Pr. KHATTAB Mohamed Pr. SOULAYMANI Rachida Pr. TAOUFIK Jamal. Anatomie-Pathologique Anesthésie Réanimation –Doyen de la FMPO Néphrologie Chirurgie Générale Chirurgie Générale Pharmacie galénique Ophtalmologie Gynécologie Obstétrique Biochimie et Chimie Pharmacologie Histologie Embryologie Pédiatrie Pharmacologie – Dir. du Centre National PV Chimie thérapeutique. Décembre 1992 Pr. AHALLAT Mohamed Pr. BENSOUDA Adil. Chirurgie Générale Anesthésie Réanimation.
(4) Pr. BOUJIDA Mohamed Najib Pr. CHAHED OUAZZANI Laaziza Pr. CHRAIBI Chafiq Pr. DAOUDI Rajae Pr. DEHAYNI Mohamed* Pr. EL OUAHABI Abdessamad Pr. FELLAT Rokaya Pr. GHAFIR Driss* Pr. JIDDANE Mohamed Pr. TAGHY Ahmed Pr. ZOUHDI Mimoun. Radiologie Gastro-Entérologie Gynécologie Obstétrique Ophtalmologie Gynécologie Obstétrique Neurochirurgie Cardiologie Médecine Interne Anatomie Chirurgie Générale Microbiologie. Mars 1994 Pr. BENJAAFAR Noureddine Pr. BEN RAIS Nozha Pr. CAOUI Malika Pr. CHRAIBI Abdelmjid Pr. EL AMRANI Sabah Pr. EL AOUAD Rajae Pr. EL BARDOUNI Ahmed Pr. EL HASSANI My Rachid Pr. ERROUGANI Abdelkader Pr. ESSAKALI Malika Pr. ETTAYEBI Fouad Pr. HADRI Larbi* Pr. HASSAM Badredine Pr. IFRINE Lahssan Pr. JELTHI Ahmed Pr. MAHFOUD Mustapha Pr. MOUDENE Ahmed* Pr. RHRAB Brahim Pr. SENOUCI Karima. Radiothérapie Biophysique Biophysique Endocrinologie et Maladies Métaboliques Gynécologie Obstétrique Immunologie Traumato-Orthopédie Radiologie Chirurgie Générale- Directeur CHIS Immunologie Chirurgie Pédiatrique Médecine Interne Dermatologie Chirurgie Générale Anatomie Pathologique Traumatologie – Orthopédie Traumatologie- Orthopédie Inspecteur du SS Gynécologie –Obstétrique Dermatologie. Mars 1994 Pr. ABBAR Mohamed* Pr. ABDELHAK M’barek Pr. BELAIDI Halima Pr. BRAHMI Rida Slimane Pr. BENTAHILA Abdelali Pr. BENYAHIA Mohammed Ali Pr. BERRADA Mohamed Saleh Pr. CHAMI Ilham Pr. CHERKAOUI Lalla Ouafae Pr. EL ABBADI Najia Pr. HANINE Ahmed* Pr. JALIL Abdelouahed Pr. LAKHDAR Amina Pr. MOUANE Nezha. Urologie Chirurgie – Pédiatrique Neurologie Gynécologie Obstétrique Pédiatrie Gynécologie – Obstétrique Traumatologie – Orthopédie Radiologie Ophtalmologie Neurochirurgie Radiologie Chirurgie Générale Gynécologie Obstétrique Pédiatrie. Mars 1995 Pr. ABOUQUAL Redouane Pr. AMRAOUI Mohamed Pr. BAIDADA Abdelaziz. Réanimation Médicale Chirurgie Générale Gynécologie Obstétrique.
(5) Pr. BARGACH Samir Pr. CHAARI Jilali* Pr. DIMOU M’barek* Pr. DRISSI KAMILI Med Nordine* Pr. EL MESNAOUI Abbes Pr. ESSAKALI HOUSSYNI Leila Pr. HDA Abdelhamid* Pr. IBEN ATTYA ANDALOUSSI Ahmed Pr. OUAZZANI CHAHDI Bahia Pr. SEFIANI Abdelaziz Pr. ZEGGWAGH Amine Ali. Gynécologie Obstétrique Médecine Interne Anesthésie Réanimation – Dir. HMIM Anesthésie Réanimation Chirurgie Générale Oto-Rhino-Laryngologie Cardiologie - Directeur ERSM Urologie Ophtalmologie Génétique Réanimation Médicale. Décembre 1996 Pr. AMIL Touriya* Pr. BELKACEM Rachid Pr. BOULANOUAR Abdelkrim Pr. EL ALAMI EL FARICHA EL Hassan Pr. GAOUZI Ahmed Pr. MAHFOUDI M’barek* Pr. MOHAMMADI Mohamed Pr. OUADGHIRI Mohamed Pr. OUZEDDOUN Naima Pr. ZBIR EL Mehdi*. Radiologie Chirurgie Pédiatrie Ophtalmologie Chirurgie Générale Pédiatrie Radiologie Médecine Interne Traumatologie-Orthopédie Néphrologie Cardiologie. Novembre 1997 Pr. ALAMI Mohamed Hassan Pr. BEN SLIMANE Lounis Pr. BIROUK Nazha Pr. CHAOUIR Souad* Pr. ERREIMI Naima Pr. FELLAT Nadia Pr. HAIMEUR Charki* Pr. KADDOURI Noureddine Pr. KOUTANI Abdellatif Pr. LAHLOU Mohamed Khalid Pr. MAHRAOUI CHAFIQ Pr. OUAHABI Hamid* Pr. TAOUFIQ Jallal Pr. YOUSFI MALKI Mounia. Gynécologie-Obstétrique Urologie Neurologie Radiologie Pédiatrie Cardiologie Anesthésie Réanimation Chirurgie Pédiatrique Urologie Chirurgie Générale Pédiatrie Neurologie Psychiatrie Gynécologie Obstétrique. Novembre 1998 Pr. AFIFI RAJAA Pr. BENOMAR ALI Pr. BOUGTAB Abdesslam Pr. ER RIHANI Hassan Pr. EZZAITOUNI Fatima Pr. LAZRAK Khalid * Pr. BENKIRANE Majid* Pr. KHATOURI ALI* Pr. LABRAIMI Ahmed*. Gastro-Entérologie Neurologie – Doyen Abulcassis Chirurgie Générale Oncologie Médicale Néphrologie Traumatologie Orthopédie Hématologie Cardiologie Anatomie Pathologique. Janvier 2000 Pr. ABID Ahmed*. Pneumophtisiologie.
(6) Pr. AIT OUMAR Hassan Pr. BENJELLOUN Dakhama Badr.Sououd Pr. BOURKADI Jamal-Eddine Pr. CHARIF CHEFCHAOUNI Al Montacer Pr. ECHARRAB El Mahjoub Pr. EL FTOUH Mustapha Pr. EL MOSTARCHID Brahim* Pr. ISMAILI Hassane* Pr. MAHMOUDI Abdelkrim* Pr. TACHINANTE Rajae Pr. TAZI MEZALEK Zoubida. Pédiatrie Pédiatrie Pneumo-phtisiologie Chirurgie Générale Chirurgie Générale Pneumo-phtisiologie Neurochirurgie Traumatologie Orthopédie Anesthésie-Réanimation Anesthésie-Réanimation Médecine Interne. Novembre 2000 Pr. AIDI Saadia Pr. AIT OURHROUI Mohamed Pr. AJANA Fatima Zohra Pr. BENAMR Said Pr. CHERTI Mohammed Pr. ECH-CHERIF EL KETTANI Selma Pr. EL HASSANI Amine Pr. EL KHADER Khalid Pr. EL MAGHRAOUI Abdellah* Pr. GHARBI Mohamed El Hassan Pr. HSSAIDA Rachid* Pr. LAHLOU Abdou Pr. MAFTAH Mohamed* Pr. MAHASSINI Najat Pr. MDAGHRI ALAOUI Asmae Pr. NASSIH Mohamed* Pr. ROUIMI Abdelhadi*. Neurologie Dermatologie Gastro-Entérologie Chirurgie Générale Cardiologie Anesthésie-Réanimation Pédiatrie Urologie Rhumatologie Endocrinologie et Maladies Métaboliques Anesthésie-Réanimation Traumatologie Orthopédie Neurochirurgie Anatomie Pathologique Pédiatrie Stomatologie Et Chirurgie Maxillo-Faciale Neurologie. Décembre 2000 Pr. ZOHAIR ABDELAH*. ORL. Décembre 2001 Pr. ABABOU Adil Pr. BALKHI Hicham* Pr. BENABDELJLIL Maria Pr. BENAMAR Loubna Pr. BENAMOR Jouda Pr. BENELBARHDADI Imane Pr. BENNANI Rajae Pr. BENOUACHANE Thami Pr. BEZZA Ahmed* Pr. BOUCHIKHI IDRISSI Med Larbi Pr. BOUMDIN El Hassane* Pr. CHAT Latifa Pr. DAALI Mustapha* Pr. DRISSI Sidi Mourad* Pr. EL HIJRI Ahmed Pr. EL MAAQILI Moulay Rachid. Anesthésie-Réanimation Anesthésie-Réanimation Neurologie Néphrologie Pneumo-phtisiologie Gastro-Entérologie Cardiologie Pédiatrie Rhumatologie Anatomie Radiologie Radiologie Chirurgie Générale Radiologie Anesthésie-Réanimation Neuro-Chirurgie.
(7) Pr. EL MADHI Tarik Pr. EL OUNANI Mohamed Pr. ETTAIR Said Pr. GAZZAZ Miloudi* Pr. HRORA Abdelmalek Pr. KABBAJ Saad Pr. KABIRI EL Hassane* Pr. LAMRANI Moulay Omar Pr. LEKEHAL Brahim Pr. MAHASSIN Fattouma* Pr. MEDARHRI Jalil Pr. MIKDAME Mohammed* Pr. MOHSINE Raouf Pr. NOUINI Yassine Pr. SABBAH Farid Pr. SEFIANI Yasser Pr. TAOUFIQ BENCHEKROUN Soumia. Chirurgie-Pédiatrique Chirurgie Générale Pédiatrie Neuro-Chirurgie Chirurgie Générale Anesthésie-Réanimation Chirurgie Thoracique Traumatologie Orthopédie Chirurgie Vasculaire Périphérique Médecine Interne Chirurgie Générale Hématologie Clinique Chirurgie Générale Urologie Chirurgie Générale Chirurgie Vasculaire Périphérique Pédiatrie. Décembre 2002 Pr. AL BOUZIDI Abderrahmane* Pr. AMEUR Ahmed * Pr. AMRI Rachida Pr. AOURARH Aziz* Pr. BAMOU Youssef * Pr. BELMEJDOUB Ghizlene* Pr. BENZEKRI Laila Pr. BENZZOUBEIR Nadia Pr. BERNOUSSI Zakiya Pr. BICHRA Mohamed Zakariya* Pr. CHOHO Abdelkrim * Pr. CHKIRATE Bouchra Pr. EL ALAMI EL FELLOUS Sidi Zouhair Pr. EL HAOURI Mohamed * Pr. EL MANSARI Omar* Pr. FILALI ADIB Abdelhai Pr. HAJJI Zakia Pr. IKEN Ali Pr. JAAFAR Abdeloihab* Pr. KRIOUILE Yamina Pr. LAGHMARI Mina Pr. MABROUK Hfid* Pr. MOUSSAOUI RAHALI Driss* Pr. MOUSTAGHFIR Abdelhamid* Pr. NAITLHO Abdelhamid* Pr. OUJILAL Abdelilah Pr. RACHID Khalid * Pr. RAISS Mohamed Pr. RGUIBI IDRISSI Sidi Mustapha* Pr. RHOU Hakima Pr. SIAH Samir *. Anatomie Pathologique Urologie Cardiologie Gastro-Entérologie Biochimie-Chimie Endocrinologie et Maladies Métaboliques Dermatologie Gastro-Entérologie Anatomie Pathologique Psychiatrie Chirurgie Générale Pédiatrie Chirurgie Pédiatrique Dermatologie Chirurgie Générale Gynécologie Obstétrique Ophtalmologie Urologie Traumatologie Orthopédie Pédiatrie Ophtalmologie Traumatologie Orthopédie Gynécologie Obstétrique Cardiologie Médecine Interne Oto-Rhino-Laryngologie Traumatologie Orthopédie Chirurgie Générale Pneumophtisiologie Néphrologie Anesthésie Réanimation.
(8) Pr. THIMOU Amal Pr. ZENTAR Aziz*. Pédiatrie Chirurgie Générale. Janvier 2004 Pr. ABDELLAH El Hassan Pr. AMRANI Mariam Pr. BENBOUZID Mohammed Anas Pr. BENKIRANE Ahmed* Pr. BOUGHALEM Mohamed* Pr. BOULAADAS Malik Pr. BOURAZZA Ahmed* Pr. CHAGAR Belkacem* Pr. CHERRADI Nadia Pr. EL FENNI Jamal* Pr. EL HANCHI ZAKI Pr. EL KHORASSANI Mohamed Pr. EL YOUNASSI Badreddine* Pr. HACHI Hafid Pr. JABOUIRIK Fatima Pr. KHABOUZE Samira Pr. KHARMAZ Mohamed Pr. LEZREK Mohammed* Pr. MOUGHIL Said Pr. OUBAAZ Abdelbarre* Pr. TARIB Abdelilah* Pr. TIJAMI Fouad Pr. ZARZUR Jamila. Ophtalmologie Anatomie Pathologique Oto-Rhino-Laryngologie Gastro-Entérologie Anesthésie Réanimation Stomatologie et Chirurgie Maxillo-faciale Neurologie Traumatologie Orthopédie Anatomie Pathologique Radiologie Gynécologie Obstétrique Pédiatrie Cardiologie Chirurgie Générale Pédiatrie Gynécologie Obstétrique Traumatologie Orthopédie Urologie Chirurgie Cardio-Vasculaire Ophtalmologie Pharmacie Clinique Chirurgie Générale Cardiologie. Janvier 2005 Pr. ABBASSI Abdellah Pr. AL KANDRY Sif Eddine* Pr. ALAOUI Ahmed Essaid Pr. ALLALI Fadoua Pr. AMAZOUZI Abdellah Pr. AZIZ Noureddine* Pr. BAHIRI Rachid Pr. BARKAT Amina Pr. BENHALIMA Hanane Pr. BENYASS Aatif Pr. BERNOUSSI Abdelghani Pr. CHARIF CHEFCHAOUNI Mohamed Pr. DOUDOUH Abderrahim* Pr. EL HAMZAOUI Sakina* Pr. HAJJI Leila Pr. HESSISSEN Leila Pr. JIDAL Mohamed* Pr. LAAROUSSI Mohamed Pr. LYAGOUBI Mohammed Pr. NIAMANE Radouane* Pr. RAGALA Abdelhak Pr. SBIHI Souad Pr. ZERAIDI Najia. Chirurgie Réparatrice et Plastique Chirurgie Générale Microbiologie Rhumatologie Ophtalmologie Radiologie Rhumatologie Pédiatrie Stomatologie et Chirurgie Maxillo Faciale Cardiologie Ophtalmologie Ophtalmologie Biophysique Microbiologie Cardiologie (mise en disponibilité) Pédiatrie Radiologie Chirurgie Cardio-vasculaire Parasitologie Rhumatologie Gynécologie Obstétrique Histo-Embryologie Cytogénétique Gynécologie Obstétrique.
(9) Décembre 2005 Pr. CHANI Mohamed. Anesthésie Réanimation. Avril 2006 Pr. ACHEMLAL Lahsen* Pr. AKJOUJ Said* Pr. BELMEKKI Abdelkader* Pr. BENCHEIKH Razika Pr. BIYI Abdelhamid* Pr. BOUHAFS Mohamed El Amine Pr. BOULAHYA Abdellatif* Pr. CHENGUETI ANSARI Anas Pr. DOGHMI Nawal Pr. ESSAMRI Wafaa Pr. FELLAT Ibtissam Pr. FAROUDY Mamoun Pr. GHADOUANE Mohammed* Pr. HARMOUCHE Hicham Pr. HANAFI Sidi Mohamed* Pr. IDRISS LAHLOU Amine* Pr. JROUNDI Laila Pr. KARMOUNI Tariq Pr. KILI Amina Pr. KISRA Hassan Pr. KISRA Mounir Pr. LAATIRIS Abdelkader* Pr. LMIMOUNI Badreddine* Pr. MANSOURI Hamid* Pr. OUANASS Abderrazzak Pr. SAFI Soumaya* Pr. SEKKAT Fatima Zahra Pr. SOUALHI Mouna Pr. TELLAL Saida* Pr. ZAHRAOUI Rachida. Rhumatologie Radiologie Hématologie O.R.L Biophysique Chirurgie - Pédiatrique Chirurgie Cardio – Vasculaire Gynécologie Obstétrique Cardiologie Gastro-entérologie Cardiologie Anesthésie Réanimation Urologie Médecine Interne Anesthésie Réanimation Microbiologie Radiologie Urologie Pédiatrie Psychiatrie Chirurgie – Pédiatrique Pharmacie Galénique Parasitologie Radiothérapie Psychiatrie Endocrinologie Psychiatrie Pneumo – Phtisiologie Biochimie Pneumo – Phtisiologie. Octobre 2007 Pr. ABIDI Khalid Pr. ACHACHI Leila Pr. ACHOUR Abdessamad* Pr. AIT HOUSSA Mahdi* Pr. AMHAJJI Larbi* Pr. AMMAR Haddou* Pr. AOUFI Sarra Pr. BAITE Abdelouahed* Pr. BALOUCH Lhousaine* Pr. BENZIANE Hamid* Pr. BOUTIMZINE Nourdine Pr. CHARKAOUI Naoual* Pr. EHIRCHIOU Abdelkader* Pr. ELABSI Mohamed. Réanimation médicale Pneumo phtisiologie Chirurgie générale Chirurgie cardio vasculaire Traumatologie orthopédie ORL Parasitologie Anesthésie réanimation Biochimie-chimie Pharmacie clinique Ophtalmologie Pharmacie galénique Chirurgie générale Chirurgie générale.
(10) Pr. EL MOUSSAOUI Rachid Pr. EL OMARI Fatima Pr. GANA Rachid Pr. GHARIB Noureddine Pr. HADADI Khalid* Pr. ICHOU Mohamed* Pr. ISMAILI Nadia Pr. KEBDANI Tayeb Pr. LALAOUI SALIM Jaafar* Pr. LOUZI Lhoussain* Pr. MADANI Naoufel Pr. MAHI Mohamed* Pr. MARC Karima Pr. MASRAR Azlarab Pr. MOUTAJ Redouane * Pr. MRABET Mustapha* Pr. MRANI Saad* Pr. OUZZIF Ez zohra* Pr. RABHI Monsef* Pr. RADOUANE Bouchaib* Pr. SEFFAR Myriame Pr. SEKHSOKH Yessine* Pr. SIFAT Hassan* Pr. TABERKANET Mustafa* Pr. TACHFOUTI Samira Pr. TAJDINE Mohammed Tariq* Pr. TANANE Mansour* Pr. TLIGUI Houssain Pr. TOUATI Zakia. Anesthésie réanimation Psychiatrie Neuro chirurgie Chirurgie plastique et réparatrice Radiothérapie Oncologie médicale Dermatologie Radiothérapie Anesthésie réanimation Microbiologie Réanimation médicale Radiologie Pneumo phtisiologie Hématologique Parasitologie Médecine préventive santé publique et hygiène. Virologie Biochimie-chimie Médecine interne Radiologie Microbiologie Microbiologie Radiothérapie Chirurgie vasculaire périphérique Ophtalmologie Chirurgie générale Traumatologie orthopédie Parasitologie Cardiologie. Décembre 2007 Pr. DOUHAL ABDERRAHMAN Décembre 2008. Ophtalmologie. Pr ZOUBIR Mohamed* Pr TAHIRI My El Hassan* Mars 2009 Pr. ABOUZAHIR Ali* Pr. AGDR Aomar* Pr. AIT ALI Abdelmounaim* Pr. AIT BENHADDOU El hachmia Pr. AKHADDAR Ali* Pr. ALLALI Nazik Pr. AMAHZOUNE Brahim* Pr. AMINE Bouchra Pr. ARKHA Yassir Pr. AZENDOUR Hicham*. Anesthésie Réanimation Chirurgie Générale Médecine interne Pédiatre Chirurgie Générale Neurologie Neuro-chirurgie Radiologie Chirurgie Cardio-vasculaire Rhumatologie Neuro-chirurgie Anesthésie Réanimation.
(11) Pr. BELYAMANI Lahcen* Pr. BJIJOU Younes Pr. BOUHSAIN Sanae* Pr. BOUI Mohammed* Pr. BOUNAIM Ahmed* Pr. BOUSSOUGA Mostapha* Pr. CHAKOUR Mohammed * Pr. CHTATA Hassan Toufik* Pr. DOGHMI Kamal* Pr. EL MALKI Hadj Omar Pr. EL OUENNASS Mostapha* Pr. ENNIBI Khalid* Pr. FATHI Khalid Pr. HASSIKOU Hasna * Pr. KABBAJ Nawal Pr. KABIRI Meryem Pr. KARBOUBI Lamya Pr. L’KASSIMI Hachemi* Pr. LAMSAOURI Jamal* Pr. MARMADE Lahcen Pr. MESKINI Toufik Pr. MESSAOUDI Nezha * Pr. MSSROURI Rahal Pr. NASSAR Ittimade Pr. OUKERRAJ Latifa Pr. RHORFI Ismail Abderrahmani * Pr. ZOUHAIR Said*. Anesthésie Réanimation Anatomie Biochimie-chimie Dermatologie Chirurgie Générale Traumatologie orthopédique Hématologie biologique Chirurgie vasculaire périphérique Hématologie clinique Chirurgie Générale Microbiologie Médecine interne Gynécologie obstétrique Rhumatologie Gastro-entérologie Pédiatrie Pédiatrie Microbiologie Chimie Thérapeutique Chirurgie Cardio-vasculaire Pédiatrie Hématologie biologique Chirurgie Générale Radiologie Cardiologie Pneumo-phtisiologie Microbiologie. PROFESSEURS AGREGES : Octobre 2010 Pr. ALILOU Mustapha Pr. AMEZIANE Taoufiq* Pr. BELAGUID Abdelaziz Pr. BOUAITY Brahim* Pr. CHADLI Mariama* Pr. CHEMSI Mohamed* Pr. DAMI Abdellah* Pr. DARBI Abdellatif* Pr. DENDANE Mohammed Anouar Pr. EL HAFIDI Naima Pr. EL KHARRAS Abdennasser* Pr. EL MAZOUZ Samir Pr. EL SAYEGH Hachem Pr. ERRABIH Ikram Pr. LAMALMI Najat Pr. LEZREK Mounir Pr. MALIH Mohamed* Pr. MOSADIK Ahlam Pr. MOUJAHID Mountassir* Pr. NAZIH Mouna*. Anesthésie réanimation Médecine interne Physiologie ORL Microbiologie Médecine aéronautique Biochimie chimie Radiologie Chirurgie pédiatrique Pédiatrie Radiologie Chirurgie plastique et réparatrice Urologie Gastro entérologie Anatomie pathologique Ophtalmologie Pédiatrie Anesthésie Réanimation Chirurgie générale Hématologie.
(12) Pr. ZOUAIDIA Fouad. Anatomie pathologique. Mai 2012 Pr. AMRANI Abdelouahed Pr. ABOUELALAA Khalil* Pr. BELAIZI Mohamed* Pr. BENCHEBBA Driss* Pr. DRISSI Mohamed* Pr. EL ALAOUI MHAMDI Mouna Pr. EL KHATTABI Abdessadek* Pr. EL OUAZZANI Hanane* Pr. ER-RAJI Mounir Pr. JAHID Ahmed Pr. MEHSSANI Jamal* Pr. RAISSOUNI Maha*. Chirurgie Pédiatrique Anesthésie Réanimation Psychiatrie Traumatologie Orthopédique Anesthésie Réanimation Chirurgie Générale Médecine Interne Pneumophtisiologie Chirurgie Pédiatrique Anatomie pathologique Psychiatrie Cardiologie. Février 2013 Pr. AHID Samir Pr. AIT EL CADI Mina Pr. AMRANI HANCHI Laila Pr. AMOUR Mourad Pr. AWAB Almahdi Pr. BELAYACHI Jihane Pr. BELKHADIR Zakaria Houssain Pr. BENCHEKROUN Laila Pr. BENKIRANE Souad Pr. BENNANA Ahmed* Pr. BENSEFFAJ Nadia Pr. BENSGHIR Mustapha* Pr. BENYAHIA Mohammed* Pr. BOUATIA Mustapha Pr. BOUABID Ahmed Salim* Pr. BOUTARBOUCH Mahjouba Pr. CHAIB Ali* Pr. DENDANE Tarek Pr. DINI Nouzha* Pr. ECH-CHERIF EL KETTANI Mohamed Ali Pr. ECH-CHERIF EL KETTANI Najwa Pr. ELFATEMI Nizare Pr. EL GUERROUJ Hasnae Pr. EL HARTI Jaouad Pr. EL JOUDI Rachid* Pr. EL KABABRI Maria Pr. EL KHANNOUSSI Basma Pr. EL KHLOUFI Samir Pr. EL KORAICHI Alae Pr. EN-NOUALI Hassane* Pr. ERRGUIG Laila. Pharmacologie – Chimie Toxicologie Gastro-Entérologie Anesthésie Réanimation Anesthésie Réanimation Réanimation Médicale Anesthésie Réanimation Biochimie-Chimie Hématologie Informatique Pharmaceutique Immunologie Anesthésie Réanimation Néphrologie Chimie Analytique Traumatologie Orthopédie Anatomie Cardiologie Réanimation Médicale Pédiatrie Anesthésie Réanimation Radiologie Neuro-Chirurgie Médecine Nucléaire Chimie Thérapeutique Toxicologie Pédiatrie Anatomie Pathologie Anatomie Anesthésie Réanimation Radiologie Physiologie.
(13) Pr. FIKRI Meryim Pr. GHANIMI Zineb Pr. GHFIR Imade Pr. IMANE Zineb Pr. IRAQI Hind Pr. KABBAJ Hakima Pr. KADIRI Mohamed* Pr. LATIB Rachida Pr. MAAMAR Mouna Fatima Zahra Pr. MEDDAH Bouchra Pr. MELHAOUI Adyl Pr. MRABTI Hind Pr. NEJJARI Rachid Pr. OUBEJJA Houda Pr. OUKABLI Mohamed* Pr. RAHALI Younes Pr. RATBI Ilham Pr. RAHMANI Mounia Pr. REDA Karim* Pr. REGRAGUI Wafa Pr. RKAIN Hanan Pr. ROSTOM Samira Pr. ROUAS Lamiaa Pr. ROUIBAA Fedoua* Pr. SALIHOUN Mouna Pr. SAYAH Rochde Pr. SEDDIK Hassan* Pr. ZERHOUNI Hicham Pr. ZINE Ali*. Radiologie Pédiatrie Médecine Nucléaire Pédiatrie Endocrinologie et maladies métaboliques Microbiologie Psychiatrie Radiologie Médecine Interne Pharmacologie Neuro-chirurgie Oncologie Médicale Pharmacognosie Chirurgie Pédiatrique Anatomie Pathologique Pharmacie Galénique Génétique Neurologie Ophtalmologie Neurologie Physiologie Rhumatologie Anatomie Pathologique Gastro-Entérologie Gastro-Entérologie Chirurgie Cardio-Vasculaire Gastro-Entérologie Chirurgie Pédiatrique Traumatologie Orthopédie. Avril 2013 Pr. EL KHATIB Mohamed Karim* Pr. GHOUNDALE Omar* Pr. ZYANI Mohammad*. Stomatologie et Chirurgie Maxillo-faciale Urologie Médecine Interne. *Enseignants Militaires.
(14) 2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES PROFESSEURS / PRs. HABILITES Pr. ABOUDRAR Saadia Pr. ALAMI OUHABI Naima Pr. ALAOUI KATIM Pr. ALAOUI SLIMANI Lalla Naïma Pr. ANSAR M’hammed Pr. BOUHOUCHE Ahmed Pr. BOUKLOUZE Abdelaziz Pr. BOURJOUANE Mohamed Pr. BARKYOU Malika Pr. CHAHED OUAZZANI Lalla Chadia Pr. DAKKA Taoufiq Pr. DRAOUI Mustapha Pr. EL GUESSABI Lahcen Pr. ETTAIB Abdelkader Pr. FAOUZI Moulay El Abbes Pr. HAMZAOUI Laila Pr. HMAMOUCHI Mohamed Pr. IBRAHIMI Azeddine Pr. KHANFRI Jamal Eddine Pr. OULAD BOUYAHYA IDRISSI Med Pr. REDHA Ahlam Pr. TOUATI Driss Pr. ZAHIDI Ahmed Pr. ZELLOU Amina. Physiologie Biochimie – chimie Pharmacologie Histologie-Embryologie Chimie Organique et Pharmacie Chimique Génétique Humaine Applications Pharmaceutiques Microbiologie Histologie-Embryologie Biochimie – chimie Physiologie Chimie Analytique Pharmacognosie Zootechnie Pharmacologie Biophysique Chimie Organique Biologie moléculaire Biologie Chimie Organique Chimie Pharmacognosie Pharmacologie Chimie Organique. Mise à jour le 09/01/2015 par le Service des Ressources Humaines.
(15) Dédicaces.
(16) À papa et maman, Tous les mots du monde ne sauraient exprimer l’immense amour que je vous porte, ni la profonde gratitude que je vous témoigne pour tous les efforts et les sacrifices que vous n’avez jamais cessé de consentir pour mon instruction et mon bien-être. C’est à travers vos encouragements que j’ai opté pour cette noble profession, et c’est à travers vos critiques que je me suis réalisée. J’espère avoir répondu aux espoirs que vous avez fondés en moi. Je vous rends hommage par ce modeste travail en guise de ma reconnaissance éternelle et de mon infini amour. Vous résumez si bien le mot parents qu’il serait superflu d’y ajouter quelque chose. Je vous souhaite donc santé, bonheur et longue vie pour que vous demeuriez le flambeau illuminant le chemin de vos enfants. À mon petit frère Saäd, Tu es le rayon de soleil de mes journées. À mon frère, Mohammed, Mon petit frère, devenu grand, complice de mes rires et de mes pleurs. A tous nos nombreux moments partagés et en te remerciant pour notre grande complicité. À mes amies de toujours, Farah et Mariam, Pour ces belles années partagées ensemble et pour les beaux moments qui nous attendent encore. À Fouad, Unes et l’ensemble des étudiants de la promotion de Pharmacie. À l’ensemble des techniciens du Laboratoire Central de Virologie, Pour votre aide dans la réalisation de ce travail, votre gentillesse tout au long de cette étude effectuée au laboratoire de Virologie. À Mademoiselle le Dr Hind Jmahri, Pour tes connaissances partagées et ton aide précieuse pour la réalisation de cette étude..
(17) Remerciements.
(18) À LA PRESIDENTE ET DIRECTRICE DE JURY, Madame Le Professeur Malika Essakali, Vous avez accepté de présider ce jury de thèse. Veuillez trouver ici le témoignage de notre profonde reconnaissance. À NOS JUGES, Monsieur Le Professeur Idriss Lahlou Amine, Vous nous faites l’honneur de participer à ce jury. Veuillez trouver ici l’expression de nos sincères remerciements.. Madame Le Professeur Hakima Rhou, Vous avez participé à la mise en place de ce travail. Nous vous remercions pour votre aide et pour avoir accepté de juger ce travail.. Madame Le Professeur Hakima Kabbaj, Vous m’avez encouragée et habilement conseillée durant tout mon parcours au LCV. Soyez-en vivement remerciée. Madame Le Professeur Myriam Seffar, Vous m’avez accueillie pendant un an et demi au niveau du laboratoire central de virologie. Où vous n’avez cessé de m’encourager et de croire en mes capacités. Je vous remercie d’avoir dirigé ce travail avec rigueur et attention. Vous avez toujours su être à mon écoute et me conseiller. Veuillez trouver ici l’expression de ma profonde reconnaissance, et mon éternelle admiration..
(19) LISTE DES ABRÉVIATIONS Ac ADN ADNémie ADNurie Ag ARN BHN BKémie BKurie BKV BKVN CD CH CHIS CMV CV EBV EDTA EBV HEK HLA IgG IgM IRC J KDIGO KIV LCV LEMP M NCCR ND ORI. Anticorps Acide désoxyribonucléique Présence d’ADN dans le sang Présence d’ADN dans l’urine Antigène Acide ribonucléique B Hors Nomenclature Présence d’ADN du virus BK dans le sang Présence d’ADN du virus BK dans l’urine Virus BK Néphropathie associée au virus BK Cluster of Differenciation Cystites hémorragiques Centre Hospitalier Ibn Sina Cytomégalovirus Charge Virale Epstein-Barr Virus Ethylène Diamine Tetra Acétique Epstein-Barr Virus Cellules embryonnaires de rein humain Human Leucocyte Antigen Immunoglobuline G Immunoglobuline M Insuffisance rénale chronique Jour Kidney Disease Improving Global Outcomes Virus KI Laboratoire Central de Virologie leucoencéphalopathie multifocale progressive Mois Région de contrôle non codante Non Détectable Origine de réplication.
(20) POL PCR QS1,2,3 RFC s SV40 SIL TCR UF UR VP1,2,3. Polymérase Polymerase Chain Reaction Standards de quantification réaction de fixation du complément Semaine Virus simien 40 système d'information du laboratoire Région de contrôle de la transcription Unité fonctionnelle Urines Protéines virales de capside.
(21) LISTE DES FIGURES Figure 1 : Représentation graphique des propriétés structurales des polyomavirus.......................................................................... 5 Figure 2: Représentation schématique de l’organisation du génome du virus BK. .................................................................................. 6 Figure 3 : Schéma récapitulatif de l'organisation génomique du virus BK. 8 Figure 4 : Structure du virion de la famille des Polyomaviridae. ................ 8 Figure 5 : Entrée du virus BK dans la cellule. ............................................. 12 Figure 6 : Cycle de réplication du virus BK................................................. 15 Figure 7 : Répartition des sous-types du BKV et des sous-groupes de son sous-type I dans le monde. .................................................... 19 Figure 8 : Modèle proposé de survenue d'une cystite hémorragique. .......... 28 Figure 9 : Déterminants et modulateurs dans l'apparition d'une néphropathie consécutive à une virémie à virus BK. .................. 29 Figure 10: Cycle de la maladie liée à l’infection par le virus BK chez l’Homme. ........................................................................... 33 Figures 11 et 12 : Decoy cells par coloration de Papanicolaou (x 400). ..... 35 Figure 13 : Decoy cells à stade tardif de l’infection virale. ......................... 35 Figure 14 : Histologie d’une biopsie rénale présentant une nephropathie à virus BK. .................................................................................. 37 Figure 15 : Effet cytopathique du virus BK sur des cellules embryonnaires de rein. ......................................................................... 38 Figure 16 : Particule de virus BK observée en microscopie électronique. .. 39 Figure 17 : Schéma récapitulatif de l’arbre décisionnel relatif à une Infection à BK virus. ................................................................ 47.
(22) Figure 18 : Schéma de la navette optique de détection par fluorescence. ... 57 Figure 19 : Automate de la PCR: CFX96 Biorad. ....................................... 57 Figure 20: Poste de sécurité microbiologique. ............................................. 57 Figure 21: Demande d'examens de Biologie Moléculaire. .......................... 58 Figure 22: The QIAamp MinElute Virus Spin Procedure. .......................... 59 Figure 23: Principe général de la PCR. ....................................................... 61 Figure 24: Aspect général de toutes les courbes de fluorescence. ............... 66 Figure 25: Aspect d'une courbe de fluorescence d'un résultat positif. ......... 67 Figure 26: Courbe de fluorescence d’un patient positif affichée avec son contrôle interne. ................................................................... 68 Figure 27: Patient négatif avec son CI. ........................................................ 69 Figure 28: Courbe des Standards de Quantification. ................................... 70 Figure 29: Model d’un compte rendu de charge virale BKV au LCV. ........ 71 Figure 30: Répartition des patients selon le sexe. ........................................ 72 Figure 31 : Répartition des patients par classe d’âge. ................................. 73 Figure 32 : Proportion des échantillons biologiques. ................................... 73 Figure 33 : Répartition des échantillons par patient. ................................... 75 Figure 34 : Répartition des prélèvements positifs et négatifs selon les patients......................................................................................... 76 Figure 35 : Suivi du virus BK en post transplantation pour Madame A. ..... 79 Figure 36 : Suivi du virus BK en post transplantation pour Madame B. ..... 81 Figure 37 : Suivi du virus BK en post transplantation pour Madame C. ..... 82 Figure 38 : Suivi du virus BK en post transplantation pour Madame D. ..... 83 Figure 39 : Algorithme des résultats de l’étude. .......................................... 84.
(23) Figure 40 : Description des résultats en trois groupes selon la présence ou l’absence d’ADNurie et d’ADNémie............................ 85 Figure 41 : Virus BK et cinétique. ............................................................... 89.
(24) LISTE DES TABLEAUX Tableau I : Caractéristiques principales des agents immunosuppresseurs. 25 Tableau II : Formes cliniques de l’infection à BKvirus. ............................... 31 Tableau III : Résumé de Tests de PCR en temps réel pour la mesure de charge virale à BKV tel que publiés dans la littérature (a) .......... 42 Tableau IV : Résumé de tests de PCR en temps réel pour la mesure de charge virale à BKV tel que publiés dans la littérature (b) .......... 44 Tableau V : Traitements potentiels des néphropathies à BKV (BKVN) et cystites hémorragiques (CH) à BKV. ........................ 48 Tableau VI : Composition du kit d’extraction QIAamp DNA minElute de Qiagen....................................................................................... 55 Tableau VII : Composition de la trousse de détection et de quantification de BKV. ......................................................................................... 56 Tableau VIII : Conditions d’amplification .................................................. 62 Tableau IX : Composition du mélange réactionnel .................................... 62 Tableau X : Concentration finale des QS..................................................... 65 Tableau XI : Interprétation des résultats des échantillons ........................... 65 Tableau XII : Principaux résultats de l’étude (urines, plasma) ................... 77 Tableau XIII : Pourcentage de positivité du virus BK dans les échantillons et pour les patients de l’étude. ...................................................... 86 Tableau XIV : Bibliographie comparée en termes de positivité pour des.
(25) patients ou pour des échantillons. .............................................. 87 Tableau XV : Patients de la cohorte et seuil prédictif de néphropathie. ..... 90 Tableau XVI : Revue exhaustive de la littérature. ....................................... 91.
(26) TABLE DES MATIÈRES INTRODUCTION GÉNÉRALE ............................................................... 1 PARTIE I – Théorique : GÉNÉRALITÉS SUR LE VIRUS BK ........... 4 I – Caractères virologiques ......................................................................... 5 1.1-Classification................................................................................... 5 1.2-Structure du BKvirus ...................................................................... 6 1.2.1-Le génome viral ....................................................................... 6 1.2.2 -Les protéines virales .............................................................. 8 II – Histoire naturelle de l’infection .......................................................... 9 2.1-Tropisme viral ................................................................................. 10 2.2-Cycle de réplication ........................................................................ 11 2.2.1-Entrée du virus dans la cellule ................................................. 11 2.2.2-Migration nucléaire.................................................................. 12 2.2.3-Réplication du génome viral .................................................... 12 2.2.4-Conséquences des interactions virus-cellules- ........................ 16 2.3-Latence virale .................................................................................. 16 III – Epidémiologie ...................................................................................... 17 3.1- Prévalence ...................................................................................... 17 3.2- Transmission .................................................................................. 20 IV – Physiopathologie de l’infection par le BK virus .............................. 21 4.1-Chez l’immunocompétent ............................................................... 21 4.2- Chez l’immunodéprimé ................................................................. 21 V – Pouvoir Pathogène ................................................................................ 30 VI –Diagnostic Biologique .......................................................................... 34 6.1-Cytologie ......................................................................................... 34.
(27) 6.2- Histologie ....................................................................................... 36 6.3- Culture cellulaire............................................................................ 38 6.4- Microscopie électronique............................................................... 39 6.5- Biologie moléculaire ...................................................................... 40 6.6- Sérologie ........................................................................................ 46 VII –Traitement........................................................................................... 47 VIII –Prévention ......................................................................................... 48 IX –Conclusion ........................................................................................... 50 PARTIE II – Détection et quantification du BKvirus chez les greffés rénaux, Expérience du laboratoire central de Virologie – Centre hospitalier Ibn Sina de Rabat ........................................................ 51 I – Introduction............................................................................................ 52 II – Problématique de l’étude..................................................................... 53 III – Matériel et méthodes .......................................................................... 53 3.1- Population étudiée.......................................................................... 53 3.1.1-Critères d’inclusion et d’exclusion .......................................... 54 3.1.2-Description de la population .................................................... 54 3.2- Echantillons biologiques ................................................................ 54 3.3- Matériel et équipement .................................................................. 55 3.3.1-Extraction du génome viral...................................................... 55 3.3.2-PCR .......................................................................................... 55 3.4- Déroulement de l’analyse au laboratoire ....................................... 58 3.4.1-Réception des échantillons ...................................................... 58 3.4.2-Processus Analytique ............................................................... 59 3.4.2.1-Extraction .......................................................................... 59 3.4.2.2-Amplification .................................................................... 60.
(28) 3.4.2.3-Détails de la procédure ..................................................... 63 IV – Résultats ............................................................................................... 64 4.1-Résultats des PCR sur CFX96 ........................................................ 64 4.1.1-Analyse et interprétation des résultats ..................................... 64 4.1.1.1--Conditions et validation de la technique ......................... 64 4.1.1.2-Validation de la courbe de calibration .............................. 65 4.1.1.3-Interprétation des résultats des échantillons-.................... 65 4.1.2-Sensibilité de la technique ....................................................... 66 4.1.3-Quelques exemples de courbes PCR ....................................... 66 4.1.4-Modèle de compte rendu d’une charge virale BKV-............... 71 4.2- Répartition des patients de l’étude................................................. 72 4.2.1-Proportions des femmes par rapport aux hommes .................. 72 4.2.2-Répartition des patients par classe d’âge ................................. 73 4.3- Répartition des échantillons biologiques ....................................... 74 4.4- Analyse des résultats ...................................................................... 77 4.4.1-Présence du BK virus dans les urines et/ou dans le plasma .... 78 4.4.2-Pratients faisant l’objet d’une étude plus approfondie ............ 78 V – Discussion .............................................................................................. 84 5.1- Algorithme des études virologiques de notre étude....................... 84 5.2- Interprétation des résultats ............................................................. 85 5.2.1-Pourcentage de positivité des patients et des échantillons par rapport à la littérature ......................................................... 86 5.2.2-Prévalence de la néphropathie associée au BKV .................... 88 5.2.3-Périodicité du suivi pour le virus BK des patients ayant eu une transplantation ................................................................ 88 5.2.4-Cinétique du virus BK ............................................................. 88.
(29) 5.2.5-Seuil de virémie prédictif d’une néphropathie induite par le virus BK ............................................................................... 89 VI –Limites ................................................................................................... 93 VII –Conclusion ........................................................................................... 94 Perspectives et conclusion générale ........................................................... 95 RÉSUMÉ ...................................................................................................... 97 RÉFÉRENCES BIBLIOGRAPHIQUES .................................................. 101.
(30) INTRODUCTION GÉNÉRALE. 1.
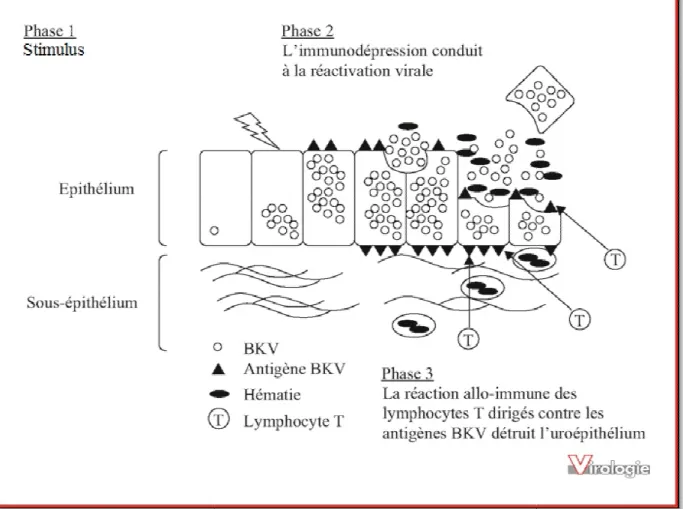
(31) Le virus BK (BKV) est un petit virus de la famille des Polyomaviridae, genre Polyomavirus, non enveloppé, de 45 nm de diamètre. C’est un virus ubiquitaire et omniprésent dans la population humaine, infectant les enfants asymptomatiquement et persistant par la suite dans les reins. Sur la base de méthodes sérologiques et de génotypage, BKV est classé en quatre sous-types (I-IV), le Ier sous-type est répandu dans le monde entier, le IVème sous-type est plutôt répandu en Asie et une partie de l'Europe, tandis que les soustypes II et III sont très rares [1]. BKV a une forme circulaire dont l’ADN présente une forme double brin. La réplication se fait dans le noyau de la cellule hôte. BKV a été isolé pour la première en 1971 à partir de l'urine d'un homme de 39 ans qui a développé une sténose urétérale 4 mois après une transplantation rénale. Le nom du virus se réfère aux initiales de ce premier patient, B.K. [2]. Les polyomavirus infectent une large variété d'espèces animales avec une étroite spécificité d'espèce. Les polyomavirus humains comprennent, entre autres, le BKV et le JCV. La principale caractéristique de ces 2 virus est d'induire une infection persistante dans l'organisme après la primo-infection et de ne provoquer que rarement une maladie clinique. Les études sérologiques indiquent que l'infection BKV a un taux de séroprévalence de l’ordre de 75 % chez les adultes dans le monde [3,17]. La primo-infection est généralement asymptomatique, la phase de latence se passe dans l'épithélium urinaire [4,17]. Alors que la réactivation et l'excrétion urinaire survient chez 10 à 60% des sujets immunocompétents [3, 5, 6], des taux nettement plus élevés ont été rapportés chez les sujets immunodéprimés [7]. Le BKV ne semble provoquer une affection clinique que chez des personnes avec des réponses immunitaires diminuées ou altérées. Ceci a été documenté chez certaines femmes enceintes, les personnes atteintes par le virus de l'immunodéficience humaine 1 (VIH-1) ou recevant une chimiothérapie et chez les receveurs de greffe d'organe solide ou de moelle [8]. L’infection à BKV chez les transplantés rénaux a été décrite comme causant plusieurs manifestations différentes. Il s'agit notamment de sténose de l’uretère, de cystite hémorragique, d’insuffisance rénale transitoire et d’insuffisance rénale progressive due à une néphropathie associée au BKV (NABKV) [17]. Parmi ces manifestations, la NABKV est la plus commune et la plus significative cliniquement en raison de son association avec la perte 2.
(32) du greffon [9]. La NABKV était en principe une entité inexistante dans les années 1980 et au début des années 1990. Cependant, une étude rétrospective examinant des lames de biopsie du rein chez des transplantés rénaux a confirmé l’excrétion des Decoy cells entre 1985 et 1996 (il s’agit de cellules contenant des inclusions virales et excrétées dans les urines) [10]. Toutefois, son incidence a augmenté de façon importante au cours des années suivantes, avec des taux aussi élevés que 10% [11]. Plus important encore, BKVAN a émergé comme une cause importante de la perte du greffon, parfois même jusqu’à 80% des cas selon le traitement immunosuppresseur utilisé, la taille de la cohorte, le moment de la détection et la stratégie de gestion mise en place [9, 12, 17]. Les progrès effectués dans le domaine des thérapies immunosuppressives ont considérablement amélioré le pronostic de la transplantation rénale à court terme. Depuis, il a été noté une très forte diminution des taux de rejet aigu de greffe. Ainsi, le pourcentage de survie du greffon après un an de la transplantation dépasse actuellement les 95% [13,14]. En revanche, ces dernières années n’ont vu que de minimes progrès concernant l'amélioration du pronostic de la transplantation à long terme [15]. Les décès dus exclusivement au rejet de greffe n'ont été que légèrement diminués [13, 14] et l'espérance de vie des transplantés rénaux reste nettement inférieure à celle de la population générale [2]. Cela est en grande partie dû à des complications liées à l'immunosuppression à vie du patient greffé.. 3.
(33) PARTIE I: GÉNÉRALITÉS SUR LE BKV :. 4.
(34) PARTIE THEORIQUE : Définitions et généralités. I - CARACTERES VIROLOGIQUES : 1.1-Classification : Le virus BK appartient à la famille des Polyomaviridae, genre Polyomavirus. Son autre appellation est le polyomavirus de l’homme de type 1. Les polyomavirus sont des virus à ADN non enveloppés de petite taille. La famille des Polyomaviridae comporte actuellement cinq polyomavirus humains et seize polyomavirus non humains, caractérisés par une étroite spécificité d’espèce. Tous ont une capside icosaédrique de taille voisine, composée de trois protéines virales de capside (VP1, VP2, VP3) [17]. Cinq polyomavirus humains ont été identifiés : le virus BK (agent de cystites hémorragiques et de néphropathies), le virus JC (responsable de leucoencéphalite multifocale progressive), le virus KI, le virus WU (liens possibles avec des affections respiratoires) et le polyomavirus associé au carcinome à cellules de Merkel. Deux polyomavirus de singe ont été identifiés : le SV40 et le LPV polyomavirus lymphotropic.[18,19,21]. Figure 1 : Représentation graphique des propriétés structurales des polyomavirus. 5.
(35) 1.2- Structure du BKvirus Le virus BK est un virus nu, constitué d’une capside icosaédrique à symétrie cubique de 45 nm de diamètre. Le génome viral est composé d’un ADN bicaténaire, circulaire et super enroulé d’environ 5300 paires de bases. De par l’absence d’enveloppe, ce virus est résistant aux solvants, et de façon plus relative à l’inactivation par la chaleur. La résistance à la dessiccation favorise sa survie dans le milieu extérieur [8].. 1.2.1-Le génome viral Le génome viral est un ADN bicaténaire, circulaire, surenroulé de 5300 paires de bases qui comporte trois régions : Région précoce. NCCR. Région tardive. Figure 2 : Représentation schématique de l’organisation du génome du virus BK D’après Krumbholz et al [23], Agno = agnoprotéine, ORI = origine de réplication, t-Ag = antigène t, T-Ag = Antigène T, VP1-2-3 = protéines virales de capside 6.
(36) – La région régulatrice non codante (Regulatory region), appelée également NCCR (Non Coding Control Region ou région de contrôle non codante) ou TCR (Transcription Control Region ou région de contrôle de la transcription). Cette région comprend l’ORI (origine de réplication), les promoteurs des gènes précoces et tardifs et la région activatrice. Elle se situe entre les régions précoce et tardive. [22] – La région précoce comporte la portion du génome transcrite. Elle est exprimée dès l’entrée du virus dans la cellule et code des protéines exprimées au début du cycle de réplication. Les gènes précoces codent deux protéines de régulation, les antigènes T et t, dont l'expression persiste pendant toute la durée du cycle. – La région tardive est la portion du génome traduite après l'étape de réplication génomique en sens inverse de la région précoce. Elle code les protéines de capside VP1 (362 acides aminés), VP2 (351 acides aminés) et VP3 (232 acides aminés) et une protéine non structurale appelée agnoprotéine (66 acides aminés) [23]. Le génome des polyomavirus est très stable ; il existe un important pourcentage d’homologie entre eux. Les virus BK et JC, strictement humains, présentent 72 % d’homologie de séquence. Chacun d’entre eux partage 70 % d’homologie avec le SV40, d’origine simienne [2]. Néanmoins, il existe aussi une diversité génomique, tant dans la région non codante de régulation que dans les régions codantes.. 7.
(37) Figure 3: Schéma récapitulatif de l'organisation génomique du virus BK. 1.2.2 _ Les protéines virales : La capside virale est constituée de trois protéines : VP1, protéine majeure de capside, et deux protéines mineures de capside, VP2 et VP3. Leur assemblage forme un icosaèdre constitué de soixante douze capsomères pentamériques. Chaque pentamère se compose de cinq protéines VP1 et d’une protéine centrale VP2 ou VP3. La capside contient la molécule d'ADN complexée avec des histones cellulaires, l'ensemble formant une structure de type chromatinien évoquant un mini chromosome [25].. Figure 4 : Structure du virion de la famille des Polyomaviridae. 8.
(38) II – HISTOIRE NATURELLE DE L'INFECTION Les données concernant l'histoire naturelle de l'infection à BKV sont très parcellaires. En extrapolant les études menées sur des modèles animaux, en particulier murins (virus K), et les investigations menées sur le virus JC, il est plausible de proposer le modèle suivant. La primo-infection survient après pénétration du virus au niveau des voies respiratoires, où il est possible qu'il se multiplie dans les amygdales. Il dissémine ensuite probablement par voie hématogène, au sein des cellules mononucléées ou libre dans le plasma, vers les différents organes cibles. Parmi ces derniers, les mieux identifiés sont le rein et le tractus urinaire, pouvant être à l'origine d'une excrétion importante du virus dans les urines. Le pancréas ou le système nerveux central pourraient également constituer des organes cibles [26]. À l'issue de cette primo-infection, le virus a la capacité de persister dans l'organisme, selon des modalités mal connues. L'ADN viral serait soit intégré au génome cellulaire, soit sous forme épisomale. Le site majeur de la persistance virale est l'épithélium du rein (épithéliums de transition, des tubules rénaux, de la capsule de Bowman) et du tractus urinaire [27, 28]. La présence de l'ADN du BKV a également été détectée dans divers autres organes (foie, estomac, poumons, parathyroïdes, nodules lymphoïdes), et en particulier dans le cerveau et les cellules mononucléées sanguines [29, 30]. L'observation d'épisodes d'excrétion virale urinaire, y compris chez les sujets immunocompétents, démontre la capacité de ce virus à réactiver périodiquement. Les données concernant la réponse immune sont, elles aussi, très limitées. Il a été proposé que l'immunité humorale soit prédominante dans les suites de l'infection aiguë. Les anticorps dirigés contre VP1 sont neutralisants et inhibent l'hémagglutination. À l'inverse, et en raison de l'observation de réactivations virales plus fréquentes chez les sujets présentant un déficit de l'immunité cellulaire, il est probable que la réponse T soit. 9.
(39) responsable du contrôle de l'infection [31]. Les polyomavirus se multiplient in vitro presque exclusivement dans les cellules de leur hôte naturel, l’homme, en raison de la spécificité d’hôte du virus. Le plus souvent, chez l’hôte, cette multiplication est restreinte à un tissu voire à des cellules spécialisées de ce tissu. Le tropisme in vivo du virus BK s’exerce sur les cellules épithéliales de diverses origines mais surtout sur les cellules tubulaires rénales avec un tropisme rénal très marqué et sur les cellules endothéliales [26]. Dans les cellules qui ne correspondent pas au tropisme du virus BK, l’infection est incomplète et s’arrête au stade de synthèse des antigènes précoces, la réplication virale est alors arrêtée sans conséquence ultérieure pour la cellule. Ce virus dépend entièrement de la machinerie cellulaire pour les étapes de transcription et de réplication et son cycle de multiplication est intranucléaire. La multiplication du BKV est complète dans les cellules humaines, ainsi que, de façon moins efficace, dans les cellules de singe, en raison de la spécificité d'hôte du virus. La transcription se déroule en deux phases, précoce et tardive, séparées par la réplication de l’ADN génomique. Les protéines précoces ont une fonction de régulation. Les protéines tardives qui constituent la capside, ont un rôle structural et s’assemblent avec l’ADN génomique néoformé dans le noyau [26].. 2.1-Tropisme viral : L’histoire naturelle de l’infection par le BKV comporte schématiquement trois phases: – La primo-infection, qui survient généralement chez les jeunes enfants ; – La phase de persistance dans l’organisme ; – Les phases de réactivation endogène ou de réinfection exogène, généralement 10.
(40) asymptomatiques chez les individus immunocompétents, et qui peuvent avoir certaines expressions cliniques chez les sujets immunodéprimés [49]. Le cycle de réplication débute par liaison du virus BK à la cellule. La protéine de capside VP1 joue un rôle majeur dans la liaison du virus BK à son récepteur et dans son internalisation par la cellule [26] (figures 5 et 6).. 2.2-Cycle de réplication: 2.2.1-Entrée du virus dans la cellule Les récepteurs cellulaires pour le BKV ne sont pour l'instant pas clairement identifiés. Néanmoins, l'inhibition de l'entrée du virus après traitement par la neuraminidase et la capacité du BKV à agglutiner les globules rouges de type O suggèrent la présence de glycoprotéines contenant de l'acide sialique au sein de ce récepteur. L'interaction avec le récepteur viral fait intervenir essentiellement la VP1, comme l'atteste le blocage de l'entrée des virions par des anticorps anti-VP1. Par ailleurs, VP2 et VP3 sont myristylées et pourraient interagir avec la membrane cellulaire pour faciliter l'entrée du virus. L’attachement du virion au récepteur est suivi d’une endocytose cholestérol dépendante. Il s’agit d’un type d’endocytose non spécifique appelée pinocytose ; les vésicules contiennent des gouttelettes de liquide extracellulaire et sont adressées vers les compartiments intracellulaires. L’étape d’internalisation est relativement longue et dure environ quatre heures. Une fois à l’intérieur de la cavéole, la poursuite du cycle de multiplication requiert une étape d’acidification. Le pH acide permet des changements conformationnels de la capside et le début du désassemblage du virion [26].. 11.
(41) Figure 5 : Entrée du virus BK dans la cellule D’après [Drachenberg et al., 2003] a : attachement du virus à la surface de la cellule, b et c : entrée du virion , d : formation d’une vésicule entourant le virion, e : la vésicule se détache de la membrane cellulaire. 2.2.2-Migration nucléaire Peu de temps après l'infection, les particules virales observées en microscopie électronique sont repérées dans des vacuoles de pinocytose. La protéine de capside VP1 contient des signaux d'adressage nucléaire, permettant la migration des vésicules jusqu'au noyau où leur membrane fusionne avec la membrane nucléaire externe, au niveau du pore nucléaire. Le réticulum endoplasmique pourrait également être une des voies d'accès du virus au noyau. La décapsidation n'a sans doute lieu qu'à l'intérieur du noyau, comme le suggère la détection de virions entiers avant celle de l'Ag T [32].. 2.2.3-Réplication du génome viral Dans le noyau ont lieu la transcription, la réplication et l’assemblage. L’arrivée du génome viral dans le noyau initie la transcription des gènes viraux et la réplication du génome.. 12.
(42) Dès la détection de l'antigène T dans les cellules, une augmentation de la production des enzymes cellulaires est observée. En effet, la présence de l’antigène T (Ag T) entraîne l’expression de promoteurs viraux et cellulaires [33]. Le mini-chromosome viral, ainsi libéré dans l'espace nucléaire, sert de matrice pour la transcription par l'ARN polymérase II cellulaire, aboutissant à la production des ARN messagers viraux précoces. Ces derniers sont produits à bas niveau et représentent 0,01 à 0,02 % du total des ARN produits par la cellule avant l'étape de réplication virale. La transcription s'étend de façon bidirectionnelle à partir de sites d'initiation situés près de l'origine de réplication : la transcription des ARNm précoces se fait sur un des deux brins dans un sens et celle des ARNm tardifs se fait sur l'autre brin dans la direction opposée. Deux ARN messagers précoces sont obtenus par épissage alternatif à partir d'un pré-ARNm commun. La transcription précoce est autorégulée par la liaison de l'Ag T à l'ADN viral. Sa fixation bloque l'assemblage du complexe de transcription au site d'initiation et inhibe la transcription précoce. Cela permet par ailleurs de libérer les éléments intervenant dans la transcription tardive[26]. L'Ag T est présent de façon prédominante dans le noyau cellulaire, libre ou associé à la chromatine et/ou à la matrice nucléaire. Il s'agit d'une protéine multifonctionnelle complexe de 695 acides aminés. L'étude de la séquence de l'Ag T du SV40 a permis d'identifier le premier signal de localisation intranucléaire [34]. Trois régions peuvent être différenciées : la première, à l'extrémité N terminale, est homologue du domaine J des molécules chaperons de l'ADN appelées DnaJ et joue un rôle important dans l'assemblage du virion, la réplication de l'ADN et le contrôle transcriptionnel ; la deuxième comporte la séquence consensus LCXCXE qui permet la liaison aux protéines de la famille des suppresseurs de tumeurs pRb et la troisième contient le site de fixation à la protéine p53. Ses multiples fonctions comprennent la mise en route de la réplication de l'ADN viral par interactions avec des séquences pentamériques au niveau de l'origine de réplication du génome viral ; une activité hélicase, la formation de complexes avec l'ADN polymérase α ainsi qu'avec la RPA (protéine déstabilisant l'hélice), impliquées dans la réplication de 13.
(43) l'ADN ; la formation de complexes avec des protéines impliquées dans la régulation de la croissance cellulaire, telles que p105Rb, p107, p130, p53 (surtout décrit pour le SV40) et des interactions avec des facteurs de transcription cellulaires. L'Ag t est une protéine riche en cystéine, de 172 acides aminés. Les 82 acides aminés de sa partie amino-terminale sont communs avec l'Ag T car issus de l'épissage alternatif d'un ARN pré-messager commun. Moins bien connu, il semble avoir des fonctions multiples au cours du cycle de réplication et des interactions avec la cellule cible. Il s'associe avec deux sous-unités de la protéine phosphatase 2A, ce qui inactive les protéines kinases ERK1 et MEK1 et favorise ainsi la progression dans le cycle cellulaire. La réplication est bidirectionnelle de part et d'autre de son origine et les deux fourches de réplication avancent à peu près à la même vitesse de part et d'autre de son origine. Il n'y a pas de séquence identifiée de terminaison de la réplication. Elle survient au sein de n'importe quelle séquence localisée à environ 180° de l'origine de réplication. La réplication de l'ADN viral est régulée par la phosphorylation de l'Ag T. Le début de la réplication coïncide avec un changement du schéma transcriptionnel. La transcription des ARNm tardifs, tous polycistroniques, augmente de façon très importante, leur production étant alors beaucoup plus abondante que celle des ARNm précoces. Les protéines de capside jouent un rôle majeur dans l'entrée du virus dans la cellule : VP1 intervient dans l'hémagglutination et son interaction avec les récepteurs cellulaires est indispensable à l'entrée du virus. Les protéines VP2 et VP3 pourraient jouer un rôle important dans la transmission du virus de cellule à cellule. L'agnoprotéine s'accumule dans la région péri-nucléaire pendant la dernière phase du cycle de multiplication. Elle semble faciliter la translocation de VP1 au niveau du noyau au début de l'infection.. 14.
(44) Après l'étape de traduction, les protéines de capside synthétisées dans le cytoplasme sont transportées dans le noyau pour l'assemblage des virions. Les interactions capside-ADN viral-protéines histones aboutissant à la formation d'un virion entier sont mal connues. Les virions nouvellement formés sont transportés dans des vésicules jusqu'à la membrane cellulaire, puis libérés par exocytose [26].. Figure 6: Cycle de réplication du virus BK. Après l'entrée dans la cellule hôte, le virion est transporté directement jusqu'au noyau dans des vacuoles de pinocytose. Le cycle de réplication est ensuite entièrement intranucléaire. D’après Bressolette Bodin et al. [26]. 15.
(45) 2.2.4- Conséquences des interactions virus-cellules Les conséquences de l'interaction entre le BKV et sa cellule hôte dépendent en premier lieu de l'espèce dont est issue la cellule infectée. Pour les cellules appartenant à l'hôte naturel du virus, l'homme dans le cas du BKV, l'infection productive aboutit à la lyse cellulaire des cellules permissives, associée à la mise en évidence d'un effet cytopathique. Dans les cellules non permissives, l'infection est abortive et s'arrête au stade de synthèse des antigènes précoces ; la réplication du génome viral est alors bloquée et l'interaction viruscellule est généralement sans conséquence ultérieure pour la cellule. Dans de rares cas d'essais in vitro, il a été montré des altérations morphologiques, une augmentation de la durée de vie et l'apparition d'anomalies chromosomiques. Cependant, les cellules transformées ne présentent pas toutes les caractéristiques des cellules tumorales. L'ADN viral y est le plus souvent présent sous forme épisomale, non intégrée [35]. Dans les cellules non humaines, l'interaction est limitée à une infection abortive qui peut aboutir à la transformation cellulaire. Les virions entiers, l'ADN complet ou les fragments génomiques codant pour les antigènes précoces du BKV sont ainsi capables de transformer in vitro des fibroblastes embryonnaires ou des cellules rénales ou cérébrales de rongeurs, de lapin ou de singe. L'ADN viral est soit intégré au génome cellulaire, soit présent sous forme épisomale. Les mécanismes de l'oncogenèse ont été étudiés surtout pour le SV40, impliquant l'interaction de l'Ag T [36], synthétisé en excès au cours des infections abortives, avec les protéines p53 et pRb. Dans le cas du BKV, seule l'interaction avec pRb a été mise en évidence, à un niveau plus faible que pour le SV40 [37]. 2.3-Latence virale Les polyomavirus sont connus pour établir des latences ou des infections persistantes. La latence du virus a lieu essentiellement dans les cellules tubulaires rénales. Le virus BK est capable de rester latent à l’intérieur de la cellule cible de l’épithélium rénal sous une forme non réplicative ou avec une réplication minimale, selon un mécanisme proche de celui de la famille des Herpesviridae. A l’état latent, le génome du virus BK peut rester sous forme 16.
(46) épisomale non intégré dans les cellules cibles de l’épithélium tubulaire rénal [26]. Le rein est le principal organe de latence du virus ; le cerveau, les cellules leucocytaires du sang circulant sont des sites de latence controversés et seraient plutôt associés à la dissémination du virus. Des phases de réactivation virale bénigne asymptomatique peuvent avoir lieu chez les sujets immunocompétents. Par ailleurs, la détection de l’ADN de VP1 dans les cellules du sang serait plutôt associée à une réinfection ou à une réactivation [30] ; ceci s’explique en considérant que l’infection par le virus BK a lieu pendant l’enfance [18].. III – EPIDEMIOLOGIE : 3.1-Prévalence Le BKV est un virus ubiquitaire, dont la séroprévalence varie entre 60 et 100 % en fonction des études épidémiologiques menées dans différents pays. Aux États-Unis, 50 % des enfants entre 3 et 4 ans possèdent des anticorps. La séroprévalence atteint presque 100 % vers l'âge de 10-11 ans, puis diminue progressivement pour se situer aux alentours de 70-80 % pour les sujets plus âgés [27]. Le virus BK est classé en quatre sous-types par des techniques sérologiques et génotypiques dont le schéma de génotypage repose sur un très court segment du gène VP1 [27]. En effet, le gène de la capside VP1 présente un polymorphisme génétique qui permet de classer les souches en quatre sous-types distincts (I à IV). Les divergences de séquences sont situées au sein d'un épitope probablement immunodominant, ce qui a conduit certains auteurs à proposer la dénomination de sérotypes [38]. Les conséquences de cette variabilité n'ont pas été explorées à ce jour. 17.
Figure

![Figure 2 : Représentation schématique de l’organisation du génome du virus BK D’après Krumbholz et al [23], Agno = agnoprotéine, ORI = origine de réplication,](https://thumb-eu.123doks.com/thumbv2/123doknet/15043596.692346/35.892.164.728.461.917/figure-représentation-schématique-organisation-génome-krumbholz-agnoprotéine-réplication.webp)
![Figure 5 : Entrée du virus BK dans la cellule D’après [Drachenberg et al., 2003]](https://thumb-eu.123doks.com/thumbv2/123doknet/15043596.692346/41.892.138.718.107.414/figure-entrée-virus-bk-cellule-drachenberg-al.webp)

Outline
Documents relatifs
» 79 , à la lumière de cette citation, on comprend que l’écrivain attribue des noms à ses personnages pour leur donner l’apparence du réel, en fait, le nom singularise
( ﺓﺪﻟﺎﺧ ﻰﻘﻴﺳﻮﻣ ﻰﻟﺇ ﻝﻮﺤﺘﺘﻓ ﻡﺎﻳﻷﺍ ﺓﺎﺟﺎﻨﻣ ﻚﺒﻠﻗ ﻲﻓ ﺞﻠﺘﺨﺗ ﺭﺎﻣﺰﻣ ﻯﻮﺳ ﺖﻧﺃ ﺎﻤﻓ ﺖﻠﻐﺘﺷﺍ ﺍﺫﺈﻓ) ,and Okasha translated it as: ( ﻡﺎﻐﻧﺃ ﻰﻟﺇ ﻪﻓﻮﺟ ﻲﻓ ﺮﻫﺪﻟﺍ ﺕﺎﺴﻤﻫ ﻝﻮﺤﺘﺗ،ﺭﺎﻣﺰﻣ
With regard to animals on the discontinuous growth path, RR steers required a similar amount of gross energy and RR lambs only 12• % more than the respective control groups on
We then examined the weighted topological conflict (as well as the total number of resolved nodes in conflict, the total number of strongly supported conflicting nodes, and Penny
Computed tomography of the paranasal sinuses was undertaken to help plan surgical removal via an endoscopic trans-sphenoidal approach; this scan revealed an atypical extracranial
A population based study of use of cardiac procedures and outcomes in elderly patients post acute myocardial infarction did not find better long-term survival rates for U.S.A.
(The activity in the filtrate of the Lake Constance samples was 40.3 ± 7 cpm and thus was identical to the background. This indicates that stripping of "CO 2 after