UNIVERSITE MOHAMMED V –SOUISSI–
FACULTE DE MEDECINE ET DE PHARMACIE –RABAT
ANNEE : 2014 THESE N°:65
AdénocArcinome de l’endomètre: à
propos de 14 cAs de l’ino
(série chirurgicale)
THESE
Présentée et soutenue publiquement le :……….………….
PAR
Mme. Ilham CHKARNAT
Née le 10 Août 1986 à Kénitra
Pour l'Obtention du Doctorat en Médecine
MOTS CLES: Adénocarcinome endomètrial – hystérectomie totale – annexectomie bilatérale – radiothérapie.
MEMBRES DE JURY
Pr. F. TIJAMI PRESIDENT
Professeur de Chirurgie Générale
Pr. H. HACHI RAPPORTEUR
Professeur de Chirurgie Générale Pr. T. KEBDANI
Professeur de RadioThérapie Pr. B. EL KHANNOUSSI
Professeur d’Anatomie- Cytologie Pathologique
Pr. R. LATIB
Professeur de Radiologie
انتملع ام لاإ انل ملع لا كناحبس
ميكحلا ميلعلا تنأ كنإ
ةرقبلا ةروس
:
ةيلآا
:
13
اعشاخ ابلق و اعفان املع كلأسن انإ مهللا
ءافشو
مقس و ءاد لك نم
Toutes les lettres ne sauraient trouver les mots qu’il
faut…
Tous les mots ne sauraient exprimer la gratitude,
l’amour,
Le respect, la reconnaissance…
Aussi, c’est tout simplement que
Je dédie cette
Thèse…
A ma chère mère
FARIDA LAANGRY
Autant de phrases aussi expressives soient-elles ne sauraient montrer le degré
d’amour et d’affection que j’éprouve pour toi. Tu m’as comblé avec ta tendresse et affection tout au
long de mon parcours.
Tu n’as cessé de me soutenir et de m’encourager durant toutes les années de mes
études, tu as toujours été présente à mes cotés pour me consoler quand il fallait.
En ce jour mémorable, pour moi ainsi que pour toi, reçoit ce travail en signe de ma
vive reconnaissance et ma profonde estime. Puisse le tout puissant te donner santé, bonheur et
longue vie afin que je puisse te combler à mon tour.
A mon cher père
MOHAMMED CHKARNAT
Aucune dédicace ne saurait exprimer le respect et l’amour que je vous porte.
Pour votre amour constant, je suis et je resterai pour toujours obéissante. Que ce travail soit le gage de ma reconnaissance et de ma gratitude. Que Dieu le tout
puissant puisse vous bénir, et vous accorder une longue vie pleine de bonheur et de satisfaction.
A MON TRÈS CHER EPOUX
OUADIE ELBIDADI
Ton encouragement et ton soutien étaient la bouffée d’oxygène
qui me ressourçait dans les moments pénibles, de solitude et de souffrance.
Merci d’être toujours à mes côtés, par ta présence, par ton amour
dévoué et ta tendresse, pour donner du goût et du sens à notre vie de famille
En témoignage de mon amour, de mon admiration et de ma grande affection, je te prie de trouver dans ce
travail l’expression de mon estime et mon sincère attachement.
Je prie dieu le tout puissant pour qu’il te donne bonheur et prospérité.
A mes chères sœurs Hind et Youssra
A mon cher frère Chakib
En souvenir d’une enfance dont nous avons partagé
les meilleurs
et les plus agréables moments.
Pour toute la complicité et l’entente qui nous
unissent,
ce travail soit le témoignage tangible de mon
affection et de mes profonds sentiments fraternels.
AVEC TOUS MES VOEUX DE BONHEUR ET
SANTE.
Aux familles :
Veuillez trouver dans ce travail l’expression de mon
respect le plus profond et mon affection la plus
sincère.
A tous mes amis :
En souvenir des moments agréables passés ensemble,
veuillez trouver dans ce travail l’expression de ma
tendre affection et mes sentiments les plus
respectueux avec mes vœux de succès, de bonheur et
de bonne santé.
A tous ceux que j’ai omis de citer :
Que ce travail soit le témoignage des bons moments
que nous avons passé ensemble.
A NOTRE MAITRE ET PRESIDENT DE THESE
Monsieur le professeur TIJAMI FOUAD
Professeur de Chirurgie Générale
Nous vous remercions du grand honneur que vous
nous faites en acceptant de présider notre jury de
thèse.
Votre accueil, votre gentillesse et votre assistance
nous ont beaucoup touchés.
Veuillez trouver dans ce travail le témoignage de
notre profond respect.
A NOTRE MAITRE ET RAPPORTEUR DE THESE
Monsieur le professeur HACHI HAFIDE
Professeur de Chirurgie Générale
Vous nous avez éclairés durant notre travail et vous
avez proposé votre aide sans aucune réserve.
Permettez de vous remercier pour votre
compréhension et votre amabilité, et de vous
présenter notre vive reconnaissance pour votre
disponibilité durant les étapes de notre travail
Veuillez trouver dans cet ouvrage, l’expression de
notre respect et notre admiration pour votre
compétence
A NOTRE MAITRE ET JUGE DE THESE
Monsieur le professeur KEBDANI TAYEB
Professeur de Radiothérapie
Nous vous remercions vivement d’avoir accepté
sans réserve de siéger parmi le jury de notre thèse.
Nous vous prions de bien vouloir accepter à travers
ce travail l’expression de notre profond respect.
A NOTRE MAITRE ET JUGE DE THESE
Madame le professeur BASMA ELKHANNOUSSI
Professeur d’Anatomo-pathologie
Nous sommes très sensibles à l’honneur que vous
nous faites en acceptant de juger ce travail.
Veuillez accepter, maître, l’expression de notre
A NOTRE MAITRE ET JUGE DE THESE
Madame le professeur RACHIDA LATIB
Professeur de Radiologie
Vous avez accepté en toute simplicité de juger ce
travail et c'est pour nous un grand honneur de vous
voir siéger parmi notre jury de thèse.
Nous tenons à vous remercier et à vous exprimer
notre respect.
INTRODUCTION ... 1 REVUE DE LA LITTERATURE ... 3 I- Rappel anatomique ... 5 A- Les moyens de fixité ... 5 B- Les rapports de l’utérus ... 7 C- Vascularisation, innervation ... 8 1- Artères ... 8 2- Veines ... 8 3- Lymphatiques ... 9 4- Nerfs ... 11 II- Epidémiologie ... 12 A. Incidence et mortalité ... 12 B. L’Age ... 12 C. Les facteurs de risque ... 13 1. Les facteurs hormonaux ... 13 2. L'obésité ... 16 3. Le diabète et l'hypertension ... 17 4. Histoire familiale ... 17 III- Rappel anatomo-pathologique ... 17 A- Classification ... 17 B- Grading ... 21 C- Stadification ... 21 D- Les sous types histologiques ... 23 MATERIEL ET METHODES ... 26 RESULTATS ... 37 I- Epidémiologie ... 35 A- Age ... 35 B- Antécédents ... 35 1. Médicaux-chirurgicaux ... 35 2. Gynéco-obstétricaux ... 35 3. Les antécédents néoplasiques ... 36 4. Les antécédents familiaux ... 36
II- Etude clinique ... 36 A. Délai du diagnostic ... 36 B. Circonstances de découverte ... 37 1. Métrorragies ... 37 2. Douleurs pelviennes ... 37 3. Les leucorrhées ... 37 4. Autres signes cliniques ... 37
C. Examen physique ... 37 III- Bilan paraclinique ... 38 A. à visée diagnostique ... 38 1. l’échographie pelvienne ... 38 2. TDM abdomino-pelvienne ... 38 3. Imagerie par résonnance magnétique ... 39 4. Curetage biopsique de l’endomètre ... 39 5. Examen extemporané ... 39 B. Bilan d’extension ... 39 IV- Conduite thérapeutique ... 40 A- Traitement chirurgical ... 40 B. Le compte rendu anatomo-pathologie : ... 41 B. La Radiothérapie ... 42 C. chimiothérapie ... 42 D. Evolution ... 42 DISCUSSION ... 43 I- Epidémiologie ... 44 A- Incidence ... 44 B- Les facteurs de risque : ... 46 1- L’âge ... 46 2- Facteurs raciaux et régionaux ... 46 3- Les facteurs hormonaux ... 46 4- Le syndrome des ovaires polykystiques ... 50 5- l’obésité ... 51 6- le diabète ... 51 7- le syndrome de Lynch II ... 51 8- Tabac ... 52 9- Alcool ... 52
10- Les facteurs environnementaux ... 52 II- Le dépistage ... 53 III- Le diagnostic clinique ... 54 A- les circonstances de découverte ... 54 B- Les signes cliniques ... 55 1- Les métrorragies ... 55 2- Douleurs abdomino-pelviennes ... 55 3- Leucorrhées- pyométrie ... 55 4- Autres signes ... 55 C- L’examen clinique ... 56 IV- paraclinique ... 56 A- Avisée diagnostique ... 56 1. Cytologie endomètriale ... 56 2. Biopsie-curetage de l’endomètre ... 57 3. Echographie pelvienne etendovaginale ... 58 4. Apport du Doppler ... 60 5. Hystéroscopie ... 61 6. Hystérosonographie ... 64 7. La tomodensitométrie ... 65 8. IRM ... 65 9. Tomographie par émission de positons ... 70 10. Examen Anatomo-pathologique : ... 71 B. Bilan d’extension ... 73 V- Traitement ... 75 A- les moyens thérapeutiques ... 76 1- La chirurgie ... 76 b- les modalités chirurgicales ... 85 2- Radiothérapie ... 104 a- Radiothérapie externe ... 104 b- Curiethérapie ... 109 c- l’irradiation exclusive ... 114 3- Hormonothérapie ... 117 4- Chimiothérapie ... 123 B- Les indications thérapeutiques ... 127 1- Les indications chirurgicales ... 127 2- les indications du traitement adjuvant ... 130
VI- Evolution ... 132 A- Surveillance ... 132 B- Récidive ... 133 C- Dissémination ... 134 1- lymphatique ... 134 2- hématogène ... 135 VII- Pronostic ... 135 A- Les facteurs pronostiques ... 135 1- les facteurs pronostiques histologiques ... 135 2- Les caractéristiques des patientes ... 138 3- facteurs pronostiques cliniques et chirurgicaux ... 139 B- fertilité et adénocarcinome de l’endomètre ... 142 CONCLUSION ... 142 RESUME ... 145 BIBLIOGRAPHIE : ... 147
LISE DES FIGURES ET DES TABLEAUX
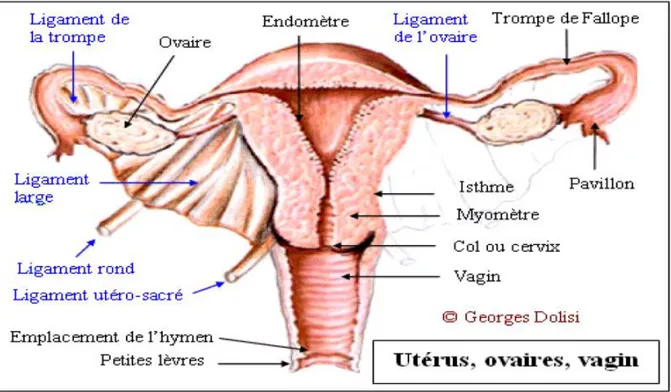
Figure 1 : Moyens de fixité de l’utérus.
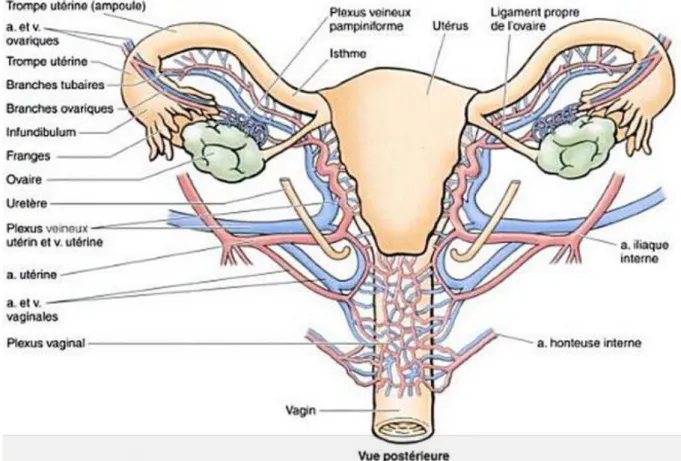
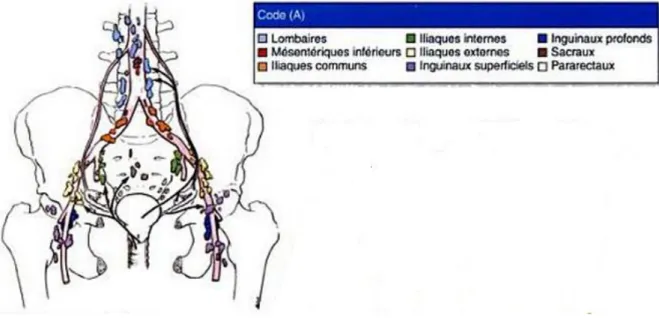
Figure 2 : Vascularisation artérielle et drainage veineux de l'utérus, du vagin et des ovaires. Figure 3 : Drainage lymphatique de l'utérus et des trompes.
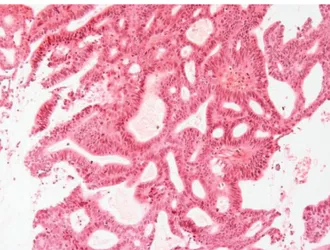
Figure 4 : Adénocarcinome endomètrioïde type I, de grade I . Figure 5 : Adénocarcinome endomètrioïde type I, de grade II . Figure 6 : Adénocarcinome endomèroide grade III.
Figure 7 : Adénocarcinome à cellules claires . Figure 8 : Adénocarcinome papillaire séreux.
Figure 9 : Échographie pelvienne, voie abdominale, coupe sagittale: adénocarcinome
endométrioïde.
Figure 10 : adénocarcinome de l’endomètre. Épaississement échogène hétérogène de
l’endomètre), avec une hypervacularisation.
Figure 11 : IRM pelvienne coupes sagittale et axiale T2, et axiale T1 injectée.
Adénocarcinome de l’endomètre IC grade 1.
Figure 12 : IRM pelvienne, coupe sagittale T2.adénocarcinome endométrioïde FIGO IA. Figure 13 : IRM pelvienne coupe sagittale T2 et axiale T2 rapide. Adénocarcinome
endométrioïde de grade III, FIGO IIIC.
Figure 14 : Pièce d'hystérecomie avec annexectomie bilatérale et curage pelvien bilatérale Figure 15 : pièce d'omentectomie emportant 02 nodules métastatique du grand epiploon. Figure 16 : Procédure du ganglion sentinelle dans le cancer de l’endomètre.
Tableau 1: Classification histogénétique des adénocarcinomes endométriaux [2].
Tableau 2 : Critères de la classification de l’International Federation of Gynecology and
Obstetrics (FIGO).
Tableau 3 : Caractéristiques cliniques des patientes. Tableau 4 : Diagnostic et bilan d’extension.
Tableau 5 : Traitement chirurgical, anapath définitive et stade de FIGO. Tableau 6 : Traitement adjuvant et évolution.
Tableau 7 : Délai diagnostique.
Tableau 8 : la fréquance des signes cliniques.
Tableau 9 : les différents stades tumoraux dans notre série.
Tableau 10 : Incidence d’adénocarcinome de l’endomètre dans différents pays [4]. Tableau 11 : Principales études de l’extension myométriale profonde par échographie
endovaginale (EEV).
Tableau 12 : Séries rétrospectives comparant la voie coelio-assistée à la laparotomie [154]. Tableau 13 : Irradiation exclusive des adénocarcinomes de l’endomètre, chez les patientes
inopérables, associant radiothérapie externe et curiethérapie [211].
Tableau 14 : Principaux protocoles de traitement par progestatifs [226]. Tableau 15 : Taux des survies selon le stade d’après Bemard P. [284].
1
2
L’adénocarcinome de l’endomètre est le cancer gynécologique le plus fréquent et le quatrième en incidence chez la femme (après les cancers du sein, du côlon et du poumon). [1]
L’adénocarcinome de l'endomètre est avant tout un cancer de la femme ménopausée pour plus de 75% des cas alors qu'il est beaucoup plus rare avant 40 ans avec 3 % des cas environ. [2]
Il est divisé en deux types de cancers distincts : le cancer de type I, le plus fréquent, développé dans un contexte d’hyper-oestrogénie et sur des lésions précurseurs d’hyperplasie glandulaire endométriale, correspond à un adénocarcinome endométrioïde, il est de bon pronostic. Alors que le cancer de type II, moins fréquent, se développe sur des lésions de carcinome intramuqueux dans un contexte de muqueuse atrophique, son type histologique est plus agressif soit de type adénocarcinome séreux soit à cellules claires avec un moins bon pronostic. [3]
L’adénocarcinome endomètroide représente environ 80% des cancers de l’endomètre, il touche le plus souvent des femmes âgées entre 50 et 60 ans, présentant une hyper-oestrogénie. L’hyper-oestrogénie peut être d’origine exogène (traitement hormonal substitutif, Tamoxifène®) ou d’origine endogène (syndrome des ovaires polykystiques, tumeur ovarienne, ménopause).
Les autres facteurs de risque sont l’obésité, l’hypertension artérielle, l’hyperlipidémie et la nulliparité (infertilité), une prédisposition génétique comme le syndrome de Lynch peut également favoriser ce type de cancer. [3] La majorité des adénocarcinomes de l’endomètre sont diagnostiqués à des stades précoces (stade I 80 %, stade II 10 %, stade III 7 %, stade IV 3 %). Son pronostic reste relativement favorable avec un taux de mortalité par cancer qui reste le plus faible en comparaison des autres cancers féminins[1].
3
Le traitement classique de l’adénocarcinome de l'endomètre est l'hystérectomie totale englobant les trompes et les ovaires, les patientes présentant une infiltration profonde du myomètre ou au-delà peuvent être traitées par une radiothérapie une chimiothérapie ou une hormonothérapie progestative complémentaire. [4]
De plus en plus, l’adénocarcinome de l'endomètre est diagnostiqué dans des femmes plus jeunes dans ce que la préservation de la fertilité peut être une considération importante en décidant la gestion(le traitement) optimale. [5]
4
REVUE DE LA
LITTERATURE
5
I- RAPPEL ANATOMIQUE : [6-7]
L’utérus est l’organe de gestation, il est situé dans la partie médiane du pelvis, entre la vessie en avant, le rectum en arrière, le vagin en bas, les anses grêles et le colon ilio-pelvien en haut.
L’utérus a une forme de cône à sommet tronqué, aplatie d’avant en arrière. Il présente dans sa partie moyenne un léger étranglement : l’isthme utérin qui sépare le corps et le col.
Normalement, chez la femme pubère, l’utérus a une position antéfléchie et antéversée.
Les dimensions de la cavité utérine prises après hystérométrie sont les suivantes:
Pour une nullipare :
La longueur totale de l’utérus est de 55mm La largeur de l’utérus est de 40mm
Pour une multipare :
La longueur totale de l’utérus est de 75mm La largeur de l’utérus est de 60mm
A- Les moyens de fixité
Le péritoine des faces et du fond de l’utérus s’étend de chaque côté, au-delà de ses bords latéraux, jusqu’à la paroi latérale de la cavité pelvienne. Il forme, ainsi, de chaque côté de l’utérus, un repli transversal : le ligament large qui relie l’utérus à la paroi pelvienne.
Ce sont des cordons du tissu conjonctif et musculaire contenant l’artère du ligament rond. Ils s’étendent des angles latéraux de l’utérus, au-dessous les
6
trompes, et se terminent sur les parois du canal inguinal et dans le tissu cellulo-graisseux du mont venus et des grandes lèvres.
1- Les ligaments utero ovariens :
Ils se fixent sur les angles latéraux de l’utérus, au-dessous et en arrière de la trompe, et se terminent sur le mésovarium et l’ovaire.
2- Les ligaments utero sacrés ou postérieurs :
Ils s’étendent de la face postérieure du col à la face antérieure du sacrum en dehors des trous sacrés.
On oppose le corps utérin qui est mobile au col qui est fixe :
Le corps utérin est mobile et il est maintenu dans sa position par la pression abdominale, les ligaments larges et les ligaments ronds.
Le col utérin est fixé grâce au vagin, les paramètres et les ligaments utero sacrés.
7
B- Les rapports de l’utérus
L’utérus présente : Une face antérieure Une face postérieure
2 bords latéraux
Une base dirigée en haut Un sommet tourné vers le bas 2 angles latéraux ou cornes utérine
1- La face antérieure :
Répond à la face supérieure de la vessie, elle est recouverte par le péritoine qui forme, au niveau de l’isthme, le cul de sac vésico-utérin.
2- La face postérieure :
Répond aux anses intestinales et au rectum. Elle est tapissée par le péritoine qui descend jusqu’à la partie supérieure de la face postérieure du vagin, puis se réfléchit sur la face antérieure du rectum en formant le cul de sac de Douglas
3- Les bords latéraux :
Répondent aux ligaments larges. Ils sont longés par les artères et les veines utérines
4- La base ou le fond utérin :
Situé au-dessous du détroit supérieur. Il est coiffé par les anses intestinales et le colon ilio pelvien.
5- Le sommet :
Représenté par la portion intra vaginale du col de l’utérus et appelés museau de tanche.
8
6- Les angles latéraux ou cornes utérines donnent insertion de chaque côté:
A la trompe utérine au sommet de l’angle Le ligament rond antéro inférieur
Le ligament utero ovarien postérieur
C- Vascularisation, innervation 1- Artères
L’utérus est vascularisé essentiellement par les artères utérines droites et gauches, et accessoirement par les artères ovariennes et les artères du ligament rond.
L’artère utérine naît de l’artère iliaque interne et irrigue l’utérus, mais aussi ses annexes et le vagin.
L’artère ovarienne participe à la vascularisation de l’utérus par ses anastomoses avec l’artère utérine.
L’artère du ligament rond est sans importance fonctionnelle. 2- Veines
Elles forment de chaque côté de l’utérus le plexus veineux utero vaginale. Ils se drainent dans la veine hypogastrique par les veines utérines.
9
Figure 2 : Vascularisation artérielle et drainage veineux de l'utérus, du vagin et des ovaires.
3- Lymphatiques
A l’origine, les lymphatiques s’organisent en 3 réseaux : muqueux, musculaire et séreux.
Par la suite, les lymphatiques de l’utérus se drainent en 2 réseaux essentiels :
Un réseau supérieur qui draine le corps de l’utérus, et se divise en 3 pédicules:un principal ou ovarique, un accessoire ou iliaque externe, et un antérieur.
10
Un réseau inférieur qui draine le col et l’isthme, et qui se divise en 3 pédicules:iliaque externe pré ureterique, iliaque interne rétro ureterique, et antéro postérieur qui se termine dans les noeuds sacrés et du promontoire.
Les lymphatiques pelviens sont drainés par des conduits efférents vers des Iymphonoeuds inconstants, à proximité des viscères.
Des différentes tuniques de l'utérus (muqueuse, musculeuse, séreuse), les canaux lymphatiques se réunissent sur les faces latérales de l'utérus. On distingue :
Lymphonoeuds iliaques externes
8 à 10 ganglions sont groupés le long des vaisseaux iliaques externes. Lymphonoeuds obturateurs
Ils sont entre le pédicule obturateur, le muscle obturateur interne. Ils
reçoivent les collecteurs principaux de la vessie, de l'uretère, de l'utérus et du vagin; Leur exérèse est nécessaire en cas de cancer pelvien.
Lymphonoeuds inter-iliaques
Ils sont situés au niveau de la bifurcation des vaisseaux iliaques externe et interne. Ils drainent les noeuds obturateurs et iliaques externes ainsi que la vessie, l'utérus et le vagin.
Lymphonoeuds iliaques internes
Disposés entre les interstices des branches de l'artère iliaque interne, on les divise en :
-noeuds glutéaux supérieurs et inférieurs
-noeuds sacraux: situés le long de l'artère sacrale près du plexus sacré.
Lymphonoeuds communs
Placés contre les vaisseaux iliaques communs; ils drainent les nœuds iliaques externes, internes et intermédiaires. Ils forment cinq groupes:
11
-noeuds iliaques communs latéraux dans la fosse ilio-Iombaire -noeuds iliaques communs intermédiaires
-noeuds iliaques communs médiaux.
-noeuds iliaques communs du promontoire. -noeuds iliaques communs sub-aortiques.
Figure 3 : Drainage lymphatique de l'utérus et des trompes.
4- Nerfs
Ils proviennent du plexus hypogastrique, qui longe la face interne des lames sacro-recto-génito-pubiennes. Ils s’individualisent en :
Pédicule cervico isthmique qui suit le trajet des vaisseaux
Pédicule corporéal qui forme, en arrière de l’artère utérine, le nerf latéral de l’utérus ou nerf de LATARJET.
12
II- EPIDÉMIOLOGIE :
A. Incidence et mortalité:L’adénocarcinome de l'endomètre est le troisième cancer le plus fréquent chez la femme, après le cancer du sein et les cancers colorectaux. [8]
Actuellement, l'incidence en France est en augmentation et le chiffre est de 18 nouveaux cas pour 100 000 et par an en 1995 est largement dépassé, il se situe en 2007 entre 25 et 30 nouveaux cas pour 100 000 et par an .en 2005, 4800 cas ont été diagnostiqués en France et 1300 décès par cancer de l'endomètre enregistrés la même année.
Cette incidence s'élève sans atteindre encore celle des états unis : 38,5 pour 100 000 et par an en 1995. [8]
L’adénocarcinome de l’endomètre est une maladie des pays riches, avec des incidences maximales en Amérique du Nord et en Europe de l’ouest, et une faible incidence au Japon et dans les pays en voie de développement d’Afrique, d’Asie et d’Amérique latine.
L’adénocarcinome de l’endomètre est classiquement un cancer de la femme ménopausée, environ 80 % des cas sont diagnostiqués chezdes femmes de 50 à 75 ans avec un pic d'incidence à l’âge de 55 ans. [4]
L’incidence varie de façon drastique d'un pays à l'autre, comme l'indique le tableau ci-dessous, montrant les taux les plus élevés dans les pays industrialisés.
B. L’Age :
C'est le facteur le plus important. L’adénocarcinome de l'endomètre survient, dans 80 % des cas, chez des patientes ménopausées, avec une forte incidence entre 50 et 65 ans .avant 40 ans il ne présente que 5 %. [8]
13
C. Les facteurs de risque : 1. Les facteurs hormonaux :
Les hormones sexuelles comme les œstrogènes et progestatifs, mais aussi anti-œstrogènes et anti progestérones, influencent profondément la biologie des cellules endométriales et l'homéostasie du tissu endométrial. Aussi d'autres ligands de récepteurs d'œstrogène comme le raloxifène et des métabolites de la tibolone sont connu pour avoir des effets sur l'endomètre. [9]
a. estrogènes :
Des niveaux élevés d'œstrogènes en circulation sanguine chez la femme augmentent les risques de l’adénocarcinome de l'endomètre. [10-11-12]
L’excès d’œstrogène entraîne une stimulation continue de l’endomètre avec augmentation de la production locale de l’IGF1 (Insulin-like growth factor) qui peut aboutir à l’hyperplasie endomètriale [13]. Les femmes ayant une
hyperplasie atypique ont un risque de 23% de présenter un cancer de l’endomètre, lors des 10 années suivantes. [14]
Les œstrogènes sont donc déterminants dans l'étiologie de l’adénocarcinome de l'endomètre.
Des différences dans l'épidémiologie et le pronostic suggèrent qu'il existe deux formes d’adénocarcinomes de l'endomètre : ceux reliés à la stimulation par les estrogènes (80% des cas) et ceux qui n'y sont pas reliés (20% des cas).
L’adénocarcinome de l'endomètre de type I, aussi appelé adénocarcinome endométrioïde, est relié à une exposition accrue aux estrogènes endogènes et exogènes.
Les femmes souffrant d'un cancer de type II ne présentent pas de facteurs de risque associés à une exposition aux estrogènes. [(15-16)]
14
b. La progestérone :
Les estrogènes entraînent la prolifération de l’épithélium endomètrial alors que la progestérone transforme le tissu en prolifération en tissu sécrétoire, propice à l'implantation [17]. C'est ce processus qui, lorsque déséquilibré, peut mener à l'hyperplasie du tissu endometrial et conduire au développement du cancer. Les hormones de remplacement à la ménopause sans progestatif seraient associées à l’adénocarcinome de l'endomètre [18-19-20]. Toutefois, l'ajout de progestatif diminue de façon significative l'incidence de l’adénocarcinome de l'endomètre [21-22-23]. La majorité des facteurs de risque peuvent être expliqués par l'hypothèse de non opposition aux estrogènes par des niveaux suffisants de progestérone naturelle ou synthétique [24-25]. Un déficit en progestérone chez la femme, causé par l'anovulation, l'absence de prise de progestatif exogène ou encore la sous-expression du récepteur de la progestérone dans l'endomètre, prédisposerait la femme à ce type de cancer. [25] Différentes études ont examiné les niveaux de progestérone chez des femmes atteintes ou non d’adénocarcinome de l'endomètre. Certaines n'ont trouvé rien de significatif alors que d'autres ont révélé des taux de progestérone moins élevés chez les femmes atteintes de ce type de cancer [26-27-28-29]. D'autres recherches sont nécessaires pour établir si les taux sériques de progestérone pourraient servir à la détection ou comme marqueur de risque d’adénocarcinome de l'endomètre, ce qui constituerait un biomarqueur pour ce cancer. Par ailleurs, des études ont démontré que la progestérone pouvait renverser divers degrés d'hyperplasies du tissu endometrial en phénotype normal et même entraîner une régression de la lésion. [30-31]
Présentement, les progestatifs sont surtout utilisés pour prévenir l'apparition de l’adénocarcinome de l'endomètre, par la prise de contraceptifs oraux ou
15
d'hormones de remplacement à la ménopause avec progestatifs, ou pour favoriser la rémission complète de ce cancer suite à des traitements d’hormonothérapies.
c. Tamoxifène :
Le tamoxifène est utilisé depuis une trentaine d'années pour son intérêt adjuvant dans le traitement du cancer du sein.
On lui reconnait cependant, des effets délétères, notamment au niveau de l'endomètre.
En effet cet anti estrogène de synthèse est désormais reconnu pour favoriser l'adénocarcinome de l'endomètre. [32]
Au total, il existe actuellement un consensus général pour estimer que les traitements par tamoxifène augmentent le risque d’adénocarcinome de l’endomètre d’un facteur de l’ordre de 2 à 3 chez les femmes ménopausées. [33]
d. Les androgènes plasmatiques :
Plusieurs études ont montré que le risque de l’adénocarcinome de l’endomètre augmente chez les femmes pré et post ménopausées avec l’augmentation du taux plasmatique des androgènes. [33-34-35]
Les androgènes servent de précurseurs à la synthèse des estrogènes. En effet, l'étape menant à la formation des estrogènes est catalysée par l'enzyme aromatase (CYP 19) qui transforme de façon irréversible l’androstènedione et la testostérone en estrone et en œstradiol, respectivement. Ces deux androgènes sont principalement produits par les glandes surrénales et sont surtout aromatisés dans les ovaires chez la femme pré-ménopausée et seulement dans les tissus extra-ovariens chez la femme ménopausée (tissus adipeux, peau, muscles, glandes mammaires, utérus, etc.). [36-37-38]
16
Il est démontré que les niveaux d'androstènedione sont significativement plus élevés chez les femmes ménopausées atteintes d’adénocarcinome de l'endomètre comparé aux femmes en santé (2.65 vs 2.16 nmol/L) alors que les niveaux de testostérone ne semblent pas affectés (0.20 vs 0.24 nmol/L). [39-40]
e. Insuline
L’hyperinsulinisme chronique est un facteur de risque important de l’adénocarcinome de l’endomètre en période de pré et post ménopause. Ceci peut être expliqué par son action à 2 niveaux :
Au niveau de l’endomètre : l’insuline stimule le développement tumoral par la diminution du taux de l’IGBP-1 et donc l’augmentation de l’activité de l’IGF-1, mais il peut également agir directement par l’intermédiaire de ses récepteurs au niveau de l’endomètre.
Au niveau ovarien : l’hyperinsulinisme chronique favorise le développement de l’hyperandrogénisme ovarien avec une anovulation et déficit en progestérone. [35-41]
2. L'obésité :
L’obésité augmente le risque d’adénocarcinome de l’endomètre par une modification au niveau des hormones sexuelles endogènes notamment (œstrogènes et progestérone). [42]
Chez les femmes pré ménopausées, la principale source des œstrogènes circulants est la production ovarienne, l’obésité a un faible effet sur la concentration de l’œstradiol mais, c’est une cause de l’augmentation de la fréquence des cycles menstruels irréguliers et anovulatoires résultant de la réduction de la phase lutéale progestéronique.
17
Chez les femmes ménopausées, l’obésité augmente énormément l’exposition aux œstrogènes par augmentation de l’aromatisation des androgènes en œstrogènes dans les tissus graisseux. Egalement, les femmes obèses ont un taux bas de SHBG (sex hormon binding globulin), ce qui entraîne une augmentation de l’activité biologique des œstrogènes. [43-44-45]
3. Le diabète et l'hypertension : [46]
On retrouve trois fois plus de diabète que dans la population générale. L'hypertension est un terrain classique. Il est dû à l’âge et aussi à l'obésité.
4. Histoire familiale : [47]
Le syndrome de Lynch, responsable de 3 % des adénocarcinomes de l’endomètre.
C’est une maladie autosomique dominante, à pénétrance variable et dont la fréquence se situe entre 1/500 et 1/1 000. Dans ce syndrome, le cancer le plus fréquent est le cancer colorectal (syndrome HNPCC : « hereditary non polyposis colorectal cancer »).
Le deuxième cancer est l’adénocarcinome de l’endomètre [9]. Puis sont décrits des cancers des ovaires, de l’intestin grêle, des voies biliaires et urinaires.
III- RAPPEL ANATOMO-PATHOLOGIQUE :
A- Classification :Il existe 2 types d’adénocarcinome endométrial : oestrogèno dépendant et indépendant.
-type 1 : Il consiste en un adénocarcinome endométrioïde bien (G1) ou moyennement différencié (G2) et provient d’une série de lésions hyperplasiques
18
précurseurs. Ces lésions sont liées à l’état d’hyperestrogénie relatif (de la péri ménopause, aggravé par l’obésité) ou réel (prescription d’œstrogènes seuls). Ce type de tumeur survient en pré- ou péri ménopause, souvent découvert à un stade précoce d’œstrogèno dépendant, essentiellement endomètrioide, correspond à 80% à 85 % des cas.
-type 2 : Elles sont composées souvent d’adénocarcinome endométrioïde peu différencié (G3) les adénocarcinomes séreux ou a cellules claires. Elles se développent souventdans un environnement d’atrophie endométrial.
Type I Type II
Hyperœstrogènie Présente Absente
Ménopause Pré- et péri-ménopause Poste-ménopause
Précurseur Hyperplasie atypique Carcinome intraépithélial
Grade histologique Bas Élevé
Infiltration myomètriale Souvent superficielle Souvent profonde
Type histologique Endométrioïde Séreux ou cellules claires
Evolution Indolente Agressive
Génétique Mutation de PTEN Mutation de P53 Instabilité microsatellitaire Inactivation P16 Mutation K-ras, B-catenin Surexpression HER-2 Tableau 1 : classification histogénétique des adénocarcinomes endométriaux [2].
L’hyperplasie endométriale, souvent associée aux adénocarcinomes de type 1, en devient le précurseur, notamment dans sa forme atypique définie comme une lésion proliférative comportant des anomalies architecturales et des atypies cytologiques. [8]
La classification de la société internationale de gynéco pathologie adoptée par l’OMS divise les hyperplasies en 2 groupes :
-Hyperplasie simple (glandulokystique) : le revêtement endométrial est épaissi par la prolifération du tissu glandulaire de l’endomètre avec de multiples
19
kystes, le stroma alentour comporte souvent de volumineux vaisseaux à paroi mince.
-Hyperplasie complexe : existe également une prolifération des glandes, elles peuvent être tellement serrées les unes contre les autres que l’on se distingue presque plus de stroma entre elles.
- tous les types d’hyperplasie sont souvent associés au risque augmenté de carcinome de l’endomètre, ce risque est faible en cas d’hyperplasie simple, plus élevé en cas d’hyperplasie complexe et maximale en cas d’hyperplasie complexe avec atypies cytonucléaires importantes. [48]
20
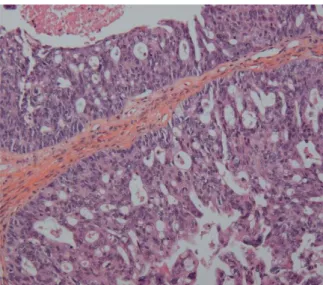
Figure 5 : Adénocarcinome endomètrioïde type I, de grade II (HES×20).
21
B- Grading : [3]
Le grade histopronostique est uniquement appliqué à l’adénocarcinome de type I, le type II étant considéré d’emblée de haut grade.
Ce grade, défini par la Fédération internationale de gynécologie obstétrique (FIGO), est basé sur l’architecture et les atypies cytonucléaires.
Tout d’abord, on classe l’architecture : -G1 : inférieurà5%de zones solides. - G2 : entre 6 et 50 % de zones solides. -G3 : supérieur à 50 % de zones solides.
Puis, si les atypies cytonucléaires sont très importantes, G1 passe en G2 et G2 en G3.
C- Stadification :
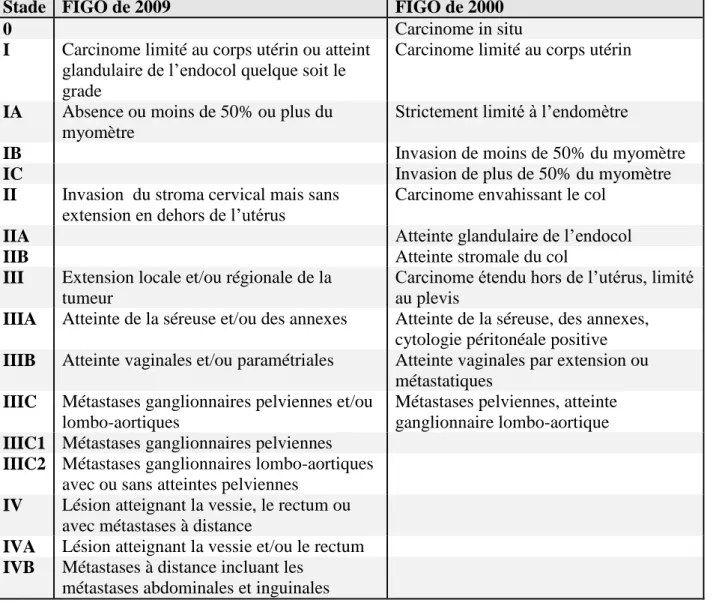
Le stade tumoral est rapporté selon les critères de la classification de l’International Federation of Gynecology and Obstetrics (FIGO) dans la plupart des centres et non pas selon la classification TNM de l’UICC de 2002. La classification de la FIGO a été actualisée en 2009 et fait suite à la version précédente datant de 2000 (Tableau). [49]
22
Stade FIGO de 2009 FIGO de 2000
0 Carcinome in situ
I Carcinome limité au corps utérin ou atteint glandulaire de l’endocol quelque soit le grade
Carcinome limité au corps utérin
IA Absence ou moins de 50% ou plus du myomètre
Strictement limité à l’endomètre
IB Invasion de moins de 50% du myomètre
IC Invasion de plus de 50% du myomètre
II Invasion du stroma cervical mais sans extension en dehors de l’utérus
Carcinome envahissant le col
IIA Atteinte glandulaire de l’endocol
IIB Atteinte stromale du col
III Extension locale et/ou régionale de la tumeur
Carcinome étendu hors de l’utérus, limité au plevis
IIIA Atteinte de la séreuse et/ou des annexes Atteinte de la séreuse, des annexes, cytologie péritonéale positive
IIIB Atteinte vaginales et/ou paramétriales Atteinte vaginales par extension ou métastatiques
IIIC Métastases ganglionnaires pelviennes et/ou lombo-aortiques
Métastases pelviennes, atteinte ganglionnaire lombo-aortique
IIIC1 Métastases ganglionnaires pelviennes IIIC2 Métastases ganglionnaires lombo-aortiques
avec ou sans atteintes pelviennes
IV Lésion atteignant la vessie, le rectum ou avec métastases à distance
IVA Lésion atteignant la vessie et/ou le rectum
IVB Métastases à distance incluant les métastases abdominales et inguinales
Tableau 2 : Critères de la classification de l’International Federation of Gynecology and Obstetrics (FIGO).
En effet, l’évaluation des facteurs pronostiques constitue une étape majeure de la prise en charge. Elle permet d’adapter le traitement adjuvant afin de ne pas sur traiter les formes de pronostic favorable et à l’inverse d’optimiser le traitement des formes à risques de récidive. [49]
23
D- Les sous types histologiques :
Les adénocarcinomes de l’endomètre sont divisés en deux grands groupes histologiques : les adénocarcinomes de type 1 (endométrioïdes) qui bénéficient d’un bon pronostic et les types 2 (séreux, à cellules claires) dont le pronostic est plus réservé.
Type 1 :L’adénocarcinome endométrioïde ressemble sur le plan morphologique à un endomètre en phase proliférative. Dans cette forme, il est possible d’observer une différenciation épidermoïde, séreuse, mucineuse ou à cellules claires concernant moins de 10% des cellules. [50]
Il est le plus souvent d’architecture tubulo-glandulaire, parfois en nappes confluentes. Les cellules tumorales sont cylindriques, stratifiées et présentent des atypies cytonucléaires variées. [2]
Vingt à trente pour cent des tumeurs de type 1 présentent une instabilité des microsatellites [51] et on observe une mutation de Pten chez près de la moitié de ces patientes. Des mutations de Kras2 et de b-caténine et des polyploïdies sont également décrites dans la caractérisation moléculaire de ces tumeurs [52-53]
Type 2:L’adénocarcinome endométrial de type 2 est une forme
indépendante de l’imprégnation œstrogénique. Il rassemble les adénocarcinomes à cellules claires, les adénocarcinomes papillaires séreux. Il se déclare chez des patientes non obèses après l’âge de 70 ans.
Ce type de cancer se développe sur une muqueuse endométriale atrophique comportant des lésions de carcinome séreux intra-épithélial (endometrial intraepithelial carcinoma, EIC). [54-55]
24
Histologiquement :
-Adénocarcinome séro- papillaire: constitué par une prolifération tumorale d’architecture papillaire ou solide avec calcasphérites .les atypies cytonucléaires sont marquées avec de nombreuses mitoses.
Ce type de cancer est agressif, et considéré comme une lésion de haut grade. Il est souvent associé avec une invasion vasculaire, une invasion myométriale profonde, une colonisation lymphatique fréquente, une extension à la séreuse, à l'épiploon et une atteinte à distance parfois généralisée d'emblée. [56]
-Adénocarcinome à cellules claires : comporte un polymorphisme architectural et cellulaire :
-l’architecture peut être papillaire, glandulaire ou solide. -les cellules tumorales peuvent être claires, ou oxyphiles.
Ce type a une tendance agressive avec envahissement du myomètre et des vaisseaux dans plus de 25% des cas.
Son pronostic est plus mauvais que l’adénocarcinome endométrioïde et
25
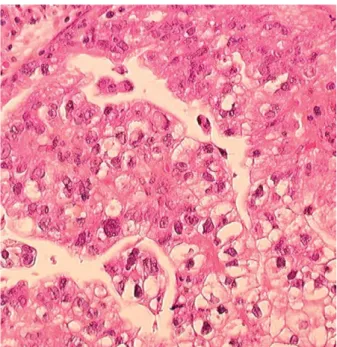
Figure 7 : Adénocarcinome à cellules claires (HES×40).
26
MATERIEL ET
METHODES
27
Il s’agit d’une étude rétrospective portant sur quatorze dossiers de l’adénocarcinome de l’endomètre effectué au service de chirurgie de l’institut national d’oncologie de rabat, durant une période de 2 ans du 1er Janvier 2012 au 31Décembre 2013.
Afin de réaliser ce travail, on s’est basé sur les renseignements recueillis à partir:
Du Registre d’anatomo-pathologique:
Il fournit pour chaque cas les données suivantes : nom et prénom de la malade, date d’entrée, numéro d’entrée, geste effectué, et le résultat d’anatomie pathologie.
Des dossiers médicaux des malades : Ils permettent de recueillir les éléments suivants : nom et prénom de la malade, diagnostic d’entrée et de sortie, l’observation clinique, les examens complémentaires effectués et leurs résultats, traitement et le compte rendu opératoire, suites post opératoires immédiates, résultats de l’anatomie pathologique de la pièce opératoire et l’évolution clinique.
Pour mieux étudier les différents aspects épidémiologique, clinique, para-clinique, et thérapeutique, on a classé ces renseignements en tableau comportant les paramètres suivants :
- L’âge de la malade - Les antécédents
- La clinique et paraclinique - Le traitement chirurgical
- Le compte rendu anatomopathologique - Evolution
28
REPERTOIRE DES CAS : tableaux
CAS AGE LES ANTECEDENTS
DELAIS DE CONSULT ATION SIGNES CLINIQUES ECHOGRAPHIE 1 46 ans - G0 P0 - Non ménopausée - Fibrome sous séreux de l'endomètre (2003) 12mois -métrorragies - douleur pelvienne - dysménorrhée - utérus poly-myomateux -endomètre de 14 mm d’épaisseur 2 60 ans - G0 P0 - ménopausée 10 mois - métrorragies de faible abondance - conservation de l'état générale - processus lésionnel tissulaire échogène très vascularisé intra cavitaire de 3 cm
3 65 ans - ménopausée depuis 12
ans 12 mois - métrorragies _ 4 83 ans - ménopausée - G8 P8 - HTA
- cataracte opérée (l'œil gauche)
24 mois
- métrorragies de moyenne abondance - leucorrhées fétides -ex :pas de masse
- Hematométrie - endomètre hypertrophique 5 73 ans - ménopausée - G12 P11 - HTA _ - métrorragies
-ex : utérus augmenté de volume _ 6 56 ans - G0 P0 - ménopausée depuis 6 ans -célibataire 5 mois - métrorragies abondantes _ 7 47 ans - non ménopausée - HTA 18 mois
- métrorragies - présence d'une lésion échogène, homogène de siège fundique paraissant se développer au niveau de l'endomètre
8 41 ans
- non ménopausée - opérée pour pelvi péritonite secondaire à une masse ovarienne droite rompue
_ _
- masse latèro-utérine droite d'écho structure mixte + épanchement minime dans le cul de sac de douglas 9 68 ans - G10 P9 - ménopausée - opérée en 2004 pour _
-douleur pelvienne - endomètre épaissi en faveur d'une hypertrophie glandulaire
29
Tableau 3 : caractéristiques cliniques des patientes. néo du sein droit
- mise sous radiothérapie + hormonothérapie (tamoxifène) -CO pendant un an -endométrite tuberculeuse traité en 2008 10 67 ans - G6 P4 - ménopausée 4 mois - métrorragies -examen : saignement _ 11 61 ans - G7 P6 - ménopausée depuis 13 ans 6 mois - métrorragies - altération de l'état général
-TV : col vaginal siège d’une végétation _ 12 43 ans - non ménopausée -G0P0 -mariée 4 mois - troubles menstruels - leucorrhées fétides -ex : masse latéro-utérine -masse latéro-utérine droite 13 28 ans - G0 P0 -célibataire -non ménopausée _ - métrorragies de moyenne abondance _ 14 63 ans -G0P0 -ménopausée
-suivie depuis 2002 pour néo du sein : Patey+ chimiothérapie+ radiothérapie -opérée pour masse ovarienne
_ -métrorragies de moyenne abondance -douleur pelvienne -brulures mictionnelles -ex : utérus augmenté de taille, gros polype accouché par le col, pédiculé.
-lésion hétérogène de la face antérieure de l’endomètre
30 CAS TDM THORACO-ABDOMINO PELVIENNE RADIOGRAP HIE DU POUMON IRM DIAGNOSTIQUE HISTOLOGIQUE
1 -Utérus polymyomateux Normale _ _
2 Normale _
Processus lésionnel occupant la cavité utérine avec infiltration du myomètre à moins de 50% ADK endomètroide bien différencié 3 - utérus globuleux
- absence de localisation secondaire décelable Normale _ ADK papillaire séreux infiltrant 4 - processus intra-cavitaire sans atteinte ganglionnaire ni localisation secondaire à distance
- syndrome
interstitiel _
ADK endomètroide bien différencié
5 - lésions intra-cavitaire utérine sans extension aux organes de voisinage _ _ ADK papillaire séreux
6 Normale Normale _ ADK endomètroide
bien différencié
7
- en faveur d'une tumeur de l'endomètre avec infiltration myomètriale probable _ _ ADK endomètroide villo-glandulaire 8 _ Normale _ _ 9 - présence de micronodules pulmonaires
- absence de processus évolutif
Normale _
ADK endomètroide moyennement différencié
10 - utérus globuleux augmenté de taille Normale _ ADK endomètroide bien différencié
11 Normale _ _ ADK endomètroide
bien différencié
12 - masse latéro-utérine gauche tissulaire hétérogène _ _ ADK endomètroide bien différencié
13 Normale Normale _ ADK séreux de l’endomètre
14 Normale Normale _ ADK endomètroide bien différencié Tableau 4 : Diagnostic et bilan d’extension.
31 CAS CHIRURGIE QUALIT E DE LA CHIRUR GIE COMPLICA TIONS DE LA CHIRURGIE ANATOMOPATHOLOGIE DE LA PIECE PERATOIRE GRAD E HISTO LOGIQ UE STADE DE LA FIGO
1 HT totale curative Non
ADK endomètroide bien
différencié sans envahissement du myomètre Grade I Stade Ia 2 hystérectomie totale + annexectomie bilatérale curative Non
ADK endomètroide bien différencié infiltrant mois de 50 %
du myomètre
Grade I Stade IIa
3 Colpo-hystéréctomie totale + curage pelvien bilatéral curative Non
ADK infiltrant l'endomètre et plus de 50% du myomètre avec
extension à l'isthme et au col utérin et invasion du chorion Grade II StadeII 4 Colpo-hystérectomie totale+curage latéro-pelvien droit et gauche curative Non
ADK endomètroide infiltrant plus de 50 % du myomètre, l'isthme et s'étendant au col utérin dépassant le chorion cervical, EV + Grade II Stade II 5 Colpo-hystérectomie totale +curage pelvien curative Non
ADK papillaire séreux de l'endomètre EV+, infiltration de plus de 50 % du myomètre s'étendant à l'isthme,l'endocol et les cornes utérines droites et gauches, curage ganglionnaire(-)
Grade III stade II 6 HT +annexectomie bilatérale+cura ge ganglionnaire curative Non
ADK endomètroide infiltrant moins de 50 % du myomètre, EV + au niveau de l'isthme et
paramètre, curage ganglionnaire (-)
grade III Stade I
7 hystérectomie
totale curative Non
ADK endomètroide infiltrant l'endomètre et moins de 50% du
myomètre grade I Stade Ia
8 Colpo-HT totale + annexectomie gauche +curage ganglionnaire curative Non
ADK endomètroide infiltrant l'endomètre et plus de 50% du myomètre, avec extension au site
32
Tableau 5 : Traitement chirurgical, anapath définitive et stade de FIGO.
9
HT +Annexectomie
bilatérale
curative Non
ADK endomètroide infiltrant
moins de 50% du myomètre grade I Stade I
10 HT +curage ganglionnaire pelvien curative Non ADK endomètroide grade II _ 11 Colpo-hystérectomie totale +curage pelvien _ _
ADK séreux de l'endomètre de haut grade étendu sur plus de 50% du myomètre, infiltre l’isthme, corne gauche, endocol et ovaire gauche
grade III Stade IIIa
12 HT +AB+
+curage pelvien curative Non
ADK endomètroide de 4,4 cm de grand axe, infiltrant l'endomètre et moins de 50% du myomètre avec extension à l'isthme et la corne utérine gauche, curage pelvien (-)
grade II Stade I 13 HT+AB+Omen tectomie+ curage ganglionnaire curative Non
ADK endomètroide infiltrant moins de 50% du myomètre, curage ganglionnaire (-),ovaire normal grade II stade Ic 14 hystérectomie totale+ curage ganglionnaire curative Non
ADK endomètroide infiltrant plus de 50% du myomètre, curage ganglionnaire( -)
33
CAS TRAITEMENT
COMPLEMENTAIRE
EVOLUTION (RECUL) EN MOIS
1 radiothérapie externe (23 séances)
curiethérapie (2fractions) 10 mois 2 radiothérapie externe (23 séances)
curiethérapie (2fractions) 24 mois (bonne évolution) 3 radiothérapie externe (23 séances)
curiethérapie (2fractions) 12 mois (bonne évolution) 4 radiothérapie externe (23 séances)
curiethérapie (2fractions) 16 mois (bonne évolution) 5 radiothérapie externe (23 séances)
curiethérapie (2fractions) 22 mois (bonne évolution)
6 radiothérapie externe (23 séances)
curiethérapie de barrage vaginale 26 mois (bonne évolution) 7 radiothérapie externe (23 séances)
curiethérapie (2fractions) 10 mois (bonne évolution)
8 _ 10 mois
9 radiothérapie externe (23 séances)
curiethérapie (2fractions) 10 mois (bonne évolution)
10 _ 20 mois (bonne évolution)
11 radiothérapie externe (23 séances)
curiethérapie de barrage pelvien 12 mois 12 curiethérapie (03 séances) 08 mois
13 chimiothérapie 14 mois (bonne évolution) 14 Radiothérapie externe
curiethérapie 06 mois
34
35
I-
EPIDEMIOLOGIE :
A- Age :
L’âge moyen de nos patientes, lors de la découverte de l’adénocarcinome de l’endomètre est de 55.5 ans avec des âges extrêmes entre 28 et 83 ans.
B- Antécédents
1. Médicaux-chirurgicaux :
-L’obésité a été mentionnée dans les dossiers chez 06 patientes, soit (42,8%) des cas.
-On note 03 patientes hypertendues et sous traitement médical soit (21,4%) des cas.
-une patiente avait une endométrite tuberculeuse et traitée il y a 5 ans (Patiente N° 9).
-un cas d’intervention pour une cataracte gauche (Patiente N° 4) 2. Gynéco-obstétricaux :
-Dans notre série, on a trouvé que cinq patientes sont multipares soit (35,8%) des cas avec une parité moyenne est de 7.6, six patientes sont nullipares soit (42.8%) des cas et trois autres patientes dont la parité n’est pas mentionnée dans les dossiers ce qui représente (21,4%) des cas.
- Deux patientes sont célibataires (patientes N°6 et 13) - Une patiente présente une stérilité (patiente N°12°)
- Neuf patientes sont ménopausées depuis au moins 4 ans soit (64,2%) - Une patiente était sous contraception orale (patiente N°9)
36
3. Les antécédents néoplasiques
Dans notre série, il y a deux patientes qui ont un antécédent de cancer du sein dont une a fait l’objet d’une intervention de type Patey associée à une
Chimiothérapie et une radiothérapie (patiente N° 14), et l’autre a bénéficié d’un Patey associé à une radiothérapie et une hormonothérapie (patiente N°9).
4. Les antécédents familiaux
- Aucune patiente n’avait des antécédents familiaux d’adénocarcinome de l’endomètre.
II-
ETUDE CLINIQUE
A. Délai du diagnostic (Tableau)
Le délai entre le début des symptômes et le diagnostic est très variable allant
De quatre mois à 24 mois avec une moyenne de 10 mois. Tableau : délai diagnostique
Délai du diagnostic Nombre des cas Pourcentage %
< 6 mois 03 33.4%
≥ 6 mois ET < 1 an 02 22.2%
≥ 1 an 04 44.4%
Tableau 7 : Délai diagnostique.
On constate que les deux tiers des patientes consultent après six mois. Le délai diagnostic peut être expliqué par la négligence de la patiente au premier symptôme ou par la latence clinique et la lenteur d'évolution.
37
B. Circonstances de découverte (Voir tableau) 1. Métrorragies
Les métrorragies constituent le premier symptôme rencontré dans 78% des cas, elles sont de faible ou de moyenne à grande abondance.
Elles sont isolées et constituent la seule circonstance de découverte dans 50% des cas.
Ce signe clinique a une grande valeur d’orientation diagnostique surtout chez les femmes ménopausées.
2. Douleurs pelviennes
Elles sont souvent associées aux métrorragies. Retrouvées dans 21.4% des cas.
3. Les leucorrhées
Elles sont présentes dans 14.2% des cas, associées aux métrorragies et aux douleurs pelviennes.
4. Autres signes cliniques
AEG et signes urinaires sont rencontrés dans 14.2% des cas. Ces signes témoignent souvent des formes évolués.
C. Examen physique :
- Un utérus augmenté de taille a été retrouvé chez 2 patientes - Une masse pelvienne a été retrouvée chez 3 patientes
Tableau : prévalence des signes cliniques au moment du diagnostic de l’adénocarcinome de l’endomètre.
38
Signes cliniques Nombres des cas Pourcentage %
Métrorragies 11 78 %
Douleurs pelviennes 03 21.4%
Leucorrhées 02 14.2%
utérus augmenté de taille 02 14.2%
Masse utérine 03 21.4%
AEG 01 7.2%
Signes urinaires et/ou digestifs 01 7.2%
Tableau 8 : la fréquance des signes cliniques.
III-
BILAN PARACLINIQUE :
A. à visée diagnostique : 1. L’échographie pelvienneRéalisée chez 9 patientes il s’agissait d’une échographie par voie endovaginale ou sus pubienne et qui avait montré :
- chez 3 patientes : la présence d’une lésion tissulaire hétérogène. - chez 2 patientes : une masse latéro-utérine.
-chez 2patientes : une hypertrophie glandulaire. -chez une patiente : un utérus polymyomateux. 2. TDM abdomino-pelvienne :
Elle a été pratique chez 13 patientes et avait objectivé: - chez 5 patientes : un processus lésionnel intra utérin - chez 2 patientes : un utérus globuleux
39
- chez 1 patiente : un utérus polymyomateux - chez 1 patiente : une masse latéro-utérine -chez 1 patiente : une tumeur de l’endomètre - chez 3 patientes : La TDM était sans particularité 3. Imagerie par résonnance magnétique
Dans notre série, réalisée chez une seule patiente. Elle a mis en évidence un processus lésionnel occupant la cavité utérine.
4. Curetage biopsique de l’endomètre sous hystéroscopie
Dans notre série, 12 patientes ont bénéficié de cet examen et il a permis de faire le diagnostic de l’adénocarcinome de l’endomètre dans 100% des cas.
Le résultat de la biopsie a mis en évidence :
- un adénocarcinome endométroide bien différencié chez 08 patientes. - un adénocarcinome endométroide moyennement différencié chez 1 patiente.
- un adénocarcinome papillaire séreux chez 3 patientes.
-pas de cas d’adénocarcinomes à cellules claires dans notre série. 5. Examen extemporané : n’a pas été réalisé chez nos patientes.
B. Bilan d’extension : a comporté en plus de l’examen clinique : - La radiographie pulmonaire : réalisée chez 9 patientes de notre série dans le cadre du bilan d’extension et le bilan préopératoire, pour les 4 autres patientes elle pas été mentionnée dans les dossiers. La radiographie était normale chez 8 patientes sauf le cas N° 4 elle a montré un syndrome interstitiel.
40
- L’échographie abdominale : réalisée chez toutes nos patientes, elle était sans particularité.
- TDM abdominale : réalisée chez toute nos patientes, n’a pas révélé la présence de métastases viscérales ou un envahissement d’organes de voisinage à l’exception de la patiente N°4 dont la TDM a révélé la présence de micronodules pulmonaires.
- L’UIV : n’a été pratiqué chez aucune patiente.
Au terme de ces bilans cliniques et para cliniques, le diagnostic positif de l’adénocarcinome de l’endomètre a été posé chez 12 patientes parmi les 14 patientes de notre série, il s’agissait d’un diagnostic histologique obtenu après 12 cas de curetage biopsique de l’endomètre après hystéroscopie diagnostique.
Pour les 2 autres cas, le diagnostic de l’adénocarcinome de l’endomètre a été obtenu grâce à l’examen anatomo-pathologique de la pièce opératoire.
IV- CONDUITE THERAPEUTIQUE : A- Traitement chirurgical :
Dans notre série le traitement chirurgical a représenté toujours la référence thérapeutique, toute les patientes ont bénéficié d’une chirurgie.
La colpo-hystérectomie totale a été effectuée chez 05 patientes. L’hystérectomie totale a été réalisée chez 09 patientes.
Toutes les patientes de notre série ont bénéficié d’une annexectomie bilatérale.
L’omentectomie a été réalisé chez une seule patiente (n°13)
10 patientes parmi 14 ont bénéficié d’un curage ganglionnaire pelvien. Aucune patiente n’a bénéficié d’un curage lomboaortique.
41
B. Le compte rendu anatomo-pathologique : Les types histologiques retrouvés sont :
- l’adénocarcinome endomètrioide bien différencié dans 71.4% des cas - l’adénocarcinome endomètrioide moyennement différencié dans 7.2% des cas.
- l’adénocarcinome papillaire séreux dans 21.4% L’infiltration myomètriale était :
-superficielle dans 46%des cas. - profonde dans 46% des cas.
- Et dans 08% il n’y avait pas d’envahissement du myomètre.
Pour le grade histologique, on note 28,5% de grade1, 50% de grade 2, 21,5% de grade 3.
Les stades tumorales retrouvés selon la classification de la FIGO est 57% pour le stade I, 28,5% pour le stade II, et 14.25 % pour le stade III (voir tableau).
Stade tumoral Nombre des patientes Pourcentage %
Stade I 08 57 %
Stade II 04 28,5 %
Stade III 02 14.25 %
Stade IV 00 00
Tableau 9 : les différents stades tumoraux dans notre série.
Dans notre série, on note que les stades I et II sont les plus représentés ce qui constitue un facteur de bon pronostic.
42
B. La Radiothérapie :
10 patientes ont bénéficié d’une radiothérapie externe post opératoire associée à une curiethérapie soit 84% des cas.
Une patiente a été mise sous curiethérapie seule.
C. chimiothérapie :
Une seule patiente a reçu des cures de chimiothérapie dans notre série.
D. Evolution :
Après un recul moyen de 14 mois avec des extrêmes allant de 06 à 22 mois - L’évolution était favorable chez toutes les patientes avec un bon contrôle locorégional.
43
44
I- EPIDEMIOLOGIE :
A- Incidence :L’adénocarcinome de l’endomètre est le plus fréquent des cancers gynécologiques dans le monde occidental. En 2012 aux Etats-Unis, on a estimé à 47 130 le nombre de nouveaux cas d’adénocarcinome de l’endomètre et ce dernier a été responsable de 8010 décès [321]. En France, il est le 5eme cancer féminin en termes d’incidence avec 6560 nouveaux cas estimés en 2010. [322]
L’incidence de l’adénocarcinome de l’endomètre est faible dans les pays en voie de développement.
En France, la probabilité pour une femme d'avoir un adénocarcinome de l’endomètre pendant sa vie (80 ans) est de 1,7 % (1 femme sur 57). Ce cancer est extrêmement rare avant 35 ans. Le taux d'incidence augmente avec l'âge pour atteindre des taux de 53 pour 100 000 chez les femmes de plus de 64 ans. Ce taux d'incidence est stable depuis 1975. [228]
A l’échelle nationale :
-dans le registre de rabat, l’adénocarcinome de l’endomètre est le 5ème cancer gynécologique, sa fréquence est 3,4% des cancers gynécologiques enregistrés en 2005. [329]
-dans le registre de Casablanca, l’adénocarcinome de l’endomètre est le 7ème cancer gynécologique, représente 2,8% de l’ensemble des cancers féminins.[330]
- dans le registre du centre Hassan II de Fès, la proportion de l’adénocarcinome de l’endomètre était environ 6,7% de l’ensemble des cancers gynécologiques enregistrés entre 2004 et 2007.
Les résultats de la littérature confirment nos résultats, l’incidence de l’adénocarcinome de l’endomètre au Maroc est proche de celle retrouvées dans
45
les pays en voie de développement, mais elle est plus faible que celle retrouvées dans les pays occidentaux. (Tableau)
Dans notre série on a recueilli 14 cas d’adénocarcinome de l’endomètre durant une période de 2 ans (2012 et 2013)
Pays Incidence pour 100 000
USA (Almeda, CA : population blanche) 45,8
Allemagne (Sarre) 33,8
Nouvelle-Zélande (Maoris) 28,8
Suisse (Genève) 23,6
Canada (Alberta) 21,1
USA (Almeda, CA : population noire) 19,3
Mante 17,8 Suède 16,8 Finlande 13,4 Pologne (Varsovie) 13,2 Roumanie (Timis) 12,4 Royaume-Uni (Liverpool) 12,0 Porto Rico 8,4 Colombie (Cali) 7,0 Singapour 6,8 Espagne (Saragosse) 5,8 Brésil (Recife) 3,0 Inde (Bombay) 1,8 Japon (Miyagi) 1,7
46
B- Les facteurs de risque : 1- L’âge :
L’adénocarcinome de l'endomètre est un cancer de la femme âgée. Philippe et Charpin [57] ainsi que Truc et al. [58] situent l'âge moyen entre 59-60 ans. D'autres études [59] révèlent un âge moyen de 57,5 ans, et 2 % des cas avant 40 ans dont un diagnostiqué à l'âge de 12 ans.
Dans la série d’Agostini et al.[60] la moyenne d’âge des patientes était de 53,4 ans (extrêmes : 45–76 ans).
En comparant nos résultats aux données de la littérature, on constate que notre série rejoint la littérature avec des âges extrêmes entre 28 et 83 ans et un âge moyen est de 55.5 ans.
2- Facteurs raciaux et régionaux :
Letaux d'incidence est supérieur dans la population blanche par rapport aux populations noires ou asiatiques. Cependant le taux de mortalité chez la population noire est supérieur aux deux autres.
Par ailleurs il existe aussi des variations régionales au sein des groupes raciaux, l’incidence chez les femmes noires et asiatiques vivant aux états unis est beaucoup plus élevée que celle de leurs homologues dans d’autres pays.
Cette variation raciale suggère qu’il existe d’importants facteurs génétiques et environnementaux qui influencent le développement de l’adénocarcinome de l’endomètre. [61-62]
3- Les facteurs hormonaux :
L’adénocarcinome de l'endomètre est considérée comme une maladie hormono-dépendante.