FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2020
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Biotechnologies
Spécialité : Biotechnologie Microbienne
Présenté par :
BELGACEM Nesrine & SAOUD Roumaissa
Thème
L’influence des conditions d’extraction sur l’activité
coagulante de deux protéases fongiques : Essais de
fabrication du fromage EDAM
Soutenu le: 17/09/2020
Devant le jury composé de :
Nom et Prénom Grade
Mme. BOUTELDJA Razika MCB Univ. de Bouira Présidente
Mlle. BENSMAIL Souhila MAA Univ. de Bouira Promotrice
Mme. DJOUAHRA-FAHEM Djamila MAA Univ. de Bouira Examinatrice
Ce travail est l’aboutissement d’un dur labeur et de nombreux sacrifices. Tout d'abord, nous remercions Dieu Tout-Puissant, l’omniscient et le miséricordieux de nous avoir donné la force et la patience pour achever ce travail, qui nous a guidé sur le droit chemin et nous a donné la force, la patience, la volonté et la bonne santé pour achever ce travail.
Nous remercions vivement et chaleureusement notre promotrice Mme
BENSMAIL Souhila pour avoir accepté de diriger ce mémoire avec une grande rigueur scientifique. On vous remercie particulièrement pour toutes les heures, les jours et les mois que vous avez passé avec patience extrême à guider et corriger ce manuscrit et aussi pour sa disponibilité, ses conseils judicieux, ainsi son soutien qui ont contribué à la réalisation et l’accomplissement de ce travail.
Nos sincères remerciements vont aussi aux membres de jury pour l’honneur qu’ils auront fait en acceptant de juger ce travail :
À notre présidente de jury Mme BOUTELDJA Razika de nous avoir
fait l’honneur d’accepter la présidence du jury de mémoire et à l’examinatrice Mme DJOUAHRA Djamila pour avoir accepté d’examiner et
évaluer notre travail.
Également, nous tenons à remercier les techniciens des laboratoires de Biochimie et de Microbiologie de Département de Biologie.
Finalement, nous adressons notre reconnaissance à nos familles pour le support moral, l'encouragement et la compréhension qu'elles nous ont
offerts tout au long de nos études.
Au terme de ce modeste travail, je tiens à remercier en premier lieu, Dieu tout puissant de m’avoir donné la Force et le courage
A mes très chers et adorables parents Mon père Aissa et ma très chère mère Hamida
pour leur amour, leur encouragement et leur soutien tout au long de mes études, que Dieu les bénisse.
A mes très chers frères Khalil et Ilyas
A mon futur mari Zaki qui m'a toujours soutenu dans mes choix A ma promotrice Mme Bensmail S.
A mon adorable binôme Roumaissa
À toutes mes amies, ma famille et ma belle-famille.
Nesrine
Dédicace
Avant tout, je remercie ALLAH, le miséricordieux, le tout puissant et le plus clément qui m’a aidé et m’a donné la force dans les moments difficiles d'éditer
ce mémoire.
Avec toute ma gratitude, je dédie cet humble travail de mes études, à tous mes proches, particulièrement :
Ma mère Zohra et mon Père Mohammed qu’ils trouvent ici le témoignage de ma profonde gratitude pour leur amour, leur encouragement et leur soutien tout au
long de mes études, que DIEU les bénisse
A ceux qui sont proches de mon cœur, mes adorables sœurs Yasmine et Ihssane. A ma chère promotrice Mme BENSMAIL S.
A mon cher binôme Nesrine, on a passé des bons moments ensemble que Dieu garde notre amitié pour toujours.
A tous mes collègues de promotion " Biotechnologie Microbienne". A tous mes amies.
A tous ceux que j’aime.
Liste des abréviations
AC: Activité coagulante
CMP: Caséine macro-peptide
GRAS: Generally Recognized As Safe HR: Humidité relative
LFB: Laiterie et Fromagerie de Boudouaou OMS: Organisation Mondiale de Santé p: poids
PDA: Potato Dextrose Agar pH: potentiel d’Hydrogène SmF: Submerged Fermentation SSF: Solid-state Fermentation T: Température
tr/min: tour par minute v: volume
Liste des figures
Figure 1 : Mécanisme général de l'action des enzymes protéolytiques...3
Figure 2 : Classification des fromages selon le type de coagulation...8
Figure 3 : Représentation schématique de la structure d'une micelle...10
Figure 4 : L'organisation des hyphes chez les moisissures...12
Figure 5 : Cycle de la reproduction sexuée et asexuée des moisissures...14
Figure 6 : Une représentation histologique du grain de blé...19
Figure 7 : Aspect macroscopique des cultures de M. circinelloides (à gauche) et R. stolonifer (à droite) sur milieu PDA âgées de 5-7 jours à 28°C...21
Figure 8 : Système de filtration adopté durant l'expérimentation pour la récupération des suspensions de spores de deux souches fongiques...22
Figure 9 : Préparation des milieux de fermentation pour chaque souche...23
Figure 10 : Aspect des milieux de fermentation avant de lancer la production des coagulants fongiques...24
Figure 11 : Effet de différentes concentrations en solution de MgCl2, NaCl, KCl et CaCl2 sur l'extraction de la protéase coagulante d’A. oryzae...26
Figure 12 : Effet de différents solvants sur l’extraction l'enzyme coagulant le lait produite par A. oryzae sur milieu solide...27
Figure 13 : Effet du volume de la solution du chlorure de calcium sur l'extraction de la protease coagulante d'A. oryzae...29
Liste des Tableaux
Tableau I : Avantages et inconvénients de la SSF par rapports la SmF...17
Tableau II : Composition du son de blé...19
Tableau III : Liste du matériel non biologique utilisé durant l'expérimentation...21
Tableau IV : Sélection du solvant d’extraction de la protéase de R. oryzae...25
Tableau V : Effet de trois solutions sur l’extraction de la protéase de R. oryzae...28
Tableau VI : Effet de la température sur l'extraction de la protéase coagulante d’A.oryzae..31
Tableau VII : Effet du pH de tampon phosphate 0,1 M sur l'extraction de la protéase de R. oryzae RO IIT RB-13...33
Liste des tableaux
SOMMAIRE
Introduction ...1
Chapitre I : Synthèse bibliographique 1. Protéases ...3
1.1. Définition ...3
1.2. Classification ...3
1.3. Source des protéases ...4
1.3.1. Protéases végétales...4
1.3.2. Protéases animales ...4
1.3.3. Protéases microbiennes...4
1.4. Principales applications des protéases ...5
2. Fromage ...6
2.1. Classification ...6
2.2. Fabrication du fromage ...8
2.3. La coagulation du lait ...9
2.3.1. Les caséines du lait...9
2.3.2. Mécanisme de la coagulation ...11
3. Moisissures...12
3.1. Définition ...12
3.2. Morphologie des moisissures ...12
3.3. Classification ...13 3.4. Cycle de vie ...13 3.5. Conditions de croissance...14 3.6. Genre Mucor...15 3.7. Genre Rhizopus ...16 4. Fermentation ...16 4.1. Définition ...16 4.2. Types de fermentation ...17
4.3. Avantages et inconvénients de la SSF ...17
4.4. Son de blé ...18
Chapitre II : Matériel et Méthodes 1. Matériel ...20
1.1 Matériel biologique ...20
1.2 Matériel non biologique ...20
2. Méthodes...21
2.1. Revivification des souches...21
2.2. Préparation des inocula...22
2.3. Production des coagulants fongiques ...22
2.4. Extraction des protéases ...24
2.5. Méthodes de dosage ...24
Chapitre Ⅲ : Résultats & discussion I. Effet de l’extraction sur l’activité coagulante ...25
I.1. Influence du type de solvant ...25
I.2. Influence du volume de solvant d’extraction...28
I.3. Effet du temps d’extraction ...30
I.4. Effet de l’extraction répétée ...30
I.5. Effet de la température d’extraction...31
I.6. Effet de l’agitation ...32
I.7. Effet du pH de solvant d’extraction ...32
II. Fabrication du fromage...33
Conclusion & perspectives ...36
Références Bibliographiques...38 Annexes
1
Introduction
L'utilisation des enzymes dans les processus de fermentation est connue depuis l'antiquité où plusieurs enzymes étaient appliquées dans la boulangerie, le brassage, la production du vin, la fabrication du fromage, etc. L’amélioration des connaissances et le développement des techniques analytiques ont démontré la capacité des enzymes à remplir une grande variété des fonctions non seulement dans l’industrie alimentaire, mais également dans plusieurs autres industries et domaines de recherche (Sharma et al., 2017).
La coagulation du lait est une étape majeure du processus de fabrication du fromage. Elle induit un changement critique de l’état liquide du lait à un état semi-solide viscoélastique sous l’action d’un agent coagulant (Derra et al., 2017). La présure animale, un mélange de deux enzymes (pepsine et chymosine) extrait à partir de l'estomac des jeunes veaux et autres ruminants, est l’agent coagulant traditionnellement appliqué dans la fabrication du fromage. Plusieurs protéases coagulant le lait, provenant de différentes origines, ont été étudiées dans le but de les utiliser comme des succédanés de la présure animale. La pénurie de cette dernière, son prix élevé ainsi que l’augmentation de la production du fromage sont les principaux facteurs qui ont stimulé ce domaine de recherche (Shah et al., 2014 ; Silva et al., 2014).
Actuellement, environ 70% du marché mondial des enzymes coagulant le lait sont représentés par la chymosine recombinante ou Fermentation Produced Chymosin (FPC) (Wei et al., 2016 ; Sundarrajet al., 2018) produite par des microorganismes génétiquement
modifiés (OGM) (E. coli, Kluyveromyces lactis, Aspergillus niger) (Corredig et Salvatore, 2016 ; Wei et al., 2016). Cette chymosine apparaît souvent sur les étiquettes des aliments comme « présure microbienne », qui ne reflète pas si la chymosine est produite naturellement (non OGM) par le micro-organisme ou si elle est le résultat d’un OGM (Feijoo-Siota et al., 2014).
Avec le débat développé sur la sécurité des produits génétiquement modifiés, des recherches approfondies ont été menées sur l’étude des protéases coagulant le lait produit naturellement (maintenant appelées coagulants) par certaines espèces de levures et de moisissures (Harboe et al., 2010 ; Mistry, 2012).
Tous les coagulants microbiens sont produits à l’échelle industrielle par fermentation sur milieu solide (ou Solid State Fermentation, SSF) ou liquide (Submerged Fermentation, SmF) et sont directement sécrétés dans le milieu de culture sous une forme diluée exempte de protéines cellulaires dans la plupart des cas de manière extracellulaire, ce qui simplifie
2
grandement les processus d’extraction et de purification (Harboe et al., 2010; Yegin et
al., 2011). Les champignons filamenteux ont été largement exploités par comparaison aux
bactéries, en raison de l’activité coagulante très élevée des protéases produites en grande quantité dans le milieu de fermentation, qui est dans la majorité des cas à base des déchets agroalimentaires, ce qui réduit considérablement les coûts de production (Silva et al., 2014).
Dans ce cadre, notre travail porte sur l’étude des protéases coagulant le lait produites par deux souches fongiques locales Mucor circinelloides et Rhizopus stolonifer. La fermentation sur milieu solide est le procédé choisi pour leur production. Deux objectifs sont visés par notre étude :
− Du fait de l’importance de l’étape d’extraction, différentes solutions seront testées afin de sélectionner la meilleure assurant la récupération d’un rendement important en protéases à partir du moût de la fermentation ;
− L’application des extraits enzymatiques de M. circinelloides et R. stolonifer dans des essais de production du fromage à pâte pressée non cuite type EDAM. Avant de procéder à la fabrication, une étape préliminaire de purification est visée afin d’améliorer la qualité des extraits fongiques.
Sur le point de commencer à avancer dans les manipulations afin d’atteindre nos objectifs et orienter les recherches selon les résultats obtenus, une pandémie sévit dans la plupart des pays du monde. Elle était connue sous le nom du nouveau coronavirus COVID-19. Comme ce virus est très contagieux et se propage rapidement et continuellement dans la population humaine; des stratégies strictes ont été mises en œuvre pour la prévention et le contrôle de cette maladie dans les pays touchés. L'Algérie étant parmi ces pays, il a été décidé que la majorité des citoyens doivent rester en quarantaine. De ce fait, nous avons arrêté le reste de nos travaux expérimentaux.
3
1. Protéases
1.1. Définition
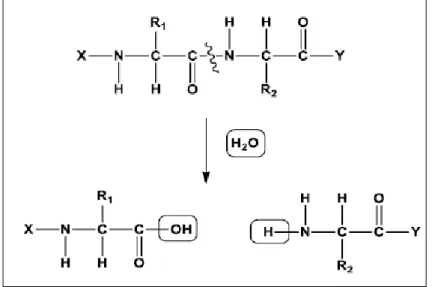
Les protéases, appelées également peptidases ou enzymes protéolytiques (Shamsi et al., 2016), sont des enzymes qui hydrolysent les liaisons peptidiques reliant les acides aminés dans une chaîne polypeptidique (Fig. 1). La grande variété des protéases et leur spécificité d’action ont attiré l’attention pour possible exploitation dans diverses applications physiologiques, biotechnologiques et industrielles (Sawant et Narendra, 2014).
Figure 1 : Mécanisme général de l'action des enzymes protéolytiques (Homaei et al., 2016). 1.2. Classification
Les protéases sont généralement classées en endopeptidases et exopeptidases. Les exopeptidases clivent la liaison peptidique à proximité des extrémités N- et C-terminal (aminopeptidases et carboxypeptidases, respectivement) (Sawant et Narendra, 2014). Les endopeptidases ou protéinases hydrolysent les liaisons peptidiques au milieu des chaînes polypeptidiques (Homaei et al., 2016). Elles sont classées en six groupes importants selon la nature de l'acide aminé au niveau du site actif impliqué dans l'hydrolyse du substrat, à savoir : les protéases à sérine, à acide aspartique, à cystéine, à acide glutamique, à thréonine et les métalloprotéases. Certaines protéases possèdent à la fois une fonction endo‐ et exopeptidase (Jarocki et al., 2015). Les protéases peuvent également être classées en fonction de la plage du pH pour laquelle elles ont l’activité la plus élevée : protéases acides (pH 2‒6), neutres (pH 6‒8) et alcalines (pH 8‒13) (Souza et al., 2015).
1.3. Source des protéases
Les protéases sont omniprésentes dans diverses sources : les plantes, les animaux et les micro-organismes (Singh et al., 2016a).
4 1.3.1. Protéases végétales
Les plantes comme source de protéases ont de nombreuses considérations qui incluent la dépendance aux conditions climatiques favorables et la disponibilité des terres agricoles pour la culture (Gurumallesh et al., 2019). Elles sont très utilisées dans l'industrie alimentaire et pharmaceutique. Parmi les protéases végétales largement exploitées : la bromélaïne, la ficine et la papaïne extraites à partir d’Ananas comosus, Ficus carica et Carica papaya, respectivement. Ces protéases sont utilisées pour différentes applications telles que : l'attendrissement de la viande, la coagulation du lait, la digestion, le traitement de certaines pathologies virales et le cancer (Singh et al., 2016a).
1.3.2. Protéases animales
Les protéases animales les plus couramment utilisées sont la présure, la chymotrypsine, la trypsine pancréatique et la pepsine extraites de plusieurs ruminants, des volailles et des porcs. Ces enzymes jouent un rôle fondamental dans le processus digestif (Singh et al., 2016a; Gurumallesh et al., 2019). La trypsine est utilisée dans la lutte biologique contre les insectes nuisibles et la préparation des milieux de culture microbiens avec peu d’applications médicales et analytiques. La chymotrypsine et la chymosine sont largement utilisées afin de réduire l’allergénécité des protéines du lait de vache consommé par les enfants et dans la production du fromage, respectivement (Singh et al., 2016a). Cependant, la production de ces enzymes dépend de la disponibilité de bétail pour l'abattage, qui à son tour est régi par les réglementations agricoles (Jabalia et al., 2014).
1.3.3. Protéases microbiennes
Pour répondre à la demande toujours croissante de protéases pour diverses applications, les micro-organismes sont devenus la source préférée par rapport aux autres sources en raison de la facilité de production et de manipulation génétique. Les protéases microbiennes constituent le plus grand groupe d'enzymes industrielles et représentent plus de 60% des ventes mondiales totales d’enzymes. Les sources fongiques utilisées pour produire ces enzymes hydrolytiques appartiennent principalement aux genres Aspergillus, Humicola, Mucor, Penicillium, Rhizopus, Thermomyces, etc. Bien que les protéases fongiques aient une vitesse de réaction et une stabilité thermiques inférieures à celles des enzymes bactériennes, elles présentent une plus grande variété et une large spécificité de substrat (Singh et al., 2016a).
La production de protéases fongiques à un avantage par rapport aux protéases d’origine bactérienne car le mycélium peut être facilement éliminé par filtration. En outre, l'utilisation
5
de champignons comme producteurs d'enzyme est plus sûre que l'utilisation de bactéries, puisqu’elles sont normalement reconnues comme GRAS (Generally Recognized As Safe) (Souza et al., 2015).
1.4. Principales applications des protéases
Les protéases sont très demandées en raison de leurs applications biotechnologiques vastes et différentes, Elles peuvent être utilisées comme des médicaments, dans l'isolement cellulaire, dans la formulation de détergents et des produits cosmétiques, dans l’industrie alimentaire et de textiles, … etc.
1.4.1. L’industrie de détergents
Les protéases sont utilisées comme l'un des constituants clés dans la formulation de détergents afin d’améliorer les performances du lavage domestique en solution, le nettoyage des lentilles de contact et les prothèses dentaires. Le plus souvent, ces protéases appartiennent à la sous-classe des protéases à sérine produites par des souches Bacillus spp. Les protéases alcalines provenant de sources fongiques gagnent également un intérêt en raison de la facilité de traitement en aval. Dans de nombreuses formulations, un mélange de différentes enzymes (protéases, amylases, cellulases et lipases) est également utilisé pour améliorer l'effet du lavage à des fins domestiques (Singh et al., 2016a).
1.4.2. Industrie alimentaire
Les protéases sont utilisées dans l'industrie alimentaire pour l'amélioration continue de la qualité organoleptique des produits (la saveur, l'arôme, la couleur, la texture, l'apparence et la valeur nutritive) et pour modifier les propriétés fonctionnelles, telles que la coagulation, l'émulsification, le moussage, la force du gel, la fixation des graisses, …etc.
La production de plusieurs variétés de fromages se base sur l’addition des protéases au lait afin d’hydrolyser des liaisons peptidiques spécifiques de la caséine conduisant à la formation du caillé. En industrie de boulangerie, l’utilisation d'une large gamme de protéases garantit l’uniformité de la pâte, réduit sa consistance, maintient la force du gluten dans le pain et améliore sa saveur et sa texture, …etc. (Singh et al., 2016b).
1.4.3. Industrie de cuir
Le traitement de cuir implique l'utilisation des produits chimiques, toxiques et dangereux, qui génèrent une pollution de l'environnement et un effet néfaste sur les
organismes vivants. Par conséquence, les procédés d’épilation à base de protéases sont actuellement appliqués dans cette industrie afin d’améliorer la qualité et réduire la pollution de l’environnement. Avant d’utiliser une protéase donnée dans tel processus, un criblage
6
approfondi doit être effectué pour obtenir une enzyme spécifique au substrat (kératine) afin d’éviter la dégradation des autres constituants (Gurumallesh et al., 2019).
1.4.4. Applications thérapeutiques
La grande diversité et la spécificité des protéases microbiennes sont largement utilisées à des fins thérapeutiques et de diagnostic. La serratio-peptidase produite par l'espèce Serratia, est la protéase la plus efficace utilisée contre l'inflammation et pour soulager les douleurs. La protéase d'Aspergillus oryzae est utilisée comme aide digestive pour guérir la carence en enzymes lytiques. L'asparaginase d'Escherichia coli et la collagénase de Clostridium sont utilisées dans le traitement de la leucémie lymphocytaire, des brûlures et des plaies, respectivement. La nattokinase de Bacillus subtilis est utilisée comme anticoagulant pour le traitement des maladies cardiovasculaires. En tant que médicament contre les traumatismes, ces enzymes hydrolytiques sont appliquées pour traiter les cicatrices, régénérer les épithéliums et accélérer les processus de guérison. Plusieurs protéases d'origine bactérienne et fongique présentent également des propriétés antimicrobiennes (Singh et al., 2016a).
2. Fromage
Le fromage est le nom générique d'un groupe de produits alimentaires à base du lait fermenté (Fox, 1993). Il est généralement produit à partir du lait pasteurisé (traitement à 72°C pendant 15s) (Hougaard et al., 2010). Le fromage est une source très riche en nutriments essentiels, en particulier en protéines, calcium, peptides bioactifs, acides aminés, lipides, en acides gras, vitamines et en sels minéraux (Walther et al., 2008).
2.1. Classification
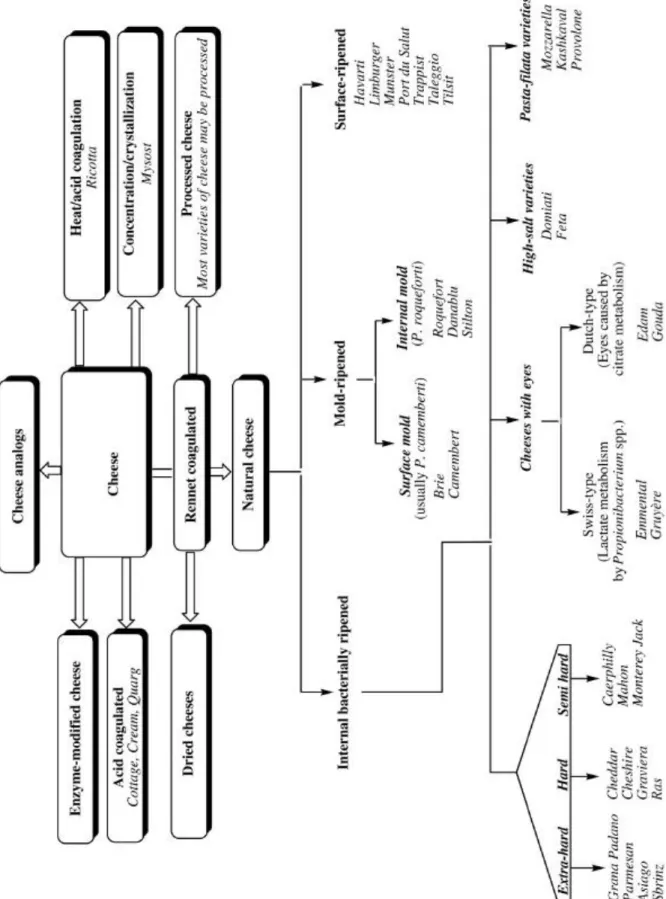
Actuellement les fromages sont classés selon la nature de l'agent coagulant (enzyme protéolytique, un agent acidifiant, ou mixte) ; la texture et la teneur en humidité (très dur, dur, semi-dur, à pâte molle, …) ; fromage affiné ou frais, et selon la microflore d’affinage (flore interne, bactéries de surface, moisissures internes ou de surface, bactéries acide propénoïque) (Fig. 2) (Fox et al., 2017).
7
Figure 2 : Classification des fromages selon le type de coagulation et le procédé d’affinage (Mcsweeney et al., 2017) (voir traduction Fig.1 Annexe 1).
Les variétés de fromages sont classées en superfamilles en fonction de la méthode de coagulation, puis
8 2.2. Fabrication du fromage
La fabrication du fromage est un processus qui implique la conversion du lait liquide (une matière première instable, volumineuse mais très nutritive) en fromage (un produit stable, savoureux et concentré qui procure du plaisir alimentaire et a une durée de conservation prolongée) (Legg et al., 2017). La fabrication moderne du fromage comprend l'ingénierie avancée, la biotechnologie et la science alimentaire. Malgré ça, cette opération est considérée comme un processus ancien et de nombreuses procédures standards de fabrication sont basées sur des pratiques traditionnelles (Powell et al., 2016).
Bien qu'il existe de nombreux types de fromage, mais certaines étapes de fabrication sont en communs pour plusieurs d’entre elles (Olson, 2003). Le déroulement des différentes étapes de fabrication du fromage est illustré dans la Fig.2 Annexe 1.
2.2.1 Préparation du lait : cette étape consiste à préparer le lait qui inclue la standardisation des niveaux de caséine et de matière grasse pour atteindre les proportions requises pour un type de fromage particulier et la pasteurisation pour contrôler la microflore du fromage(Grappin et Beuvier, 1997). Dans certains cas, le lait cru peut être utilisé afin que la microflore du lait puisse conférer des caractéristiques sensorielles particulières (Coker et al., 2005).
2.2.2 Coagulation : est le changement de l’état liquide du lait en présence d’un agent coagulant conduisant à la séparation du caillé de caséines du lactosérum et ses protéines solubles (Schlienger et Rolling, 2011).
2.2.3 Egouttage : il a pour but la séparation entre le callé, composé de certains éléments du lait qui sera ultérieurement soumis à l’affinage, et le lactosérum. Il s'agit donc d'une phase essentielle qui conditionne directement la composition du fromage et son devenir au cours de l'affinage. Il se traduit par une élimination importante de lactosérum qui s'accompagne d'une rétraction et d'un durcissement du gel (Ramet et al., 1985).
2.2.4 Salage : est l'une des dernières étapes du processus de fabrication du fromage pour divers types. Il est réalisé soit par l’ajout direct et mélange de cristaux de sel sec à des morceaux de caillé brisés ou broyés à la fin de la fabrication (salage à sec) ou par immersion du caillé dans de la saumure (salage en saumure). Le sel en fromagerie joue deux rôles principaux, à savoir agit comme conservateur et contribue directement à la saveur et à la qualité du fromage. Il affecte également la microbiologie du fromage en augmentant la pression osmotique de sa phase aqueuse, provoquant la déshydratation des cellules bactériennes, soit en les
9
inactivant, soit en empêchant leur croissance (Kapoor et al., 2004 ; Mcsweeney, 2007).
2.2.5 Affinage : il correspond à une phase de digestion enzymatique (Turcot et al., 2002), principalement de deux composants majeurs : les protéines et la matière grasse par protéolyse et lipolyse. Au cours de cette phase, le fromage subit des modifications profondes liées à sa composition physico-chimique, qui influe son aspect, ses qualités organoleptiques, sa digestibilité et sa valeur nutritive (Ramet
et al., 1985).
2.3. La coagulation du lait
La coagulation du lait est la principale étape dans la production du fromage (Mohamed
et al., 2015). Elle correspond à une déstabilisation de l'état micellaire originel de la caséine du
lait réalisée par trois manières :
• Voie enzymatique par des enzymes coagulantes, en particulier la présure.
• Voie fermentaire par des bactéries productrices d'acide contenant naturellement dans le lait ou apportées sous forme de ferments, ou par un agent acidulant (HCl, acide gluconique-δ-lactone).
• Voie mixte entre les deux processus déjà signalés
Les mécanismes d'action de ces agents coagulants au niveau de la micelle sont très différents,
bien qu'ils conduisent tous les deux à la formation d'un coagulum (gel ou caillé) (Ramet
et al., 1985).
2.3.1. Les caséines du lait
Les caséines sont des phosphoprotéines synthétisées sous un contrôle multi-hormonal complexe et représentent la fraction protéique la plus abondante dans le lait. Elles proviennent de l’expression de quatre chaînes polypeptidiques distinctes : les caséines αs1, β,
αs2 et κ, dont les structures sont maintenant connues pour plusieurs espèces (Perinelli et al.,
2019; Rijnkels et al., 2003). Elles sont codées par quatre gènes (CSN1S1, CSN1S2, CSN2 et CSN3) situés sur le chromosome 6 et présentent des taux de mutation élevés (Fuerer et al., 2020). En effet, la teneur en
caséines des laits est très variable, près de 80% des protéines du
lait des ruminants, mais pour le lait humain, leur pourcentage n’excède pas 50%. Au-delà de cette variabilité globale, il existe des différences de proportions relatives des caséines entre les espèces (Léonil et al., 2013).Les micelles de caséine sont des agrégats à peu près sphériques stabilisés en suspension colloïdale dans le lait (Alessi et al., 2007). Elles contiennent 92% de protéines et une fraction
10
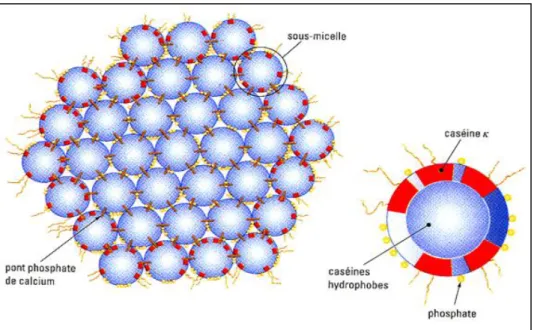
minérale de 8%. Les minéraux sont constitués de 90% de phosphate de calcium et de 10% d’ions citrate et magnésium. Leur diamètre moyen est d’environ 180 nm mais peut varier de 30 à 600 nm (McMahon et Brown, 1984). Les micelles sont formées de sous-micelles reliées ensemble par des ponts phosphate de calcium. Les sous-micelles périphériques sont plus hydrophiles et contiennent une plus grande proportion de casein-κ (Fig. 3) (Vignola, 2002).
Figure 3 : Représentation schématiques de la structure d'une micelle (Vignola, 2002). 1. Les caséines αs
La caséine αs1 est le constituant majoritaire des caséines du lait. Les deux extrémités
N- et C-terminal de la molécule sont hydrophobes contrairement à d'autres caséines, ce qui conduit à la formation d'interactions intramoléculaires et intermoléculaires. Elle est la plus sensible à l’action des ions Ca2+ (Madadlou et Azarikia, 2013). La caséine αs
2 comporte 207
acides aminés avec un grand nombre de chaînes latérales chargées positivement en particulier dans le segment C-terminal. Elle contribue avec 29% de la teneur totale en caséines (Selvaggi
et al., 2014).
2. Les caséines β et γ
La caséine-β est composée de 209 acides aminés avec un poids moléculaire ∼24 kDa. Elle représente environ 37% des caséines du lait de vache et est la plus hydrophobe grâce à sa queue C-terminale riche en résidus proline (17%) (Bahri et al., 2019). Les caséines γ sont des
fragments C-terminal résultant de la protéolyse de la caséine-ß par la plasmine (Rutigliano
11 3. La caséine-κ
La caséine-κ est une molécule amphiphile avec un seul résidu phosphoséryl. Elle est chargée de fragments tri-saccharide ou tétra-saccharide situés dans le segment C-terminal. Le reste de la molécule a un caractère hautement hydrophobe. Elle contient 169 résidus d'acides aminés (Eskin et Goff, 2013), pour une masse moléculaire moyenne de 19 kDa (Brulé et al., 1997) dont 11,8% sont de la proline (Eskin et Goff, 2013) et représente 8– 15% du total des caséine (Fuc et al., 2018).
2.3.2. Mécanisme de la coagulation
La coagulation enzymatique du lait se déroule en trois étapes désignées communément par :
• L’hydrolyse de la protéine stabilisatrice des micelles, la caséine-κ ;
• L’agrégation et la gélification des micelles modifiées par l’enzyme coagulante ; • Le développement d’un gel particulier (Fox et al., 2017).
1. Phase primaire
L'activité de la chymosine ou d’autres enzymes protéolytiques (avec quelques exceptions) pendant la phase primaire est l'hydrolyse de la liaison peptidique Phe105-Met106 de
la caséine-κ (Lucey, 2011). Cela produit la paracaséine-κ (résidus 1-105), assez hydrophobe qui reste attaché aux autres caséines, et le caséinomacropeptide (CMP) (résidus 106-169) qui est très hydrophile, libéré dans le lactosérum (Hyslop, 2003).
2. Phase secondaire
Elle corresponde au processus physique de la coagulation qui implique l'agrégation des micelles modifiées par voie enzymatique, ou les micelles de paracaséine, conduisant à la formation d'un coagulum (Zobrist et al., 2005). Après avoir perdu sa queue soluble dans l'eau, les caséines ne peuvent plus se séparer, elles commencent donc à former des chaînes et des amas. Les grappes continuent de croître jusqu'à former un réseau continu en trois dimensions, qui emprisonne l'eau à l'intérieur et forme un gel comme dernière étape du processus (Fox et al., 2017).
12
3. Moisissures
3.1. Définition
Les moisissures sont des champignons filamenteux microscopiques (Viel et al., 2019), ayant un rôle important dans les processus biotechnologiques en tant que producteurs d'enzymes et de composés naturels utilisés en médecine, dans la production de biocarburants, des pigments et autres métabolites (Schuster et Kahmann, 2019). Ce sont des eucaryotes, hétérotrophes dont la plupart sont des saprophytes dans le sol et sur la matière organique en décomposition. Elles sont caractérisées par une gamme de systèmes membranaires internes, des organites liés à la membrane et une paroi cellulaire bien définie composée en grande partie de polysaccharides (glucane, mannane), de chitine et de chitosane (Warnock, 2012). 3.2. Morphologie des moisissures
Les moisissures sont des organismes multicellulaires présentant un corps ou une structure végétative appelée « thalle ». Ce dernier est constitué de longs filaments fins et ramifiés à structure cellulaire appelée « hyphe » (du grec hyphe : tissu) qui forme le « mycélium ».
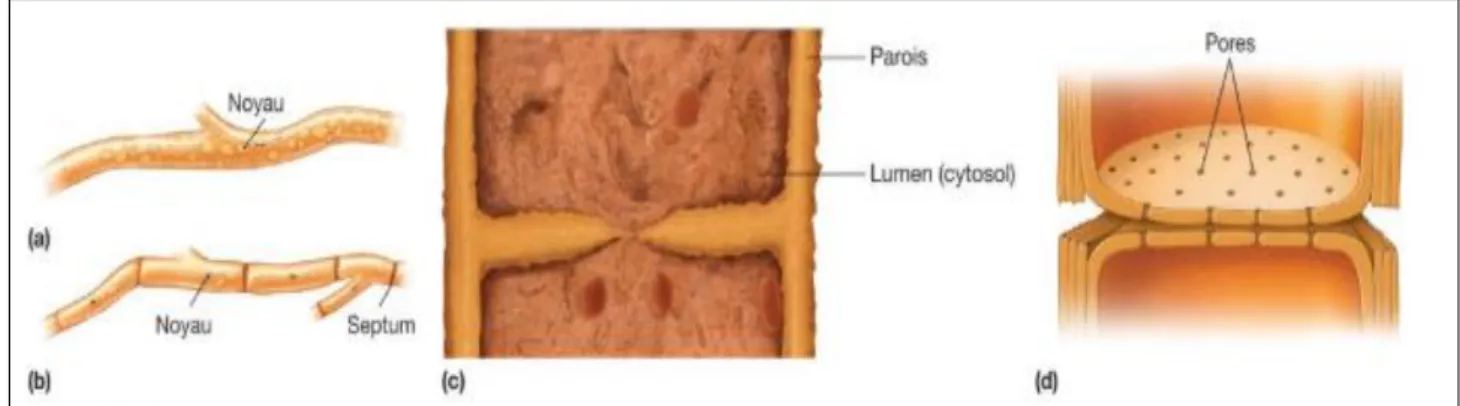
Chez certains champignons filamenteux, le protoplasme coule dans l’hyphe sans être interrompu par des cloisons transversales, ce sont des hyphes coenocytiques ou aseptés (Fig. 4a). Les hyphes des autres champignons (Fig. 4b) ont des cloisons transversales appelées septums, percées soit d’un pore unique (Fig. 4c), soit de pores multiples (Fig. 4d), qui permettent le passage du cytoplasme. On les désigne comme des hyphes septés. La nature filamenteuse des hyphes donne une surface relativement grande par rapport au volume du cytoplasme ce qui rend possible une absorption nutritive adéquate par osmotrophie (Joanne
et al., 2018).
Figure 4 : L'organisation des hyphes chez les moisissures : (a) hyphes coenocytiques (non septés), (b) hyphes divisés en cellules par des septums, (c) septum uni-pore (d) septum multi
13 3.3. Classification
Les moisissures s’imposent comme un règne distinct dans la classification actuelle du vivant qui regroupe les eucaryotes (Eucarya), les archées (Archaea) et les bactéries (Bacteria) (Woese et al., 1990). Elles sont classées en fonction de critères phénotypiques historiquement définis en quatre catégories : Phycomycètes, Ascomycètes, Basidiomycètes et les Deutéromycètes ou fungi imperfecti (Ainsworth, 1973). Au cours de ces dernières années, l’introduction des critères génotypiques a contribué dans le développement important de cette classification (Hibbett et al., 2007; Spatafora et al., 2016). La nouvelle classification adoptée est rendue possible grâce au séquençage des nombreux génomes fongiques actuellement disponibles (Spatafora et al., 2016).
Le groupe des moisissures est composé actuellement d’un sous-règne, de 7 divisions et de 10 sous-divisions (Hibbett et al., 2007; Spatafora et al., 2016). Le sous règne des
Dikarya comporte deux divisions, Ascomycota et Basidiomycota. La division des Ascomycota se scinde en trois sous-divisions (Pezizomycotina, Saccharomycotina et Taphrinomycotina), tandis que la division des Basidiomycota se divise en trois sous-divisions (Pucciniomycotina, Ustilaginomycotina et Agaricomycotina)(Spatafora et al., 2017). Les autres divisions sont : Mucoromycota, Zoopagomycota, Chytridiomycota, Blastocladiomycota et Cryptomycota. La division des Mucoromycota regroupe les trois sous-divisions Mucoromycotina, Mortierellomycotina et Glomeromycotina, tandis que la division des Zoopagomycota regroupe les sous-divisions Zoopagomycotina, Kickxellomycotina et Entomophtoromycotina (Spatafora et al., 2016; Morin-Sardin et al., 2017).
3.4. Cycle de vie
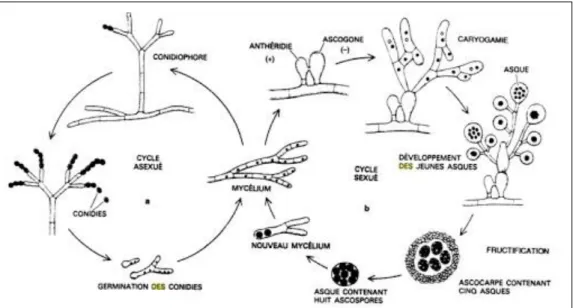
La reproduction chez les moisissures s’effectue par deux modes (Fig. 5) :
1. Reproduction asexuée : elle se fait sans fusion de gamètes et correspond majoritairement à la dispersion de spores asexuées produites par des structures spécialisées développées à partir du mycélium. Différents types de spores asexuées ont été décrits sur la base de leur mode de production : (a) les arthrospores se développant à partir d'un fragment parent de mycélium ; (b) les sporocystiospores qui sont produites de manière endogène à l’intérieur de sporocystes et (c) les conidies ou conidiospores générées de manière exogène et en continu à l’extrémité de structures spécialisées appelées cellules conidiogènes (annélides, phialides, … etc.) (Barnett et Hunter 1998).
14
2. Reproduction sexuée : il s’agit de la rencontre de deux mycéliums de signes sexuels opposés. Un mycélium à (n) chromosomes va rencontrer un autre mycélium à polarité complémentaire pour donner lieu à la fusion des cytoplasmes, ce qui donne une zygospore qui germe de nouveau pour former un mycélium à 2n chromosomes (Roquebert, 2002).
Figure 5 : Cycle de la reproduction sexuée et asexuée des moisissures (Jennings et Lysek, 1996).
3.5. Conditions de croissance
Les moisissures sont omniprésentes dans la nature et leur développement nécessite des facteurs nutritifs et environnementaux. Elles sont généralement considérées comme des hétérotrophes qui dépendent des éléments nutritifs tels que : le carbone et l’azote comme composés organiques, les ions minéraux comme le potassium, le phosphore, le magnésium, le fer ou le souffre. Elles nécessitent aussi d’autres molécules qui peuvent pénétrer dans la cellule sans transformation comme les acides aminés ou après une digestion enzymatique des
molécules complexes comme l’amidon, la cellulose ou les protéines (Cole, 1996; Botton
et al., 1990). Les différents modes de nutrition des champignons filamenteux sont : le
saprophytisme (Martins et al., 2014; Zhang et al., 2016), la symbiose (Ray et Craven, 2016), le parasitisme (Dean et al., 2012).
Le développement des moisissures est également dépendant de l’environnement, Le facteur le plus important est l’humidité relative (HR). La majorité des moisissures se développent en présence d’une activité d’eau comprise entre 0,85-0,99 (Lahouar et al., 2016). Le deuxième facteur est la température, dont les exigences thermiques pour le développement diffèrent d’une moisissure à l’autre. La majorité de ces microorganismes sont
15
mésophiles qui se développent entre 20-25°C, mais il existe certaines moisissures dites psychrophiles, thermophiles et thermo-tolérantes (Botton et al., 1990). Les moisissures sont des microorganismes aérobies et qui se développent sur des milieux à pH compris entre 4,5‒8 ; bien que le pH optimum soit entre 5,5‒7,5 (Larpent-Gourgaud et Sanglie, 1992). 3.6. Genre Mucor
Le genre Mucor a été décrit premièrement par Fresenius en 1850 (Nguyen et al., 2020), c’est un groupe de champignons phylogénétiquement ancien appartenant aux premières lignées divergentes de champignons (Lebreton et al., 2020). Il appartient à la famille des Mucoracées, ordre Mucorales, sous-embranchement Mucoromycotina. Il comprend le plus grand nombre d'espèces au sein des Mucorales (Nguyen et al., 2020). Les espèces appartenant à ce genre sont principalement saprophytes colonisant des environnements multiples et différents, des excréments ou des matières végétales mortes au tissus végétaux et animaux (Lebreton et al., 2020).
Les caractères morphologiques des espèces de Mucor ont été largement signalés par Schipper (Schipper, 1967; 1969; 1970; 1976) et Zycha (Zycha et al., 1969). Les hyphes des Mucor sont généralement siphonnés et larges avec un diamètre pouvant atteindre 15 μm. La présence de septums chez les Mucor ne se rencontre que pour séparer les organes de reproductions sexuée et asexuée du reste du mycélium (Stajich et al., 2009) ou lors de l’isolement des parties sénescentes pour éviter la propagation de composés toxiques dans tout le mycélium (Carlile, 1995). L’extension mycélienne est générée au niveau de l’apex des hyphes (Morin-Sardin et al., 2017). Le mycélium des Mucor est haploïde et multi-nucléé, seules les cellules issues de la reproduction sexuée générant les zygospores, sont diploïdes (Morin-Sardin et al., 2017).
En effet, les différentes espèces appartenant au genre Mucor sont utilisées depuis des siècles dans la fabrication des aliments, l’affinage du fromage, la production de certains aliments fermentés asiatiques et africains. Certaines espèces ont également marqué leur exploitation dans l’industrie en raison de leur taux de croissance rapide, leurs activités protéolytiques et lipolytiques élevées et leur capacité à produire divers métabolites secondaires (Walther et al., 2013; Lebreton et al., 2020). D’autres applications comprennent : la production des biocarburants, production des stéroïdes et des terpénoïdes pour des intérêts pharmaceutique et médical, et plusieurs autres biotransformations (Alves et al., 2002). 26 souches appartenant à 6 espèces différentes (M. circinelloides, M. hiemalis, M. genevensis, M.
16
piriformis, M. racemosus et M variosporus) sont connues par la production des taux très élevés en polygalacturonases, amylases et en protéases (Morin-Sardin et al., 2017).
3.7. Genre Rhizopus
La description de Rhizopus a été faite pour la première fois par Ehrenb en 1821. Il appartient à la famille des Rhizopodaceae, ordre des Mucorles. On le trouve presque partout dans le sol, les excréments d'animaux et la végétation en décomposition (Gryganskyi et al., 2018; Slaviero et al., 2020).
Il est habituel de distinguer les espèces de Rhizopus en fonction de caractéristiques morphologiques et physiologiques distinctes, comme : la température maximale de croissance, la formation de structures morphologiques (chlamydospores, sporanges et rhizoïdes), les caractéristiques des sporangiophores (couleur, forme et taille), le diamètre des sporanges, la production des acides, …etc. La classification de Rhizopus publiée par Schipper (1984) a séparé le genre en trois groupes, R. microsporus, R. stolonifer et R. arrhizus (oryzae), en fonction de la ramification des rhizoïdes, la température de croissance et la taille des sporanges et des sporangiophores (Gryganskyi et al., 2018).
Les souches de Rhizopus sont utilisées depuis longtemps en industrie pour la production des acides lactique, fumarique et malique par le complexe R. arrhizus/R. delemar, la synthèse de l'éthanol, des caroténoïdes et des enzymes hydrolytiques (protéases, lipases) ainsi que d’autres acides organiques (Dolatabadi et al., 2016; Gryganskyi et al., 2018). Certaines espèces sont utilisées comme des organismes modèles dans l'étude de la biologie cellulaire et moléculaire fongique, dont d’autres sont considérées comme des agents phytopathogènes ou causent des maladies chez les animaux, y compris les humains (Gryganskyi et al., 2018).
4. Fermentation
4.1. Définition
Le mot « fermentation » vient du verbe latin fevere, qui signifie bouillir (Okafor, 2016; Thatoi et al., 2020). La fermentation est définie comme une transformation chimique impliquant la participation d’enzymes et des catalyseurs organiques générés par une gamme de micro-organismes qui comprenne les bactéries, les levures et les champignons (Batt, 2016; Ojha et al., 2017).
Depuis la préhistoire la fermentation a été utilisée pour fabriquer de la bière, du pain, du fromage, du vin et d'autres produits alimentaires. Aujourd’hui, et avec le développement de la technologie de fermentation, plusieurs produits sont fabriqués, notamment des carburants, des
17
produits chimiques, des enzymes, des antibiotiques et des produits pharmaceutiques (Anderson, 2009).
4.2. Types de fermentation
Les processus de fermentation peuvent être divisés en deux systèmes : la fermentation submergée (SmF) et la fermentation à l'état solide (SSF).
4.2.1. Fermentation sur milieu liquide ou submergée
La fermentation submergée (Submerged fermentation ; SmF) a été appliquée depuis longtemps par rapport à la fermentation sur milieu solide (Suriya et al., 2016). Elle implique l'inoculation de la culture microbienne dans un milieu liquide qui est optimisé avec les nutriments nécessaires pour avoir une meilleure croissance et production du métabolite recherché (Doriya et al., 2016).
4.2.2. Fermentation sur milieu solide
La fermentation à l'état solide (Solid-state fermentation, SSF) est définie comme un processus de bioconversion dans lequel les micro-organismes se développent sur des substrats solides humides en absence d'eau libre (Martínez-Medina et al., 2019). Les processus SSF sont principalement utilisés pour la transformation des aliments et la production d'enzymes à l'aide de micro-organismes principalement les champignons filamenteux (Malakar et al., 2020), puisque leurs hyphes peuvent se développer à la surface des déchets agricoles, pénétrer
à l’intérieur des espaces entre les particules et coloniser les substrats solides (Nighojkar
et al., 2019).
Plusieurs applications de la fermentation à l'état solide par intervention biotechnologique ont été étudiées pour la transformation d'aliments, la production de boissons, des pigments, des arômes, des antibiotiques, des biosurfactants, des enzymes (amylases, lipases, phytases, cellulases, protéases, tannases, chitinases, …ect), des acides organiques, …etc (Mitchell et al., 2011; Malakar et al., 2020). Les substrats largement utilisés pour les systèmes SSF sont : le son de blé, le son de riz et la bagasse de canne à sucre (Patnala et al., 2016).
4.3. Avantages et inconvénients de la SSF
La fermentation solide est généralement connue pour offrir une série d'avantages opérationnels et économiques par rapport à son homologue la fermentation submergée. Une gamme d'avantages et des inconvénients de la SSF par rapport à SmF est résumée dans le
18
Tableau I : Avantages et inconvénients de la SSF par rapports la SmF. (Fellows, 2009; Ramos et Malcata, 2011; De Castro et al., 2018; Martinez-Medina et al., 2019; Nighojkar
et al., 2019).
Avantages Inconvénients
− Elle ressemble à l'habitat naturel de plusieurs micro-organismes en particulier les moisissures.
− Assure des rendements et des productivités plus élevés.
− Une stabilité accrue des produits élaborés.
− Les milieux de culture requis ne sont pas très complexes.
− Les substrats peuvent être utilisés tels quels (ou enrichis en nutriments supplémentaires).
− Des coûts énergétiques inférieurs (la stérilisation, l'agitation mécanique et l'aération ne sont pas toujours nécessaires).
− Meilleure circulation de l'oxygène. − Moins de risques de contamination. − Volume de bioréacteur est faible. − La technologie des réacteurs est simple. − La faible disponibilité en humidité peut
favoriser la production de composés qui ne peuvent pas être produits en culture submergée.
− Absence de formation de mousse donc pas besoin d'agent anti-mousse.
− Contrôle difficile des paramètres du processus (la teneur en humidité, l'oxygène et la biomasse produite).
− Le coût de récupération est élevé.
− Les temps de cycle de fermentation sont plus longs car des volumes d'inoculum élevés sont nécessaires et les spores inoculées ont un temps de latence avant la germination.
− Un risque de contamination par des champignons indésirables.
− Mélange d'éléments nutritifs non uniforme. − Difficultés du passage entre les échelles. − Accumulation de la chaleur.
− Produit d’intérêt plus impureté.
4.4. Son de blé
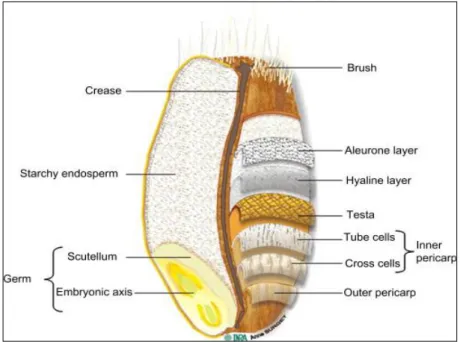
De nombreuses recherches ont été effectuées sur le son de blé, dont la majorité se concentre sur les facteurs alimentaires, mais l'utilisation biotechnologique du son de blé a également retenu l'attention, surtout comme substrat de fermentation pour la production de différentes enzymes. Le son de blé est un sous-produit agroindustriel (Higuchi, 2014). La Fig. 6 illustre les différentes couches constituant le son de blé : la couche d’aleurone, la couche
19
hyaline, le testa ou le tégument, le péricarpe intérieur et le péricarpe extérieur (Emanuelli
et al., 2014).
Figure 6 : Une représentation histologique du grain de blé (Emanuelli et al., 2014). Le son de blé est riche en fibres, la plupart d'entre eux sont des fibres alimentaires insolubles (Tableau II), représentant une bonne source de protéines, de minéraux, de vitamines et d'antioxydants. Les principaux composants fibreux du son de blé sont les hémicelluloses, principalement les arabinoxylanes. Le péricarpe et le testa sont des tissus hydrophobes qui contiennent des quantités importantes de lignine et de cellulose. La couche d'aleurone est composée d'arabinoxylanes relativement linéaires fortement substitués par l'acide férulique, de β-glucanes , qui sont le principal composant de la fibre soluble du son
de blé, la plupart des phytates et les minéraux essentiels présents dans le grain (Emanuelli
et al., 2014).
Tableau II : Composition du son de blé(Emanuelli et al., 2014).
Constituant Quantité (g/100 g) Humidité (%) 1,5-2,2 Protéines 13,6–15,9 Lipides 4,1–8,1 Glucides 14,7-28,1 Cendres totales 4,3–6,1 Fibres insolubles 32,1–48,4 Fibres solubles 1,2–4,0
20
Ce travail a été réalisé au niveau des Laboratoires de Biochimie et de Microbiologie, Département de Biologie, Faculté des sciences de la nature et de la vie et des sciences de la terre (SNV-ST, Université Akli Mohand Oulhadj-Bouira).
Vers la fin de l’année 2019, une nouvelle épidémie a été identifiée. Elle est provoquée par un nouveau type de virus de la famille des Coronaviridae, temporairement appelé «nouveau coronavirus», 2019-nCoV. L’organisation mondiale de santé (OMS) a déclaré que l'épidémie est une urgence internationale et lui a attribué les noms de SARS-CoV2 (Syndrome
Respiratoire Aigu Sévère 2) et COVID-19. Cette pandémie a affecté rapidement et profondément chaque partie de la vie quotidienne. En raison de la prévalence du
coronavirus (COVID-19) en Algérie, le ministère de l'enseignement supérieur et de la recherche scientifique (MESRS) a décidé de fermer les universités afin d'éviter la contamination par le COVID-19 et rester en quarantaine en tenant compte des mesures de prévention jusqu’à ce qu'il existe des solutions pour le traiter.
Pour cela, nous n'avions pas eu l'opportunité de continuer la partie pratique de notre projet de fin cycle (Master II) au niveau des laboratoires de la faculté, afin d'obtenir les
résultats souhaités et achever le reste du travail en stage pratique dans la Laiterie et Fromagerie de Boudouaou (LFB) pour la production du fromage. Avant le déclenchement
de la pandémie, nous avons déjà commencé à travailler sur une fraction minimale de la partie expérimentale, qui sera expliquée dans ce chapitre.
1. Matériel
1.1. Matériel biologique
Les deux espèces fongiques utilisées dans ce travail, Mucor circinelloides DIV16/2095-2047 et Rhizopus stolonifer DIV16/2095-2048-1, ont été isolées à partir des sols agricoles provenant de deux Wilayas du centre d’Algérie (Bouira, Tipaza) puis identifiées sur la base de leurs propriétés phénotypiques (aspect macroscopique et microscopique) et génotypiques (Bensmail et al., 2020).
1.2. Matériel non biologique
L’ensemble du matériel non biologique utilisé durant notre partie expérimentale est illustré dans le Tableau III.
21
Tableau III : Liste du matériel non biologique utilisé durant l’expérimentation.
2. Méthodes
2.1. Revivification des souches
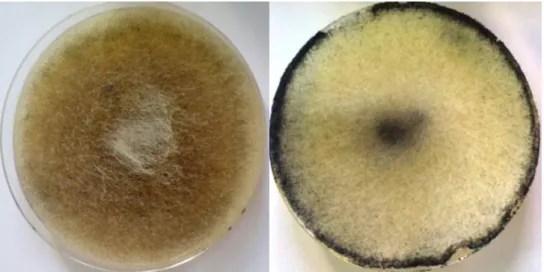
Les deux souches fongiques sont revivifiées par prélèvement de quelques spores et/ou des fragments de mycélium à partir des cultures conservées sur milieu PDA (g/L: 200g Pomme de terre, 20g Glucose, 17g Agar-agar) (Guiraud, 2012) en tubes à essai ou coulé dans des boites de Pétri. Par la suite, les boites ensemencées sont incubées à 28 ± 2°C pendant 5-7 jours jusqu’à l’obtention d’une sporulation complète.
La Figure 7 représente l’aspect des deux souches fongiques ensemencées sur le milieu PDA après la période d’incubation.
Figure 7 : Aspect macroscopique des cultures de M. circinelloides (à gauche) et R. stolonifer (à droite) sur milieu PDA âgées de 5-7 jours à 28°C.
Appareillage Verrerie et petit matériel
Autoclave (Systec BD-23), agitateur magnétique couplé à une plaque chauffante (HOT plate stirrer), balance (KERN 440-35N), balance analytique (OHAUS), étuve (Memmert, Heraeus 9209), bain-marie (Nuve bath), pH mètre (METTLER TOLDO), …etc.
Bécher, fioles jaugées 250 mL, entonnoir ; Erlenmeyers 250 mL, pipettes graduées, tubes à essai,…etc.
Boites de Pétri, anse de platine, micropipettes : 100µL et 1mL, coton cardé, papier Wattman n°1, parafilm, bec Bunsen…etc.
22 2.2. Préparation des inocula
La préparation des suspensions de spores à partir des cultures fongiques a été effectuée par l’addition de 10 mL d’une solution stérile de Tween 80 à 0,1% pour chaque boite de Pétri (Agrawal et al., 2005). À l'aide d'une anse de platine stérile, on gratte légèrement la surface de la gélose afin de libérer le maximum de spores en suspension, sans toucher la gélose elle-même. Une étape de filtration à travers le papier Wattman n°1 entreposé sur un entonnoir stérile, assure la récupération des spores dans un tube à essai stérile et élimine les autres débris de mycélium (Fig. 8). Tous les constituants du système ont été stérilisés au préalable à 120°C pendant 20 min, alors que la filtration a été conduite entre deux becs Bunsen afin d’assurer en mieux la zone d’asepsie. Les suspensions de spores récupérées sont conservées à -18°C jusqu’à utilisation ultérieure.
Le dénombrement de spores sera réalisé suite à quelques étapes de dilution à partir de la suspension mère pour chaque souche séparément, via la cellule de Malassez sous microscope photonique au grossissement GX40.
Figure 8 : Système de filtration adopté durant l’expérimentation pour la préparation des suspensions de spores des deux souches fongiques.
2.3. Production des coagulants fongiques
La fermentation sur milieu solide est le procédé choisi pour produire les protéases coagulant le lait par les deux souches fongiques sélectionnées. Au total 12 Erlenmeyers de 250 mL ont été utilisés durant cette étape (Fig. 9). Ce nombre a été divisé en deux, dont six Erlenmeyers sont réservés pour chaque souche fongique. Le substrat utilisé pour la production des enzymes par M. circinelloides et R. stolonifer est le son de blé, mais la préparation des
23
milieux de fermentation sera spécifiée pour chaque souche vu la différence de certaines conditions de production.
Figure 9 : Préparation des milieux de fermentation pour chaque souche.
Dans le cas de M. circinelloides, nous avons introduit dans chaque Erlenmeyers 10g de son de blé additionné de 0,1g du sulfate d’ammonium puis mélangés et humidifiés avec 10 mL de la solution M-9 dont le pH a été ajusté à 4,23 avant stérilisation (Bensmail et al., 2019). La composition de la solution minérale M-9 est la suivante (g/L) : NaH2PO4 12,8 ;
KH2PO4 3 ; NaCl 0,5 ; NH4Cl 1 ; MgSO4.7H2O 0,5 ; CaCl2.2H2O 0,01 (Tunga et al., 1998).
L’addition de la solution minérale au substrat de la fermentation sur milieu solide permet de l’enrichir avec des oligo-éléments, de lui assurer une certaine humidité et de régler son pH (Krishna, 2005; Singhania et al., 2017).
Pour R. stolonifer, une quantité de 5g du son de blé a été introduite dans chaque Erlenmeyers. 0,1g de xylose et 0,04g de CaCl2.2H2O sont ajoutés puis mélangés avec le
substrat de la fermentation. Le taux d’humidité a été régulé par l’addition de 6 mL de la solution M-9 avec un pH ajusté à une valeur de 6,0.
Après la préparation des milieux de fermentation, tous les Erlenmeyers sont bouchés avec du coton cardé puis coiffés avec du papier aluminium avant de lancer la stérilisation à 115°C pendant 15 min (Fig. 10). Suite au refroidissement, les Erlenmeyers ont été conservés à 4°C avant de procéder à l’ensemencement et l’incubation sous les conditions optimales de production.
24
Malheureusement, l’expérimentation au niveau du laboratoire a été arrivée à ce stade là avant de commencer la stratégie de confinement imposée par l’état afin de prévenir la propagation de la pandémie du COVID-19 au niveau des établissements universitaires.
Figure 10 : Aspect des milieux de fermentation avant de lancer la production des coagulants fongiques.
2.4. Extraction des protéases
L’objectif de notre travail est d’étudier l’influence de certaines solutions sur l’extraction des protéases coagulant le lait produites par les deux souches fongiques à partir du moût de fermentation. Pour cette raison, nous avons préparé six Erlenmeyers pour chaque cas. Les solutions qui ont été choisies sont: KCl à 0,05%, CaCl2 à 0,05%, (NH4)2SO4 à 0,05%, glycérol
à 10%, Tween 80 à 5% et l’eau distillée qui est utilisée comme témoin.
Le protocole d’extraction selon Tunga, après 3 jours de fermentation, la matière fermentée a été entièrement écrasée et trempée pendant 2 h avec 5 fois le volume d’eau à température ambiante (30°C). Le liquide a ensuite été séparé par filtration sur tissu de coton et le filtrat a été centrifugé à 10 000 xg pendant 10 min en utilisant un rotor pré-refroidi à 4°C (Remi-24, Inde) pour éliminer les spores et autres matières insolubles. Le surnageant a été stocké à 4°C et utilisé comme source d’enzyme (Tunga et al., 2003).
2.5. Méthodes de dosage
Il était prévu que pour chaque extrait brut, trois types de dosage seront réalisés. Il s’agit du dosage des protéines (Bradford, 1976), la détermination de l’activité coagulante (Arima
et al., 1970) et l’estimation de l’activité protéolytique (Anson, 1938) (voir annexe 2). Avant
d’être appliqué dans un essai de fabrication du fromage à pâte pressée non cuite type EDAM, les deux extraits bruts présentant les meilleures activités coagulantes, pour chaque souche, doivent passer par une étape de purification partielle (précipitation au sulfate d’ammonium et dialyse) afin de réduire le maximum des contaminants ayant un effet négatif sur la qualité des extraits bruts comme des substituants de la chymosine commerciale.
25 I. Effet de l’extraction sur l’activité coagulante
Selon notre recherche dans la littérature, peu de travaux ont été publiés sur l’influence de la méthode d’extraction et ses conditions sur l’activité coagulante des protéases d’origine fongique. Aucun article n’a été publié sur l’effet de cette étape sur l’activité coagulante des protéases produites par les deux espèces choisies dans notre étude, M. circinelloides et R. stolonifer cultivées sur milieu solide. Pour cette raison, les résultats détaillés et discutés dans ce chapitre sont obtenus à partir des travaux lancés sur des souches fongiques du genre Rhizopus et Aspergillus et qui ne sont pas obligatoirement des producteurs de protéases coagulant le lait.
La fermentation à l'état solide est une fermentation en absence ou presque absence d’eau libre, dont la récupération du produit de fermentation nécessite son extraction par l’addition d’un solvant approprié (Aikat et Bhattacharyya, 2000).
I.1. Influence du type de solvant
Dans le travail publié par Ikasari et Mitchell (1996), le maximum d’activité de la protéase acide de R. oligosporus ACM 145F a été atteint avec l’utilisation de la solution NaCl à 5% (p/v) comme solvant d’extraction. La substitution de l’eau distillée par le tampon citrate (0,1 M ; pH 4) n’a pas révélé une différence significative, tandis que la solution d’HCl à 0,1 M a induit une diminution de l’activité récupérée par environ 50%.
Les travaux de Tunga et al. (1998), ont révélé que l’éthanol à 10% (v/v) a contribué dans l’amélioration de l’extraction de la protéase de R. oryzae NRRL-21498, par rapport aux autres solutions testées (Tableau IV), probablement due à sa constante diélectrique la plus basse qui assure une interaction plus forte avec la protéase. Cette interaction a été considérée plus importante que la force de liaison établie entre l’enzyme produite et le substrat de la fermentation (le son de blé) (Tunga et al., 1999).
Tableau IV : Sélection du solvant d’extraction de la protéase de R. oryzae (Tunga et al., 1999).
Solvant d’extraction Activité protéolytique (U/mL d’extrait) Eau distillée Tampon phosphate (0,1 M ; pH 6,5) Glycérol à 10% Ethanol à 10% Méthanol à 10% Acétone à 10% 34,5 38 54 61,5 46 30
26
Dans la même étude et vu l’effet positif de l’éthanol et le glycérol sur le rendement en activité protéolytique extraite du substrat fermenté, des essais d’extraction ont été lancés avec des mélanges entre les deux alcools. Selon les résultats du dosage réalisé sur les extraits bruts récupérés, un mélange contenant 10% d’éthanol et 3% de glycérol assure le maximum d’extraction. Tunga et al. (1999) ont suggéré que les groupes hydroxyles de l'éthanol et du glycérol peuvent former des liaisons hydrogènes avec les molécules de protéine, ce qui améliore la stabilité de l'enzyme durant le processus d’extraction.
Au total l’effet de dix solutions entre minérales, alcools et solvants organiques a été étudié sur le rendement en protéase coagulant le lait produite par Aspergillus oryzae à partir du moût de fermentations. Les solutions choisies par Shata (2005) sont : l’eau distillée, l’eau de robinet, NaCl, CaCl2, MgCl2, KCl, le glycérol, l’éthanol, le méthanol et l’acétone, testées à
une concentration de 5%. Les résultats illustrés sur les figures (11 et 12), montrent que la solution de CaCl2 à 0,05% assure la meilleure extraction (AC = 2520 U/g de son de blé)
suivie par le glycérol (1725 U/g de substrat) et l’acétone. L’eau distillée et l’eau de robinet ont assuré les plus faibles taux d’extraction.
Figure 11: Effet de différentes concentrations en solution de MgCl2, NaCl, KCl et CaCl2 sur
27
Figure 12 : Effet de différents solvants sur l’extraction l'enzyme coagulant le lait d’A. oryzae produite sur milieu solide (Shata, 2005).
L’interprétation de ces résultats a été basée sur deux points :
- L’amélioration de la solubilité de l’enzyme à des faibles concentrations en sel (ou le Salting-in) est favorisée par l’augmentation des interactions électrostatiques entre la protéine et le solvant ;
- Des travaux antérieurs ont suggéré puis démontré la présence de faibles liaisons ioniques entre la protéase produite et le substrat de fermentation ainsi qu’avec la paroi des cellules fongiques productrices. L’addition de la solution saline permet de briser
cette interaction et augmente la solubilité de la protéase d’intérêt (Wang 1967 ; Corpe et Winters, 1973; Shata, 2005).
D’un autre côté, l’augmentation de la concentration du glycérol jusqu’à 40% n’a pas permis d’atteindre celle obtenue avec la solution de CaCl2. Ce faible pouvoir extractant du
glycérol a été expliqué par l’effet de la viscosité du glycérol sur le transfert de la matière (Shata, 2005).
L’efficacité relative de quatre types d’alcool sur l’extraction de la protéase coagulante
d’Aspergillus oryzae NCIM 1032, produite par fermentation sur une mixture du son de blé et de riz, a été étudiée par Pati Pallavi et al. (2012). Les alcools testés à une concentration de
5% (v/v) sont : l’éthanol, le sorbitol, le méthanol, le glycérol par comparaison à l’eau distillée comme témoin. Les résultats de cette étude révèlent que le glycérol garantis le maximum