HAL Id: tel-01447144
https://tel.archives-ouvertes.fr/tel-01447144
Submitted on 26 Jan 2017HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Evaluation de l’effet protecteur de protéines du système
de sécrétion de type III de bactéries entéropathogènes
pour la vaccination et l’immunothérapie.
Bakhos Jneid
To cite this version:
Bakhos Jneid. Evaluation de l’effet protecteur de protéines du système de sécrétion de type III de bactéries entéropathogènes pour la vaccination et l’immunothérapie.. Vaccinologie. Université Paris-Saclay, 2016. Français. �NNT : 2016SACLS578�. �tel-01447144�
NTT : 2016SACLS578
L’U
Innovation Thérapeutique
Spécialité de doctorat
Évaluation de l’effet protecteur de protéines du Système de Sécrétion de Type III de
bactéries entéropathogènes pour la vaccination et l’immunothérapie
Thèse présentée et soutenue au
Composition du Jury :
Dr. Armelle Phalipon Directeur de recherche Dr. Christian Demeure Directeur de recherche Dr. Bernard Maillère Directeur de recherche Dr. Eric Faudry Chercheur
Dr. Stéphanie Simon Chef de labor
T
HESE DE DOCTORAT
DE
L’U
NIVERSITE
P
ARIS
-S
ACLAY
PREPAREE AU
“CEA
DE
S
ACLAY
”
ECOLE DOCTORALE N° 569
Innovation Thérapeutique : du fondamental à l’appliqué
Spécialité de doctorat : Immunologie-Microbiologie
Par
Monsieur Bakhos Jneid
valuation de l’effet protecteur de protéines du Système de Sécrétion de Type III de
bactéries entéropathogènes pour la vaccination et l’immunothérapie
soutenue au CEA de Saclay, le 24 Novembre 2016 :
Directeur de recherche, Institut Pasteur Rapporteur Directeur de recherche, Institut Pasteur Rapporteur Directeur de recherche, Paris-Saclay Examinateur Chercheur, CEA-Grenoble Examinateur Chef de laboratoire, CEA-Saclay Directrice de thèse
du fondamental à l’appliqué
Microbiologie
valuation de l’effet protecteur de protéines du Système de Sécrétion de Type III de
bactéries entéropathogènes pour la vaccination et l’immunothérapie
Rapporteur Rapporteur Examinateur Examinateur Directrice de thèse
3
Evaluation de l’effet protecteur de protéines du système de sécrétion de type III de bactéries entéropathogènes pour la vaccination et l’immunothérapie
Les bactéries entéropathogènes du genre Salmonella et Shigella sont transmises par les aliments ou l’eau et sont responsables de nombreuses infections entériques chez les humains. Ces maladies infectieuses restent une cause importante de morbidité et de mortalité dans les pays en voie de développement. L’existence de multiples souches de Salmonella et de Shigella ainsi que l’émergence de souches résistantes aux antibiotiques, nécessite le développement de vaccins efficaces et large spectre. Ces bactéries utilisent un système d’injection de leurs protéines effectrices, appelé Système de Sécrétion de Type III (SST3), nécessaire à leur pathogénicité. Certaines des protéines structurales composant l’injectisome sont relativement bien conservées parmi les différentes bactéries pathogènes, notamment les protéines de l’aiguille : PrgI et MxiH, et celles de la coiffe de l’aiguille : SipD et IpaD, respectivement de Salmonella et Shigella. Ces protéines, impliquées dans la virulence des bactéries, semblent donc être des cibles de choix pour lutter contre des infections impliquant ces bactéries pathogènes.
Le premier objectif de cette thèse était d’évaluer l’immunogénicité et l’effet protecteur des protéines structurales de l’injectisome citées précédemment contre les infections à Salmonella et Shigella. Les protéines recombinantes préparées et produites au laboratoire ont été utilisées de façon séparée ou en combinaison pour immuniser des souris par différentes routes. Ensuite, les réponses immunitaires des souris ainsi immunisées ont été analysées par des tests immunométriques. Enfin, la capacité protectrice de ces protéines structurales a été évaluée en infectant les souris avec Salmonella par voie orale ou Shigella par voie intranasale. Le meilleur résultat a été obtenu en utilisant la voie intra-gastrique pour les immunisations avec environ 72% de protection. Cette stratégie a permis également d’évaluer la pertinence de cette approche vaccinale dans un modèle murin de protection croisée. Le deuxième objectif de cette thèse était d’évaluer le pouvoir protecteur d’anticorps monoclonaux murins reconnaissant les régions conservées des protéines SipD et IpaD. Les anticorps obtenus ont été caractérisés et leur pouvoir neutralisant a été évalué in vivo dans un modèle murin d’infection avec Salmonella ou Shigella (jusqu’à 60% de protection).
L’ensemble de ces travaux montre que l’utilisation de certaines protéines structurales conservées de l’injectisome de bactéries entéropathogènes présente un intérêt vaccinal et immunothérapeutique pour aider au traitement de certaines salmonelloses et shigelloses.
Mots clés : Bactéries entéropathogènes, SST3, Vaccination, Anticorps monoclonaux, Immunothérapie.
Evaluation of the protective efficacy of Type III Secretion System proteins of enteropathogenic bacteria in vaccination and immunotherapy
Salmonella and Shigella species are food and water borne pathogens that are responsible for enteric infections in humans. These infectious diseases are still the major cause of morbidity and mortality in the emerging countries. The existence of multiple Salmonella and Shigella species as well as the emergence of antibio- resistant strains, require the development of protective and broad-spectrum vaccines. All these bacteria utilize a system for injection of their effectors, called Type III Secretion System (T3SS), necessary for their pathogenicity. While effector proteins are varied and depend essentially on the cellular target and thus on the specificity of the pathogen, the structural proteins that form the injectisome are common to all virulent Salmonella and Shigella spp., particularly the needle proteins PrgI and MxiH and the needle-tip proteins SipD and IpaD of Salmonella and Shigella respectively. These proteins, involved in the virulence of the bacteria, appear to be ideal candidate antigens for a subunit-based, broad spectrum vaccine.
The first aim of my PhD was to evaluate the immunogenicity and protective efficacy of structural proteins of the above-mentioned injectisome against Salmonella and Shigella infections. The recombinant proteins were prepared and produced in the laboratory and were used alone or in combination to immunize mice using different routes. The immune responses of immunized mice were then analyzed by immunometric assays. Finally, the protective efficacy was evaluated in a mouse model of intestinal (Salmonella) or pulmonary (Shigella) challenge. The best result was obtained by orogastric immunization with 72% of protection. This strategy also allowed to estimate the relevance of this approach in a mouse model of crossed protection. The second objective of my PhD was to evaluate the protective efficacy of murine monoclonal antibodies recognizing conserved regions of SipD and IpaD proteins. The obtained antibodies were characterized and their therapeutic effect was evaluated in vivo with a Salmonella and Shigella infection murine model (up to 60% of protection).
To conclude, this work showed that some conserved structural proteins composing the injectisome of enteropathogenic bacteria is of interest for treatment of enteric diseases caused by Salmonella and Shigella.
5
TABLE DES MATIÈRES
TABLE DES MATIÈRES……….5
LISTE DES FIGURES……….11
LISTE DES TABLEAUX……….13
ABRÉVIATIONS………..15
INTRODUCTION GÉNÉRALE ... 17
CHAPITRE I : LES BACTÉRIES ENTÉROPATHOGÈNES : SALMONELLA ET SHIGELLA ... 17
A. GÉNÉRALITÉS ... 17
B. LE GENRE SALMONELLA ... 18
1. Définition et nomenclature ... 18
2. L’épidémiologie ... 20
a. Les Salmonella non-typhoïdales ... 20
b. Les Salmonella typhoïdales ... 21
C. LE GENRE SHIGELLA ... 21
1. Définition et nomenclature ... 21
2. L'épidémiologie ... 22
D. LES FACTEURS DE VIRULENCE ET LA PATHOGÉNICITÉ... 23
1. Les gènes et les îlots de pathogénicité de Salmonella ... 23
2. Le plasmide de virulence et les toxines de Shigella ... 25
E. LE SYSTÈME DE SÉCRÉTION DE TYPE 3 ... 26
1. L’architecture du SST3 ... 27
2. L’assemblage du SST3 ... 28
F. L’INTERACTION BACTÉRIE - CELLULE HÔTE ... 30
1. L’adhésion ... 30
2. L’invasion cellulaire ... 31
3. La survie intracellulaire ... 32
CHAPITRE II : LES RÉPONSES IMMUNITAIRES INDUITES SUITE AUX INFECTIONS À SALMONELLA ET SHIGELLA ... 34
A. RAPPEL SUR LES INFECTIONS BACTÉRIENNES ... 34
1. L’immunité innée et adaptative ... 34
6
B. LES DÉFENSES IMMUNITAIRES CONTRE SALMONELLA ... 37
1. La réponse immunitaire innée ... 38
2. La réponse immunitaire cellulaire adaptative ... 39
C. LES DÉFENSES IMMUNITAIRES CONTRE SHIGELLA ... 41
1. La réponse immunitaire innée ... 41
2. La réponse immunitaire adaptative humorale et cellulaire ... 43
CHAPITRE III : L’ÉTAT DES LIEUX DES APPROCHES VACCINALES DÉVELOPPÉES CONTRE SALMONELLA ET SHIGELLA ... 44
A. LES VACCINS CONTRE SALMONELLA ... 44
1. Les vaccins du passé et présents ... 45
2. Les vaccins du futur... 46
B. LES VACCINS CONTRE SHIGELLA ... 49
1. Les vaccins vivants de virulence atténuée ... 50
2. Les vaccins à base de sous-unités ... 52
C. LA VACCINATION PAR VOIE ORALE ... 53
CHAPITRE IV : LES ANTICORPS THÉRAPEUTIQUES ... 56
A. LES ANTICORPS MONOCLONAUX ... 57
1. Définition et structure ... 57
2. Les différents types d’AcM ... 58
B. LES MÉCANISMES D’ACTION ... 59
C. L’ÉVOLUTION DES ANTICORPS THÉRAPEUTIQUES ET LES MALADIES INFECTIEUSES ... 62
D. LES ANTICORPS DIRIGÉS CONTRE LE SST3 ... 61
E. LES LIMITES DE L’UTILISATION D’ANTICORPS MONOCLONAUX ... 63
OBJECTIFS DES TRAVAUX DE THÈSE ... 65
MATÉRIEL ET MÉTHODES ... 67
I.LE MATÉRIEL BIOLOGIQUE UTILISÉ ... 67
1. Les bactéries ... 67
2. Les protéines recombinantes ... 67
3. Les anticorps monoclonaux ... 68
II. LE CLONAGE DES GÈNES CODANT LES PROTÉINES DA LA COIFFE ET L’AIGUILLE ... 68
1. L’extraction de l’ADN plasmidique ... 68
2. L’amplification de l’ADN par PCR... 69
7
4. Le clonage dans le vecteur pET-22b (+) ... 70
5. La transformation des bactéries compétentes ... 70
6. Le criblage des clones de bactéries recombinantes ... 70
7. La purification et la vérification des plasmides recombinants ... 71
III. LA PRODUCTION DES PROTÉINES RECOMBINANTES ... 71
1. Le test d’expression des protéines en corps d’inclusion avec induction à l’IPTG ... 71
2. La purification des protéines recombinantes par chromatographie d’affinité sur colonne de nickel ... 71
IV.LA PRODUCTION DES ANTICORPS MONOCLONAUX ... 72
1. L’immunisation des souris avec les immunogènes ... 72
2. L’obtention des hybridomes par fusion des lymphocytes B avec un myélome... 73
3. L’obtention des anticorps monoclonaux dans le liquide d’ascite et isotypage ... 73
4. La purification des anticorps monoclonaux par chromatographie d’affinité sur protéine A ………74
V.LES ANALYSES BIOCHIMIQUES ... 74
1. L’électrophorèse et la coloration au bleu de Coomassie ... 74
2. L'immuno-empreinte (« Western-Blot ») ... 75
3. La détermination des épitopes de reconnaissance des anticorps ... 75
VI.LES DOSAGES IMMUNOMÉTRIQUES ... 76
1. La préparation du matériel pour les tests EIA ... 76
a. Les tampons utilisés ... 76
b. La préparation des phases solides ou le « coating » ... 76
c. Les traceurs ... 77
d. Le réactif d’Ellman ... 77
2. Les tests immuno-enzymatiques ou EIA ... 77
a. Le test ELISA indirect pour le dosage d'immunoglobulines ... 77
b. Le test ELISA indirect ... 78
c. Le test ELISA sandwich ... 79
d. Les quantifications et les analyses statistiques ... 80
3. Le test ELISPOT ou « Enzyme-Linked ImmunoSPOT » ... 80
VII.L’EXPÉRIMENTATION ANIMALE ... 82
1. Les tests in vivo ... 82
a. La détermination des doses létales 50 des bactéries utilisées pour les infections……….82
b. Les immunisations pour les protections contre les infections à Salmonella et Shigella.82 c. L’efficacité de protection des anticorps monoclonaux dirigés contre IpaD/SipD contre des infections à Salmonella et Shigella (immunothérapie passive) ... 84
8
2. Les prélèvements d’organes et de cellules sanguines ... 85
a. Les ponctions sanguines ... 85
b. Les prélèvements des poumons ... 85
RÉSULTATS ... 87
PARTIE A : LA VACCINATION AVEC DES PROTÉINES DU SYSTÈME DE SÉCRÉTION DE TYPE III DE SALMONELLA ET SHIGELLA ... 87
I. LA VACCINATION CONTRE SALMONELLA TYPHIMURIUM ET SHIGELLA FLEXNERI ... 87
1. La production et la purification des protéines recombinantes du SST3 ... 88
2. Les immunisations avec les protéines du SST3 de S. Typhimurium ... 89
a. La cinétique de la réponse humorale en IgG et IgA dans les sérums ... 89
i. Les réponses Ig(G+M) ... 89
ii. Les réponses IgA... 92
iii. Les réponses IgG1 et IgG2(a+b)……….94
b. La DL 50 de Salmonella Typhimurium ... 97
c. L’effet de protection après une infection avec Salmonella Typhimurium ... 98
3. Les immunisations avec les protéines du SST3 de S. flexneri ... 100
a. La cinétique de la réponse humorale en IgG et IgA dans les sérums ... 100
i. Les réponses Ig(G+M) ... 100
ii. Les réponses IgA... 103
iii. Les réponses IgG1 et IgG2(a+b) ... 104
b. La DL 50 de Shigella flexneri 2a... 107
c. L’effet de protection après une infection avec Shigella flexneri 2a ... 108
4. Discussion et Perspectives ... 109
II. L’EXPLORATION DE L’INDUCTION DE LA RÉPONSE TH1 DANS LE CADRE DE LA VACCINATION CONTRE S. TYPHIMURIUM ... 113
1. Le dosage des cytokines spécifiques (IL-4 et IFN-γ) sécrétées par les cellules immunitaires du sang périphérique ... 114
2. L’efficacité de protection après l’infection avec S. Typhimurium ... 115
3. Discussion et Perspectives ... 117
III. LA PROTECTION CROISÉE SALMONELLA-SHIGELLA ... 117
1. La réponse humorale en Ig(G+M)dans le sérum ... 118
2. L’efficacité de protection croisée après les infections ... 122
3. Discussion et Perspectives ... 123
ARTICLE:Role of SPI-1 T3SS proteins in protecting mice against non-typhoidal Salmonella Typhimurium..………....127
9 PARTIE B : L’IMMUNOTHÉRAPIE PASSIVE POUR LA PRÉVENTION ET LE
TRAITEMENT DES INFECTIONS À SALMONELLA ET SHIGELLA ... 161
I. LA PRODUCTION ET LA CARACTÉRISATION DES ANTICORPS MONOCLONAUX DIRIGÉS CONTRE LE SST3 ... 162
1. Le choix des antigènes... 162
2. La production et la sélection des anticorps monoclonaux ... 163
a. L’immunisation et la fusion ... 163
b. La sélection des hybridomes ... 164
c. Le clonage des hybridomes ... 164
d. L’obtention des anticorps monoclonaux... 164
3. La caractérisation des AcMs produits ... 165
a. Par immunoblot avec les protéines recombinantes ... 165
b. La sélection des AcMs neutralisantsin vivo ... 166
c. La caractérisation des épitopes de reconnaissance des AcMs ... 167
4. Les analyses combinatoires ... 167
II. L’UTILISATION DES ANTICORPS MONOCLONAUX EN PROPHYLAXIE ………..171
1. L’infection avec S. Typhimurium ... 171
2. L’infection avec S. flexneri 2a ... 172
III. LES ANTICORPS MONOCLONAUX ET L’IMMUNOTHÉRAPIE ... 173
1. L’infection avec S. Typhimurium ... 173
2. L’infection avec S. flexneri 2a ... 175
IV. L’IMMUNOTHÉRAPIE « PASSIVE/VACCINANTE » ... 177
V. DISCUSSION ET PERSPECTIVES ... 179
CONCLUSION GÉNÉRALE... 185
RÉFÉRENCES BIBLIOGRAPHIQUES ... 187
11
LISTE DES FIGURES
Figure 1 : Image de synthèse de Salmonella Typhi. ... 19
Figure 2 : Shigella flexneri vue au microscope électronique.. ... 22
Figure 3 : Facteurs de virulence de S. Typhimurium et S. Typhi. ... 24
Figure 4 : Représentation schématique des différents SPI chez S. Typhimurium.. ... 24
Figure 5 : Région 31 kb ou « entry region » du plasmide de virulence pWR100 de 230 kb codant pour les composants et les protéines effectrices du SST3 de S. flexneri... 25
Figure 6 : Vue structurale du SST3 ou injectisome de S. flexneri et de S. Typhimurium ... 27
Figure 7 : Modèle du processus de sécrétion des différents substrats du SST3 ... 29
Figure 8 : Mécanismes d’infection deShigella flexneri et de Salmonella enterica ... 31
Figure 9 : Réponses immunitaires innées et adaptatives. ... 34
Figure 10 :Architecture de la surface de la muqueuse intestinale... 36
Figure 11 : Mécanismes de défenses immunitaires au niveau de la muqueuse intestinale ... 37
Figure 12 : Réponse immunitaire innée de l’intestin contre Salmonella ... 38
Figure 13 : Rôle de la stimulation spécifique et non-apparentée des cellules T dans l’immunité contre Salmonella ... 40
Figure 14 : Réponses immunitaires induites par Shigella ... 42
Figure 15 : Anciens et nouveaux vaccins contre Salmonella et leur évolution ... 45
Figure 16 : Distribution géographique de la fièvre typhoïde et des iNTS. ... 49
Figure 17 : Différentes technologies développées pour l’administration des vaccins par voie orale ... 54
Figure 18 : Structure des anticorps d’immunoglobuline G ou IgG ... 58
Figure 19 : Différents types d’anticorps monoclonaux thérapeutiques ... 59
Figure 20 : Mécanismes d’action des anticorps thérapeutiques ... 60
Figure 21 : Prévention de la formation des pores de translocation dans la membrane de la cellule hôte par des anticorps thérapeutiques dirigés contre les protéines de la coiffe de l’injectisome ... 63
Figure 22: Test ELISA indirect pour le dosage d'immunoglobulines. ... 78
Figure 23 : Test ELISA indirect. ... 79
Figure 24 : Test ELISA sandwich. ... 80
Figure 25 : Test ELISPOT. ... 81
Figure 26 : Processus d’immunisation et d’infection. ... 83
Figure 27 : Analyse par SDS-PAGE et coloration au Bleu de Coomassie des protéines recombinantes purifiées IpaD, MxiH, SipD et PrgI ... 88
Figure 28 : Réponses sériques en Ig(G+M) spécifiques de PrgI et SipD. ... 92
Figure 29 : Réponses sériques en IgA de souris immunisées avec PrgI ou SipD et PrgI/SipD ... 93
Figure 30 : Réponses sériques des sous-classes IgG1, IgG2a et IgG2b spécifiques de PrgI et de SipD ... 96
Figure 31 : Ratio IgG2(a+b) : IgG1 après les immunisations avec PrgI et SipD ... 97
Figure 32 : Détermination de la DL 50 de S. Typhimurium. ... 98
Figure 33 : Efficacité de protection de PrgI et SipD.. ... 99
Figure 34 : Réponses sériques en Ig(G+M) spécifiques de MxiH et IpaD ... 102
Figure 35 : Réponses sériques en IgAde souris immunisées avec IpaD ou MxiH/IpaD. ... 103
Figure 36 : Concentrations sériques des sous-classes IgG1 et IgG2(a+b) spécifiques de MxiH et IapD. .. 105
Figure 37 : Ratio IgG2(a+b) : IgG1 après les immunisations avec IpaD et MxiH/IpaD. ... 106
Figure 38 : Détermination de la DL 50 de S. flexneri 2a ... 108
Figure 39 : Efficacité de protection d’IpaD et MxiH/IpaD. ... 109
Figure 40 : La balance TH1/TH2. ... 114
Figure 41 : Dosage des cytokines, sécrétées par les cellules immunitaires du sang, spécifiques de PrgI ou de SipD.. ... 115
12
Figure 42 : Efficacité de protection de PrgI et/ou SipD après des immunisations par voie SC en utilisant
l’alum-CpG comme adjuvant. ... 116
Figure 43 : Alignement de séquences des protéines SipD de Salmonella Typhimurium et IpaD de Shigella flexneri ... 118
Figure 44 : Réponses en Ig(G+M) sériques spécifiques de SipD et croisées avec IpaD ... 120
Figure 45 : Réponses en Ig(G+M) sériques spécifiques de IpaD et croisées avec SipD ... 121
Figure 46 : Efficacité de protection croisée d’IpaD et de SipD ... 122
Figure 47 : Structure 3D du complexe MxiH-IpaD du SST3 de Shigella... 161
Figure 48 : Les zones d’interaction conservées des protéines de l’aiguille PrgI et MxiH et celles de la coiffe SipD et IpaD ... 162
Figure 49 : Titres en anticorps polyclonaux présents dans le plasma des souris sélectionnées pour effectuer les fusions. ... 163
Figure 50 : Immunoblots avec les protéines recombinantes pour chaque AcM. ... 166
Figure 51 : Courbe de survie des souris traitées avec les anticorps monoclonaux 24 h avant l’infection avec 100 DL 50 deS. Typhimurium ... 172
Figure 52 : Courbe de survie des souris traitées avec les anticorps monoclonaux 24 h avant l’infection avec 100 DL 50 de S. flexneri 2a ... 173
Figure 53 : Courbe de survie des souris traitées avec les anticorps monoclonaux à différents temps après l’infection avec 100 DL 50 deS. Typhimurium : J0, J+1 et J+5. ... 174
Figure 54 : Courbe de survie des souris traitées avec les anticorps monoclonaux à différents temps après l’infection avec 100 DL 50 S. flexneri 2a : J0, J+4h et J+24h. ... 176
Figure 55 : Courbe de survie des souris traitées avec les anticorps monoclonaux 8 semaines avant l’infection soit avec S. Typhimurium soit avec S. flexneri 2a.. ... 177
13
LISTE DES TABLEAUX
Tableau 1 : Nomenclature du genre Salmonella. ... 19
Tableau 2 : Effecteurs de l’immunité innée et adaptative dans une infection bactérienne extra ou intracellulaire ... 35
Tableau 3 : Avantages et inconvénients des vaccins actuels ... 46
Tableau 4 : Avantages et inconvénients des vaccins en cours de développement ... 47
Tableau 5 : Différents types de vaccins contre Shigella en développement ... 51
Tableau 6 : Avantages et inconvénients des systèmes d’administrations par voie orale ... 55
Tableau 7 : Souches bactériennes utilisées. ... 67
Tableau 8 : Protéines recombinantes produites possédant une étiquette poly-histidine ... 67
Tableau 9 : Anticorps monoclonaux produits et utilisés. ... 68
Tableau 10 : Amorces utilisées ... 69
Tableau 11 : Immunisations et infections réalisées pour la protection croisée Salmonella-Shigella ... 84
Tableau 12 : Les quantités de protéines produites et purifiées. ... 88
Tableau 13 : Récapitulatif des réponses en anticorps (Ig(G+M), IgG1, IgG2(a+b) et IgA) après la dernière immunisation avec PrgI ou SipD par les différentes voies SC, IN et OG ... 89
Tableau 14 : Récapitulatif des réponses en anticorps (Ig(G+M), IgG1, IgG2(a+b) et IgA) après la dernière immunisation avec PrgI et SipD en combinaison par les différentes voies SC, IN et OG ... 94
Tableau 15 : Efficacité de protection des protéines du SST3, PrgI et SipD, dans un modèle murin d’infection avec S. Typhimurium par voie orale ... 100
Tableau 16 : Récapitulatif des réponses en anticorps (Ig(G+M), IgG1, IgG2(a+b) et IgA) après la troisième immunisation avec IpaD ou MxiH/IpaD associées par les voies IN et OG ... 102
Tableau 17 : Efficacité de protection des protéines, IpaD et MxiH/IpaD, dans un modèle murin d’infection avec S. flexneri 2a par voie intra-nasale ... 109
Tableau 18 : Efficacité de protection de PrgI et/ou SipD dans un modèle murin d’infection avec S. Typhimurium après des immunisations par voie sous-cutanée utilisant l’Alum et l’Alum-CpG comme adjuvants. ... 116
Tableau 19 : Récapitulatif des réponses en anticorps Ig(G+M) obtenues après la dernière immunisation avec SipD et IpaD par les voies IN et OG. ... 119
Tableau 20 : Efficacité de protection croisée induite par IpaD et SipD dans un modèle murin d’infection avec S. Typhimurium et S. flexneri 2a. ... 123
Tableau 21 : Dénominations et isotypes des AcMs produits contre MxiH-PrgI et IpaD-SipD. ... 165
Tableau 22 : Efficacité de protection des AcMs (2 X 500 µg/souris) dirigés contre les régions conservées de « IpaD-SipD » dans un modèle murin d’infection avec S. Typhimurium. ... 167
Tableau 23 : Résultats de l’analyse combinatoire des AcMs IpaD-SipD, avec les protéines recombinantes IpaD et SipD utilisées à la concentration de 100 ng/mL... 169
Tableau 24 : Résultats de l’analyse combinatoire des AcMs IpaD-SipD, avec les protéines recombinantes IpaD et SipD utilisées à la concentration de 10 ng/mL ... 170
Tableau 25 : Récapitulatif des efficacités de protection des AcMs... 175
Tableau 26 : Efficacité de protection des AcMs, avec ou sans l’antigène SipD ou IpaD, dans un modèle murin d’infection avec S. Typhimurium (voie OG) et S. flexneri 2a (voie IN) après 8 semaines de l’injection par voie IP ... 178
15
ABRÉVIATIONS
AcM Anticorps monoclonal AChE Acétylcholinestérase
ADCC Cytotoxicité à médiation cellulaire dépendante des anticorps ADN Acide désoxyribonucléique
AEBSF 4-(2-Aminoethyl) benzenesulfonyl fluoride hydrochloride BEP Bactéries entéropathogènes
BET Bromure d’éthidium
BLSE Béta-lactamases à spectre élargi
CAS Anticorps de chèvre anti-anticorps de souris CDC Cytotoxicité dépendante du complément CDCP Centers for Disease Control and Prevention CFU Unités formant colonies
CMH Complexe Majeur d'Histocompatibilité CPA Cellule Présentatrice de l'Antigène CT Toxine cholérique CTL Cytotoxic T Lymphocytes DC Cellules Dendritiques DL Dose Létale DMF Diméthylformamide DTNB Acide dithio-bis-nitrobenzoïque EDTA Ethylène Diamine Tétra Acétique EHEC E. coli entérohémorragique EIA Enzyme immunoassay
ELISA Enzyme-linked immunosorbent assay ELISPOT Enzyme-Linked ImmunoSPOT EPEC E. coli entéropathogènes FAE Follicle-Associated Epithelium GALT Gut-Associated Lymphoid Tissu GIT Tractus gastro-intestinal
16
IgG Immunoglobuline de type G IgM Immunoglobuline de type M IM Membrane interne bactérienne IN Intra-nasale
iNTS Invasive Non-Typhoïdal Salmonella IP Intrapéritonéale
LB Luria Broth
LPS Lipopolysaccharide M cells Microfold cells
MLN Ganglions lymphatiques mésentériques
NC Needle Complex
NK Naturel killer
NTS Non-Typhoidal Salmonella OG Intra-gastrique
OMS Organisation Mondiale de la Santé OM Membrane externe bactérienne
PAMP Pathogen-Associated Molecular Pattern Molecules PCR Polymerase chain reaction
PMN Leucocytes polymorphonucléaires PP Plaques de Peyer
PRR Pattern Recognition Receptor
SC Sous-cutanée
SCV Salmonella-containing vacuole
SDS-PAGE Sodium dodecyl sulfate polyacrylamide gel electrophoresis SPI Salmonella Pathogenicity Island
SST3 Système de Sécrétion de Type 3 TCR T Cells Receptor
Th T helper
TLR Toll-like Receptor UE Unités Ellman
UNICEF Fonds des Nations Unies pour l'enfance VIH Virus de l'Immunodéficience Humaine
17
INTRODUCTION GÉNÉRALE
CHAPITRE I : LES BACTÉRIES ENTÉROPATHOGÈNES :
SALMONELLA ET SHIGELLA
A. GÉNÉRALITÉS
Les bactéries entéropathogènes ou BEP appartiennent à la famille des Enterobacteriaceaequi comprend plusieurs genres bactériens dontSalmonella et Shigella. Ce sont généralement des bacilles à Gram négatif, immobiles ou mobiles grâce à une ciliature péritriche. Ils sont aéro-anaérobies facultatifs. Beaucoup d’entérobactériessont, à des degrès divers, extrêmement pathogènes pour l’hôte (1). On en distingue alors deux groupes : les pathogènes stricts (par exemple Salmonella typhi, Shigella dysenteriae, Escherichia coli entérotoxique, etc.)et les pathogènes opportunistes (par exemple Serratia, Klebsiella,E. coli, etc.).L’infection par les BEP strictes est produite par voie digestive (eau ou aliment contaminé) et provoquedes troubles intestinaux de gravité variable (diarrhées, gastro-entérites, dysentérie...) mais peut également induire une dissémination systémique. Les BEP opportunistes sont quant à elles susceptibles de déclencher une infection essentiellement chez les sujets immunodéprimés surtout en milieu hospitalier(2,3).
Les diarrhées aiguës bactériennes constituent encore aujourd’hui un grave problème de santé publique dans les pays en développement. Elles représentent la deuxième cause de mortalité et de morbidité chez les enfants âgés moins de 5 ans (4). Des chiffres permettent de réaliser l’ampleur du problème : 8.8 millions de cas dans le monde, 25% de décès d’enfants de 0 à 5 ans dans certains pays d’Afrique de l’Est et centrale et 31% en Asie du Sud, 22 pour 1000 enfants de moins de 1 an meurent de diarrhée avec 14 à 16 épisodes par an et par enfant (5). Le taux d’incidence des maladies diarrhéiques est variable, il dépend des pays et de la tranche d’âge des enfants atteints. A titre d’exemple, en 2010, dans les pays aux revenus faibles ou moyens, chaque enfant de moins de 5 ans a subi en moyenne 2.9 épisodes soit un total de 1.7 milliards d’épisodes de diarrhées avec 1.8 millions de décès(6).
Plusieurs espèces bactériennes sont impliquées dans les diarrhées aiguës notamment lesE. coli entéropathogènes ECEP, Salmonella enterica et Shigella spp. S. enterica est le troisième agent pathogène parmi les espèces bactériennescapables de causer une vaste gamme de maladies allant de l’intoxication alimentaire aux infections systémiques mortelles dans les pays d’Afrique et l’Amérique
18
du Sud (7-9). D’autre part, les Shigella (agents responsables des shigelloses), restent une menace de santé publique dans le monde entier, particulièrement dans les pays en voie de développement (10). Par exemple, Shigella spp occupe la quatrième position parmi les agents bactériens à l’origine d’épidémies en Afrique, l’Amérique et l’Europe(8, 11).
La résistance des entérobactéries aux antibiotiques est de plus en plus préoccupante(12,13). En effet, l’utilisation massive et non-raisonnée d’antibiotiques à large spectre (comme les béta-lactamines et en particulier les carbapénèmes) a induit la sélection de souches productrices de bétalactamases à spectre élargi (BLSE ou ESBL en anglais) et de carbapénèmases capables de les inactiver, réduisant ainsi l’éventail thérapeutique, pouvant même conduire à une impasse thérapeutique(14,15). D’autres mécanismes de résistance (autres que la production d’enzymes capables d’hydrolyser les antibiotiques) peuvent s’y ajouter rendant les bactéries multi- voire toto-résistantes.
La persistance des maladies diarrhéiques en particulier les infections à Salmonella et Shigella dans certaines régions du monde et surtout chez les enfants de 1 à 5 ans dans les pays en développement, ainsi que l’émergence de souches multi-résistantes aux antibiotiques, impliquent la nécessité de disposer d’un traitement efficace contre ces bactéries.
B. LE GENRE SALMONELLA
1. Définition et nomenclature
Les organismes qui appartiennent au genre Salmonella sont des bacilles Gram-négatif, mobiles, anaérobies facultatifs, intracellulaires facultatifs et sont classifiés dans la famille des Enterobacteriaceae(Figure 1). Le genre Salmonella consiste en 2 espèces : enterica et bongori(16). En 2001, des études d’hybridation d’ADN ont suggéré que les Salmonella les plus importantes cliniquement peuvent être incluses dans une seule espèce : Salmonella enterica sous-espèce enterica(17). Plus de 2500 sérotypes ont pu être identifiés par des études sérologiquesutilisant des anti-sera adressés contre des antigènes de surface spécifiques : O (somatiques ou lipopolysaccharides), H (flagellaires) et Vi (capsulaires)(18).
19 Figure 1 : Image de synthèse de Salmonella Typhi(19).
Parce que la nomenclature de Salmonella peut être très complexe et pour une meilleure clarification, le CDC (Centers for Disease Control and Prevention, USA) a publié une terminologie facilitant l’interprétation pour l’utilisation clinique et épidémiologique, comme indiqué dans le tableau 1 ci-dessous.
Nom complet Désignation CDC
Salmonella enterica subsp enterica ser Typhi Salmonella enterica subsp enterica ser Paratyphi A Salmonella enterica subsp enterica ser Typhimurium Salmonella enterica subsp enterica ser Enteritidis Salmonella enterica subsp enterica ser Dublin
Salmonella ser Typhi Salmonella ser Paratyphi A Salmonella ser Typhimurium Salmonella ser Enteriditis Salmonella ser Dublin Abréviations : subsp, sous-espèce ; ser, sérotype
Tableau 1 : Nomenclature du genre Salmonella. Adapté d’après (20).
Salmonella Typhi et Salmonella Paratyphi A, B et C sont responsables de la fièvre typhoïde et paratyphoïde et sont des pathogènes strictement humains(21) dont la transmission interhumaine s’effectue de manière directe (mains sales) ou de manière indirecte (eau et aliments souillés par des matières fécales de porteurs sains ou de malades). Ces Salmonella sont dites majeures en raison de la gravité de la pathologie qu’elles provoquent(22). Salmonella Typhimurium et Salmonella Enteriditis sont quant à elles dites « Non-Typhoidal Salmonella (NTS) » ou mineures et sont responsables dans la majorité des cas de gastro-entérites chez les humains(23). Ces salmonelles non-typhoïdales ne sont pas restreintes à l’Homme et leur transmission est fréquemment associée à la consommation d’eau et de nourriture contaminées d’origine animale dans des conditions d’hygiène insuffisante (toxi-infections alimentaires). Dans certains cas (dépendant de l’hôte et de la souche bactérienne), ces infections peuvent être gravissimes et même conduire à la mort. En particulier, chez le nouveau-né, le jeune enfant aussi bien que chez les enfants et adultes immunodéprimés (avec des troubles d’hémoglobine,
20
ou présentant une co-infection avec le virus de l’immunodéficience humaine VIH(24,25), ou la malaria ou d’autres causes d’immunosuppression), ces Salmonella sont susceptibles de provoquer un syndrome septicémique (appelé iNTS pour « invasive Non-Typhoïdal Salmonella ») et la mort de ces derniers(26,27).
2. L’épidémiologie
Les infections à Salmonella représentent une cause majeure de gastro-entérites aiguës dans le monde entier avec une incidence évaluée à 2.8 milliards de cas de diarrhées chaque année. L’épidémiologie des infections à NTS diffère tout à fait de celle de la fièvre typhoïde et paratyphoïde.
a. Les Salmonellanon-typhoïdales
Les infections à salmonelles non-typhoïdales sont une cause majeure de morbidité et de mortalité dans le monde entier tant chez les enfants que chez les adultes. Les données épidémiologiques de pays en voie de développement sont difficiles à établir du fait de systèmes de surveillance insuffisants dans beaucoup de ces pays. Selon une étude réalisée par Crump et Mintz en 2010 (28), les infections à NTS causeraient plus de 90 millions de maladies et environ 155 000 décès chaque année dans le monde entier. En Afrique, l’incidence annuelle est évaluée à 175 à 388 cas pour 100000 enfants âgés de 3 à 5 ans (29,30)et 2000 à 7500 cas pour100 000 adultes infectés par le VIH(31-33). Aux Etats-Unis, des études montrent que l’incidence des infections à NTS est de 17.6 cas pour 100 000 personnes et que les enfants de moins de 5 ans ont un taux d’incidence quatre fois plus élevé, de 69.5 cas d’infections pour 100 000 enfants (34).
Dans les pays développés, les épidémies d’infections à NTS sont généralement associées aux volailles et sont transmises par des produits alimentaires contaminés (des œufs crus ou insuffisamment cuits, de la viande, du lait et d’autres produits frais, comme des légumes). A l’inverse, dans les pays en voie de développement (par exemple les pays d’Afrique et d’Asie), ces infections semblent être plutôt associées aux contaminations d’eau. La transmission peut également se faire par contact avec des animaux domestiques (et même par la manipulation de leur nourriture) tels que des chats et des chiens, des rongeurs (des souris, des rats), ainsi que des reptiles et des amphibiens (le plus généralement des tortues, des grenouilles et des serpents)(18).
Les symptômes des infections à NTS dépendent du nombre de bactéries ingérées. Il faut 106 à 108 de bactéries pour qu’un hôte humain sain développe une maladie symptomatique. Les patients présentent souvent des nausées, de la fièvre, des vomissements, des diarrhées aqueuses et des douleurs abdominales. Chez les enfants en bas âge ou immunodéprimés, la maladie peut être causée par l’ingestion d’un inoculum bactérien plus faible. Dans ces cas, les patients immunodéprimés peuvent développer aussi des signes cliniques non spécifiques (par exemple une pneumonie, une
21 splénomégalie, une hépatomégalie et autres) (35). Après l’infection et sans traitement antimicrobien, les bactéries sont excrétées pendant environ 4 à 6 semaines. L’immunodépression et la thérapie antimicrobienne peuvent prolonger l’excrétion fécale des bactéries(18).
b. Les Salmonella typhoïdales
L’Organisation Mondiale de la Santé (OMS) estime à 16 à 33 millions les cas de fièvres typhoïdes et paratyphoïdes causant 500 000 à 600 000 décès annuellement dans le monde (18,36). L’Asie Centrale, l’Asie du Sud-Est et l’Afrique du Sud sont les régions les plus touchées par les fièvres typhoïdes et paratyphoïdes (plus de 100 cas pour 100 000 personnes par an)(37,38). Cette incidence est plus faible (10-100 cas pour 100 000 personnes par an) en Amérique latine, le reste de l’Asie et de l’Afrique. En Europe et en Amérique du Nord, l’incidence est la plus basse (0.2 pour 100 000 personnes en France) et cette baisse est attribuée à la disposition d’eau propre et de systèmes d’eaux usées plus sophistiqués (22,39). Globalement, l’incidence des fièvres paratyphoïdes est considérablement plus faible que celle des fièvres typhoïdes. Par exemple, en Inde, la prévalence de la fièvre paratyphoïde est au moins 10 fois plus faible que celle de la fièvre typhoïde (40).
L’homme est le seul hôte naturel et le réservoir pour Salmonella Typhi et Paratyphi, qui sont capables de survivre dans n’importe quel type d’eau pendant des jours ainsi que dans les œufs et les huîtres pendant des mois. L’infection arrive souvent par l’ingestion de nourriture ou d’eau contaminées avec des excréments humains (103 à 106 de bactéries sont suffisantes pour provoquer une infection chez l’homme par S. Typhi). Celle-ci provoque des signes cliniques comme la fièvre plus ou moins associée à des signes digestifs (diarrhées, constipation, hémorragies intestinales et perforations, maux de tête, etc.) et des signes biologiques (une leucopénie). La transmission s’effectue par contact avec des gens infectés, malades ou porteurs sains, ayant une hygiène corporelle limitée (en particulier absence de lavages de mains) (18).
C. LE GENRE SHIGELLA
1. Définition et nomenclature
Les Shigella spp. appartiennent à la famille des Enterobacteriaceae et sont des bactéries Gram-négatif, non-sporulées, non-capsulées, immobiles, anaérobies facultatifs, en forme de tige (Figure 2). Elles sont des pathogènes intracellulaires facultatifs qui montrent une grande spécificité pour les primates et l'homme. Le premier rapport sur l'isolement et la caractérisation des bactéries causant la dysenterie bacillaire, nommées plus tard Shigella, a été publié par Kiyoshi Shiga à la fin du 19èmesiècle. Dans des études d'hybridation de l'ADN, les espèces d'E. coli et de Shigella, qui sont
22
extrêmement proches, ne peuvent pas être différenciées au niveau polynucléotidique mais que par la présence du plasmide de virulence chez Shigella(41). Afin de distinguer les souches pathogènes de celles moins pathogènes ou non-pathogènes, le genre Shigella est défini sur la base des caractéristiques biochimiques, sérologiques et cliniques(42). On distingue quatre espèces de Shigella : S. dysenteriae (séro-groupe A), S. flexneri (séro-groupe B), S. boydii (séro-groupe C) et S. sonnei (séro-groupe D). Dans les pays en voie de développement,S. flexneri et, dans une moindre mesure, S. sonnei sont endémiques et causent la majorité de toutes les shigelloses. Quant à S. dysenteriae, elle est épidémique et représente la forme la plus sévère responsable de la majorité des cas mortels de shigellose (43). En Europe, S. sonnei est responsablede 61% des shigelloses observées (44).
Figure 2 : Shigella flexneri vue au microscope électronique. Adaptée de(45).
2. L'épidémiologie
La shigellose reste un vrai problème de santé publique, particulièrement dans les pays en voie de développement à niveau d'hygièneinsuffisant (46). A l’échelle mondiale, l'incidence des shigelloses est la plus élevée chez les enfants de 1 à 4 ans. Dans les cas d’épidémies de S. dysenteriae,dans les pays en développement, toutes les tranches d'âge sont affectées et sont responsablesd'approximativement 5% de tous les épisodes diarrhéiques chez les enfants de moins de 5 ans et jusqu'à 75% de décès(47).Le nombre d’épisodes annuels de Shigella a été évalué à 164.7 millions dans le monde entier, dont 163.2 millions dans les pays en voie de développement (avec 1.1 millions de décès) et 1.5 millions dans les pays industrialisés(5, 43, 47).
Les shigelles sonttransmises par voie oro-fécale soit par l’intermédiaire de personnes malades soit par l'ingestion de nourriture et d'eau contaminées. Ces bactéries sont extrêmement infectieuses puisque seulement 10 à 100 micro-organismes ingérés par voie orale sont suffisants pour causer la maladie chez l’Homme (48).
La shigellose, appelée aussi dysenterie bacillaire, est une infection invasive intestinale aiguë, dont les signes cliniques peuvent s'étendre d’une diarrhée aqueuse modérée ou sévère à une rectocolite infectieuse. Ces signes cliniques varient selon l'espèce de shigelle, l'âge et le statut immunitaire de
23 l'hôte, et la présence de facteurs de risque. La période d'incubation est en moyenne de 1 à 4 jours et jusqu’à 8 jours avec S. dysenteriae(49). Les symptômes commencent à apparaître dans les 24-48 heures après l'ingestion des bactéries. Les sujets atteints se plaignent de crampes abdominales parfois accompagnées de vomissements, de selles très importantes, sanglantes, purulentes glaireuses, et parfois hémorragiques ainsi que de fièvre, de fatigue, de malaise et d'anorexie(50).
Dans beaucoup de pays en voie de développement, l'immunodéficience associée au VIH est responsable des manifestations cliniques les plus sévères de Shigella, comprenant une maladie intestinale persistante ou récurrente et une bactériémie(51). L’infection à Shigellapeut devenir mortelle chez ces patients immunodéprimés ou si des soins médicaux adéquats ne sont pas mis en place chez les sujets atteints.
D. LES FACTEURS DE VIRULENCE ET LA PATHOGÉNICITÉ
1. Les gènes et les îlots de pathogénicité de Salmonella
Le séquençage du génome entier de Salmonellaa permis l’identification et la caractérisation de beaucoup de gènes impliqués dans la pathogénèse de la bactérie. Ceci a révélé que Salmonella a acquis certains îlots de pathogénicité par transfert génétique horizontal. Les protéines codées par ces îlots de pathogénicité aident la bactérie à envahir, se reproduire et disséminer à l’intérieur de son hôte (Figure 3). L’invasion de la bactérie ainsi que sa survie intracellulaire sont gouvernées par au moins 60 gènes de virulence répartis sur plusieurs îlots de pathogénicité du chromosome bactérien.
24
Figure 3 : Facteurs de virulence de lipopolysaccharides (LPS), des fimbr
sécrétion de type III. L’antigène Vi est exclusivement exprimé par
Actuellement, 12 îlots de pathogénicité ont été identifiés chez principaux SPI-1 et SPI-2 (pour «
de 40 gènes de virulence, codant des protéines de deux SST3-2) (Figure 4). Ces systèmes de sécrétion
effectrices à l’intérieur de la cellule cible. SST3
espèces de Salmonella et est nécessaire pour l’invasion des cellul à lui, est indispensable à la survie intracellula
(l’assemblage et la composition du
dans la partie suivante).En plus des deux SST3 système de sécrétion de type 1 (codé par SPI transporteurs d’ions (codés par SPI
dans l’établissement et le maintien de la niche intracellulaire de la bactérie
Figure 4 : Représentation schématique des différents SPI chez En outre, Salmonella possède deux syst
capables de détecter la variation du pH, la disponibilité des nutriments, le stress oxydatif et la présence de molécules toxiques. Ces TCS permettent à la bactérie d
conditions drastiques (pH gastrique
acteurs de virulence de S. Typhimurium et S. Typhi. Les deux sérovars , des fimbriae, des flagellines, de l’ADN bactérien et deux . L’antigène Vi est exclusivement exprimé par S. Typhi (52).
Actuellement, 12 îlots de pathogénicité ont été identifiés chez Salmonella
2 (pour « Salmonella Pathogenicity Island »), qui à eux deux contiennent plus de 40 gènes de virulence, codant des protéines de deux Systèmes de Sécrétion de Type 3 (SST3
. Ces systèmes de sécrétion sont utilisés par la bactérie afin d’injecter ses protéi l’intérieur de la cellule cible. SST3-1 est présent chez tous les sérotypes et les sous
et est nécessaire pour l’invasion des cellules non-phagocytaires. SST3
la survie intracellulaire de la bactérie et sa dissémination systémique (l’assemblage et la composition du Système de Sécrétion de Type 3 de Salmonella
En plus des deux SST3 (ou T3SS en anglais), Salmonella
système de sécrétion de type 1 (codé par SPI-4) (53)et d’autres facteurs de virulence comme des par SPI-3), des fimbriae et des flagelles qui jouent des rôles importants dans l’établissement et le maintien de la niche intracellulaire de la bactérie(54).
: Représentation schématique des différents SPI chez S. Typhimurium. Adaptée
possède deux systèmes de régulation appelés TCS qui sont des capteurs capables de détecter la variation du pH, la disponibilité des nutriments, le stress oxydatif et la présence de molécules toxiques. Ces TCS permettent à la bactérie de s’adapter et de survivre dans
(pH gastrique et l’environnement intracellulaire)(56).
Typhi. Les deux sérovars possèdent des lines, de l’ADN bactérien et deux systèmes de
Salmonella. Il en existe deux »), qui à eux deux contiennent plus de Sécrétion de Type 3 (SST3-1, sont utilisés par la bactérie afin d’injecter ses protéines 1 est présent chez tous les sérotypes et les
sous-phagocytaires. SST3-2 quant et sa dissémination systémique Salmonella seront détaillés Salmonella possède un autre autres facteurs de virulence comme des 3), des fimbriae et des flagelles qui jouent des rôles importants
Typhimurium. Adaptée de(55). TCS qui sont des capteurs capables de détecter la variation du pH, la disponibilité des nutriments, le stress oxydatif et la présence e s’adapter et de survivre dans certaines
25
2. Le plasmide de virulence et les toxines de Shigella
Les informations génétiques constituant les génotypes de Shigella spp. sont portées par un chromosome bactérien et un grand plasmide de virulence de 230kb appelé pWR100 qui code pour une machinerie moléculaire nécessaire à l’invasion et à la survie intracellulaire de la bactérie. L’élément central des facteurs de virulence est le SST3 qui permet aux bactéries de transférer un ensemble d’environ 25 protéines du cytoplasme bactérien directement dans la cellule eucaryote, où ces protéines effectrices vont interférer avec des processus cellulaires divers (57)(les caractéristiques du SST3 seront décrites dans la partie suivante). Les gènes indispensables pour l’entrée des bactéries dans les cellules sont tous regroupés sur la région 31 kb appelée « entry region » du plasmide pWR100 (Figure 5). Cette région code pour les composants et les substrats du SST3de Shigella (ou Mxi-Spa T3SS) (58).
Figure 5 : Région 31 kb ou « entry region » du plasmide de virulence pWR100 de 230 kb codant pour les composants et les protéines effectrices du SST3 de S. flexneri (ou Mxi-Spa T3SS : Type 3 Secretion System) (59).
L’évolution rapide des Shigella spp. pathogènes à partir d’E. colinon-invasives, leurs ancêtres non-pathogènes, est liée aussi bien au transfert génétique horizontal qu’à l’incorporation chromosomique de grandes entités génétiques mobiles portant un ou des gènes de virulence nommés PAI ou îlots de pathogénicité et qui sont portés par le plasmide de virulence. D’autres îlots de
26
pathogénicité appelés SHI pour « Shigella pathogenicity islands » ont été identifiés sur le chromosome bactérien (SHI-1, 2 et 3). La présence et la localisation de ces SHI diffèrent entre les souches de Shigella et peuvent contribuer à la variation des phénotypes de virulence. On distingue aussi la présence de SHI-O contenant des gènes modifiant la structure des antigènes O du lipopolysaccharide bactérien (LPS) qui est un facteur de virulence crucial dans l’infection à Shigella. D’autres gènes de résistance aux antibiotiques sont également identifiés dans le génome de Shigella (58,60).
Pour compléter, tous les gènes de virulence sont sous le contrôle d’un réseau de régulation qui répond aux changements environnementaux suite à l’entrée des bactéries dans les cellules hôtes. Le facteur majeur induisant l’expression des gènes du plasmide de virulence est le changement de température (passage à 37°C) après l’ingestion par l’hôte. Les facteurs supplémentaires qui peuvent influencer aussi l’expression du plasmide de virulence sont le pH, l’osmolarité et la concentration des ions (61).
Enfin, certaines souches de Shigella peuvent produire des entéro-toxines intervenant dans leurs mécanismes d’infection : SHET-1(pour Shigella enterotoxin 1) présente uniquement chez S. flexneri 2a, SHET-2 (pour Shigella enterotoxin 2) présente chez plusieurs sérotypes de Shigella et la Shiga-toxine (Stx)sécrétée exclusivement par S. dysenteriae. Cette dernière est neurotoxique, cytotoxique et entéro-toxique (62).
E. LE SYSTÈME DE SÉCRÉTION DE TYPE 3
ShigellacommeSalmonellaet d’autres bactéries pathogènes Gram (-) profitent des processus cellulaires de l’hôte afin d’établir l’infection. Les bactéries ciblent directement les voies de signalisation intracellulaires de la cellule hôte en transportant des protéines effectrices à travers trois membranes : la membrane interne bactérienne (IM), la membrane externe bactérienne (OM) et la membrane cytoplasmique de l’hôte (HM). Le SST3 de S. flexneri ou Mxi-Spa T3SS et les deux SST3 de S. Typhimurium codés par SPI-1 ou SPI-2 sont des représentants sophistiqués des machines moléculaires d’exportation qui transfèrent des protéines dans le cytoplasme cellulaire de l’hôte en une seule étape(63).
Le SST3 appelé aussi injectisome est composé de plus de 20 protéines dont la plupart est incorporée dans la membrane bactérienne et forme des oligomères.L’architecture du SST3 de différents genres bactériensmontre une certaine adaptation spécifique de l’hôte mais partage une structure principale conservée qui est étroitement semblable au flagelle (64).
27
1. L’architecture du SST3
L’injectisome de S. flexneri (Figure 6, partie gauche) et celui de S. Typhimurium codé par SPI-1 (Figure 6, partie droite) sont très similaires et jouent un rôle primordial dans la pathogénicité de ces bactéries. Le SST3 est composé de 3 parties principales : (i) une aiguille de sécrétion (extracellulaire) avec une coiffe à son extrémité, (ii) un corps basal inséré dans les membranes bactériennes IM et OM, et (iii) un compartiment intracellulaire nommé « C ring » (pour Cytoplasmic ring).
Figure 6 : Vue structurale du SST3 ou injectisome de S. flexneri (à gauche) et de S. Typhimurium (à droite). Adaptée de(58,65).
Le complexe de l’aiguille (ou Needle Complex NC) consiste en une structure cylindrique semblable au corps basal du flagelle. Il est composé de deux paires d’anneaux qui recouvrent les membranes bactériennes IM et OM aboutissant à une tige appelée aiguille de sécrétion. Le corps basal assure l’ancrage de l’aiguille aux membranes bactériennes internes et externes en traversant le périplasme (66).
28
L’aiguille de sécrétion fait environ 60 nm de longueur avec un diamètre interne d’environ 25 Å. Elle est construite par la polymérisation hélicoïdale de 100 à 150 sous-unités de PrgI chez Salmonella et de MxiH chez Shigella. Puisque cette aiguille a un diamètre trop petit pour permettre aux protéines repliées d’y passer, ces dernières doivent être dépliées afin d’être facilement exportées (65).
C’est l’ATPase (InvC chez Salmonella et Spa47 chez Shigella), l’une des protéines conservées de l’injectisome, qui semble impliquée dans la dissociation des différents substrats du SST3 de leurs chaperonnes cytoplasmiques avant leur passage dans l’aiguille. L’ATPase assure l’énergie nécessaire au transport transmembranaire des protéines sécrétées. Par conséquent, elle occupe une position centrale dans le processus de sécrétion (67).
A l’extrémité de l’aiguille se positionne un complexe protéique qu’on appelle la coiffe ou « tip protein complex » dont la fonction est de détecter la présence des cellules eucaryotes, de faciliter l’insertion des translocons dans la membrane de la cellule cible et de régler la sécrétion des protéines effectrices dans la cellule hôte. Ce complexe est formé d’un pentamère de sous-unités de SipD chez Salmonella et d’IpaD chez Shigella (68).
Afin de permettre l’injection des protéines effectrices, l’injectisome n’est actif, qu’une fois en contact avec la cellule cible, par la formation de pores (par l’insertion des translocons) dans la membrane cytoplasmique de la cellule hôte (69). En général, il existe deux translocons dans chaque SST3 : SipB et SipC chez Salmonella et IpaB et IpaC chez Shigella(70). Une fois que les pores sont établis par les translocons et que l’aiguille est dans sa conformation active « ouverte », les protéines effectrices peuvent directement passer par l’injectisome afin d’atteindre leurs cibles à l’intérieur de la cellule hôte.
2. L’assemblage du SST3
Pendant l’infection, les bactéries reçoivent un signal de l’environnement de l’hôte et commencent à assembler les constituants du système de sécrétion, un processus qui doit être coordonné dans l’espace et dans le temps. Cet assemblage se fait en plusieurs étapes : (i) l’assemblage du corps basal et celui de l’appareil d’exportation, (ii) l’assemblage de l’aiguille et de sa tige intérieure, (iii) l’assemblage de la coiffe de l’aiguille et des translocons et enfin (iv) la sécrétion des protéines effectrices(71,72).
L’assemblage du corps basal est initié par un groupe de protéines membranaires formant l’appareil d’exportation suivi par la formation de l’aiguille(73). Les composants du « C ring » forment des
29 complexes avec l’ATPase nommé « Sorting Platform » ou SP (Figure 7A) qui joue un rôle important dans le recrutement des composants de l’aiguille, des translocons et des effecteurs d’une façon chronologique. Par conséquent, le SP est nécessaire pour assurer l’assemblage de l’aiguille de sécrétion qui possède une longueur bien définie régulée par un groupe de protéines présentes dans le cytoplasme bactérien (représentées en jaune sur la figure 7B et 7C).Suite à la formation de l’aiguille, le complexe composant la coiffe se positionne à l’extrémité de l’aiguille dont le rôle est de détecter la présence de la cellule hôte (Figure 7D). Ceci aboutit à l’ouverture de l’aiguille et à la sécrétion des translocons via un mécanisme de phosphorylation dépendant du SP (Figure 7E). Enfin, les protéines effectrices sont sécrétées par le SST3 selon un ordre régulé au niveau transcriptionnel (Figure 7F).
30
F. L’INTERACTION BACTÉRIE - CELLULE HÔTE
Les salmonelles et les shigelles font partie des bactéries entéropathogènes qui utilisent une grande variété de stratégies pour coloniser l’épithélium intestinal. Ces bactéries ont développé plusieurs capacités : (i) la résistance aux défenses non spécifiques de l’hôte comme l’acidité de l’estomac, le péristaltisme du tube digestif, l’exfoliation cellulaire des muqueuses, les mucines intestinales et les bactériocines(75); (ii) l’adhérence ou l’adhésion aux épithéliums intestinaux et en fin de compte (iii) la colonisation de ces épithéliums. Quand l’invasion cellulaire a lieu, elle peut être suivie par la persistance bactérienne ou par la multiplication intracellulaire et la diffusion des bactéries dans d’autres tissus.Ces bactéries emploient également d’autres stratégies afin de cibler leurs cellules hôtes par exemple détourner leurs voies de signalisation, modifier la plasticité du cytosquelette et résister à la phagocytose.
L’hôte, à son tour, se défend contre l’infection en induisant une réponse inflammatoire et en altérant l’équilibre du fluide intestinal de façon à extruder les bactéries indésirables, causant ainsi la diarrhée. Par conséquent, le succès de l’infection dépend des interactions entre les bactéries et les cellules hôtes et dans chaque étape la bactérie exploite la machinerie cellulaire cible pour son propre intérêt.
1. L’adhésion
L’adhésion est l’étape préliminaire dans le processus infectieux de Salmonella et Shigella. Elle exige des fortes interactions grâce à des adhésines spécifiques : FimA et FimH chez Salmonella spp.(76) ou des « adhésines-like » :le complexe IpaB/IpaC, les translocons du SST3 chez Shigella spp.(77). De plus, l’adhésion bactérienne aux épithéliums intestinaux est aussi favorisée par des facteurs exogènes locaux comme le milieu alcalin, l’humidité et l’anaérobiose.
L’interaction initiale entre Salmonellaou Shigella avec l’épithélium intestinal se fait de préférence avec les cellules M (pour Microfold cells) de la plaque de Peyer ou du tissu lymphoïde intestinal (ou SILT pour Solitary Intestinal Lymphoid Tissue) au niveau du côlon et du rectum pour Shigella (Figure 8a) et de l’intestin grêle pour Salmonella (Figure 8b). Les cellules M se trouvent dans l’épithélium associé aux follicules lymphoïdes (FAE pour Follicle-Associated Epithélium) dont la fonction est de transporter des antigènes. Leur face baso-latérale est invaginée et forme une structure semblable à une poche, dans laquelle les macrophages et les lymphocytes peuvent migrer et interagir avec les particules antigéniques ou bactéries entières portées par ces cellules M (78).
Salmonella contient aussi, en plus des adhésines fimbrillaires (FimA, FimH), des adhésines non-fimbrillaires codées par l’îlot de pathogénicité SPI-4 et qui sont également impliquées dans
31 l’adhérence et l’invasion du côté apical des cellules épithéliales polarisées(53). Chez Shigella, les protéines bactériennes responsables de l’adhésion et l’invasion sont identiques. Suite à l’adhérence, Shigella induit immédiatement l’activation du SST3 et la sécrétion des protéines effectrices dans la cellule cible.
Figure 8 : Mécanismes d’infection de (a) Shigella flexneri et de (b) Salmonella enterica. Adaptée de (79).
2. L’invasion cellulaire
Après l’adhésion de Salmonella aux cellules M de l’épithélium intestinal, le SST3 codé par SPI-1 est activé. La bactérie injecte alors au moins 12 effecteurs qui facilitent son invasion. Les protéines SipA et SipC sont les premières à être sécrétées par le SST3. Le translocateur SipC localisé au niveau de la membrane cellulaire, facilite la translocation d’autres effecteurs de Salmonella et déclenche la nucléation de l’actine. Ensuite, SipA est injecté dans le cytoplasme de la cellule hôte et agit en synergie avec SipC afin de stabiliser les filaments d’actine F. Puis, d’autres protéines sont délivrées par le SST3 dont la fonction est d’activer les RhoGTPases qui régulent la polymérisation d’actine et induisent le réarrangement du cytosquelette (80). Ce réarrangement entraîne des modifications membranaires et permet la pinocytose de Salmonella par les cellules épithéliales (81). Enfin, la cellule regagne sa forme normale et Salmonella se reproduit à l’intérieur d’une vacuole nommée « Salmonella-containing vacuole » ou SCV (Figure 8b).
Quant à Shigella, le même complexe IpaB/IpaC déclenche la polymérisation de l’actine. Le translocon IpaC active aussi les RhoGTPases. La bactérie livre ensuite d’autres protéines effectrices dans le cytoplasme de la cellule hôte qui permettent la déstabilisation du microtubule et la
32
dépolymérisation de l’actine. Enfin, et une fois à l’intérieur de la cellule hôte, Shigella rompt la vacuole de pinocytose et dissémine dans les cellules épithéliales voisines (58,79).
3. La survie intracellulaire
Une fois traversée les cellules M ou les phagocytes, Salmonella est enfermée dans la SCV, où elle va se répliquer. L’acidité de la SCV est un stimulus clé pour Salmonellaqui lui permet d’exprimer et assembler son second SST3 codé par SPI-2 environ trois heures après l’infection (82). En revanche, la sécrétion de ses effecteurs à travers la membrane de SCV dépend du pH neutre du cytosol de la cellule hôte (54,83). Quatre à six heures après l’entrée, SCV est caractérisée par la présence de longues structures membranaires appelées « Salmonella-induced filaments » ou Sifs. Ces filaments augmentent la taille des SCV fournissant ainsi l’espace pour la réplication de Salmonella (84). A l’intérieur de la SCV des phagocytes, la bactérie peut inhiber, d’une façon SPI-2 dépendante, la production des dérivés réactifs de l’oxygène (ROS) en empêchant l’assemblage du complexe NADPH oxydase (85). Les deux SST3 exprimés par Salmonella peuvent induire la mort des macrophagesbien que par des mécanismes distincts et à des temps différents de l’infection. La réponse inflammatoire produite contre Salmonella peut nuire à la barrière intestinale, permettant aux bactéries de la traverser et rencontrer les phagocytes attirés vers le site de l’infection. Une fois à l’intérieur des phagocytes, les bactéries survivent et se reproduisent, et certaines espèces de Salmonella (eg. S. Typhi) diffusent des plaques de Peyer aux ganglions lymphatiques mésentériques, créant ensuite une infection généralisée. L’apoptose des cellules épithéliales peut aussi contribuer à la désintégration des épithéliums intestinaux observée dans la salmonellose (79).
Après avoir traversée les cellules M, Shigella s’expose à une zone intensivement peuplée de macrophages et de cellules dendritiques. Comme dans le cas de Salmonella, elle déclenche alors la pyroptose (mort cellulaire programmée qui amplifie la réponse inflammatoire) des macrophages par l’activation de la voie caspase-1 (79). Une fois présente dans le cytoplasme, la bactérie détourne à son profit l’actine polymérisée de la cellule hôte pour l’accumuler sur un de ses pôles, formant ainsi une queue qui la propulse à travers le cytoplasme. Quand la bactérie atteint finalement la face interne de la membrane baso-latérale de la cellule épithéliale hôte, elle sera endocytée par une cellule épithéliale voisine, qui permet de proche en proche d’envahir de nouvelles cellules (86). En conséquence de la présence intracellulaire des bactéries, des cellules épithéliales commencent à produire un ensemble de cytokines pro-inflammatoires qui vont attirer fortement les leucocytes polymorphonucléaires (PMN) de la couche sous-épithéliale vers la lumière intestinale. L’infiltration des PMN provoque tout d’abord une ouverture partielle de l’épithélium intestinal qui renforce l’infection et les lésions tissulaires en facilitant l’entrée de plus de bactéries, pour finalement mener à la résolution de l’infection en tuant les bactéries. Les conséquences négatives de l’infiltration des PMN sont l’inflammation sévère et la
33 destruction massive de la muqueuse colique, causant des abcès et des ulcères, les caractéristiques cliniques des diarrhées provoquées en particulier par Shigella(87).
34
CHAPITRE II : LES RÉPONSES IMMUNITAIRES INDUITES
SUITE AUX INFECTIONS À SALMONELLA ET SHIGELLA
A. RAPPEL SUR LES INFECTIONS BACTÉRIENNES
1. L’immunité innée et adaptative
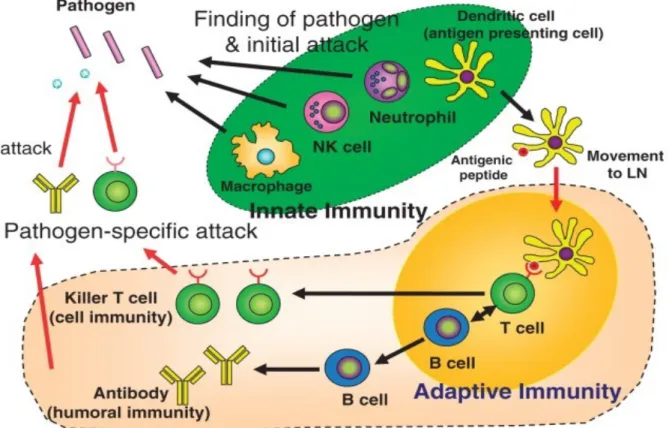
La défense contre les infections bactériennes est réalisée par différents mécanismes de l’immunité innée et adaptative. La réponse immunitaire innée, qui représente la première ligne de défense, est rapide et de faible spécificitéalors que la réponse adaptative est plus tardive mais spécifique de l’agent infectieux. Selon la pathogénicité des bactéries qui pénètrent, différents niveaux dedéfense de l’hôte sont engagés. Si les bactéries sont faiblement pathogènes, les phagocytes tissulaires locaux peuvent être suffisants pour éliminer les bactéries en mettant en jeu les défenses naturelles non-spécifiques (activation des neutrophiles, des cellules NK et des macrophages). En revanche, les bactéries présentant une plus forte pathogénicité induisent une réponse spécifique adaptative en plus de la réponse innée (activation des cellules T et production d’anticorps par les cellules B, Figure 9).
Figure 9 : Réponses immunitaires innées et adaptatives. NK : les cellules « Naturel killer », LN : « Lymphnode » ou ganglion lymphatique (88).