HAL Id: tel-01558623
https://hal.archives-ouvertes.fr/tel-01558623
Submitted on 10 Jul 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Distributed under a Creative Commons Attribution - NonCommercial| 4.0 International License
Contrôle de la contraction musculaire volontaire après
un traumatisme médullaire cervical : Etude de la
réorganisation des activations musculaires et corticales
Sylvain Cremoux
To cite this version:
Sylvain Cremoux. Contrôle de la contraction musculaire volontaire après un traumatisme médul-laire cervical : Etude de la réorganisation des activations muscumédul-laires et corticales. Biomécanique [physics.med-ph]. Université d’Aix-Marseille, 2013. Français. �tel-01558623�
UNIVERSITE D’AIX MARSEILLE Faculté des Sciences du Sport
Ecole Doctorale Sciences du Mouvement Humain – ED 463
Institut des Sciences du Mouvement Humain Etienne Jules Marey – UMR 7287
THESE
pour obtenir le grade de Docteur de l’Université Aix-Marseille
présentée par
Sylvain Cremoux
C
ONTROLE DE LA CONTRACTION MUSCULAIRE VOLONTAIREAPRES UN TRAUMATISME MEDULLAIRE CERVICAL
:
E
TUDE DE LA REORGANISATION DES ACTIVATIONS MUSCULAIRES ET CORTICALESDate de Soutenance : 2 Décembre 2013
Composition du Jury :
David Guiraud DR, Université de Montpellier 2 Rapporteur Arnaud Delval MCF-HDR PH, Université de Lille 2 Rapporteur Aymeric Guillot PU, Université de Lyon 1 Examinateur Jean-René Cazalets DR, Université de Bordeaux 2 Examinateur
Jessica Tallet MCF, Université de Toulouse 3 Examinatrice invitée David Amarantini MCF, Université de Toulouse 3 Co-directeur
R
ESUMELa réalisation d’une action motrice implique l’activation simultanée des muscles agonistes et antagonistes contrôlés par le système nerveux central. Suite à un traumatisme médullaire, la détérioration de la moelle épinière entraine à la fois une perte d’efficience motrice et des modifications du contrôle des activations musculaires. Dans le cadre de ce travail de thèse, nous avons étudié la réorganisation des activations musculaires, des activations corticales et des interactions cortico-musculaires (ICM) d’un groupe traumatisé médullaire cervical (SCI) et d’un groupe contrôle (AB) lors de contractions isométriques volontaires en flexion et en extension autour de l’articulation du coude. En extension, nos résultats ont mis en évidence une altération des capacités de force maximale chez les participants SCI, associée à une augmentation des activations musculaires, une activation corticale identique au groupe AB et une diminution de l’implication du M1 dans le contrôle des activations musculaires. En flexion, la force développée, les activations corticales et les ICM étaient similaires chez les participants SCI et AB, mais l’activation des muscles antagonistes et la difficulté à inhiber la contraction étaient plus importantes chez les participants SCI. Pour l’ensemble des participants, les ICM en flexion étaient différentes selon la fonction des groupes musculaires. L’ensemble de ces résultats suggèrent une altération du contrôle cortical des mécanismes inhibiteurs spinaux de la contraction musculaire suite à une lésion médullaire mais indiquent que le cortex moteur est toujours activable et fonctionnel pour contrôler un acte moteur malgré l’atrophie des muscles extenseurs. Ces résultats pourraient trouver des applications cliniques pour l’élaboration de neuroprothèses nécessitant un contrôle simultané de différents groupes musculaires.
Mots clés : Contractions isométriques, électroencéphalographie, électromyographie, moment
R
EMERCIEMENTSUn grand merci à l’ensemble des membres du jury,
Mes rapporteurs, Arnaud DELVAL et David GUIRAUD, et mes examinateurs, Jean-René CAZALETS et Aymeric GUILLOT qui ont accepté d’expertiser ce travail de thèse et d’assister à sa soutenance publique. Vos remarques et votre intérêt pour ces travaux de recherche, au-delà de vos spécialités scientifiques, enrichissent considérablement ce travail. Merci à ma famille scientifique,
Mes « papas », David AMARANTINI et Eric BERTON, qui ont toujours su répondre avec rapidité à l’ensemble de mes demandes et interrogations, scientifiques ou administratives. Ma « maman », Jessica TALLET, qui m’a appris à garder confiance en moi et m’a aidé à faire aboutir de nombreuses réflexions scientifiques. Mes « grands frères », Fabien DAL MASO, Laurent SOLINI et Yannick WAMAIN, qui ont supporté mon enthousiasme pendant quelques années. Mon « petit frère », Yannick DAVIAUX. Courage ! Mes « cousins » de près ou de loin : Jérémie, Mathieu, Nicolas, David, Hugo(s), Numa, Jonathan, Vincent, Julien, Liesjet, Mathieu et j’en oublie surement…
Merci à ma famille sportive qui m’a permis de décompresser lors de ces années de thèse. Pablo, Nico, Ludo, l’équipe rugby fauteuil et rugby XIII fauteuil du STRH. C’est nous qu’on va gagner cette année !!!
Une grande pensée à ma famille,
mes grands-parents, mes parents et mes frères qui m’ont instruit et m’ont appris à persévérer quel que soit la tâche à effectuer.
Merci enfin à mon beau bateau, mon trois « mâts » familial,
Marie, Maëva et Maïwenn vous avez réussi à me faire garder le cap, merci de m’avoir accompagné tout au long de ses années et de me suivre encore pour les années à venir.
P
RODUCTIONS SCIENTIFIQUES ASSOCIEES A CE TRAVAIL DE THESEArticles et résumés publiés dans des revues internationales à comité de lecture
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2013). Does the force level
modulate the cortical activity during isometric contractions after a cervical spinal cord injury? Clinical Neurophysiology, 124: 1005-12. (IF = 3.14).
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2013). Motor-related
cortical activity after cervical spinal cord injury: multifaceted-EEG analysis of actual isometric contractions. Brain Research. 1533: 44-51. (IF = 2.88).
Cremoux, S. Tallet, J., Berton, E., Dal Maso F., Amarantini, D. (2012). Atypical EMG
activation patterns of the elbow extensors after complete C6 tetraplegia during isometric contractions: a case report. Computer Methods in Biomechanics and Biomedical Engineering, 1:sup1, 266-268. (IF = 1.39).
Cremoux, S., Amarantini, D., Tallet, J., Dal Maso, F., Berton, E. (to be submitted).
Modulation of agonist and antagonist muscle activations during submaximal isometric elbow flexion and extension in SCI participants. Journal of Neurophysiology (IF = 3.32).
Cremoux, S., Amarantini, D., Tallet, J., Dal Maso, F., Berton, E. Alteration of the
corticomuscular interactions after a spinal cord injury (In preparation).
Chapitres d’ouvrage
Cremoux, S., Ibanez Pereda, J., Ates, S., & Dessì, A. (2014). Neuromodulation on Cerebral
Activities. In J. L. Pons & D. Torricelli (Eds.), Emerging Therapies in Neurorehabilitation SE - 6 (Vol. 4, pp. 103–115). Springer Berlin Heidelberg. doi:10.1007/978-3-642-38556-8_6
Communications dans des congrès internationaux
Cremoux, S., Amarantini, D., Tallet, J., Dal Maso, F., Berton, E. (2013). Effets d’une lésion
médullaire sur la modulation de l’activation musculaire agonistes et antagonistes lors de contractions isométriques sous-maximales. 15ème congrès international de l’ACAPS, Grenoble,
France, October 29-31, 2013. Oral communication.
Dal Maso, F., Longcamp, M., Cremoux, S., Amarantini D. (2013) Corticomuscular interactions with antagonist muscles – Direct evidence of supraspinal control of antagonist muscles. 15ème congrès international de l’ACAPS, Grenoble, France, October 29-31, 2013.
Oral communication.
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2012). Modulation of the
iv
cord injury, Summer School on Neurorehabilitation: Emerging Therapies. Zaragoza, Spain, September 16-21, 2012. Poster presentation.
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2011). Désynchronisation
corticale lors de contractions isométriques volontaires sous maximales chez le sujet tétraplégique. 14ème congrès international de l’ACAPS, Rennes, France, October 24-26, 2011.
Oral communication.
Séminaires invités
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2013). Modulation of the
cortical activity during isometric elbow contractions performed by tetraplegic participants. Courtine Laboratory, Brain Mind Institute, Lausanne, Switzerland, February 19, 2013. Oral communication.
Communications dans des congrès nationaux
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2012). Atypical EMG
activation patterns of the elbow extensors after complete C6 tetraplegia during isometric contractions : a case report, 37ème Congrès de la Société de Biomécanique. Toulouse, France,
October 16-19, 2012. Poster presentation.
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2012). Evolution de
l’activité corticale lors de contractions isométriques à différents niveaux de force après une tétraplégie. 8ème Journée de l’Ecole Doctorale Sciences du Mouvement Humain, Montpellier,
France, June 1, 2012. Poster presentation (Price for best poster presentation).
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2012). Modulation de
l’activité corticale lors de contractions isométriques à différents niveaux de force après une lésion médullaire cervicale, 16èmes Journées d’Etudes Francophones en Activités Physiques Adaptées, Orsay, France, March 29-31, 2012. Oral communication.
Cremoux, S., Tallet, J., Berton, E., Dal Maso, F., Amarantini, D. (2011). Effets d’une lésion
médullaire sur la désynchronisation corticale lors de contractions isométriques volontaires sous-maximales. 7ème Journée de l’Ecole Doctorale Sciences du Mouvement Humain,
T
ABLE DES MATIERES ! INTRODUCTION)...)1! AVANT!PROPOS!...!2! INTRODUCTION!GENERALE!...!3! CADRE)THEORIQUE)...)6! 1! CONSEQUENCES!ANATOMIQUES!ET!FONCTIONNELLES!D’UN!TRAUMATISME!MEDULLAIRE!...!7! 2! ADAPTATIONS!FONCTIONNELLES!ET!MUSCULAIRES!SUITE!A!UN!TRAUMATISME!MEDULLAIRE!...!9! 2.1$ Evaluation$de$la$production$de$force$volontaire$...$9$ 2.2$ Activations$musculaires$sous8jacentes$...$14$ 3! MECANISMES!REGULATEURS!DE!LA!CONTRACTION!MUSCULAIRE!...!21! 3.1$ Contrôle$et$régulation$spinale$de$la$contraction$musculaire$...$21$ 3.2$ Contrôle$et$régulation$corticale$de$la$contraction$musculaire$...$25$ 3.3$ Plasticité$corticale$suite$à$un$traumatisme$médullaire$...$30$ 4! INTERACTIONS!CORTICO<MUSCULAIRES!...!36! 4.1$ Voies$de$la$motricité$volontaire$...$37$ 4.2$ Estimation$des$interactions$cortico8musculaires$lors$d’effort$musculaire$volontaire$...$39$ 4.3$ Modulation$des$interactions$cortico8musculaires$...$41$ PROBLEMATIQUE)...)46! METHODOLOGIE)...)52! 5! METHODOLOGIE!GENERALE!...!53! 5.1$ Participants$...$53$ 5.2$ Matériels$...$54$ 5.3$ Dispositif$experimental$...$56$ 5.4$ Protocole$experimental$...$57$ 5.5$ Traitement$des$données$...$62$vi
CONTRIBUTIONS)EXPERIMENTALES)...)64!
6! RESUME!DES!ETUDES!...!65!
7! ATYPICAL!EMG!ACTIVATION!PATTERNS!OF!THE!ELBOW!EXTENSORS!AFTER!COMPLETE!C6!TETRAPLEGIA! DURING!ISOMETRIC!CONTRACTIONS:!A!CASE!REPORT!...!68!
8! MODULATION!OF!AGONIST!AND!ANTAGONIST!MUSCLE!ACTIVATIONS!IN!SCI!PARTICIPANTS:!EVIDENCE!OF! RECIPROCAL!FACILITATION!DURING!SUBMAXIMAL!VOLUNTARY!ELBOW!CONTRACTIONS!...!73!
9! DOES!THE!FORCE!LEVEL!MODULATE!THE!CORTICAL!ACTIVITY!DURING!ISOMETRIC!CONTRACTIONS!AFTER! A!CERVICAL!SPINAL!CORD!INJURY?!...!90!
10! MOTOR<RELATED!CORTICAL!ACTIVITY!AFTER!CERVICAL!SPINAL!CORD!INJURY:!MULTIFACETED!EEG! ANALYSIS!OF!ISOMETRIC!ELBOW!FLEXION!CONTRACTIONS!...!110! 11! ALTERATION!DES!INTERACTIONS!CORTICO<MUSCULAIRES!APRES!UN!TRAUMATISME!MEDULLAIRE!..!126! CONCLUSIONS)...)143! 12! DISCUSSION!DES!PRINCIPAUX!RESULTATS!...!144! 13! LIMITES!ET!PERSPECTIVES!...!148! 14! CONCLUSION!GENERALE!...!153! REFERENCES)BIBLIOGRAPHIQUES)...)155! ANNEXES)...)177!
L
ISTE DES ABBREVIATIONSAB : Able Bodied (fr : personnes valides)
AIS : American Impairment Scale (fr : Echelle américaine du traumatisme). ANOVA : ANalysis Of VAriance (fr : analyse de la variance)
ASIA : American Spinal Injury Association BB : Biceps Brachii (fr : Biceps Brachial) BR : Brachioradialis (fr : Brachio-radial) CxPM : CorteX Pré-Moteur
EEG : ElectroEncephaloGraphie EMG : ElectroMyoGraphie
ERD : Event Related Desynchronization (fr : désynchronisation liée à un événement)
ERS : Event Related Synchronization (fr : synchronisation liée à un événement) ICA : Independent Component Analysis (fr : Analyse par Composante
Indépendante)
ICM : Interactions Cortico-Musculaires IRM : Imagerie par Résonnance Magnétique M1 : cortex Moteur primaire
MEG : MagnétoEncéphaloGraphie
MMT : Manual Muscle Test (fr : Test Musculaire Manuel)
MVC : Maximal Voluntary Contraction (fr : contraction maximale volontaire) rMVC : relative Maximal Voluntary Contraction (fr : contraction maximale
volontaire relative) S1 : cortex Sensoriel primaire
SCI : Spinal Cord Injury (fr : traumatisme médullaire)
SENIAM : Surface Electromyography for the Non-Invasive Assessment of Muscles (fr : Electromyographie de surface pour l’évaluation non-invasive des muscles)
TBlh : Triceps Brachial long head (fr : Long chef du triceps brachial) TBlt : Triceps Brachial lateral head (fr : Vaste latéral du triceps brachial)
INTRODUCTION
A
VANTP
ROPOSLe 1er décembre 2001, Paul vit sa passion sur les pistes de ski de Peyragudes, station de sport d’hiver des Pyrénées. Bon skieur, il se dirige vers le « big air » du Snow Park pour effectuer un saut périlleux arrière. Il connaît cette figure, il l’a déjà réalisée de nombreuses fois, mais aujourd’hui il la rate. Paul fait une chute et tombe d’une hauteur de 1 mètre sur le dos, sans aucun impact sur un cailloux ou sur de la glace. Il se réceptionne dans une mauvaise position et n’arrive plus à bouger ses membres. Transféré rapidement aux soins intensifs de l’hôpital Rangueil de Toulouse, le pronostic médical est annoncé : Paul a une tétraplégie suite à un traumatisme cervical avec fracture au niveau de la vertèbre C5…
Chaque année en France, 1500 personnes connaissent une histoire similaire à celle de Paul, devenant para- ou tétra- plégique à la suite d’un accident (étude menée en 2005 par l’Institut pour la Recherche sur la Moelle épinière et l’Encéphale). Cette incidence sur la population fait des traumatismes de la moelle épinière un problème de santé publique. Les thérapies cliniques actuelles ne permettent pourtant pas aux personnes traumatisées médullaires de récupérer entièrement leurs capacités sensorielles et motrices. L’amélioration des connaissances des mécanismes de contrôle et de régulation sous-jacents la contraction musculaire, intacte ou altérée par le traumatisme médullaire, devrait permettre de contribuer au développement de meilleures thérapies palliatives (p. ex., Van Der Brand et al., 2012 ; Collinger et al., 2012).
I
NTRODUCTION GENERALEChaque action motrice volontairement réalisée implique de nombreuses activations musculaires contrôlées et modulées par le système nerveux central. Si de nombreuses études montrent une implication directe des aires corticales motrices dans le contrôle du mouvement (Petersen et al., 2012), comprendre comment les structures spinales et corticales coopèrent pour élaborer une réponse motrice adéquate constitue un objet d’étude majeur en Neurosciences et en Biomécanique (De Luca et Mambrito, 1987 ; Lévénez et al., 2005). Ce travail de thèse a pour objectif central l’étude de la réorganisation des activations musculaires, corticales et des interactions cortico-musculaires sous-tendants la contraction musculaire volontaire suite à un traumatisme médullaire. Nous détaillerons cette problématique sur l’analyse des activités électrophysiologiques, musculaires et corticales, examinées lors d’une action motrice volontaire, intacte ou altérée par un traumatisme médullaire, après avoir présenté dans notre cadre théorique les connaissances actuelles sur les mécanismes de contrôle de l’action motrice chez la personne saine et l’altération de ces mécanismes suite à un traumatisme médullaire.
Le cadre théorique est composé de trois parties détaillants les thématiques abordées dans ce travail de thèse. La première partie du cadre théorique présente les conséquences anatomiques et fonctionnelles d’un traumatisme médullaire puis décrit les méthodes d’évaluation du moment de force résultant et des activations musculaires associées, intactes ou altérées par un traumatisme médullaire. Il est intéressant de noter que les activations musculaires augmentent chez la personne traumatisée médullaire lors d’une action motrice impliquant des muscles altérés par le traumatisme médullaire (Thomas et al., 1998). Cette augmentation des activations musculaires pourrait résulter de l’atrophie des muscles altérés par le traumatisme
4
médullaire (Thomas et al., 1997a), d’une altération des mécanismes de régulation localisés au niveau de la moelle épinière (Knikou, 2012) et/ou d’une réorganisation des commandes corticales (Muller-Putz et al., 2007).
La seconde partie du cadre théorique aborde les effets d’un traumatisme médullaire sur les mécanismes de contrôle et de régulation des activations musculaires. Nos travaux de recherches se sont principalement concentrés sur la réorganisation de l’activité du cortex moteur primaire car étant la principale structure corticale impliquée dans la transmission de la commande motrice volontaire vers les muscles (Schwartz, 2007 ; Lemon, 2008). D’un point de vue électrophysiologique, l’activité du cortex moteur primaire est distinctement modulée lors de l’action motrice volontaire (Pfurtscheller et Lopes da Silva, 1999). Chez la personne traumatisée médullaire, l’activité du cortex moteur primaire reste inchangée pendant l’action motrice, intacte ou altérée par le traumatisme médullaire (Mattia et al., 2009 ; Gourab et Schmit, 2010). Ces résultats permettent de supposer que, malgré une réorganisation corticale importante après un traumatisme médullaire, l’efficience de la commande corticale est préservée. Ainsi, l’augmentation des activations musculaires chez la personne traumatisée médullaire pourrait être directement liée à une modification des interactions cortico-musculaires.
La troisième partie du cadre théorique détaille les interactions cortico-musculaires, c.-à-d., le couplage entre les activités corticales et musculaires, lors d’une action motrice volontaire. De nombreuses études ont constaté un couplage fonctionnel entre l’activité du cortex moteur primaire et l’activité des muscles sollicités par l’action motrice (p.ex., Lattari et al., 2010 ; Petersen et al., 2012). L’analyse et l’interprétation des interactions cortico-musculaires, et plus largement encore des interactions entre les différentes structures anatomiques, constituent encore l’un des challenges les plus importants des neurosciences computationnelles et cognitives (Schnitzler et Gross, 2005 ; Bullmore et Sporns, 2009 ; 2012).
Il semble donc pertinent d’étudier les altérations du couplage fonctionnel entre le cortex moteur primaire et les muscles sollicités lors d’une action motrice réalisée par une personne traumatisée médullaire. Nos travaux étudient notamment le couplage fonctionnel entre l’activité du cortex moteur primaire et l’activité des muscles sollicités par l’action motrice, qu’ils soient agonistes ou antagonistes.
A l’issue de ce cadre théorique, la problématique générale et la méthodologie originale utilisée dans le cadre de ce travail de thèse seront présentées. Les résultats obtenus par cette méthode sont présentés dans le chapitre Contributions Expérimentales. Ce chapitre est composé de cinq études analysant les activations musculaires, les activations corticales et les interactions cortico-musculaires chez un groupe de participants traumatisés médullaires cervicaux comparativement à celles de participants contrôles. Le dernier chapitre propose une conclusion générale et les perspectives de ce travail de thèse.
C
ADRE THEORIQUE
♫ Fates (Erik Mongrain, 2008)1 C
ONSEQUENCES ANATOMIQUES ET FONCTIONNELLES D’
UN TRAUMATISME MEDULLAIREUn traumatisme médullaire peut être défini comme une atteinte sévère et localisée de la moelle épinière suite à un accident (figure 1). Les causes accidentelles sont le plus souvent indirectes (p. ex., hyperflexion, hyperextension suite à un accident de la circulation routière, compression de la colonne vertébrale à la suite d’un plongeon en eau peu profonde) mais peuvent, dans de très rares cas, être directes (p. ex., blessures par balles, par armes blanches). Il en résulte une détérioration permanente d’éléments nerveux dans le canal rachidien de la moelle épinière entraînant une paralysie ou une parésie motrice, une perte ou une diminution de la sensibilité, une perturbation des fonctions urinaires, anales et génitales et certains troubles respiratoires pour les traumatismes médullaires les plus hauts.
Figure 1. Exemple d’une image IRM de la moelle épinière cervicale montrant une fracture au niveau des vertèbres C6-C7 (empruntée à Akhaddar, Cours de Pathologie Neurochirurgicale 2010-11).
8
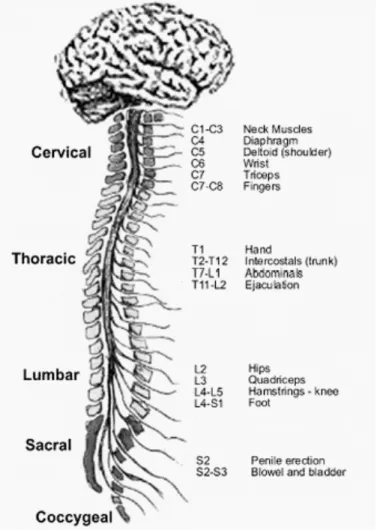
Dans le cadre de ce travail de thèse, nous nous intéressons à l’altération des fonctions motrices volontaires causée par un traumatisme médullaire cervical. Le niveau de paralysie est dépendant du niveau du traumatisme médullaire (figure 2). Si le traumatisme médullaire touche la moelle cervicale, les quatre membres sont paralysés et on parle de tétraplégie. Si le traumatisme médullaire touche la moelle thoracique ou lombaire, seuls les membres inférieurs sont paralysés et on parle alors de paraplégie. Le niveau de paralysie est également dépendant de la complétude du traumatisme médullaire, c.-à-d., de l’interruption totale ou partielle des voies motrices descendantes. Comme nous le détaillerons dans le chapitre suivant, le niveau d’atteinte neurologique et la complétude du traumatisme médullaire peuvent être définis à partir d’une classification des capacités fonctionnelles, motrices et sensitives, issue de l’American Spinal Injury Association (ASIA).
Figure 2. Représentation schématique de l’innervation musculaire par les nerfs spinaux (empruntée et adaptée de thewellingtonneurosurgeryunit.com).
2 A
DAPTATIONS FONCTIONNELLES ET MUSCULAIRES SUITE A UN TRAUMATISME MEDULLAIRELa réalisation d’une action motrice volontaire aussi simple qu’une extension du bras crée un moment de force autour d’une articulation. Ce moment de force représente la somme des moments de force produits par les muscles agonistes, c.-à-d. les muscles produisant un effort dans le sens de l’action motrice, et les muscles antagonistes, c.-à-d. les muscles produisant un effort dans le sens opposé à celui de l’action motrice, entourant l’articulation sollicitée (Zajac et al., 2002 ; Winter, 2005). Après un traumatisme médullaire, la réalisation de cette même action motrice simple implique parfois des muscles non activables volontairement et entraine de nombreuses adaptations fonctionnelles et musculaires (Marciello et al., 1995). Dans ce chapitre, nous abordons les adaptations fonctionnelles et musculaires de l’action motrice volontaire chez la personne traumatisée médullaire. Nous présentons le test musculaire manuel permettant l'évaluation clinique de l'action motrice et sa relative efficacité pour détecter la production d'un moment de force ou d'une activité musculaire volontaire. Nous présentons ensuite la réorganisation des activités musculaires, agonistes et antagonistes, suite à un traumatisme médullaire.
2.1 Evaluation de la production de force volontaire
Un traumatisme médullaire fait référence à une détérioration d’éléments nerveux dans le canal rachidien de la moelle épinière entraînant une diminution ou une perte de fonctions sensorielles et/ou motrices (Maynard et al., 1997). Pour déterminer le niveau d’atteinte neurologique, un examen clinique des fonctions sensorimotrices est effectué et la classification issue de l’ASIA est majoritairement utilisée (Maynard et al., 1997). Cet examen clinique repose en partie sur un test musculaire manuel (MMT pour Manual Muscle Test)
10
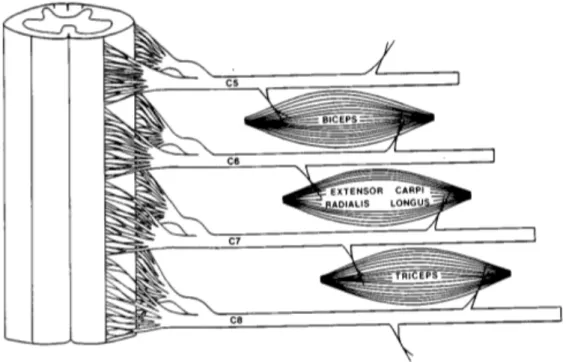
proposé par Daniels et al. (1972), repris et développé dans de nombreux travaux (Hislop et Montgomery, 2007). Du fait de son utilité médicale et de son coût minime, le MMT s’est peu à peu imposé comme la référence permettant de déterminer les capacités fonctionnelles des personnes traumatisées médullaires. Les niveaux d’atteintes neurologiques moteurs et sensitifs sont définis pour chaque hémicorps (gauche et droit) et chaque fonction (motrice et sensorielle) comme étant les niveaux les plus caudaux ayant une fonction motrice et sensorielle normale. Dix myotomes, c.-à-d. des muscles clés, sont définis pour analyser les capacités motrices d’un patient (figure 3).
Figure 3. Représentation schématique de l’innervation des trois principaux muscles du membre supérieur par deux segment de nerfs (empruntée à Maynard et coll., 1997).
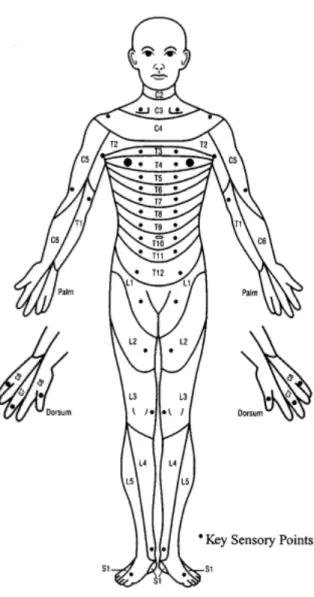
Les capacités motrices sont évaluées par un test musculaire manuel gradé de 0 à 5 ; 0 représentant l’absence totale de contraction musculaire et 5 représentant une contraction musculaire intacte. 28 dermatomes, c.-à-d. des points sensoriels clés, ont été définis pour
déterminer les capacités sensorielles (figure 4). Les capacités sensorielles sont gradées de « 0 » à « 2 », « 0 » représentant l’absence totale de sensation et « 2 » représentant une sensation normale à la piqûre et à l’effleurement. Notons que certaines fonctions motrices et/ou sensorielles peuvent être conservées en dessous du niveau neurologique. Un complément de classification (ASIA Impairment Scale; AIS), permet alors de définir le caractère complet ou incomplet du traumatisme médullaire. Cinq niveaux sont définis en fonction du nombre de fonctions motrices et/ou sensorielles préservées en-deçà du niveau neurologique du traumatisme médullaire.
Figure 4. Représentation schématique des 28 dermatomes associés aux différents niveaux neurologiques (empruntée à Maynard et coll., 1997)
12
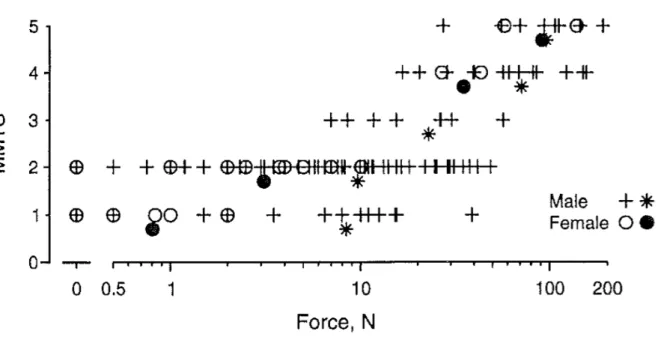
De nombreuses études ont mis en garde contre certains inconvénients du MMT tels que son inconsistance dans la prédiction des capacités fonctionnelles d’une personne (Herbison et al., 1996 ; Sisto et Dyson-Hudson, 2007), le caractère subjectif de l’évaluation lié à l’expérience du praticien (Cuthbert et Goodheart, 2007) ou encore le peu de rapport entre le score MMT et le moment de force réellement produit (Aitkens et al., 1989 ; Needham-Shropshire et al., 1997). Concernant ce dernier point, les résultats de l’étude menée par Needham-Shropshire et al. (1997), présentés figure 5, sont particulièrement révélateurs des différences entre le score MMT et la force produite. Cette étude compare le score MMT et la force maximale produite par les muscles extenseurs de l’articulation du coude chez des personnes ayant un traumatisme médullaire cervical chronique. Le niveau d’atteinte neurologique des participants se situe au-dessus ou au-niveau de la racine cervicale C7, rendant les muscles extenseurs de l’articulation du coude partiellement paralysés (Maynard et al., 1997 ; Hislop et Montgomery, 2007).
Figure 5. Comparaison entre force produite lors de contraction maximale volontaire et score MMT des muscles extenseurs de l'articulation du coude (MMTS). Les forces moyennes pour chaque score sont présentées en dessous des valeurs individuelles (n = 135 muscles). L’axe des abscisses est une échelle logarithmique. 18 muscles n’ont pas produit de force mesurable (empruntée à Needham-Shropshire et coll., 1997).
Bien qu’il existe une relation significative entre le score MMT et la force produite, de nombreux chevauchements apparaissent dans les forces mesurées pour chaque score MMT. Needham-Shropshire et al. (1997) rapportent ainsi que 12 muscles évalués « 2 » par le MMT exercent plus de force que le muscle le plus faible évalué 4 par le MMT. Les auteurs rapportent également que certains muscles évalués « 1 » ou « 2 » par le MMT ne produisent aucune force bien qu’une activation musculaire soit enregistrée. Une étude récente menée par Vargas-Ferreira et al. (2012) précise le rapport entre le score MMT, la force produite et l’activation des muscles fléchisseurs et extenseurs de l’articulation du coude. Pour les muscles fléchisseurs, les résultats montrent une corrélation entre le score MMT et la force produite uniquement. Pour les muscles extenseurs, les résultats suggèrent une corrélation entre les trois mesures pour des scores MMT faibles, c.-à-d. en-dessous de « 3 », et indiquent que le niveau de corrélation décroît lorsque le score MMT est supérieur à « 3 ». Il paraît donc nécessaire de quantifier la production de force et les activations musculaires sous-jacentes pour obtenir une estimation fiable des capacités fonctionnelles d’une personne traumatisée médullaire (Sisto et Dyson-Hudson, 2007).
La production de force peut être quantifiée à partir d’un ergomètre évaluant le moment de force net produit autour de l’articulation. D’un point de vue biomécanique, le moment de force net représente l’aptitude physique des muscles à faire tourner un membre autour de l’articulation et s’exprime en Newton-mètre (Nm). Le moment de force net est influencé par le type de sollicitation musculaire, c.-à-d. concentrique, excentrique ou isométrique (Kellis et Batzopoulos, 1999). Le moment net est également influencé par les propriétés physiologiques et neurophysiologiques des muscles sollicités, c.-à-d. par l’architecture et la typologie musculaire et par les propriétés mécaniques et électrophysiologiques du muscle (Duclay, 2008). De ce fait, un moment de force net identique peut donc être produit par de nombreuses combinaisons d’activations musculaires et rend indispensable l’évaluation quantifiée des
14
activations musculaires associées par électromyographie (Challis, 1997 ; Stokes et Gardner-Morse, 1999 ; 2001 ; Prilutsky et Zatsiorsky, 2002).
2.2 Activations musculaires sous-jacentes
L’activation musculaire peut être évaluée par électromyographie de surface (EMG), technique permettant d’enregistrer l’activité électrique émanant des muscles à partir de deux électrodes positionnées sur la surface de la peau (De Luca, 1997). Ces électrodes sont localisées au-dessus du muscle (recommandation SENIAM ; Hermens et al., 2000) et enregistrent la tension électrique générée par les fibres musculaires se situant sous leurs champs de détection (Farina et al., 2002). D’un point de vue physiologique, la différence de tension enregistrée entre les deux électrodes représente l’activité globale des fibres musculaires sollicitées, c.-à-d. la sommation des potentiels d’action musculaire émis par plusieurs unités motrices1 (figure 6 ; Day et Hulliger, 2001). La modulation du signal EMG indique une modulation de la fréquence de décharge du motoneurone alpha et/ou du recrutement de nouvelles unités motrices. Ainsi, plus le signal EMG est important, plus l’activation musculaire est importante et plus le moment de force produit est important (Milner-Brown et Stein, 1975 ; Buchanan et al., 1986 ; Rao et al., 2009). Afin de comparer l’activation musculaire dans différentes conditions ou encore de comparer l’activation musculaire de différents muscles sollicités pendant la tâche, le signal EMG de chaque muscle est normalisé par sa valeur maximale atteinte lors de contraction maximale volontaire (Shiavi et al., 1998 ; Amarantini et Martin, 2004 ; Reaz et al., 2006). Il a ainsi été mis en évidence que les activations musculaires sont modulées par différents facteurs externes tels que, entre autres, l’expertise motrice (Griffin et
1 Une unité motrice est définie comme l’ensemble constitué par un motoneurone alpha et par les fibres
musculaires qu’il innerve (Day et Hulliger, 2001). Brièvement, le motoneurone alpha stimule le groupe de fibres musculaires en envoyant un potentiel d’action musculaire se propageant le long de la fibre musculaire et provoquant ainsi une contraction musculaire (De Luca et al., 1979).
Cafarelli, 2005 ; Bru et Amarantini, 2008 ; Tilin et al., 2011), le type de sollicitation musculaire (Rao et al., 2009) et la fatigue musculaire (Rao et al., 2010).
En outre, la production d’un moment de force net autour d’une articulation ne résulte pas uniquement d’activations musculaires dans le sens de l’effort net. Au contraire, le moment de force net résulte de l’activation simultanée des muscles agonistes et antagonistes (Zajac et al., 2002 ; Winter, 2005). De nombreux travaux ont montré que cette activation musculaire simultanée, connue sous le nom de co-activation musculaire (Kellis, 1998), permet d’assurer la double fonction de protection et de stabilisation de l’articulation (Solomonow et al., 1988 ; Kellis et Batzopoulos, 1999) et de coordination du mouvement (Lestienne, 1979).
La protection et la stabilisation passive de l’articulation sont principalement assurées par les structures ligamentaires et tendineuses entourant l’articulation (Regan et al., 1991 ; Alcid et al., 2004). Cependant, la contribution de ces structures est insuffisante pour assurer la stabilité de l’articulation et répartir de façon homogène les moments de force exercés autour de Figure 6. Signal EMG de surface représentant la sommation des potentiels d’action musculaire (encadré du haut à droite) et décomposition des trains de potentiels d’action générés par chaque unité motrice (encadré du bas à droite). (empruntée à De Luca et coll., 1979).
16
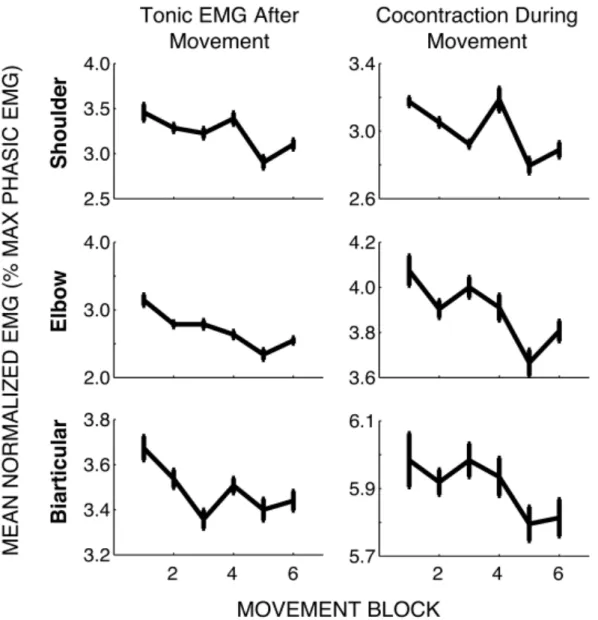
l’articulation dès lors que cette dernière est sollicitée (Gribble et al., 2003 ; Braendvik et Rœleveld, 2012). L’activation des muscles antagonistes permet alors d’augmenter la raideur articulaire et d’améliorer la précision du mouvement réalisé (Gribble et al., 2003). L’étude menée par Gribble et al. en 2003 s’intéresse à la modulation du niveau de co-activation musculaire relativement à la précision du mouvement réalisé lors d’une tâche de pointage impliquant plusieurs articulations du bras. Les résultats obtenus montrent que plus la cible à atteindre est réduite, plus la précision du mouvement et le niveau de co-activation musculaire sont importants (figure 7). Ce premier résultat suggère donc que le contrôle et la modulation de l’activation des muscles antagonistes pourraient être liés à une stratégie d’efficience du mouvement. Il est également intéressant de noter que le niveau de co-activation musculaire diminue avec l’augmentation de la pratique (figure 8). Ce second résultat suggère donc que Figure 7. Co-activation musculaire moyenne (COC) au cours du mouvement en fonction de la taille de la cible pour trois groupes musculaires : épaule (pectoral et deltoïde postérieur), coude (chef court du biceps brachial ou brachioradialis et chef latéral du triceps brachial), et biarticulaire (chef court du biceps brachial et chef long du triceps brachial). (empruntée et adaptée de Gribble et coll., 2003)
l’apprentissage d’un mouvement est lié à une optimisation du niveau d’activation des muscles antagonistes à des fins d’optimisation énergétique (Baratta et al., 1988).
Chez la personne traumatisée médullaire, les liens existants entre le moment de force net, les activations musculaires et la co-activation musculaire sont modifiés. Lors d’un mouvement volontaire, l’altération de l’activation musculaire antagoniste chez la personne traumatisée
Figure 8. Effet de la pratique sur l’indice de co-activation (cocontraction). La moyenne normalisée de l’activité EMG tonique à la fin du mouvement (gauche) et l’indice de co-activation au cours du mouvement (droite) sont représentées en fonction du bloc de mouvement réalisé pour les paires de muscles de l’épaule, du coude et biarticulaire. Dans tous les cas, une diminution significative de l’indice de co-activation était observée au cours de l’expérimentation. Les barres verticales représentent ± 1 écart-type. (empruntée à Gribble et coll., 2003)
18
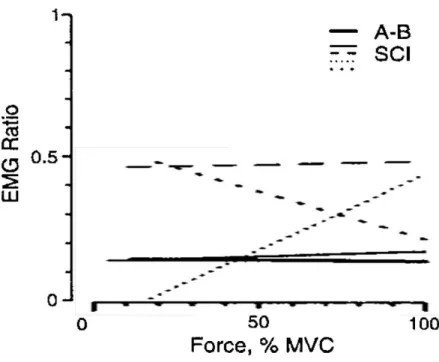
médullaire entraîne une diminution de la précision du mouvement et une augmentation de son temps de réalisation (Wierzbicka et Wiegner, 1992, 1996). Lors de contractions isométriques, Thomas et al. (1998) ont quantifié la force développée, l’activation du triceps et du biceps brachial, respectivement muscle extenseur et fléchisseur de l’articulation du coude, et le niveau de co-activation musculaire chez 72 personnes traumatisées médullaires réalisant des extensions de l’avant-bras en condition isométrique à différents niveaux de force. Il convient de noter que les personnes traumatisées médullaires ayant participé à cette expérimentation étaient toutes tétraplégiques avec un niveau d’atteinte neurologique située au-dessus ou au niveau de la racine cervicale C7. De ce fait, les muscles extenseurs étaient partiellement paralysés (Maynard et al., 1997 ; Hislop et Montgomery, 2007). Expérimentalement, ce dernier point se confirme par une diminution de la force produite chez les participants tétraplégiques comparativement à des participants sains lors de la réalisation de contractions maximales volontaires. Au niveau musculaire, le niveau de co-activation musculaire est modifié chez les participants tétraplégiques comparativement aux participants sains (figure 9). Bien que la moitié des participants tétraplégiques ait un niveau de co-activation musculaire similaire à celui des participants sains, l’autre moitié présente un niveau de co-activation musculaire supérieur, quel que soit le niveau de force développé. Nous notons également une plus forte variabilité interindividuelle du niveau de co-activation musculaire en fonction du niveau de force développé chez les participants tétraplégiques. Les résultats de Thomas et al. (1998) mettent ainsi en évidence les adaptations musculaires qui suivent le traumatisme médullaire et deux aspects sont particulièrement abordés. Le premier aspect concerne l’atrophie musculaire des muscles altérés par le traumatisme médullaire reflétant la désuétude et la dénervation du muscle (Thomas et al., 1997a ; Thomas et Grumbles, 2005). Le second aspect concerne la modification de l’ordre de recrutement et du taux de décharge des unités motrices (Thomas et al., 1997b ; Thomas et Del Valle, 2001 ; Thomas et Zijdewind, 2006).
Figure 9. Relations entre le rapport EMG Triceps-Biceps et la force développée (représentée en % de la contraction maximale volontaire ; MVC) par les lignes de régressions linéaires pour les participants sains (AB ; ligne épaisse) ; tous les muscles des participants tétraplégiques (SCI) avec un rapport EMG comparable aux participants sains (ligne fine) ; rapport EMG 3 écart-types au dessus de la moyenne (ligne pointillée). ; rapport EMG qui décroît avec la force (ligne pointillée épaisse) ; rapport EMG qui s’accroît avec la force (ligne pointillée fine). (empruntée et adaptée de Thomas et coll., 1998).
Ces résultats sont cependant à relativiser par rapport à la force maximale atteinte volontairement qui diffère entre les deux groupes. Sachant que la force maximale est inférieure pour le groupe de participants tétraplégiques, l’effort requis pour maintenir un moment de force net similaire à celui du groupe contrôle diffère. Par conséquent, les mécanismes de régulation de l’activation musculaire pourraient différer entre le groupe tétraplégique et le groupe contrôle (Boorman et al., 1996).
Sachant qu’une diminution du niveau de co-activation musculaire reflète un mouvement efficient et une optimisation énergétique chez le sujet sain, on peut supposer que l’augmentation du niveau de co-activation musculaire chez la personne traumatisée
20
médullaire est une conséquence délétère du traumatisme médullaire. Il paraît alors nécessaire d’étudier les activités neurophysiologiques en amont de l’activation musculaire afin d’établir l’origine de l’augmentation du niveau de co-activation et de limiter son apparition.
A la suite d’un traumatisme médullaire, de nombreuses fonctions motrices et sensorielles sont
perdues ou altérées (Maynard et al., 1999). L’évaluation de la perte des fonctions motrices et
sensorielles est principalement réalisée à partir de test musculaire manuel (Hislop et
Montgomery, 2007). Bien qu’efficace dans un cadre clinique, ce test n’est pas suffisamment
précis pour évaluer correctement le niveau de force ou l’activation musculaire
(Needham-Shropshire et al., 1997 ; Vargas-Ferreira et al., 2012). De ce fait, l’évaluation quantifiée du
moment de force net et des activations musculaires est nécessaire pour faire état des pertes
motrices suite à un traumatisme médullaire. La production d’un moment de force net
implique l’activation simultanée des muscles agonistes et antagonistes (Kellis et al., 2003 ;
Winter, 2005). Ce phénomène de co-activation musculaire a pour principales fonctions (i) la
protection et la stabilisation de l’articulation et (ii) la coordination du mouvement réalisé
(Solomonow et al., 1988 ; Gribble et al., 2003). Chez la personne traumatisée médullaire, le
niveau d’activation des muscles antagonistes augmente significativement en comparaison à
celui de personnes saines (Thomas et al., 1998). Cette augmentation pourrait résulter d’une
atrophie des muscles altérés par le traumatisme médullaire (Thomas et al., 1997a), d’une
altération des mécanismes de régulation localisés au niveau de la moelle épinière (Knikou,
3 M
ECANISMES REGULATEURS DE LA CONTRACTION MUSCULAIRELe contrôle des activations musculaires est principalement effectué au niveau de la moelle épinière et au niveau du cortex cérébral. La moelle épinière contient d’une part les motoneurones alpha innervant les fibres musculaires, d’autre part les neurones des circuits réflexes influençant l’activité des motoneurones alpha (Pierrot-Deseilligny, 2005). Ces circuits réflexes permettent de moduler rapidement le niveau d’activation des muscles agonistes et antagonistes. Au niveau cortical, le cortex moteur primaire, le cortex pré-moteur et l'aire motrice supplémentaire peuvent moduler l’activité des motoneurones alpha et des circuits réflexes. Bien que d’autres aires corticales interviennent dans la planification et la programmation d’une action motrice volontaire (Rosenbaum, 1991 ; Rizzolatti et Luppino, 2001 ; Bioulac et al., 2005), elles ne seront pas présentées dans ce chapitre. Après un traumatisme médullaire, une réorganisation de l’activité spinale et corticale a été révélée (Tran et al., 2004 ; Herbert et al., 2007 ; Knikou, 2012). Après avoir précisé la physiologie et l’organisation de chaque structure, nous présentons comment l’activité de ces structures est modulée lors d’une action motrice simple. Nous présentons ensuite la réorganisation structurelle et l’altération de l’activité des structures spinales et corticales à la suite d’un traumatisme médullaire et leurs possibles influences sur la modification des niveaux d’activations des muscles agonistes et antagonistes agissant autour de l’articulation mobilisée.
3.1 Contrôle et régulation spinale de la contraction musculaire
Comme nous l’avons indiqué au chapitre précédent, l’activation musculaire précède l’activation d’un pool de motoneurones alpha. Les motoneurones alpha sont localisés dans la moelle épinière et sont organisés de façon somatotopique, c.-à-d. que chaque partie du corps y est représentée par une surface bien précise et que l'ensemble suit une organisation ordonnée
22
(Goshgarian, 2003). Par exemple, les motoneurones alpha situés dans le renflement cervical de la moelle épinière innervent uniquement les membres supérieurs. Le pool de motoneurones innervant les muscles distaux est situé vers l’extrémité de la corne ventrale tandis que celui qui innerve les muscles proximaux est situé vers la médiane (figure 10). Notons ici que cette organisation somatotopique de la moelle épinière rend les muscles distaux particulièrement vulnérables à un traumatisme médullaire (Nohda et al., 2007). Les circuits réflexes se forment par connexions entre les motoneurones alpha, les différents récepteurs sensoriels localisés dans le muscle et les interneurones inhibiteurs localisés dans la moelle épinière (pour une revue complète voir Pierrot-Deseilligny, 2005). Ces derniers permettent de moduler le niveau d’activation des muscles antagonistes par rapport à celui des muscles agonistes via, entre autres, le réflexe d’inhibition réciproque et le réflexe myotatique inverse (Crone et Nielsen, 1994 ; Knikou, 2012). Concernant le réflexe d’inhibition réciproque, les afférences sensorielles Ia des fuseaux neuromusculaires provenant des muscles agonistes stimulent l’activité des motoneurones alpha de ces mêmes muscles et inhibent l’activité des
Figure 10. Organisation somatotopique des motoneurones sur une coupe transversale de la corne ventrale de la moelle épinière. Les motoneurones innervant la musculature axiale sont situés en position médiane, ceux qui innervent la musculature distale, en position plus latérale. (empruntée à Purves et Coquery, 2005).
motoneurones alpha des muscles antagonistes (figure 11.A). Concernant le réflexe myotatique inverse, les afférences sensorielles Ib des organes tendineux de Golgi des muscles agonistes inhibent l’activité des motoneurones alpha des muscles agonistes et stimulent l’activité des motoneurones alpha des muscles antagonistes (figure 11.B). Certains travaux supposent que le réflexe d’inhibition réciproque et le réflexe myotatique inverse sont atténués lorsque le niveau de force développé augmente (Leonard et al., 1999 ; Hwang et al., 2002). Cette modulation pourrait provenir directement des structures corticales. En effet, de nombreux travaux ont mis en évidence que le réflexe d’inhibition réciproque et le réflexe myotatique inverse sont régulés au niveau cortical (Crone and Nielsen, 1994). Précisément, il est supposé que l’activité corticale régule le niveau d’excitabilité des interneurones inhibiteurs afin d’accentuer l’inhibition des muscles antagonistes (Hongo et al., 1969; Lundberg et Voorhoeve, 1962).
A B
Figure 11. A. Réflexe d’inhibition réciproque. L’étirement du faisceau neuromusculaire fait augmenter l’activité des fibres afférentes Ia. Ces dernières excitent les motoneurones des muscles agonistes et inhibent les motoneurones des muscles antagonistes. B. Réflexe myotatique inverse. L’étirement de l’organe tendineux de Golgi fait augmenter l’activité des fibres afférentes Ib. Ces dernières inhibent les motoneurones des muscles agonistes et excitent les motoneurones des muscles antagonistes. (empruntée et adaptée de Doutreloux, 1998).
24
A la suite d’un traumatisme médullaire, l’ensemble des circuits réflexes est altéré et plus particulièrement le réflexe d’inhibition réciproque (Knikou et al., 2006 ; Knikou et Mummidisetty, 2011 ; Dietz, 2012). Knikou et Mummidisetty (2011) ont étudié la diminution de l’inhibition réciproque chez huit sujets traumatisés médullaires incomplets (c.-à-d., AIS C et D) lors d’une tâche de marche assistée. Pour ce faire, Knikou et Mummidisetty ont enregistré les modulations de l’activité musculaire réflexe (réflexe H, qui représente l’activation directe des motoneurones alpha via les afférences Ia issues des fuseaux neuromusculaires ; pour des considérations méthodologiques voir p. ex., Knikou, 2008 ou Grosprêtre et Martin, 2012). Les résultats obtenus montrent que la modulation du réflexe d’inhibition réciproque est fortement réduite, voire absente, chez les sujets traumatisés médullaires incomplets (figure 12). Cette altération du réflexe d’inhibition réciproque chez les personnes traumatisées médullaires pourrait être causée par la modification d’autres circuits réflexes (Katz et Pierrot-Deseilligny, 1982; Shefner et al., 1992 ; Faist et al., 1994; Morita et al. 2006) et par une diminution du contrôle cortical des interneurones inhibiteurs recevant les afférences sensorielles Ia (Boorman et al., 1996 ; Xia et Zev Rymer, 2005). La rupture des voies descendantes, excitatrices des circuits réflexes, causerait une diminution de l’inhibition et donc une augmentation de l’activation musculaire antagoniste. D’autres études montrent que la modulation du niveau d’activation des muscles antagonistes pourrait être directement liée à une modification de la commande centrale (Solomonow et al., 1988 ; Carolan et Caffarelli, 1985; Hakkinen et al., 1998). Comparer les activations corticales de personnes traumatisées médullaires à celles de personnes saines pourrait donc renseigner sur l’origine de l’augmentation de l’activation des muscles antagonistes chez les personnes traumatisées médullaires. Une altération de l'activation corticale pourrait ainsi appuyer l’hypothèse du contrôle cortical de la co-activation musculaire.
Figure. 12. Réflexe d’inhibition réciproque chez deux sujets traumatisés médullaire au repos (A, B). Le réflexe H moyen est enregistré en condition contrôle (lignes grises) et suite à la stimulation du nerf péronier commun après conditionnement de 3 ms. (lignes noires) chez deux sujets SCI assis. (C) Histogramme montrant l’effet de la stimulation du nerf péronier commun sur l’amplitude du réflexe H après conditionnement de 2 et 3 ms. Le réflexe H moyen est exprimé en pourcentage du réflexe H enregistré lors de la condition contrôle ± erreur standard moyenne. Il est à noter que l’inhibition réciproque est remplacée par une facilitation après le conditionnement de 2 ms (p < 0.05). (empruntée et adaptée de Knikou et Mummidisetty, 2011).
3.2 Contrôle et régulation corticale de la contraction musculaire
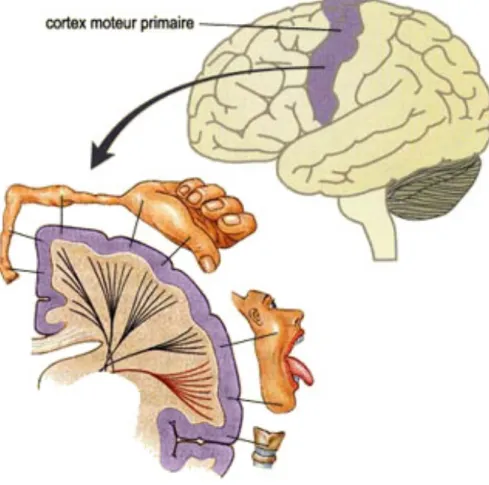
D’un point de vue anatomique, le cortex moteur primaire (M1) est une région corticale située sur le gyrus précentral, en avant du sillon central (Purves et Coquery, 2005). Il forme une large bande s’étendant de la scissure latérale jusqu’à la scissure longitudinale (figure 13). Le cortex prémoteur (CxPM) inclut le cortex prémoteur latéral et l’aire motrice supplémentaire et est situé à l’avant du M1. Le cortex somatosensoriel (S1) est localisé en arrière du sillon central. Il forme une large bande s’étendant de la scissure centrale jusqu’à la scissure longitudinale. La substance grise de M1, contenant les neurones pyramidaux (ou neurones moteurs), peut être décomposée en une couche superficielle et une couche profonde.
26
Figure 13. Région anatomique du cerveau correspondant à M1 (graphique du haut, aire violette) et organisation somatotopique de M1. (graphique du bas). La surface dédiée à chaque partie du corps est fonction de la précision des mouvements pouvant être réalisée par cette partie du corps (empruntée à lecerveau.mcgill.ca)
Les axones des neurones pyramidaux situés dans la couche profonde composent la voie corticospinale innervant les motoneurones alpha (Rosen et Asanuma, 1972 ; Bioulac et al., 2005 ; Lemon, 2008). Tout comme la moelle épinière, les neurones pyramidaux sont organisés de façon somatotopique (figure 13 ; Penfield et Rasmussen, 1950). Il est intéressant de noter que la surface de M1 dédiée à chaque partie du corps est relative à la précision du mouvement pouvant être réalisée par cette partie du corps. A titre d’exemple, la surface dédiée au contrôle du membre supérieur représente quasiment la moitié de la surface de M1.
Les neurones moteurs du CxPM reçoivent les influences d’autres aires corticales intervenant dans la planification et la programmation de l’action motrice volontaire. Les neurones composant S1 reçoivent les afférences sensorielles des faisceaux neuromusculaires et des organes tendineux de Golgi. Les neurones du CxPM et de S1 peuvent influencer l’acte moteur en interagissants avec le M1 et en projettant leurs axones les neurones des circuits réflexes de la moelle épinière (Bioulac et al., 2005 ; Lemon, 2008).
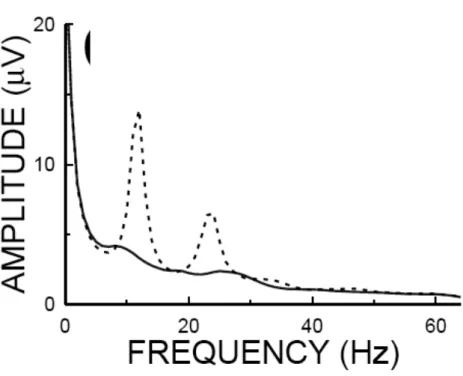
D’un point de vue électrophysiologique, l’activité corticale peut être enregistrée par électroencéphalographie (EEG), technique permettant de recueillir l’activité électrique émise à chaque instant par un groupe de neurones du cortex avec une bonne résolution temporelle (Niedermeyer et Lopes da Silva, 2005). Un enregistrement EEG est réalisé à partir d’un bonnet munis d’électrodes placé sur le cuir chevelu d’un individu, les électrodes étant positionnées selon la recommandation internationale 10-20 (Jasper, 1958). Chaque électrode enregistre l’activité électrique générée par un groupe de neurones orientés et situés dans la même direction (Buzsaki et Draghun, 2004). Les signaux enregistrés sont ensuite référencés par rapport à une ou plusieurs électrode(s) (Nunez et al., 1997). Les activations corticales sont principalement analysées par un calcul de puissance spectrale (figure 14) ou, plus récemment, par décomposition temps-fréquence (figure 15), technique permettant d’obtenir le meilleur compromis entre résolution temporelle et fréquentielle (Tallon-Baudry et al., 1996). Lors de la réalisation d’un acte moteur, les premières études EEG ont rapidement décelé une modulation caractéristique de l’activité corticale enregistrée au-dessus de M1 (Gastault, 1952 ; Gastault et al., 1952). Les travaux de Pfurtscheller, ont précisément décrit cette modulation comme une diminution de la puissance spectrale autour de 10 Hz et 20 Hz comparativement à un état de repos (Pfurtscheller, 1977 ; 1981 ; Pfurtscheller et Aranibar, 1977, 1979 ; Pfurtscheller et al., 1997 ; Pfurtscheller et Lopes da Silva, 1999). Ces diminutions de puissance spectrale sont connues sous le nom de désynchronisation corticale
28
liée à un événement (ERD pour Event Related Desynchronization). L’ERD autour de 10 Hz est localisée au niveau du S1 et est supposée refléter l’intégration sensorielle du comportement moteur pendant l’action motrice (Pfurtscheller, 1992 ; Pfurtscheller et al., 1994 ; Salmelin et al., 1995).
Figure 14. Spectre de puissance enregistré par une électrode située au-dessus du cortex moteur primaire au repos (ligne pointillée) et lors d’une contraction imaginée (ligne pleine). (empruntée et adaptée de Schalk (2004) depuis BCI2000.org).
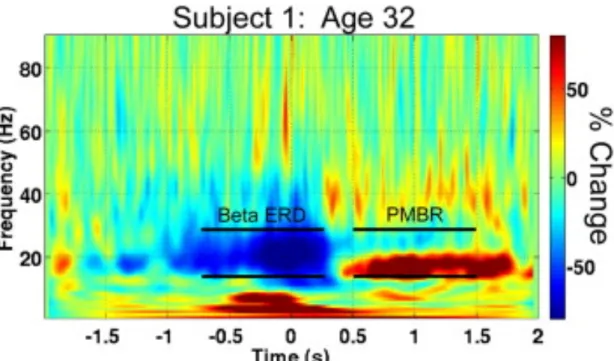
Figure 15. Représentation temps-fréquence de l’activité corticale enregistrée au dessus du cortex moteur lors d’un rapide mouvement de l’index de la main droite réalisé par un sujet sain. La barre de couleur représente le pourcentage de changement par rapport à une activité basale calculée sur la période [-2 -1.5] s. La diminution de la puissance spectrale ERD autour de 20 Hz est représentée par une zone bleue. L’augmentation de la puissance spectrale ERS autour de 20 Hz (appelée ici Post Movement Beta Resynchronization ; PMBR) est représentée par une zone rouge. (empruntée et modifiée de Gaetz et al., 2010).
L’ERD autour de 10 Hz est sensible à la présence et à la durée de la contraction musculaire plutôt qu’à la modulation du niveau de force développé (Stancák et al., 1997). L’ERD autour de 20 Hz, représentée par la zone bleue sur la figure 15, est localisée au niveau du M1 et est supposée refléter son activation lors de la préparation et de la transmission des potentiels d'action vers les muscles sollicités (Pfurtscheller, 1981 ; Salmelin et Hari, 1994 ; Crone et al., 1998 ; Pfurtscheller et al., 2003 ; MacKay, 2005). L’ERD autour de 20 Hz est influencé par le niveau de force produit pendant le mouvement (Stancák et al., 1997 ; Pfurtscheller et Lopes da Silva, 1999). Précisément, l’ERD autour de 20 Hz augmente avec le niveau de force et indique que l’activation de M1 est plus importante pour des niveaux de force importants ou nécessitant une attention plus importante (Stancák et al., 1997 ; Mima et al., 1999 ; Dal Maso et al., 2012). A l’arrêt de l’acte moteur, une augmentation de la puissance spectrale autour de
30
20 Hz apparaît (Pfurtscheller, 1992 ; Pfurtscheller et al., 1996, 1997, 1998; Pfurtscheller et Neuper, 1997). Cette augmentation de la puissance spectrale, représentée par la zone rouge sur la figure 15, est connue sous le nom de synchronisation corticale liée à un évènement (ERS pour Event Related Synchronization). Dans la littérature, les processus corticaux liés à l’apparition de l’ERS font toujours l’objet d’un important débat (Pfurtscheller et al., 1998; Cassim et al., 2001). D’une part, l’ERS autour de 20 Hz est associée à une désactivation du M1 (Pfurtscheller, 1992 ; Pfurtscheller et al., 1996, 1997, 1998). Ce point de vue étant supporté par d’autres études neurophysiologiques montrant que M1 est moins excitable pendant cette période (Chen et al., 1998). D’autre part, l’ERS autour de 20 Hz est associée à un traitement des informations sensorielles liées au mouvement réalisé (Cassim et coll, 2001 ; Houdayer et al., 2006 ; Reyns et al., 2008). Ce point de vue étant supporté par l’apparition de l’ERS autour de 20 Hz lors de mouvement passif (Xiang et al., 1997) et de stimulation électrique périphérique (Maertens et al., 1992 ; Tokimura et al., 2000). Ces deux hypothèses ne sont toutefois pas antinomiques et il est fort probable que les informations sensorielles liées au mouvement réalisé jouent un rôle dans l’inhibition de M1 (Pfurtscheller et al., 1996 ; Szurhaj et al., 2003). Tout comme l’ERD autour de 20 Hz, l’ERS autour de 20 Hz est modulé avec le niveau de force et indique que l’activation de M1 est plus importante pour des niveaux de force importants (Stancák et al., 1997). En accord avec les travaux présentés précédemment, la modulation des activations corticales en fonction du niveau de force produit suggère que les activations corticales contribuent au contrôle du niveau de force développé (Siemionow et al., 2000; Chakarov et al., 2009).
3.3 Plasticité corticale suite à un traumatisme médullaire
A la suite d’un traumatisme médullaire, les structures corticales impliquées dans l'acte moteur sont altérées (pour une revue de littérature, voir Kokotilo et al., 2009) et deux formes de
modifications peuvent être distinguées. La première concerne la réorganisation physiologique et somatotopique du M1 et du S1 innervant les membres lésés par le traumatisme médullaire (Green et al., 1998, 1999 ; Bruehlmeier et al., 1998 ; Crawley et al., 2004 ; Jurkiewicz et al., 2006 ; 2007, 2010). La seconde concerne la réorganisation de l'activité corticale visible lors d’une tâche motrice (Tran et al., 2004 ; Herbert et al., 2007 ; Muller-Putz et al., 2007 ; Gourab et Schmit, 2010).
Concernant la réorganisation physiologique du cortex moteur, les travaux de Crawley et al. (2004) mettent en évidence par Imagerie par Résonance Magnétique (IRM) que la quantité de substance grise composant M1 reste inchangée à la suite d’un traumatisme médullaire. Jurkiewicz et al. (2007, 2010) précisent ces résultats en étudiant la réorganisation du M1 chez six personnes traumatisées médullaires au cours de la première année suivant le traumatisme médullaire. Les résultats de ces études montrent que, depuis une faible activation de M1 dans la phase subaiguë post-traumatique, l’activation de M1 augmente pour retrouver un niveau comparable à celui de personnes saines. Jurkiewicz et al. notent également (i) une activation du S1 non-présente chez les personnes saines qui décroît au cours de la première année post-traumatique et (ii) que l’augmentation de l’activation de M1 est relative à la récupération fonctionnelle post-traumatique. Ainsi la perte post-traumatique de capacités fonctionnelles résultera en une diminution permanente de l’activation de M1. Ce dernier résultat concorde avec les résultats reportés par Green et al. (1998, 1999). Ces études, mêlant EEG et IRM, suggèrent que l’activité corticale dédiée au contrôle moteur est localisée plus postérieurement chez les personnes traumatisées médullaires, c.-à-d. au niveau du S1 (figure 16) et que l’activité corticale de M1 est relative à la récupération fonctionnelle post-traumatique. Cette réorganisation corticale interroge sur la réorganisation des activations corticales, ERD et ERS, lors de contractions saines ou altérées par le traumatisme médullaire.
32
Au niveau électrophysiologique, peu d’études se sont intéressées aux activations corticales ERD et ERS à la suite d’un traumatisme médullaire. A notre connaissance, Müller-Putz et al. (2007) ont été les premiers à étudier les modifications d’ERD et d’ERS autour de 20 Hz chez des sujets traumatisés médullaires pendant la tentative (ou la réalisation pour les sujets valides) et la réalisation passive d'un mouvement du pied. Leurs résultats ne montrent aucune activation ERD et ERS chez les sujets traumatisés médullaires, quelle que soit la condition expérimentale effectuée. En 2010, Gourab et Schmit réalisent une étude similaire ; les patients traumatisés médullaires devant tenter un bref mouvement du pied avec un effort minimal. Les résultats de cette étude, présentés par la figure 17, révèlent une ERD similaire chez les personnes traumatisées médullaires et valides et une diminution de l’ERS chez les personnes traumatisées médullaires. Gourab et Schmit notent également une relation linéaire entre le score MMT des patients traumatisés médullaires et l’amplitude de l’ERS (figure 18).
Figure 16. Localisation topographique de l’activation corticale dédiée au contrôle moteur (zone bleutée) chez les participants contrôle (à gauche) et traumatisés médullaires (à droite). L’activation corticale dédiée au contrôle moteur est postérieure chez les participants traumatisés médullaires comparativement aux participants contrôles. (empruntée et modifiée de Green et al., 1998).
Figure 17. Carte topographique de la puissance spectrale moyenne dans la bande de fréquence 13-35 Hz pour 8 patients traumatisées médullaires (SCI) et 8 patients valides (NI). La topographie de la puissance spectrale pendant l’ERD chez les NI (A) et les SCI (B) est présentée en haut avec la carte topographique présentant la différence ERD entre les SCI et les NI (E). La topographie de la puissance spectrale pendant l’ERS chez les NI (C) et les SCI (D) est présentée en haut avec la carte topographique présentant la différence ERD entre les SCI et les NI (F). (empruntée et modifiée de Gourab et Schmit, 2010).
Figure 18. Corrélation du pic d’amplitude ERS avec le score MMT moteur. (A) ERD et ERS enregistrés au-dessus de l’électrode Cz chez un patient traumatisé médullaire (complétude du traumatisme médullaire : D). (B) Corrélation entre le score MMT moteur et le pic d’amplitude ERS chez l’ensemble des sujets traumatisés médullaires. (empruntée et modifiée de Gourab et Schmit, 2010).
34
D’une manière générale, la conservation de l’ERD suggère que cette activation corticale est essentiellement d’origine corticale et est nécessaire à la réalisation d’une action motrice. La diminution de l’ERS suite à un traumatisme médullaire et sa relation avec les scores MMT suggèrent une sensibilité de l’ERS aux afférences sensorielles (Cassim et al., 2001). Ces études sont toutefois limitées par la tâche expérimentale n’incluant pas de contractions réellement réalisées. L’ERD et l’ERS sont-elles modulées différemment lors de contractions n’incluant pas de muscles altérés par le traumatisme médullaire ? Par ailleurs et bien que certaines précautions aient été prises, la tâche expérimentale ne permet pas de mesurer le niveau de force tenté par la personne traumatisée médullaire. Sachant que la modulation du niveau de force influence l’ERD et l’ERS, il est possible que certaines différences d’activations corticales aient été masquées.
Certaines études électrophysiologiques impliquant des contractions intactes ont toutefois été réalisées chez des patients traumatisés médullaires (Mattia et al., 2006, 2009). Bien que ces études n’investiguent pas directement l’ERD et l’ERS, les résultats suggèrent que l’activation corticale du M1 dédiée au contrôle moteur n’est pas altérée lors de contractions intactes. A notre connaissance, aucune étude n’a pris en considération l’influence du niveau de force sur l’ERD et l’ERS au cours de contractions volontaires réalisées par des patients traumatisées médullaires, qu’elles soient intactes ou altérées par le traumatisme médullaire.