Analyse du profil d’expression de la protéine
pro-apoptotique Dap-3 dans les vésicules extracellulaires
produites dans le contexte de l’infection au VIH-1
Mémoire
Sofiane BERRAZOUANE
Maîtrise en microbiologie-immunologie
Maître ès sciences (M.Sc.)
Québec, Canada
©Sofiane BERRAZOUANE, 2016
Analyse du profil d’expression de la protéine
pro-apoptotique Dap-3 dans les vésicules extracellulaires
produites dans le contexte de l’infection au VIH-1
Mémoire
Sofiane BERRAZOUANE
Sous la direction de :
iii
Résumé
L’immunopathogenèse de l’infection au VIH-1 est principalement causée par la déplétion des LT CD4 (lymphocytes T-CD4). Cette mort des LT CD4 dépend de plusieurs facteurs comme la lyse des LT CD4 infectés et la présence de vésicules extracellulaires et d’exosomes libérées par les cellules dendritiques et les LT CD4 infectés au VIH-1.
L’analyse protéomique des exosomes issus des cellules dendritiques mises en culture avec le VIH-1 a révélé la présence de molécules pro-apoptotiques comme le Dap-3 (Death Associated Protein 3). Nous avons proposé comme hypothèse que le Dap-3 puisse être contenu dans d’autres types de vésicules extracellulaires et que le Dap-3 vésiculaire contribue à la déplétion des LT CD4.
Après avoir optimisé l’immunobuvardage avec l’anti-Dap-3, nous avons déterminé la présence de Dap-3 dans les vésicules extracellulaires issues des cellules RAJI-CD4-DCIR infectées au VIH-1. L’utilisation de gradients de vélocité nous a permis d’observer la présence de Dap-3 dans les fractions du gradient contenant les exosomes issus des cellules RAJI-CD4-DCIR infectées, mais également dans d’autres fractions du gradient de vélocité encore non caractérisées. Chez les patients, nous avons montré une hétérogénéité des vésicules extracellulaires dans les fractions du gradient de vélocité issues des plasmas des patients VIH-1+. Ces résultats indiquent la présence de plusieurs populations de vésicules
extracellulaires séparées par la méthode du gradient de vélocité. Enfin, la transfection des cellules RAJI-CD4-DCIR et des cellules dendritiques a été mise au point avec les ARN anti-sens de Dap-3 afin de produire éventuellement des vésicules Dap-3 négatives.
Ce projet de recherche aura permis de valider les outils nécessaires à la poursuite de l’étude du rôle de Dap-3 dans la pathogenèse de l’infection au VIH-1.
iv
Table des matières
Résumé ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... viii
Liste des abréviations ... ix
Chapitre I : Introduction ... 1
1. Le virus de l’immunodéficience humaine de type 1 (VIH-1). 1
1.1. Découverte ... 11.2. Épidémiologie du VIH-1 ... 1
1.3. Structure du VIH-1 ... 1
1.4. Les phases d’infection au VIH-1 ... 2
1.4.1. Phase de primo-infection ... 3
1.4.2. Phase chronique ... 3
1.4.3. Phase du SIDA ... 4
2. Les cellules participant à l’immunopathogenèse de l’infection
au VIH-1 ... 5
2.1. Les cellules dendritiques ... 5
2.2. Les lymphocytes T CD4 ... 7
2.3. Les lymphocytes T CD8 ... 8
2.4. Déplétion des LT CD4 ... 8
3. Apoptose ... 9
3.1. Apoptose des LT CD4 ... 10
4. Les vésicules extracellulaires ... 12
4.1. Découverte des exosomes ... 12
4.2. Types de vésicules extracellulaires ... 13
4.2.1. Les microvésicules ... 13
4.2.2. Les vésicules apoptotiques ... 14
v
4.3. Les rôles pléiotropiques des vésicules extracellulaires dans la réponse
immunitaire ... 16
4.4. Pathogenèse de l’infection au VIH-1 ... 17
4.5. Limitation des méthodes classiques ... 18
5. Mitochondries dans les infections au VIH-1 ... 19
6. La protéine pro-apoptotique Dap-3 ... 20
6.1. Structure de Dap-3 ... 21
6.2. Fonctions physiologiques de Dap-3 ... 21
6.3. Rôles de Dap-3 dans les pathologies ... 22
Chapitre II : Problématique, hypothèse et objectifs de recherche
... 24
1. Problématique ... 24
2. Hypothèse de recherche ... 24
3. Objectif ... 25
Chapitre III : Matériel et Méthodes ... 26
1. Patients ... 26
2. Réactifs et anticorps ... 26
2.1. Réactifs ... 26 2.2. Anticorps ... 273. Culture cellulaire ... 27
3.2.Cellules dendritiques ... 284. Immunobuvardage ... 28
5. Caractérisation des vésicules extracellulaires ... 29
Purification des vésicules extracellulaires avec ultracentrifugation ... 29
Purification des vésicules extracellulaires par l’ExoQuick™ ... 29
Séparation des vésicules extracellulaires par gradient de vélocité ... 30
6. Détection des vésicules extracellulaires ... 30
6.1. Mesure de l’activité d’acétylcholine estérase ... 30
6.2. Rayon d’hydrolyse dynamique des vésicules extracellulaires mesuré au Zetasizer Nano ZS (Malvern™) ... 31
7. Transfection des cellules avec des ARN anti-sens anti-DAP3 ... 31
8. Production virale ... 32
vi
1-Optimisation de l’immunobuvardage avec l’anti-Dap-3 ... 34
2- L’infection par le VIH-1 favorise la présence de Dap-3 dans les vésicules extracellulaires des cellules RAJI CD4 DCIR ... 38
3- Présence de Dap-3 dans les différents types de vésicules extracellulaires issues des cellules RAJI CD4 DCIR infectées au VIH-1 ... 40
4-Caractérisation des vésicules extracellulaires issues des plasmas des patients infectés au VIH-1 ... 41
4-1- Étude comparative de la présence des vésicules extracellulaires issues des plasmas des patients infectés au VIH-1 ... 42
4-2- Analyse de l’abondance d’exosomes par la mesure de l’activité d’acétylcholine estérase ... 44
4-3-Mesure de la taille des vésicules extracellulaires avec le nanosizer46 4-4- Détection de Dap-3 dans les fractions du gradient. ... 51
5- Mise au point du modèle de transfection avec les ARNs anti-sens Dap-3 ... 51
Chapitre V : Discussion ... 54
1. Les rôles des vésicules extracellulaires dans la pathogenèse de l’infection au VIH-1 ... 55
2-Présence de Dap-3 sur les vésicules extracellulaires issues des cellules infectées au VIH-1 ... 56
3-Caractérisation des vésicules extracellulaires issues des plasmas des sujets infectés au VIH-1 ... 58
4. Rôle de Dap-3 dans les autres pathologies ... 59
Chapitre VI : Conclusions et perspectives... 61
vii
Liste des tableaux
Tableau 1 : Les protéines du VIH-1 participant à la régulation de l’apoptose des LT CD4. ... 12 Tableau 2 : Les rôles de Dap-3 ... 23 Tableau 3 : Quantité des protéines pour chaque dilution de cellules utilisées dans la mise au point de l’immunobuvardage avec l’anti-Dap-3 ... 35 Tableau 4 : Caractéristiques cliniques des sujets ... 42
viii
Liste des figures
Figure1 : Séquence de la protéine Dap-3.
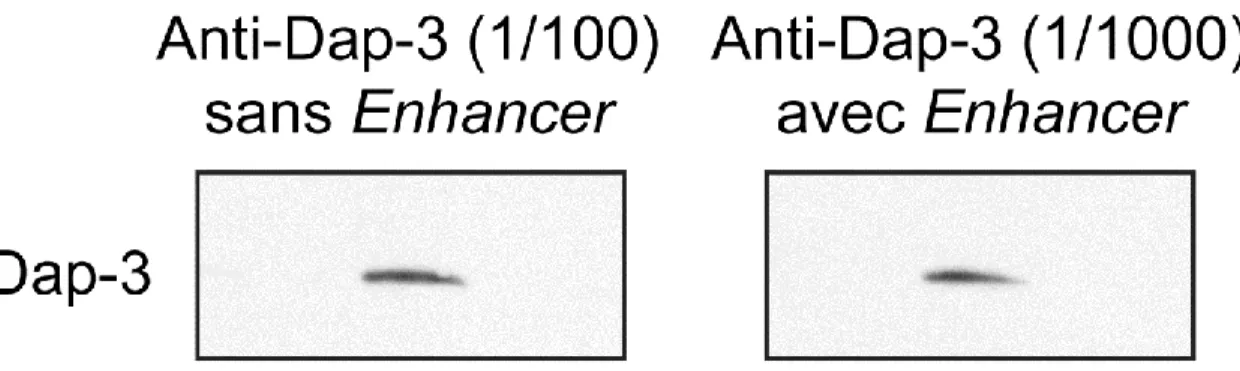
Figure 2 : Immunobuvardage avec l’anti-Dap-3 avec ou sans utilisation d’Enhancer comme diluant des anticorps
Figure 3 : Immunobuvardage avec l’anti-Dap-3 et révélation avec le Luminata Forte ou l’ECL
Figure 4 : Immunobuvardage avec l’anti-Dap-3 avec différents temps de transfert et d’incubation avec l’anti-Dap-3
Figure 5 : Immunobuvardage avec Dap-3 avec ou sans enhancer pour l’anti-Dap-3 et l’anticorps secondaire
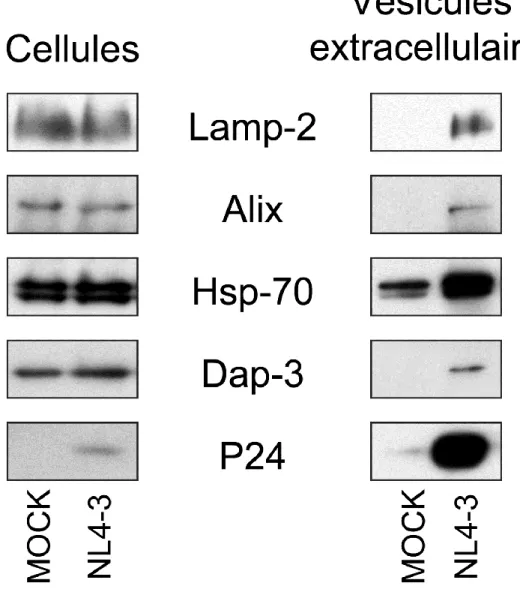
Figure 6 : Caractérisation des vésicules extracellulaires issues des cellules RAJI CD4 DCIR infectées au VIH-1
Figure 7 : Présence de Dap-3 dans les fractions du gradient de vélocité issues des vésicules extracellulaires des cellules RAJI CD4 DCIR infectées au VIH-1
Figure 8 : Détection des marqueurs d’exosomes et de membrane plasmique sur les vésicules extracellulaires
Figure 9 : Présence d’ICAM-1 dans les fractions du gradient de vélocité
Figure 10 : Analyse de l’abondance des exosomes sur les fractions du gradient de vélocité issues des préparations de vésicules extracellulaires des plasmas des patients infectés au VIH-1
Figure 11 : Distribution des vésicules extracellulaires dans le gradient de vélocité analysées au nanosizer
Figure 12 : Caractérisation de l’hétérogénéité des vésicules extracellulaires issues de plasmas des patients infectés au VIH-1 ou non
ix
Liste des abréviations
AChE : Acétylcholinestérase
ADAM17 : metallopeptidase domain 17 Alix : ALG-2-interacting protein X
Caspases: Cysteine-dependent aspartate-cleaving proteases CCR5: C-C chemokine receptor type 5
CCR7: C-C chemokine receptor type 7
CMH : Complexe majeur d'histocompatibilité CNP : 2', 3’-Cyclic-nucleotide 3'-phosphodiesterase CSF: Colony-stimulating factor
CTLA-4: cytotoxic T-lymphocyte-associated protein CytC: Cytochrome C
CXCR4: C-X-C chemokine receptor type 4 Dap-3: Death associated protein 3
DCIR: Dendritic Cell Immunoreceptor
DC SIGN: Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integrin
DMEM: Dulbecco's Modified Eagle Medium
ESCRT: Endosomal sorting complexes required for transport FADD: Fas Associating protein with Death Domain
Gp120: Glycoprotein 120
GM-CSF: Granulocyte-Macrophage Colony Stimulating Factor HBS: HEPES-buffered saline
ICAM-1: Intercellular Adhesion Molecule 1 IFNγ: Interferon gamma
IL: Interleukines
IgG: Immunoglobuline G
LAMP-2: Lysosomal-associated membrane protein LFA-1: Lymphocyte function-associated antigen 1
x
LTR: Long terminal repeat LB: Lymphocytes B
LT CD4 : Lymphocytes T CD4 LT CD8 : Lymphocytes T CD8
MIF: Macrophage migration Inhibitory Factor Nef: Negative Regulatory Factor
PBL: Peripheral Blood Lymphocyte
PBMCs: Peripheral Blood Mononuclear Cell PI3 kinase: Phosphatidyl-inositol 3-kinase PLP: major myelin proteolipid protein PD-1: Programmed cell death
PSG: Pénicilline Streptamycine L-Glutamine PTCP: the permeability transition pore complex PVDF: Polyvinylidene Difluoridede
SDH: Succinate Déshydrogénase
SDS-PAGE : Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis
SIDA : Syndrome d'immunodéficience acquise SIV : Simian Immunodeficiency Virus
SVFU : sérum du veau fœtal ultracentrigugé
TAM: Tumor Associated Macrophage Tat: Trans-Activator of Transcription TBS: Tris Buffer Saline
TCA: Trichloroacetic acid
TGF-β: Transforming growth factor beta TNFα: Tumor Necrosis Factor
TRAIL: Tumor-necrosis-factor related apoptosis inducing ligand TSG 101 : Tumor susceptibility gene 101 protein
Vpr: Viral Protein R
xi
À mes chers parents et sœurs pour leurs soutiens indéfectibles et leurs encouragements
xii
Remerciements
Je tiens à remercier ma directrice de recherche Dre Caroline Gilbert de m’avoir accepté dans
son laboratoire et permis d’exercer ma passion pour la recherche scientifique. Également d'avoir appris avec elle la méthodologie, l’organisation du projet de recherche et la rigueur scientifique.
Je remercie également les membres de l’équipe : Audrey Hubert, Thy-René Nsimba Batomene, Alma Posvandzic, Caroline Subra, Myriam Vaillancourt et Julien Vitry.
1
Chapitre I : Introduction
1. Le virus de l’immunodéficience humaine de type 1 (VIH-1)
1.1. DécouverteLes premiers cas du syndrome de l’immunodéficience acquise (SIDA) ont été décrits aux États-Unis, en 1981. En 1982, les chercheurs savaient que le taux des lymphocytes T CD4 (LT CD4) sanguin diminuait drastiquement suggérant ainsi que ces cellules pouvaient être la cible du pathogène qui était encore inconnu à l’époque. Ce n’est que suite à l’observation d’une activité transcriptase inverse dans le surnageant du milieu de culture des cellules issues des biopsies des ganglions des patients présentant ce syndrome, et couplée à une analyse en microscopie électronique que l’identification du rétrovirus a été réalisée en 1983
[1]. Cette découverte a valu le prix Nobel de physiologie ou médecine 2008 aux Drs Luc Montagnier et Françoise Barré-Sinoussi.
1.2. Épidémiologie du VIH-1
Selon l’Organisation mondiale de la santé (OMS), près de 78 millions de personnes dans le monde sont infectées au VIH-1 et près de 39 millions de personnes en sont décédées depuis le début de l’épidémie jusqu’à 2014. La prévalence de l’infection au VIH-1 était d’environ 36,9 millions de personnes en 2014 [2]. Au Canada, selon l’Agence de la santé publique, la prévalence des infections au VIH-1 était de 75 500 personnes à la fin de 2014 [3].
1.3. Structure du VIH-1
Le VIH-1 fait partie de la famille des Retroviridae, de la sous-famille de Lentivirinae et du genre de Lentivirus [4]. Le VIH-1 est un rétrovirus enveloppé et encapsidé mesurant entre 100 et 120 nm de diamètre. La capside virale contient un génome composé de deux copies d’ARN monocaténaires comprenant trois gènes principaux gag, pol et env, deux gènes essentiels tat et rev et quatre gènes accessoires nef, vpr, vif et vpu. Le gène gag (group
2
specific antigen) code pour des protéines Gag qui forment une structure de base pour la capside [5]. Le gène pol code pour la transcriptase inverse qui rétrotranscrit l'ARN viral en ADN viral [6]. Le gène Env code pour les glycoprotéines gp120 et gp41 de l’enveloppe virale [7].
On retrouve également dans la capside virale des protéines comme l'intégrase p32 qui intègre l'ADN viral dans le génome cellulaire [8] et la protéase p12 qui permet l'assemblage et la formation des capsides du virus en clivant les précurseurs protéiques Gag [9].
L’enveloppe virale provient du bourgeonnement de la membrane plasmique de la cellule cible lors de la multiplication virale. Cette enveloppe comprend en plus des protéines de l’hôte [10] les glycoprotéines gp120 et gp41 qui jouent un rôle central dans l’attachement et la pénétration du virus dans la cellule cible. La gp120 se lie avec une grande affinité au récepteur CD4 ce qui change la conformation de la gp120 et permet la liaison aux récepteurs de chimiokines comme le CCR5 et le CXCR4 d’avoir lieu [11, 12]. Cette liaison expose alors la gp41 permettant la fusion entre la membrane plasmique de la cellule cible et la capside virale permettant ainsi la pénétration de cette dernière dans la cellule [13]. Après la décapsidation, l’ARN viral sera rétro-transcrit par la transcriptase inverse formant un ADN double brin qui se transloque vers le noyau grâce à la présence de la protéine virale Vpr et des pores nucléaires [14, 15]. Une fois que l’ADN viral se retrouve dans le noyau, il sera intégré dans l’ADN de l’hôte grâce à la présence d’intégrase et fera partie du génome de la cellule, d’où la très grande difficulté d’éliminer ce virus [16].
1.4. Les phases d’infection au VIH-1
L’infection au VIH-1 passe par trois phases, la primo-infection, la phase chronique et la phase SIDA. Bien que les signes cliniques de cette infection peuvent être discrets lors de la primo-infection, dès les premières semaines, il y a une perte de la majorité des lymphocytes T (LT) CD4 mémoires dans le tractus gastro-intestinal [17]. C’est en fait la prise de contrôle du système immunitaire par le virus, car cette perte est irréversible. La réponse immunitaire et les traitements antirétroviraux ne peuvent éradiquer le VIH-1, et ce, en raison de la présence de cellules réservoirs pour le VIH-1 comme les cellules dendritiques, les macrophages et les LT CD4 permettant ainsi la persistance de l’infection [18-20]. Par la
3
suite, lors de la phase chronique ou de latence, l’activation de la réponse immunitaire engendre la diminution de la charge virale grâce à l’intervention des LT CD8 qui permettent la lyse des cellules infectées. De plus, le virus peut également être contrôlé grâce à la production d’anticorps contre les protéines virales [21]. Cependant, en absence de traitement, l’activation accrue du système immunitaire engendre un épuisement de celui-ci et le patient entre dans la phase SIDA qui se caractérise par un déficelui-cit immunitaire et a comme conséquence l’apparition d’infections opportunistes.
1.4.1. Phase de primo-infection
L’entrée du virus dans l’organisme se produit via sa capture par les cellules dendritiques des muqueuses. Deux voies sont utilisées par le VIH-1 pour infecter les cellules dendritiques soit : via la fusion de la gp120 du VIH-1 avec le CD4 et le CCR-5 des cellules dendritiques [22]; ou bien via l’interaction entre les sucres de la gp120 avec les récepteurs de lectine tels que le récepteur au mannose, le DCIR (Dendritic Cell Immunoreceptor), le CD206, le DC SIGN (Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integrin) et la langerine [12, 23-25].
Grâce à ces nombreux récepteurs, les cellules dendritiques peuvent capturer le VIH-1 et l’internaliser dans leurs compartiments intracellulaires. Les cellules migrent ensuite vers les organes lymphoïdes secondaires afin de présenter les antigènes viraux aux LT CD4 et aux LT CD8 et activer la réponse immunitaire cellulaire [26] tout en transmettant les virus au LT CD4 [27].
1.4.2. Phase chronique
Les patients peuvent ne présenter aucun symptôme évident d’infection même si le virus continue à se répliquer. Cependant, la progression de cette phase varie largement d’une personne à l’autre. Cela dépend en partie du traitement. En effet, les personnes non traitées peuvent passer de la phase asymptomatique à la phase symptomatique qui comprend une fatigue chronique, perte de poids inexplicable, diarrhée, fièvre, sueur nocturne et problème de peau [28]. Durant cette phase, des évènements différents peuvent se dérouler et
4
contribuent grandement à la pathogenèse de l’infection au VIH-1. Notamment la latence virale, l’activation accrue du système immunitaire et la poursuite de la déplétion des LT CD4.
Le virus devient latent grâce à l’intégration de son génome dans celui de l’hôte, en particulier chez les LT CD4 mémoires [29]. En effet, ces cellules constituent un réservoir du virus permettant ainsi l’échappement de ce dernier à la reconnaissance par le système immunitaire et son élimination par les traitements antirétroviraux [30].
Durant cette phase, on assiste également à une activation accrue du système immunitaire. Cela se manifeste notamment par une augmentation du taux de cytokines pro-inflammatoires comme le TNF-α qui peut induire l’apoptose des LT CD4 via l’activation des récepteurs de mort cellulaire Fas et TRAIL [31, 32]. Une autre cause favorisant la dérégulation du système immunitaire est la translocation microbienne. Ceci commence par la perte de jonction serrée dans les muqueuses intestinales et une levée de protection de cette dernière par les LT CD4 déplétés vis-à-vis de la flore commensale. Ce qui permet la translocation microbienne de l’intestin vers la circulation sanguine. Ceci se manifeste par la présence d’un fort taux de lipopolysaccharides dans les plasmas des patients infectés au VIH-1 [33].
Depuis le début de la primo-infection et durant la phase chronique, on note une déplétion continue des LT CD4. En effet, les LT CD4 naïfs expriment des taux élevés en récepteurs de mort cellulaires Fas et des pores Bax proapoptotiques. Ce qui accélère l’immunopathogenèse de l’infection au VIH-1 [17, 32, 34, 35].
1.4.3. Phase du SIDA
Elle survient quand le système immunitaire est altéré. Le patient devient alors sensible à de nombreux pathogènes y compris ceux qui causent des infections bénignes. Cette phase est déclarée quand le compte des LT CD4 passe sous le seuil des 200 cellules/mm3 dans le
sang [36]. Ce déficit immunitaire engendre l’apparition d’infections aux pathogènes opportunistes comme le champignon Pneumocystis responsable de la pneumocystose, les bactéries Mycobacterium avium associées au syndrome de Lady Windermere, les
5
protozoaires Toxoplasmosis gondii qui causent la toxoplasmose et les cytomégalovirus [37]. Certains types de cancer, tels que le lymphome, sont également plus courants chez les personnes infectées au VIH-1 [38].
Le déficit immunitaire est le résultat de la déplétion des LT CD4 et un épuisement du système immunitaire. Ces deux processus sont irréversibles parce que les LT CD4 perdent leurs capacités de prolifération [39].
2. Les cellules participant à l’immunopathogenèse de l’infection au VIH-1
Les cellules dendritiques représentent une porte d’entrée pour le VIH-1 puisque ces cellules sont présentes dans la muqueuse intestinale [23]. Ces cellules migrent vers les organes lymphoïdes secondaires et favorisent la propagation du VIH-1 vers les cellules cibles comme les LT CD4 [40].
Les LT CD4 vont à leur tour favoriser la transmission des virus vers les LT CD4 avoisinants étant donné que ces cellules représentent un lieu de réplication et de production du VIH-1. Quant aux LT CD8, ils permettent la lyse des LT CD4 infectés, ce qui accélère la mort des LT CD4 mémoires en faveur du déficit immunitaire [39, 41].
2.1. Les cellules dendritiques
Les cellules dendritiques sont des cellules présentatrices d’antigène qui jouent un rôle clé dans l’élaboration de la réponse innée et acquise. Ces cellules présentent des prolongements cytoplasmiques appelés dendrites d’où le nom de cellule dendritique. Ils existent deux types de ces cellules dendritiques, les PDC (Plasmacytoid dendritic cells) d’origine lymphoïde qui circulent dans le sang et les MDC (Myeloid dendritic cells) d’origine myéloïde présentes dans les muqueuses [42, 43].
Les cellules dendritiques PDC reconnaissent les antigènes viraux et déclenchent la sécrétion de cytokines comme l’INF γ et l’IFN β qui inhibent la réplication du virus. Ces cellules peuvent également sécréter le TNFα qui stimule l’activité cytotoxique des LT CD8 et des cellules NK [44].
6
Les cellules dendritiques MDC jouent un rôle central dans l’activation de la réponse immunitaire adaptative. En effet, au niveau des tissus, ces cellules en état immature ont une grande capacité d’endocytose et de phagocytose des antigènes exogènes. Par contre elles expriment un faible niveau de molécules du complexe majeur d’histocompatibilité (CMH) les CMH-I et CMH-II responsables de la présentation antigénique [45]. À la suite de l’internalisation des pathogènes, un processus de maturation de ces cellules et de domiciliation vers les ganglions se met en place. Elles deviennent matures et expriment plus de CMH-I et CMH-II. Les microvésicules libérées peuvent contenir aussi des molécules de CMH-I et CMH-II et peuvent fusionner avec la membrane plasmique augmentant ainsi le niveau de ces molécules [46]. De plus, ces cellules expriment des récepteurs aux chimiokines comme le CCR7 (C-C chemokine receptor type 7) permettant ainsi la migration des cellules dendritiques vers les organes lymphoïdes secondaires et l’activation des LT via la présentation antigénique. En effet, les cellules dendritiques sécrètent des cytokines comme l’IL-12 qui favorise la polarisation des LT en cellules Th1. Ces dernières activent les LT CD8 qui lysent les cellules infectées [47].
Le virus infecte les cellules dendritiques et modifie ainsi l’évolution d’une réponse immunitaire efficace telle que décrite ci-dessus. Le virus peut infecter la cellule dendritique en cis c’est-à-dire suite à la fusion de la gp120 du VIH-1 avec le CD4 et le CCR-5 qui permettent l’entrée du VIH-1 dans la cellule dendritique [22, 48]. La deuxième voie d’infection est la trans-infection qui implique des récepteurs des cellules dendritiques comme les récepteurs mannose, le DCIR, le CD206, DC SIGN et les langerines qui permettent l’attachement et l’entrée du VIH-1 dans les cellules dendritiques [12, 23]. Les récepteurs lectines de type C ne permettent pas seulement l’attachement du VIH-1, mais aussi la formation de synapse immunologique entre les cellules dendritiques et les LT CD4 comme c’est le cas des récepteurs DC-SIGN [49]. Ce dernier est stimulé par la protéine virale Nef pour favoriser l’interaction des cellules dendritiques avec les LT et l’infection en trans des cellules dendritiques [12, 50]. Ce qui permet la transmission du VIH-1 des cellules dendritiques vers les LT CD4.
Une autre voie favorise cette interaction cellulaire, c’est la protéine Nef qui déclenche la production des chimiokines par les cellules dendritiques permettant ainsi l’attraction des LT
7
vers les cellules dendritiques infectées et favoriser la transmission du virus [51]. Les cellules dendritiques mises en contact avec la gp120 peuvent produire des cytokines comme l’IL-10 qui régule négativement la réponse immunitaire Th1 antivirale favorisant ainsi la persistance de l’infection [52]; sachant que les cellules Th1 stimulent l’activité cytotoxique des LT CD8. C’est-à-dire la production des perforines et des granzymes qui provoquent la nécrose des cellules infectées [53-55].
2.2. Les lymphocytes T CD4
Suite à l’entrée du VIH-1 dans l’organisme via les cellules dendritiques, le virus cible principalement les LT CD4 en raison de la présence du récepteur CD4 fortement exprimé sur les LT CD4. En effet, l’infection de ces derniers par le VIH-1 débute par l’attachement de la gp120 de l’enveloppe du VIH-1 au récepteur CD4. Cet attachement est également facilité par la présence de corécepteurs de chimiokines comme le CCR5 ou le CXCR4 de la cellule cible [56]. Ce qui permet l’entrée du virus et l’infection.
Après l’infection des LT CD4 au VIH-1, ces cellules pourront constituer un réservoir de VIH-1 favorisant ainsi la persistance de ce virus [57]. En effet, une étude par RT PCR réalisée sur les LT CD4 des ganglions périphériques révèle une forte expression de protéines du VIH-1 comme Gag. De plus, le pourcentage des LT CD4 dans le ganglion est corrélé avec le taux de virémie mesuré par le dosage de p24 [58]. Ce qui indique aussi que les LT CD4 constituent un lieu de production du VIH-1.
L’infection ciblée des LT CD4 ne dépend pas uniquement de l’interaction de CD4 avec la gp120, mais aussi du profil d’expression protéique des LT CD4 et de leur état de différenciation. En effet, des études ex vivo sur les LT CD4 issus des patients VIH-1+
montraient que la population des LT CD4 enrichies en sous-populations Th1 et Th17 était plus susceptibles aux infections au VIH-1 [59]. De plus, une analyse transcriptomique sur les LT CD4 infectés à différents pathogènes révèle que l’expression des gènes influence la susceptibilité des LT CD4 à être infectés par le VIH-1 [60]. Parmi ces gènes, on peut citer les IFI (Interferon Induced protein), les cytokines pro-inflammatoires IL17-A et IL-17-F et également les TRIM 5 et 22 (tripartite motif family) impliquées dans la reconnaissance de l’antigène [60]. Ces facteurs sont capables d’influencer l’infectivité des LT CD4.
8
D’autres facteurs pouvant influencer l’infectivité et les fonctions des LT CD4 comme les récepteurs CTLA-4 et le CD28. Le CTLA-4 est un récepteur qui favorise l’apoptose et le CD28 est un récepteur qui stimule la prolifération cellulaire [61]. Les CTLA-4 sont retrouvés surexprimés dans les LT CD4 infectés au VIH-1, en revanche, le CD28 stimulé favorise la prolifération des LT CD4 spécifiques au VIH-1 [62].
Ces données expliquent le profil d’expression des LT CD4 détermine la susceptibilité de ces cellules à la résistance ou à l’infection au VIH-1.
2.3. Les lymphocytes T CD8
Les LT CD8 effecteurs et mémoires sont capables de reconnaitre l’antigène viral présenté par les CMH-I des LT CD4 infectés au VIH-1, ce qui déclenche la libération de perforine qui perfore la membrane plasmique de la cellule infectée et la libération aussi de granzyme qui permet la dégradation des protéines et la lyse de la cellule infectée [63]. Ce processus est également régulé par l’interaction du récepteur de mort cellulaire Fas de LT CD8 avec le Fas-Ligand de LT CD4.
L’une des approches dans la vaccination contre le VIH-1 est l’activation des LT CD8. En effet, un co-traitement des macaques avec l’anti-IBB-1-4 et l’antigène Gag du virus de SIV (Simian Immunodeficiency Virus) permet la stimulation des fonctions des LT CD8 dans la production des granzymes, de perforine et de l’IFN-γ [64].
Les LT CD8 sont capables de libérer des cytokines comme le TNF-α (Tumor Necrosis Factor) qui active la nécrose des LT CD4 infectés et participe à la déplétion de celles-ci [65]. En effet, les récepteurs de TNF-α comme TRAIL, jouent un rôle prépondérant dans la mort des LT CD4 [31].
2.4. Déplétion des LT CD4
Dès la primo-infection, il y a une déplétion massive des LT CD4 dans le tissu lymphoïde associé au tractus intestinal [17]. On observe également une diminution du ratio des LT CD4/LT CD8 dans le sang périphérique des patients infectés [66] car les LT CD8
9
prolifèrent et deviennent inefficaces pour éliminer les LT CD4 infectés. Le phenotype des LT CD8 devient alors épuisé [67].
Plusieurs facteurs sont impliqués dans la déplétion des LT CD4. En effet, les protéines virales sont évidemment incriminées dans la mort des LT CD4. En effet, la protéine Nef est capable d’activer la déplétion des LT CD4 et d’augmenter la sensibilité des LT CD4 avoisinants à l’apoptose sur les tissus lymphoïdes cultivés ex vivo [68].
Cependant, l’infection des LT CD4 au VIH-1 n’est pas suffisante pour expliquer la déplétion massive de ces cellules. En effet, une observation sur les sections de nodule lymphoïde montre que la majorité des LT CD4 en apoptose ne sont pas infectés au VIH-1, mais se trouve à proximité des LT CD4 infectés [69]. Cette mort cellulaire pourrait être déclenchée en partie par l’interaction de glycoprotéine virale Env avec le CD4 et les corécepteurs CCR5 et CXCR4 des LT CD4 non infectés [70].
Un autre mécanisme de déplétion des LT CD4 indépendant de la présence de l’infection au VIH-1 est l’intervention de TGF-β1 dans l’induction de la production de collagène et son dépôt sur le tissu lymphoïde observé chez les patients infectés au VIH-1. Cette déposition isole les LT des facteurs de croissance comme l’IL-7, ce qui favorise l’apoptose et contribue ainsi à leur déplétion [71].
Les récepteurs de mort cellulaire comme Fas, Fas-L et TRAIL-DR5 sont également associés à la déplétion des LT CD4 par apoptose chez les patients infectés au VIH-1 [72].
3. Apoptose
La déplétion des LT CD4 par apoptose favorise la persistance du VIH-1 et l’apparition d’infections opportunistes qui caractérisent la phase du SIDA [73, 74].
L’apoptose est une mort cellulaire programmée de façon intrinsèque contrairement à la nécrose qui se produit grâce à la présence de signaux extracellulaires comme une infection. L’apoptose se manifeste par une condensation du cytoplasme, une fragmentation de la
10
chromatine suivie de la désagrégation de la cellule en corps apoptotiques qui seront phagocytés par les macrophages [75].
Ils existent deux voies d’apoptose, la voie extrinsèque et la voie intrinsèque. La voie extrinsèque est régulée par les récepteurs membranaires Fas et TRAIL (tumor-necrosis-factor related apoptosis inducing ligand) qui permettent le recrutement des caspases (cysteine-dependent aspartate-cleaving proteases) [75]. La protéine Fas comporte un domaine de mort capable de recruter FADD (Fas Associating protein with Death Domain) permettant ainsi l’activation des pro-caspases 8 et la fragmentation de l’ADN [76].
La voie intrinsèque d’apoptose peut être induite par les radicaux libres qui engendrent des cassures d’ADN et l’activation de la protéine p53 [77], ce qui ramène au déclenchement de la voie intrinsèque d’apoptose [78]. Les protéines mitochondriales jouent un rôle central dans la voie intrinsèque d’apoptose. En effet, la protéine p53 active les protéines mitochondriales Bcl-2 pro-apoptotiques et induit l’agrégation et l’activation des pores mitochondriaux Bax. Ceci permet le relargage des protéines mitochondriales CytC (Cytochrome C) et Smac/Diablo [79]. Ces derniers vont former avec la pro-caspase 9 et la protéine adaptatrice Apaf-1 un complexe cytosolique appelé apoptosome.
Les deux voies mènent à l’activation de la pro-caspase 3, la fragmentation de l’ADN et la mort de la cellule [80].
3.1. Apoptose des LT CD4
L’immunopathogenèse se développe avec une déplétion continue des LT CD4 notamment par apoptose. Plusieurs facteurs peuvent réguler ce processus : les protéines du VIH-1 et les LT CD8 [73, 81]. En effet, les protéines Nef et Tat du VIH-1 interagissent avec les caspases 8 pour activer l’apoptose des LT CD4 [82]. La gp120 de l’enveloppe virale interagit avec CXCR4 pour activer la protéine Fas et la voie extrinsèque de l’apoptose [83] (voir tableau 1). Une autre protéine virale Vpr active le récepteur de mort cellulaire Fas-L pour induire les caspases 8 [84].
11
Les protéines virales peuvent interagir avec les protéines mitochondriales permettant ainsi l’induction de l’apoptose des LT CD4. En effet, les protéines Vpr et Tat peuvent inhiber les Bcl2 anti-apoptotiques favorisant ainsi la levée de l’inhibition d’apoptose des LT CD4 [81] (voir tableau 1). De plus, la transfection des cellules Jurkat avec les pores Bax de la membrane mitochondriale provoque sélectivement l’apoptose des cellules Tat positives en comparaison avec les LT CD4 Tat négatives[85].
Quant aux LT CD8, ils sont impliqués dans la mort par apoptose des LT CD4 via l’interaction de Fas-L de LT CD8 avec le récepteur Fas de LT CD4 et aussi via le TNFα qui active la voie extrinsèque d’apoptose des LT CD4 [73].
Par ailleurs, le récepteur de mort cellulaire TRAIL est surexprimé dans le tissu lymphoïde humain infecté ex vivo par le VIH-1. Ce qui impliquerait ce récepteur dans l’accélération de la déplétion des LT CD4 [86]. Les molécules TRAIL présentes sur les microvésicules pourraient ainsi contribuer à la déplétion des LT CD4 [87].
Enfin, grâce à la présence de protéines virales comme Nef et des protéines mitochondriales comme la death associated protein 3 (Dap-3), les exosomes peuvent favoriser la déplétion des LT CD4 [88, 89].
Protéine du VIH-1 Protéine cible Réponse physiologique Nef et Tat Caspase 8 Fragmentation de l'ADN [82] gp120 CXCR4 Activation de la protéine Fas [83]
Vpr Fas-L Activation des caspases 8
[84]
Vpr et Tat Bcl2 anti-apoptotique Levé d'inhibition de l'apoptose [81]
Tat Pores Bax
Relargage du CytC et Apaf-1 et formation d'apoptosome
[81]
Tableau 1 : Les protéines du VIH-1 participant à la régulation de l’apoptose des LT CD4.
12
4. Les vésicules extracellulaires
4.1. Découverte des exosomes
Les exosomes furent nommés pour la première fois en 1981 pour décrire les microvésicules issues des cellules néoplasiques contenant l’enzyme 5' nucléotidase impliquée dans la réplication d’ADN [90]. Quelques années plus tard en 1985, les chercheurs ont observé au microscope électronique, la fusion entre les endosomes comportant les corps multivésiculaires avec la membrane plasmique au niveau des réticulocytes et ces vésicules contiennent le récepteur de transferrine responsable du transfert du fe3+ [91]. Cette étude a
montré que les exosomes sont d’origines endosomales et que les endosomes ne fusionnent pas toujours avec les lysosomes. Ces vésicules ont été obtenues par ultracentrifugation à partir du surnageant de culture des réticulocytes.
Par la suite, les chercheurs se sont intéressés à caractériser les fonctions des vésicules extracellulaires et ils ont montré que ces dernières étaient impliquées dans plusieurs processus biologiques majeurs comme la présentation antigénique pour l’activation du système immunitaire, le cancer et la pathogenèse des infections.
En 1996, une étude a mis en évidence la présence du CMH-II sur les vésicules extracellulaires issues des LB et des cellules dendritiques [92, 93]. C’est là où les vésicules extracellulaires ont requis toute l’attention pour les étudier dans le contexte des infections et du cancer. Et ce, en raison de la capacité de ces vésicules extracellulaires à présenter les antigènes exogènes et les antigènes tumoraux pour l’activation de la réponse immunitaire. Les vésicules extracellulaires peuvent également contenir des intégrines comme LFA-1
(Lymphocyte function-associated antigen 1) et des molécules de co-stimulation comme le CD28 régulant la survie et l’activité des cellules immunitaires [94, 95].
Par la suite, les chercheurs étudiaient la participation des vésicules extracellulaires dans le maintien de l’environnement tumoral grâce à leurs capacités à contenir des récepteurs régulant la prolifération cellulaire comme la présence des récepteurs EGFR (epidermal growth factor receptor) sur les microvésicules issues des cellules tumorales [96].
Plus récemment, des études ont montré l’implication des vésicules extracellulaires dans la pathogenèse de l’infection au VIH-1. Suite à l’observation de la présence de protéines du
13
VIH-1 comme Nef sur les vésicules extracellulaires issues des LT CD4 infectés aux VIH-1 [88].
4.2. Types de vésicules extracellulaires
Ils existent plusieurs types de vésicules extracellulaires qui diffèrent dans la taille, l’origine de la biogenèse et les fonctions. On peut retrouver au sein des fluides biologiques comme le plasma la présence de plusieurs types de vésicules extracellulaires comme les exosomes, les microvésicules et les vésicules apoptotiques [97].
4.2.1. Les microvésicules
Ce sont les plus grandes vésicules extracellulaires, leurs tailles sont comprises entre 100 et 1000 nm [98]. Les microvésicules peuvent provenir de différents types cellulaires comme les cellules endothéliales, les plaquettes sanguines, les cellules immunitaires comme les LT CD4 et les macrophageset les cellules tumorales [99]. Étant donné que les microvésicules proviennent du bourgeonnement de la membrane plasmique, leur composition varie en fonction de la composition de la membrane plasmique de la cellule productrice [100]. Les microvésicules participent dans la communication intercellulaire. En effet, les microvésicules issues des LT CD4 peuvent contenir des TCR (T Cell Receptor) participant ainsi à la formation de la synapse immunologique et l’interaction entre les LT CD4 et les cellules présentatrices d’antigènes comme les LB [101]. Une autre étude a montré qu’une co-culture des cellules cancéreuses de prostate avec les cellules de moelle osseuse rend ces dernières capables d’exprimer des gènes actifs spécifiquement dans la prostate, et ce, grâce à la présence des microvésicules libérées par les cellules tumorales de la prostate [102]. Les microvésicules issues des cellules tumorales peuvent également contenir une protéine membranaire CSE1L (chromosome segregation 1–like protein) impliquée dans le processus métastatique par l’activation des protéines Ras [103].
Les microvésicules peuvent également réguler la survie des cellules. En effet, une étude a rapporté que les microvésicules issues des monocytes stimulés avec l’endotoxine peuvent activer l’apoptose des cellules VSMC (vascular smooth muscle cells) et que ces
14
microvésicules contiennent les caspases 1, ce qui suggère le possible rôle de ces microvésicules dans l’induction de l’apoptose [104].
4.2.2. Les vésicules apoptotiques
Appelées également corps apoptotiques, leurs tailles sont comprises entre 50 et 500 nm [105]. Elles proviennent de la fragmentation des cellules en apoptose. Ces vésicules peuvent contenir les résidus de cellules mortes par apoptose, c’est-à-dire le cytoplasme, les organites et de l’ADN fragmentée [106].
Des études ont montré l’influence des vésicules apoptotiques dans le processus de migration et de différenciation cellulaire. En effet, les vésicules apoptotiques issues des cellules endothéliales sont capables d’induire la production de MCP-1 (Monocyte chemotactic protein 1) et l’IL8 [107]. Ce qui confère aux vésicules apoptotiques des fonctions de régulation de la migration des cellules. De plus, ces vésicules apoptotiques peuvent également activer la différenciation des cellules progénitrices des cellules endothéliales [108].
4.2.3. Les exosomes
Les exosomes ont une taille comprise entre 50 nm et 100 nm [105]. Ils peuvent provenir de différents types cellulaires comme les LB, les LT, les adipocytes, les astrocytes et les cellules tumorales [109-111]. Les exosomes proviennent du bourgeonnement de la membrane endosomale vers l’intérieur de l’endosome formant des vésicules intraluminales appelées également corps multivésiculaires [112]. L’endosome va soit fusionner avec le lysosome formant l’endolysosome [113] ou bien fusionner avec la membrane plasmique libérant ainsi des vésicules qu’on appelle exosomes [114].
Les complexes ESCRT-I, II et III (The endosomal sorting complexes required for transport) permettent la biogenèse des exosomes, le recrutement et la séquestration des protéines ubiquitinylées dans les exosomes [115]. Il est de plus en plus établi que le Tsg-101 représente un des marqueurs des exosomes qui participe au tri des protéines. Le Tsg-101 est
15
également impliqué dans le bourgeonnement du VIH-1 vers l’extérieur de la cellule infectée [116, 117].
Les exosomes possèdent aussi comme marqueurs :
-Alix (ou ESCRT-II) impliquée dans la séquestration des protéines dans les corps multivésiculaires [118].
-CMH-I et CMH-II responsables de la présentation antigénique retrouvés sur les exosomes issus des LB et des cellules dendritiques [119].
-Lamp-2 (Lysosomal-associated membrane protein) impliquée dans la protection et l’adhésion des lysosomes [120].
-ICAM-1 (Intercellular Adhesion Molecule 1), une molécule de costimulation participant à l’activation des LT [121].
-AChE-E (Acétylcholinestérase-E) possédant une ancre glycosyl phosphate inositol (GPI) qui permet l’ancrage de cette enzyme dans la membrane des vésicules [122, 123].
Dans notre laboratoire, grâce à la méthode du gradient de vélocité, nous avons pu séparer les exosomes AChE+ des particules du VIH-1 présent dans le culot 100 000 xg des cultures
des cellules dendritiques mises en contact avec le VIH-1 [124].
4.2.3.1. Fonctions des exosomes
La composition des exosomes varie en fonction de la cellule productrice et reflète son état d’activation. Ce qui lui confère une large possibilité de communication intercellulaire. En effet, les exosomes peuvent avoir des fonctions dans la réponse immunitaire et dans la pathogenèse des infections au VIH-1.
Les exosomes sont responsables du transport et du recyclage des protéines grâce à l’intervention de ses composantes en protéine comme Alix et VPS (Vacuolar protein sorting) qui permettent le chargement des exosomes en protéine [125, 126].
Dans l’étude du processus de neurotransmission, les chercheurs ont observé par microscopie à fluorescence que les exosomes issus des cellules gliales peuvent être
16
internalisés dans les neurones et protéger ces derniers du stress oxydatif [127]. De plus, ces exosomes issus des cellules gliales peuvent contenir des protéines PLP (major myelin proteolipid protein) et une enzyme CNP (2',3'-cyclique-nucléotide 3'-phosphodiestérase) essentielles pour la production de myéline [128].
Des exosomes retrouvés dans la vésicule biliaire participent à la prolifération des cholangiocytes, des cellules épithéliales des voies biliaires [129]. Les exosomes sont également présents dans le liquide cérébro-spinal et sont associés à la séquestration des protéines amyloïdes β. Cette fonction est protectrice contre l’accumulation des amyloïdes β [130].
Dans le contexte de la régulation de la réponse tumorale, les exosomes issus des cellules tumorales peuvent contenir des antigènes tumoraux qui seront reconnus par les cellules dendritiques. Ce qui permet de déclencher une réponse immunitaire antitumorale [131] Les exosomes peuvent également participer à la coagulation sanguine et l’angiogenèse [132, 133]. De plus, des études ont montré que les plaquettes sanguines peuvent libérer des vésicules extracellulaires et que le nombre de celles-ci varie en fonction de l’état d’activation des plaquettes [134].
4.3. Les rôles pléiotropiques des vésicules extracellulaires dans la réponse immunitaire
Les exosomes participent à la régulation de la réponse immunitaire favorisant la présentation antigénique, la sécrétion des cytokines et l’immunosuppression.
Les exosomes issus des cellules présentatrices d’antigène comme les cellules dendritiques et les LB peuvent contenir des molécules du CMH-II lui conférant ainsi un rôle dans la présentation antigénique [135] [136]. Ces mêmes exosomes favorisent la prolifération des LT CD4 et l’activation des LB [135].
Une autre étude a montré que le traitement des LT CD4 avec des exosomes et de l’IL2 augmente la sécrétion de MIF (Macrophage migration Inhibitory Factor, l’IL-16 et GM-CSF (Granulocyte-Macrophage Colony Stimulating Factor) en comparaison avec les conditions de traitement avec l’IL2 seul [137]. Ce qui montre un rôle des exosomes dans la potentialisation de la réponse à l’IL2.
17
Les exosomes contribuent également à réguler la formation des vaisseaux sanguins (l’angiogenèse), en effet ces vésicules modulent la sécrétion de l’IL8 et la migration des cellules endothéliales [138]. Les exosomes issus des cellules dendritiques infectées au Malassezia sympodialis activent la production de TNFα et l’IL4, et ce grâce à la capacité de ces vésicules à contenir des antigènes de M. sympodialis [139].
Les chercheurs ont également mis en évidence le rôle des exosomes dans la réponse immunitaire antivirale, en effet, ils peuvent contenir de l’UTPase du virus d’Epstein Barr qui sera reconnu par le système immunitaire et permet la sécrétion de cytokines telle que l’IL-10, IL-12p70, IL-1ß, IL-8 et TNF-α [140].
Enfin, les exosomes peuvent également participer à l’immunosuppression et la pathogenèse du cancer. En effet, les exosomes issus des cellules tumorales du sein peuvent inhiber la sécrétion de CSF-1 et de l’IL8 empêchant ainsi le recrutement et la polarisation des macrophages en TAM (Tumor Associated Macrophage) qui régulent négativement le système immunitaire, ce qui favorise le développement tumoral [141]. Une autre étude a montré que les exosomes issus des cellules tumorales sont capables d’inhiber la maturation des cellules dendritiques et activer la production de TGFβ1 dans la lymphe chez les souris [142]. Les lymphocytes T régulateurs peuvent libérer plus d’exosomes en comparaison avec les autres lymphocytes T observés par une analyse quantitative par ELISA de CD63, un des marqueurs d’exosomes [143]. De plus, ces mêmes exosomes sont capables de réguler négativement la prolifération des cellules Th1 et la sécrétion d’IFNγ [143].
4.4. Pathogenèse de l’infection au VIH-1
Les vésicules extracellulaires peuvent jouer plusieurs rôles dans l’immunopathogenèse de l’infection au VIH-1. En effet, les exosomes issus des LT CD4 infectés au VIH-1 peuvent contenir la protéine virale Nef et les exosomes Nef+ qui sont capables d’augmenter
l’apoptose des LT CD4 [88].
Les exosomes peuvent également favoriser la production virale. En effet, les exosomes issus des LT CD4 infectés au VIH-1 augmentent la réplication du virus sur les LT CD4 naïfs. Une fonction associée à la présence de la protéine ADAM17 (metallopeptidase
18
domain 17) dans ces exosomes. Cette enzyme convertit le pré TNF-α en sa forme mature [144]. Le TNF-α peut à son tour induire l’apoptose des LT CD4 via l’activation des récepteurs de mort cellulaire Fas et TRAIL [31].
L’influence que peuvent avoir les vésicules extracellulaires sur l’immunopathogenèse de l’infection au VIH-1 rend ces vésicules capables de révéler l’état d’activation des LT CD4 et sa plasticité [145].
Très récemment, notre équipe s’est intéressée à étudier les vésicules extracellulaires issues des plasmas des patients infectés aux VIH-1 et ils ont observé que l’abondance des
exosomes et la taille des vésicules sont inversement corrélées avec le ratio de LT CD4/LT CD8 un marqueur de l’évolution de la pathogenèse de l’infection au VIH-1
[146]. De plus, la présence de la protéine pro-apoptotiques Dap-3 a aussi été observée dans les vésicules des plasmas des patients VIH-1+. Ce qui suggère que les exosomes et leurs
contenus pourraient être des biomarqueurs de l’immunopathogenèse de l’infection au VIH-1 [147].
Toutefois, la distinction entre la composition des vésicules extracellulaires et celle des virus est limitée par les méthodes de purification et les appareils de détection.
4.5. Limitation des méthodes classiques
Il était délicat, voire impossible, d’étudier les exosomes et les vésicules extracellulaires séparément dans le contexte de l’infection au VIH-1 en raison de la taille du VIH-1 qui est similaire à celle des exosomes. En effet, l’ultracentrifugation sur gradient de densité ne permettait pas de séparer les exosomes du VIH-1 en raison des tailles similaires de ces deux populations (100 nm). Dans notre laboratoire, nous avons élaboré la technique d’ultracentrifugation sur gradient de vélocité et l’immunocapture des exosomes avec l’anti-AChE-E pour séparer les exosomes du VIH-1 [124]. Ces deux méthodes nous ont permis de montrer que les exosomes et le VIH-1 sont deux populations bien distinctes et que le VIH-1 ne peut pas être contenu dans les exosomes. La fraction des exosomes se détectait par la mesure de l’activité AChE qui représente un marqueur d’exosomes. Ces méthodes nous ont permis d’observer le rôle des exosomes dans la pathogenèse de l’infection au
19
VIH-1 et détecter par protéomique la présence de molécules pro-apoptotiques comme Dap-3 [89].
Bien que les exosomes puissent désormais être isolés et détectés par ces méthodes, les autres types de vésicules comme les microvésicules et les vésicules apoptotiques ne sont pas encore très bien caractérisés dans ce gradient. Et ce, en raison de l’absence de marqueurs spécifiques de ces deux populations de vésicules. Des méthodes de séparation et de détection des vésicules extracellulaires du plasma et des surnageants cellulaires sont en cours de développement dans notre laboratoire afin de pouvoir caractériser la structure et la fonction de chaque type vésiculaire et également de discriminer les vésicules extracellulaires des protéines agrégées ou des récepteurs solubles.
Enfin, les plasmas des patients infectés au VIH-1 peuvent contenir des résidus de mitochondries libres ou incorporés dans les microvésicules. En effet, une étude a montré une augmentation du taux d’ADN mitochondriaux au niveau des plasmas des patients infectés. Ce qui suggère que les mitochondries pourraient aussi représenter des biomarqueurs potentiels des dommages causés par l’infection au VIH-1 [148].
5. Mitochondries dans les infections au VIH-1
Les mitochondries sont des organites de taille variable entre 0,5 et 1 μm de diamètre et sa forme varie beaucoup. Elles jouent un rôle central dans le cycle respiratoire et la voie intrinsèque de l’apoptose. En effet, les protéines impliquées dans la respiration sont en partie traduites dans les mitochondries comme le CytB qui convertit l'énergie des molécules organiques issues de la digestion comme le glucose en énergie utilisable par la cellule, l'ATP [149, 150]. Également, les enzymes SDH (succinate déshydrogénase) sont impliquées dans la phosphorylation oxydative et le cycle d’acide citrique, des processus inclus dans la respiration [151].
Plusieurs protéines mitochondriales sont impliquées dans la voie intrinsèque de l’apoptose. On peut citer les pores Bax et les Bcl2 qui permettent le relargage du CytC. Cette dernière permet la formation du complexe d’apoptosome qui active les caspases et l’apoptose [152].
20
Le nombre et les fonctions des mitochondries sont affectés par la présence de l’infection au VIH-1, ceci est notamment dû à la présence d’un fort taux de TNFα [153]. De plus, les mitochondries sont associées à l’induction de l’apoptose dans les infections au VIH-1. En effet, la protéine virale Vpr peut interagir avec PTCP (Permeability Transition Pore Complex), un complexe polyprotéique de la mitochondrie. Ce qui permet une libération du CytC et l’activation des caspases et de l’apoptose [154].
Les ARNs viraux peuvent être séquestrés au niveau des mitochondries, ce qui altère les fonctions de ces derniers. En effet, l’augmentation du taux d’ARN viraux dans les mitochondries fait diminuer l’activité des enzymes mitochondriales [155]. De plus, une analyse protéomique sur les mitochondries isolées à partir des PBMCs des patients infectés au VIH-1 révèle une altération des protéines mitochondriales [156].
Des chercheurs ont procédé au comptage des mitochondries sur les PBLs (Peripheral Blood Lymphocytes) des patients infectés au VIH-1 traités aux antirétroviraux et ont observé que le nombre des mitochondries a diminué significativement [157]. Cependant, ils restent des interrogations sur l’intégrité et la localisation des mitochondries ainsi que le processus d’autophagie des mitochondries (mitophagie) en présence de l’infection au VIH-1.
Enfin, la présence de Dap-3 dans les exosomes (AChE+) issues des cellules infectées au
VIH-1 nous laisse une question de savoir si les mitochondries altérées par l’infection peuvent être recyclées par les endosomes et si d’autres types de vésicules peuvent contenir le Dap-3 ?
6. La protéine pro-apoptotique Dap-3
Nous nous intéressons dans notre projet de recherche à étudier Dap-3 pour deux raisons : la première est que les rôles physiologiques et immunopathologiques de Dap-3 ne sont pas encore bien élucidés. La deuxième raison est qu’une analyse protéomique des exosomes issus des cellules dendritiques mises en culture en présence de VIH-1 a révélé la présence de Dap-3 [89] ainsi que dans les vésicules extracellulaires des plasmas des patients VIH-1+
21 6.1. Structure de Dap-3
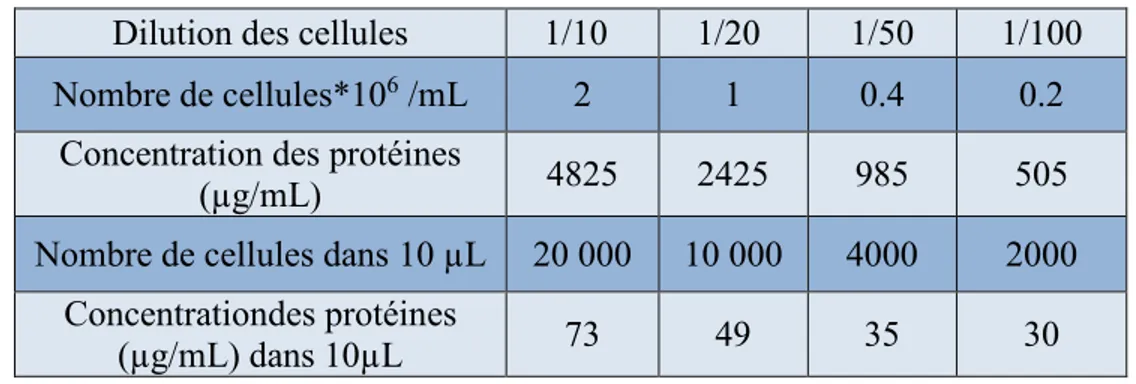
La Dap-3 est une protéine de la sous-unité 28S du mitoribosome de 397 acides aminés (46 kDa) possédant un motif de liaison au GTP dans son extrémité N-terminale 36 [158]. Appelée également 28S ribosomal protein S29, c’est l’une des rares protéines pro-apoptotiques localisées dans la matrice mitochondriale [159]. Le gène codant pour Dap-3 est localisé dans le chromosome 1q21 [160]. Dap-3 possède 4 motifs de liaison au Guanine (G1, G2, G3, G4) ainsi que cinq sites de phosphorylation représentés par un Astérix (*) sur la figure 1 (UniProtKB, identifiant: P51398-1). La séquence indiquée en rouge est la partie reconnue par l’anticorps anti-Dap-3 (BD®) utilisé dans notre étude.
Figure1 : Séquence de la protéine Dap-3. Le Dap-3 contient 4 motifs de liaison au
Guanine (G1, G2, G3, G4) ainsi que cinq sites de phosphorylation représentés par un astérix (*), la séquence protéique prise à partir de UniProtKB (Identifiant : P51398-1).
6.2. Fonctions physiologiques de Dap-3
La protéine Dap-3 est impliquée dans la traduction mitochondriale en plus de posséder une activité GTPase [161, 162].
22
Plusieurs études ont montré le rôle de Dap-3 dans l’apoptose, notamment la mise en évidence de l’implication de Dap-3 dans la voie extrinsèque apoptotique. En effet, les chercheurs ont observé que la déplétion de Dap-3 dans les cellules embryonnaires de souris et les cellules mammifères augmente la sensibilité de ces cellules vis-à-vis des récepteurs de mort cellulaire : TRAIL (TNF related apoptosis inducing ligand) et le Fas-ligand [163, 164]. Une autre étude a mis en évidence l’interaction de Dap-3 avec le récepteur de mort cellulaire FADD (Fas-Associated protein with Death Domain) et son rôle dans l’activation des pro-caspases 8 [165]. Elle intervient également dans la voie de l’induction de l’apoptose par l’IFNγ, en effet l’inactivation du gène codant pour la Dap-3 par l’ARN anti-sens réduit la anti-sensibilité des cellules HeLa vis-à-vis de l’IFN γ (voir tableau 2) [166]. Enfin, une analyse de Dap-3 par RT-PCR dans les thymocytes a montré que la Dap-3 est surexprimée dans les cellules T CD4+ CD8+. Ce qui indiquerait un possible rôle pour
Dap-3 dans la sélection négative des cellules T immatures par apoptose [167].
Rôles de Dap-3
Traduction mitochondriale [161, 162]
Augmente la sensibilité des cellules vis-à-vis de TRAIL et de Fas-ligand [163] [164]
Interaction avec FADD pour l’activation des pro-caspases 8 [165] Augmente la sensibilité des cellules vis-à-vis de l’IFN γ [166]
Tableau 2 : Les rôles de Dap-3 6.3. Rôles de Dap-3 dans les pathologies
Les fonctions de Dap-3 dans les pathologies infectieuses et le cancer ne sont pas encore bien élucidées. Néanmoins, certaines observations ont montré par RT PCR sur les tumeurs du sein, une corrélation entre la surexpression de Dap-3 et l’évolution des stades du cancer du sein [168].
Une autre étude a montré par RT PCR une surexpression statistiquement significative de Dap-3 chez les cellules cancéreuses du gliome, de plus ces cellules sont résistantes au
23
camptothecin-induced apoptosis, un inducteur d’apoptose. Ce qui suggère que Dap-3 confère aux cellules cancéreuses du gliome en migration une résistance à l’apoptose [169]. Dans notre laboratoire, nous avons déterminé la présence de Dap-3 sur les vésicules extracellulaires issues des cellules RAJI CD4 DCIR infectées au VIH-1 [170]. De plus, une analyse protéomique révèle la présence de Dap-3 sur les vésicules AChE+ issues des
cellules dendritiques mises en contact avec le VIH-1 [89]. Plus récemment, nous avons observé la présence de Dap-3 sur les vésicules extracellulaires issues des plasmas des patients infectés au VIH-1 [171].
Dans notre étude, nous nous intéressons à déterminer la présence de Dap-3 dans les vésicules extracellulaires des cellules en contact avec le VIH-1 et celles du plasma des patients, afin de montrer éventuellement le rôle de Dap-3 dans la pathogenèse de l’infection au VIH-1 ou en tant que biomarqueur.
24
Chapitre II : Problématique, hypothèse et objectifs de recherche
1. Problématique
L’interaction entre les cellules dendritiques et les LT CD4+ est nécessaire pour le
déclenchement de la réponse immunitaire contre le VIH-1. Cependant, plusieurs mécanismes de dérégulation du système immunitaire sont mis en place, notamment la déplétion massive des LT CD4+ observée dès le début de l’infection au VIH-1 [35]. Ce qui
empêche l’élaboration d’une réponse immunitaire efficace contre le virus et par conséquent son élimination, favorisant ainsi sa propagation et l’établissement des réservoirs cellulaires du VIH-1. Des études ont montré l’effet délétère sur la viabilité des LT CD4+ des exosomes
libérés par les cellules dendritiques ou les LT CD4+ lors de l’infection par le VIH-1 [88, 89,
147]. Cependant, les mécanismes par lesquels les exosomes ou autres types de vésicules extracellulaires affectent la viabilité des LT CD4+ ne sont pas encore bien élucidés. Une
autre étude au laboratoire a montré la présence de molécules pro-apoptotiques comme le Dap-3 dans les exosomes provenant des cellules dendritiques stimulées par le VIH-1 [89]. De plus, la présence de Dap-3 dans les vésicules extracellulaires issues des plasmas des patients infectés au VIH-1 suggère un rôle pour ces vésicules dans le contexte de l’infection au VIH-1 et peut-être dans l’évolution de la pathogenèse [147].
2. Hypothèse de recherche
L’hypothèse proposée pour ce projet de recherche est que le Dap-3 peut être contenu dans les exosomes et autres types de vésicules extracellulaires et participe à la pathogenèse en favorisant la déplétion des LT CD4.
25
3. Objectifs
Pour répondre à notre hypothèse, trois objectifs ont été définis :
Objectif 1 : Déterminer la présence de Dap-3 dans les différents types de vésicules
extracellulaires issues des cellules infectées au VIH-1.
Objectif 2 : Déterminer la présence de Dap-3 dans les différents types de vésicules
extracellulaires provenant des plasmas de patients infectés au VIH-1.
Objectif 3 : Déterminer le rôle de Dap-3 dans l’activation de l’apoptose des LT CD4 par
26
Chapitre III : Matériel et Méthodes
1. Patients
Les prélèvements sanguins proviennent des patients de la clinique UHRESS (Unité hospitalière de recherche, d’enseignement et de soins sur le SIDA) de la Dre Sylvie Trottier
au CHU de Québec. Les échantillons sanguins des patients ont été prélevés sur des tubes contenant soit le citrate de sodium ou l’EDTA en guise d’anticoagulant. Grâce à une série de centrifugations, les plasmas sont récupérés puis déplaquettés et conservés à -80 °C. Pour notre analyse, nous avons utilisé les plasmas provenant de deux patients non infectés (CG 107, CG 109), deux patients porteurs du VIH-1 et sous traitement antirétroviral (CG 108, CG 120) et deux patients porteurs du virus sans aucun traitement (CG 106, CG 111). Les patients VIH-1+ traités ont des charges virales inférieures à 40 copies du virus/mL de
plasma. Les deux patients VIH-1+ non traités ont des charges virales de 11234 copies du
virus/mL et de 5608 copies du virus/mL (Tableau 3). Tous les participants de cette étude ont donné un consentement libre et éclairé et cette étude a été approuvée par le comité d’éthique du CHU de Québec.
2. Réactifs et anticorps
2.1. RéactifsLe milieu de culture RPMI 1640 1X avec L-glutamine et sodium bicarbonate (Nºcat : 350-000-CL), le PBS 1X, la Pénicilline/Streptamycine/L-Glutamine (PSG) et le bleu de trypan ont été achetés chez Wisent™ (Montréal, Qu, Canada). Le plasmide NL4-3 a été obtenu grâce au programme AIDS Repository Reagent Program (Germantown, MD). Le polymère ExoQuick™ a été acheté chez System Biosciences (Mountain View, California). L’Optiprep™ ainsi que les réactifs acétylthiocholine chloride et le 5,5′-Dithiobis (2-nitrobenzoic acide) ont été acheté chez
Sigma-Aldrich™ (St Louis, Missouri). Les ARNs anti-sens de Dap-3, soit l’AS2 : 5'-TTTCAGCATCATCCTTGC-3' et l’AS3 : 5'-TATTCCTTTCAGCATCAT-3' ainsi que l’ARN
sens Dap-3 : 5'-ATGATGCTGAAAGGAATA-3' ont été achetés chez Integrated DNA Technologies (Skokie, Illinois). L’oligofectamine et l’Optimem reduced serum medium ont été
27
acheté chez Life Technologies (Carlsbad, California). Les Signal Boost immunoreaction Enhancers pour les anticorps primaires et secondaires ont été achetés chez EMD Millipore™ (Darmstadt, Germany). Le Luminata Forte a été acheté chez Fisher Scientific (Waltham, Massachusetts) et l’Enhanced Chemiluminescence Substrate (ECL) a été acheté chez Perkin Elmer (Waltham, Massachusetts). Le kit Stemsep Human CD14 Selection Kit a été acheté chez STEMCELL Technologies (Vancouver, BC, Canada). Le sérum de veau fœtal (SVF) est acheté chez Sigma (NºCat : F-1051, St. Louis, Missouri) puis ultracentrifugé à 100 000 xg pour avoir un sérum dépourvu de vésicules extracellulaires (SVFU). La primocine (NºCat : ANT-PM-2) et le plasmocine (NºCat : ANT-MPP) ont été achetés chez InvivoGen (San Diego, California).
2.2. Anticorps
Les anticorps anti-LAMP-2 (sc-18822), l’anti-Alix (sc-53538), l’anti-Hsp-70/HSC-70 (sc-24), l’anti-ICAM-1 (sc-8439) et l’anti-actine (sc-1616) ont été achetés chez Santa Cruz Biotechnology (Santa Cruz, CA). L’anticorps anti-Dap-3 (610662) a été acheté chez BD Biosciences (Mississauga, ON, Canada). L’anti-goat IgG (Immunoglobuline G) couplé à la peroxydase (AffiniPure F(ab')2 Fragment Donkey) a été acheté chez Jackson ImmunoResearch (Baltimore Pike, PA). L’anti-p24 (hybridome 183-H12-5C) a été obtenu grâce au programme AIDS Repository Reagent Program (Germantown, MD).
3. Culture cellulaire
3.1. Cellules RAJI CD4 DCIRNous avons utilisé une lignée cellulaire dérivée des lymphocytes B transfectée avec le gène codant pour le CD4 [172, 173], pour donner des cellules RAJI CD4. Cette lignée cellulaire permissive pour l’infection avec les virus X4 a ensuite été transfectée avec un autre vecteur MSCV-IRES-eGFP portant l’ADNc codant pour le DCIR humain, un récepteur de lectine de type-C présent dans les cellules dendritiques [49] rendant ainsi ce modèle cellulaire plus proche du phénotype des cellules dendritiques humaines.
Les cellules RAJI CD4 DCIR ont été mises en culture à une concentration de 2 x 105
cellules/mL à 37°C avec 5% de CO2, dans du milieu RPMI complet comprenant 10 % de