مجلا
ـ
يروه
ــــ
ة
يرئازجلا
ــــ
ة
يطارقميدلا
ــــ
ة
يبعشلا
ـــــ
ة
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
ةرازو
يلعتلا
ـــ
م
لاعلا
ــــ
ي
و
حبلا
ـــ
ث
ملعلا
ــــــ
ي
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE
Évaluation des effets protecteurs de la supplémentation en
quercétine et en vanilline sur la cytotoxicité induite par la
métribuzine chez le rat de la souche wistar.
Directeur de thèse : Messarah Mahfoud Professeur, Université d’Annaba Membres de Jury:
Président : M. Abdennour C. Professeur, Université d’Annaba
Examinateurs : M. Khelili K. Professeur, Université d’Annaba
M. Djabri B. Professeur, Université de Tébessa
M. Boussekine S. Maître de conférences (A), Université de
Tébessa
M. Slimani S. Maître de conférences (A), Université de
skikda
FACULTE DES SCIENCES
DEPARTEMENT DE BIOLOGIE
THÈSE
Présentée en vue de l'obtention
du diplôme de DOCTORAT en
SCIENCES
Option : Biologie Animale
THEME
Présentée par : KADECHE Lilia
عماج
ـــ
ة
جاب
ـــ
ي
راــــتخم
-ةـــــبانع
UNIVERSITE BADJI MOKHTAR - ANNABA
Année universitaire : 2017/2018
R
R
E
E
M
M
E
E
R
R
C
C
I
I
E
E
M
M
E
E
N
N
T
T
S
S
E
E
n tout premier lieu, je remercie Allah le Tout-Puissant
ﻰ ﺎﻌﺗ و ﮫ ﺎ ﺒ ﷲا, L’Audient
اﻊﯿﻤ
, Le Voyant
ﺮﯿﺼﺒا, Le Créateur
ﻖ ﺎﺨا, L’Omniscient
ﻢﯿ ﻌا, Le Présevateur
ﻤﯿﮭﻤأ, Le
Tout-Clément
نﺎﻤ ﺮاet Le Très-Miséricordieux
ﻢﯿ ﺮاde m’avoir donné la force et le
courage pour dépasser toutes les difficultés afin de réaliser ce travail. Louange à
L’Éternel
ﷲﺪﻤ ا.
J
J
e tiens à remercier très vivement Monsieur le professeur
Abdennour Cherif
qui nous
a fait l'honneur de présider le jury.
M
M
es sincères remerciements, ma reconnaissance et ma gratitude extrême
s’adressent à
Monsieur le professeur
Messarah Mahfoud
pour sa disponibilité, ses conseils, ses
encouragements inestimables et ses généreuses explications, en me laissant une large liberté
pour mener à bien cette étude.
J
J
e tiens à exprimer mes plus vifs remerciements à Monsieur le professeur
Khelili
Kamel
qui nous fait l’honneur de critiquer et d’analyser ce travail.
J
J
e remercie très vivement Monsieur le professeur
Djabri Belgacem
qui a accepté de
faire partie du jury et d'apporter ses critiques constructifs.
J
J
e tiens à exprimer mes remerciements à Madame le Docteur
Boussekine Samira
qui
nous honore de sa présence en examinant ce travail.
J
J
e voudrais aussi remercier chaleureusement Madame le Docteur
Slimani Souhila
qui
a bien voulu accepté de juger ce travail.
M
M
a profonde reconnaissance est adressée à mes très chers parents. Merci de votre
amour, patience et encouragements. Que Allah vous Garde pour nous.
J
J
e remercie également mes chers frères et sœurs pour leur aide inestimable. Que Allah
vous garde pour nous.
J
J
’exprime ma gratitude à Monsieur Aissani S, chef du service de santé, je vous
remercie pour toute votre aide.
J
J
e remercie profondément toutes les personnes qui nous ont soutenus de pré ou de loin
à la réalisation de ce travail.
صـــــــ ل
صـــــــخلملا
ل
،ني ي تي
. يع زل ليص ح ل نم ي ل ع
تسا عئ ش شعأ ي م ه
ه ف ي
ي حت ل ل ل
يثأت
( ع جل حل تحت
تل
133.33
ل
نم غك / غم
يح
)
نم
ع ني ي تي ل
يغت
ش ل
ي م ل
،
يئ ي يك ي ل
ل حل
ي سكأتل
ل
ك
جل
لاس نم
تسي
.
تق ل سفن يف
،
ني ين فل نيتس ل يئ ق ل
ل ميي ت مت
،
ك م
ي ي يل يفيل ب
،
ض
ه
ني ي تي ل سي يتل
يغتل
.
ت تش
ع ب جتل
48
ل ل
ف ين ث نم ع جم تس ل س م
فل نم ً ك
: ع جم
ه ش ع جم
،
ع ع جم
ت م
نيتس ل ب
ب
50
،مغك / مغ م
ع ع جم
م
ت
ني ين فل ب
ب
150
مغك / مغ م
،
ع ع جم
ني ي تي ل ب ت م
شل يم يف
،
ع ع جم
م
ت
نيب ع جل ب
ني ين فل ني ي تي ل نيب ع جل ب يخا نيتس ل ني ي تي ل
.
أ جئ تن
أ
ل
ني ي تي
ل مفل قي نع
ل
،
ج
ب س
زي ت يلاحن ف
يف
ف ن ب
ش ل
ي م ل
(
ء حل ي م ل ي ل
،
نيب غ ي ل
،
تي ك ت ي ل
مجحل
ل
ي س ل
)
.
يف
يغت
ش ل
تظحام ت ت يئ ي يك ي ل
كل ك
يف
ل
.
عق ل يف
،
أ
تس
ني ي تي ل
يي ل
يغت
ح ل
ل
يم ا
،
ص خ
، ي يل ، ك جل ي تسم يف
، يثاثل ه ل ،نيب ي ي ل ،ني يت ي ل
،
تسل ل
يف يزب ب ح م
شن
ق ل
يزنا
نيما ع ج ل
ت فس فل
ي ل
يت ل ي تسم يف
ف ن عم
ي ل
.
ك ،كل ع اع
يف
ض ه
لم ل
ل
أل
سك
ل
ي
ل م ل ، ل ،
(
ي
سكأ ش م
ي ي ي ل
،
يث ت جل ميزنأ شن
ف ن
يسك يب
عج ل يث ت جل ي ك
ن
).
ه
يغتل
ب ح م تن ك
ب
مسج
يف
ف ن
ل
ج
،
ب
ي س ل
ل يف يز
س
ل ء عال
ب
يغت
ي ي ب
ع
ل
تس
ل
ل
.
يل يفيل ل ك ل ب جل ل نيح يف
(
نيتس ل
،
ني ين فل
، )
ح ع لك
،
أ
يف لي ت ل
يغت
ش ل
ي م ل
،
يئ ي يك ي ل
ي سكأتل
ع ي ع ل حت ل ك ت نم ي ق ي تسم ل
ه شل
فل
.
أ جئ ت ل ه
ل
ني ين ف
ل
نيتيس ي
نم ت ت
ل
ج ل ب ضا نم ح
نع
ل
ل
ئ خ ب سب ني ي تي
سكال
.
ا املكلا
يحاتفمل
:
،ني ي تيم
، ي ل
نيتس ك
،
ني ين ف
،
م
، سكأ
ا يفيل ل
،
، سكأتل جإ
ف
.
ABSTRACT
ABSTRACT
Metribuzin (Mtz) is an herbicide commonly used on many agricultural crops. This work aims to determine the effects of subacute exposure at a dose of (133,33 mg / kg body weight) of Mtz, on hematological and biochemical parameters as well as oxidative status of male Wistar rats. Besides, the ability of quercetin and vanillin, natural phenolic compounds, to prevent changes induced by metribuzin was evaluated.
The experiment involved 48 male rats divided into six groups of eight rats each: a control group (T), a group treated with quercetin (Que) at a rate of 50 mg / kg, a group treated with vanillin (Va) at a rate of 150 mg / kg, a group treated with metribuzin (Mtz) in drinking water, a group treated with the combination (Mtz + Que) and the last is treated with the combination (Mtz + Va) for 21 days.
Our results showed that metribuzin administered orally to rats, causes hemolytic anemia characterized by decreased haematological parameters (red blood cells, hemoglobin, hematocrit and MCV). Biochemical alterations are also observed in the blood. Metribuzin caused, in fact, a disruption of plasma parameters including glucose, urea, creatinine, bilirubin, triglycerides, cholesterol, accompanied by an increase in enzymatic activities of transaminases and alkaline phosphatase with decreased total protein levels. Furthermore, there was a disturbance of the hepatic, renal, cerebral and testicular pro-antioxidant system (elevation of MDA; decreased GPx activities and depletion of GSH). These changes were accompanied by a reduction in the body weight of the rats, an increase in the relative weight of the organs studied and structural changes in the liver and kidney.
However, administration of the two polyphenols (quercetin, vanillin), separately, led to an adjustment of the change in hematological, biochemical and oxidative parameters to levels close to those of control rats. These results show that vanillin and quercetin can limit the disturbances caused by metribuzin due to their antioxidant properties.
Key words: Metribuzin, Pesticides, Quercetin, Vanillin, Antioxidants, Polyphenols, Oxidative stress, Rats.
RÉSUMÉ
RÉSUMÉ
La métribuzine (Mtz), est un herbicide utilisé couramment sur de nombreuses cultures agricoles. Ce travail de thèse vise à déterminer les effets d’une exposition subaigüe à une dose de (133,33 mg/kg de poids corporel) de Mtz, sur le profil hématologique, biochimique ainsi que le statut oxydatif des rats mâles Wistar. Parallèlement, la capacité de la quercétine et la vanilline, composés phénoliques naturels, de prévenir les changements induits par la métribuzine a été évaluée.
L'expérimentation a porté sur 48 rats mâles répartis en six groupes de huit rats chacun: un groupe témoin (T), un groupe traité par la quercétine (Que) à raison de 50 mg/kg, un groupe traité par la vanilline (Va) à raison de 150 mg/kg, un groupe traité par la métribuzine (Mtz) dans l'eau de boisson, un groupe traité par la combinaison (Mtz+Que) et le dernier est traité par la combinaison (Mtz+Va), pendant 21 jours.
Nos résultats ont montré que la métribuzine adminstré par voie orale aux rats, provoque une anémie hémolytique caractérisée par une diminution des paramètres hématologiques (globules rouges ; hémoglobine ; hématocrite et VGM). Des altérations biochimiques sont également constatées au niveau sanguin. La métribuzine a provoqué, en effet, une perturbation des paramètres plasmatiques, notamment des taux de glucose, urée, créatinine, bilirubine, triglycérides, cholestérol, accompagnée par une augmentation des activités enzymatiques des transaminases et de la phosphatase alcaline avec une diminution des taux de protéines totales. De plus, nous avons noté une perturbation du statut antioxydant hépatique, rénale, cérébrale et testiculaire (elévation de MDA ; diminition des activités GPx et déplétion du GSH). Ces changements ont été accompagnés d'une réduction du poids corporel des rats, d’une augmentation du poids relatif des organes étudiés et des variations structurales au niveau hépatique et rénale.
Toutefois, l’administration des deux polyphénols (quercétine, vanilline), séparément, a conduit à un ajustement du changement des paramètres hématologiques, biochimiques et oxydatifs à des niveaux proches de ceux des rats témoins. Ces résultats montrent que la vanilline et la quercétine permettent de limiter les perturbations provoquées par la métribuzine grâce à leurs propriétés antioxydantes.
Mots clé : Métribuzine, Pesticides, Quercétine, Vanilline, Antioxydants, Polyphénols,
TABLES DES ILLUSTRATIONS
LISTE DES TABLEAUX
TABLEAU TITRE PAGE
Tableau 1 Principales ERO radicalaires et non-radicalaires 05
Tableau 2 Les grandes familles de polyphénols 26
Tableau 3 Teneur en équivalent quercétine de quelques fruits et légumes 35
Tableau 4 Les propriétés physico-chimiques de la métribuzine 50
Tableau 5 Différentes DL50 pour les rongeurs 52
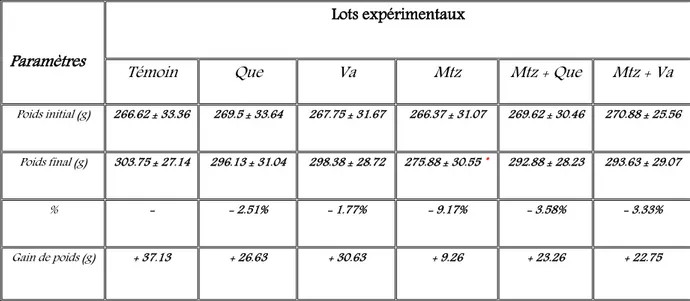
Tableau 6 Composition de l’alimentation pour 1 kilogramme d’aliment 53 Tableau 7 Variation du poids corporel PC (g) des rats témoins et rats traités
après 21 jours de traitement 75
Tableau 8
Variation du poids absolu PA (g) et du poids relatif PR (g/100g de poids corporel) des organes (foie, reins, cerveau et testicules) chez les rats témoins et rats traités après 21 jours de traitement
77
Tableau 9 Variation de quelques paramètres hématologiques chez les rats
témoins et rats traités après 21 jours de traitement 83
Tableau 10 Variation de quelques paramètres biochimiques chez les rats
témoins et rats traités après 21 jours de traitement 88
Tableau 11
Variation de glutathion (nmol/mg prot), de MDA (nmol/mg prot) et de l’activité enzymatique de la GPx (mol GSH/mg prot) dans les organes (Foie et rein) chez les rats témoins et rats traités après 21 jours de traitement
104
Tableau 12
Variation de glutathion (nmol/mg prot), de MDA (nmol/mg prot) et de l’activité enzymatique de la GPx (mol GSH/mg prot) dans les organes (cerveau et testicules) chez les rats témoins et rats traités après 21 jours de traitement
TABLES DES ILLUSTRATIONS
LISTE DES FIGURES
FIGURE TITRE
PAGE
Figure 1 Mécanismes de production des différents radicaux libres oxygénés
et espèces réactives de l’oxygène impliqué en biologie 07
Figure 2 Fuite d’électrons source de ROS au sein de la chaine de transport
d’électrons 09
Figure 3 Les différentes cibles des Espèces Réactives de l'Oxygène 11
Figure 4 Réactions de la peroxydation lipidique 12
Figure 5 Lésions de l’ADN formées par attaque radicalaire du patrimoine
génétique des cellules 14
Figure 6 Représentation schématique des mécanismes de défenses
enzymatiques antioxydantes 17
Figure 7 Formule semi-développée du glutathion réduit (GSH) 19
Figure 8 Structure chimique de l'alpha-tocophérol ou vitamine E 21
Figure 9 Structure du β-carotène 21
Figure 10 Structure de l'acide L-ascorbique 22
Figure 11 Différents pathologies associes au stress oxydant 23
Figure 12 Structure du noyau phénol 24
Figure 13 Structure générale du noyau des flavonoïdes 25
Figure 14 Quelques flavonoïdes 25
Figure 15 Acides phénoliques, squelette benzoïque (I) et squelette
cinnamique (II) 27
Figure 16 Structure d’un stilbène, le resvératrol 27
Figure 17 Structure et numérotation des atomes de carbone du
phénylpropane (1) et des lignanes (2) (liaison β-β’ ou 8,8’) 28
Figure 18 Schéma général de biodisponibilité des polyphénols 29
Figure 19 Flavonoïdes et leurs sites proposés pour la chélation des ions
métalliques 32
Figure 20
Nomenclature des cycles et numérotation systématique des
hydroxyles de la quercétine 34
Figure 21 Formule de la vanilline 38
TABLES DES ILLUSTRATIONS
Figure 23 Processus de diffusion des pesticides dans l’environnement 44
Figure 24 Modes d’exposition de l’homme et des milieux par les pesticides 46
Figure 25 Structure chimique de métribuzine 49
Figure 26 Schéma récapitulatif du protocole expérimental 56
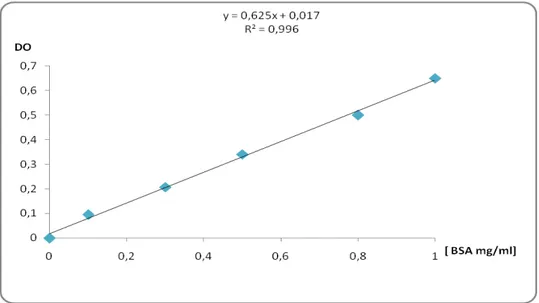
Figure 27 La gamme d’étalonnage utilisée (BSA 1mg/ml) pour le dosage des
protéines 70
Figure 28 Variation du poids corporel (g) des rats témoins et rats traités après
21 jours de traitement 76
Figure 29 Evolution du poids relatif du foie (g/100 g Pc) chez les rats
témoins et rats traités après 21 jours de traitement 78
Figure 30 Evolution du poids relatif des reins (g/100 g Pc) chez les rats
témoins et rats traités après 21 jours de traitement 79
Figure 31 Evolution du poids relatif du cerveau (g/100 g Pc) chez les rats
témoins et rats traités après 21 jours de traitement 79
Figure 32 Evolution du poids relatif du cerveau (g/100 g Pc) chez les rats
témoins et rats traités après 21 jours de traitement 79
Figure 33
Variation des globules rouges (106/ul) chez les rats témoins et rats
traités après 21 jours de traitement 82
Figure 34 Variation d’hématocrite (%) chez les rats témoins et rats traités
après 21 jours de traitement 84
Figure 35 Variation d’hémoglobine (g/dl) chez les rats témoins et rats traités
après 21 jours de traitement 84
Figure 36 Variation du volume globulaire moyen (fl) chez les rats témoins et
rats traités après 21 jours de traitement 84
Figure 37 Variation de la concentration sérique en glucose (mg/dl) chez les
rats témoins et rats traités après 21 jours de traitement 89
Figure 38 Variation de la concentration sérique en bilirubine totale (mg/l)
chez les rats témoins et rats traités après 21 jours de traitement 89
Figure 39 Variation de la concentration sérique en urée (mg/dl) chez les rats
témoins et rats traités après 21 jours de traitement 89
Figure 40
Variation de la concentration sérique en créatinine (mg/dl) chez les
rats témoins et rats traités après 21 jours de traitement 91
TABLES DES ILLUSTRATIONS
rats témoins et rats traités après 21 jours de traitement
Figure 42 Variation de la concentration sérique en triglycérides (g/l) chez les
rats témoins et rats traités après 21 jours de traitement 91
Figure 43 Variation de la concentration sérique en protéines totales (g/l) chez
les rats témoins et rats traités après 21 jours de traitement 93
Figure 44
Variation de l’activité enzymatique de la phosphatase alcaline (UI/L) chez les rats témoins et rats traités après 21 jours de traitement
93
Figure 45 Variation de l’activité enzymatique de l’AST (UI/L) chez les rats
témoins et rats traités après 21 jours de traitement 94
Figure 46 Variation de l’activité enzymatique de l’ALT (UI/L) chez les rats
témoins et rats traités après 21 jours de traitement 94
Figure 47
Taux du glutathion réduit (GSH), de glutathion peroxydase (GPx) et de malondialdéhyde (MDA) hépatiques chez les rats témoins et rats traités après 21 jours de traitement
105
Figure 48
Taux du glutathion réduit (GSH), de glutathion peroxydase (GPx) et de malondialdéhyde (MDA) rénales chez les rats témoins et rats traités après 21 jours de traitement
106
Figure 49
Taux du glutathion réduit (GSH), de glutathion peroxydase (GPx) et de malondialdéhyde (MDA) cérébraux chez les rats témoins et rats traités après 21 jours de traitement
110
Figure 50
Taux du glutathion réduit (GSH), de glutathion peroxydase (GPx) et de malondialdéhyde (MDA) testiculaires chez les rats témoins et rats traités après 21 jours de traitement
111
Figure 51 Coupes histologiques du foie de rat témoin et rats traités après 21
jours de traitement 113
Figure 52 Coupes histologiques du rein de rat témoin et rats traités après 21
LISTE DES ABRÉVIATIONS
ABRÉVIATIONS
•NO 2 : Dioxyde d'azote 1O 2 : Oxygène singulet 4-HNE : 4-hydroxy-2-nonénal AchE : AcétylcholinestéraseBSA : Sérum albumine bovine
CAT : Catalase
CCMH : Concentration corpusculaire moyenne en hémoglobine
ClO- : Ion hypochlorite
Cu/Zn-SOD : Superoxyde dismutase aux ions cuivre et zinc
DL50 : Dose létale 50
DTNB : Acide 5,5’-dithiobis (2-nitrobenzoique) ou réactif d’Ellman
EDTA : Ethylène diamine tétra-acétique
ERO : Espèces réactives de l'oxygène
G6PDH : Glucose-6-phosphate déshydrogénase
Gamma-GT : Gamma glutamyl-transférase
GB : Globules Blancs
GR : Globules Rouges
GR : Glutathion réductase
LISTE DES ABRÉVIATIONS
GSSG : Disulfure de glutathion (Glutathion oxydé)
H2O2 : Peroxyde d’hydrogène
Hb : Hémoglobine
HO2• : Hydroperoxyle
LOO• : radical peroxyle
MDA : Malondialdéhyde
Mn-SOD : Superoxyde dismutase
Mtz : Métribuzine NO• : Monoxyde d’azote O2•- : Radical superoxyde O22- : Anion peroxyde O3 : Ozone OH• : Radical hydroxyle ONOO- : Peroxynitrite ONOO• : Peroxynitrite Que : Quercétine RL : Radical libre RO• : Alkoxyle RO2• : Peroxyle
ROO- : Radical peroxyde
LISTE DES ABRÉVIATIONS
ROS : Reactive oxygen species
SOD : Superoxyde dismutase
TBA : “2-Thiobarbituric acid”: L’acide thiobarbiturique
TBARS : substances réagissant avec l'acide thiobarbiturique
TCA : Trichloroacétique
TABLE DES MATIÈRES
TABLE DES MATIÈRES
ETUDE BIBLIOGRAPHIQUE
INTRODUCTION 01
CHAPITRE I. Stress oxydant :
1. Radicaux libres 04
1.1. Généralité sur les radicaux libres 04
1.2. Les radicaux libres biologiques 04
2. Définition du stress oxydant 05
3. Mécanismes de production des principales ERO 06
3.1. L’anion superoxyde O2•- 06
3.2. Le peroxyde d’hydrogène H2O2 06
3.3. Le radical hydroxyle HO• 07
3.4. L’oxygène singulet1O
2 08
4. Sources des ERO ou ROS 08
4.1. Sources endogènes 08
4.2. Sources exogènes 10
5. Cibles biologiques des ROS 11
5.1. Peroxydation lipidique 11
5.2. Oxydation des protéines 13
5.3. Oxydation de l’ADN 13
6. Antioxydants 14
6.1. Définition 14
6.2. Mode d’action des antioxydants 15
6.3. Les systèmes de défense antioxydants 15
6.3.1. Les systèmes antioxydants enzymatiques 15
6.3.2. Les systèmes antioxydants non enzymatiques 18
6.3.2.1. Antioxydants non enzymatiques endogène 18
6.3.2.2. Antioxydants non enzymatiques exogènes 20
7. Les maladies liées au stress oxydant 22
CHAPITRE II. Polyphénols en tant qu’antioxydants:
1. Présentation générale sur les polyphénols 24
1.1. Diversité structurale, sources alimentaires et classification des polyphénols 24
TABLE DES MATIÈRES
1.2.1 Absorption 28
1.2.2. Conjugaison 29
1.2.3. Transport plasmatique 30
1.2.4. Distribution dans les tissus et organes 30
1.2.5. Excrétion 30
1.3. Propriétés biologiques des polyphénols 31
1.3.1. Activité antioxydante des polyphénols 31
1.3.1.1. Piégeage direct de radicaux libres 31
1.3.1.2. Chélation des ions métalliques 32
1.3.1.3. Inhibition enzymatique 32
1.3.2. Les polyphénols: une action pro-oxydante ? 33
2. La quercétine et la vanilline deux molécules modèles 33
2.1. Quercétine 34
2.1.1. Description et propriétés physico-chimiques 34
2.1.2. La biodisponibilité de la quercétine 35
2.1.3. Effets physiologiques de la quercétine 36
2.2. Vanilline 37
2.2.1. Origine 37
2.2.2. Propriétés physicochimiques 38
2.2.3. Etude toxicologique 38
2.2.4. Les propriétés physiologiques de la vanilline 39
CHAPITRE III. Pesticides :
1. Définition et utilisation 41
2. Classification 42
3. Mode d’action des pesticides 43
4. Impacts des pesticides sur l’environnement et la santé humaine 43
4.1. Effets sur l’environnement 43
4.2. Effets sur la santé 45
5. Le pesticide étudié : la métribuzine 48
5.1. Présentation 48
5.2. Utilisation et mode d’action 49
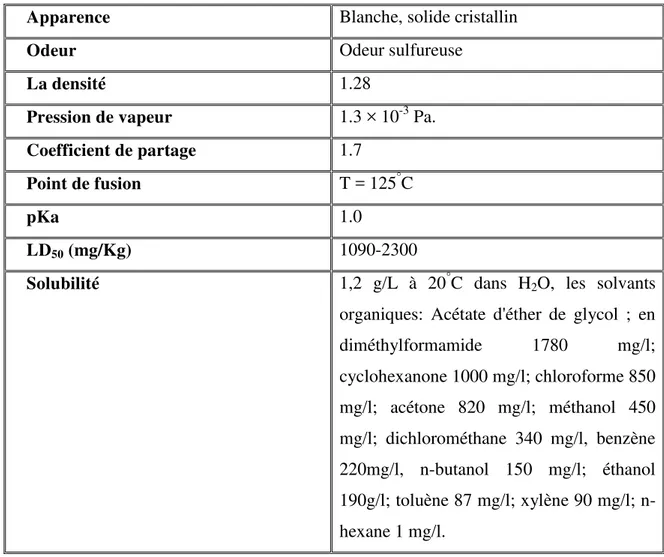
5.3. Propriétés physico-chimiques 50
TABLE DES MATIÈRES
5.5. Mode d’action et toxicité de la métribuzine 51
PARTIE PRATIQUE
CHAPITRE I. MATÉRIEL ET MÉTHODES :
1. Matériel biologique et conditions d’élevage 53
2. Méthodes 53
3. Sacrifices et prélèvements des organes 55
3.1. Prélèvement sanguin 55
3.2. Prélèvement des organes 55
4. Méthodes de dosage des paramètres biochimiques 57
4.1. Dosage du glucose 57
4.2. Dosage de la bilirubine totale 58
4.3. Dosage de l’urée 59
4.4. Dosage de la créatinine 60
4.5. Dosage du cholestérol 61
4.6. Dosage des triglycérides 62
4.7. Dosage des protéines totales 64
4.8. Dosage des transaminases 65
4.8.1. Dosage de l’aspartateaminotransférase (AST) 65
4.8.2. Dosage d’Alanine aminotransférase (ALT) 66
4.9. Dosage de la phosphatase alcaline (PAL) 67
5. Dosage des paramètres du stress oxydant 68
5.1. Préparation de l’homogénat 68
5.2. Dosage du glutathion réduit (GSH) 68
5.3. Dosage des protéines 69
5.4. Dosage de malondialdehyde (MDA) 70
5.5. Dosage de l’activité de la GPx 71
6. Etude histologique 72
7. Analyse statistique des résultats 74
CHAPITRE II. RÉSULTATS ET DISCUSSION :
1. Paramètres de croissance 75
1.1. Action sur la croissance corporelle 75
TABLE DES MATIÈRES
1.2.1. Foie 76
1.2.2. Reins 76
1.2.3. Cerveau 78
1.2.4. Testicules 78
2. Effets sur la fonction hématologique 82
3. Etude des paramètres biochimiques 87
3.1. Glucose 87 3.2. Bilirubine totale 87 3.3. Urée 87 3.4. Créatinine 90 3.5. Cholestérol 90 3.6. Triglycérides 90 3.7. Protéines totales 92 3.8. Phosphatase alcaline 92 3.9. Transaminases 92
4. Évaluation des marqueurs du stress oxydatif dans certains organes 102
4.1. Foie 102 4.2. Reins 103 4.3. Cerveau 107 4.4. Testicules 108 5. Etude histologique 112 5.1. Foie 112 5.2. Reins 112 CONCLUSION ET PERSPECTIVES 118 BIBLIOGRAPHIE 121 ANNEXES 161
INTRODUCTION GÉNÉRALE
1
Introduction
Les problèmes posés par la dispersion de polluants dans l’environnement ont suscité l’intérêt de la communauté scientifique depuis maintenant de nombreuses décennies. La prise de conscience de la nécessité de préserver les écosystèmes terrestres et aquatiques a ainsi fait émerger certaines questions, notamment celles du devenir de ces polluants dans l’environnement ainsi que de leurs effets sur les communautés animales et végétales.
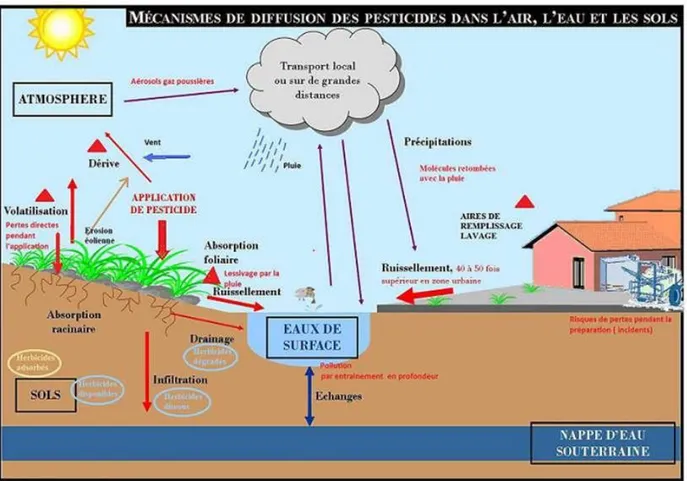
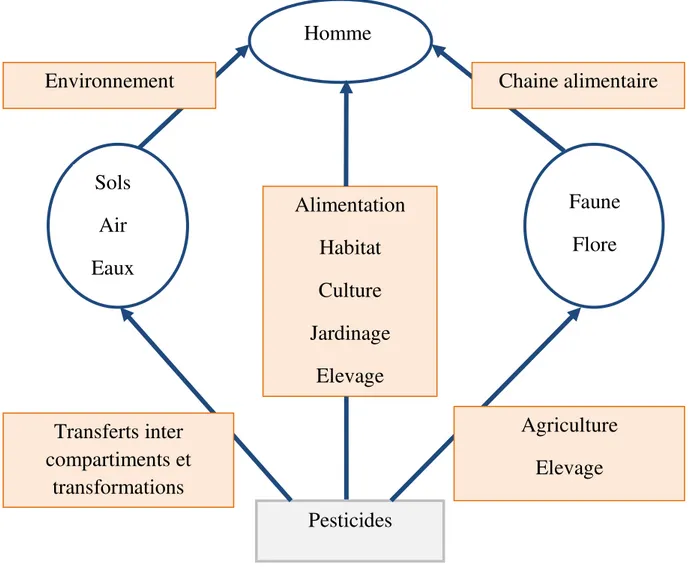
Parmi les contaminants majeurs de l’environnement, les pesticides posent de sérieux problèmes écologiques et sanitaires (Mengistie et al., 2016). Leur immense succès dans les applications agricoles afin d’optimiser la productivité des denrées, a entraîné une étendue rapide de leur production et utilisation. Mais, vu leurs propriétés toxicologiques, ubiquité, persistance, présence et concentration dans la chaîne alimentaire, ils constituent un véritable danger, et sont actuellement considérés parmi les principaux polluants environnementaux, à l’origine de résidus toxiques dans l’air, le sol et l’eau (Li et al., 2014 ; Jayaraj et al., 2016 ; Souza et al., 2017).
Bien qu'utilisés contre des organismes cibles particuliers, les pesticides sont susceptibles d'exercer une activité toxique vis-à-vis d'autres organismes dits non-cibles (Maroni et al., 2000; Eason et O'Halloran, 2002). Par conséquent, et face à cette dualité bénéfice-risque, la protection de la santé humaine contre l’exposition aux pesticides demeure une préoccupation majeure, et le problème de résidus toxiques reste d’actualité.
Les effets potentiellement néfastes des pesticides sur les espèces non ciblées font l’objet d’un large consensus. Ainsi, les principaux effets chroniques relevés sont les troubles des systèmes nerveux central (Steeve et al., 2013 ; Sharma et al., 2014 ; Galal et al., 2014 ; Andrea Rother, 2014) et immunitaire (Baconi et al., 2013 ; Badgujar et al., 2013 ; Thakur et al., 2013 ; Kumar et al., 2015), les effets perturbateurs endocriniens (Memon et al., 2014 ; Khedr Nassar, 2016 ) et les cancers (Héritier et al., 2014 ; Zare et al., 2015).
A ce jour, ces études n’ont pas cessé et sont à l’origine de nombreux documents de référence (Rezaie Agdam et al., 2017 ; Jamal et al., 2016 ; Mehri et al., 2016 ; Abdel-Ghany et al., 2016), démontrant la complexité des mécanismes toxicologiques mis en jeu. Néanmoins, les résultats obtenus par le biais de ces études concluent que les pesticides incluant les herbicides, les insecticides et les fongicides sont des molécules pro-oxydantes dans la mesure où elles engendrent une surproduction d'espèces réactives de l'oxygène (ROS) dans les cellules de l’organisme qui y est exposé.
INTRODUCTION GÉNÉRALE
2
Du fait de leur très grande réactivité, ces dérivés de l’oxygène (ROS) peuvent réagir avec la plupart des composés cellulaires (lipides membranaires, les protéines ou l’ADN), entrainer ainsi des dommages cellulaires et tissulaires (Valavanidis et al., 2006). Toutefois, une régulation très fine de la production et de la dégradation des ROS est réalisée dans les cellules (Lushchak, 2011 ; Islas-Flores et al., 2013).
En fait, pour se protéger des effets toxiques du ROS, l’organisme a développé des systèmes de défense contre ces toxiques ou acquiert les antioxydants de l’alimentation. Ces systèmes comprennent des enzymes qui catalysent la réduction des ROS (e.g. catalase, superoxydes dismutases ou glutathion peroxidases), et des molécules non enzymatiques qui les neutralisent (e.g. glutathion réduit, acide ascorbique, vitamine E et polyphénnols) (Bouayed, 2010 ; Lushchak, 2011 ; Regoli et Giuliani, 2014).
Cependant, les pesticides peuvent altérer le fonctionnement des systèmes de contrôle (inhibition de l’ensemble des enzymes et déplétion de la quantité de glutathion), et être à l'origine d’un stress cellulaire appelé stress oxydant, comme cela est décrit dans de nombreuses études concernant la toxicité des pesticides chez l’homme (Medjdoub et al., 2011 ; Balaji et al., 2012) et les rongeurs (Sidhu et al., 2014 ; Heikal et al., 2014 ; Ojo et al., 2014 ; Sief et al., 2015; Vara Prasad et al., 2016), en particulier. En réponse au stress oxydant, ces études ont également montré que les pesticides peuvent affecter de nombreux processus physiologiques, traduits en changements fonctionnels ou lésionnels (morphologie) d'un ou de plusieurs organes comme le foie (Seif et al., 2015), les reins (Seif et al., 2015 ; Vara Prasad et al., 2016), le cerveau (Ojo et al., 2014) et les testicules (Heikal et al., 2014).
Pour prévenir ce type de situations, la recherche sur la supplémentation en antioxydants a été le sujet de plusieurs études (Kim et al., 2013 ; Shati, 2014 ; Mehrpak et al., 2015 ; Ibrahim Elsayed et al., 2015), qui ont montré qu'un apport exogène en antioxydants peut réduire les dommages induits par le stress oxydatif. Ces antioxydants sont apportés chez l’homme à travers la consommation de fruits et légumes ou d’autres boissons à base de plante et peuvent s’avérer utiles pour la santé humaine (Shebis et al., 2013).
A ce titre, les polyphénols, particulièrement abondants dans une alimentation riche en produits végétaux, pourraient jouer un rôle protecteur important qui a été attribué, en partie, à leur potentiel antioxydant (Ibrahim Elsayed et al., 2015 ; Olayinka et al., 2015 ; Nagendra Kumar et al., 2016 ; Al-Shaaibi et al., 2016). Ces composés issus du métabolisme secondaire des plantes sont, en effet, connus pour leur capacité à piéger les espèces réactives d'oxygène.
INTRODUCTION GÉNÉRALE
3
Bien plus, ils ont une multitude d’activités biologiques dépendant de leurs structures chimiques. Plus de 8000 structures ont été identifiées, les polyphénols constituent une importante famille d’antioxydants présents dans les végétaux (Działo et al., 2016).
À partir de ces connaissances, il serait donc intéressant d'étudier l'effet d'un apport exogène en polyphénols sur le stress oxydant induit par les pesticides. L'objectif de notre travail est d'évaluer la toxicité induite par un herbicide, la métribuzine chez le rat et de tester les effets modulateurs de la supplémentation en polyphénols (la quercétine ou la vanilline).
Il est donc possible d’analyser l’impact de la métribuzine chez les rats par le biais de différents biomarqueurs d’effet. Parmi ceux-ci peuvent notamment être cités les marqueurs enzymatiques et non enzymatiques de stress oxydant ; les modifications de paramètres hématologiques ; biochimiques ou encore de paramètres de croissance (poids corporel et poids relatif des organes). Nous avons également recherché des effets histologiques (variation de structure) au niveau de certains tissus cibles (foie et reins).
Afin de présenter l’étude menée en ce sens, le présent manuscrit s’articule en deux parties : l’une bibliographique, l’autre expérimentale.
Dans la partie bibliographique, le premier chapitre est une revue de littérature introduisant le concept du stress oxydant. Les sources des ROS et leurs conséquences biologiques sont abordées dans un premier temps. Les antioxydants endogènes et exogènes, sont ensuite présentés. Le second chapitre est quant à lui dédié à la présentation des polyphénols en général et des polyphénols selectionnés (quercétine et vanilline) en particulier: structures et propriétés, capacité antioxydante, biodisponibilité et effet santé. Enfin, les connaissances sur l’utilisation et les effets de l'ensemble des pesticides agricoles, et du pesticide étudié (métribuzine) fait l’objet de la troisième chapitre.
La partie expérimentale débute avec la présentation de la démarche entreprise qui tient lieu de préambule au chapitre « Matériels et Méthodes » proprement dit. Les chapitres
« Résultats et Discussion » sont ensuite exposés avant de dresser un bilan de ces travaux au
travers d’une conclusion générale et de présenter les perspectives d’études sur lesquelles ces travaux seraient susceptibles de déboucher.
CHAPITRE I. Stress
oxydant
ETUDE BIBLIOGRAPHIQUE Stress oxydant
4
I. Stress oxydant 1. Radicaux libres
1.1. Généralité sur les radicaux libres
Un radical libre (RL) est une entité chimique (atome, molécule ou fragment de molécule) capable d’exister sous forme indépendante, et contenant au moins un électron célibataire ou non apparié sur sa couche électronique externe (Bonnefont-Rousselot et al., 2003 ; Finaud et al., 2006). Cette propriété lui confère une grande instabilité et par-là même une extrême réactivité chimique (Halliwell et Gutteridge, 1992). De ce fait, les radicaux libres doivent donner un électron non apparié ou arracher un électron à une molécule avoisinante, afin de tendre vers un état moins éxcité, donc plus stable (Fang et al., 2002).
Les réactions de transfert d’électrons qu’ils produisent (réactions d’oxydoréduction, redox) conduisent souvent à la formation d’un nouveau radical, ce phénomène pouvant se propager par des réactions en chaîne (Carriere et al., 2006). La durée de vie des radicaux libres est extrêmement très courte de la nano à la milliseconde, et il est symbolisé par un point qui indique où l’électron libre se situe (Goto et al., 2008).
1.2. Les radicaux libres biologiques
En biologie, les radicaux libres sont formés le plus souvent par gain d’électron à partir de l’O2 (Droge, 2002). Les radicaux dérivés d'oxygène représentent, en effet, la classe la plus
importante d'espèces radicalaires générées dans les systèmes vivants à cause de l’importance de leur métabolisme aérobique (Valko et al., 2007). Cependant, d’autres espéces radicalaires sont encore à considérer, à savoir les espéces réactives de l’azote (Palmer et al., 1988).
Parmi toutes les espèces radicalaires susceptibles de se former dans les cellules, il convient de distinguer (Favier, 2003) :
* Des radicaux primaires, dérivent de l’oxygène par des réductions à un électron tel anion superoxyde O2•-, et le radical hydroxyle OH•; ou de l'azote tel le monoxyde d'azote NO•.
* Des radicaux secondaires, se forment par réaction de ces radicaux primaires sur les composés biochimiques de la cellule.
* D’autres espèces dérivées de l’oxygène, dites espèces actives de l'oxygène comme l’oxygène singulet 1O
2, le peroxyde d’hydrogène (H2O2) ou le nitroperoxyde (ONOOH), ne
sont pas des radicaux libres, mais sont aussi réactives et peuvent être des précurseurs de radicaux.
ETUDE BIBLIOGRAPHIQUE Stress oxydant
5
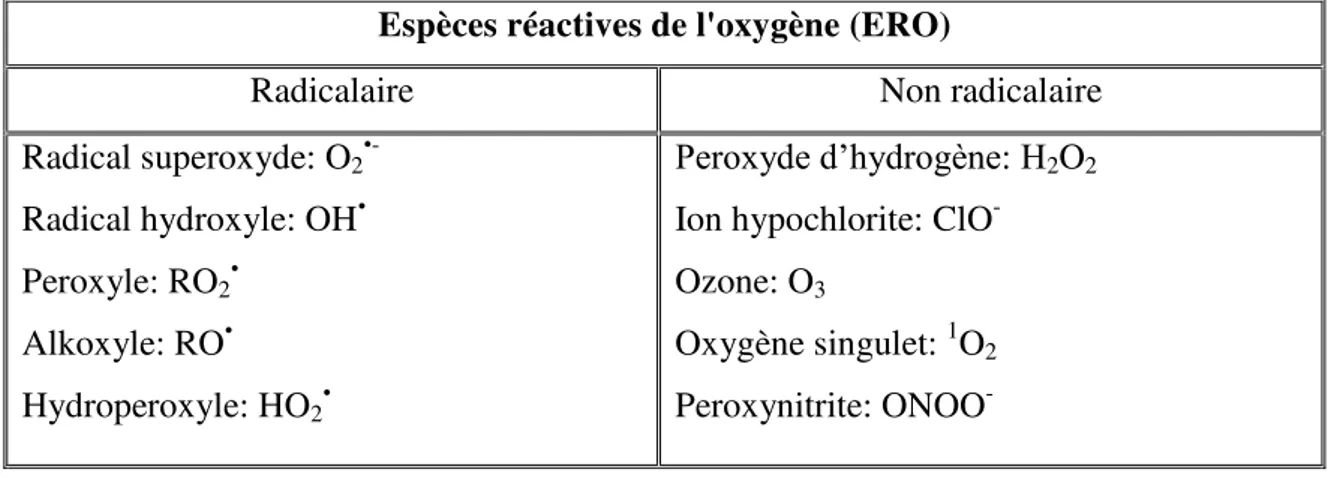
L'ensemble des radicaux libres et de leurs précurseurs est souvent appelé espèces réactives de l'oxygène (ERO), ou de l’anglais reactive oxygen species (ROS) (tab.1)
Tableau 1: Principales ERO radicalaires et non-radicalaires (Halliwell et Whiteman, 2004) Espèces réactives de l'oxygène (ERO)
Radicalaire Non radicalaire
Radical superoxyde: O2 •-Radical hydroxyle: OH• Peroxyle: RO2• Alkoxyle: RO• Hydroperoxyle: HO2• Peroxyde d’hydrogène: H2O2
Ion hypochlorite: ClO- Ozone: O3
Oxygène singulet: 1O2
Peroxynitrite: ONOO
-Toutes ces espèces oxygénées sont produites par divers mécanismes physiologiques car elles sont utiles pour l’organisme à dose raisonnable (Favier, 2003). En fait, les espèces réactives de l'oxygène (ERO) protègent, régulent la cellule et permettent de maintenir une certaine homéostasie de l’état redox de l’oraginsme (Dikalov et al., β007). Cependant, les ERO provoquent des dommages cellulaires si elles sont produites d'une manière incontrôlée (Kim et al., 2009).
Leur hyperréactivité les engage dans des réactions de dénaturation des constituants cellulaires de type peroxydation avec les glucides, les lipides, les protéines et l’ADN (Curtay et Robin, 2000). De ce fait, ces entités oxydantes sont physiologiquement maintenues en équilibre par de nombreux systèmes antioxydants (Sies, 1991).
2.Définition dustress oxydant
Ce type de stress est généré par l’accumulation des espèces réactives de l’oxygène (ERO) au niveau cellulaire (Beckman et Ames, 1998). Comme cité précédemment, une accumulation excessive de radicaux libres pouvant engendrer des dommages importants sur la structure et le métabolisme cellulaire (Halliwell et Cross, 1994). La conséquence des effets nocifs des RL et des métabolites réactifs est dite « stress oxydant »(Barouki, 2006 ; Jenkins et al., 2007).
Ce terme est défini comme un déséquilibre entre les processus biochimiques de production des ERO et ceux qui sont responsables de leur contrôle et élimination (Bloomer et Fisher-Wellman, 2008 ; Browne et al., 2008 ; Powers et al., 2010). Ce déséquilibre peut se produire quand le système de défense antioxydant est surmené par l’augmentation des oxydants
ETUDE BIBLIOGRAPHIQUE Stress oxydant
6
ou lorsque les défenses sont affaiblies par une carence d’apport et/ou de production d’antioxydants (Kirschvink et al., 2008). L’équilibre ou l’homéostasie redox est alors perturbé et les cellules deviennent vulnérables aux attaques par les ERO (Mac Laren, 2007).
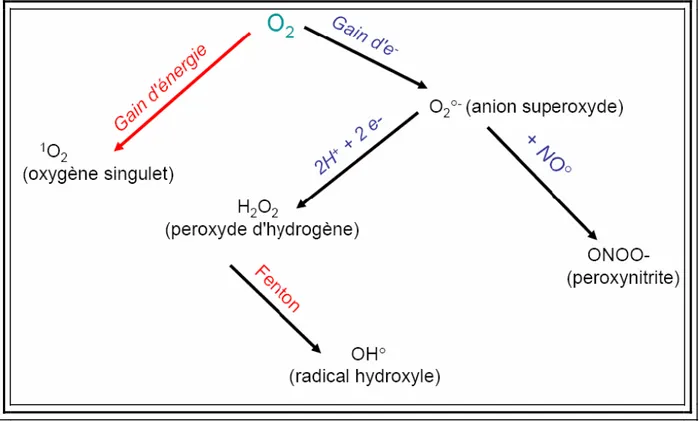
3.Mécanismes de production des principales ERO
Parmi les EROs, on peut distinguer quatre espèces principales (fig.1) : l’anion superoxyde (O2•-), le peroxyde d’hydrogène (H2O2), le radical hydroxyle (OH•) et l’oxygène singulet (1O2) :
3.1. L’anion superoxyde O2
•-L’anion superoxyde O2•- constitue le précurseur de la plupart des ERO et induit les
réactions oxydatives en chaîne (Abele et al., 2002). C’est l’espèce la plus couramment générée par la cellule, par réduction d’une molécule d’O2 (Wolin, 1996). A l’état fondamental, l’O2 est
une molécule biradicalaire formée de deux atomes présentant sur leurs orbitaux externes deux électrons non appariés (Sies, 1993 ; De Leiris, 2003). En présence d’une quantité d’énergie suffisante, la molécule d’oxygène peut acquérir un électron supplémentaire et former ainsi l’anion superoxyde (Bisbal et al., 2010).
O2 + é O2
•-Les radicaux superoxydes (O2•-) ne sont pas très réactifs, mais constituent des précurseurs
d'autres espèces plus réactives. La faible réactivité de ces radicaux permet d'ailleurs leur utilisation par l'organisme comme médiateurs régulant des fonctions biologiques (Favier, 2003).
3.2. Le peroxyde d’hydrogène H2O2
Le peroxyde d’hydrogène H2O2(appelé également eau oxygénée) est formé par l’addition
d’un second électron sur l’O2•- donnant comme intermédiaire l’anion peroxyde O22-, qui se
protone facilement pour donner H2O2. Toutefois, la principale production de H2O2 résulte de la
dismutation de l’O2•- selon la réaction suivante (Daum-Badouard, 2006):
2O2•- + 2H+ H2O2 + O2
L’absence de charge à sa surface rend cette ERO très lipophile et peu réactif en milieu aqueux (Cash et al., 2007). Contrairement à l’anion superoxyde, le peroxyde d’hydrogène est donc capable de traverser les membranes des cellules et des organites cellulaires pour engendrer des dommages loin de son site de production (Halliwelt et Gutteridge, 1996).
ETUDE BIBLIOGRAPHIQUE Stress oxydant
7
3.3. Le radical hydroxyle HO•
Le radical hydroxyle, est généré par la réaction du peroxyde d’hydrogène avec l’anion superoxyde (réaction d’Haber-Weiss), engendrant alors un ion OH- inoffensif et un radical
hydroxyle HO• (Comhair et Erzurum, 2002).
H2O2+ O2•- HO• + O2 + OH-
Cette réaction est lente et probablement inopérante dans les tissus vivants. Mais, en revanche, en présence de métaux de transition (fer, cuivre), l’H2O2 donne naissance in vivo via
la réaction de Fenton à un radical hydroxyle HO• hautement réactif (Goldstein et al., 1993).
O2•- + Fe+3 O2 + Fe+2
H2O2 + Fe+2 OH- + HO• + Fe+3
Le radical hydroxyle à une demi-vie extrêmement courte et une capacité à diffuser restreinte, il est capable de réagir très rapidement avec la plupart des molécules biologiques
Figure 1 : Mécanismes de production des différents radicaux libres oxygénés et espèces
ETUDE BIBLIOGRAPHIQUE Stress oxydant
8
comme l’ADN, les protéines, les sucres et les lipides membranaires (Delattre et al., 2005),en transformant la molécule cible en radical libre très réactif. Ce radical nouvellement formé peut alors interagir avec d’autres molécules cibles déclenchant ainsi des réactions en chaîne.
Les réactions en chaîne représentent l’un des plus grands dangers du radical OH•. En
revanche, l’H2O2 et l’O2•- ne sont pas suffisammentréactifs pour déclencher des réactions en
chaîne (Lau et al., 2008; Aprioku, 2013). Le radical hydroxyle apparaît donc comme l’espèce réactive ayant une responsabilité majeure dans la cytotoxicité des radicaux libres (Guetteridge, 1993).
3.4. L’oxygène singulet 1
O2
L’oxygène singulet (1O
2), une autre espèce réactive de l’oxygène, est principalement
produite dans le vivant suite à une exposition à des rayons lumineux (Freinbichler et al., 2011), où une molécule excitée transfert son énergie à l’oxygène et l’active en oxygène singulet. 1 O
2
est très reactif et peut par exemple s’additionner rapidement sur des doubles liaisons carbone-carbone (Yoshikawa et al., 2000). Il a pour cible biologique les membranes, les acides nucléiques et les protéines.
Toutefois, il existe d’autres ERO tel que le monoxyde d’azote (NO•), qui a un rôle dans de
multiples fonctions physiologiques (De Backer, 2006). Mais, à forte concentration, le NO devient délétère pour les cellules notamment en réagissant avec O2•- pour former un puissant
oxydant le peroxynitrite (ONOO•), qui peut secondairement se décomposer en d’autres oxydants comme •NO2 et le OH•(Densiov et Afanas’ev, β005).
4. Sources des ERO ou ROS
Les RL sont produits dans l’organisme par de nombreux mécanismes tant endogènes qu’ exogènes (Halliwell, 2006).
4.1. Sources endogènes
Les ERO produits d’une manière endogène proviennent essentiellement du métabolisme mitochondrial (Pattwell et Jackson, 2004), du peroxysome (Boveris et al., 1972) et du réticulum endoplasmique (De et Baudhuin, 1966).
Mitochondrie
La mitochondrie est considérée comme une des principales sources de ROS dans la cellule par l'intermédiaire de sa chaîne respiratoire. Elle produirait, en effet, 90% des ROS cellulaires
ETUDE BIBLIOGRAPHIQUE Stress oxydant
9
(Balaban et al., 2005). Cette production centralisée de ROS est due au fait que la mitochondrie est le lieu central de consommation de l'oxygène au cours de la phosphorylation oxydative (Qutub et Popel, 2008).
Cet organite produit la majeure partie de l'énergie cellulaire grâce aux processus de phosphorylation oxydative où l'oxydation de divers substrats métaboliques (tels les glucides et les acides gras en particulier) produit de l'eau et de l'adénosine triphosphate (ATP), avec l’oxygène (O2) comme accepteur final d'électrons (Nicholls et Ferguson, 2002).
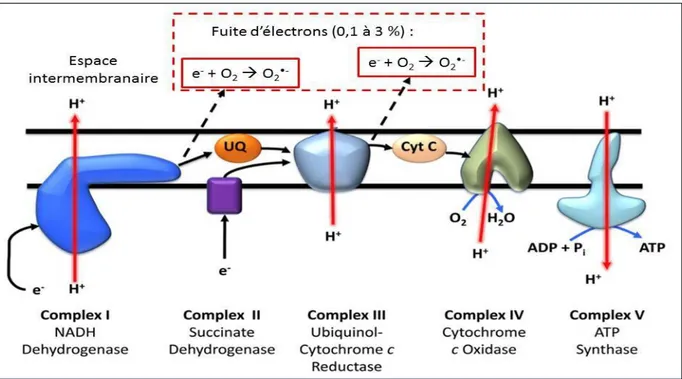
La réduction de l’oxygène en eau nécessite l'apport de quatre électrons (Beckman et Ames, 1998). Or, des réductions à un seul électron, produisant des anions superoxyde, peuvent aussi survenir (Abele et al., β00β). Cette réduction partielle d’oxygène dans la mitochondrie est due à la fuite d’électrons dans la chaîne respiratoire qui a lieu dans la membrane interne mitochondriale (fig.2).
Figure 2: Fuite d’électrons source de ROS au sein de la chaine de transport d’électrons
(D’après Ghouleh et al., β011) (UQ : Ubiquinone ; Cyt C : Cytochrome C)
ETUDE BIBLIOGRAPHIQUE Stress oxydant
10
Cette fuite se produit principalement au niveau des complexes I (NADH deshydrogénase) et III (ubiquinone – cytochrome c réductase), et mène à la production du radical superoxyde (O2•-), le précurseur des ROS (Turrens, 1997; McLennan et Degli Esposti, 2000).
Selon les sources, cette fuite d’électrons représente entre 0,1 et γ% du flux total de la chaine respiratoire (Beckman et Ames, 1998).
Peroxysomes
Les peroxysomes sont des organites intracellulaires catalysant des réactions essentielles pour la cellule comme la bêta-oxydation de certains acides gras et l’alpha-oxydation de l’acide phytanique. Toutes ces réactions d’oxydation conduisent à la production de peroxyde d’hydrogène (H2O2), neutralisé ensuite par la catalase peroxysomale (enzyme antioxydante)
afin de réaliser des réactions de peroxydation d'autres substrats (Schrader et Fahimi, 2004). Ces réactions sont importantes dans le processus de détoxification présent dans le foie et le rein. Seule une faible quantité d'H2O2 produit au niveau du peroxysome pourrait échapper à la
catalase (Dalle-Donne et al., 2006).
Réticulum endoplasmique
Le réticulum endoplasmique lisse contient des enzymes qui catalysent une série de réactions pour détoxifier les molécules liposolubles et d'autres produits métaboliques toxiques (Turrens et al., 1982 ; Freeman et al., 1983). La plus connue de ces enzymes est le cytochrome P450 qui oxyde les acides gras insaturés et les xénobiotiques, produisant ainsi des ROS (Morel et Barouki, 1999).
4.2. Sources exogènes
L’environnement dans lequel nous vivons tout comme notre mode de vie sont à l’origine d’une augmentation de la production de ROS dans notre organisme et sont générateurs du stress oxydant.
Les sources exogènes peuvent être représentées par des facteurs environnementaux, pollutions diverses, produits chimiques ainsi que des contaminations par des métaux lourds ou certaines carences nutritionnelles (Priyadarsini, 2005). Les nombreuses sources potentielles de ROS exogènes comprennent les radiations, les infections pathogènes, les herbicides, insecticides, les toxines, les UV et la fumée de cigarette (Kregel et Zhang, 2007).
ETUDE BIBLIOGRAPHIQUE Stress oxydant
11
5. Cibles biologiques des ROS
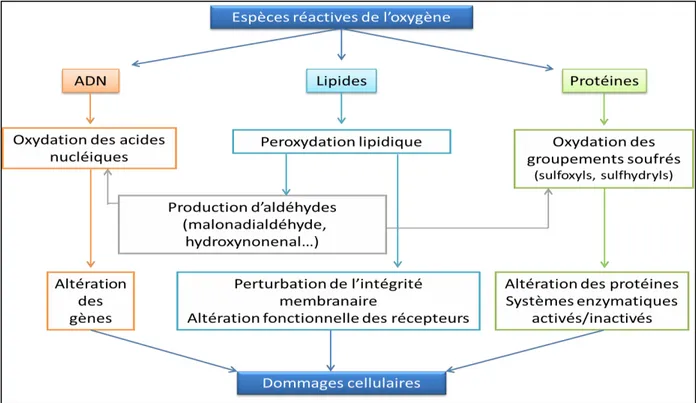
En plus des fonctions biologiques, la réactivité particulière des ROS ajoute des propriétés toxiques et diversifiées (Barouki, 2006 ; Valko et al., 2007). Le stress oxydatif dû aux radicaux libres, entraîne des dégâts tissulaires essentiellement (fig.3) par l’oxydation des protéines, de l’ADN ou des lipides (Laight et al., 2000).
5.1. Peroxydation lipidique
Les premières cibles privilégiées de l’attaque radicalaire sont les lipides et principalement leur acides gras polyinsaturés, qui sont très sensibles à l’oxydation en raison de leur degré élevé d’insaturation (Pamplona et al., 2000 ; Hulbertl, 2005).
La peroxydation lipidique (fig.4) se déroule en trois phases :
L’initiation : qui consiste en la rupture homolytique, occasionnée par un initiateur
radicalaire (tel que le radical hydroxyle OH•), d’une liaison C-H de la chaîne d’un acide gras, ce qui en fait un composé radicalaire (diène conjugué) très réactif vis-à-vis de l’oxygène et qui va donc se transformer en radical peroxyle (LOO•).
Figure 3 : Les différentes cibles des Espèces Réactives de l'Oxygène (D’après Monteil et
ETUDE BIBLIOGRAPHIQUE Stress oxydant
12
La propagation : au cours de laquelle le radical peroxyle va arracher un hydrogène à
un autre acide gras, créant un nouveau radical et entretenant ainsi une réaction en chaîne, pour se transformer en hydroperoxyde.
La terminaison : les hydroperoxydes peuvent subir plusieurs modes d’évolution, être
réduits et neutralisés par la glutathion peroxydase et la vitamine E intercalée dans la bicouche lipidiques des membranes (Luc et al., 1991 ; Halliwell, 1996 ; Favier, 2003), ou continuer à s’oxyder et à se fragmenter en produits secondaires c'est-à-dire en aldéhydes très réactifs, pouvant être considérés comme des messages secondaires toxiques qui augmente les dommages initiaux dus aux radicaux libres (Marnett, 1999).
Parmi les aldéhydes formés : l’isoprostane, le malondialdehyde (MDA) et le 4-hydroxynonénal (4- HNE), sont très étudiés comme marqueurs de la peroxydation lipidique. Les deux derniers produits (MDA, 4HNE) réagissent avec les protéines et l’ADN, une fois fixé à la molécule d’ADN, le MDA semble être le produit le plus mutagène, alors que le 4-HNE est le plus toxique pour la cellule (Marnett, 1999).
La peroxydation lipidique est suivie d’un changement structural des membranes biologiques (Pacifici et al., 1994) ou d’autres éléments contenant des lipides (Niki et al. 2005; Stark , 2005 ; Al-Mutairi et al., 2007). Ces perturbations fonctionnelles peuvent aboutir à la mort des cellules (Bonnefont-Rousselot, 1994).
ETUDE BIBLIOGRAPHIQUE Stress oxydant
13 5.2. Oxydation des protéines
De façon comparable à l'oxydation des lipides, les protéines sont aussi susceptibles d'être oxydées par les ROS. Ces réactions d'oxydation, fréquemment influencées par les cations métalliques comme le Cu2+ et le Fe2+, peuvent être classées en deux catégories : celles qui cassent les liaisons peptidiques et modifient la chaîne protéique et l’aures qui induire des modifications peptidiques par l'addition de produits issus de la peroxydation lipidique comme le 4-HNE. De telles modifications conduisent généralement à une perte de fonction catalytique ou structurale des protéines (Levine, 2002).
Les principaux marqueurs biologiques de l'oxydation des protèines sont les dérivés carbonylés. Ces derniers sont formés lorsque les espèces réactives de l'oxygénes attaquent les résidues d’acides aminés (Levine, β00β).
5.3. Oxydation de l’ADN
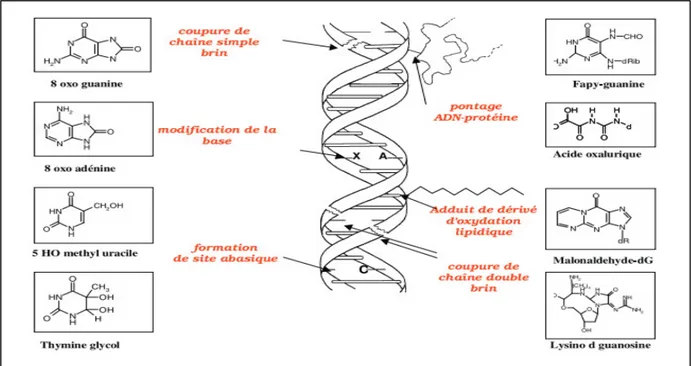
Les modifications induites par des processus oxydatifs dans le matériel génétique appartiennent à quatre catégories (fig.5): modifications des bases, cassures simples et doubles de la chaîne d’ADN, site abasiques et pontage avec les protéines (Hochberg et al., 2006).
Les ROS ont une grande affinité de réaction avec certaines bases constitutives de l’ADN particulièrement la guanine. Celle-ci est facilement transformée en 8-hydroxy-2- déoxyguanosine (8-OHdG), qui est normalement éliminée par des enzymes de réparation de l’ADN. Si ces enzymes sont défaillantes, la (8-OHdG) s’accumulera au sein de l’ADN causant ainsi des mutations (Borek, 1997).
Les aldéhydes réactifs issus de la peroxydation lipidique dont le MDA et le 4- HNE peuvent s’ajouter au groupe amine des bases de l’ADN et constituer ainsi une autre catégorie de dégâts oxydatifs de l’ADN (Marnett, 1999 ; Nair et al., 1999).
La formation de pontages covalents entre ADN et les protéines peut modifier l’expression des gènes et avoir ainsi de lourdes conséquences biologiques pour la cellule (Hochberg et al., 2006).
ETUDE BIBLIOGRAPHIQUE Stress oxydant
14
6. Antioxydants
L’organisme a développé des systèmes de défense très efficaces contre la production des espèces réactives de l’oxygène (ERO). Les molécules contrôlant cette production sont désignées par le terme « Antioxydant ».
6.1. Définition
Du point de vue biologique, les antioxydants sont toute substance qui, présente à faible concentration par rapport à celle du substrat oxydable, retarde ou inhibe significativement l’oxydation de ce substrat, et dont les produits de réaction avec l’oxydant ne sont pas toxiques (Durackova et al., 2008).
Cette définition fonctionnelle s’applique à un grand nombre de substances, comprenant des enzymes aux propriétés catalytiques spécifiques, mais aussi aux petites molécules hydro- ou liposolubles (Delattre et al., 2005). Cette grande variété physico-chimique autorise la présence d’antioxydants dans tous organismes, qu’ils soient intracellulaire, membranaires ou extracellulaires (Cano et al., 2006).
Figure 5 :Lésions de l’ADN formées par attaque radicalaire du patrimoine génétique des
ETUDE BIBLIOGRAPHIQUE Stress oxydant
15 6.2. Mode d’action des antioxydants
Indépendamment de leur localisation, les antioxydants peuvent agir à deux niveaux: en prévenant la formation de radicaux libres oxygénés ou en épurant les radicaux libres oxygénés. (Penna et al., 2009). En fait, en fonction de leur mécanisme d’action on distingue des antioxydants inhibiteurs des radicaux libres, décomposeurs des peroxydes, désactivateurs des ions métalliques, ou des piégeurs d’oxygènes (Dziezak, 1986; Yagi, 1970). En complément de ces mécanismes, l’organisme est en outre capable de réparer ou d’éliminer les molécules endommagées par l’attaque radicalaire (Penna et al., 2009).
6.3. Les systèmes de défense antioxydants
Les systèmes antioxydants présents dans l'organisme sont, soit d'origine endogène, soit exogène. On distingue également les antioxydants enzymatiques des antioxydants non enzymatiques (Niki, 2010). Les antioxydants peuvent donc être produits de façon endogène ou provenir de sources exogènes, comme l’alimentation ou les suppléments antioxydants (Vertuani et al., 2004).
6.3.1. Les systèmes antioxydants enzymatiques
Les systèmes antioxydants enzymatiques sont d'origine endogène. Ces différentes enzymes sont en interrelation dans la régulation du stress oxydant intracellulaire (Matés et al., 1999). Les enzymes antioxydantes sont les premières lignes de défenses contre les entités oxydantes. Leur rôle est de diminuer la quantité de ROS présentes dans la cellule. Parfois ces enzymes nécessitent des oligo-éléments (Cu, Zn, Mn, Se, Fe) comme cofacteurs pour pouvoir exercer leur activité enzymatique.
Les principales enzymes antioxydantes sont la superoxyde dismutase (SOD), la catalase (CAT) et la glutathion peroxydase (GPx) (Garrel et al., 2007). Ces enzymes ont une action complémentaire (fig.6) sur la cascade radicalaire au niveau de l’O2•- et du H2O2, conduisant
finalement à la formation de l’eau et de l’oxygène moléculaire (Lehucher-Michel et al., 2001). La Superoxyde dismutase (SOD)
La SOD est une enzyme essentielle de défense contre les ERO. Elle est capable de transformer par dismutation de l'anion superoxyde, première espèce toxique en une molécule d'oxygène et de peroxyde d'hydrogène qui est beaucoup moins réactif (Zelko et al., 2002).
ETUDE BIBLIOGRAPHIQUE Stress oxydant
16
2O2 •- + 2H+ H2O2 + O2
Le mécanisme réactionnel est catalysé par un métal situé au centre de l’enzyme dont la nature permettra de distinguer les superoxydes dismutases à manganèse (MnSOD) protégeant la mitochondrie, des superoxydes dismutases à cuivre-zinc protégeant le cytosol (cCu-Zn SOD), la face externe de la membrane des cellules endothéliales (ecCu- Zn SOD) ou le plasma sanguin (pCu-Zn SOD) (Favier, 2003).
Cependant, le peroxyde d’hydrogène généré par les SODs est notamment impliqué dans la réaction de Fenton qui produit un radical très réactif, le radical hydroxyle (OH•). Ainsi, le
peroxyde d’hydrogène est détoxifié par une seconde ligne de défenses composée d’autres enzymes telles que la catalase et la glutathion peroxydase (GPx) (Ganther, 1999).
La Catalase (CAT)
La catalase ou CAT est une enzyme tétramérique contenant un groupe hème qui catalyse, d’où son nom, la décomposition du peroxyde d’hydrogène en eau et en dioxygène, selon la réaction suivante :
La catalase est présente dans de nombreux tissus mais son activité est particulièrement abondante dans les globules rouges, le foie et les reins. Par ailleurs, la catalase joue un rôle important dans la détoxication de H2O2 dans les peroxysomes (Schrader et Fahimi, 2006).
À haute concentration, le H2O2 intracellulaires entraîne une activation préférentielle de la
catalase tandis que de très faibles concentrations seraient préférentiellement prises en charge par la GPx (Pamplona et Costantini, 2011).
SOD
Catalase
ETUDE BIBLIOGRAPHIQUE Stress oxydant
17
La Glutathion peroxydase (GPx) et reductase (GR)
La glutathion peroxydase ou GPx est une enzyme tétramérique permettant également la décomposition du H2O2. Elle agit plus lentement que la catalase mais elle a une meilleure
affinité pour le H2O2 que cette dernière. La GPx est donc essentielle à la décomposition du
H2O2 produit de manière continue et à des niveaux physiologiques dans la cellule.
Les GPx sont des enzymes sélénium-dépendantes ou sélénium-indépendantes et sont soit cytosoliques, comme c’est le cas de la première GPx identifiée (Mills, 1957), soit extracellulaires. Les GPx permettent la décomposition de H2O2 par l’oxydation de son
co-substrat le glutathion réduit (GSH) en glutathion oxydé (GSSG) qui sera réduit par la suite par l’action de la glutathion réductase.
La glutathion réductase ou GR n’est pas une enzyme antioxydante à proprement parler dans le sens où elle n’a pas d’action directe sur les ROS. En revanche, elle a un rôle très important dans la réduction du glutathion, puissant antioxydant et co-substrat de la GPx.
En effet, le fonctionnement de la GPx nécessite un flux de glutathion recyclé par la coopération de plusieurs enzymes dont la glutathion réductase (GR) qui réduit le glutathion
GPx
Figure 6 : Représentation schématique des mécanismes de défenses enzymatiques
antioxydantes (Mate et al., 1999).
ETUDE BIBLIOGRAPHIQUE Stress oxydant
18
oxydé en consommant du NADPH, lui-même régénéré grâce à la glucose 6 phosphate deshydrogénase (G6PDH) alimentée par le shunt des pentoses phosphates (fig.6) (Mate et al., 1999).
Les GPx permettent aussi la détoxication des cellules de certains hydroperoxydes (ROOH) qui sont les ROOH des esters de cholestérol, des phospholipides des membranes cellulaires, des lipoprotéines et de l’ADN (Delattre et al., β005 ; Schrader et Fahimi, 2006 ; Valko et al., 2007). Ces hydroperoxydes vont alors se transformer en alcools (ROH) selon la réaction suivante (Halliwell et Gutteridge, 2008) :
2 GSH + ROOH GSSG + ROH + H2O
6.3.2. Les systèmes antioxydants non enzymatiques
Les systèmes antioxydants non enzymatiques sont des nutriments naturellement apportés par l’alimentation (exogéne) ou par des composés endogènes. Ils peuvent avoir un rôle de «
scavenger », c’est à dire qu’ils ont la capacité de piéger les entités oxydantes en captant leur électron libre et en formant ainsi des entités plus stables qui pourront être éliminées par d’autres systèmes antioxydants.
6.3.2.1. Antioxydants non enzymatiques endogènes
Ce groupe d’antioxydants renferme de nombreuses molécules endogènes synthétisées par les cellules (glutathion, l’acide urique, la bilirubine) dont la plus importante est le glutathion réduit GSH (Tang et al., 2006 ; Menon et Goswami, 2007).
Le Glutathion (GSH)
Le glutathion est un tripeptide, formé par la condensation d'acide glutamique, de cystéine et de glycine : -L-Glutamyl cystéinyl glycine (fig.7). Il est principalement synthétisé par le foie et représente le premier système de défense antioxydant non enzymatique des cellules (Yu et al., 2003).