Université de Montréal
ÉVALUATION DES EFFETS D’UNE DIÈTE FAIBLE EN PHOSPHORE SUR LE SYSTÈME IMMUNITAIRE DE L’OMBLE DE FONTAINE
(SALVELINUS FONTINALIS) EN CONDITION DE PISCICULTURE
Par
VALÉRIE GIRARD
Département de pathologie et microbiologie faculté de médecine vétérinaire
Mémoire présenté à la Faculté des études supérieures en vue de l’obtention du grade
Maître ès sciences (M.$c.) en sciences vétérinaires option microbiologie ,/Grade Conféré\ avril 2006 © Valérie Girard, 2006
C9
o7
In
-i
Direction des bibliothèques
AVIS
L’auteur a autorisé l’Université de Montréal à reproduire et diffuser, en totalité ou en partie, par quelque moyen que ce soit et sur quelque support que ce soit, et exclusivement à des fins non lucratives d’enseignement et de recherche, des copies de ce mémoire ou de cette thèse.
L’auteur et les coauteurs le cas échéant conservent la propriété du droit d’auteur et des droits moraux qui protègent ce document. Ni la thèse ou le mémoire, ni des extraits substantiels de ce document, ne doivent être imprimés ou autrement reproduits sans l’autorisation de l’auteur.
Afin de se conformer à la Loi canadienne sur la protection des renseignements personnels, quelques formulaires secondaires, coordonnées ou signatures intégrées au texte ont pu être enlevés de ce document. Bien que cela ait pu affecter la pagination, il n’y a aucun contenu manquant.
NOTICE
The author of this thesis or dissertation has granted a nonexciusive license allowing Université de Montréal to reproduce and publish the document, in part or in whole, and in any format, solely for noncommercial educational and research purposes.
The author and co-authors if applicable retain copyright ownership and moral rights in this document. Neither the whole thesis or dissertation, nor substantial extracts from it, may be printed or otherwise reproduced without the author’s permission.
In compliance with the Canadian Privacy Act some supporting forms, contact information or signatures may have been removed from the document. While this may affect the document page count, it does not represent any loss of content from the document.
Ce mémoire intitulé
Évaluation des effets d’une diète faible en phosphore sur le système immunitaire de l’omble de fontaine (SctÏvetinusfontinaÏis) en condition de pisciculture
présenté par
VALÉRIE GIRARD
a été évalué par un jury composé des personnes suivantes
Pierre Hélie, président-rapporteur Khyali Ram Mittal, directeur de recherche
F. Cari. Uhiand. codirecteur Serge Messier, codirecteur Michel Fournier, membre du jury
Les pisciculteurs doivent maintenant se soumettre à des normes environnementales strictes pour limiter les rejets à l’origine de l’eutrophisation. Le phosphore, principal responsable de ce type de pollution nutritionnelle en eau douce, est un nutriment essentiel et doit obligatoirement se retrouver dans l’alimentation. Une diète faible en phosphore peut aider les pisciculteurs à répondre aux normes environnementales, mais peut aussi avoir des conséquences sur les différentes fonctions biologiques des poissons. Dans cette étude expérimentale, le suivi général de l’état de santé d’un groupe d’ombles de fontaine (SalveÏirnts fontinaÏis) nourri avec une moulée équilibrée en phosphore (Normo-P) a été comparé à un groupe nourri avec une moulée déficiente en phosphore (Low-P) sur une période de $ mois. La réponse immunitaire cellulaire a été évaluée par la phagocytose et la transformation lyrnphoblastique. La résistance aux infections causées par la bactérie Aerornonas saïrnonicida, responsable de la furonculose, a également été examinée chez les deux groupes. Nos résultats démontrent que les poissons Low-P ont accumulé plus de graisse abdominale et que quelques individus ont développé des déformations squelettiques typiques de ce genre de déficience. Les taux de phagocytose ont tendance à être pius élevés chez les Low-P mais les différences entre les deux groupes ne sont pas statistiquement significatives. Il n’y a pas eu de prolifération des lymphocytes B et T en présence de mitogènes lors de la transformation lymphoblastique. Le pourcentage de survie, lors des essais infectieux, est légèrement supérieur chez les Low-P mais les différences ne sont pas statistiquement significatives entre les deux groupes. L’atteinte de la maturité sexuelle durant l’essai nutritionnel et certains stress chroniques reliés aux conditions d’élevage ont influencé les paramètres immunologiques examinés dans cette étude.
Mots clés :
phagocytose, transformation lymphoblastique, omble de fontaine, Aeromonas saïmonicicla, infections expérimentales, facteurs de stress, cortisot, phosphore,In order to comply with new environmental regulations regarding eutrophication, fish fanriers must limit nutrient inputs to water. In freshwater, phosphorus is the principle cause of excess plant and algal proliferation. This essential nutrient is flot synthesised by organisms such as fish and must therefore be ingested through food. A diet low in phosphorus may help to reduce waste from fish farming but it can have negative impacts on several biological functions in fish. In this experimental study, a group of brook trout ($aÏvelirntsfontinalis) fed with a balanced diet (Normo-P) was compared to another group fed with a phosphorus deficient diet (Low-P) for $ months. General health, immune response and resistance to disease were compared between groups of fish. Phagocytosis and lyrnphoblastic transformation were considered to evaluate the cellular immune response, and challenge trials with the bacterium Aeroinonas salnzonicida, the cause of furunculosis, were conducted to examine the resistance of fish to disease. Our resuits show that Low-P fishes had greater arnounts abdominal fat than Normo-P fishes and a small percentage developed spinal deformations typically associated with a phosphorus deficient diet. Phagocytosis tended to be higher in the Low-P group, but it was flot statistically significant. No proliferation of T or B ceils was observed afier exposure to mitogens in the blastogenic assays. In bacterial challenges, there was no statistically signfficant difference in survival between both groups of fish, although Low-P fishes seemed to be slightly more resistant to infection afier two weeks of observation. The immunological parameters investigated in this study may have been affected by chronic stress associated with the development of sexual maturity and fish maintenance during the nutritional phase.
Key words:
phagocytosis, lyrnphoblastic transformation, brook trout, Aeromonas saÏmonicidct, bacterial challenge, stress factors, cortisol, phosphorus, diet, sexual maturityTable des matières
Résumé iii
Abstract iv
Tabledes matières y
Listedes tableaux viii
Listedes figures ix
Listedessigles etdesabréviations__________________________________________________x
Introduction 1 Problématique 1 Hypothèsede recherche 2 Objectifs de recherche 3 Recensioit de latittératttre____________________________________________________________4 Le phosphore 4 Origine 4 Aspects abiotiques 4 Utilisations commerciales 4 Aspects biotiques 5
Absorption et excrétion du phosphore 6
Carenceenphosphorechezlespoissons 7
Phosphore d’origine végétale________________________________________________________________ 7
Phosphore d’origine animale $
Eutrophisation 9 Causes et conséquences 9 Processus d’eutrophisation 9 Omble de fontaine 10 Synonymes______________________ 10 Taxinomie 10 Identification 10
Distribution mondiale et habitat naturel_____________________________________________________________ 11 Importance économique au Québec_______________________________________________________ 12
La furonculose 13
L’agent pathogène__________ 14
Facteurs de virulence 14
La maladie 15
Signes cliniques 16
Formesous-cliniqueoulatente 16
Transmission 17
Système immunitaire des poissons 17
Organes et cellules 17
Rein 18
Thymus 18
Rate 19
vi
Immunitéinnée 20
Immunité humorale non spécifique 20
Immunitécellulairenonspécifique 21
Immunitéacquise 21
Immunité humorale spécifique 22
Immunité cellulaire spécifique__________________________________________________________________ 22
Nutrition etimmunité 24
Régulation des besoins en minéraux chez les poissons 24 Effets des carences alimentaires sur le système immunitaire des poissons 25 Effets des carences en phosphore sur le système immunitaire________________________________________ 26
Méthodologie 28
Essai nutritionnel 2$
Espèce utilisée et design expérimental__________________________________________________________ 28 Bassins et systèmes du LARSA_____________________________________________________________ 29
Diètes expérimentales 29
Protocoled’alimentation 30
Procédures pourtests immunitaires 31
Milieux de culture 3 1
Echantillonnage 3 I
Euthanasie 3 I
Peséeet prélèvementsanguin 32
Prélèvement d’organes et identification du sexe 32 Dénombrement cellulaire et contrôle de la viabilité 33
Tests immunologiques 33 Phagocytose 33 Transformation tymphoblastique 34 Infectionsexpérimentales 35 Installations 35 Souches bactériennes 36 Suspension bactérienne 36
Période d’adaptation initiale 37
Pré-essai #1 37
Pré-essai #2 3$
Infection #l 3$
Infection #2 39
Infection #3 40
Autopsiedespoissonssuites aux infections 40
Analyses statistiques 40
Résultats 42
Essainutritionnel 42
Les diètes expérimentales 42
Période d’alimentation_____________________________________________________________________ 42
Evolutiondupoids des poissons 43
Effetdupoidssur lasurvie despoissons 44
Observations durantl’essai nutritionnel 46
Tests immunologiques 47
Viabilité cellulaire 47
Phagocytose 47
vii
Essais infectieux 51
Confirmation de la présence d’Aeromonas sa/,nonicida 51 Effet de la moulée expérimentale sur la survie des poissons 52 Effet de la moulée expérimentale dans la première semaine de l’infection 53 Effet du sexe sur la survie des poissons 54
Discttssion 56
Diète expérimentale 56
Déficience en phosphore et poids des poissons 57
Déficience en phosphore et masse graisseuse 59
Vitamine D et phosphore 61
Déformations osseuses 62
Déficience en phosphore et maturité sexuelle 63
Modifications au protocole affectant les paramètres immunologiques 65
Interaction entre le système immunitaire et endocrinien 66
Transformation lymphoblastique 67
Phagocytose 69
Infections expérimentales 70
Confirmation des mortalités 71
Survie aux infections 72
Conclusions 74 Perspectives____________________ 76 Bibliographie 77 Sites interitet_____________________ 91 Annexe 1 xvi Annexe 2 xvii Aititexe 3 xviii Annexe 4 xix Aititexe 5 xx Annexe 6 xxi Aintexe 7 xxii
Tableau I Dates importantes des procédures expérimentales effectuées durant l’essai
nutritionnel. 43
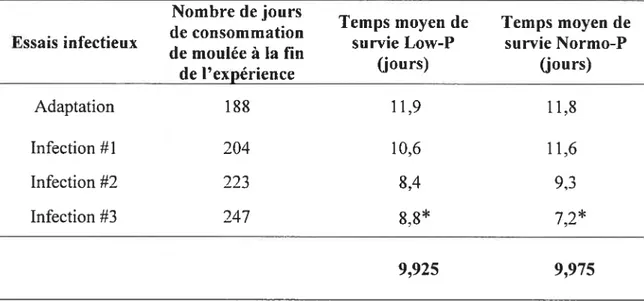
Tableau II Temps de survie moyen des ombles de fontaine selon le type de moulée et la durée de consommation durant les infections expérimentales. 53
Liste des figures
Figure 1 Omble de fontaine 11
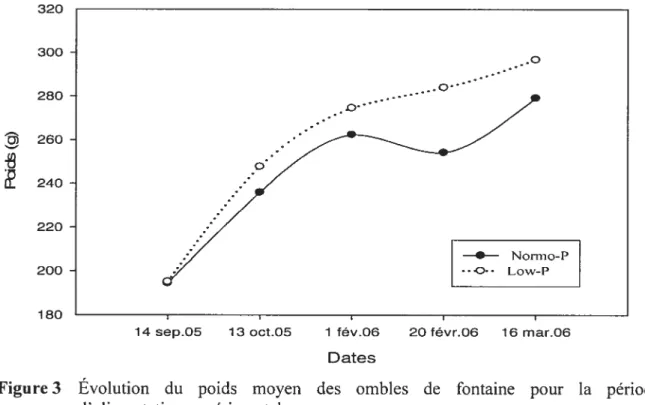
Figure 2 Distribution sommaire de l’omble de fontaine indiquée par les zones rouges (carte interactive sur le site web http://www.iobis.org/Welcome.htm). 12 Figure 3 Évolution du poids moyen des ombles de fontaine pour la période
d’alimentation expérimentale. 44
f igure 4 Effet du poids sur la survie des poissons lors des infections avec la bactérie
Aeroinonas saÏmonicida. 45
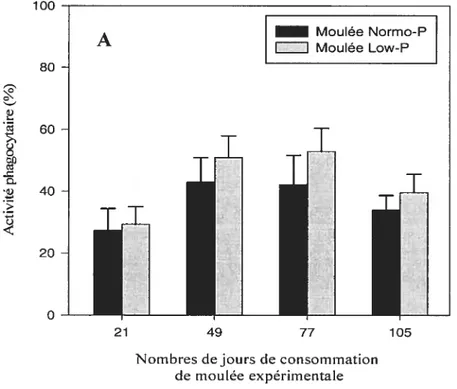
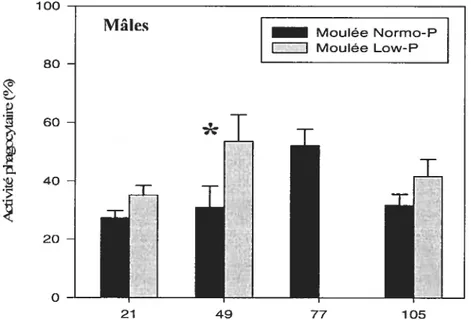
figure 5 Activité phagocytaire (A) et efficacité phagocytaire (B) des cellules du
pronéphros à différentes étapes de l’essai nutritionnel. 49 figure 6 Activité phagocytaire des cellules du pronéphros chez les poissons mâles et
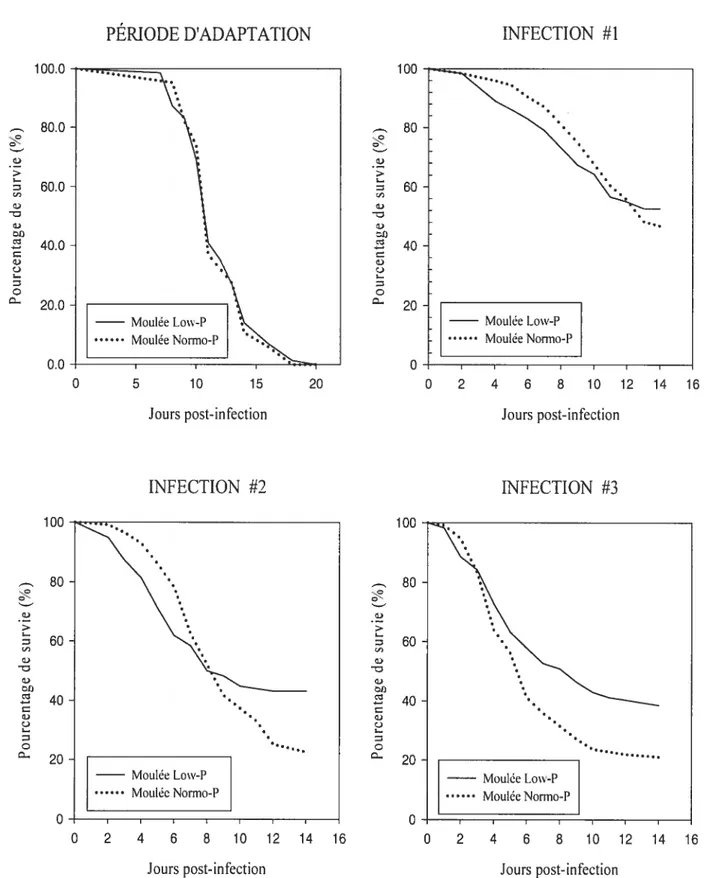
femelles à différentes étapes de l’essai nutritionnel. 50 Figure 7 Effet du type de moulée sur la survie des poissons Low-P et Nonno-P en
période d’adaptation et lors des infections avec la bactérieAeromonas
saÏrnonicida. 55
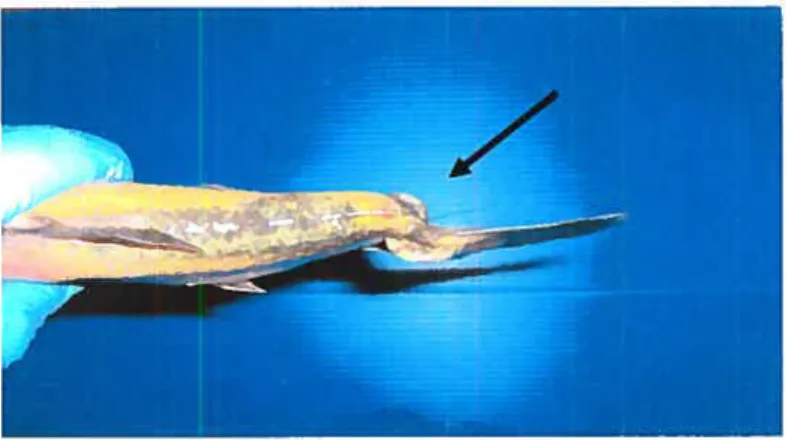
Figure $ Omble de fontaine Low-P à l’abdomen distendu par l’accumulation de
graisse. 60
figure 9 Déformation « curled spine » ou« phosphatic curl » typique d’un omble de
Ac : Anticorps
ADN: Acide désoxyribonucléique
Ag: Antigène
APP : A ente phase proteins / protéines de phase aigu
ARN: Acide ribonucléique
ARNm: Acide ribonucléique messager
Ass: Aeromonas saïmonicida sotis-espèce saïmonicida
ATP: Adénosine triphosphate
BALT: Bronchus-ctssociated lympÏzoid tissue!tissu lymphoïde associé attx bronches BCR: B ccli receptor / récepteur des lymphocytes B
BGG: Bovinegammaglobulin! gammaglobuline bovine BKD: BacteriaÏ kidney disease / maladie bactérienne du rein
C: Carbone
Degrés Celsius
Ca: Calcium
CaHPO4 2H20: Phosphate de calcium dibasique
CCPA: Conseil canadien de protection des animaux CF: Chiiniotaxisfactors / facteurs de chimiotaxie cfu: Cotonyforming unit / unité formant des colonies
cm: Centimètre
CMH: Complexe mai eur d’ histocompatibilité
ConA: Concanavaline A
CPA: Cellules présentatrices d’antigène
DM : Dry inatter/ matière sèche
DPM: Désintégration par minute
fCR: feed conversion ratio / ratio de conversion alimentaire
g: Gramme
GALT: Gut-associated/vinpoid tissue ! tissu lymphoïde associé au tube digestif GCAT: Glycérophospholipide cholestérol acyltransférase
Tritium
IAF: Institut Armand-Frappier
IBP: fron bindingproteins / protéines se liant au fer
IFN: Interféron
1g: Immunoglobuline
IL: Interleukine
TNRS: Institut national de la recherche scientifique
IP : Intrapéritonéal
IS: Index de stimulation
Kg: Kilogramme
L : Litre
Low-P: faible en phosphore
LPS: Lipopolysaccharides
Mètre cube
MAF : Macrophctge activation factor / facteur d’activation des macrophages
mg: Milligramme
MIF: Migration inhibitoryfactor / facteur d’inhibition de la migration
MJ: Mégajoule
mL : IVIillilitre
MS-222: Tricaïne méthane-sulfonate
N: Azote
NaPi2: Co-transporteur de sodium phosphate
NCC : Nonspecific cytotoxic celis / cellules cytotoxiques non spécifiques NK: Natural killer celis / cellules tueuses
nm: Nanomètre
Normo-P: Équilibré en phosphore
OTC: Oxytétracycline
P: Phosphore
PAMs: Peptides anti-microbiens
PBS : Phosphate btffered saline / saline de phosphate tamponnée
PHA: Phytohemagglutinine
PMN: Cellules polymorphonucléées
P043: Phosphate
PWM: Pokeweed mitogen / mitogène de la phytolaque
RIA: Radioimmunoassay/ essai radioimmunologique
RPM: Rotations par minute
SALI: $kin-associated lympoid tissue / tissu lymphoïde associé à la peau
SN: Souche naturelle
$pp: Sous-espèce
SS: Souche standard
ST: Sérum de truite
SVf: Sérum de veau foetal
TCR: T celÏ receptor / récepteur des lymphocytes I
1GFf3: Transforming growthfactor
fi
/ facteur de croissance transformantf3
TNF: Tztmor necrosisfactor / facteur de nécrose tumoraleISA: Trypticase soy agctr / gélosetrypticase soja
ISB: Trypticase soy broth / bouillon trypticase soja
tCi: Microcurie
UI: Unité internationale
LL : Microlitre
Micromètre
À
Guillaume Levesque, grâce à qui cette expérience a étépossible, supportable et même agréable!!!
À
Ninou,• Pour m’avoir fait confiance du début à la fin, pour m’avoir fait découvrir les «poissons» sous un autre angle, pour m’avoir fait connaître des gens de plein de milieux et pour avoir supporté mes crises d’angoisse, je remercie sincèrement mon codirecteur le Dr Cari Uhland.
• Pour son implication et son support lorsque
j
‘en avais de besoin, je remercie le Dr Serge Messier, mon autre codirecteur.• Pour toutes les choses non dites qui veulent dire beaucoup, je remercie mon directeur, le Dr Khyali Ram Mittal.Nwnaste!
• Pour les nombreuses précisions et judicieux conseils, son aide inestimable, son appui, pour avoir pu discuter «poissons» avec elle, je remercie Marlène Fortier, agente de recherche au laboratoire d’écotoxicoiogie de Michel Foui-nier à l’LNRS Institut Armand-Frappier de Pointe-Claire à Montréal. C’est aussi grâce à elle que
j
‘ai connu Claire Dautremepuits et Sophie Gauthier-Clerc qui ont partagé avec moi leur savoir immunologique des animaux aquatiques.• Pour m’avoir accueilli dès le début comme sa collègue de travail mais aussi comme son amie, pour avoir partagé avec moi ses expériences professionnelles et personnelles, pour m’avoir hébergée et nourrie pendant mes séjours à Québec, je remercie Émilie Proulx, agente de recherche pour le Dr Grant Vandenberg au département de sciences animales de l’Université Lavai et son copain Yannick. • Pour le partage de ses connaissances biologiques et son aide irremplaçable, je
remercie Patrick Cejka de la Station d’épuration des eaux usées de Montréal.
• Parce qu’ils m’ont donné ma première chance en recherche et qu’ils ont toujours cru que j’étais capable peu importe où j’allais, je remercie Alexandre Poulain et Marc Amyot, sans oublier Dominique Bélanger, Phanie, Vergene, Édenise, Bastoche, Malorie du département de sciences biologiques de l’UdM.
• Pour sa contribution au projet en me laissant libre accès à ses ressources humaines (Marlène!!) et matériel (labo), pour m’avoir mis en contact avec Patrick Cejka et pour avoir accepté d’être membre de mon jury, merci spécial à Michel f oui-nier de 1’INRS-IAF de Montréal.
• Pour avoir été la référence en matière de nutrition chez les poissons et pour m’avoir ouvert les portes de l’Université Lavai à Québec, je tiens à remercier chaleureusement le Dr Grant Vandenberg.
Et finalement, remerciements sincères à mes parents. à toute l’équipe du laboratoire de bactériologie de la FMV, à Guy Beauchamp (statistiques), Jean-Christophe Therrien, Joanne Keays et Serge Higgins du LARSA, StéFanie Cardin, Kathleen Brown, Annie Desmeules, Jessica Michaud, Cécile Aenishaenslin, Gabriel Koffi D. KOKO, Dre Lucie Verdon, Dre Ann Letellier, Dre Josée Harel (pour le local de radioactivité), Louis Sénécal (posters), merci à l’équipe de FUQROP et celle du département de médecine zoologique de laFMV.
Problématique
L’aquaculture est une industrie en développement qui s’intensifie et se spécialise afin de répondre à la demande croissante des consommateurs pour les organismes aquatiques (FAQ, 2003). Par conséquent, les producteurs vont favoriser l’élevage d’espèces les plus en demande et correspondant à une plus grande valeur économique. Les salmonidés, grande famille piscicole comprenant les truites, les saumons et les ombles composent une grande partie de ce type élevage au Canada (MPO, 2005) et particulièrement au Québec (Morin, 2004). Afin d’obtenir une croissance maximale des poissons, les pisciculteurs vont utiliser des diètes riches contenant certains nutriments en excès. Le rejet de ces nutriments non assimilés par les poissons est à l’origine d’un enrichissement excessif des plans d’eau, phénomène que Von appelle eutrophisation (MAPAQ, 2005). En temps normal, le phosphore, l’azote et dans une moindre mesure le carbone, sont les éléments limitants de la croissance des végétaux dans les milieux aquatiques. Leur présence en excès, particulièrement le phosphore en eaux douces, est la cause principale de ce type de pollution nutritionnelle provoquant la prolifération massive de plantes et de cyanobactéries indésirables (Coiiel, 199$). Pour cette raison, les producteurs doivent maintenant se soumettre à des normes environnementales strictes (MEF, 199$; MAPAQ. 2004) pour limiter les rejets de leur pisciculture tout en maintenant le volume et la qualité de leur élevage.
Le phosphore est un oligoélément essentiel. Il n’est pas synthétisé par l’organisme et doit obligatoirement se retrouver dans l’alimentation. Les effets d’un déficit en phosphore sur la diminution du développement osseux et le métabolisme animal sont bien documentés (Labbé, 1933; Demolon, 1949; Dernolon, 1961, Compère, 1967). Chez les poissons, ces effets sont bien connus (Ketola, 1975; Rodehutscord, 1996; Baeverfjord, 199$) et la diminution de la réponse immunitaire humorale et cellulaire suite à une carence nutritionnelle générale l’est également (Blazer, 1984ab; Blazer, 1989; Blazer, 1992; Olivier, 1997). Par contre, les études piscicoles portant spécifiquement sur les effets d’une
déficience en phosphore sur le système immunitaire sont rares (Eya, 199$; Jokinen, 2003; Sugiura, 2004).
Chez les poissons, les résultats obtenus d’une étude chez une espèce ne peuvent souvent pas être extrapolés à toutes les espèces parce que les poissons sont un groupe plus hétérogène que les mammifères et que des différences majeures peuvent exister au niveau du système immunitaire entre et dans chaque classe (Douglas, 1990). En effet, la phylogénie des poissons débute avec les agnathes ou poissons sans mâchoire tel que les lamproies, se poursuit avec les chondrichtyens ou poissons au squelette cartilagineux comme les requins et les raies et se termine avec les téléostéens ou poissons au squelette osseux dont font partie les salmonidés (Tizard, 2000). Cette évolution des espèces amène une complexification du système immunitaire commençant par le développement des organes lymphoïdes et hématopoïétiques. De plus, le biotope des espèces incluant des facteurs comme la température, la salinité de l’eau et la profondeur habitée ainsi que les comportements saisonniers ou de migration vont directement agir sur le type de réponse immunitaire en modulant des adaptations physiologiques et comportementales.
L’étude suivante a été réalisée dans un contexte de nutrition en relation avec le système immunitaire et la spécificité des expérimentations adaptées aux poissons, plus précisément les salmonidés. Une diète faible en phosphore peut possiblernent aider les pisciculteurs à répondre aux normes environnementales, mais peut aussi avoir des conséquences sur les différentes fonctions biologiques des poissons, entraînant ainsi une diminution de la rentabilité des élevages se traduisant par la perte de cheptels malades et par l’utilisation accrue d’antibiotiques. Ce projet de recherche fait parti du Programme Coopératif de Recherche et de Développement en Aquaculture (PCRDA) et de la Stratégie de développement durable pour l’aquaculture en eau douce (STRÀDDAQ).
Hypothèse de recherche
Une diète faible en phosphore administrée à l’espèce $aÏveÏinus fontinaÏis entraînerait une diminution de la réponse immunitaire cellulaire, contribuant ainsi à une susceptibilité accrue à la bactérie Aeromonas saÏrnonicidct.
Objectifs de recherche
Afin de mieux comprendre les conséquences d’une diète faible en phosphore sur les fonctions biologiques, nous proposons dans cette étude de comparer certains aspects du système immunitaire chez un groupe d’ombles de fontaine (SaÏvelinusfontinaÏis) alimenté avec une diète normale par rapport à un groupe alimenté avec une diète faible en phosphore. Pour ce faire, nous avons développé les objectifs spécifiques suivants:
> faire un suivi de santé générale (activité, morphologie, anormalité, mortalité) du groupe nourri avec une diète faible en phosphore par rapport au groupe nourri avec une diète normale.
Comparer la réponse immunitaire cellulaire par l’activité phagocytaire et la transformation lymphoblastique chez les deux groupes.
> Comparer la résistance à la furonculose suite à des infections expérimentales avec la bactérie Aerornonas saïrnonicida à la fin de l’essai nutritionnel.
Ce document présente d’abord une revue de littérature appuyant les principaux concepts abordés dans l’introduction. Par la suite, le matériel utilisé et les méthodes employées seront décrits en détail. Enfin, les sections « Résultats » et « Discussion » permettront de tester l’hypothèse.
Le phosphore
Origine
Le phosphore a été découvert en 1667 par un alchimiste allemand du nom de Henning Brand qui cherchait dans l’urine humaine une substance capable de transformer les métaux en or (Sugiura, 2004). C’est au début du XVffle siècle que Johann Kunckel réussi à extraire du phosphore des os et à la fin du même siècle que Cari Wilhelm Scheele met au point un procédé efficace d’extraction à partir des os calcinés. Il faut attendre en
183$ pour qu’il y ait préparation et extraction à une échelle industrielle. Aspects abiotiques
Le phosphore, symbole P et numéro atomique 15 du tableau périodique, est le 1I’
élément le plus abondant de la croûte terrestre (0,12%). Il est retrouvé sous plusieurs formes ayant des propriétés physiques différentes mais gardant des propriétés chimiques identiques. En effet, vu sa grande réactivité à l’air et aux autres composés oxygénés, le phosphore ne se retrouve jamais à l’état brut. En présence d’oxygène, le phosphore se consume en émettant une lumière brillante d’où le terme «phosphorescence» qui décrit une substance qui brille dans le noir sans combustion. Le mot phosphore vient du grec phôs désignant « lumière» etphoros désignant « porteur» (Larousse, 1996).
Utilisations commerciales
Le phosphore est utilisé de façon commerciale dans la production d’engrais, dans la fabrication d’allumettes et de feux d’artifice et comme composant des détergents à lessive. Certains de ses isotopes, 32P et 33P, émettent des radiations
F3
et sont utilisés dans les laboratoires de recherche pour le marquage et le séquençage de l’ADN. Le phosphate de calcium provenant des cendres osseuses sert à la fabrication de porcelaine de chine et est employé dans la poudre à pâte. Le phosphore peut également être utilisé comme arme chimique et comme matériel militaire.Aspects biotiqiies
Le phosphore est un élément essentiel pour toutes formes de vie sur terre. Il s’y retrouve principalement sous forme de phosphate cest-à-dire un atome de phosphore et quatre atomes d’oxygène (P043). Il entre dans la composition de nombreuses enzymes et joue un rôle clé dans la couche bilipidique des membranes cellulaires par la présence des phospholipides. Dans la structure des acides nucléiques, il se lie au ribose (pour l’ARN) ou au désoxyribose (pour l’ADN) pour former un nucléotide à l’ajout d’une base azotée variable. C’est la répétition phosphate-sucre qui forme le squelette du polymère (Karp, 199$). Plusieurs processus cellulaires utilisent le phosphate comme source d’énergie via la coenzyrne adénosine triphosphate (ATP). En fait, ce sont les liaisons anhydrides dacide qui lient les groupements phosphates qui sont riches en énergie et qui créent ainsi les réserves de la cellule (Eckert, 1999). Le phosphore est également très important au niveau du système de tampon phosphate qui permet de maintenir le pH interne des cellules et de l’équilibre phospho-calcique sanguin (Lall, 1989; Karp, 199$).
En plus de sa participation dans un grand nombre de phénomènes biologiques, le phosphore tient un rôle principal dans la formation et le maintient des os et des dents chez les vertébrés et dans la composition des coquilles de mollusques. Sous l’action de la vitamine K et en association avec les vitamines A et D, les phosphates complexés au calcium sous forme d’hydroxyapatite (sel inorganique), s’intègrent à l’ostéocalcine des structures osseuses et supportent la croissance des tissus durs (Eckert, 1999). Les os de poissons contiennent de l’hydroxyapatite à un ratio CaJP de 5:3 ou encore un mélange hydroxyapatite/phosphate de calcium à un ratio CaJP de 3:2 (Baeverfjord, 1998). L’homéostasie du phosphore est contrôlée à trois niveaux : la résorption des réserves osseuses, l’absorption intestinale et la conservation au niveau des reins, chez les poissons comme chez les vertébrés supérieurs (Vielma 1998. Jokinen 2003).
Absorption et excrétion du phosphore
La vitamine D, en plus d’être un modulateur important de l’homéostasie du calcium, est étroitement reliée à l’absorption et l’excrétion du phosphore. Une hypophosphatémie augmente la vitamine D3 active (Engstrom, 1985; Kegley, 2001; site web de ULg). Les formes actives de la vitamine D3 se présentent sous différents métabolites dont le calcitriol, le calciférol, cholecalciférol ou la la,25 dihydroxyvitamine D3 (1-25 (OH)2 D3) en réserve dans le foie et les reins. Cette dernière est la forme la plus biologiquement active et responsable de Faction hormonale de la vitamine D (Coloso, 2003). La vitamine D fait partie du groupe de lipide des stérols (stéroïdes) et est liposoluble. Chez les truites, elle est faiblement synthétisée et est donc requise dans l’alimentation à raison de 2,400 UIIKg d’aIient (Coloso, 2003). Dans les reins, la vitamine D3 augmente la réabsorption tubulaire du calcium et du phosphore. Dans le petit intestin, elle déclenche leur absorption en augmentant la synthèse de protéines de transport du calcium et du phosphore (Eckert, 1999). Plus précisément, une carence en phosphore va induire l’expression de FARNm codant pour un co-transporteur phosphate de sodium NaPi2) au niveau des reins et de l’intestin (Coloso, 2003). Chez les poissons, cette homéostasie du calcium/phosphore peut différer selon les espèces piscicoles vivant en eaux douces ou salées (Lall, 1989; Vielma 199$). La 1Œ,25 dihydroxyvitamine D3 est aussi connue pour avoir un rôle dans l’immunité en inhibant la prolifération des lymphocytes B et des lymphocytes T chez l’humain (Lemire, 1984).
Il est également connu que la rétention du phosphore par l’organisme est en corrélation avec les niveaux de phosphore présent dans la diète. En effet, lorsque tous les besoins en P de l’organisme sont comblés, les surplus sont excrétés sous forme insoluble dans les fèces ou sous forme soluble dans les urines. Une concentration de P trop élevée dans la diète est donc inutile puisque les surplus non utilisés sont éliminés. Une légère déficience en phosphore penriet donc une meilleure rétention du P. Les poissons ne commencent à excréter les surplus de P que lorsque leurs besoins fondamentaux sont satisfaits (Baeverfjord, 199$; Bureau, 1999; Sugiura, 2000a,b; Coloso, 2003; Satoh, 2003; Lellis, 2004; McDaniel, 2005).
Carence en pli osphore chez tes poissons
Les signes visibles d’une carence en phosphore sont la réduction de la croissance, l’anorexie, la faible conversion alimentaire, la faible minéralisation osseuse, les déformations du squelette et du crâne et l’accumulation de gras abdominal (Ketola, 1975; Lali, 1989; Baeverfjord, 1998). L’intensité de ces signes perceptibles est toutefois variable selon les études. Une des pathologies osseuses typiques associée à une déficience en P est le «curted spine » démontrée par Shearer et Hardy en 1987 chez la truite arc-en-ciel (Roberts, 2001; Sugiura. 2004) et par Baeverfjord en 199$ chez les saumons de FAtiantique. Typiquement, le «curled spine » ou «phosphatic curi» se caractérise par une colonne vertébrale finissant en forme de crochet ou de boucle et des déformations sigmoïdes des côtes. Contrairement à une déficience en vitamine C, les os affectés par une déficience en P sont mous, flexibles et les déformations observées ne sont pas accompagnées de fracture. Une alimentation supplémentée en P, en plus de rééquilibrer les paramètres plasmatiques de P et de Ca, peut aider les poissons à redevenir normaux si les déformations ne sont pas trop prononcées (Baeverfjord. 199$: Sugiura, 2004).
Phosphore d’origine végétale
La teneur en phosphore des aliments est très variable et a une importance notable lors de la fabrication des moulées pour animaux. On signale des réserves phosphoriques allant de 4,8 1% dans la farine de viande. 2,67% dans la farine de poisson, 1,29% dans le son de froment, 0,27 à 0,39% dans les grains et 0,15 à 0.25% dans les foins de bonne qualité (Compère, 1967).
L’acide phytique (myo-inositol-hexakisphosphate) ou phytate est une des principales formes de phosphate emmagasinée chez les plantes et constitue entre 40 et 90% du phosphore dans les céréales et les légumes (Ravindran, 1999). Cet acide phytique est par contre considéré comme un anti-nutriment puisque le système digestif des animaux monogastriques est incapable de digérer ce composé (Joyce, 2005). En effet, une fois ingérées par l’animal, les phytates se lient au calcium, au magnésium et au fer pour former des complexes insolubles qui sont directement éliminés par L’organisme (LalI, 1989; Satoh, 2003). Les effets négatifs de l’acide phytique incluent donc une diminution de la
biodisponibilité de certains minéraux causant des problèmes de santé, une augmentation de la pollution par les rejets de phosphore et une augmentation des coûts pour les éleveurs qui doivent ajouter des suppléments minéraux à l’alimentation des animaux (Joyce, 2005). L’enzyme phytase (diastase), produite par des microorganismes mais aussi par certaines plantes et certains tissus du tractus digestif d’animaux herbivores (Dernolon, 1961), a le pouvoir d’hydrolyser les phytates. Ainsi, le phosphore et les minéraux liés se retrouvent de nouveau sous une forme assimilable par l’organisme. L’ajout de cette enzyme à l’alimentation des animaux permet donc de rentabiliser l’assimilation du phosphore et d’augmenter l’absorption des minéraux. Elle a également le potentiel d’augmenter la digestibilité des acides aminés (Zhang, 1999; Haefner, 2005). La phytase est très populaire auprès des éleveurs d’animaux monogastriques (porcs, volailles, poissons) qui ne la possèdent pas de façon naturelle (Lali, 1989; Haefner. 2005). Elle permet d’assimiler le phosphore provenant des diètes à base de farines végétales sans ajout alimentaire de phosphore inorganique tout en diminuant les rejets phosphoriques dans l’environnement. Phosphore d’origine animale
Le problème de l’assimilation du phosphore est également présent lors de la consommation de diète à base de farine animale. En effet, quoique ayant une grande digestibilité au niveau protéique et énergétique. tes réserves de phosphore présentes dans ce type d’alimentation se retrouvent principalement sous forme d’hydroxyapatite, complexé au calcium, très peu soluble et donc très peu assimilable (Satoh, 2003). L’avantage de ce type de phosphore d’origine animale par rapport à celui d’origine végétale vient de son ratio plus équilibré en calcium/phosphore. Cette proportion CaJP est de 0,65 pour les diètes animales comparée à 0,4$ pour les diètes végétales (Demolon, 1961). Les diètes à base de farine animale sont donc considérées riches en phosphore. Les diètes commerciales pour salmonidés sont composées en grande partie de farines de poissons et de sous-produits d’animaux qui sont généralement considérés comme une bonne source de minéraux (Sugiura, 2004). Par contre, ces diètes contiennent également une grande quantité de cendres (ash), composées majoritairement de calcium, et doivent donc être supptérnentées avec d’autres minéraux (dont le phosphore) afin d’être parfaitement équilibrées (Lail. 1989).
Eutrophisation
Causes et conséquences
L’eutrophisation est un type de pollution nutritionnelle (excès d’éléments nutritifs dans un milieu) causée par un déséquilibre du cycle du phosphore (P), de l’azote (N) ou du carbone (C). Ce désordre biogéochimique est causé par un surplus d’éléments fertilisants issus des rejets produits par les activités humaines (Correll, 199$; Srnith, 1999). Les effluents urbains (savon à lessive) et industriels, Ï’épandage agricole d’engrais, l’aquaculture, l’élevage de porcs et de volailles en sont les principaux responsables. L’eutrophisation est le problème de qualité d’eau le plus répandu aux États-Unis et dans plusieurs autres pays (Smith, 1999). L’eau qui en résulte est trouble et malodorante, la rendant inapte aux activités récréatives (baignade, voile, pêche, etc.) et peut causer de graves problèmes économiques. Elle peut même être dangereuse à la consommation s’il y a développement de cyanobactéries et d’algues toxiques (Prescott, 1995). La concentration maximale admissible en phosphore dans les eaux destinées à la consommation humaine est fixée à 5 mg/L (site web de Laease).
Processtts d’eutrophisation
Dans un environnement sain, les nutrirnents (P. N, C) sont les facteurs limitants de la productivité primaire du milieu. Leur apport en excès favorise une prolifération excessive de phytoplancton, d’algues et de plantes. La croissance végétale en surface, en raison du besoin de lumière, provoque la formation d’un couvert opaque empêchant la croissance des végétaux des zones profondes. La décomposition de tout ce matériel organique par les bactéries aérobies consomme une grande quantité d’oxygène. Le lac s’appauvri ainsi en oxygène causant la perte de plusieurs espèces animales et végétales supérieures ce qui augmente davantage la quantité de matériel organique décomposable. Les bactéries aérobies, ne pouvant pas survivre à Fanoxie du milieu, permettent alors la multiplication des bactéries anaérobies. Celles-ci provoquent à leur tour la fermentation du matériel organique et libèrent par le fait même des gaz nauséabonds tel que le méthane, l’hydrogène sulfuré et l’ammoniac (Prescott. 1995 ; site web du CNRS).
Omble de fontaine
Synoitymes
Plusieurs noms vernaculaires de Fomble de fontaine (SaÏveÏinusfontinciÏis) existent selon son aire de répartition (MLCP. 1982) : truite mouchetée, truite de mer, truite de ruisseau, truite saumonée ou saumon de fontaine en français; brook chan, brook trout, speckled trout, sea trout, coaster, salter, native trout en anglais ; Aanak en inuktitut
(Nunavik). Au Canada. on parle spécifiquement d’omble de fontaine dans un contexte de recherche et d’élevage et de la truite mouchetée dans un contexte de pêche sportive ou
«
alimentation.Taxiitomie
(site web de ITIS : Integrated Taxonomic Information System)
- Classe: Actinopterygii (poisson épineux à nageoires rayonnées)
- Ordre : Salmoniformes
- Famille : Salmonidae (salmonidés: ensemble des truites et des saumons)
- Genre : SaÏvelirnts (Richardson, 1836 -- truites)
- Espèce : SaÏvelintts fontinaÏis (Mitchill. 1814 -- omble de fontaine)
Le croisement artificiel de l’omble de fontaine avec «autres espèces est possible. Ainsi, le croisement avec la truite brune (SciÏmo truttcl) crée un hybride infertile, la truite tigrée. Le croisement d’un omble de fontaine mâle avec le touladi femelle (Saïvelinus narnaycush ou truite grise) produit la truite moulac (Saïvelinus wendigo) capable de se reproduire à son tour (Bematchez, 2000).
IdeiitUïcatioii
Selon le Ministère des ressources naturelles et de la faune du Québec, la différence entre un omble, une truite et un saumon vient de sa coloration. L’omble aura des taches pâles sur un fond sombre (figure 1) tandis que les truites et les saumons auront des taches sombres sur un fond pâle (Bernatchez, 2000). La coloration du dos de Fomble de fontaine
va du vert olive au brun foncé. Les flancs sont plus pâles et marqués de points rouges cernés de bleu.
L’omble de fontaine mesure en moyenne entre 20 et 30 cm de long mais peut atteindre une taille beattcoup plus grande dans certains plans d’eau. Son poids moyen varie entre 1 et 3 kg mais certains spécimens de 6 kg ont déjà été rapportés. Son corps, de forme caractéristique aux salmonidés, est allongé, fusiforme et légèrement comprimé latéralement. Les mâchoires, la langue et le palais sont dotés de dents bien développées lui permettant d’être un carnivore efficace. Chez les mâles matures sexuellement, la mâchoire inférieure se termine en crochet et la coloration de l’abdomen s’intensifie pour devenir orange vif en période de reproduction (Bernatchez, 2000).
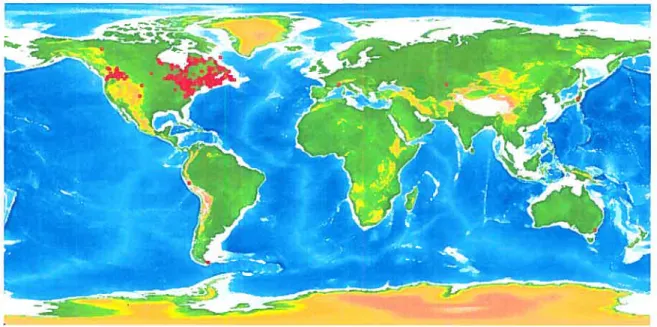
Distribution mondiale et habitat n attire!
L’omble de fontaine dulcicole est une espèce endémique de l’est de l’Amérique du Nord mais a été introduite avec succès, à la fin du XIX° siècle, dans de nombreux pays tempérés (f igure 2). Elle se retrouve dans les cours d’eau et les lacs où l’eau est très fraiclic. moins de 20°C, claire et bien oxygénée (MLCP, 1982). Les individus anadromes de l’espèce, également appelés truite de mer, vivent en mer et frayent en eau douce (LeJeune,
1987).
Figure 2 Distribution sommaire de l’omble de fontaine indiquée par les zones rouges
(carte
interactivesur
le site web : http://www.iobis.org/Welcome.htm).Importance économique au Québec
L’omble de fontaine,
par
sa beauté, son tempérament combatif et l’excellence de sa chair, est un des poissons les plus populaire au Québec (Figure 2; Bematchez, 2000). Sa popularité est telle que la ville de $t-Alexis-des-Monts en Mauricie s’en dit la capitale. Dès 1857, la popularité de la pêche sportive crée le besoin de développer l’élevage de cette espèceafin
de reconstituer les populations des milieux naturels. L’ensemencement est encore aujourd’hui la raison première de la production de ce salmonidé (MLCP, 1982; Lapointe, 1990; Morin, 2004). Ce n’est qu’en 1980 que les pisciculteurs québécois étendent leur production au marché de la table et cette expansion atteint son apogée en 199$. Cependant, dès 2000, en raison des impacts environnementaux négatifs de ce développementimportant,
le gouvernement québécoisjnstaure
une
nouvelle réglementation.Étant
particulièrement préoccupépar
l’eutrophisation accélérée des milieux aquatiquespar
les rejets piscicoles, la nouvelle loi oblige, entre autre, les pisciculteurs à diminuer de 40% la charge globale annuelle de phosphore (P) rejetée dans les milieuxaquatiques passant de 7,2 à 4,2 kg de P par tonne de production d’ici 2014 (MAPAQ, 2005).
La sévérité grandissante des lois concernant la protection de l’environnement impose donc aux éleveurs de restreindre leur production créant ainsi des limites financières ne permettant pas la survie de ces entreprises dans un marché de plus en plus compétitif. Afin d’apporter une solution aux pisciculteurs touchés, la Table filière de l’aquaculture en eau douce du Québec (TFAEDQ) a mis sur pied la Stratégie de développement durable de l’aquaculture en eau douce au Québec (STRADDAQ) pour permettre la conciliation d’un développement économique vigoureux dans une approche environnementale saine. La STRADDAQ mobilise tous les partenaires du milieu tel que l’Association des Aquaculteurs du Québec (AAQ), le Ministère du développement durable, de l’environnement et des parcs (MDDEP) et le Ministère de l’agriculture, des pêcheries et de l’alimentation (MAPAQ) afin de favoriser de nouvelles technologies aquicoles et de bonnes pratiques d’élevage (IVIAPAQ, 2005).
À
ce niveau, le secteur nutritionnel, élaborant des régimes alimentaires à teneur limitée en phosphore et/ou ayant une meilleure biodisponibilité, est essentiel à la résolution de ce problème qui pourrait s’avérer être un facteur limitant de la croissance et du développement de l’aquaculture au Québec et au Canada.La furonculose
La furonculose est probablement la maladie la plus étudiée chez les poissons depuis l’identification en 1894 de l’agent causal,Aeromonas saïnionicida alors appelée Bacterium
sahnonicida, à partir d’une pisciculture de truites brunes en Allemagne (Austin, 1993). En Amérique du Nord, le premier rapport de furonculose a été fait en 1902 dans une pisciculture du Michigan aux États-Unis. L’identification de l’agent pathogène, nommé
BaciÏÏus tntttae par M.C. Marsh. a alors été cité dans un article du magasine Science
(Austin, 1993).
Encore aujourd’hui, A saïmonicida est certainement la bactérie pathogène des poissons la plus connue et la plus étudiée. Ses effets dévastateurs lors d’épidémies dans
l’industrie piscicole, sa répartition mondiale et la grande variété de poissons pouvant être affectés causent cet intérêt.
L‘agent pathogène
Aeromonas salmonicida est une bactérie à Gram négatif, anaérobique facultative, en forme de bâtonnet coccoïde ou coccobacille, de la famille desAeromonadaceae. Le genre Aeromonas se divise en deux groupes distincts. Le groupe «A. salmonicida est composé de bactéries psychrophiles et non mobiles. Dans l’autre groupe, les Aerornonas sont mésophiles. mobiles et se divisent en trois espèces Aeromonas hydrophiÏct, Aeromonas
caviaeet Aeromonas sobria (Bergey, 1984). L’espèce A. saïmonicidadu premier groupe se subdivise en quatre sous-espèces distinctes : sahnonicida, mascoztcida, achromogenes et
smithia (Bergey, 1994). Plus récemment, une 5ei
sous-espèce, pectinolyticct, a été reconnue (Pavan, 2000: Bjrnsdottir. 2005). La bactérie responsable de la furonculose classiqtie chez les salmonidés est A. saïmonicida ssp. saïmonicida (Ass). Les 4 autres sous-espèces sont liées à la forme atypique de la maladie caractérisée par des ulcères et des lésions cutanés avec ou sans septicémie chez différentes espèces piscicoles (Cipriano, 2001).
L’identification préliminaire d’A saïmonicida ssp. saïmonicida se fait par la présence «un pigment brun diffus autour des colonies sur milieu T$A (Tryptone Soya Agar) et par la possibilité de glisser ou pousser les colonies isolées à l’aide de l’anse du manche de Koch (Stoskopf, 1993; Noga, 1996). L’identification définitive doit cependant se faire à l’aide de tests biochimiques, immunologiques (détection Ac) ou génétiques (PCR).
facteurs de virulence
La bactérie A salmonicida n besoin de différents facteurs de virulence pour pouvoir infecter un hôte, survivre à ses mécanismes de défense et se propager. La couche protéique S (S-layer. sttrface layer) est absolument nécessaire à la virulence de A. saïmonicida. Cette membrane extérieure ancrée aux LPS permet Fadhésion à une grande variété de surfaces et de cellules en plus de jouer un rôle essentiel dans la résistance au système
immunitaire de l’hôte et dans la protection contre les environnements hostiles (Ebanks, 2005). Ce facteur de virulence est éliminé si la bactérie est incubée à de trop hautes températures (à partir de 25C). Les LPS, communs aux bactéries à Gram négatif, sont situés sous la couche S. Seules les souches d’A. salmonicida possédant des LPS intacts et une couche S sont virulentes pour l’omble de fontaine (Cipriano, 1989). Les protéases. les lipases tel que la GCAT (glycérophospholipide cholestérol acyltransférase) et «autres toxines moins connues (H-lysine et les peptides hémolytiques ASH3 et ASH4) font également partie des facteurs de virulence. Le manque de connaissance du rôle de ces facteurs impliqués dans le développement de la furonculose ainsi que l’incapacité pour les truites de produire des anticorps contre ces même facteurs font que la vaccination des salmonidés contre cette maladie est inefficace (Kaattari, 1996).
La maladie
La furonculose affecte particulièrement les salmonidés tant en milieu naturel quen pisciculture. L’omble de fontaine (SaÏveÏinusfontinaÏis), le saumon de l’Atlantique (Saïmo scilar) et la truite brune (Salmo trutta) sont des espèces très sensibles tandis que la truite arc-en-ciel (SctÏmo gairdneri) est plus résistante (Blake, 1932; McCarthv. 1977; Cipriano, 1983). La furonculose a une répartition mondiale chez les poissons de plusieurs espèces de tous âges, tant en eaux douces que saumâtres ou salées. L’infection se produit généralement lorsque les poissons sont stressés par des conditions naturelles ou d’élevage inadéquates (Bemoth, 1997). L’augmentation de la température de l’eau, la diminution de l’oxygène dissout, les facteurs physico-chimiques variables et une surpopulation sont souvent en cause. L’âge, le système immunitaire de l’hôte et les différentes lignées génétiques d’une espèce vont également influencer le taux de mortalité des individus infectés (Cipriano, 2001; Cipriano, 2002).
Signes cliniques
La furonculose se retrouve le plus souvent sous forme de septicémie aigu caractérisée par un taux de mortalité élevé et peu de lésions externes visibles (Bernoth, 1997). Les éleveurs de salmonidés subissent alors des pertes de cheptel importantes causant de graves dommages financiers en peu de temps.
Lors d’infections chroniques, il y a développement de signes cliniques se caractérisant par l’apparition de furoncles c’est-à-dire de lésions cutanées ressemblant à de grosses papules. De plus, un noircissement cutané, une congestion des branchies, une nécrose musculaire, une exophtalmie plus ou moins prononcée, des hémorragies cutanées et viscérales, une liquéfaction du pronéphros. une pâleur du foie et un gonflement de la rate peuvent être observés. Des signes cliniques de refus alimentaire, difficultés natatoires ou nage près de la surface, comportement apathique et tachypnée s’ajoutent généralement (Austin, 1993; Stoskopf. 1993; Bernoth. 1997; Cipriano, 2001). La mortalité est plus faible lors de la forme chronique de la maladie. La guérison est possible et laisse parfois quelques cicatrices. Elle permet la sélection de poissons dits porteurs sains.
forme sous—clinique oit latente
La forme latente de la furonculose se retrouve chez les poissons asymptornatiques porteurs de A. saÏrnonicidct ou ceux ayant développé une résistance suite à l’infection bactérienne. Hiney (1997) stipule qu’un porteur sain est un poisson qui ne manifeste aucun signe clinique de la furonculose mais où il y a présence de la bactérie A. saïmonicida, de ses antigènes ou de son ADN. Les bactéries peuvent se retrouver à différents sites tel que le mucus cutané, les nageoires, les branchies et dans l’intestin permettant ainsi sa dispersion dans le milieu. Le pronéphios est l’organe considéré comme le réservoir primaire tant chez les poissons malades que les porteurs sains (McCarthy. 1977; Noga, 1996). Le déclenchement de la maladie chez les porteurs asymptomatiques par l’induction de stress est la meilleure méthode de détection puisqu’il n’existe encore aucun test fiable (Hiney.
Traizsniissiou
Les porteurs sains sont la cause principale de transmission horizontale de la furonculose dans les piscicultures lors de l’arrivée de nouveaux poissons (Olivier, 1992) ou par la présence indésirable d’espèces sauvages dans les bassins d’élevage (McCarthy, 1977). La contamination peut se faire par cohabitation ou par contact direct. La maladie est difficile à éradiquer puisque les bactéries peuvent résister plusieurs jours dans l’environnement, sur le matériel contaminé et dans l’eau des bassins (McCarthy, 1977). De plus, il a été démontré par Wooster et Bowseer (1996) qu’A. saïmonicida peut se disperser par des aérosols (Cipriano, 2001) ce qui facilite grandement sa dissémination à travers le milieu (transmission latérale). A. salmonicicta reste un pathogène extracellulaire obligatoire des poissons même si sa survie dans l’environnement est possible jusqu’à l’infection d’un nouvel hôte (Gibson, 1977: Austin, 1993; Enger. 1997). La transmission verticale, c’est-à-dire la contamination des oeufs via les ovaires et les testicules, est également possible mais moins étudiée car considérée insignifiante par rapport à la transmission horizontale (Smith, 1996; Cipriano, 2001).
Système immunitaire des poissons
Organes et cellules
Les téléostéens, dont font partie les salmonidés, sont le groupe le plus large et le plus avancé de la phylogénie des poissons. De par cette évolution, il est connu que la plupart des composantes de leur système immunitaire sont similaires à celles retrouvées chez les vertébrés supérieurs (Raison, 2002). Cependant, parce que les poissons sont un groupe pius hétérogène que les mammifères, des différences majeures peuvent exister entre et dans chaque classe (Tizard, 2000). Afin d’être concis, l’infonriation résumée dans cette section sera plus particulièrement reliée aux salmonidés.
Les poissons téléostéens n’ont pas de noeuds lymphatiques ni de moelle osseuse. Les tissus hématopoïétiques se situent principalement dans le rein, le thymus et la rate. L’épithélium intestinal et la lamina propria contiennent des cellules lymphoïdes. Des
lymphocytes B et T matures ont été retrouvés dans Fépiderme de la peau et dans la paroi intestinale (Thuvander, 1990; Tizard. 2000). Les monocytes isolés du sang et les macrophages se retrouvant dans plusieurs sites dont le mésentère, la rate, le rein et l’oreillette du coeur ont tme forte activité phagocytaire. Des centres de mélanomacrophages c’est-à-dire des agrégations de macrophages contenant des pigments de mélanine et d’hémosidérine se retrouvent dans la rate, le foie et le rein (Tizard, 2000). Les granulocytes se subdivisent en neutrophiles, éosinophiles et basophiles. Les neutrophiles sont capables de phagocytose et sont également appelés hétérophiles. Les basophiles sont souvent inexistants selon les espèces (Secombes, 1996).
Rein
Chez les poissons, le rein est un organe long et mince, qui suit la colonne vertébrale ventralement. Il possède la fonction hématopoïétique de la moelle osseuse des vertébrés supérieurs. Il est également l’organe lymphoïde primaire principal c’est-à-dire le site majeur de la production et de la différenciation des lymphocytes (Tizard, 2000). Plus précisément, le rein se divise en deux sections distinctes. La partie antérieure du rein. également appelée pronéphros. est le compartiment lympho-rnyéloïde constituant un réservoir et un site de différenciation cellulaire des précurseurs sanguins (Press, 1994). On y retrouve, dans le stroma du tissu réticulo-endothéliaL des macrophages, des blastocytes et des lymphocytes T et B matures (Thuvander, 1990). De plus, à la suite d’tme stimulation antigénique, le pronéphros est un producteur majeur d’anticorps et son parenchyme a la capacité de séquestrer les antigènes pour de longues périodes (Zapata, 1996). L’opisthonéphros, la portion centrale et postérieure du rein, est également hématopoïétique mais a comme fonction principale l’élimination des déchets métaboliques (excrétion) comme chez les mammifères (Tizard, 2000). Le micro-environnement créé par le rein est exploité tant par le système immunitaire que par le système endocrinien et permet une communication paracrine entre les cellules (WeyÏs, 1999).
Thyntits
Le thymus est considéré comme le deuxième organe lymphoïde primaire par la présence des nombreux anticorps s’y retrouvant et parce qu’il est également la source
principale des cellules immunocompétentes subséquentes à la sélection négative des lymphocytes T. Cet organe bilobé se retrouve sur la paroi dorso-latérale du pharynx entre le premier et le quatrième arc brachial permettant ainsi un accès direct aux antigènes pénétrant par les branchies (Takashima, 1982). Deux zones se distinguent soit le cortex, zone externe contenant habituellement plus de lymphocytes T et la médulla, zone centrale contenant les plasmocytes producteurs d’anticorps. Les réponses du thymus sont influencées par l’âge du poisson, les signaux hormonaux et les saisons (Tizard, 2000). Les expériences de thyrnectomie effectuées sur les téléostéens affectent la maturation du système immunitaire tout comme chez les vertébrés supérieurs ce qui prouve la similitude des rôles affectés à cet organe (Zapata, 1996).
Rate
La rate est un organe lymphoïde secondaire filtrant le sang pour y enlever les particules antigéniques et les vielles cellules sanguines. Sa structure et sa localisation chez les poissons est similaire à celle des mammifères mais chez les téléostéens, la zone marginale délimitant la pulpe rouge de la pulpe blanche n’est pas aussi bien définie (Zapata, 1996; Tizard, 2000). La pulpe rouge sert de réservoir d’érythrocytes et de piège pour les antigènes de la circulation sanguine. La pulpe blanche, riche en lymphocytes, est le siège de la réponse immunitaire. Leur rôle dans la liaison et la transformation des antigènes (Ag binding/processing) et dans la production d’anticorps a été démontré mais reste encore controversé (Zapata, 1996).
Immunité reliée aux muqueuses
On retrouve dans le système immunitaire des poissons des amas de tissus lymphoïdes associés à l’épithélium gastrique et intestinale (GALT ou Gut-Associated Lyrnpoid Tissue), à la peau (SALT ou Skin-A ssociated Lympoid Tissue) et aux branchies (BALT ou Bronchiis-Associated Lymphoid Tissue). Ces accumulations de tissus retrouvées dans les muqueuses sont considérées comme des organes lymphoïdes secondaires et contiennent des lymphocytes, macrophages, plasmocytes ainsi que différents types de granulocytes tel que basophiles, éosinophiles et hétérophiles selon l’espèce de poisson. Ces
tissus lymphoïdes sont exposés directement à l’environnement extérieur et donc considérés comme la première ligne de défense contre les agents pathogènes (Zapata, 1996).
Immunité innée
D’un point de vue évolutif, le système immunitaire inné ou non spécifique a été pendant longtemps le seul mécanisme de défense contre les agents pathogènes potentiels tels que bactéries, virus, fungus. protistes et parasites (Bayne, 2001). Ce système est la première ligne de défense d’un organisme puisqu’il réagit rapidement à l’attaque d’un agent pathogène en empêchant l’attachement, l’invasion et la multiplication de celui-ci sans aucune reconnaissance préliminaire. L’ immunité innée contrôle la croissance de l’agent infectieux et contribue à son élimination avant même que l’immunité acquise ne se développe. De plus, son activation est indépendante de la température ce qui est un avantage certain pour les animaux poïkilothermes tel que les poissons. Comme point de comparaison, la réponse inflammatoire s’active entre I et 2 jours suivant le début de l’infection tandis qtie la production d’anticorps peut prendre entre 4 et 6 semaines. à une température optimale pour une espèce donnée, avant d’être complète (Ellis, 2001).
Immunitéh itimioralenon spécifique
La peau, le mucus et l’enveloppe des oeufs créent une première ban’ière physique et chimique aux agents pathogènes invasifs et font ainsi partie des composantes du système inununitaire inné. Le mucus de la peau et les oeufs contiennent des substances capables d’inhiber la croissance bactérienne (Yano, 1996). Le mucus, en plus de sa capacité de’ piéger avec des mucopolysaccharides visqueux, contient plusieurs substances antibactériennes à large spectre tel que des peptides anti-microbiens (ou PAMs), des lectines. le lysozyme et des protéines de phase aigu (acute phase proteins ou APP) (Ellis. 2001). Bayne (2001) fait une revue détaillée de toutes les APP du système immunitaire inné chez les poissons.
Le plasma contient également plusieurs facteurs bactéricides ou bactériostatiques. Le lysozvrne et les lectines se retrouvent
en
plus grandes concentrations dans le plasma quedans le mucus. La transferrine (IBP) a une haute affinité pour le fer et empêche ainsi sa disponibilité pour les bactéries. Les anti-protéases comme la a2-macroglobuline sont efficaces contre les toxines protéolytiques émises par A. sahnonicida. Le système du complément est également une composante majeure de l’immunité innée puisquil peut être activé directement par les LPS bactérien (voie alternative) mais aussi par les anticorps (voie classique) et indirectement par la protéine C-réactive et les lectines attachées aux surfaces bactériennes (Yano, 1996; Ellis, 2001). Les trois classes d’interférons impliqués dans l’inhibition de la réplication virale (a. (3 et y) existent également chez les téléostéens (Yano, 1996).
Immunité cellulairenonspécfique
Une multitude de cellules sont impliquées dans les défenses non spécifiques, incluant les monocytes et macrophages, les granulocytes (hétérophiles. éosinophiles et basophiles chez certaines espèces de poissons) et les cellules cytotoxiques NCC (nonspecific cytotoxic cells) équivalentes aux cellules NK des mammifères (Secombes, 1996). Les cellules phagocytaires, les hétérophiles et plus particulièrement les macrophages, sont les agents centraux de la défense cellulaire non spécifique. Ils ingèrent les particules étrangères via la phagocytose, supportent la réponse inflammatoire par la synthèse et la sécrétion de peptides anti-microbiens et de cytokines, et aident indirectement à la production des anticorps par les lymphocytes B en agissant comme cellules présentatrices d’antigènes. Les cellules NCC sont capables d’éliminer les cellules tumorales, les cellules infectées par des virus et les parasites protozoaires (Secombes,
1996).
Immunité acquise
Limmunité acquise chez les poissons est complémentaire et interdépendante de l’immunité innée tout comme chez les mammifères. Ce système de défense spécifique, quoi que complet. est tout de même plus primitif que celui retrouvé chez les vertébrés supérieurs. Limmunité acquise a un développement beaucoup plus récent ce qui peut
Irnmttnité Itttrnorate spécifique
D’un point de vue évolutif, la réponse humorale est apparue pour la première fois chez les téléostéens qui possédaient tout l’arsenal cellulaire (cellules présentatrices d’antigènes, lymphocytes T auxiliaires et lymphocytes 3) nécessaire à la production d’anticorps. Les poissons ne possèdent qu’une seule classe d’immunoglobuline, les IgM, d’une structure en pentamère semblable aux immunoglobulines des mammifères. En fait, les similitudes portent sur la structure de base de l’immunoglobuline mais aussi sur l’ensemble des cellules impliquées dans l’induction des anticorps et du rôle de ces derniers au niveau de la neutralisation, la précipitation et l’agglutination, la fixation du complément et l’opsonisation (Kaattari, 1996). La production d’anticorps spécifiques à un antigène est optimisée par une température élevée. La concentration d’immunoglobulines sériques, le titre naturel des anticorps et le nombre de lymphocytes augmentent lors d’une augmentation de la température (Alcorn, 2002).
La connaissance des anticorps, de la mémoire immunitaire et du système immunitaire spécifique, en relation avec la température, a une implication primordiale dans le développement de vaccins efficaces. Dans le domaine piscicole, l’usage d’antibiotiques et d’agents chimiques pour combattre les infections étant limité, l’immunoprophylaxie est la méthode idéale pour prévenir les maladies infectieuses tant d’un point de vue environnemental qu’ économique.
Immunité cellulaire spécïque
L’immunité cellulaire spécifique qui a été étudiée chez les vertébrés inférieurs par des expériences de transplantation d’organes (de peau) s’est révélée être un modèle similaire à celui des mammifères. Le phénomène de rejet de greffe, particulièrement des allogreffes c’est-à-dire d’une greffe d’organe d’un membre de la même espèce mais avec une constitution génétique différente, a démontré la spécificité antigénique impliquant les lymphocytes T cytotoxiques et le CMH I (complexe majeur d’histocornpatibilité) ainsi que
la mémoire immunologique. Des expériences de thymectomie et d’hypersensibilité ont également démontré des aspects cellulaires de l’immunité acquise semblables à ceux retrouvés chez les vertébrés supérieurs (Clem, 1991; Manning, 1996).
Les poissons possèdent des populations de lymphocytes B et T analogues à ceux des mammifères. Les lymphocytes B affichent des récepteurs de surface membranaire (BCR) impliqués dans la mémoire cellulaire lors d’une réponse immunitaire secondaire. Ils jouent également le rôle de cellule présentatrice d’antigène (CPA) en présentant, par le CMH II, un peptide antigénique aux lymphocytes T auxiliaires après endocytose et transformation (processing) de celui-ci. De plus, la maturation des lymphocytes B en plasmocytes permet la production d’immunoglobulines solubles. La prolifération des lymphocytes B peut être stimulée in vivo par l’ajout d’un agent mitogêne c’est-à-dire d’une substance qui induit l’entrée en mitose d’une cellule. Les LPS (lipopolysaccharides) présents à la surface des bactéries Escherichia cou (Gram négatif) vont stimuler de manière spécifique les lymphocytes B (Janeway, 2003).
Les lymphocytes T possèdent également des récepteurs membranaires (TCR) qui, n’étant pas formellement identifiés par les moLécules CD4, CD8 ou CD3 spécifiques des mammifères, sont tout de même de familles homologues. Les lymphocytes T se divisent en
deux populations distinctes. Les cellules T auxiliaires reconnaissent les particules antigéniques présentées par le CMH II exprimé en surface des CPA (lymphocytes B, macrophages). Les cellules T cytotoxiques peuvent tuer toutes les cellules nucléées infectées par des virus et exprimant le CMH I en surface. L’agent mitogène ConA (concanavaline A) est une lectine provenant de la plante légumineuse Canavalia ensiJrrnis (pois sabre ou Jack becta) qui reconnaît de façon spécifique les Œ-glucides et Œ—mannoses présents à la surface des lymphocytes T. Con A est un mitogène potyclonal puisqu’il permet l’induction de la mitose des lymphocytes T de spécificité différente (auxiliaires et cytotoxiques) lors de tests de transformation lymphoblastique in vivo (Janeway, 2003).
L’interaction entre les cellules du système immunitaire est possible grâce aux liaisons entre les structures de surfaces cellulaires et les récepteurs mais implique également une grande variété de cytokines solubles. L’interleukine 1 (l), 2, 3,
IL-4, IL-6, les interférons ct (IFN u). (IFN Ç3) et ‘y (IFN ‘y), le facteur d’activation des macrophages (MAF), TNF (tumour necrosisfactor), TGFf31 (tranjorming growthfactor), les Cf (chemotactic fctctor) et les MIf (migration inhibition factor) sont toutes des protéines produites par des cellules qui modifient le comportement d’autres cellules. Elles ont donc une implication capitale dans l’immunité innée et acquise et leurs fonctions sont similaires à celles retrouvées chez les mammifères (Manning. 1996).
Nutrition et immunité
La compréhension du système immunitaire et l’avancement de l’immunologie se sont développés la fin du 19ième siècle grâce aux travaux de Pasteur, Metchnikoff, Bebring et Ehrlich. Depuis, de nombreuses expérimentations ont prouvé que la malnutrition et les carences alimentaires diminuent la résistance aux infections. L’ importance de la nutrition sur les différents paramètres immunitaires est maintenant évidente. Les études portant sur les carences vitaminiques ont clairement démontrées une immunosuppression. Ce n’est que depuis 1980 que les études se penchent plus précisément sur l’effet des carences en minéraux. La plupart des espèces animales ont besoin de 17 minéraux essentiels. Le calcium, le phosphore, le magnésium, le sodium, le potassium, le chlore et le soufre sont les sept macro minéraux qui composent 99% des minéraux du corps tandis que le fer, le zinc, le sélénium, le manganèse, l’iode, le cuivre, le molybdène, le chrome, le cobalt et le fluor sont les dix éléments traces qui composent le 1% restant. Selon Spallholz (1989), le phosphore ne semblerait pas avoir un effet unique et indépendant du système immunitaire et du système endocrinien. On peut donc s’attendre à retracer les conséquences d’une déficience de cet élément à plusieurs niveaux du métabolisme.
Régtilatioit des besoins eu minéraux chez les poissons
Contrairement aux mammifères, les poissons ont la possibilité d’absorber certains minéraux inorganiques non seulement de leur alimentation mais aussi directement de leur environnement extérieur, par les branchies et la peau. tant en eau douce qu’en eau salée. Les salmonidés peuvent absorber dti calcium, du magnésium, du sodium, du potassium. du fer, du zinc et du cuivre de l’environnement aquatique pour combler leurs besoins
nutritionnels tandis que les phosphates, les chlorures et les sulfates doivent absolument être absorbés à partir de l’alimentation (LalI, 1989; Baeverfjord, 1998). Cette homéostasie des minéraux, incluant celle du calcium et du phosphore, peut différer selon les espèces vivant en eaux douces ou salées (Vielma, 199$). Elle va également être influencée par le système endocrinien qui joue un rôle dans l’absorption et l’excrétion aux niveaux intestinal et rénal mais aussi dans l’adsorption ou la résorption osseuse. En effet, le squelette des téléostéens, comme celui des mammifères, sert de réservoir de calcium, de phosphore et d’autres ions continuellement en équilibre avec les électrolytes du sang et des liquides extracellulaires (Lall, 1989). Une diète contenant une grande quantité de minéraux (cendres), particulièrement de calcium, doit être supplémentée et balancée avec d’autres minéraux; par exemple, un déséquilibre peut prédisposer les saumons de l’Atlantique à la maladie bactérienne du rein (BKD) (LalI, 1989).
Effets des carences atirneittaires sttr le système intmttnitaire des poissons
Il est connu que les carences nutritionnelles sont susceptibles de diminuer la réponse immunitaire et la résistance aux infections (Roberts. 1989; Ghittino, 1989: Blazer, 1989; Blazer, 1992). Puangkaew, en 2004, a démontré qu’une carence alimentaire en vitamine E (Œ-tocophérole) cause une détérioration non spécifique des fonctions immunitaires cellulaires et humorales chez la truite arc-en-ciel (OncorhyncÏius mykiss). L’activité de la voie alternative du complément, les immunoglobulines plasmatiques totales, la phagocytose, l’activité du lysozyme, la production d’anions superoxydes et la cytotoxicité cellulaire ont été évaluées suite à une alimentation déficiente ou supplémentée en vitamine E pendant 15 semaines. De façon générale, une augmentation de la vitamine E dans la diète semble stimuler l’activité du lysozyme et de la phagocytose mais pas la cytotoxicité cellulaire et la voie alternative du complément. Ces résultats corroborent ceux de Blazer (19$4a) qui a fait différentes analyses de la réponse immunitaire spécifique et non spécifique chez la même espèce Salino gairdneri Richardson (ancien nom de la truite arc en-ciel Oncorhynchiis mykiss) avec une diète contrôle standard et une diète carencée en vitamine E pour une durée variant entre 12 et 17 semaines. Dans les deux études mentionnées, les poissons alimentés avec la diète déficiente ont démontré une diminution de la réponse immunitaire selon les paramètres examinés mais ont tous eu un taux de