HAL Id: dumas-01683036
https://dumas.ccsd.cnrs.fr/dumas-01683036
Submitted on 12 Jan 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
des pratiques
Maxime Picard
To cite this version:
Maxime Picard. L’antibiothérapie intraveineuse à domicile : évaluation des pratiques. Médecine humaine et pathologie. 2017. �dumas-01683036�
2017
N°
2017ANTI0162
L’antibiothérapie intraveineuse à domicile : évaluation des
pratiques.
Soutenue publiquement à la Faculté de Médecine Lariboisière Et examinée par les Enseignants de l’Université Paris VII
Le
17 mai 2017
Pour obtenir le grade de
DOCTEUR EN MEDECINE
(Diplôme d’Etat)
Par
Maxime PICARD
JURY :
Président : Monsieur le Professeur Jean-François BERGMANN
Examinateurs : Monsieur le Professeur Stéphane MOULY
Monsieur le Professeur Pierre-Jean GUILLAUSSEAU
UNIVERSITE DES ANTILLES
2017
FACULTE DE MEDECINE
HYACINTHE BASTARAUD
N°
2017ANTI0162
L’antibiothérapie intraveineuse à domicile : évaluation des
pratiques.
Soutenue publiquement à la Faculté de Médecine Lariboisière Et examinée par les Enseignants de l’Université Paris VII
Le
Pour obtenir le grade de
DOCTEUR EN MEDECINE
(Diplôme d’Etat)
Par
Maxime PICARD
JURY :
Président : Monsieur le Professeur Jean-François BERGMANN
Examinateurs : Monsieur le Professeur Stéphane MOULY
Monsieur le Professeur Pierre-Jean GUILLAUSSEAU
UNIVERSITE DES ANTILLES ET DE LA GUYANE
*****************
FACULTE DE MEDECINE HYACINTHE BASTARAUD ***
Administrateur Provisoire : Jacky NARAYANINSAMY Doyen de la Faculté de Médecine : Raymond CESAIRE
Vice-Doyen de la Faculté de Médecine : Suzy DUFLO
Rémi NEVIERE Physiologie
CHU de MARTINIQUE
Bruno HOEN Maladies Infectieuses
CHU de POINTE- À-PITRE/ABYMES Tel : 05 90 89 15 45
Pascal BLANCHET Chirurgie Urologique
CHU de POINTE- À-PITRE/ABYMES Tel : 05 90 89 13 95 - Tel/Fax 05 90 89 17 87
André-Pierre UZEL Chirurgie Orthopédique et Traumatologie
CHU de POINTE- À-PITRE/ABYMES Tel : 05 90 89 14 66 – Fax : 05 90 89 17 44
Pierre COUPPIE Dermatologie
CH de CAYENNE Tel : 05 94 39 53 39 - Fax : 05 94 39 52 83 Thierry DAVID
CHU de POINTE- À-PITRE/ABYMESOphtalmologie
Tel : 05 90 89 14 55 - Fax : 05 90 89 14 51 Suzy DUFLO
CHU de POINTE- À-PITRE/ABYMESORL – Chirurgie Cervico-faciale
Eustase JANKY
CHU de POINTE- À-PITRE/ABYMESGynécologie-Obstétrique
Michel DE BANDT
CHU de MARTINIQUERhumatologie
Tel : 05 96 55 23 52 - Fax : 05 96 75 84 44
François ROQUES
Chirurgie Thoracique et CardiovasculaireCHU de MARTINIQUE
Tel : 05 96 55 22 71 - Fax : 05 96 75 84 38 Jean ROUDIE
CHU de MARTINIQUEChirurgie Digestive
Tel : 05 96 55 21 01 Tel : 05 96 55 22 71 - Fax : 05 96 75 84 38 Jean-Louis ROUVILLAIN
Chirurgie OrthopédiqueCHU de MARTINIQUE
Tel : 05 96 55 22 28 Christian SAINTE-ROSE
Neurochirurgie PédiatriqueCHU de MARTINIQUE
André CABIE
CHU de MARTINIQUEMaladies Infectieuses
Tel : 05 96 55 23 01 Philippe CABRE
CHU de MARTINIQUENeurologie
Tel : 05 96 55 22 61 Raymond CESAIRE
Bactériologie-Virologie-Hygiène option virologie
CHU de MARTINIQUE Tel : 05 96 55 24 11 Michel CARLES
Anesthésiologie/RéanimationCHU de POINTE- À-PITRE/ABYMES Tel : 05 96 89 11 82 Maryvonne DUEYMES-BODENES
CH de CAYENNEImmunologie
Tel : 05 94 39 50 50 Régis DUVAUFERRIER
Radiologie et Imagerie MédicaleCHU de MARTINIQUE
Tel : 05 96 55 21 84 Annie LANNUZEL
CHU de POINTE- À-PITRE/ABYMESNeurologie
Tel : 05 90 89 14 13
Louis JEHEL Psychiatrie Adulte
CHU de MARTINIQUE Tel : 05 96 55 20 44
Mathieu NACHER
CH de CAYENNEEpidémiologie
Tel : 05 94 93 50 24 Guillaume THIERY
CHU de POINTE- À-PITRE/BYMESRéanimation
Tel : 05 90 89 17 74 Magalie DEMAR-PIERRE
Parasitologie et InfectiologueCH de CAYENNE
Tel : 05 94 39 53 09
Vincent MOLINIE
Anatomie Cytologie PathologiqueCHU de MARTINIQUE
Tel : 05 96 55 20 85/55 23 50 Philippe KADHEL
CHU de POINTE- À-PITRE/ABYMESGynécologie-Obstétrique
Jeannie HELENE-PELAGE
Cabinet libéral au GosierMédecine Générale
Tel : 05 90 84 44 40 - Fax : 05 90 84 78 90 Mehdi MEJDOUBI
r CHU de MARTINIQUERadiologie et Imagerie
Professeur des Universités Associé Karim FARID
CHU de MARTINIQUEMédecine Nucléaire
Maîtres de Conférences des Universités - Praticiens Hospitaliers
Christophe DELIGNY
Gériatrie et biologie du vieillissementCHU de MARTINIQUE
Tel : 05 96 55 22 55 Jocelyn INAMO
CHU de MARTINIQUECardiologie
Tel : 05 96 55 23 72 - Fax : 05 96 75 84 38 Franciane GANE-TROPLENT
Cabinet libéral les AbymesMédecine Générale
Fritz-Line VELAYOUDOM épse CEPHISE
CHU de POINTE- À-PITRE/ABYMESEndocrinologie
Tel : 05 90 89 13 03 Marie-Laure LALANNE-MISTRIH
CHU de POINTE- À-PITRE/ABYMESNutrition
Tel : 05 90 89 13 00 Sébastien BREUREC
CHU de POINTE- À-PITRE/ABYMESBactériologie &Vénérologie
Tel : 05 90 89 12 80
Narcisse ELENGA
CH de CAYENNEPédiatrie
Moana GELU-SIMEON
CHU de POINTE- À-PITRE/ABYMESGastroentérologie
Tel : 05 90 89 10 29- Fax : 05 90 75 84 38
Chefs de Clinique des Universités - Assistants des Hôpitaux Louis DARCHE
Chirurgie Générale et Viscérale CHU de MARTINIQUE
Tel : 05 96 55 21 01 Julia MARY
CHU de MARTINIQUERhumatologie
Tel : 05 96 55 23 52
Florence MOINET
Rhumatologie et Médecine InterneCHU de MARTINIQUE
Tel : 05 96 55 22 55
Philippe CARRERE
CHU de POINTE- À-PITRE/ABYMESMédecine Générale
Tel : 06 90 99 99 11 Benoit DE RIVOYRE
CHU de POINTE- À-PITRE/ABYMESOphtalmologie
Tel : 05 90 89 14 50 Mathieu SEVERYNS
CHU de MARTINIQUEOrthopédie
Tel : 05 90 55 22 28 Cécile NABET
Parasitologie et MycologieCH de CAYENNE
Nathalie DOURNON
CHU de POINTE- À-PITRE/ABYMESMaladies Infectieuses
Tel : 05 90 89 15 45 Daphné BORJA DE MOZOTA
CHU de POINTE- À-PITRE/ABYMESGynécologie-Obstétrique
Tel : 05 90 89 19 89 Hassan DEBBAGH
CHU de MARTINIQUEUrologie
Tel : 05 96 55 22 71 Natacha JACQUES-ROUSSEAU
Anesthésiologie/RéanimationCHU de POINTE- À-PITRE/ABYMES Tel : 05 96 89 11 82 Paul BANCEL
CHU de POINTE- À-PITRE/ABYMESORL
Tel : 05 90 93 46 16 Astrid MONFORT
CardiologieCHU de MARTINIQUE Tel : 05 96 55 23 72 Eric PARIS
CHU de POINTE- À-PITRE/ABYMESRéanimation
Tel : 05 90 39 53 39 Ana Maria SAJIN
CHU de MARTINIQUE Psychiatrie
Tel : 05 96 55 20 44 Ali GHASSANI
CHU de POINTE- À-PITRE/ABYMESGynécologie-Obstétrique
Tel : 05 90 89 19 89 Aurélie PIERRE-JUSTIN
CHU de POINTE- À-PITRE/ABYMESNeurologie
Tel : 05 90 89 13 40 Paola GALLI-DARCHE
CHU de MARTINIQUENeurologie
Clément MOUREAUX
CHU DEPOINTE- À-PITRE/ABYMESUrologie
Tel : 05 94 39 53 39 Josué MOUNSAMY
Clinique les Nouvelles Eaux Marines et Médecine Générale
Cabinet Axiane PLACIDE
Florence NIEMETZKY
Médecine GénéraleCH de CAYENNE
Tel : 05 94 39 50 50 Professeurs EMERITES Bernard CARME Parasitologie Aimé CHARLES-NICOLAS Psychiatrie Adulte Serge ARFI Médecine Interne
Remerciements
Professeur Bergmann je vous remercie de présider ma soutenance et de m’avoir accordée ce privilège.
Messieurs les Professeurs Mouly et Guillausseau à chacun, merci d’être présent et de me faire l’honneur d’apprécier mon travail, je vous assure de ma haute considération.
A mon maitre de thèse : Docteur Sylvain Diamantis. Tu m’as fait un cadeau précieux : travailler à tes côtés. Je te remercie pour le partage de tes connaissances, ta curiosité, ton humour. Je remercie ta fidélité et ta confiance. Nausicaa, je suis touchée par ton grand cœur et ton intégrité.
Je dédie ma thèse : Aux « petites », mes sœurs : Camille et Alix. Animées de grandes promesses à la vie, vous avez l’avenir à portée. Je vous le souhaite merveilleux et serai à vos côtés. A la « grande », Axelle, ma sœur, toi artiste, moi médecin, nous nous comprenons .Ta sensibilité, ta créativité et ton intelligence me touchent .Je bénis le jour de ta naissance et tous ceux à venir que je passerai à tes côtés. A Papou. Tu m’as révélée « le monde des possibles » et surtout le fait que j’avais le devoir d’y participer. Tu m’as toujours encouragée par ton amour et tes rêves. A mon Tonton : comme il se doit d’économiser l’encre… je ne peux t’écrire que je te remercie de ton soutien dans bien des domaines. A ma Let, je remercie ton amitié si vraie et d’avoir toujours eu confiance en moi. A Mengou, merci pour ta patience, ton professionnalisme et surtout pour ton amitié à toute épreuve. A Madame le Professeur Nicole Kaplan, made of gold. To Professor Peter Kaplan, I assure you my empathy and sincere respect. A mes amies, mes sœurs et frère de
médecine : Marielle, Amel, Laetitia, Sofiane, je vous garde en mon cœur après ces longues années d’études et d’expériences, pour un avenir rempli de joies et de partage.
A Anthony, pour le plus beau des avenirs. Avec tout mon amour.
Après mon internat dans la Caraïbe et en Guyane, je tiens à remercier mes chefs de médecine de l’Outre-mer qui m’ont appris à prendre ma place au sein de la Médecine. Mes pensées vont particulièrement à Professeur Chatôt-Henry, Professeur Hélène-Pelage, Docteur Gonon, Docteur Thirion, Docteur Poucaud, Docteur Clavel. Merci pour votre enseignement et votre humanité.
RESUME
« ANTIBIOTHERAPIE INTRAVEINEUSE A DOMICILE : EVALUATION DES PRATIQUES ».
Les enjeux économiques et écologiques justifient l’usage de l’antibiothérapie intraveineuse à domicile. Si elle est largement utilisée dans les pays anglo-saxons, elle est peu décrite et non encadrée en France. La généralisation de cette pratique en France multiplie le nombre de prestataires de santé qui proposent la mise en place de dispositifs spécifiques à domicile.
Objectif : Décrire et évaluer la sécurité des prescriptions et de l’administration d’antibiothérapies intraveineuses domicile par une société prestataire de santé.
Méthode : Analyse rétrospective des prescriptions et des modalités d’administration d’antibiothérapies intraveineuses à domicile prises en charge par la société Proximed, secondairement à la prescription de médecins exerçant en Seine et Marne, de janvier à juin 2014. Les prescriptions, molécules, posologies, durées et indications de traitement, ainsi que les modalités d’administration ont été évaluées par un infectiologue.
Résultats : Cent seize prescriptions concernant 104 patients ont été analysées. Les principales molécules utilisées sont les céphalosporines de troisième génération (45%), les pénicillines avec inhibiteurs (27%) puis viennent les carbapénèmes (12%). Les antibiothérapies sont à large spectre pour 83% des prescriptions et présentent une activité anti-pseudomonas dans 37% des cas. Vingt quatre pour-cent des durées de traitement sont supérieurs à 20 jours. Sept pour-cent des perfusions sont « optimisés » dont 2% en
perfusion continue. La sécurité de l’administration et l’évaluation globale des prescriptions sont jugées adéquates dans respectivement 96% et 59% des cas.
Conclusion : La sécurité d'administration d’antibiothérapies à domicile prises en charge par un prestataire de santé est satisfaisante. Cependant l'usage important de molécules à large spectre et la présence de durées de traitement prolongé évoquent un usage non encadré qui exposent à des risques écologiques et iatrogéniques. Il semble nécessaire de créer un système de surveillance et de produire un référentiel à destination des médecins généralistes.
Mots clés : antibiothérapie intraveineuse à domicile, antibiotique large spectre, paramètres Pk/Pd, perfusion continue, résistance bactérienne, stabilité.
ABSTRACT
“HOME THERAPY USING INTRAVENOUS ANTIBIOTICS: PRACTICES
ASSESMENT”.
Economical issues and microbial ecology justify the using of outpatient intravenous antimicrobial therapy. This practice is largely limited to English-speaking countries, it is poorly described in medical French literature and it is not subjected to guidelines in France. Faced with is increased use in France, many home health providers offer infusion equipment and provide intravenous antibiotic treatment administration.
Objectives: Our study aims to describe and evaluate medical prescriptions and security administration of antibiotics intravenous treatment.
Method: The study involved a retrospective review of home intravenous antibiotics doctors’s prescriptions practicing in the Seine et Marne basin, from January to June 2014, provided by Proximed company. Medical prescriptions, antibiotic molecules, doses, treatment periods, medical indications, drug preparing and administration methods, has been evaluated by an infection diseases specialist.
Results: Including 104 patients, 116 medical prescriptions has been analyzed. Principal molecules used are cephalosporins third generation 52 (45%), penicillins with inhibitor 31 (27%), carbapenems 14 (12%), broad-spectrum antibiotics 96 (83%), anti-pseudomonas activity 43 (37%). Treatment periods more than 20 days represent 28 (24%) and continuous infusions 2 (1, 7%). The global prescriptions assesment is adequate in 68 (59%), the administration security practice in 111 (96%) and the infusion optimization is in 8 (7%).
Conclusion: Home intravenous antibiotic treatment administration practice is safe. However the evaluation of prescriptions or practice patterns reveals a widespread use of broad-spectrum antibiotics for extended periods and the lack of an optimal continuous infusion regimen show that the practice is not supervised, thus exposing the patient to iatrogenic risks and bacterial antibiotic resistance problems.
There is a need to disseminate the optimal recommendations for the use of intravenous antibiotics and to create a baseline of medical indications and therapy monitoring to primary care doctors.
Keywords: OPAT, broad-spectrum antibiotic, Pk/Pd parameters, continuous infusion, antibiotic resistance, stability.
SOMMAIRE
ABREVIATIONS ... 21
LISTE DES FIGURES ... 23
LISTE DES TABLEAUX ... 24
I. INTRODUCTION ... 26
1. Recommandations ... 29
1.1. Données de la British Infectiology Association (BIA) ... 29
1.2. Données américaines de l’ Infectious Diseases Society of America (IDSA) ... 32
2. Bon usage des antibiotiques ... 35
2.1 Emergence de la multirésistance aux antibiotiques... 35
2.2. Modalités de contrôle de l’usage des antibiotiques en secteur hospitalier ... 36
2.2.1. Acteurs institutionnels hospitaliers ... 36
2.2.2. Référent(s) en antibiothérapie ... 37
2.2.3. Pharmacie hospitalière ... 37
2.3. Modalités de contrôle de l’usage des antibiotiques en ville ... 38
2.3.2. Contrôle rétrospectif de l’Assurance Maladie ... 39
2.3.3. Contrôle des molécules retrocédables ... 39
2.4. Dispositifs de contrôle intersectoriel ... 40
3. Modes de dispensation des molécules antibiotiques intraveineuses ... 41
3.1. Dispensation en officine de ville ... 41
3.2. Dispensation strictement hospitalière ... 41
3.3. Rétrocession hospitalière... 42
4. Antibiotiques « critiques » ... 44
5. Antibiothérapie intraveineuse ... 45
5.1. Stabilité des molécules ... 45
5.1.1. La température ... 46 5.1.2. La lumière et l’oxygène ... 47 5.1.3. Le solvant ... 48 5.1.4. La concentration ... 49 5.1.5. Le pH ... 49 5.1.6. Matériaux du contenant ... 50
5.1.7. Interactions médicamenteuses ... 50
5.2. Molécules antibiotiques, classifications ... 51
5.3. Indications et durées de traitement ... 54
5.4. Règles de prescription ... 55
5.5. Risque iatrogénique ... 55
5.5.1. Choix de la molécule antibiotique ... 56
5.5.2. Préparation de la solution ... 57
5.5.3. Administration de la solution ... 57
5.6. Modes d’administration de la solution antibiotique ... 57
5.7. Matériel de perfusion, dispositifs d’accès vasculaire ... 58
5.8. Optimisation des paramètres Pk/Pd... 61
6. Organisation de la prise en charge de l’antibiothérapie intraveineuse à domicile en France au moment de l’étude... 64
6.1. Données françaises ... 64
6.2. Responsabilité des soins ... 64
6.2.1. Prestataires de santé à domicile ... 64
6.2.3. Médecin généraliste ... 67
II. MATERIEL ET METHODES ... 68
1. Hypothèses ... 68
2. Objectif ... 68
3. Design de l’étude ... 68
3.1. Déroulement de l’étude ... 69
3.2. Recueil des données ... 69
3.3. Données relevées ... 69
3.4. Evaluation des données ... 70
4. Population de l’étude ... 71
4.1. Critères d’inclusion ... 71
4.2. Critère d’exclusion ... 71
III. RESULTATS ... 72
1. Résultats descriptifs des prescriptions et de l’administration ... 72
1.1. Nombre de prescriptions recueillies ... 72
1.3. Caractéristiques de l’ administration ... 77
2. Résultats descriptifs de l’évaluation ... 78
2.1. Evaluation de l’adéquation de la prescription selon l’indication renseignée .... 78
2.2. Evaluation de l’usage de la molécule ... 78
2.3. Evaluation de la sécurité du mode d’administration ... 78
2.4. Evaluation de la prescription médicale ... 79
2.5. Evaluation globale de la prescription ... 79
2.6. Optimisation des prescriptions ... 80
2.7. Synthèse des résultats descriptifs et analytiques de l’étude (Tableau 11) ... 80
IV. DICUSSSION ... 82
1. Principaux résultats ... 82
1.1. Indications des antibiothérapies par voie intraveineuse ... 82
1.2. Molécules utilisées ... 84
1.3. Modalités d’usage des molécules ... 85
1.4. Sécurité d’administration ... 85
1.6. Optimisation des prescriptions ... 87
2. Limites de l’étude ... 89
3. Perspectives ... 90
3.1. Mise en place d’une surveillance de l’usage des antibiotiques intraveineux critiques en ville ... 90
3.2. Rédaction de recommandations à usage pratique pour les médecins généralistes91 3.3. Coordination et structuration de la filière de soins ... 93
3.4. Spécificité aux Antilles Guyane : instabilité des molécules aux températures élevées. ... 95
3.5. Optimisation des paramètres Pk/Pd en perfusion continue ... 96
4. Evolutions observées depuis la réalisation de l’audit ... 97
4.1. Communication au congrès de la Réunion Interdisciplinaire de Chimiothérapie anti-Infectieuse 2014 ... 97
4.2. Recommandations du GRIIF publiées dans la revue Médecine et Maladies Infectieuses ... 97
4.3. Evolutions de l’encadrement des pratiques ... 97
V. CONCLUSION ... 100
ANNEXES ... 106
SERMENT D’HIPPOCRATE ... 118
ABREVIATIONS
ANSM : Agence Nationale de sécurité du Médicament ayant remplacé l’AFFSAPS : Agence Française de Sécurité Sanitaire des Produits de Santé.
AMM : Autorisation de mise sur le marché
ARS : Agence régionale de santé
BIA : British Infectiology Association
BLSE : Bêta-lactamase à spectre étendu
BMR : Bactéries multi-résistantes
CAI : Commission des anti-infectieux
CCLIN : Centre de coordination de la lutte contre les infections nosocomiales
CDC: Center for Disease Control and Prevention
CE: Conforme aux exigences
CG3: Céphalosporines de troisième génération
CLIN : Comité de lutte contre les infections nosocomiales
CNEDIMTS : Commission nationale d’évaluation des dispositifs médicaux et des technologies de santé (dispositif national auprès de l’HAS)
CME : Commission médicale d’établissement
CMI : Concentration minimale inhibitrice
COMEDIMS : Commission des médicaments et des dispositifs médicaux stériles
CSP : Code de santé publique
DCI : Dénomination commune internationale
DEHP : Di (2-éthylhexyl) phtalate
DMS: Durée moyenne de séjour
ECDC: European Center for Disease Prevention and Control
EPPI : Eau pour préparations injectables
ERASME : Extraction, recherche et analyse pour un suivi médico-économique
FQ: Fluoroquinolones
GRIIF : Groupe des référents en infectiologie d’Ile de France
HAD: Hospitalisation à domicile
IDE : Infirmier(ère) diplômé(e) d’état
IDSA: Infectious Diseases Society of America
IM : Intramusculaire
InVS: Institut national de Veille Sanitaire
IV : Intraveineux/se
IVD : Injection intraveineuse directe
IVSE : Injection intraveineuse à la seringue électrique
OMEDIT : Observatoire du médicament, des dispositifs médicaux et de l’innovation thérapeutique (dispositif régional auprès de l’ARS)
OPAT : Outpatient parenteral antimicrobial therapy (antibiothérapie intraveineuse à domicile)
PAC : Porth à cath (chambre implantable)
pH : potentiel Hydrogène
Pk/Pd : Pharmacokinetic/pharmacodynamic (Pharmacocinétique/pharmacodynamie)
PROPIAS : Programme national d’actions de prévention des infections associées aux soins
PVC : Polychlorure de vinyle
RCP : Résumé des caractéristiques du produit
RICAI : Réunion Interdisciplinaire de Chimiothérapie Anti-Infectieuse
SC : Sous-cutané(e)
SPILF : Société de Pathologie Infectieuse de la Langue Française
SSIAD : Services de soins infirmiers à domicile
UK: United-Kingdom
UV: Ultra-violets
VVP : Voie veineuse périphérique
LISTE DES FIGURES
Figure 1 : Dispositifs d’accès vasculaires, débits de perfusion et marges d’erreur. ... 60
Figure 2 : Modélisation des paramètres Pk/Pd... 61
Figure 3 : Perfusion continue de bêta-lactamines et état d’équilibre. ... 62
Figure 4 : Fractionnement de la dose journalière de bêta-lactamines à demi-vie courte. . 63
Figure 5: Résultats de la répartition des indications à l’antibiothérapie intraveineuse à domicile. ... 73
Figure 6 : Résultats de la répartition des molécules antibiotiques intraveineuses utilisées dans l’étude. ... 75
Figure 7 : Résultats de la répartition des antibiotiques intraveineux utilisés en fonction de leur potentiel de résistance bactérienne. ... 76
LISTE DES TABLEAUX
Tableau 1 : Propriétés et stabilités des molécules anti-infectieuses. ... 33
Tableau 2 : Suggestions de surveillance des paramètres biologiques selon l’anti-
infectieux. ... 34
Tableau 3: Liste non exhaustive des antibiotiques injectables selon leur mode de
dispensation. ... 43
Tableau 4: Liste des antibiotiques « critiques ». ... 45
Tableau 5 : Stabilité de différentes bêta-lactamines en fonction de la température. ... 46
Tableau 6 : Stabilité de la pénicilline G (benzylpénicilline) en poches réfrigérées. ... 47
Tableau 7 : Stabilité de l’ampicilline et de l’aztréonam en fonction du solvant de dilution.
... 48
Tableau 8 : Classification des antibiotiques intraveineux utilisés dans l’étude, par familles chimiques. ... 51
Tableau 9 : Classification non exhaustive des antibiotiques en fonction de leur activité antimicrobienne. ... 52
Tableau 10 : Durées de traitement selon les guidelines. ... 54
Tableau 11 : Résultats descriptifs et analytiques de l’étude, présentation au congrès de la RICAI 2014. ... 81
I. INTRODUCTION
Depuis plusieurs décennies la conjoncture économique et la transition épidémiologique ont accéléré le « virage ambulatoire » des prises en charges médicales (1) . La thérapie intraveineuse à domicile favorise la réduction du coût hospitalier en diminuant la durée moyenne de séjour (DMS) (2–4).
Ainsi un certain nombre d’hôpitaux ont mis en place des moyens de prise en charge « hors mur » comme les services d’hospitalisation à domicile (HAD) ou des services de soins infirmiers à domicile (SSIAD). Les réseaux de santé d’oncologie et de pneumologie participent depuis plusieurs années à la prise en charge ambulatoire de leurs patients chroniques (5,6).
Pour les maladies infectieuses, l’antibiothérapie intraveineuse (IV) à domicile ou « outpatient antimicrobial therapy »(OPAT) dans la littérature scientifique internationale, est utilisée et évaluée depuis plus de 30 ans dans les pays anglo-saxons encadrée par des recommandations émanant des différentes sociétés savantes (7–9).
En plus de la maîtrise des coûts hospitaliers, l’antibiothérapie intraveineuse à domicile présente de nombreux avantages : son efficacité thérapeutique est démontrée, le risque d’infections nosocomiales est diminué et la reprise précoce d'une certaine autonomie impacte sur la qualité de vie du patient (4).
En France son usage semble encore peu répandu et n’est encadré par aucune recommandation ou texte réglementaire. La pratique se développe en France et de
nombreuses sociétés prestataires de santé à domicile ouvrent leur offre de prestation aux dispositifs d’accès vasculaire dédiés à l’antibiothérapie intraveineuse.
Le médecin généraliste au centre du système de soins ambulatoires français, sera amené à assurer le suivi et à faire face aux complications et aux effets indésirables susceptibles de survenir au cours de ces thérapeutiques. Outre un rôle de surveillance le plus souvent subi secondairement aux prescriptions hospitalières, le médecin généraliste peut être amené à surseoir un recours hospitalier en faisant bénéficier son patient d’une antibiothérapie intraveineuse à domicile.
Il existe de nombreuses limites à cette pratique en l’absence de mesures d’encadrement strictes comme elle en bénéficie théoriquement en milieu hospitalier.
En effet, la préparation de l’antibiothérapie intraveineuse est sous la responsabilité de la pharmacie d’usage intérieur et la reconstitution, la perfusion et la surveillance des effets secondaires sont des missions infirmières, présentes de manière continue en milieu hospitalier sous responsabilité médicale permanente.
En plus de ces différents paramètres, en secteur ambulatoire, la prescription médicale n’est ni encadrée par le référent antibiotique ni pas le pharmacien hospitalier. Le patient est ainsi exposé à de multiples risques : un risque d’échec thérapeutique par instabilité des principes actifs utilisés dans des conditions non standardisées hospitalières, un risque iatrogénique par défaut de surveillance protocolaire et un risque écologique bactérien par l’usage prolongé d’antibiotiques à large spectre échappant au contrôle de la pharmacie hospitalière (10,11).
En France la pratique de l’antibiothérapie intraveineuse à domicile faisant intervenir une société prestataire de santé n’a jamais été évaluée.
L’objectif de cette thèse est de décrire et d’évaluer l’adéquation des prescriptions aux recommandations, ainsi que la sécurité de la préparation et de l’administration d’antibiothérapies intraveineuses par une société prestataire de santé à domicile.
1.
Recommandations
1.1. Données de la British Infectiology Association (BIA)
Les recommandations de bonne pratique pour le programme de l’antibiothérapie intraveineuse en ambulatoire, sont la mise à jour des déclarations de consensus précédentes par la BIA. Le sujet est celui de l’ « outpatient antimicrobial therapy » (OPAT) au Royaume-Uni publié en 2012 (7).
Il s’agit d’une analyse poussée de la bibliographie pendant plus de 12 ans, du 1er janvier 1998 au 30 juin 2010, avec 615 références initiales.
Les éléments de réflexion sont organisés à partir de critères restrictifs et codifiés de manière à organiser la prise en charge du patient.
Les résultats sont des conseils pratiques sur l'élaboration et la prestation des services de l’OPAT afin d’examiner tous les aspects de la conception et de la réalisation de ce programme. Ils informent également des niveaux de responsabilité clinique et de la nécessité d’une communication entre les intervenants. Les guidelines mettent aussi en avant l’importance de l’évaluation-qualité du programme pour chaque dossier avec des études prospectives permettant d’améliorer la prise en charge.
Les résultats sont organisés de la manière suivante :
La structure et la formation de l’équipe OPAT est décrite dans le cadre de centres médicalisés spécialisés en soins ambulatoires (avec retour au domicile du patient durant la nuit). L’équipe pluridisciplinaire est constituée au minimum d’un médecin clinicien et d’un spécialiste en maladies infectieuses, un pharmacien microbiologiste et d’une infirmière spécialisée en pose de matériels intraveineux périphériques et centraux.
Elle se réfère à des schémas thérapeutiques standards évalués et documentés par l’équipe OPAT et adaptés à chaque patient.
La responsabilité clinique est partagée entre le référent clinicien et le spécialiste en maladies infectieuses ; le médecin généraliste est mis au courant de la participation de ses patients au programme OPAT.
La sélection du patient est sous la responsabilité du médecin spécialiste en maladies infectieuses en accord avec les critères d’inclusion ou d’exclusion pour bénéficier de l’OPAT. Ceux-ci intègrent notamment les critères de sévérité de l’infection active et les critères d’aptitudes du patient (physiques, sociaux, économiques).
A noter que tous les patients sont susceptibles d’être à risque de thromboses veineuses, la question d’une prophylaxie est discutée de manière systématique.
La gestion de la prescription des antibiotiques et leur administration sont sous la responsabilité du référent en maladies infectieuses après discussion avec le médecin traitant.
La qualité des soins pharmaceutiques doit être équivalente aux soins prodigués en hospitalisation, ce qui donne une place primordiale au pharmacien microbiologiste en charge de délivrer les molécules et de surveiller leur utilisation. Le choix de l’anti-infectieux doit être contrôlé par le pharmacien microbiologiste.
L’administration intraveineuse doit être pratiquée par des équipes infirmières compétentes et spécialisées dans ce domaine, et la première dose doit être administrée dans un cadre supervisé afin de gérer un risque éventuel d’anaphylaxie..
Le suivi du patient pendant l’OPAT doit se faire de manière pluridisciplinaire et de manière hebdomadaire pour discuter de la surveillance et de l’efficacité du traitement. La surveillance clinique pratiquée par l’infirmière et le clinicien doit être quotidienne. La surveillance biologique du patient est au moins hebdomadaire avec une numération formule sanguine, une fonction rénale et hépatique, un indice de l’infection et au cas échéant des dosages spécifiques de la thérapeutique choisie.
Un dispositif d’astreinte doit être mise en place en cas d’événements indésirables afin de procurer des conseils et avis.
Tous les actes médicaux et paramédicaux doivent être référenciés par écrit et communiqués aux patients.
Le suivi post OPAT repose sur des audits d’évaluation de l’efficacité des soins et de la qualité de l’organisation par analyse prospective des données de chaque dossier, dans le but de perfectionner le programme et de s’assurer que les services OPAT soient de haute qualité avec des soins à faible risque, quel que soit l’établissement de santé.
Les recommandations de la BIA sont orientées pour l’organisation et la prise en charge en institutions médicalisées. Au niveau des soins strictement à domicile, la participation directe des médecins généralistes « n'a pas tenu le rythme » en grande partie en raison des faibles niveaux de remboursement des soins. Ces recommandations sont surtout adressées au médecin prescripteur clinicien spécialiste en maladies infectieuses.
1.2. Données américaines de l’ Infectious Diseases Society of America (IDSA)
Le modèle de l’OPAT aux Etats-Unis suit les grandes lignes directrices de la BIA.
A partir d’une recherche bibliographique poussée et d’études rétrospectives, les guidelines des Etats-Unis sont orientées autour du choix des molécules afin d’être utilisées de manière optimale. Elles décrivent précisément les propriétés des molécules antibiotiques utilisées dans l’OPAT (9).
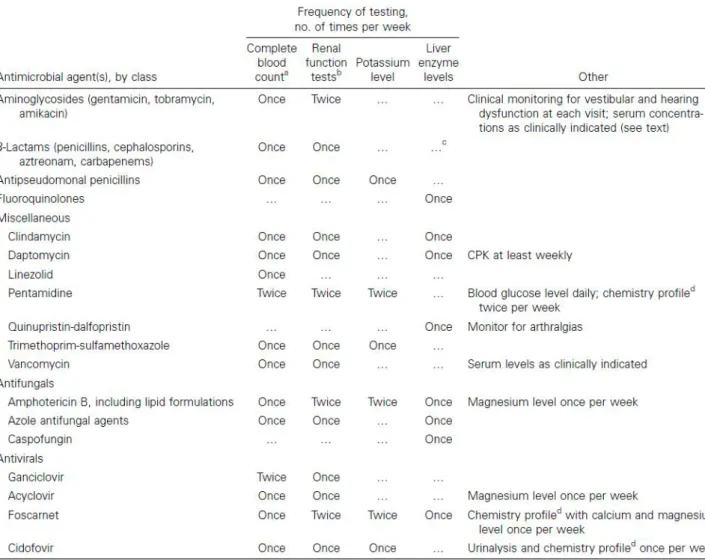
L’indication d’une molécule et son mode d’administration dépendent de multiples facteurs qui touchent à des notions spécialisées en infectiologie (Tableau 1) :
la demi- vie d’une molécule détermine la fréquence d’administration,
le niveau de risque de thrombose veineuse influence le type de dispositif d’accès vasculaire (DAV) à utiliser préférentiellement,
la stabilité moléculaire détermine le mode et le rythme de reconstitution du produit, et la manière dont il doit être stocké.
Tableau 1 : Propriétés et stabilités des molécules anti-infectieuses.
Notes : D, day(s), jour(s) ; ND, no data, non communiqué; TMP-SMZ,
triméthoprime-sulfaméthoxazole. aDisponible (12) . b Risque de causes de phlébite: 1, léger ; 2, modéré ; 3, élevé. c
Solution optimale saline ou dextrose 5%, selon l’antibiotique. d Ne doit pas être réfrigéré. e A
protéger des rayons UV. f Formation de produits de dégradation après plusieurs heures. Source
Les effets toxiques des molécules anti-infectieuses ne sont pas exceptionnels, ils sont également décrits et une planification de surveillance biologique est proposée en fonction des molécules utilisées (Tableau 2).
Tableau 2 : Suggestions de surveillance des paramètres biologiques selon l’anti- infectieux.
Notes : Les fréquences de surveillance concernent les patients adultes avec une fonction rénale normale ou stable. aDoit inclure les dosages des leucocytes et des plaquettes. bLa fonction rénale inclue les dosages de créatinine et urée plasmatiques et urinaires. cDosage hebdomadaire des enzymes hépatiques pour l’oxacilline et les carbapénèmes.dProfile biochimique incluant les enzymes hépatiques et ionogramme sanguin. Source (9).
Les guidelines de l’Infectious Diseases Society of America (IDSA) complètent celles de la British Infectiology Association (BIA) en centrant les informations sur les propriétés des molécules afin de les utiliser de manière optimale. La documentation des molécules est régulièrement remise à jour et disponible sur le web (13).
.
2.
Bon usage des antibiotiques
2.1 Emergence de la multirésistance aux antibiotiques
L’utilisation massive et répétée d’antibiotiques au fil du temps génère une pression de sélection sur les bactéries de la flore digestive et concourt à l’émergence puis à la diffusion de bactéries résistantes qui menacent l’efficacité des traitements à court, moyen et long termes (14).
De nombreuses données rapportent désormais une mortalité et une morbidité liées à la multirésistance bactérienne. Le Center for Disease Control and Prevention (CDC) d’Atlanta publie les premières données en 2013 (15). Puis le rapport anglais de l’European Centre for Disease Prevention and Control (ECDC) de 2015 pronostique la menace de la résistance dans les dizaines d’années à venir (16). Enfin la France en 2015 édite un travail de l’Institut national de Veille Sanitaire (InVS) présentant les premières estimations de la mortalité imputable à l’antibiorésistance (17).
Les antibiotiques dits à « large spectre » ont un impact plus important sur le microbiote intestinal et donc sont plus pourvoyeurs de multirésistance. Ils sont souvent d’administration obligatoire par voie intraveineuse contraignant leur usage au milieu hospitalier. Cependant la généralisation de l’antibiothérapie intraveineuse en ville permet
l’usage de certaines de ces molécules : les C3G (céfépime, ceftazidime), les bêta-lactamines anti-pseudomonas (pipéracilline+tazobactam, ticarcilline+acide clavulanique, imipénème) sont particulièrement concernées par le phénomène de résistance bactérienne (18).
La problématique de la multirésistance bactérienne aux antibiotiques autrefois associée exclusivement aux séjours hospitaliers est désormais autant présente en ville qu’à l’hôpital. L’émergence des entérobactéries productrices de carbapénèmases est principalement d’origine communautaire (19).
2.2. Modalités de contrôle de l’usage des antibiotiques en secteur hospitalier
2.2.1. Acteurs institutionnels hospitaliers
La commission des anti-infectieux (CAI) est une sous-commission de la commission des médicaments et des dispositifs médicaux stériles (COMEDIMS), elle a principalement en charge la politique des antibiotiques au sein des établissements hospitaliers (20). La CAI est chargée d’impulser et de coordonner des actions en matière de bon usage des antibiotiques. Elle a un rôle transversal en représentant toutes les spécialités concernées par la prescription d’antibiotiques. Les actions de la CAI font l’objet d’un rapport annuel présenté à la Commission médicale de l’établissement (CME) (21).
Le Comité de lutte contre les maladies nosocomiales (CLIN) est une émanation de la CME, qui assure un rôle de prévention par la mise en œuvre de protocoles d’hygiène, de surveillance des infections nosocomiales et examine la consommation
antibiotique au regard de la nature des activités médicales et des résistances bactériennes (21).
.
2.2.2. Référent(s) en antibiothérapie
Le référent est un praticien formé à l’antibiothérapie, titulaire d’un diplôme d’études supérieures complémentaires (DESC) de pathologie infectieuse et tropicale, il est désigné par le directeur de l’établissement sur proposition de la CME. Il intervient comme consultant auprès du médecin prescripteur dans l’indication, le choix et la conduite de la meilleure antibiothérapie. Dans la plupart des hôpitaux, la délivrance de certaines molécules est soumise à la validation préalable obligatoire du référent antibiotique selon des règles bien précises (21). Il s’assure de la présence de la liste d’ « antibiotiques ciblés » à réévaluer, à suivre et à dispenser nominativement, comportant en priorité les carbapénèmes, les C3G et les FQ.
Le référent antibiotique aide à des actions d’évaluation (audits de pratiques) et de recherches cliniques en collaboration avec les services cliniques, les services de pharmacie et de microbiologie médicale et l’équipe opérationnelle en hygiène (20).
2.2.3. Pharmacie hospitalière
A l’hôpital, l’encadrement de l’utilisation de molécules antibiotiques est sous la responsabilité de la pharmacie à usage intérieur (PUI) des établissements de santé. Le pharmacien dispense l’antibiotique après « analyse pharmaceutique de l’ordonnance ». En cas de non-conformité, le prescripteur doit être contacté et l’avis du référent antibiotique doit être sollicité.
Les PUI ont des missions d’évaluations épidémiologiques, pharmaco-économiques et de pharmacovigilance, soit un devoir de contrôle de chaque antibiotique délivré et plus spécifiquement des molécules ayant un fort impact écologique.
La réévaluation de ces ordonnances est obligatoire toutes les 48 heures ou limitées pour des durées de 7 jours si l’agent infectieux est documenté, et doivent être régulièrement justifiées auprès de la PUI afin d’obtenir les molécules (22).
2.3. Modalités de contrôle de l’usage des antibiotiques en ville
2.3.1. Responsabilité de la prescription
La prescription est réservée aux prescripteurs légalement autorisés. Elle est sous responsabilité médicale. Elle obéit à certaines règles fixées dans le Code de déontologie médicale et le Code de la santé publique (23). "Dans les limites fixées par la loi, le médecin est libre de ses prescriptions qui seront celles qu'il estime les plus appropriées en la circonstance. Il doit, sans négliger son devoir d'assistance morale, limiter ses prescriptions et ses actes à ce qui est nécessaire à la qualité, à la sécurité et à l'efficacité des soins. Il doit tenir compte des avantages, des inconvénients et des conséquences des différentes investigations et thérapeutiques possibles."
Dans ce cas le choix de la molécule antibiotique appartient au médecin prescripteur selon ses connaissances et son expérience personnelles.
2.3.2. Contrôle rétrospectif de l’Assurance Maladie
Les médecins libéraux reçoivent tous les trois mois un relevé individuel d'activité et de prescriptions (RIAP). Ce document retrace tous les éléments relatifs à l'activité et aux prescriptions figurant sur les feuilles de soins ayant donné lieu à remboursement par les caisses des différents régimes d'Assurance Maladie depuis le début de l'année civile, selon le code de la Sécurité sociale (24).
Pour le régime général, ces données sont analysées et peuvent être référencées au niveau régional dans la base de données ERASME (Extraction, recherche et analyse pour un suivi médico-économique) permettant de retracer, comptabiliser les prescriptions et de réaliser des études, notamment sur l’état des lieux des prescriptions d’antibiotiques en ambulatoire dans le cadre de projets régionaux de santé (25).
2.3.3. Contrôle des molécules retrocédables
Selon l’article L5126-4 du CSP, dans l'intérêt de la santé publique, le ministre chargé de la santé arrête, par dérogation aux dispositions de l'article L. 5126-1, la liste des médicaments que certains établissements de santé, disposant d'une pharmacie à usage intérieur, sont autorisés à vendre au public. Cependant, à ce jour, il n’existe de contrôle de suivi concernant les molécules rétrocédées par la PUI, à destination d’une prise en charge ambulatoire.
2.4. Dispositifs de contrôle intersectoriel
Les Centres interrégionaux de coordination de la lutte contre les infections nosocomiales (CCLIN) ont la mission de surveillance des infections liées aux soins à l’hôpital, et depuis 2011 ils participent au programme national des infections liées aux soins (IAS) par des actions de prévention dans les différents secteurs de l’offre de soins, notamment dans le secteur médicosocial (26). Dans le secteur ambulatoire, des enquêtes sont menées, par exemple sur les pratiques des infirmiers libéraux en Seine et Marne en matière de prévention des risques liés aux soins réalisés à domicile en 2012 (26).
Le PROPIAS (Programme national d’actions de prévention des infections liées aux soins) diffusé en juillet 2015, fait suite au plan stratégique national 2009-2013 de prévention des infections associées aux soins (IAS). Il vise à favoriser la mutualisation des moyens, la cohérence et la continuité des actions de prévention tout au long du parcours de santé (27).
Le plan antibiotique 2011-2016 prévoit la mise en place de plates-formes de conseil en antibiothérapie pour apporter au médecin de ville une aide à la prescription, cependant ces acteurs n’ont pas de fonction de contrôle mais uniquement d’appui (14).
3.
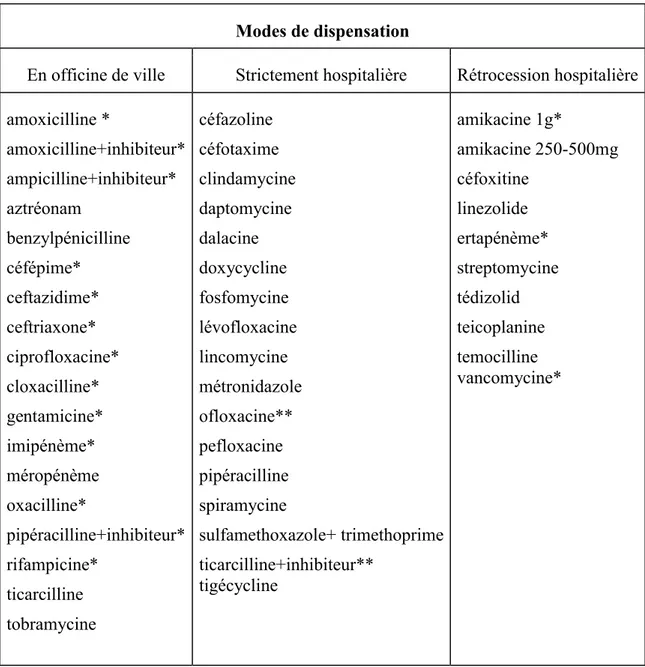
Modes de dispensation des molécules antibiotiques intraveineuses
Il existe trois modes de dispensation des molécules antibiotiques intraveineuses
(Tableau 3).
3.1. Dispensation en officine de ville
Un grand nombre de molécules antibiotiques intraveineuses sont disponibles en ville et peuvent être prescrites par le médecin généraliste. Pour savoir si un médicament est disponible en ville ou à l’hôpital il est possible de consulter différentes bases de données Thériaque (28), Thésorimed (29), à partir des résumés caractéristiques des produits (RCP) disponibles dans le répertoire des médicaments proposé par l’ANSM ( Agence nationale pour la sécurité du médicament).
Paradoxalement un antibiotique à large spectre comme la pipéracilline+tazobactam est disponible en officine de ville, alors que la pipéracilline seule est à prescription hospitalière stricte. La pipéracilline+tazobactam échappe donc au contrôle de la pharmacie hospitalière.
3.2. Dispensation strictement hospitalière
Conformément au code de la santé publique, les établissements de santé peuvent disposer d’une PUI, dont l’usage est réservé aux patients de l’établissement (30). Certaines molécules sont strictement dispensées en milieu hospitalier et sont sous le contrôle et la surveillance de la pharmacie hospitalière et du médecin référent antibiotique.
Tout patient en structure comportant une équipe médicale (HAD) peut bénéficier de molécules hospitalières strictes.
3.3. Rétrocession hospitalière
A titre dérogatoire, la pharmacie hospitalière est autorisée, par l’agence régionale de santé, à rétrocéder certaines molécules.
La dispensation, par une pharmacie hospitalière, de médicaments achetés par l’hôpital, à des patients ambulatoires est définie et organisée, en France, par le décret n°2004-546 du 15 juin 2004 (31).
Les molécules sont prescrites par les praticiens hospitaliers pour la plupart en initiation du traitement ; on remarque cependant que la vancomycine est rétrocédable en hospitalier et peut être prescrite par un médecin généraliste.
Pour être rétrocédables, les médicaments doivent être inscrits : d'une part sur la liste des spécialités agréées à l'usage des collectivités (32) et d'autre part sur une liste spécifique des médicaments qui peuvent être vendus au public, prise par arrêté du ministre chargé de la santé, après avis de l’ANSM (33).
Cette liste est souvent remise à jour et disponible sur le site du Ministère des Affaires sociales et de la Santé (34). Le Tableau 3 est indicatif pour janvier 2017.
Modes de dispensation
En officine de ville Strictement hospitalière Rétrocession hospitalière
amoxicilline * amoxicilline+inhibiteur* ampicilline+inhibiteur* aztréonam benzylpénicilline céfépime* ceftazidime* ceftriaxone* ciprofloxacine* cloxacilline* gentamicine* imipénème* méropénème oxacilline* pipéracilline+inhibiteur* rifampicine* ticarcilline tobramycine céfazoline céfotaxime clindamycine daptomycine dalacine doxycycline fosfomycine lévofloxacine lincomycine métronidazole ofloxacine** pefloxacine pipéracilline spiramycine sulfamethoxazole+ trimethoprime ticarcilline+inhibiteur** tigécycline amikacine 1g* amikacine 250-500mg céfoxitine linezolide ertapénème* streptomycine tédizolid teicoplanine temocilline vancomycine*
Tableau 3: Liste non exhaustive des antibiotiques injectables selon leur mode de dispensation.
Notes : *Molécules citées dans l’étude. ** Les molécules de ticarcilline+acide clavulanique et ofloxacine retrouvées dans l’étude, ne sont plus rétrocédables à ce jour. Source : élaboration de l’auteur, mise à jour janvier 2017.
4.
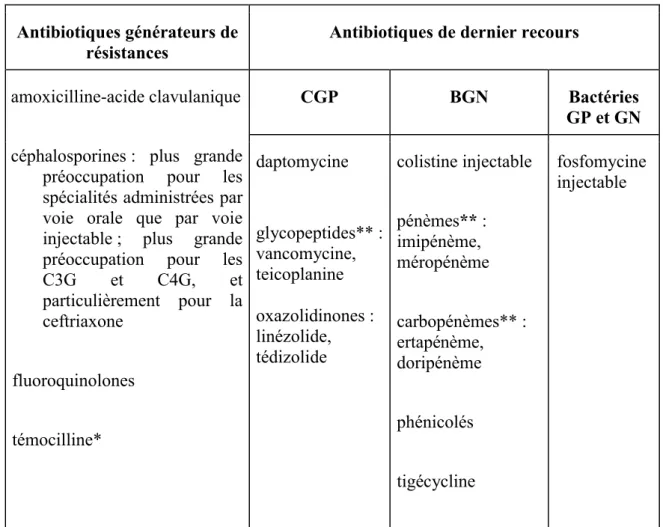
Antibiotiques « critiques »
Dans le cadre des actions à mener pour optimiser le bon usage des antibiotiques, la Direction générale de la santé (DGS) qui coordonne le « Plan national 2011-2016 d’alerte sur les antibiotiques » (13), a saisi l’ANSM sur les actions suivantes :
identifier et lister les classes d’antibiotiques particulièrement génératrices de résistances bactériennes ;
établir la liste des antibiotiques définis comme étant de « dernier recours » ;
établir un socle national minimal d’antibiotiques à dispensation contrôlée.
L’ANSM a mis au point une liste d’antibiotiques dits « critiques » (Tableau 4),
régulièrement réactualisée, reposant sur la notion de pression de sélection et sur l’intérêt en dernier recours; ils ont été catégorisés en deux groupes (35).
Antibiotiques générateurs de résistances
Antibiotiques de dernier recours
amoxicilline-acide clavulanique
céphalosporines : plus grande préoccupation pour les spécialités administrées par voie orale que par voie injectable ; plus grande préoccupation pour les
C3G et C4G, et particulièrement pour la ceftriaxone fluoroquinolones témocilline* CGP BGN Bactéries GP et GN daptomycine glycopeptides** : vancomycine, teicoplanine oxazolidinones : linézolide, tédizolide colistine injectable pénèmes** : imipénème, méropénème carbopénèmes** : ertapénème, doripénème phénicolés tigécycline fosfomycine injectable
Tableau 4: Liste des antibiotiques « critiques ».
Notes :*Pression de sélection en lien avec la problématique d’une dose optimale non établie. **Particulièrement générateurs de résistances bactériennes. Source : ANSM novembre 2016.
5.
Antibiothérapie intraveineuse
5.1. Stabilité des molécules
La stabilité d’une solution médicamenteuse est son aptitude à conserver au minimum 90% de ses propriétés physico-chimiques, microbiologiques et biopharmaceutiques dans des limites spécifiées pendant toute sa durée de validité et d’utilisation dans les conditions optimales (36). Elle dépend de multiples facteurs afin de garantir efficacité du principe actif et d’éviter la formation de produits de dégradation éventuellement toxiques.
5.1.1. La température
La plupart des RCP rappellent le niveau de stabilité des molécules dans le temps généralement à 25°C.
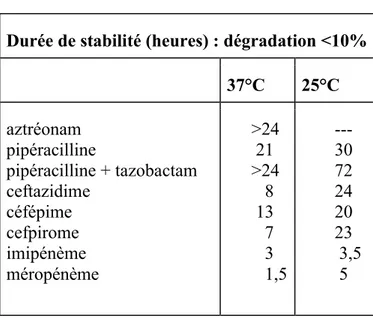
Peu de bêta-lactamines sont stables 24 heures à 37°C (Tableau 5) : seuls la pipéracilline, associée ou non au tazobactam, et l’aztréonam restent intacts. À cette température, la dégradation des C3G et des carbapénèmes est particulièrement importante. À 25°C, la situation s’améliore considérablement pour les C3G ainsi que pour les céphalosporines à large spectre qui restent stables sur une durée approchant 24 heures. En revanche, aucune amélioration n’est constatée pour les carbapénèmes qui restent particulièrement fragiles (37).
Durée de stabilité (heures) : dégradation <10%
37°C 25°C aztréonam pipéracilline pipéracilline + tazobactam ceftazidime céfépime cefpirome imipénème méropénème >24 21 >24 8 13 7 3 1,5 --- 30 72 24 20 23 3,5 5
Tableau 5 : Stabilité de différentes bêta-lactamines en fonction de la température. Source (37).
L’arrêté du 25 juillet 1977 relatif à la limitation de la température de chauffage dans les locaux hospitaliers impose une limite supérieure de chauffage moyenne à 22°C. La température de chauffage d’une pièce individuelle ne doit pas dépasser 24°C (38).
Le Tableau 6 indique clairement l’influence de la température sur la stabilité de la
benzylpénicilline : le port de poche réfrigérée réduit considérablement la dégradation de la molécule.
Dégradation de la pénicilline G en poches portées par volontaires, en 24h (%)
Poches contrôles (28,5°C)
Poches refroidies par glaces (18°C) Poches refroidies par gel (14°C)
57 18 14
Tableau 6 : Stabilité de la pénicilline G (benzylpénicilline) en poches réfrigérées. Source (37).
5.1.2. La lumière et l’oxygène
La photodégradation de certaines molécules (ofloxacine, céfépime) impose l’utilisation de poches photo-opaques et de seringues colorées (39).
L’oxydation de certaines molécules (amoxicilline, sulfaméthoxazole) majore le risque de produits de dégradation toxiques, elles nécessitent une préparation et une administration extemporanées (40) La dégradation à l’air est mentionnée pour chaque molécule dans les RCP au paragraphe « stabilité ».
5.1.3. Le solvant
Il faut vérifier la compatibilité de chaque molécule avec les différents solvants et solutés de dilution envisageables : Na Cl 9%, Glucose 5%, Glucose 10%, EPPI (eau pour préparations injectables), avant reconstitution et avant dilution du produit (39).
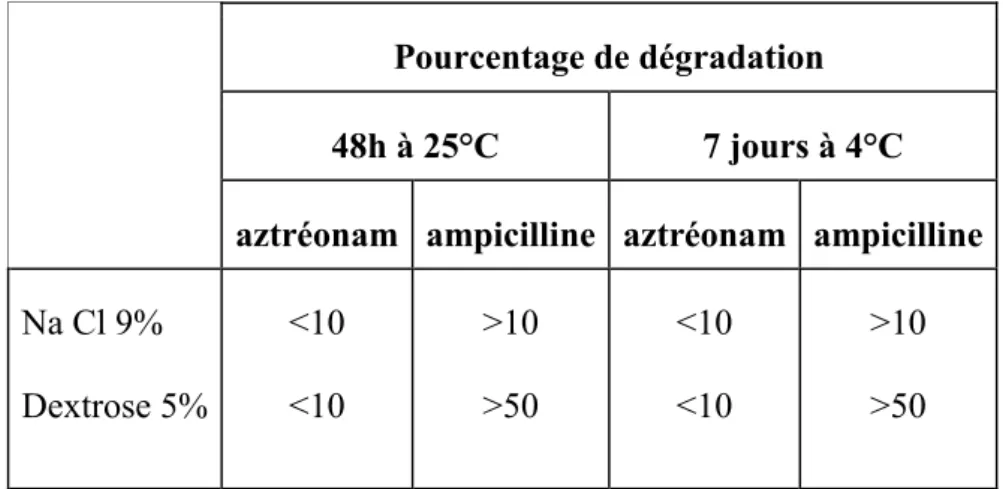
Pour exemple (Tableau 7), l’aztréonam est stable dans les deux solvants et aux deux conditions de conservation envisagées, alors que l’ampicilline subit des dégradations pouvant aller jusqu’à 50 % de la concentration initiale dans le Dextrose 5%.
Pourcentage de dégradation
48h à 25°C 7 jours à 4°C
aztréonam ampicilline aztréonam ampicilline
Na Cl 9% Dextrose 5% <10 <10 >10 >50 <10 <10 >10 >50
Tableau 7 : Stabilité de l’ampicilline et de l’aztréonam en fonction du solvant de dilution.
Source (37).
Le choix du produit de dilution peut influencer la viscosité de la solution et donc influencer le débit de perfusion (41). Plus la solution est visqueuse, plus la résistance augmente dans un diffuseur : l'utilisation d'une solution de Glucose 5% plutôt que de Na Cl à 0,9% dans un diffuseur tend à entraîner une diminution du débit de 10%, se traduisant par une augmentation de la durée d'administration et expose donc aux risques d’instabilité et de toxicité de la molécule.
5.1.4. La concentration
La quantité de soluté dissous dans un solvant définit la concentration, alors que la quantité maximale de soluté qu’il est possible de dissoudre par partie de solvant définit la solubilité.
Une concentration élevée, proche de la solubilité, et donc de la saturation, est a priori plus instable au sens où la probabilité d’apparition d’un précipité est plus importante. La forte concentration par trop faible dilution de vancomycine est veinotoxique (11), la ceftazidime est néphrotoxique par formation de cristaux de bêta-lactames (42).
Mais une dilution trop importante peut également modifier la stabilité de la molécule et induire un échec thérapeutique (43).
5.1.5. Le pH
Le pH a un double enjeu. D’une part l’efficacité de la molécule est dépendante du pH de la solution, par exemple le céfépime peut être inactivé en milieu basique (44).
D’autre part certains pH entrainent une veinotoxicité ou peuvent compromettre la stabilité d’autres molécules injectées localement. Par exemple la vancomycine devient très acide à de fortes concentrations (11) et peut induire une veinotoxicité ainsi que l’inactivité d’autres molécules injectées sur la même voie d’abord.
D’une manière générale, les solutions ayant des pH différents doivent être administrées sur des lignes de perfusion indépendantes.
5.1.6. Matériaux du contenant
La Commission Nationale d’Evaluation des Dispositifs Médicaux et des Technologies de Santé (CNEDIMTS) de la HAS est chargée de l’évaluation médicale des matériaux du contenant. Le marquage CE garantit la compatibilité du dispositif médical avec un certain nombre de principes actifs.
Le PVC est largement utilisé pour la fabrication de dispositifs médicaux (poches, tubulures). Pour augmenter la flexibilité du PVC, les fabricants ajoutent des plastifiants qui améliorent la résistance, la souplesse et le confort d’utilisation. Le plastifiant le plus répandu est le DEHP dérivé des phtalates, ils sont considérés comme carcinogènes, mutagènes ou toxiques (45). Il est préconisé de ne plus utiliser de matériaux contenant du DEHP en raison de sa toxicité.
5.1.7. Interactions médicamenteuses
Prévenir les incompatibilités médicamenteuses est un enjeu majeur pour garantir la sécurité et l'efficacité des thérapies intraveineuses.
Avant d’administrer des médicaments en Y ou de mélanger deux produits, il convient de se demander s’ils sont compatibles. Il existe des bases de données (28,46) contenant des informations sur la compatibilité des solutions pour perfusions dans une même poche ou seringue, ou encore lors d’une administration en Y.
Par exemple, la vancomycine nécessite une voie veineuse dédiée en raison des incompatibilités notamment avec les bêta-lactamines (47).
5.2. Molécules antibiotiques, classifications
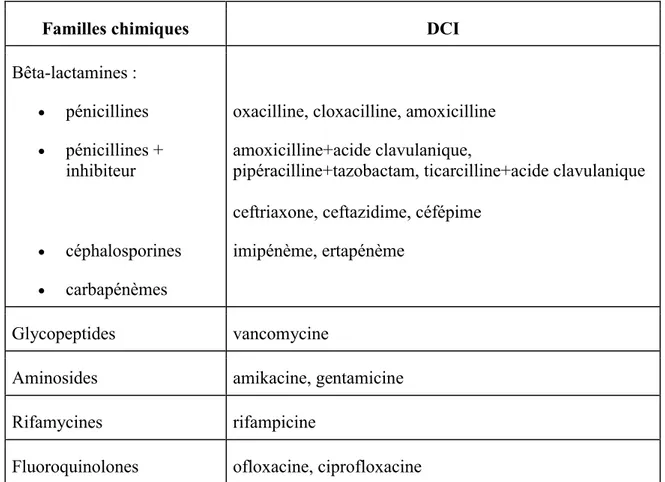
Les molécules antibiotiques sont classées par familles, par parenté chimique ou structurale ayant des similitudes d’actions ou des cibles spécifiques. Les molécules utilisées dans l’étude sont ainsi classées dans le Tableau 8.
Familles chimiques DCI
Bêta-lactamines : pénicillines pénicillines + inhibiteur céphalosporines carbapénèmes
oxacilline, cloxacilline, amoxicilline amoxicilline+acide clavulanique,
pipéracilline+tazobactam, ticarcilline+acide clavulanique ceftriaxone, ceftazidime, céfépime
imipénème, ertapénème
Glycopeptides vancomycine
Aminosides amikacine, gentamicine
Rifamycines rifampicine
Fluoroquinolones ofloxacine, ciprofloxacine
Tableau 8 : Classification des antibiotiques intraveineux utilisés dans l’étude, par familles chimiques.
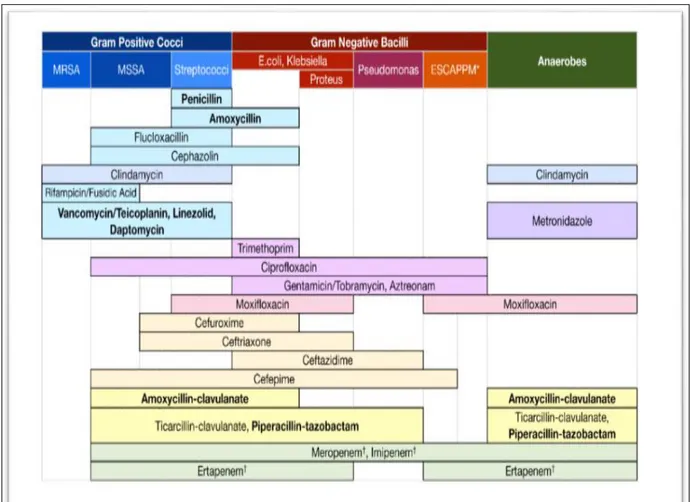
Les molécules antibiotiques sont également classées selon leur spectre d’activité antimicrobienne, exposées de manière non exhaustive dans le Tableau 9. Le spectre d’un antibiotique répartit les espèces bactériennes en trois classes en fonction de leur comportement vis-à-vis de l’antibiotique (sensible, modérément sensible ou intermédiaire et résistante). Il révèle le potentiel d’activité d’un antibiotique ainsi que ses limites.
Tableau 9 : Classification non exhaustive des antibiotiques en fonction de leur activité antimicrobienne.
Notes : Les antibiotiques en gras couvrent également l’Enterococcus faecalis. Pour simplifier les organismes atypiques ne sont pas représentés. Les organismes producteurs de BLSE ne sont pas sensibles à la plupart des antibiotiques contenant un cycle bêta-lactame. Les carbapénèmes† sont
l'agent habituel de choix.*Les organismes ESCAPPM sont Enterobacter spp., Citrobater freundii, Aeromonas spp., Proteus spp., Providencia spp. & Morganella morganii. Source (48).
Un antibiotique à spectre étroit est efficace contre certaines familles de bactéries.
Exemples : oxacilline, cloxacilline, amoxicilline +/- acide clavulanique, rifampicine.
Un antibiotique à large spectre précise la nature de l'efficacité d'un antibiotique pour lutter contre une vaste gamme de bactéries pathogènes à Gram positif ou à Gram négatif.
Exemples : pipéracilline+tazobactam, ticarcilline+acide clavulanique, ceftriaxone, céfépime, ciprofloxacine, ofloxacine, gentamicine, amikacine, vancomycine.
Il est important de répertorier les molécules antibiotiques à spectre anti-pseudomonas/ anti-pyocyanique, puisque la bactérie Pseudomonas aeruginosa est ubiquitaire et saprophyte, pathogène et opportuniste. Elle possède une résistance naturelle à de nombreux antibiotiques et acquiert de multiples mécanismes de résistances vis-à-vis des molécules actives (49).
L’utilisation de ces molécules présente un enjeu en termes d’impact écologique et notamment en ville, échappant aux mesures du contrôle hospitalier.
Les molécules à spectre anti-pseudomonas identifiées (sous réserve de résistances acquises), pour les molécules utilisées dans l’étude sont :
- bêta-lactamines: pipéracilline+tazobactam, ticarcilline+acide clavulanique, céfépime, ceftazidime, imipénème ;
- aminosides: gentamicine, amikacine ;
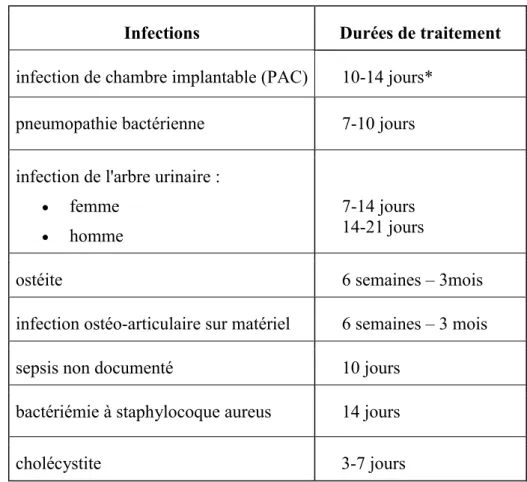
5.3. Indications et durées de traitement
Pour les indications relevées dans l'étude nous avons défini des fenêtres de traitements correspondants aux guidelines usuels permettant d'évaluer les prescriptions.
Pour les infections les plus fréquentes, nous avons évalué les durées de traitements selon les indications à partir de la plaquette "antibiotiques" (Tableau 10 et Annexe 1) diffusée à l'hôpital et à l'ensemble des médecins exerçant dans le bassin de Seine et Marne.
Infections Durées de traitement
infection de chambre implantable (PAC) 10-14 jours*
pneumopathie bactérienne 7-10 jours
infection de l'arbre urinaire :
femme
homme
7-14 jours 14-21 jours
ostéite 6 semaines – 3mois
infection ostéo-articulaire sur matériel 6 semaines – 3 mois
sepsis non documenté 10 jours
bactériémie à staphylocoque aureus 14 jours
cholécystite 3-7 jours
Tableau 10 : Durées de traitement selon les guidelines.
Notes :*Le traitement de l'infection de PAC a fait l'objet d'un protocole intra-hospitalier pour une durée de verrou de 14 jours et une antibiothérapie pouvant varier de 7 à 14 jours en fonction du germe identifié ( Annexe 2). Les indications plus rares à une antibiothérapie intraveineuse sont mentionnées en Annexe 1. Source : élaboré par l’auteur à partir de l’Annexe 1.
5.4. Règles de prescription
La prescription médicale est nominative et doit préciser le nom de la molécule en dénomination commune internationale (DCI), la posologie journalière (dose unitaire, le nombre d’injections, durée de la perfusion ou vitesse d’administration), le solvant, le volume de dilution ainsi que la durée de traitement global (50).
Une prescription observée en ville au cours ma pratique en visite au domicile : « Vancomycine 2g/j IVSE pendant 7jours ».
Le patient a présenté une hyperthermie à 48h de traitement ambulatoire, attribuable à une veinite sur la base de la VVP ou à un échec de la thérapeutique.
La prescription complète respectant l’ensemble des paramètres aurait dû être la suivante :
« vancomycine 2g par jour en perfusion continue de 4 seringues de 500mg dans 48cc IVSE sur 6 heures durant 7 jours. Sur voie périphérique et ligne dédiée. Reconstituer le produit juste avant administration dans du Na Cl 9 % ».
Le moindre oubli d’une des notions peut engendrer un risque d’échec thérapeutique ou de complications iatrogéniques.
5.5. Risque iatrogénique
"Se dit d'un trouble, d'une maladie provoqués par un acte médical ou par les médicaments,
même en l'absence d'erreur du médecin " (51).
5.5.1. Choix de la molécule antibiotique
La molécule peut elle-même engendrer des effets indésirables, dits « effets iatrogéniques/ indésirables de la molécule ».
Le choix inapproprié de la molécule reflète une inadéquation de la prescription avec un risque d’échec thérapeutique probable.
La question de l’interaction médicamenteuse doit se poser devant l’administration de plusieurs molécules antibiotiques. En effet certains antibiotiques sont inhibiteurs enzymatiques (par exemple les macrolides), d’autres sont inducteurs enzymatiques (par exemple la rifampicine), leur association risque alors de modifier l’effet escompté de chaque molécule.
La non adaptation de la posologie au poids ou aux éventuels défauts d’élimination, comme une insuffisance rénale, peuvent engendrer une toxicité de l’antibiotique qui peut être majorée par une durée de traitement trop longue.
Une posologie inadéquate ou des conditions d’instabilité moléculaire vont être propices à une moindre efficacité (sous dosage) et aboutir à un échec thérapeutique. Le surdosage peut majorer la toxicité des molécules ou provoquer une défaillance. En effet un quart des insuffisances rénales aigües sont d’origine médicamenteuse et un tiers d’entre elles est dû aux antibiotiques néphrotoxiques comme la vancomycine, les bêta-lactamines, la rifampicine et les C3G (42). Certaines molécules comme la céfépime peuvent induire une neurotoxicité en cas de surdosage (52).
5.5.2. Préparation de la solution
La préparation de la solution antibiotique intraveineuse par dilution doit être réalisée dans des conditions d’asepsie rigoureuse et du point de vue microbiologique, une utilisation immédiate ou extemporanée est recommandée devant le risque de contamination microbienne par une conservation de plus de 24 heures.
Les erreurs de choix de solutés peuvent également induire des effets toxiques, comme décrits plus haut.
5.5.3. Administration de la solution
Les risques iatrogéniques sont en rapport avec la solution perfusée et la qualité de la voie d’abord.
Les complications sont majoritairement d’ordre mécanique pendant l’insertion IV et plus tard par les risques de thromboses, de délogement, d’occlusion ou de fuite de la perfusion (53).
La dose unitaire de certaines molécules peut être toxique selon la vitesse d’administration. Pour la vancomycine, la vitesse minimum est d’une heure pour un gramme, évitant ainsi le risque de « red man syndrom » (11).
5.6. Modes d’administration de la solution antibiotique
Le choix du mode d'administration dépend des propriétés des molécules : leur stabilité, leur demi-vie et leur potentiel toxique.