Pépite | Néo-fonctionnalisation des acyltransférases de la famille des BAHD : conséquences sur le métabolisme des acides hydroxycinnamiques des Astéracées
Texte intégral
(2) Thèse de Marianne Delporte, Lille 1, 2017. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(3) Thèse de Marianne Delporte, Lille 1, 2017. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(4) Thèse de Marianne Delporte, Lille 1, 2017. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(5) Thèse de Marianne Delporte, Lille 1, 2017. UNIVERSITE DE LILLE 1, SCIENCES ET TECHNOLOGIES Ecole Doctorale Sciences de la Matière, du Rayonnement et de l’Environnement. THESE Pour l’obtention du grade de. Docteur en Sciences de l’Université de Lille 1 Mention : Ingénierie des fonctions biologiques. Néo-fonctionnalisation des acyltransférases de la famille des BAHD : Conséquences sur le métabolisme des acides hydroxycinnamiques des Astéracées. par Marianne DELPORTE soutenue le 15 décembre 2017 devant la commission d’examen :. Danièle WERCK-REICHHART, Directeur de recherche, CNRS, IBMP. Rapporteur. Alain BOUCHEREAU, Professeur, Université de Rennes 1. Rapporteur. Nathalie GIGLIOLI-GUIVARC’H, Professeur, Université de Tours. Examinateur. Alain HEHN, Professeur, Université de Lorraine. Examinateur. Jean-Louis HILBERT, Professeur, Université de Lille 1 David GAGNEUL, Maître de conférence, Université de Lille 1. © 2017 Tous droits réservés.. Directeur de thèse Co-encadrant. lilliad.univ-lille.fr.
(6) Thèse de Marianne Delporte, Lille 1, 2017. « Dans les champs de l’observation, le hasard ne favorise que les esprits préparés » Louis Pasteur. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(7) Thèse de Marianne Delporte, Lille 1, 2017. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(8) Thèse de Marianne Delporte, Lille 1, 2017. Résumé Néo-fonctionnalisation des acyltransférases de la famille des BAHD : Conséquences sur le métabolisme des acides hydroxycinnamiques des Astéracées. Chaque étape marquante de l’évolution de la lignée verte, notamment la conquête du milieu terrestre, a été marquée par l’émergence de nouvelles voies métaboliques notamment au sein du métabolisme spécialisé via des évènements de duplication et de néo-fonctionnalisation de gènes. Ces mécanismes cruciaux constituent l’un des moteurs de l’évolution en permettant l’apparition de nouvelles molécules. Celles-ci, apparues de manière aléatoire, peuvent conférer un avantage évolutif pour l’organisme dans un environnement donné et leur métabolisme peut donc être maintenu sous la pression de sélection. Au-delà de l’intérêt pour la plante, de nombreux métabolites spécialisés présentent des propriétés nutritionnelles et thérapeutiques exceptionnelles. Le décryptage minutieux des voies de biosynthèse est un élément essentiel à la valorisation de ces composés. Une approche de génétique inverse a été conduite afin de caractériser le métabolisme des acides hydroxycinnamiques majoritaires accumulés chez la chicorée. La recherche de gènes candidats a permis l’identification de 7 séquences appartenant au sous-clade Vb de la superfamille des acyltransférases de type BAHD. Les caractérisations biochimiques et fonctionnelles de ces gènes ont démontré l’implication pressentie de 5 d’entre eux dans la synthèse d’acide cholorogénique et composés apparentés soulevant ainsi la question de la redondance fonctionnelle de ces gènes. Les 2 gènes suivants sont, quant à eux, à l’origine de l’émergence d’un nouveau type de phénolamide spécifique du manteau pollinique des Astéracées. La possible contribution de cette diversification métabolique dans le succès évolutif de cette famille est alors envisagée. Mots clés : BAHD, acyltransférases, acides chlorogéniques, phénolamides, Astéracées, chicorée, néo-fonctionnalisation. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(9) Thèse de Marianne Delporte, Lille 1, 2017. Abstract Neofunctionalization of BAHD acyltransferases: Consequences on hydroxycinnamic acids metabolism within the Asteraceae family. Each milestone in the evolution of the green lineage, notably terrestrialization, was supported by the emergence of new metabolic pathways, particularly within the specialized metabolism via gene duplication and neo-functionalization events. These crucial mechanisms, leading to the emergence of new molecules, are one of the driving forces of evolution. These randomly appeared molecules can confer an evolutionary advantage for the host organism in a given environment, and their metabolism can hence be maintained under selection pressure. Beyond the interest for the plant, many specialized metabolites have exceptional nutritional and therapeutic properties. However, careful decryption of their biosynthetic pathways is an essential element for the valorization of these compounds. A reverse genetic approach was conducted to characterize the metabolism of the major hydroxycinnamic acids accumulated in chicory. The search for candidate genes allowed the identification of 7 sequences belonging to the subclade Vb of the BAHD acyltransferases superfamily. The biochemical and functional characterizations of these genes demonstrated the expected involvement of 5 of them in the synthesis of cholorogenic acid and related compounds, raising the question of the functional redundancy of these genes. The two remaining genes were characterized as well, demonstrating their responsibility in the emergence of a new type of pollen coat phenolamide specific to the Asteraceae family. The contribution of this metabolic diversification in the successful evolutionary path of this plant family is then considered.. Key words: BAHD, acyltransferases, chlorogenic acids, phenolamides, Asteraceae, chicory, neofunctionalization. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(10) Thèse de Marianne Delporte, Lille 1, 2017. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(11) Thèse de Marianne Delporte, Lille 1, 2017. Remerciements Je tiens tout d’abord à remercier les membres du jury d’avoir accepté d’évaluer mon travail de thèse : Danièle Werck-Reichhart et Alain Bouchereau en tant que rapporteurs ainsi que Nathalie Giglioli-Guivarc’h et Alain Hehn en tant qu’examinateurs. Je remercie également les membres de mon comité de thèse, Sébastien Bésseau et Sébastien Duplessis, pour l’attention portée à mon travail et les conseils prodigués lors de ces rencontres. Mes remerciements vont ensuite à Jean-Louis Hilbert pour m’avoir accueillie en tant que stagiaire au sein du laboratoire et m’avoir ensuite donné l’opportunité de poursuivre en thèse sous sa direction. Je tiens également à remercier tout particulièrement mon encadrant, David Gagneul, pour m’avoir en premier lieu donné l’envie de poursuivre en thèse après mon stage. Merci ensuite pour ta disponibilité, ton implication, tes conseils, ta patience et pour ton soutien dans mes moments de doute. Merci enfin de m’avoir supportée pendant ces 10 années de thèse (au moins !). Avoir un « encadrant de talent débordant de charisme », ça n’a pas de prix. Merci à Arnaud Lanoue et Sébastien Bésseau de l’Université de Tours, Roland Molinié et David Mathiron de l’Université d’Amiens ainsi que Björn Hielscher et Nicole Linka de l’Université de Düsseldorf pour leur participation à mes travaux de thèse. Je remercie ensuite mes collègues thésards : Guillaume Legrand, mon prédécesseur, qui m’a guidée lors de mes premiers pas dans le monde de la recherche. J’espère avoir été digne de ton héritage … et de celui de St Sébastien ! :p Honorine, mon modèle ;-) (c’est pour ça que je suis bavarde), on a dû refaire le monde au moins 100 fois dans notre bureau. Guillaume Bernard, dernier coloc en date, merci pour ta bonne humeur ainsi que ta participation à ce travail. Merci également à Maxime (Promis, je vais venir les goûter les bonbons hollandais) et Pauline (entre autres pour les nombreux gâteaux qui m’ont manqués depuis ton départ ;-) ) ainsi qu’aux différents stagiaires qui ont directement contribué à la réalisation de cette thèse : Gianni, Julie, Amandine, Audrey, Valène. Je remercie aussi tous ceux qui ont pu m’apporter leurs conseils à un moment ou un autre de ma thèse. Merci notamment à Sylvain Legrand pour mes premières lignes de commande, à Nasser Bahrmann, jamais avare de conseils, ainsi qu’à Marie-Christine Quillet et Théo Hendricks, entre autres pour le prêt d’un excellent ouvrage sur les Astéracées. Merci aux membres de l’équipe MSSA ainsi qu’à l’ensemble des personnes passées par le 3ème étage du SN2 pour les moments de convivialité partagés. Merci enfin à mes parents, ma famille, mes amis. Je ne serai rien sans vous ! Des remerciements particuliers pour ma grand-mère qui a laissé fleurir ses laitues et ses artichauts pour la science. Mes pensées les plus affectueuses vont à Antoine, qui a largement contribué à la réalisation de ce travail par son soutien sans faille. Merci d’être là, merci d’être toi, tout simplement.. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(12) Thèse de Marianne Delporte, Lille 1, 2017. Sommaire. Liste des abbréviations ............................................................................................................................ 16 Liste des figures ......................................................................................................................................... 17 Liste des tableaux...................................................................................................................................... 21 Introduction générale ................................................................................................. 23 Chapitre I : Sélection de gènes de référence pour l’analyse par qRT-PCR de l’expression de gènes dans des conditions associées à des variations de contenus en acides hydroxycinnamiques chez la chicorée ..................................................... 67 Avant-propos ....................................................................................................................... 68 Selection and validation of reference genes for quantitative real-time PCR analysis of gene expression in Cichorium intybus. ............................................................................... 71 1. Introduction ........................................................................................................................................... 73. 2. Material and methods .......................................................................................................................... 76. 3. 2.1. Plant material .............................................................................................................................................. 76. 2.2. RNA extraction and cDNA synthesis ................................................................................................... 77. 2.3. Primer design .............................................................................................................................................. 77. 2.4. qRT-PCR conditions and analysis ........................................................................................................... 78. 2.5. Statistical analysis of the reference gene expression stability .......................................................... 78. 2.6. Determination of the expression profile of GOI ............................................................................... 79. Results ..................................................................................................................................................... 83 3.1. Selection of candidate reference genes, design of primers, and evaluation of primer specificity. and PCR efficiency ...................................................................................................................................................... 83. © 2017 Tous droits réservés.. 3.2. Expression profile of the candidate reference genes ......................................................................... 83. 3.3. Reference gene stability analysis ............................................................................................................. 85. 3.4. Reference gene stability in root cell cultures ...................................................................................... 85. 3.5. Reference gene stability in seedling tissues .......................................................................................... 87. lilliad.univ-lille.fr.
(13) Thèse de Marianne Delporte, Lille 1, 2017. 4. 3.6. Determination of the optimal number of reference genes for normalization ............................. 89. 3.7. Expression of GOI in response to MeJA induction............................................................................ 89. Discussion ............................................................................................................................................... 92. Chapitre II : Étude de l’implication des HCTs et HQTs de chicorée dans la synthèse des acides hydroxycinnamiques accumulés chez cette espèce .............. 99 Avant-propos ..................................................................................................................... 101 Identification and characterization of five BAHD acyltransferases involved in hydroxycinnamoyl ester metabolism in chicory ............................................................ 103 1. Introduction ........................................................................................................................................ 107. 2. Materials and Methods ...................................................................................................................... 110. 3. 2.1. Plant material and growth conditions.................................................................................................. 110. 2.2. Isolation of full-length cDNA sequences ............................................................................................ 110. 2.3. Phylogenetic tree of acyltransferases and multiple sequence alignment ..................................... 111. 2.4. Expression, purification and in vitro assays of recombinant proteins ......................................... 111. 2.5. Enzymatic production and purification of hydroxycinnamoyl-CoA compounds ....................... 112. 2.6. gDNA extraction, amplification and sequencing ............................................................................... 113. 2.7. RNA extraction and cDNA synthesis ................................................................................................. 113. 2.8. qRT-PCR analysis ..................................................................................................................................... 113. 2.9. Determination of protein concentrations, SDS-PAGE analysis and immunoblot analysis ...... 114. 2.10. Transient expression in N. benthamiana ............................................................................................. 114. 2.11. HPLC analysis of polyphenols ............................................................................................................... 115. 2.12. Statistics...................................................................................................................................................... 116. Results .................................................................................................................................................. 119 3.1. Profiling of the main caffeic acid esters in chicory tissues .............................................................. 119. 3.2. Modulation of caffeic acid ester contents by MeJA elicitation in root culture cells ................. 121. 3.3. Identification, cloning and sequence analysis of five hydroxycinnamoyl transferase genes in. chicory ..................................................................................................................................................................... 121. © 2017 Tous droits réservés.. 3.4. Expression of HCTs and HQTs in E. coli and evaluation of their activity in vitro ...................... 127. 3.5. Kinetic parameters of recombinant proteins .................................................................................... 131. lilliad.univ-lille.fr.
(14) Thèse de Marianne Delporte, Lille 1, 2017. 4. 3.6. Chicory HCTs and HQTs are differentially expressed ................................................................... 131. 3.7. Functional analysis of HCT1 and HQT1 ............................................................................................. 133. Discussion ............................................................................................................................................ 135. Eléments complémentaires ............................................................................................. 148. Chapitre III : Caractérisation d’enzymes impliquées dans la synthèse de phénolamides originales accumulées dans le manteau pollinique des Astéracées .....................................................................................................................................153 Avant-propos ..................................................................................................................... 155 Neofunctionalization within the BAHD family results in the production of tetrahydroxycinnamoyl spermine in the pollen coat of the Asteraceae .................... 167 1. Introduction ........................................................................................................................................ 169. 2. Material and Methods ....................................................................................................................... 173. 3. 2.1. Plant material and culture ...................................................................................................................... 173. 2.2. Phenolic compound extraction ............................................................................................................. 173. 2.3. RNA extraction ........................................................................................................................................ 173. 2.4. qPCR experiments ................................................................................................................................... 174. 2.5. Identification and cloning of SHT-like sequences from chicory .................................................... 174. 2.6. Expression, purification, and in vitro assays of recombinant proteins ........................................ 174. 2.7. Chicory hairy root generation and growing conditions .................................................................. 175. 2.8. Transient expression in Nicotiana benthamiana and protoplast obtention ............................... 176. 2.9. Overexpression of YFP-fused proteins in Arabidopsis Col 0 and plasmolysis experiments. . 177. 2.10. Confocal microscopy .............................................................................................................................. 177. 2.11. Metabolite analysis ................................................................................................................................... 177. 2.12. Sequences and structure analyses ........................................................................................................ 179. Results .................................................................................................................................................. 181 3.1. Identification and characterization of pollen coat phenolamides in C. intybus ......................... 181. 3.2. Identification of tetrahydroxycinnamoylspermine as a conserved constituent of Asteraceae. pollen coat.................................................................................................................................................................. 183 3.3. © 2017 Tous droits réservés.. Identification of candidate genes for tetracoumaroylspermine biosynthesis ............................. 185. lilliad.univ-lille.fr.
(15) Thèse de Marianne Delporte, Lille 1, 2017. 3.4. CiSHT1 and CiSHT2 gene expression patterns are correlated with phenolamide accumulation. in chicory flowers ..................................................................................................................................................... 185 3.5. CiSHT2 shows a net in vitro activity towards the production of tetracoumaroylspermine.. 187. 3.6. Side activities bring to light by in vitro characterization ................................................................. 191. 3.7. Overexpression of CiSHT2 in chicory hairy roots lead to production of spermine. derivatives .................................................................................................................................................................. 191. 4. 3.8. CiSHT1 and CiSHT2 are targeted to the nucleo-cytoplasmic compartment ............................ 193. 3.9. Sequence analyses highlight a specific motif shared by members of the SHT subfamily ......... 195. Discussion ............................................................................................................................................ 199. Eléments complémentaires ............................................................................................. 213 1. 2. Matériels et Méthodes ...................................................................................................................... 213 1.1. Construction d’un vecteur permettant l’expression spécifique de CiSHT1 ou CiSHT2 dans la. tapis.. ..................................................................................................................................................................... 213. 1.2. Sur-expression de CiSHT1 et CiSHT2 chez le mutant sht d’Arabidopsis .................................. 214. Résultats attendus .............................................................................................................................. 214. Conclusions et perspectives .....................................................................................217 Références bibliographiques ................................................................................................................. 229. © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(16) Thèse de Marianne Delporte, Lille 1, 2017. Liste des abbréviations 4Cl ATP C3'H C4H Cas 9 CCT CoA CQA CRISPR CTA CTT CYP DHS diCQA diCTA DODA DOXP FRET GUS HAL HCT HPLC HQT HSS HTT IPP MEP PAL PCR PvHHHT qRT-PCR SAMT SCPL SHT TpHCT2 UGT UV VIGS. 4 coumarate :CoA ligase adenosine triphosphate p-coumarate 3’-hydroxylase cinnamate 4-hydroxylase CRISPR associated protein 9 hydroxycinnamoyl-CoA :caffeoyl-meso-tartrate hydroxycinnamoyl transferase Coenzyme A caffeoyl quinic acid = acide chlorogénique Clustered Regularly Interspaced Short Palindromic Repeat caffeoyl tartric acid = acide caftarique hydroxycinnamoyl-CoA :meso-tartrate hydroxycinnamoyl transferase cytochrome P450 deoxypusine synthase dicaffeoyl quinic acid = acide isochlorogenique dicaffeoyl tartric acid = acide chicorique 4,5- dioxygenase 1-désoxy-D-xylulose-5-phosphate Fluorescence resonance energy transfer ß-glucuronidase Histidine Ammonia Lyase Hydroxycinnamoyl-CoA shikimate/quinate hydroxycinnamoyltransferase High Performance Liquid Chromatography Hydroxycinnamoyl-CoA quinate/shikimate hydroxycinnamoyltransferase homospermidine synthase hydroxycinnamoyl-CoA :tartaric acid hydroxycinnamoyl transferase isopentényl diphosphate 2-C-méthylérythriol-4-phosphate Phénylalanine Ammonia Lyase Polymerase chain reaction hydroxycinnamoyl-CoA: tetrahydroxyhexanedioate hydroxycinnamoyl transferase [Phaseolus vulgaris] quantitative real-time PCR salicylic acid carboxyl methyltransferase Serine CarboxyPeptidase-Like Spermidine Hydoxycinnamoyl Transferase malate O-hydroxycinnamoyl transferase [Trifolium pratense] UDP-dependent glycosyl-transferases ultraviolet Virus Induced Gene Silencing. 16 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
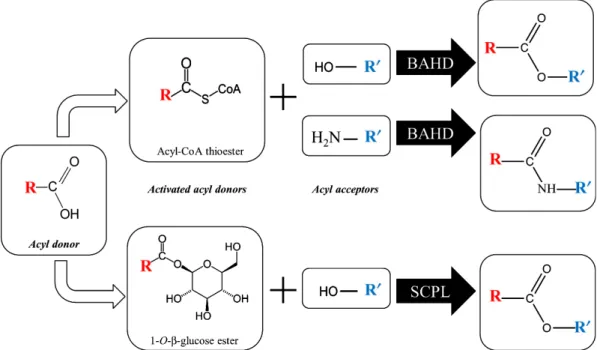
(17) Thèse de Marianne Delporte, Lille 1, 2017. Liste des figures. Introduction Figure i.1 : Implication du métabolisme spécialisé des plantes dans les grandes étapes de l’évolution. Figure i.2 : Représentation simplifiée des voies de biosynthèse des métabolites spécialisés. Figure i.3 : Comparaison des activités catalytiques de la PAL (Phenylalanine ammonia lyase) spécifique du métabolisme spécialisé et de la HAL (Histidine ammonia Lyase) impliquée dans le métabolisme primaire. Figure i.4 : Exemple de mécanismes conduisant à la diversification de gènes dupliqués ainsi qu’à leur recrutement consécutif par le métabolisme spécialisé. Figure i.5 : Réactions catalysées par l’HSS (Homospermidine synthase) et par la Deoxypusine synthase (DHS). Figure i.6 : Stratégie mise en place par Eudes et al. (2016) permettant de réduire la quantité de lignine produite en utilisant la promiscuité catalytique d’une hydroxycinnamoyl transferase (HCT). Figure i.7 : Arbre phylogénétique représentant les événements de duplication et néofonctionnalisation ayant abouti à la synthèse de bétalaïnes chez les Caryophyllales. Figure i.8 : Exemple de produits cosmétiques à base de resvératrol. Figure i.9 : Répartition selon leur source des molécules mise sur le marché pharmaceutique entre 1981 et 2014. Figure i.10 : Exemple de plantes médicinales utilisées à travers le monde. Les métabolites extraits de ces plantes ainsi que les activités associées sont indiqués. Figure i.11 : Arbre phylogénétique de la famille des Astéracées et répartition par sous-famille des espèces sur les différents continents. Figure i.12 : Espèces appartenant au genre Cichorium cultivées en Europe et leurs utilisations industrielles majoritaires. Figure i.13 : Composés phénoliques majeurs de la chicorée. Figure i.14 : Voie de biosynthèse de l’acide chlorogénique. Figure i.15 : Exemples de métabolons impliquant les enzymes de la voie générale des phénylpropanoïdes et aboutissant à la synthèse de composés phénoliques divers. Figure i.16 : Mécanismes de biosynthèse éventuels des acides hydroxycinnamiques de la chicorée d’après des données issues d’autres espèces accumulatrices. Figure i.17 : Réactions d’acylation catalysées par les enzymes appartenant à la famille des BAHD ou des SCPL.. 17 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
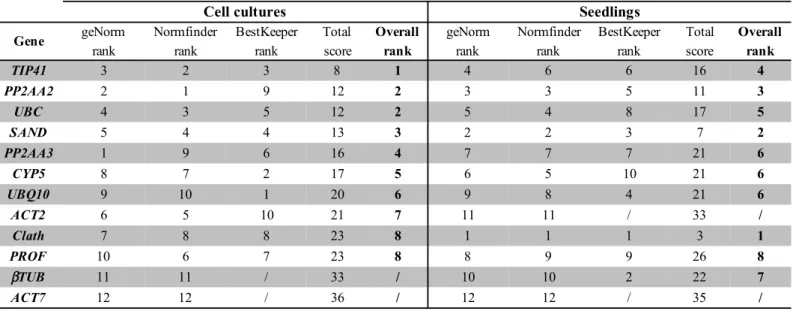
(18) Thèse de Marianne Delporte, Lille 1, 2017. Figure i.18 : Structure de la Vinorine Synthase. Figure i.20 : A : Arbre phylogénétique de la famille des BAHD construit à partir de 80 séquences précédemment caractérisées et des 81 séquences identifiées chez la chicorée. B : Répartition par clade des séquences de chicorée et de 5 autres espèces analysées par Tuominen et al.(2011) Figure i.21 : Extrait de l’arbre phylogénétique des BAHD présenté en figure i.20, correspondant au clade Vb. Les séquences de chicorée sont encadrées en vert.. Chapitre I Figure 1: Cycle threshold (Ct) values of the candidate reference genes across the different experimental samples ((A): cell cultures; (B): seedlings). Figure 2: Ranking of the candidate reference genes for chicory cell cultures under various conditions of elicitation according to NormFinder (A) geNorm (B) and BestKeeper (C). Figure 3: Ranking of the candidate reference genes for different tissues of chicory seedlings according to NormFinder (A) geNorm (B) and BestKeeper (C). Figure 4: Ranking of the candidate reference genes for both chicory seedlings and cell cultures according to geNorm. Figure 5: Pairwise variation (Vn/Vn+1) analysis of the candidate reference genes for cell cultures (A) and for seedlings tissues (B). Figure 6: Relative quantification of targeted genes expression in chicory cell cultures using different reference genes (TIP41 and PP2AA2 (A), TIP41 alone (B), ßTUB (C) or Clath (D)) under various elicitation conditions.. Chapitre II Figure 2.1 : Exemples de réactions catalysées par des enzymes de type HCT/HQT Figure 1: Putative metabolic pathways involved in hydroxycinnamic acid biosyntheses in plants. Figure 2: Chromatograms of crude methanolic extracts from leaves and roots of chicory seedlings and of a standard mixture. Figure 3: Contents of 3-CQA, CTA, diCTA and 3,5-diCQA in roots and leaves (different ages) of chicory seedlings. Figure 4: Contents of 3-CQA, 5-CQA and 3,5-diCQA in chicory cell cultures under different conditions. Figure 5: Phylogenetic analysis and sequence comparison of the five members of the BAHD family identified in this study. Figure 6: Expression and purification of recombinant HCT and HQT proteins.. 18 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(19) Thèse de Marianne Delporte, Lille 1, 2017. Figure 7: Competition assays to determine the preferred acyl acceptor of HCTs and HQTs. Figure 8: Expression of HCT1, HCT2, HQT1, HQT2 and HQT3 in various chicory tissues. Figure 9: Determination of CQA content in Nicotiana benthamiana transiently transformed leaves. Figure S1: Effect of the pH on the activity of the recombinant proteins. Figure 2.2 : Parallèle établi entre les voies de biosynthèse de la lignine chez les Angiospermes et de la cuticule chez P. patens décrivant l’implication de gènes homologues dans ces deux modèles. Figure 2.3 : Analyses par HPLC-DAD à 320 nm des produits des réactions enzymatiques des HCTs/HQTs de chicorée mises en présence de thréonate et de caféoylCoA.. Chapitre III Figure 3.1 : Arbre phylogénétique représentant le sous-clade Vb des BAHD et les différents accepteurs d’acyle utilisés par ses membres. Figure 3.2 : Mécanismes réactionnels impliqués pour la production d’acide phasélique chez le trèfle ou d’acide caftarique chez l’arachide et la prêle Figure 3.3 : Accumulation d’acide caftarique et expression relative des gènes CiSHT1 et CiSHT2 dans différentes parties d’une plantule de chicorée. Figure 3.4 : Accumulaton de trihydroxycinnamoyl spermidine (TriHCSpd) dans le manteau pollinique des Spermaphytes. Figure 3.5 : Développement du grain de pollen et mise en place de sa paroi. Figure 3.6 : Coupe transversale d’anthère d’Arabidopsis avant méiose des cellules mères du pollen. Figure 3.7 : Voie de biosynthèse des trihydroxycinnamoyl spermidine. Figure 3.8 : Comparaison de la morphologie de grains de pollen d’Arabidopsis sauvage (à gauche) et de grains de pollen de plantes dont le gène sht est muté (à droite). Figure 3.9 : Implication des polyamines dans le développement du grain de pollen. Figure 3.10 : Capitule (A) et florette de chicorée (B). C : Capitule de chicorée visité par une abeille. Figure 1: Identification of phenolamides present in chicory floral buds. Figure 2: Occurrence of tetrahydroxycinnamoyl spermine in floral buds among Asteraceae and close families. Figure 3: Phylogenetic analysis of the ten SHT-like amino-acid sequences identified in five species of the Asteraceae family and other characterized members of the BAHD family clade Vb. Figure 4: Expression profile of CiSHT1 and CiSHT2 and tetracoumaroyl spermine contents in roots, leaves and in floral buds at different development stages. 19 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(20) Thèse de Marianne Delporte, Lille 1, 2017. Figure 5: Expression and purification of recombinant CiSHT1 and CiSHT2. Figure 6: HPLC chromatograms of in vitro assays of recombinant CiSHT2 (A) and CiSHT1 (B) in presence of coumaroylCoA and spermine (grey line) or spermidine (black line) or without acyl acceptor (dotted line). Figure 7: Subcellular imaging of YFP-tagged constructs transiently expressed in N. benthamiana leaves. Figure 8: Superposition of the three dimensional molecular models of CiSHT1 (pink) and CiSHT2 (blue). Figure 9: Sequence analysis of the SHT-like enzymes. Supplemental Figure S1: Proposed fragmentation scheme of compound C1 (A) and UV spectra (B) Supplemental Figure S2: Subcellular imaging of YFP-tagged constructs stably expressed in A. thaliana.. Conclusion Figure c.1 : Proposition de voie de biosynthèse de l’acide chlorogénique privilégié d’après les résultats de caractérisation des HCTs et HQTs de chicorée.. 20 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(21) Thèse de Marianne Delporte, Lille 1, 2017. Liste des tableaux. Introduction Tableau i.1 : Familles d’enzymes majeures du métabolisme spécialisé des plantes et leur correspondance au sein du métabolisme primaire. Tableau i.2 : Produits pharmaceutiques issus du métabolisme spécialisé des plantes les plus importants d’un point de vue économique. Tableau i.3 : Utilisations traditionnelles de l’espèce Cichorium intybus.. Chapitre I Table 1: Description of candidate reference genes, genes of interest, and comparison with Arabidopsis orthologs Table 2: Primer sequences used for amplification of reference genes and genes of interest, amplicon length, melting temperature and PCR efficiency. Table 3: Overall ranking of the candidate reference genes for cell cultures and for seedlings after geNorm, NormFinder and BestKeeper analysis.. Chapitre II Table 1: Kinetic parameters of HCTs and HQTs from chicory. Supplemental Table S1: Sequence of primers used in this study. Supplemental Table S2: Caffeic acid ester contents in leaves and roots of 6-week-old plants of chicory.. Chapitre III Table 1. Spermine derivative contents in chicory hairy roots overexpressing CiSHT2. Supplemental Table S1: Sequences of primers used in this study. Supplemental Table S2: Description of proteins used in phylogenetic analysis. 21 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(22) Thèse de Marianne Delporte, Lille 1, 2017. 22 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(23) Thèse de Marianne Delporte, Lille 1, 2017. Introduction générale. 23 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(24) Thèse de Marianne Delporte, Lille 1, 2017. 24 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(25) Thèse de Marianne Delporte, Lille 1, 2017. Depuis l’apparition de la vie il y a près de 4 milliards d’années, les organismes présents sur terre n’ont eu de cesse d’être confrontés à différentes contraintes environnementales telles que les fluctuations de températures, la composition de notre atmosphère ou encore la compétition avec d’autres organismes. La capacité d’adaptation aux variations du milieu de vie est ainsi essentielle à la survie d’une espèce. A l’échelle d’un individu, cela suppose d’être capable d’adapter son comportement ou encore son métabolisme afin de supporter les effets d’une modification de l’environnement. Cependant, cette capacité d’adaptation est par essence restreinte par le patrimoine génétique que possède l’individu. Par contre, sur des échelles de temps bien supérieures, le patrimoine génétique des organismes est susceptible d’être modifié en réponse aux pressions environnementales grâce à des phénomènes évolutifs. L’évolution des organismes vivants a conduit dans un premier temps à la colonisation du milieu aquatique. Puis l’apparition des organismes photosynthétiques a engendré une modification drastique de la composition des océans et de l’atmosphère. S’ensuit une modification profonde de la biosphère avec l’apparition d’organismes eucaryotes d’abord unicellulaires puis pluricellulaires. Par la suite, la conquête des continents va être majoritairement conditionnée par trois facteurs : la gestion des pertes en eau, la résistance à la gravité et la capacité à se reproduire en environnement non aqueux. Pour faire face à de nouvelles situations, les animaux possèdent la mobilité qui leur permet notamment de fuir ou de se défendre en cas de menace mais les organismes sessiles tels que les plantes apparaissent bien plus vulnérables. Néanmoins, de par leur très large distribution à la surface du globe, les plantes démontrent une capacité d’adaptation aux contraintes environnementales exceptionnelle. Les stratégies mises en place par les végétaux afin de tirer profit de leur environnement ou de résister aux attaques subies, qu’elles soient d’origine biotique ou abiotique, sont d’une incroyable complexité et reposent en grande partie sur des processus biochimiques.. 25 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(26) Thèse de Marianne Delporte, Lille 1, 2017. Figure i.1 : Implication du métabolisme spécialisé des plantes dans les grandes étapes de l’évolution. (D’après Weng, 2014). 26 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(27) Thèse de Marianne Delporte, Lille 1, 2017. L’évolution de la lignée verte est ainsi largement associée à l’apparition de nouvelles molécules issues du métabolisme dit « secondaire » par opposition au métabolisme primaire. Si le métabolisme primaire regroupe les processus biochimiques centraux essentiels à la croissance et à la reproduction de la plante, les molécules issues du métabolisme secondaire ont dans un premier temps été considérées comme des déchets issus de la dégradation des composés du métabolisme primaire puis comme non essentielles à la survie de la plante. Cependant, de nombreuses études menées depuis plus d’un demi-siècle ont permis de démontrer l’importance du métabolisme secondaire pour l’adaptation de l’organisme à son environnement et donc son rôle primordial en ce qui concerne le maintien de l’organisme dans un milieu souvent hostile. Qu’il s’agisse de la lignine essentielle au maintien de la plante ou des composés volatils permettant l’attraction des pollinisateurs, il est aujourd’hui établi que l’apparition de nouveaux métabolites secondaires a joué un rôle majeur dans chacune des grandes étapes de l’évolution depuis la conquête du milieu terrestre par les végétaux il y a 500 millions d’années (Fig i.1). Depuis quelques années, le terme de « métabolisme secondaire » est d’ailleurs délaissé au profit de celui de « métabolisme spécialisé » qui sera également utilisé dans la suite de ce mémoire. Ce changement de terminologie s’explique notamment par la grande spécificité taxonomique de ce groupe de molécules qui sera discutée plus loin (Pichersky and Gang, 2000). Le métabolisme spécialisé des plantes regroupe un nombre incommensurable de molécules (plusieurs centaines de milliers) impliquées dans des processus aussi variables que la rigidité structurale, la protection contre les rayonnements UV ou la dessiccation, la défense contre des pathogènes ou encore les interactions entre plantes ou avec d’autres organismes tels que les pollinisateurs ou les organismes symbiotiques (Wink, 2016).. 27 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(28) structures and the metabolic pathways responsible for their biosynthesis (Figure 1): phenolic and tools that can be applied to effectively manipulate the phytochemical levels in agronomically compounds; terpenoids; and nitrogen-containing compounds, i.e., alkaloids and glucosinolates [9]. Thèse de Marianne Delporte, Lille 1, 2017 important crops. Finally, we describe a functional study of the lipoxygenase-B1 gene family in durum 2.1. Phenolic Compounds wheat that controls the final carotenoid content in pasta products. Phenolic compounds represent one ofMetabolites the largest groups of secondary metabolites produced in 2. General Overview of Plant Secondary plants (i.e., >8000 different structures), and particularly in edible plants (e.g., vegetables, fruit, cereals). metabolites can essentially divided into groups that are hydroxylbased on TheseSecondary include several structurally different be compounds that three have main at least one aromatic their structures the metabolic pathways responsible for their biosynthesis 1): pathway phenolic substituted ring and in common. Phenolic compounds are produced primarily via the(Figure shikimate compounds; and nitrogen-containing that gives riseterpenoids; to phenylpropanoids (Figure 1). compounds, i.e., alkaloids and glucosinolates [9].. Figure 1. Schematic representation of the biosynthesis of secondary metabolites. E4P, erythrose Figure 1. Schematic representation of the biosynthesis of secondary metabolites. E4P, erythrose 4-phosphate; glyceraldehyde 3-phosphate; PEP, PYR, pyruvate; DOX5P, Figure i.2 : G3P, Représentation simplifiée des voies dephosphoenolpyruvate; biosynthèse des métabolites spécialisés. E4P, 4-phosphate; G3P, glyceraldehyde 3-phosphate; PEP, phosphoenolpyruvate; PYR, pyruvate; deoxyxylulose 5-phosphate;G3P, IPP, isopentenyl pyrophosphate; DMAPP, dimethylallyl pyrophosphate; erythrose 4-phosphate; glyceraldehyde 3-phosphate; PEP, phosphoenolpyruvate; PYR, DOX5P, deoxyxylulose 5-phosphate; IPP, isopentenyl pyrophosphate; DMAPP, dimethylallyl pyruvate; DOX5P, GPP, deoxyxylulose isopentenyl PP, pyrophosphate; geranyl 5-phosphate; pyrophosphate;IPP,FPP, farnesyl pyrophosphate; pyrophosphate; DMAPP, GGPP, pyrophosphate; PP, pyrophosphate; GPP, geranyl pyrophosphate; FPP, farnesyl pyrophosphate; GGPP, dimethylallyl pyrophosphate; GPP, geranyl pyrophosphate; FPP, farnesyl pyrophosphate; GGPP, geranylgeranyl pyrophosphate. geranylgeranyl geranylgeranylpyrophosphate. pyrophosphate. (D’après Borrelli and Trono, 2016). The combination of the shikimate pathway with the mevalonate pathway leads to the generation 2.1. Phenolic Compounds of the flavonoids [10]. Condensation and polymerization reactions produce hydrolysable and Phenolic compounds oneand of the largest groupscompounds of secondary condensed tannins, lignans,represent lignin, cutin, suberin. Phenolic aremetabolites involved in produced a number in physiological plants (i.e., >8000 different structures), particularly in edible plants (e.g., vegetables, of processes in plants, such asand pollination, resistance to pathogens and predators,fruit, and cereals). These include structurally have at least one aromatic resistance to abiotic stressseveral [10]. Although theydifferent can existcompounds in their free that forms, phenolic compounds are hydroxyl-substituted in common. Phenolic are produced primarily the shikimate commonly conjugatedring to sugars or proteins, andcompounds can also occur as esters and methylvia esters, probably pathway that gives riseare to toxic phenylpropanoids (Figure 1).least in part neutralized in their bound form. because most of them compounds that are at 28 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(29) Thèse de Marianne Delporte, Lille 1, 2017. Malgré une diversité structurale remarquable, les composés issus du métabolisme spécialisé peuvent toutefois être classés en 3 familles principales qui sont les composés azotés, les terpènes et les composés phénoliques. Ces différentes familles prennent cependant leur source au sein du métabolisme primaire (Fig. i.2). Les composés azotés regroupent des molécules telles que les acides aminés non protéinogènes, les glycosides cyanogéniques, les glucosinolates et les alcaloïdes. Ces derniers sont notamment représentés par des molécules bien connues telle que la nicotine, la morphine ou encore la vinblastine. Les alcaloïdes désignés comme « vrais » présentent un hétérocycle azoté et sont synthétisés à partir d’acides aminés tels que la tyrosine, le tryptophane, l’arginine ou la lysine. On retrouve également dans cette famille les pseudo-alcaloïdes qui dérivent également d’acides aminés mais pour lesquels l’azote n’est pas inclus dans un hétérocycle et enfin les protoalcaloïdes qui présentent un hétérocycle azoté mais ne sont pas synthétisés à partir d’acides aminés (Ahmed et al., 2017). Les terpènes sont une classe d’hydrocarbure notamment représentés par des molécules d’intérêt majeur que sont l’artémisinine, utilisée dans le traitement contre la malaria, ou le taxol, anticancéreux issu de l’if ou encore de nombreux composés volatils contribuant à la fragrance des fleurs utilisés entre autres dans l’industrie cosmétique comme le linalol. Ces molécules aux structures et fonctions très différentes, peuvent être décrites comme issues de la condensation d’unités isopentane avec comme précurseur commun l’IPP (isopentényl diphosphate) (Fig. i.2). L’IPP, produit à partir soit de la voie cytosolique du mévalonate, soit de la voie plastidiale du MEP/DOXP (2-C-méthylérythriol-4-phosphate / 1-désoxy-D-xylulose-5-phosphate), sert également de précurseur à de nombreux métabolites primaires tels que les chlorophylles ou les phytohormones (gibbérellines, cytokinines etc.) (Vranová et al., 2013).. 29 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(30) Thèse de Marianne Delporte, Lille 1, 2017. PAL 1144 Review. New Phytologist. Minireview. Phenylalanine. Acide cinnamique. along with the ancestral folds are often conserved during enzyme set of earlier-evolved pathways extended by variable lineage-specific family expansion, although it is also common that new catalytic peripheral pathway branches in the extant land plants. chemistry could arise within the fold family by reassembly of new Third, the expansion of the specialized metabolism in plants did catalytic residues in the active site (Weng & Noel, 2012b). For not involve the emergence of new protein folds, but rather the example, chalcone synthase (CHS), the first committed enzyme in extensive exploitation of the sequence space in the pre-existing Ammoniac flavonoid biosynthesis in plants, shares the same fold and catalytic protein folds by natural selection. Many of these fold families are machinery as the b-ketoacyl-ACP synthase III (KAS III), a key rooted in more ancient primary metabolic systems (Weng et al., enzyme of fatty acid biosynthesis in plants and bacteria (Weng & 2012b; Fig. 2, Table 1). Particular catalytic machineries inherited. HAL. shikimate Land plants PHE. p-coumaroyl-CoA. HCT. caffeoyl-shikimate p-coumaroyl-shikimate CYP98A3 HCT. Histidine. caffeoyl-CoA. feruloyl-CoA CCoAOMT. Urocanate. spermidine A. thaliana. PHE. p-coumaroyl-CoA SHT. PHE. lignin. tricaffeoyl-spermidine tricoumaroyl-spermidine CYP98A9/CYP98A8 TSM. triferuloyl-spermidine. N1, N5-di-(hydroxyferuoyl) -N10-sinapoyl spermidine. 4-OH-phenyllactate p-coumaroyl-4’-OHrosmarinic acid phenyllactate RAS CYP98A14. Ammoniac. p-coumaroyl-CoA. C. blumei. Figure i.3 : Comparaison des activités catalytiques de la PAL (Phénylalanine ammonia lyase) spécifique du métabolisme spécialisé et de la HAL (Histidine ammonia Lyase) impliquée dans le métabolisme primaire.. Cousins in primary metabolism. Acyltransferase fold. P450 fold. Carnitine acyltransferase. Sterol 14α-demethylase. OMT fold. Chatechol-O-methyltransferase. Fig. 2 Disparate plant specialized metabolic pathways assembled from descendants of radiating enzyme families with their ancestry deeply rooted in primary metabolism. For example, acyltransferase, P450, and OMT-fold enzyme families are typical plant specialized metabolic enzyme families that share similar protein folds with in primaryd’enzymes metabolism yet have undergone extensive expansion during land plant evolution.des CCoAOMT, caffeoyl 3-OTableau i.1their: cousins Familles majeures du métabolisme spécialisé plantes etCoAleur methyltransferase, HCT, hydroxycinnamoyl-CoA:shikimate hydroxycinnamoyl transferase; PHE, phenylalanine; RAS, rosmarinic acid synthase; SHT, correspondance au transferase; sein du TSM, métabolisme primaire. Le nombre de gènes dans les génomes de l’algue spermidine hydroxycinnamoyl Tapetum-specific methyltransferase.. verte Chlamydomonas reinhardtii et de la plante à fleurs Arabidopsis thaliana codant des enzymes de chacune des familles est listé pour comparaison. (D’après Weng, 2014) Table 1 Major enzymes families known to be involved in specialized metabolism in extant land plants and their presumed cousins in primary metabolism Gene number Major enzyme families involved in plant specialized metabolism. C. reinhardtii. A. thaliana. Cousins in primary metabolism. Cytochromes P450 Glycosyltransferase family 1 2-oxoglutarate-dependent dioxygenase Class III peroxidase BAHD acyltransferase SCPL acyltransferase Terpene synthase CCR-like NAD(P)H-dependent reductase Flavin-dependent monooxygenase SABBATH methyltransferase CAD-like alcohol dehydrogenase GH3 acyl-adenylase COMT-like methyltransferase Strictosidine synthase-like Acyl-CoA ligase CCoAOMT-like methyltransferase Type III polyketide synthase. 39 1 0 0 0 7 0 5 10 0 5 0 1 1 4 1 0. 245 115 84 75 61 51 32 31 29 24 19 19 17 15 13 8 4. Sterol 14-demethylase Lipopolysaccharide glycosyltransferase phytanoyl-CoA dioxygenase Cytochrome c peroxidase Carnitine acetyltransferase Serine carboxypeptidase Farnesyl pyrophosphate synthase 3-b-Hydroxysteroid dehydrogenase trimethylamine oxidase Catechol-O-methyltransferase Alcohol dehydrogenase Long-chain fatty acyl-CoA synthetase Catechol-O-methyltransferase Gluconolactonase Long-chain fatty acyl-CoA synthetase Catechol-O-methyltransferase b-ketoacyl-ACP synthase III. The number of genes in the genome of the green algae Chlamydomonas reinhardtii and the flowering plant Arabidopsis thaliana encoding enzymes belonging to each enzyme family are listed for comparison. New Phytologist (2014) 201: 1141–1149 www.newphytologist.com © 2017 Tous droits réservés.. ! 2013 The Author New Phytologist ! 2013 New Phytologist Trust. 30. lilliad.univ-lille.fr.
(31) Thèse de Marianne Delporte, Lille 1, 2017. Enfin, les composés phénoliques présentent également une grande diversité de structure et sont présents de façon ubiquitaire chez les végétaux. Ils ont en commun la présence d’un (ou plusieurs) cycle(s) benzénique(s) hydroxylé(s). L’acide salicylique, précurseur de l’acide acétylsalicylique (ou aspirine) est un exemple de composé phénolique, tout comme les tanins du vin. Pour une grande majorité des représentants de cette famille, leur biosynthèse débute par la désamination oxydative de la phénylalanine pour aboutir à la formation d’acide transcinnamique par l’intermédiaire de la Phénylalanine Ammonia Lyase (PAL). Cette enzyme, à l’origine de l’émergence des composés phénoliques chez les plantes, est issue de l’évolution d’une Histidine Ammonia Lyase (HAL) impliquée dans le catabolisme de l’histidine chez de nombreux organismes procaryotes comme eucaryotes (Emiliani et al., 2009) (Fig. i.3). Par conséquent, la biosynthèse des composés phénoliques est directement liée au détournement de la machinerie du métabolisme primaire et de ses intermédiaires. La réaction catalysée par la PAL marque la première étape de la voie dite « des phénylpropanoïdes ». Cette voie exclusive du règne végétal aboutit à la formation de molécules ayant un squelette de base en C6-C3 et notamment à la production d’un métabolite essentiel, le coumaroyl-CoA. Ce métabolite d’une importance capitale au sein du métabolisme spécialisé est un précurseur nécessaire à la synthèse de la quasi-totalité des composés phénoliques dont celle du polymère de lignine. Le nombre d’enzymes actrices du métabolisme spécialisé n’a eu de cesse de croître depuis son émergence, précédent ainsi l’augmentation continuelle de la chimiodiversité chez les plantes (Tableau i.1). La part du génome de la plante consacrée au métabolisme spécialisé est par ailleurs passée d’environ 5 à 7 % chez les Bryophytes à près de 30% chez les plantes à fleurs telle qu’A. thaliana (Weng and Noel, 2013). Néanmoins, l’apparition des métabolites spécialisés n’a pas impliqué l’émergence de nouveaux types d’enzymes à proprement parler mais est plutôt liée à la modification des propriétés catalytiques d’enzymes préexistantes.. 31 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(32) Moghe and Last. Thèse de Marianne Delporte, Lille 1, 2017. Figure i.4 : Exemples de mécanismes conduisant à la diversification de gènes dupliqués ainsi qu’à leur recrutement consécutif par le métabolisme spécialisé. (D’après Moghe and Last, 2015) Moghe and Last. Evolution of Enzym. Promiscuity is d of reactions other zyme evolved” (K Metabolic enzyme miscuity; for exam metabolism have cuous compared 1514 Planttabolism, Physiol. Vol. 169, 2015 which Downloaded from www.plantphysiol.org on May 29, 2016 - Published by www.plant.org Copyright © 2015 American Society of Plant Biologists. All rights reserved. reaction space (M 2012). However, dreds of millions bolic enzymes ma as evidenced by t loids (PAs) in mu PAssynthase are produ Figure i.5 : Réactions catalysées par l’HSS (Homospermidine synthase) et par la Deoxypusine 32 2015) (DHS). L’HSS est issue de la néo-fonctionnalisation d’une DHS ancestrale. (D’après Moghemonocot and Last, families, © 2017 Tous droits réservés. lilliad.univ-lille.fr Convolvulaceae, F et al., 2004; Anke Figure 1. Mechanisms that lead to the divergence of duplicate genes and their subsequent recruitment to specialized metabolism. A, After duplication, the duplicate gene gains new cis-regulatory elements, creating a different expression profile compared with the progenitor metabolic gene. Divergence in spatial, temporal, and environmental responsiveness may lead to the evolution of new metabolic pathways in the plant. B, A primary metabolic enzyme with main and side activities. After duplication, one copy retains and is optimized for the side activity. C, A primary metabolic enzyme, which produces only a single product, gets duplicated. The duplicated, diverged enzyme, however, is multifunctional and may produce several different products from the same substrate. D, A single amino acid change in the active site of a duplicate enzyme disrupts interaction with a substrate or a cofactor, abolishing the original activity and potentially leading to the gain of a new activity. E, The progenitor primary metabolic enzyme is allosterically inhibited by the end product of the pathway. This property is lost in the specialized metabolic enzyme due to a C-terminal deletion. In the absence of such regulation, the steady-state levels of some of the pathway intermediates may increase, leading to novel.
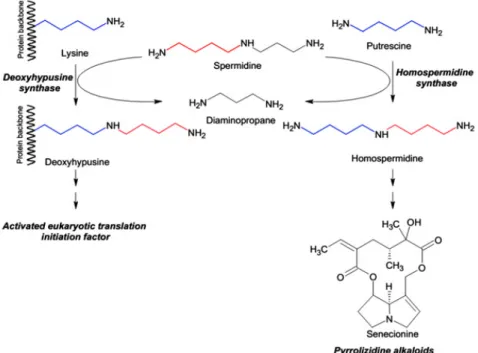
(33) Thèse de Marianne Delporte, Lille 1, 2017. Ainsi, un parallèle peut être établi entre chacune des différentes familles d’enzymes impliquées dans le métabolisme spécialisé et des enzymes aux propriétés structurales et catalytiques similaires impliquées quant à elles dans le métabolisme primaire. On peut ainsi rapprocher les acyltransférases de type BAHD avec les Carnitine acyltransférases ou encore les Glycosyltransferases de type 1 avec les lipopolysaccharide glycosyltransférases (Table i.1) (Weng, 2014). Cependant, la pression de sélection appliquée sur les enzymes du métabolisme primaire ne permet pas le maintien de gènes mutés, hormis si une autre copie continue d’assurer les fonctions requises pour le développement de l’organisme (Weng et al., 2012). Les évènements de duplication de gènes sont donc d’une importance capitale pour la diversification du métabolisme. Dès lors, la pression de sélection peut être relâchée sur une des deux copies et diverses modifications génomiques peuvent intervenir aboutissant ainsi à une néofonctionnalisation. De l’élargissement du panel de substrats utilisés par les enzymes à la relocalisation de l’expression des gènes, en passant par l’acquisition de propriétés catalytiques ou encore la perte d’interactions entre sous-unités, l’action combinée ou non de ces évènements mène de manière inéluctable à l’apparition de nouvelles molécules (Moghe and Last, 2015) (Fig. i.4). Par exemple, l’émergence des alcaloïdes pyrrolizidiniques impliqués dans la défense de la plante contre les herbivores, est liée à la néo-fonctionnalisation d’une Déoxyhypusine synthase (DHS) en Homospermidine Synthase (HSS) (Fig. i.5). La DHS, présente de façon ubiquitaire dans les cellules eucaryotes en division, catalyse l’activation post-traductionnelle d’un facteur de transcription essentiel à la croissance de la plante. Cette activation est permise par la modification d’une lysine en déoxyhypusine via l’utilisation de spermidine. Ce même substrat est utilisé par l’homospermidine synthase ce qui conduit à la synthèse d’homospermidine, une polyamine rare qui constitue le point de départ de la voie de biosynthèse des alcaloïdes pyrrolizidiniques.. 33 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(34) Thèse de Marianne Delporte, Lille 1, 2017. OH HO. OH. Overproduction of protocatechuate. HO. O. Shikimate. OH. O O OH. ubiC. CH 2. HO. O. Chorismate O. p-hydroxybenzoate. OH NH2. Phenylalanine. pobA CoAS. protocatechuate. O. p-CoumaroylCoA. OH HO. OH. OH. HO. O. HCT OH O. O. OH. HO. Coumaroylprotocatechuate. O. Coumaroylshikimate OH. 30% reduction of lignin content Lignin Figure i.6 : Stratégie mise en place par Eudes et al. (2016) permettant de réduire la quantité de lignine produite en utilisant la promiscuité catalytique d’une hydroxycinnamoyl transferase (HCT). ubiC : chorismate pyruvate-lyase de Escherichia coli. pobA : p-hydroxybenzoate 3-monooxygenase de Pseudomonas aeruginosa.. 34 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(35) Thèse de Marianne Delporte, Lille 1, 2017. De plus, la modification des éléments régulateurs du gène codant l’HSS a conduit à une expression exclusive dans les racines (Böttcher et al., 1993; Moll et al., 2002). De manière générale, les enzymes du métabolisme spécialisé possèdent ce que l’on appellera une « promiscuité catalytique » étendue par rapport à leurs équivalents du métabolisme primaire (Weng and Noel, 2012; Leong and Last, 2017). En effet, les réactions du métabolisme primaire sont généralement ultra spécifiques et catalysées avec une grande efficacité afin d’optimiser au maximum les flux métaboliques. A contrario, l’efficacité catalytique des enzymes du métabolisme spécialisé est souvent bien inférieure à celle observée au niveau du métabolisme central (30 fois en moyenne) (Bar-Even et al., 2011). De plus, les acteurs enzymatiques du métabolisme spécialisé présentent une plasticité bien plus importante et il n’est pas rare de voir une enzyme catalyser la formation de plusieurs produits minoritaires en parallèle de son activité principale. Par exemple, la caractérisation d’enzymes de type SAMT (salicylic acid carboxyl methyltransferase) chez Nicotiana suaveolens et d’autres solanacées, a montré leur capacité à utiliser plus de 15 substrats différents en plus de leur activité principale vis-à-vis de l’acide salicylique (Huang et al., 2012). Cette versatilité catalytique peut d’ailleurs être utilisée à des fins de production de métabolites pour lesquels les voies de biosynthèse ne sont pas élucidées ou d’autres applications de génie métabolique. La production de dérivés de phlorétine, retrouvés spécifiquement dans le genre Malus a ainsi été obtenue chez la levure en utilisant, entre autres, la large spécificité de substrats d’UGTs (UDP-dependent glycosyltransferases) isolées chez Arabidopsis thaliana (Eichenberger et al., 2016). Par ailleurs, la plasticité d’une hydroxycinnamoyl transférase (HCT) impliquée dans la biosynthèse de la lignine a été exploitée afin de réduire la quantité de ce polymère qui peut s’avérer problématique lorsqu’il s’agit de valoriser la biomasse sous forme de bioéthanol. Une lignée d’Arabidopsis avec une teneur en lignine réduite de 30% a en effet été obtenue grâce à l’insertion de deux gènes permettant une synthèse accrue de protocatéchuate (Fig. i.6) (Eudes et al., 2016).. 35 © 2017 Tous droits réservés.. lilliad.univ-lille.fr.
(36) New Phytologist. Thèse de Marianne Delporte, Lille 1, 2017 (a). CACTACEAE. PORTULACACEAE. Portulaca. Pereskia. TALINNACEAE. Talinum. Opuntia. DIDIERARACEAE. Alluaudia. BASELLACEAE. Halophytum. MONTIACEAE. Claytonia. Basella. MOLLUGINACEAE. Mollugo. SARCOBATACEAE. Sarcobatus. NYCTAGINACEAE. RIVINACEAE. Rivina. Bougainvillea. PHYTOLACACEAE. Phytolacca. Mirabilis. AIZOACEAE. GISEKIACEAE. KEWACEAE. Kewa. Gisekia. LIMEACEAE. Limeum. Delosperma. STEGNOSPERMATACEAE. Stegnosperma. ACHATOCARPACEAE. AMARANTHACEAE. Spinacea. Celosia. Phaulothamnus. MACARTHURIACEAE CARYOPHYLLACEAE. B mo from bry enz enz New unk Betalain Anthocyanin Phytologist et a Fig. 1 (a) Pink hue of a betalain-pigmented flower (Mirabilis jalapa). (b) (L-D Blue anthocyanins, a color that is not obtainable with betalains (Myosotis 4,5 sp.). (Ch cyc DO et al., 2012). Given the clear health benefits of betalains (Gand!ıame Herrero et al., 2013), there is interest in expressing the betalain or synthesis pathway in the anthocyanic background of food crops con (Harris et al., 2012; Hatlestad et al., 2012). Understanding the tein restricted distribution of betalains within Caryophyllales may (DO therefore have implications for human health and nutrition et a (Gand!ıa-Herrero et al., 2013). Although some of the genetic comna, ponents necessary for betalain pigmentation are suggested to be the present in anthocyanic plants outside of the Caryophyllales, I thereby minimizing the steps needed to express the pathway in cya heterologous species, other elements appear to be CaryophyllalesMa specific (Harris et al., 2012). In this context, a clear understanding Ca of the origin and evolution of the genetic components comprising Ma the betalain synthesis pathway is valuable. Stellaria. MICROTEACEAE Microtea. Macarthuria. ASTEROPEIACEAE. PHYSENACEAE Physena. SIMMONDISIACEAE Simmondsia. Asteropeia. ANCISTROCLADACEAE. DIONCOPHYLLACEAE Triphyophyllum. RHABDODENDRACEAE. DROSOPHYLLACEAE Drosophyllum. Rhabdodendron. DROSERACEAE Drosera. Ancistrocladus. NEPENTHACEAE Nepenthes. PLUMBAGINACEAE. POLYGONACEAE Polygonum. Limonium. FRANKENIACEAE Frankenia. Plumbago. TAMARICACEAE Tamarix. DILLENIACEAE Hibbertia. VITACEAE Vitis. Tetracera. BERBERIDOPSIDACEAE Berberidopsis. 1176 Research. (b). (a). ?. * -α neo-functionalisation inferred prior to this node DODA-α/-β duplication CYP761-α/-β duplication. CY. P7. 6A. D1. Tyrosine. Fig. 4 Topology derived from a maximum-likelihood (ML) analysis of a concatenated matK/rbcL dataset, with terminals coded blue for anthocyanin, pink for betalain and grey fori.7 missing data. Results of the ML reconstruction of dominant pigment type are also depicted; probabilities for character Figure : Arbre phylogénétique représentant les événements de duplication et néo-states at S* internal nodes are reported as pie charts. The solid pink line indicates the approximate phylogenetic location of the duplication event in the CYP76AD1 fonctionnalisation ayant abouti à la synthèse de bétalaïnes chez les Caryophyllales. Les espèces lineage that gave rise to CYP76AD1-a, -b, and -c and the duplication event (DODA) lineage that gave rise to DODA-a and b. The Fig.in2the (a)4,5-dioxygenase Outline of the betalain biosynthetic représentées en bleu correspondent aux espèces « à with anthocyanes », must celles en rose aux espèces « à pink asterisk marks the node at which we infer neofunctionalisation of thepathway CYP76AD1-a and DODA-a have taken place on the basis of duplication the key enzymes CYP76AD1 bétalaïnes » et celles en gris aux espèces pour lesquelles les données sont manquantes. D’après and subsequent losses in the CYP76AD1 and DODA lineages. and 4,5-dioxygenase (DODA) marked in red. cyclo-DOPA CYP76AD1 catalyses the conversion of L-3,4(Brockington et al., 2015) dihydroxyphenylalanine (L-DOPA) into and that the betalain-specific genes betalain synthesis pathway, absence of the CYP76AD1-a homolog from the genome of the cyclo-DOPA, whereas DODA catalyzes the were then lost in the anthocyanic taxa because betalain pigmentaanthocyanic Dianthus caryophyllus, suggesting that gene loss may conversion of L-DOPA to betalamic acid. tion is spontaneously no longer maintained. underlie the general absence of CYP6AD1-a homologs from at Betalamic acid cyclizes withLoss of both the CYP76AD1-a and DODA-a is confirmed in only one anthocyanic species least some anthocyanic transcriptomes. Exactly the same patterns cyclo-DOPA to giveisoforms red-pigmented betanidins, acidgenome, can withwhereas a fullybetalamic sequenced D. caryophyllus. The bulk of our of asymmetric gene loss occur in DODA-a vs DODA-b. Isoconjugate with amino and amine to data were derived fromgroups transcriptomes and we therefore cannot forms of DODA-b are present in 15 anthocyanic transcriptomes generate yellow betaxanthins. (b) Variegated distinguish between gene loss and downregulation. Although we plus the genome of D. caryophyllus, but the DODA-a variant was forms of Mirabilis jalapa, with yellow forms that from the transcriptomes is not proof of only detectable from the transcriptome of a single putatively in whichappreciate betaxanthins areabsence the dominant common anthocyanic species, Spergularia media. The DODA-a sequence pigmentabsence, and pinkthe forms in which expression betacyanins of the DODA-b in 15 different Be are dominant. anthocyanic transcriptomes compared with the presence of the of S. media occupies the typical phylogenetic position of Caryo-. DODA-a in a single anthocyanic transcriptome is compelling. phyllaceae, suggesting that this locus has been inherited and ! 2015 TheThe Authors asymmetric loss or downregulation of the DODA-a and retained in S. media rather than acquired via horizontal gene New Phytologist ! 2015 New Phytologist Trust 36 CYP76AD1-a homologs in anthocyanic taxa suggests an interesttransfer (HGT). Loss or downregulation of these loci in taxa with © 2017 Tous droits réservés. lilliad.univ-lille.fr ing mechanistic difference underlying the mutual exclusion of anthocyanin pigmentation also strongly implies that these clades these two pigment types. Whereas the suppression of anthocyahave a betalain-specific function. Furthermore, it indicates that.
Figure

Documents relatifs
GenFam* is dedicated to the manual and precise analysis of gene families and includes specific workflows running under a Galaxy platform, allowing to gather
GenesPath: a tool using GenFam, and focused on metabolic pathways.. GenesPath: launch workflow through
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des
MSBIO831 - Master 1 (Nutrition, Besoins Nutritionnels et Prévention des grandes Pathologies (NBPP)), 2012.. Contrôle central de la
If you cannot go to the hospital or health post for any reason, you must speak with your local community leader immediately or call the Ebola Hotline XXXX for help.. If there
Au cours de mon doctorat, j’ai validé un protocole de génération optimisée de CGRs différenciées à partir de plusieurs lignées de cellules hiPS, en alliant d’une part
D r. Sulaimon Giwa, Assistant Professor in the School of Social Work at Memorial University, broke down a common miscon- ception that not all families on the move are
Maximum Entropy modelling of a few protein families with pairwise interaction Potts models give values of σ ranging between 1.2 (when all amino acids present in the multiple