HAL Id: tel-02993717
https://tel.archives-ouvertes.fr/tel-02993717
Submitted on 7 Nov 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
virulence du Streptocoque du groupe B
Constantin Hays
To cite this version:
Constantin Hays. Influence de l’imprégnation hormonale périnatale sur la virulence du Streptocoque du groupe B. Microbiologie et Parasitologie. Université Sorbonne Paris Cité, 2018. Français. �NNT : 2018USPCB171�. �tel-02993717�
1
Ecole doctorale BioSPC
Institut Cochin INSERM U1016 / Equipe Barrières et Pathogènes
Influence de l'imprégnation hormonale
périnatale sur la virulence du
Streptocoque du groupe B
Par Constantin Hays
Thèse de doctorat de Microbiologie
Dirigée par M
mele Pr Claire Poyart
et co-encadrée par Mme le Dr Asmaa Tazi
Présentée et soutenue publiquement le 28 novembre 2018
Devant un jury composé de :
Mme le Pr Claire Poyart (PU-PH) Directeur de thèse M. le Pr Frédéric Laurent (PU-PH) Rapporteur M. le Pr Laurent Mereghetti (PU-PH) Rapporteur
Mme le Pr Claire Janoir (PU) Examinateur
Mme le Dr Shaynoor Dramsi (DR) Examinateur M. le Pr Stéphane Bonacorsi (PU-PH) Examinateur
3 Je voudrais remercier Madame le Professeur Claire Poyart de m’avoir accordé sa confiance depuis plus de 6 ans maintenant. Après m’avoir permis de réaliser mon Master 2 dans son laboratoire sur une bactérie qui n’est même pas un Streptocoque (!!!), elle a accepté de diriger cette thèse de science. Je la remercie pour son soutien durant ces belles années.
Je remercie aussi Asmaa de m’avoir encadré durant ma thèse, j’ai été très heureux de travailler avec toi. Merci pour la grande autonomie que tu m’as laissée, ta bonne humeur constante et ton humour. Merci pour les bons moments passés ensemble, à discuter de la vie en disséquant des intestins de souris ou à boire des litres de café (les « tu veux un café ?» 10 fois par jour). Merci pour la qualité de nos échanges et de ton encadrement scientifique. J’ai beaucoup appris à tes côtés. Merci aussi pour tes talents de traductrice qui ont permis de me faire comprendre parmi mes semblables.
Madame le Professeur Claire Janoir, madame le Docteur Shaynoor Dramsi et Messieurs les Professeurs Frédéric Laurent, Laurent Mereghetti et Stéphane Bonacorsi qui me font l’honneur d’avoir accepté de participer à ce jury.
Je remercie toute l’équipe « Barrières et Pathogènes » qui a bien changé depuis mon arrivée. Plus particulièrement à Agnès Fouet, co-directrice de l’équipe qui m’a co-encadrée lors de mon Master 2 et qui veille au grain depuis son bureau dont la porte est toujours ouverte pour discuter. A Antonin mon co-bureau depuis plus d’un an, avec qui j’ai partagé de nombreuses discussions biologicophylosophiques, qui m’a à plusieurs reprises conseillé dans mes immunomarquages et aidé dans la programmation pour l’analyse d’images. On a passé de très bons moments et je te souhaite le meilleur. A Anne-Sophie qui fut mon interne et qui est maintenant AHU et en thèse de science dans l’équipe, bon courage pour la suite. A Julie Guignot pour sa bonne humeur et ses présentations enrichissantes en réunions de labo. A Gérald qui a rejoint l’équipe récemment et qui m’a aidé à maniper pendant ces derniers mois. Sa rigueur, sa motivation et sa gentillesse ont été une aide précieuse. A Abdel qui m’a aidé à mes débuts et a construit les magnifiques mutants srr2 et la souche révertée. A Magalie et aux nouveaux venus depuis plus ou moins longtemps : Clara qui aura l’honneur d’être la dernière thèse d’Agnès (bon courage Clara), Lionel et Sébastien. Aux anciens partis depuis plus ou moins longtemps : Sophie Brinster, Samuel, Adbel…
Je remercie toute l’équipe de Bactériologie hospitalière de Cochin. A Josette Raymond, la reine des Helicobacter pour ta gentillesse et ta formation toute particulière à la bactériologie appliquée à un service de réanimation néonatale. Merci d’avoir à maintes reprises d’avoir assuré (plus qu’à ton tour) la routine. Merci aussi pour tous les articles faits ensemble dans la bonne humeur. Merci à Céline et Nadjet
4 pour votre gentillesse et les moments arrosés notamment chez Rusti.
Je remercie le personnel de laboratoire notamment Annick, Gislaine, Nicole, Patricia, Laurence (que l’on peut croiser dans l’hôpital à 22h), Martine, Cécile, Caroline, Jean-Marie, Mardoché, Corinne, JP, Vincent, Fabien, et les autres…
Les internes que j’ai eu le plaisir de former et pour leur aide précieuse dans l’activité de laboratoire.
Je remercie aussi toutes les personnes avec qui j’ai pu discuter de mon travail de près ou de loin. Notamment les Niedergang, les Bourdoulous, les Arrieumerlou, les Piquotins, les Chiche avec une mention spéciale pour le couple Christophe et Fanny (ma pédiatre). Toutes les plateformes : l’imagerie avec Thomas Gilbert, de Cytométrie avec Murielle, Karine et Patrice, d’histo avec Maryline Favier. Merci à Mathieu de l’animalerie. Merci à la laverie avec le duo Khemwantee et Romero.
Merci aux secrétaires de Méchain avec une dédicace spéciale pour Maryline Bajolle.
Merci à mon amie Solen, cheffe d’équipe du 13h pile avec qui j’allais déjeuner presque tous les midis.
Je voudrais aussi remercier particulièrement Messieurs les Professeurs Roland Leclerc et Vincent Cattoir qui m’ont donné l’envie de faire ce métier. Ainsi que tous ceux qui ont participé à ma formation notamment aux CHU de Caen et du Kremlin-Bicêtre.
Merci aux copains que je ne vais pas citer car ils ne liront jamais ma thèse.
Je remercie ma famille pour le soutien et leur patience. Et la belle-famille bien sur qui a toujours considéré que ma thèse me servait d’excuse pour éviter les repas de famille.
Je remercie Marion, ma femme qui m’a fait deux magnifiques filles. Merci pour tout. Merci pour le soutien indéfectible, pour ton amour et ta patience : « Cela fait 6 ans que j’entends que tu as envie de nous consacrer du temps … j’attends de voir…» et « Je crois bien que quand je t’ai rencontré tu étais déjà en thèse ». Non j’étais en M2R ce n’est pas pareil !
Je dédie cette thèse à ma mère qui aurait été fière (normal c’est ma mère), à mon père qui est maintenant un grand-père aimant et attentionné, et à Ninou qui est une grand-mère de cœur pour mes filles.
5
Streptococcus agalactiae (streptocoque du groupe B, SGB) représente la première
cause d'infections néonatales bactériennes invasives pour lesquelles on définit deux syndromes, un syndrome précoce (1ère semaine de vie) et un syndrome tardif (7 à 89 jours après la naissance). Le syndrome précoce se manifeste par une pneumonie associée ou non à une bactériémie et résulte de l’inhalation par le nouveau-né de sécrétions vaginales ou de liquide amniotique contaminés par le SGB. Le syndrome tardif se déclare par une septicémie dont la porte d’entrée serait le tractus gastro-intestinal et est caractérisé par un fort taux de méningite. Un clone désigné CC-17 est responsable de près de la moitié des syndromes précoces et de 70% des syndromes tardifs et des méningites, alors qu’il n’est que rarement responsable d’infections chez l’adulte (15% des cas). L’hypervirulence du clone CC-17 a été attribuée à des capacités accrues de colonisation et de translocation du tube digestif, ainsi que de franchissement de la barrière hémato-encéphalique. Cependant, ces propriétés ne peuvent expliquer à elles seules son association aux infections néonatales et des facteurs liés à l’hôte sont probablement impliqués. Tout au long de la grossesse, le fœtus est exposé à des concentrations croissantes d’hormones stéroïdiennes maternelles, en particulier l’œstradiol (E2) et la progestérone (P4). Ainsi, les taux du nouveau-né sont 500 fois supérieurs à ceux d’un homme adulte puis chutent drastiquement dans les trois premiers jours de vie et se stabilisent pour quelques mois à des taux 5 à 50 fois plus élevés que chez l’adulte. Or, ces hormones régulent de manière concentration dépendante la réponse immunitaire, la perméabilité des barrières cellulaires, et l’expression de molécules d’adhésion. Aussi, l’imprégnation hormonale massive des nouveau-nés pourrait spécifiquement favoriser l’infection tardive à SGB CC-17.
Dans ce travail, le rôle de l’E2 et de la P4 aux concentrations retrouvées à la naissance (E2-P4 D0, E2 10-8 M et P4 10-6 M) et au-delà de 7 jours de vie (E2-P4 D7, E2 10-9 M et P4 10-7 M) dans la physiopathologie des infections à SGB a été étudié dans des modèles cellulaires et murins d’infection utilisant deux souches de SGB représentatives, à la fois le clone hypervirulent CC-17 et un SGB non CC-17. Nous montrons que les concentrations E2-P4 D7 contribuent spécifiquement à la sévérité de la méningite due à SGB CC-17 dans un modèle murin d’infection par voie orale. Ce phénotype est lié à une augmentation du franchissement
6
intestinales ligaturées et de cultures cellulaires d’entérocytes-cellules M infectées par SGB CC-17 montre que SGB CC-CC-17 peut franchir la barrière intestinale via les cellules M, que l’association aux cellules M est plus importante pour le clone CC-17, et qu’elle est favorisée par les conditions E2-P4 D7. Enfin, l’étude de mutants du clone CC-17 inactivés pour l’expression des protéines de surface spécifiques intervenant dans le franchissement des barrières physiologiques nous a permis de démontrer que l’association de SGB CC-17 aux cellules M est liée à la protéine Srr2 et que celle-ci contribue à la sévérité de la méningite en modèle murin dans les conditions E2-P4 D7 en favorisant la translocation intestinale de SGB CC-17 après infection par voie orale. L’identification du (des) récepteur(s) cellulaire(s) de la protéine Srr2 exprimé(s) par les cellules M, la régulation de son expression par les concentrations hormonales et la caractérisation des cascades de signalisation induites dans ces conditions constitueront la suite logique de ce travail.
Mots-clés :
Streptococcus agalactiae, Streptocoque du groupe B, CC-17, Srr2, Œstradiol, Progestérone,
7
Streptococcus agalactiae (Group B Streptococcus, GBS) is the leading cause of invasive
bacterial neonatal infections for which two syndromes are defined, the early-onset disease (EOD, first week of life) and the late-onset disease (LOD, 7 to 89 days of life). EOD starts with pneumonia and results from the inhalation by the neonate of GBS-contaminated vaginal secretions or amniotic fluid. LOD manifests as a bacteremia for which the proposed portal of entry is the gastrointestinal tract and is characterized by a high rate of associated meningitis. A particular clone designated GBS CC-17 is responsible for nearly half of all EOD and for 70% of LOD and meningitis cases, while it is rarely responsible for infections in adults (15% of the cases). The hypervirulence of this CC-17 clone has been attributed to increased colonization and translocation capabilities of the gastrointestinal tract, as well as increased ability to cross the blood-brain barrier. However, these properties alone cannot explain its association with neonatal infections and host-related factors are likely involved. Throughout pregnancy, the fetus is exposed to increasing concentrations of maternal steroid hormones, particularly estradiol (E2) and progesterone (P4). Thus, newborn rates are 500 times higher than those of an adult male, then drop drastically in the first three days of life to stabilize for a few months at rates 5 to 50 times higher than in adults. These hormones regulate in a concentration-dependent manner the immune response, the permeability of cellular barriers, and the expression of adhesion molecules. Also, the massive hormonal impregnation of newborns could specifically promote GBS CC-17 late infections.
In this work, the role of E2 and P4 at birth concentrations (E2-P4 D0, E2 10-8 M and P4 10-6 M) and beyond 7 days of life (E2-P4 D7, E2 10-9 M and P4 10-7 M) in the pathophysiology of GBS infections was studied in cellular and mouse models of infection using two representative strains, a CC-17 hypervirulent GBS and a non-CC-17 GBS. We show that HormD7 concentrations specifically contribute to the severity of meningitis caused by GBS CC-17 in a mouse model of oral infection. This phenotype is linked to an increase in the crossing of the intestinal barrier highlighted by a greater number of bacteria in the mesenteric lymph nodes and Peyer's patches. Optical microscopy imaging of intestinal ligated loops and M cells-enterocytes co-cultures infected with GBS CC-17 shows that GBS CC-17 can cross the intestinal barrier through M cells, that the association with M cells is more important for the CC-17 clone compared to non-CC-17 GBS, and that it is favored in E2-P4 D7condition. Finally, the study of
8
association of GBS CC-17 with M cells is linked to the Srr2 protein which contributes to the severity of meningitis under E2-P4 D7 condition by promoting the intestinal translocation of GBS CC-17 following mice oral infection. The identification of the cellular receptor(s) of the Srr2 protein expressed by M cells, their expression regulation by hormonal concentrations and the characterization of the signaling cascades induced in these conditions will constitute the logical continuation of this work.
Keywords
Streptococcus agalactiae, Group B Streptococcus, CC-17, Srr2, Estradiol, Progesterone,
9 Avant-propos ... 17 Revue bibliographique ... 19 1. Le streptocoque du groupe B... 21 1.1. Caractères bactériologiques ... 21 1.1.1. Taxonomie ... 21 1.1.2. Identification clinique ... 21 1.1.3. Typage ... 22 1.1.3.1. Sérotypage capsulaire ... 22 1.1.3.2. Séquence typage ... 24 1.2. Pouvoir pathogène ... 25
1.2.1. Infection chez l’adulte ... 25
1.2.2. Infection chez le nouveau-né ... 26
1.2.2.1. Le syndrome précoce - EOD ... 28
1.2.2.2. Le syndrome tardif - LOD ... 29
1.2.3. Physiopathologie des infections à SGB ... 30
1.2.3.1. Adhésion aux cellules de l’hôte ... 31
1.2.3.2. Franchissement des barrières physiologiques ... 33
1.2.3.3. Réponse immunitaire induite par SGB ... 36
1.2.3.4. Echappement au système immunitaire ... 38
1.2.3.5. Franchissement de la BHE et infection du SNC ... 39
1.3. Le clone hypervirulent CC-17 ... 39
1.3.1. Définition et épidémiologie... 39
1.3.2. Facteurs de virulence spécifique du clone CC-17 ... 41
2. Franchissement de la barrière intestinale par les bactéries ... 45
2.1. La barrière intestinale ... 45
2.1.1. Anatomie du tractus intestinal ... 45
2.1.2. La lumière intestinale ... 46
2.1.2.1. Le mucus ... 46
2.1.2.2. La flore intestinale ... 47
2.1.3. Les muqueuses intestinales ... 47
2.1.3.1. L’épithélium intestinal ... 47
2.1.3.2. Muqueuse intestinale non associée aux follicules ... 48
2.1.3.3. Tissu intestinal associé aux follicules lymphoïdes ... 49
2.1.3.4. Réponse immune antibactérienne ... 53
2.2. Modes de franchissement de la barrière intestinale par les bactéries ... 55
2.2.1. La transcytose ... 56
2.2.2. La paracytose ... 57
10
3. Rôle des hormones dans la vulnérabilité des nouveau-nés aux infections invasives
bactériennes. ... 62
3.1. Susceptibilité des nouveau-nés aux infections bactériennes : généralités ... 62
3.1.1. La réponse immunitaire innée chez les NN... 62
3.1.1.1. Réponse Th1/Th2 ... 62
3.1.1.2. Spécificité des cellules de l’immunité innée anti-bactérienne ... 64
3.1.2. La barrière intestinale du nouveau-né ... 65
3.2. Hormones stéroïdiennes et susceptibilité aux infections ... 66
3.2.1. Imprégnation hormonale périnatale ... 66
3.2.2. Mécanisme d’action des hormones ... 68
3.2.2.1. Les voies de signalisation liées aux œstrogènes ... 68
3.2.2.2. La progestérone ... 72
3.2.3. Hormones stéroïdiennes et barrières physiologiques ... 73
3.2.4. Hormones et système immunitaire ... 74
3.2.4.1. Régulation de la réponse inflammatoire ... 75
3.2.4.2. Chimiotactisme ... 77
3.2.4.3. Régulation de la voie NF-κB ... 77
3.2.5. Hormones et infections ... 79
Contexte et objectif des travaux ... 83
Résultats expérimentaux ... 85
Article……….. ... 97
Discussion et Perspectives ... 133
11
BHE Barrière hémato-encéphalique
CC Complexe-clonal
CPS Sérotype capsulaire
CPA Cellule présentatrice d’antigène
DC Cellule dendritique
EOD Infection précoce, early onset disease
FAE Epithélium associé aux follicules, follicle-associated epithelium
LOD Infection tardive, late onset disease
LP Lamina propria
LPS Lipopolysaccharide
MNL Ganglions lymphatiques mésentériques, mesenteric lymph nodes
NN Nouveau-né
PAMP Motifs moléculaires bactériens, pathogen associated molecular patterns
PP Plaques de Peyer
PRR Récepteurs cellulaires de reconnaissance de motifs moléculaires, pattern
recognition receptors
SGB Streptocoque du groupe B
SI Système immunitaire
SNC Système nerveux central
13
Liste des figures
Fig. 1. Caractères d’identification phénotypique des colonies de SGB. ... 22
Fig. 2. Représentation schématique de l’organisation de l’opéron cps responsable de la synthèse de l’antigène capsulaire des souches de sérotypes Ia, Ib, et II à VIII de SGB. ... 23
Fig. 3. Analyse phylogénétiques de souches de SGB. ... 24
Fig. 4. Répartition en pourcentage des principaux sérotypes capsulaires de souches de SGB isolées de portage et d’infections invasives... 26
Fig. 5. Scénario physiopathologique de l’infection néonatale à SGB. ... 27
Fig. 6. Nombres estimés de cas d’infections invasives néonatales précoces et tardives à SGB de 1996 à 2015 en France. ... 29
Fig. 7. Schéma représentant les différentes étapes d’une infection invasive à SGB. ... 31
Fig. 8. Représentation schématique des principaux mécanismes d’invasion de barrières cellulaires par SGB. ... 33
Fig. 9. Observation par microscopie électronique d’interactions entre SGB et différentes cellules eucaryotes. ... 34
Fig. 10. Franchissement de monocouches de cellules humaines par le SGB via un mécanisme de paracytose. ... 35
Fig. 11. Voies de signalisations induites par SGB après reconnaissance par les PRR. ... 37
Fig. 12. Représentation de différents mécanismes mis en jeu dans l’échappement de SGB au système immunitaire... 38
Fig. 13. Répartition des souches SGB CC-17 isolées d’infections néonatales recueillies par le CNR des streptocoques en France de 2007 à 2012. ... 40
Fig. 14. Structure du locus bibA/hvgA chez SGB. ... 42
Fig. 15. Organisation génétique des loci srr de SGB et structure protéique de Srr2. ... 43
Fig. 16. Représentation schématique de l’opéron PI-2b... 44
Fig. 17. Anatomie de l’intestin et des muqueuses intestinales. ... 45
Fig. 18. Représentation schématique de la composition des jonctions intercellulaires des cellules épithéliales. ... 48
Fig. 19. Tissu intestinal associé aux follicules lymphoïdes. ... 49
Fig. 20. Portion d’intestin grêle d’une souris BALB/c âgée de 3 semaines. ... 50
Fig. 21. Morphologie et différenciation des cellules M. ... 51
Fig. 22. Schéma représentant trois voies possibles de capture d’antigènes et de bactéries par les cellules M. ... 52
Fig. 23. Représentation schématique de la réponse immunitaire intestinale initiée par des bactéries pathogènes. ... 54
Fig. 24. Mécanismes d’invasion de différents entéro-pathogènes. ... 55
14
Fig. 28. Structure des récepteurs nucléaires aux hormones... 69 Fig. 29. Voies de signalisation des récepteurs aux estrogènes. ... 71 Fig. 30. Influence de l’œstradiol et de la progestérone sur la réponse inflammatoire en
fonction des types cellulaires. ... 76 Fig. 31. Représentation schématique des différents modes d’inhibition de la voie NF-κB par les estrogènes. ... 78 Fig. 32. Les hormones E2-P4 D7 modulent la sévérité de la méningite. ... 88 Fig. 33. Les hormones E2-P4 D7 favorisent le franchissement de la barrière intestinale et la dissémination de SGB CC-17 après infection par voie orale. ... 89 Fig. 34. Le SGB CC-17 traverse la barrière intestinale via les plaques de Peyer, processus favorisé par les conditions hormonales E2-P4 D7. ... 90 Fig. 35. Localisation cellulaire de SGB CC-17 après infection d’anses intestinales ligaturées. 91 Fig. 36. La condition hormonale E2-P4 D7 favorise spécifiquement la phagocytose de SGB CC-17. ... 92 Fig. 37. La protéine de surface HvgA spécifique de SGB CC-17 promeut la phagocytose en condition hormonale E2-P4 D7. ... 93 Fig. 38. La protéine de surface Srr2 spécifique de SGB CC-17 promeut l’association aux
cellules M en condition hormonale E2-P4 D7. ... 94 Fig. 39. La protéine de surface Srr2 spécifique du clone hypervirulent CC-17 promeut la translocation intestinale de SGB. ... 95 Fig. 40. Rôle de l’œstradiol et de la progestérone dans le franchissement de la barrière intestinale et dans la physiopathologie des infections tardives à SGB. ... 139
Liste des tableaux
Tableau 1. Principales protéines de surface de SGB intervenant dans la pathogénie ... 32 Tableau 2. Principaux ligands des cellules M ... 57 Tableau 3. Expression des récepteurs aux estrogènes et à la progestérone par les cellules immunitaires. ... 74
15
Avant-propos
17
Le streptocoque du groupe B (SGB) représente la première cause d'infections néonatales invasives pour lesquelles on définit deux syndromes, un syndrome précoce se manifestant principalement par une pneumonie et un syndrome tardif se déclarant par une septicémie dont la porte d’entrée serait le tractus gastro-intestinal et qui est caractérisé par un fort taux de méningite. Un clone désigné CC-17 est responsable de près de 70% des syndromes tardifs et des méningites, alors qu’il n’est que rarement responsable d’infections chez l’adulte (15% des cas).
La revue bibliographique de ce mémoire est divisée en trois parties. La première est dédiée au SGB et permet d’exposer les facteurs bactériens impliqués dans la pathogénèse des infections. Les données épidémiologiques et cliniques, ainsi que les facteurs de virulence impliqués dans différents mécanismes de franchissement des barrières cellulaires sont passés en revus. La deuxième partie aborde la barrière intestinale, porte d’entrée probable des infections tardives. Je détaille comment les cellules épithéliales et immunitaires assurent une protection contre les bactéries, puis j’expose les différents mécanismes possibles de franchissement de la barrière intestinale par des bactéries entéropathogènes. Enfin, la dernière partie fait un état des lieux sur l’influence des hormones (œstradiol et progestérone) dans la pathogénie des infections bactériennes et la modulation de la réponse immunitaire. La partie résultats met en lumière les principaux résultats de mon travail, elle est suivie de l’article en préparation puis d’une discussion générale dans laquelle sont proposées différentes perspectives de recherche afin d’identifier à plus long terme les cibles cellulaires mises en jeu dans le franchissement de la barrière intestinale par SGB CC-17.
19
Revue bibliographique
21
1. Le streptocoque du groupe B
1.1. Caractères bactériologiques
1.1.1. Taxonomie
Streptococcus agalactiae appartient à l’ordre des Lactobacillales, famille des Streptococcaceae qui regroupe les genres Streptococcus, Lactococcus et Lactovum. Ces trois
genres partagent les caractéristiques suivantes : ce sont des coques à Gram positif, non sporulés, à métabolisme aéro-anaérobie facultatif et dépourvus de catalase. En 1933, Rebecca Lancefield propose de classer les bactéries appartenant au genre Streptococcus en 19 groupes sérologiques en fonction des propriétés de l’antigène C localisé dans la paroi des streptocoques (A à H, K à P et R à V) (1). S. agalactiae est l’unique membre du groupe B de la classification de Lancefield, d’où son nom de streptocoque du groupe B (SGB) (2).
1.1.2. Identification clinique
L’identification de SGB est aujourd’hui facilitée par des techniques simples utilisées en diagnostic. Des caractères d’indentification phénotypique peuvent être recherchés après croissance sur différents milieux de culture. Après croissance sur gélose au sang de cheval défibriné, les colonies de SGB forment des colonies rondes et claires, produisant une β-hémolyse plus ou moins importante selon les souches (Fig. 1 A). La production d’un pigment orange par plus de 95% des souches peut également être recherchée sur milieu spécifique Granada (Fig. 1 B) (3).
22
Fig. 1. Caractères d’identification phénotypique des colonies de SGB.
(A) Isolement sur gélose Columbia additionnée de sang défibriné de cheval. (B) Isolement sur
gélose Granada incubée en anaérobiose. La synthèse du pigment orange est exacerbée et rend la bactérie aisément identifiable.
La confirmation de l’identification du SGB à partir des colonies peut être réalisée par la recherche de l’antigène B par agglutination de billes de latex sensibilisées par des immunoglobulines spécifiques de groupe ou par spectrométrie de masse à ionisation douce comme avec le MALDI-TOF (matrix assisted laser desorption ionisation time-of-flight) (4).
Enfin, des techniques moléculaires d’identification avec en particulier la PCR en temps réel peuvent être utilisées directement à partir du prélèvement en cas de suspicion de méningite ou pour le dépistage vaginal en per-partum (5).
1.1.3. Typage
Les souches de SGB présentent une variabilité génétique et phénotypique mise à profit pour l’étude épidémiologique des infections à SGB. Différentes méthodes de typages ont été mises au point pour la classification des souches de SGB.
1.1.3.1. Sérotypage capsulaire
La quasi-totalité des souches isolées d’infections étant capsulées, une première méthode de classification a été élaborée sur la base des antigènes capsulaires (2). La capsule polysaccharidique présente une variabilité́ interspécifique et dix sérotypes capsulaires ont été décrits (Ia, Ib, II-IX) (6, 7). Chaque sérotype correspond à un assemblage de quatre sucres parmi cinq (glucose, galactose, rhamnose, N-acétylglucosamine et acide sialique) en une sous-unité unique et répétée permettant la formation du polyoside capsulaire (7, 8). Le locus cps
23
qui est à l’origine de la synthèse du polyoside capsulaire est constitué de gènes communs à tous les CPS ainsi que de gènes spécifiques (7) (Fig. 2). L’identification des différents sérogroupes peut se faire par agglutination de billes sensibilisées par des anticorps spécifiques de chaque groupe capsulaire, ou par PCR multiplexe après amplification de régions variables du locus cps (9). Cinq CPS sont responsables de près de 75% des infections à SGB de par le monde (Ia, Ib, II, III et V) (10).
Fig. 2. Représentation schématique de l’organisation de l’opéron cps responsable de la synthèse de l’antigène capsulaire des souches de sérotypes Ia, Ib, et II à VIII de SGB.
Les lettres figurant au-dessus des gènes indiquent le nom de ceux-ci (exemple: G pour cpsG). La fonction de groupes de gènes est indiquée au-dessus du schéma. Les gènes cpsA à F, cpsL,
neuB à D et neuA sont conservés chez 8 des 9 sérotypes et ne sont représentés que pour le
sérotype Ia. Les gènes qui partagent plus de 50% d’identité sont représentés par la même couleur. Un espace a été introduit entre les gènes cpsH et cpsI afin de permettre l’alignement des cadres de lecture correspondants entre les loci des différents sérotypes. D'après (7).
24
1.1.3.2. Séquence typage
En 2003, une méthode de typage moléculaire des souches de SGB basée sur la comparaison des séquences de sept gènes de ménage a été proposée (Multi Locus Sequence
Typing ou MLST) (11). Cette méthode permet de définir le profil allélique ou séquence-type
de chaque souche. Un numéro d’allèle est attribué à une séquence d’un gène. La combinaison des sept numéros d’allèles donne le séquence-type de la souche. Les séquence-types permettent également de regrouper les souches de SGB phylogénétiquement proches en complexes clonaux (CC). Un CC est constitué de souches partageant au moins cinq numéros d’allèles identiques sur sept (12). L’analyse des séquence-types de souches SGB provenant d’origines géographiques diverses a permis de mettre en évidence cinq CC majoritaires (CC-1, CC-10, CC-17, CC-19, CC-23) (Fig. 3).
Fig. 3. Analyse phylogénétiques de souches de SGB.
Arbre phylogénétique de 229 génomes entiers séquencés à partir de souches de SGB isolés chez l’homme. Les CC-1, 10, 17, 19, 23 et 26 ont été déterminés grâce à l’algorithme eBURST (http://pubmlst.org/sagalactiae/). Chaque souche est représentée par un rond de couleur en fonction de son origine géographique. D’après (13).
25
1.2. Pouvoir pathogène
Le SGB est un commensal du tractus gastro-intestinal et des voies vaginales humaines, dont le portage peut fluctuer avec le temps. Le taux de colonisation vaginale par le SGB varie selon les pays et les études, et est estimé entre 13 à 35 % (14). La colonisation est asymptomatique chez l’adulte en bonne santé. Cependant, cette bactérie représente actuellement un réel problème de santé publique pour les nouveau-nés (NN) et les personnes âgées ou immuno-déficientes.
1.2.1. Infection chez l’adulte
Le SGB a émergé en tant que pathogène d’importance croissante chez l’adulte dans les années 1990 notamment parmi les personnes âgées ou immunodéprimées. L’incidence des infections invasives à SGB chez l’adulte est évaluée à 4,6 pour 100 000 habitants en France en 2016 (15). La moyenne d'âge est située autour de 60 ans et le taux de mortalité est d’environ 10% (16–18). Dans la majorité des cas, des pathologies sous-jacentes comme le diabète, la cirrhose, le cancer du sein, ou une vessie neurologique ont été rapportées (16, 19). L’incidence est plus forte chez les personnes âgées de plus de 65 ans avec un taux situé entre 20 et 28 pour 100 000. L’émergence des infections à SGB chez l’adulte (hors femme enceinte) pourrait être liée à l’augmentation de la population à risque avec le vieillissement de la population et à l’augmentation du nombre de patients souffrant de pathologies chroniques comme le diabète.
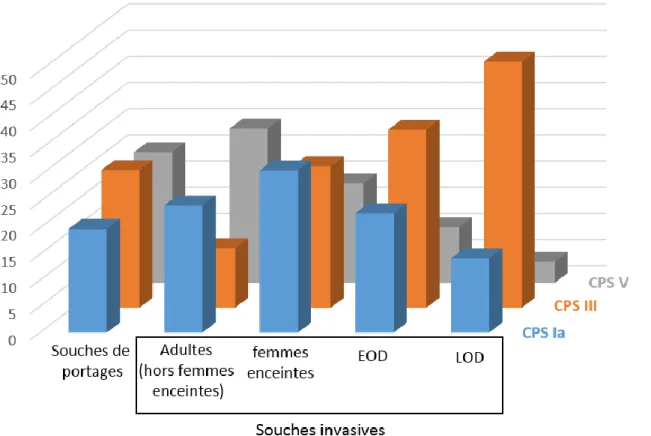
Les manifestations cliniques sont variées. En France, le SGB est responsable principalement de bactériémies isolées sans localisation secondaire (58%), d’infections de la peau et des tissus mous (15%) et d’infections ostéo-articulaires (8%) (18). Plus de 90% des infections invasives à SGB chez l’adulte concernent des personnes hospitalisées avec une médiane de 7 jours d’hospitalisation (19). Les infections chez l’adulte sont majoritairement causées par des souches de CPS Ia, III et V (Fig. 4) (18, 19).
26
Fig. 4. Répartition en pourcentage des principaux sérotypes capsulaires de souches de SGB isolées de portage et d’infections invasives.
EOD, infections néonatales précoces ; LOD, infections néonatales tardives. D’après (10, 19– 21)
Concernant les infections invasives à SGB chez la femme enceinte ou en post-partum, l’incidence est stable à 0,23 pour 1000 naissances vivantes et n’a pas été modifiée par la mise en place de l’antibioprophylaxie en per-partum pour la prévention des infections néonatales précoces (21). Le SGB est responsable d’environ 5 à 10% des chorioamniotites et des endométrites du post-partum. Le taux de mortalité chez les femmes enceintes se situe autour de 0,19%. La distribution des CPS des souches de SGB impliquées dans les infections maternelles est semblable à celle des souches de portage avec 31% de CPS Ia, 27% de CPS III et 19% de CPS V (Fig. 4) (21).
1.2.2. Infection chez le nouveau-né
Les infections à SGB seraient responsables d’environ 147 000 décès annuels (mort fœtale in utero et mortalité post-natale) à travers le monde (22). Le SGB reste la principale
27
cause d’infection néonatale bactérienne invasive en France et dans de nombreux pays industrialisés et cela malgré la mise en place de mesures préventives évoquées plus haut (15, 22). Les infections néonatales à SGB se manifestent par deux syndromes : un syndrome précoce, early-onset disease (EOD) survenant au cours de la première semaine de vie et un syndrome tardif ou late-onset disease (LOD), se déclarant de 7 jours à 3 mois après la naissance. Ces deux syndromes présentent des scénarios physiopathologiques différents (Fig. 5).
Fig. 5. Scénario physiopathologique de l’infection néonatale à SGB.
(A) La contamination du NN a lieu lors de l’accouchement par inhalation ou ingestion de
sécrétions vaginales ou de liquide amniotique contaminés. (B) Le syndrome précoce résulte d’une colonisation pulmonaire pouvant évoluer en bactériémie par la translocation des bactéries à travers l’épithélium pulmonaire. (C) Le syndrome tardif résulte probablement du franchissement de la barrière intestinale de SGB. (D) La bactériémie peut évoluer en méningite après franchissement de la barrière hémato-encéphalique par la bactérie. D’après (10, 23).
28
1.2.2.1. Le syndrome précoce - EOD
L’incidence mondiale des infections précoces à SGB est de 0,41 pour 1000 naissances vivantes. Le taux de mortalité est de 10% avec une grande disparité géographique, allant de 27% en Afrique subsaharienne à 5% en Europe de l’ouest (10).
L’EOD se manifeste au cours de la première semaine de vie et pour 95% des cas durant les 48 premières heures (24). L’EOD résulte principalement d’une transmission verticale de la bactérie, soit par contamination du liquide amniotique suite à la rupture de la membrane amniotique, soit durant l’accouchement par voie basse, par l’inhalation de sécrétions vaginales contaminées (Fig. 5). L’EOD débute par une pneumonie, pouvant se compliquer de bactériémie (78%) après translocation de la barrière pulmonaire, et de méningite (16%) après translocation de la barrière hémato-encéphalique (BHE) (10).
Le facteur de risque le plus important est le portage maternel du SGB dans les filières génito-urinaires (14). En cas de portage maternel et en l’absence d’antibioprophylaxie
per-partum, le risque pour les NN de développer une infection précoce à SGB est de 1,1% (25). La
mise en place d’un traitement antibiotique systématique chez la mère colonisée à SGB a réduit l’incidence des EOD dans de nombreux pays industrialisés, diminuant le risque à 0,03% (Fig. 6) (25). En cas d’infection maternelle à SGB au cours de la grossesse, le risque pour le NN de développer une infection précoce est élevé (6,09 vs. 0,41 / 1000 naissances) (21). (21)(21)D’autres facteurs de risque ont été décrits comme la rupture prolongée des membranes supérieure à 18 heures et une fièvre maternelle au moment de l’accouchement (> 38°C) (25). Dans les pays où les mesures de prévention des infections précoces ont été mises en place, la majorité des EOD surviennent en l’absence d’antibioprophylaxie en per-partum.
Le CPS III est responsable de la moitié des EOD à travers le monde, et représente avec les CPS Ia et V, plus de 80% des cas (Fig. 4) (10).
29
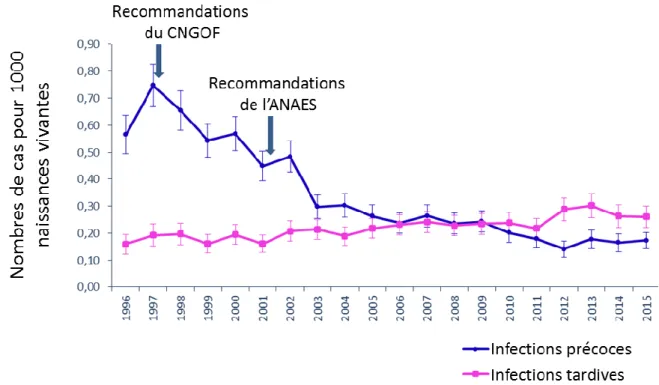
Fig. 6. Nombres estimés de cas d’infections invasives néonatales précoces et tardives à SGB de 1996 à 2015 en France.
Sont également représentés sur la figure les dates d’émission des recommandations de préventions par le collège national des gynécologues et obstétriciens français (CNGOF) et de l’agence nationale d’accréditation et d’évaluation en santé (ANAES). Source : Epibac, Santé publique France.
1.2.2.2. Le syndrome tardif - LOD
L’incidence mondiale des LOD à SGB est estimée à 0,26 pour 1000 naissances (10) et contrairement aux EOD qui ont reculé suite à l’amélioration des soins et par la mise en place de l’antibioprophylaxie en per-partum, l’incidence des LOD est demeurée stable au cours du temps (Fig. 6).
Le LOD se déclare entre 7 et 89 jours de vie et se caractérise par le développement d’une bactériémie isolée (53%) sans porte d’entrée évidente et par une forte prévalence des méningites (43%), 4 fois plus importante que pour les EOD (Fig. 5 C) (10).
L’hypothèse d’une porte d’entrée digestive (au niveau de l’oropharynx ou du tissu intestinal) du SGB dans les infections tardives semble partagée par la communauté médicale et scientifique (26–29). La translocation du SGB à travers la barrière intestinale aboutirait à une dissémination hématogène et, dans les cas les plus graves, au franchissement de la BHE et à l’infection du système nerveux central. Cette hypothèse s’appuie sur plusieurs arguments
30
observationnels ou expérimentaux qui sont les suivants :
- aucun foyer évident (pulmonaire, cutané, urinaire) n’est rapporté chez les NN ayant développé une infection tardive à SGB ;
- une colonisation digestive du NN est fréquente. En effet, en absence d’antibioprophylaxie, 50% des NN de mères colonisées à SGB seront colonisés au niveau du tractus digestif à la naissance, et le portage persiste chez 50% d’entre eux jusqu’à trois mois de vie (30) ; l’antibioprophylaxie, quoique réduisant fortement la colonisation des NN à la naissance (6%), ne prévient pas totalement leur colonisation et 20% d’entre eux sont colonisés à 3 semaines de vie et le demeurent jusqu’à 2 mois de vie (31).
- le SGB est capable de franchir la barrière digestive. L’analyse bactériologique et histopathologique d’un cas létal de LOD a permis de mettre en évidence la présence de SGB dans le tissu intestinal, soulignant ainsi la capacité de SGB à franchir la barrière intestinale dans ce contexte (29).
Les données épidémiologiques collectées par le CNR-Strep et à travers le monde montrent que plus de 70% des cas de LOD sont causés par des souches de CPS III (10, 18). Ces souches appartiennent pour la plupart au CC-17 (environ 80%) qui est particulièrement homogène et est composé presque exclusivement de souches de séquence-type 17 (13, 18, 32, 33). Ce complexe clonal CC-17, est responsable de près de 65% des infections néonatales tardives en France et dans les pays industrialisés.
1.2.3. Physiopathologie des infections à SGB
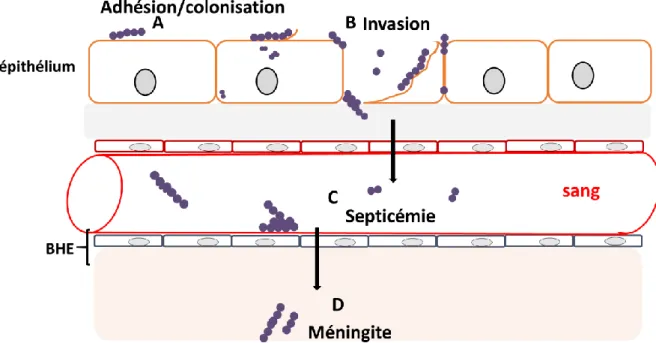
Le processus infectieux du SGB inclut la capacité de la bactérie à adhérer, coloniser, puis à franchir les barrières épithéliales (pulmonaire et intestinale) et endothéliales de l’hôte, en particulier la BHE, tout en se multipliant et en échappant au système immunitaire (SI). Le SGB possède un large éventail de facteurs de virulence qui interviennent dans les différentes étapes de la physiopathologie (Fig. 7).
31
Fig. 7. Schéma représentant les différentes étapes d’une infection invasive à SGB.
(A) Adhérence et/ou colonisation à la surface apicale de cellules de l’épithélium, par exemple
intestinal. (B) Invasion de l’épithélium par SGB (C) Dissémination sanguine de SGB et échappement au SI. (D) Franchissement de la BHE. D’après (34).
1.2.3.1. Adhésion aux cellules de l’hôte
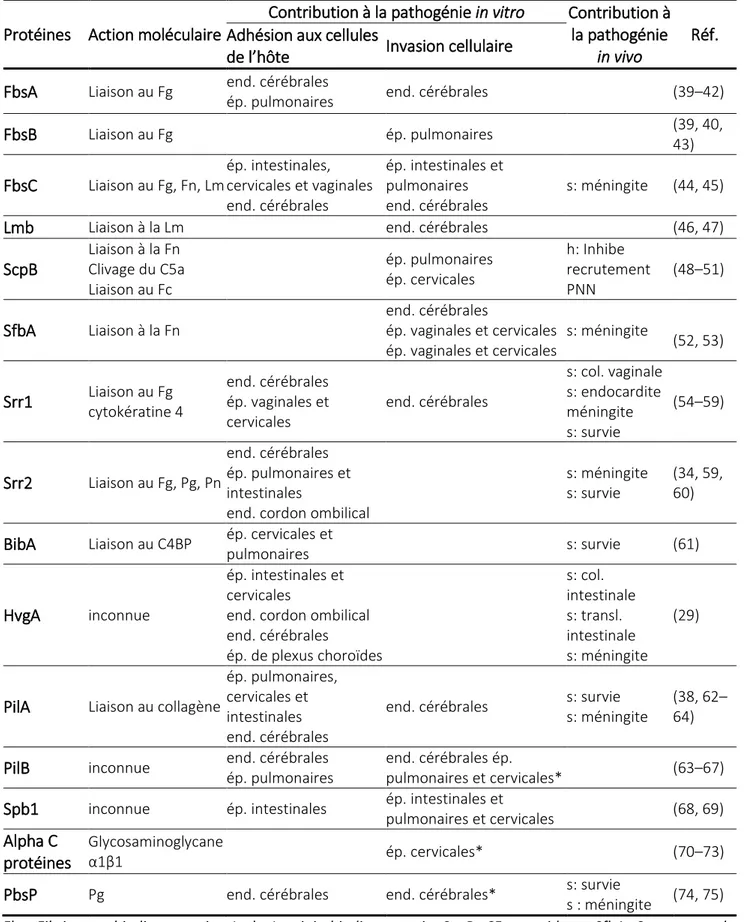
L’adhésion des bactéries aux cellules épithéliales résulte d’interactions de faible et forte affinité. Les interactions de faible affinité entre SGB et les cellules de l’hôte mettent en jeu la surface lipophile des cellules avec les acides lipotéichoïques bactériens (35). Les interactions de forte affinité entre SGB et l’épithélium sont soit directes, soit indirectes via la fixation à des protéines de la matrice extracellulaire comme le fibrinogène, la fibronectine ou la laminine. Ces protéines peuvent interagir avec des protéines d’ancrage des cellules hôtes telles que les intégrines, servant alors de pont moléculaire entre la bactérie et des protéines de surface de la cellule hôte (36–38). Le tableau 1 énumère les principales protéines de surface impliquées dans l’infection à SGB.
32
Tableau 1. Principales protéines de surface de SGB intervenant dans la pathogénie
Protéines Action moléculaire
Contribution à la pathogénie in vitro Contribution à la pathogénie
in vivo
Réf. Adhésion aux cellules
de l’hôte Invasion cellulaire FbsA Liaison au Fg end. cérébrales
ép. pulmonaires end. cérébrales (39–42)
FbsB Liaison au Fg ép. pulmonaires (39, 40, 43) FbsC Liaison au Fg, Fn, Lm ép. intestinales, cervicales et vaginales end. cérébrales ép. intestinales et pulmonaires end. cérébrales s: méningite (44, 45)
Lmb Liaison à la Lm end. cérébrales (46, 47)
ScpB Liaison à la Fn Clivage du C5a Liaison au Fc ép. pulmonaires ép. cervicales h: Inhibe recrutement PNN (48–51) SfbA Liaison à la Fn end. cérébrales ép. vaginales et cervicales ép. vaginales et cervicales s: méningite (52, 53) Srr1 Liaison au Fg cytokératine 4 end. cérébrales ép. vaginales et cervicales end. cérébrales s: col. vaginale s: endocardite méningite s: survie (54–59) Srr2 Liaison au Fg, Pg, Pn end. cérébrales ép. pulmonaires et intestinales
end. cordon ombilical
s: méningite s: survie
(34, 59, 60)
BibA Liaison au C4BP ép. cervicales et
pulmonaires s: survie (61)
HvgA inconnue
ép. intestinales et cervicales
end. cordon ombilical end. cérébrales ép. de plexus choroïdes s: col. intestinale s: transl. intestinale s: méningite (29)
PilA Liaison au collagène
ép. pulmonaires, cervicales et intestinales end. cérébrales
end. cérébrales s: survie s: méningite
(38, 62– 64)
PilB inconnue end. cérébrales ép. pulmonaires
end. cérébrales ép.
pulmonaires et cervicales* (63–67)
Spb1 inconnue ép. intestinales ép. intestinales et
pulmonaires et cervicales (68, 69)
Alpha C protéines
Glycosaminoglycane
α1β1 ép. cervicales* (70–73)
PbsP Pg end. cérébrales end. cérébrales* s: survie
s : méningite (74, 75) Fbs, Fibrinogen binding protein ; Lmb, Laminin-binding protein ;ScpB, C5a peptidase ; SfbA, Streptococcal
fibronectin binding protein ; Srr, Serine-rich repeat proteins ; BibA, GBS immunogenic bacterial adhesin; HvgA, Hypervirulent GBS adhesin ; PbsP, Plasminogen binding surface Protein; Fg, fibrinogène ; Pg, plasminogène ;
Fn, fibronectine ; ép, épithélium ; end, endothélium ; s, souris ; h, humain ; col, colonisation ; transl, translocation. *rôle de la protéine dans le franchissement d’une monocouche cellulaire.
33
1.2.3.2. Franchissement des barrières physiologiques
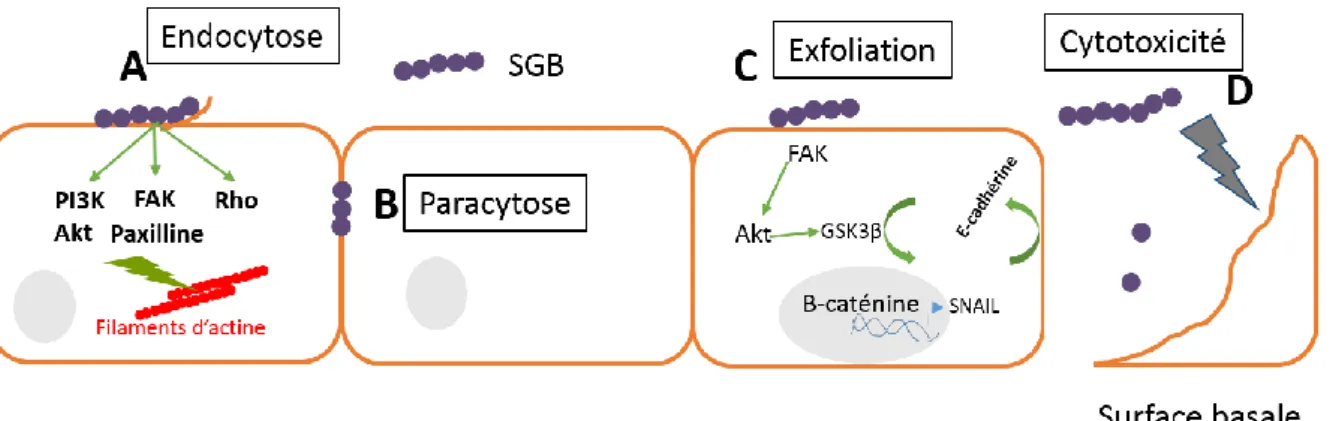
Le franchissement des barrières physiologiques découle à la fois des capacités d’adhésion et d’invasion liées aux protéines de surface exprimées par le pathogène, du pouvoir cytotoxique de SGB et des dommages induits par la réponse inflammatoire. Plusieurs modalités de franchissement des barrières ont été mises en évidence expérimentalement et pourraient coexister (Fig. 8).
Fig. 8. Représentation schématique des principaux mécanismes d’invasion de barrières cellulaires par SGB.
(A) L’endocytose du SGB résulte de l’activation de différentes voies impliquant des kinases
conduisant au remaniement du cytosquelette d’actine. (B) Traversée paracellulaire de SGB sans altération des protéines de jonctions. (C) Invasion tissulaire de SGB par désorganisation des protéines de jonctions intercellulaires. SGB active la Focal adhesion kinase (FAK) induisant l’expression du régulateur transcriptionnel SNAIL qui inhibe l’expression des protéines de jonctions intercellulaires. (D) Destruction de l’épithélium par des molécules cytotoxiques comme la β-hémolysine. Akt, protein kinase B; GCK3β, glycogen synthase kinase-3 β; Srr,
Serine rich repeat; Fbs, Fibrinogen binding protein. D’après (27, 71, 76–80).
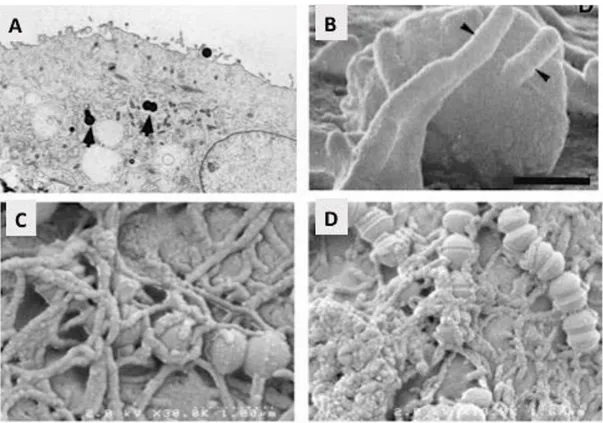
La capacité de SGB à traverser des monocouches cellulaires par un mécanisme de transcytose a été démontrée dans plusieurs études. SGB peut être endocyté par des cellules épithéliales cervicales utérines (Fig. 9) et endothéliales vasculaires cérébrales sans modification des jonctions intercellulaires (76). Ce processus de transcytose a été observé par microscopie électronique in vitro et montre la formation de microvilli et/ou de protrusions à la surface cellulaire (Fig. 9) précédant l’endocytose bactérienne par un mécanisme dépendant de l’actine pour lequel trois voies de signalisation ont été décrites (Fig. 8 A) (78, 81–83).
34
Premièrement, l’adhésion de SGB sur les cellules épithéliales utérines peut augmenter le taux intracellulaire de Rho GTPases activés, modulant alors le cytosquelette d’actine (Fig. 8 A). L’invasion des cellules peut être inhibée par des inhibiteurs des Rho GTPases, démontrant leur implication dans le mécanisme d’invasion cellulaire de SGB (71, 77). Les deux dernières voies de signalisation impliquées dans l’entrée de SGB dans les cellules de l’hôte font intervenir la voie phosphoinositide-3 kinase (PI3K)/Akt et la focal adhesion kinase (FAK) (Fig. 8 A). La PI3K catalyse le recrutement, la phosphorylation et l’activation de l’effecteur intracellulaire Akt qui déclenche la signalisation nécessaire aux réarrangements du cytosquelette (78, 83, 84). Enfin, l’endocytose de SGB déclenchée par la voie de signalisation impliquant la FAK est dépendante de son association avec la paxilline, protéine régulant les filaments d’actines (85).
Fig. 9. Observation par microscopie électronique d’interactions entre SGB et différentes cellules eucaryotes.
(A) Visualisation par microscopie électronique en transmission (TEM) de coques de SGB
présents dans des vacuoles (flèches) à l’intérieur de cellules de chorion, x 4000 (81). (B) Observation par microscopie électronique à balayage (Scanning Electron Microscopy, SEM) de l’« engouffrement » de SGB à la surface de cellules cervicales (HEp-2) par protrusions cellulaires indiquées par des flèches ; échelle = 0,25 um (82). (C) et (D) Recouvrement des chainettes de SGB par des microvillosités de cellules cervicales (HeLa), SEM (83).
35
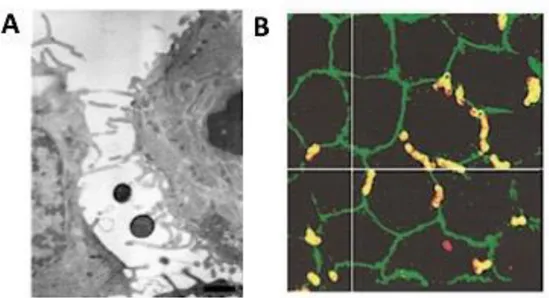
SGB pourrait par ailleurs envahir un tissu de manière intercellulaire par paracytose (Fig. 8 B). In vitro, SGB serait capable de traverser une monocouche de cellules épithéliales cervicales et intestinales (27). L’étude du franchissement par microscopie optique et électronique a révélé une association préférentielle des bactéries avec les jonctions cellulaires (Fig. 10), suggérant un mécanisme paracellulaire de franchissement. Dans ce modèle d’étude in vitro, le franchissement de SGB se faisait sans altération des jonctions ou de cytotoxicité (27).
Fig. 10. Franchissement de monocouches de cellules humaines par le SGB via un mécanisme de paracytose.
(A) Visualisation par microscopie électronique à transmission (TEM) de coques de SGB (souche
2603 V/R) entre deux cellules épithéliales cervicales (ME180) après 4 heures d’infection. Barre d’échelle 500nm. (B) Infection de cellules épithéliales intestinales (Caco-2) différenciées sur filtre par SGB (souche 2603 V/R) pendant 4 heures. Visualisation par immunofluorescence des jonctions serrées après marquage par un anticorps anti-zona occludens (ZO-1) en vert et de SGB en rouge. Les SGB qui colocalisent avec ZO-1 apparaissent alors en jaune (27).
Une autre étude a montré le rôle de l’action exfoliante de SGB sur l’épithélium vaginal dans l’invasion des muqueuses, qui met en jeu aussi de la voie FAK/Akt, la désorganisation des jonctions intercellulaires et la paracytose de SGB (Fig. 8 C) (79). Dans cette étude, l’adhésion de SGB sur des cellules épithéliales vaginales, humaines et murines, induit l’activation de la voie de signalisation FAK/Akt conduisant à la translocation nucléaire de la caténine. La β-caténine favorise l’expression de différents gènes comme le répresseur transcriptionnel SNAIL connu pour réprimer la transcription des gènes codant les protéines de jonctions. La voie FAK/Akt serait activée suite à la détection de SGB par les intégrines α1β1. En effet, in vivo, la compétition avec l’intégrine α1β1 directement instillée dans la muqueuse vaginale de souris
36
(avant et pendant l’infection à SGB) inhibe l’expression des gènes dépendant de la voie β-caténine, l’expression de l’E-cadhérine, l’exfoliation et l’invasion des muqueuses par SGB. Au total, la fixation de SGB sur les cellules vaginales entrainerait une désorganisation des jonctions cellulaires, permettant ainsi le passage de SGB entre les cellules (79).
Enfin, l’action cytotoxique directe de la β-hémolysine de SGB et la réaction inflammatoire suscitée favoriseraient également le franchissement des barrières cellulaires via un mécanisme paracellulaire (Fig. 8 D) (80).
1.2.3.3. Réponse immunitaire induite par SGB
Les cellules immunitaires innées comme les monocytes, les macrophages, les cellules dendritiques (DC) et les polynucléaires neutrophiles (PNN) sont des acteurs importants de la réponse immunitaire et inflammatoire dirigée contre le SGB. Cette réponse inflammatoire est déclenchée après interaction entre des récepteurs cellulaires de reconnaissance de motifs moléculaires (Pattern Recognition Receptors, PRR) et des motifs moléculaires bactériens (Pathogen Associated Molecular Patterns, PAMP).
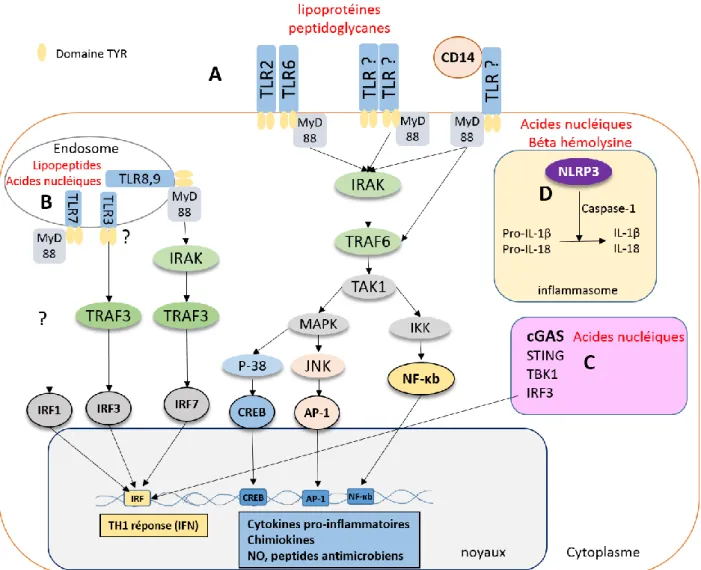
Chez SGB, trois types de PRR ont été identifiés comme pouvant interagir avec des motifs bactériens de SGB telles que des lipoprotéines, des molécules d’ADN et d’ARN et sont : les toll like receptor (TLR), les nucleotide-binding oligomerization domain (NOD) like receptor (NLR) et le récepteur cytosolique « cyclic GMP-AMP synthase » (cGAS) (Fig. 11) (86).
La mise en jeu de ces différentes voies de signalisation peut conduire à la translocation nucléaire de régulateurs transcriptionnels comme NF-κB (Fig. 11 A) ou interferon-regulatory
receptor (IRF) (Fig. 11 B), permettant alors l’expression de cytokines pro-inflammatoires
comme le TNFα et l’IL-1β par NF-κB, et d’interféron (INF) de type I via IRF (87–90). La synthèse d’IFN de type I (l’IFNα et l’IFNβ) et II (IFNγ) est essentielle dans la réponse inflammatoire dirigée contre le SGB, probablement via leur action favorisant la maturation des macrophages en macrophages pro-inflammatoires (91). En effet, des souris déficientes dans les voies de biosynthèse d’INF ont un taux de mortalité supérieure aux souris « sauvages » et ceci dans différents modèles d’infections (91, 92).
37
Fig. 11. Voies de signalisations induites par SGB après reconnaissance par les PRR.
La reconnaissance de motifs bactériens (indiqués en rouge) par différents récepteurs cellulaires peut induire l’activation de voies de signalisation conduisant à la translocation nucléaire de régulateurs transcriptionnels. (A) Les TLR présents à la surface cellulaire comme TLR2/6 détectent des motifs bactériens comme les acides lipotéichoïques et induisent la translocation nucléaire de NF-κB ; (B) les TLR associés à la membrane endosomale comme le TLR7 dans les DC induisent la translocation nucléaire de IRF1 après détection d’ARN de SGB;
(C) le récepteur cytosolique cGAS induit la translocation nucléaire de IRF3 après
reconnaissance de molécules d’ARN de SGB; (D) le récepteur NLR, pyrin domain containing 3
(NLRP3) active l’inflammasome après détection d’ARN de SGB, conduisant au clivage des
précurseurs de l’IL-1β et de l’IL-18 dans les DC et les macrophages. CREB, c-AMP Response
element-binding protein ; AP-1, activator protein-1 ; IRF, interferon-regulatory receptor.
38
1.2.3.4. Echappement au système immunitaire
Que cela soit lors du franchissement des barrières (pulmonaires, intestinales ou hémato-encéphaliques) ou dans une étape ultérieure, le SGB est soumis au SI de l’hôte. Le SGB exprime de nombreux facteurs qui lui permettent de contrer les défenses immunitaires de l’hôte (Fig. 12) tels la capsule et la C5a peptidase qui interfèrent avec l’opsonisation et modulent la réaction immunitaire et inflammatoire, et la superoxyde dismutase (SOD) qui promeut la résistance aux espèces réactives de l’oxygène (76, 97, 98). Enfin, la susceptibilité des NN provient certainement aussi de déficiences qualitatives et quantitatives de leur SI, que nous détaillerons dans un chapitre propre (98).
Fig. 12. Représentation de différents mécanismes mis en jeu dans l’échappement de SGB au système immunitaire.
Le SGB exprime différents facteurs qui contribuent à l’échappement au SI et à la survie chez l’hôte. L’acide sialique de la capsule ainsi que les fragments de fibrinogène fixés sur la capsule inhibent la reconnaissance par le SI en raison d’un mimétisme avec des motifs de l’hôte. La capsule inhibe aussi le dépôt de la fraction C3 du complément. L’acide sialique, les protéines β, ScpB et BibA inhibent l’activation du complément. La protéine β lie aussi la région Fc des IgA1 inhibant ainsi l’activation du SI. HylB inhibe la production de cytokines et CspA clive certaines chimiokines. Les protéines PilB et PBP1 sont impliquées dans la résistance aux peptides antimicrobiens. β-h/c β-hémolysine/cytolosine. D’après (48, 66, 97–113).
39
1.2.3.5. Franchissement de la BHE et infection du SNC
L’adhésion du SGB à l’endothélium des microvaisseaux cérébraux est facilitée par différentes interactions entre des protéines de surface de SGB (Tableau 1) et leurs récepteurs, tels le fibrinogène, la laminine et la fibronectine toutes présentes à la surface des cellules endothéliales (74). Le franchissement de l’endothélium cérébral par SGB résulte de différents mécanismes pouvant être concomitants. Premièrement, il a été montré que SGB était internalisé par les cellules endothéliales et transmigrait dans des phagosomes, utilisant ainsi le processus physiologique de transcytose de macromolécules du sang vers les le tissu cérébral par les cellules endothéliales (114). Outre le mécanisme de transcytose, Kim et ses collaborateurs ont démontré que SGB était responsable de l’induction du répresseur transcriptionnel SNAIL1 par les cellules endothéliales, diminuant ainsi l’expression des protéines de jonctions (115) et permettant le passage de SGB entre les cellules et son interaction directe avec les protéines exprimées au pôle basolatérale. La β-hémolysine de SGB ainsi que les protéines cytotoxiques (protéolytiques et inflammatoires) de l’hôte contribuent également à l’augmentation de la perméabilité de l’endothélium cérébral (74).
Enfin, le rôle des protéines de virulence spécifiques du clone CC-17 dans la survenue de méningite sera abordé plus loin.
1.3. Le clone hypervirulent CC-17
1.3.1. Définition et épidémiologie
Les données épidémiologiques à travers le monde ont montré par MLST que les souches de SGB, isolées de portage ou d’infection, appartenaient majoritairement à cinq CC différents : CC-1, CC-10, CC-17, CC-19 et CC-23 (11, 13). Ces études ont également mis en évidence la forte association entre le clone CC-17 qualifié d’hypervirulent et les infections néonatales invasives. Ce clone CC-17 de dissémination mondiale et identifié dès 1989 par des techniques de Multi Locus Enzyme Electrophoresis est composé principalement de souches appartenant au CPS III (95%) et par quelques souches de CPS IV (5%) (11, 18). Les études phylogénétiques ont démontré que ce clone est apparu récemment dans les années 50. Il a été proposé que la stabilisation du clone CC-17 soit liée à l’utilisation massive de tétracycline
40
à la moitié du 20ème siècle, favorisant l’implantation des souches de CC-17 résistantes à cet antibiotique et particulièrement adaptées à leur hôte (13).
Le clone CC-17 est considéré comme un pathogène du NN car il regroupe environ 65% des souches responsable de méningites néonatales (EOD et LOD confondus), et près de 70% des souches responsable d’infections tardives (Fig. 13) (18, 24, 29, 116). Cette forte association entre le clone CC-17 et les NN est soulignée par la surreprésentation des souches CC-17 responsables d’infections néonatales (50-65%) par rapport aux souches CC-17 de portage ou responsables d’infections chez l’adulte (10 à 20%) (13, 18).
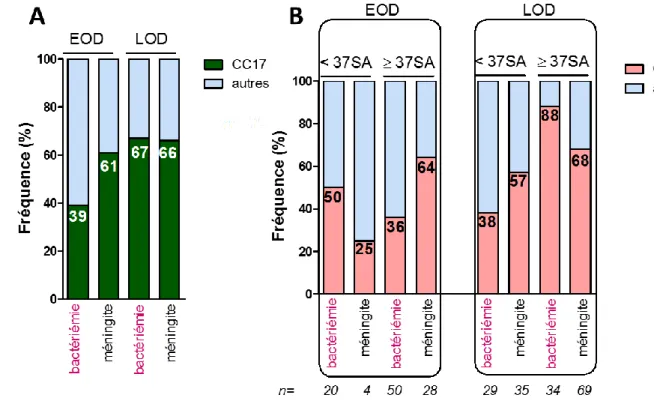
Fig. 13. Répartition des souches SGB CC-17 isolées d’infections néonatales recueillies par le CNR des streptocoques en France de 2007 à 2012.
Au total 438 souches de SGB ont été recueillies, 174 étaient responsables d’EOD et 264 de LOD. Le CPS et le CC ont été déterminés. (A) Répartition des souches CC-17 responsables d’EOD et LOD en fonction du site d’isolement. D’après (24). (B) Répartition des souches CC-17 responsables d’INN à SGB en fonction du terme et du site d’isolement (données CNR non publiées).
La prématurité est un facteur de risque reconnu d’INN à SGB notamment dans les LOD. Une étude française portant sur 428 infections néonatales invasives à SGB rapportées au CNR des streptocoques entre 2007 et 2012 a montré que 25% des EOD et 39% des LOD survenaient chez des nourrissons prématurés (< 37 SA) (24). De manière intéressante, l’analyse de cette
41
même cohorte (données CNR-Strep non publiées) montre qu’au-delà de l’association entre le clone CC-17 et les infections du SNC, les souches CC-17 sont particulièrement prévalentes dans les bactériémies du syndrome tardif chez les enfants non prématurés (Fig. 13 C). En effet parmi les LOD, les souches CC-17 étaient responsables de bactériémies chez 38% des prématurés et 88% des enfants nés à termes (P < 0.001).
1.3.2. Facteurs de virulence spécifique du clone CC-17
La comparaison de souches de SGB de différents CC a révélé une capacité accrue d’adhérence des souches CC-17 aux cellules de l’épithélium intestinal et de l’endothélium vasculaire cérébral (29). En revanche, l’adhérence des souches CC-17 et non CC-17 aux cellules épithéliales pulmonaires est similaire. Le clone CC-17 ne semble donc pas posséder un avantage pour la colonisation de l’épithélium pulmonaire, ce qui pourrait justifier l’absence d’association entre CC-17 et EOD dont la porte d’entrée est pulmonaire (29). Les analyses génomiques comparatives des souches CC-17 à la recherche de facteurs de virulence particuliers pouvant rendre compte de l’hypervirulence de ce clone ont mis en évidence des allèles spécifiques codant pour des protéines de surface tels que hvgA et srr2 (117, 118). Le gène spb1, la protéine majeure des pili est présent chez toutes les souches CC-17 mais également chez 10% des souches non CC-17 (69). Outre l’existence de facteurs de virulence spécifiques, le niveau d’expression et la combinaison particulière de différents facteurs contribuent aussi à la virulence particulière de certaines souches. Ainsi, il a été montré que les souches CC-17, contrairement à d’autres, exprimaient de manière constante à la fois FbsA et FbsB, deux protéines de surface impliquées dans la liaison au fibrinogène (40).
- La protéine HvgA
Les protéines HvgA et BibA sont des protéines de surface, ancrées au peptidoglycane
via un motif LPXTG. Ces protéines sont codées par des gènes dont l’expression est régulée par
le système à deux composants CovRS, composé de l’histidine kinase CovS et du régulateur transcriptionnel CovR (Fig. 14).
42
Fig. 14. Structure du locus bibA/hvgA chez SGB.
Les pourcentages d’identité des séquences nucléotidiques entre les gènes hvgA d’une souche CC-17 et bibA d’une souche CC-23 sont indiqués. En jaune sont représentés les gènes bibA et
hvgA avec le promoteur (P), le site de fixation du régulateur à deux composants CovR (covRBS)
et le terminateur (ter). D’après (29, 119).
Lors d’une infection systémique à SGB CC-17 chez la souris, le gène hvgA est surexprimé dans le cerveau, le sang et le caecum, ainsi que dans le sang humain, par rapport au condition de culture en laboratoire (29). La caractérisation de la fonction d’HvgA a mis en évidence son implication dans l’adhésion à certains types cellulaires en jeu dans la physiopathologie des infections néonatales tardives à SGB, à savoir l’épithélium intestinal et l’endothélium micro-vasculaire cérébral (29). Par ailleurs, la protéine HvgA a été identifiée comme étant un déterminant essentiel à la colonisation intestinale et au franchissement des barrières intestinale et hémato-encéphalique (29). Cependant, le récepteur hôte de HvgA, ainsi que les mécanismes de franchissement des différentes barrières n’ont pas été identifiés.
- La protéine Srr2
Les protéines Srr (serine-rich repeat) appartiennent à une famille de protéines de surface retrouvées exclusivement chez les bactéries à Gram positif et sont ancrées au peptidoglycane via un motif LPXTG. Les protéines Srr sont hautement glycosylées. Les souches CC-17 expriment la protéine Srr2 tandis que les souches n’appartenant pas à ce CC expriment la protéine Srr1 (60, 117). Ces deux protéines, bien que partageant une organisation structurale similaire, ne partagent que 32% d’identité peptidique (Fig. 15). Le régulateur Rga est impliqué dans la régulation de l’expression de la protéine Srr1 dans les souches n’appartenant pas au complexe clonal CC17. La régulation de Srr2 n’a pas été étudiée.
43
Fig. 15. Organisation génétique des loci srr de SGB et structure protéique de Srr2.
Les loci contiennent un corps de gènes conservés codant pour les composants du système de sécrétion accessoire SecA2 et diffèrent dans le nombre de glycosyltransférases additionnelles. Les gènes codants pour Srr1 et Srr2 sont situés dans des loci différents localisés à des endroits distincts du génome. (A) Chez les souches non CC-17, le locus comprend le gène codant pour la protéine Srr1 (bleu), 8 gènes codant pour des glycosyltransférases (noir) et 6 gènes codant pour les composants du système de sécrétion accessoire SecA2 (gris et rouge). Un gène divergent codant pour le régulateur transcriptionnel Rga se trouve en amont du locus (bleu clair). Chez les souches CC-17, le locus contient le gène srr2, 4 gènes codant pour des glycosyltransférases et 5 gènes codant pour les composants du système de sécrétion. Par ailleurs le gène rga est absent. (B) Structure de Srr2. Le domaine de liaison au fibrinogène
latching cleft (cleft) est représenté. RI et RII correspondent aux régions de répétitions riches
en sérines. D’après (120).
Srr2 est une protéine fortement exprimée à la surface bactérienne dont le niveau d’expression varie en fonction des souches CC-17 (60). Srr2 est une protéine impliquée dans l’adhésion aux protéines de la matrice extracellulaire comme le fibrinogène. L’affinité de Srr2 pour le fibrinogène est 6 fois supérieure à celle de Srr1 et le niveau d’expression de Srr2 est directement corrélé avec la capacité de fixation du fibrinogène (54, 60). La protéine Srr2 est aussi impliquée dans l’adhésion aux cellules épithéliales intestinales et endothéliales cérébrales, ainsi que dans le franchissement de la BHE. De plus, Srr2 promeut la phagocytose et la survie dans des macrophages et des PNN humain (60). Par ailleurs, contrairement à Srr1, Srr2 peut fixer des protéines de la coagulation comme le plasminogène et la plasmine, ce qui permettrait de détourner le système plasminolytique de l’hôte et ainsi dégrader la matrice extracellulaire, facilitant ainsi le franchissement des barrières physiologiques (60).
44
- La protéine Spb1
Les pili exposés à la surface de SGB promeuvent l’adhérence et le franchissement de barrières physiologiques au cours du processus infectieux. Deux îlots contenant les gènes nécessaires à la synthèse des pili ont été identifiés chez SGB, PI-1 et PI-2, ce dernier étant soumis à variation allélique. Le variant PI-2b contient le gène codant pour la piline majeure Spb1 (Fig. 16). La protéine Spb1 est retrouvée presque exclusivement chez les souches appartenant au clone hyper-virulent CC-17, mais est aussi présente chez quelques souches d’origines humaines et bovines (64, 68, 69, 117, 121, 122). La piline Spb1 est impliquée dans l’adhérence aux épithéliums respiratoire, intestinal et cervical (68). Par ailleurs, Spb1 semble également promouvoir la phagocytose et la survie dans des macrophages (69).
Fig. 16. Représentation schématique de l’opéron PI-2b.
Les gènes sont représentés par des flèches colorées. Les gènes codant pour les protéines de structure sont représentés en violet, ceux codant pour les sortases en marron. lep code pour une protéine putative à fonction signal peptidase. D’après (123).
Au total, les souches CC-17 ont des protéines de surface spécifiques impliquées dans la colonisation digestive, la translocation de la barrière intestinale et hémato-encéphalique, ainsi que dans la survie et l’échappement au SI. Les travaux effectués durant ma thèse se sont particulièrement intéressés à la compréhension des mécanismes en jeu dans le franchissement de la porte d’entrée probable de l’infection néonatale tardive, à savoir l’épithélium intestinal.