HAL Id: tel-02059923
https://tel.archives-ouvertes.fr/tel-02059923
Submitted on 7 Mar 2019HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Étude du rôle d’une Ribonucléase de type III, MtRTL1b,
lors du développement des nodosités fixatrices d’azote
chez l’espèce modèle Medicago truncatula
Jeremy Moreau
To cite this version:
Jeremy Moreau. Étude du rôle d’une Ribonucléase de type III, MtRTL1b, lors du développement des nodosités fixatrices d’azote chez l’espèce modèle Medicago truncatula. Génomique, Transcrip-tomique et Protéomique [q-bio.GN]. Université Paris Saclay (COmUE), 2018. Français. �NNT : 2018SACLS416�. �tel-02059923�
Etude du rôle d’une Ribonucléase
de type III, MtRTL1b, lors du
développement des nodosités
fixatrices d’azote chez l’espèce
modèle Medicago truncatula.
Thèse de doctorat de l'Université Paris-Saclay préparée à l’Université Paris-Sud École doctorale n°567 Sciences du Végétal : du Gène à l’Ecosystème (SDV) Spécialité de doctorat: Biologie
Thèse présentée et soutenue à Gif-sur-Yvette, le 30 Novembre 2018, par
Jérémy MOREAU
Composition du Jury :Mme Marianne Delarue
Professeur, IPS2, Orsay Présidente
M. Marc Lepetit
DR2, INRA, Montpellier Rapporteur
M. Julio Saez-Vasquez
DR2, CNRS, Perpignan Rapporteur
M. Andreas Niebel
DR2, CNRS, Castanet tolosan Examinateur
Mme Christine Lelandais-Brière
MDC, IPS2, Gif-syr-Yvette Directeur de thèse
NNT : 2 0 1 8 S A CLS 4 1 6
Après ce long marathon de quatre ans, c’est avec un certain soulagement, de la joie et de la fierté que je présente ce manuscrit et que s’achève cette thèse.
Tout cela n’aurait pu être possible sans Christine, merci d’avoir cru en moi de m’avoir permis de réaliser cette thèse ainsi que pour tous les conseils et les discussions que nous avons pu avoir ensemble.
Merci également à Martin pour ton aide, surtout pour la phase finale de la thèse.
Merci Céline pour les manips, les discussions, ton aide et pour ton choix de la musique que je passais au labo.
Aurélie merci de ton aide pour les banques, pour le confocal et nos passages hebdomadaires à l’autoclave.
Merci Hélène et Sébastien pour l’aide pour les manips, les discussions et les pauses clope. Merci Thomas pour l’analyse des données de séquençage et du temps que tu as pris pour que l’on en discute.
La deuxième partie de la thèse a été plus difficile sans toi, Tracy merci pour tout.
Pour le temps que tu as passé dans notre labo à l’ISV, ta bonne humeur et les rigolades, merci Halima.
Merci à toute l’équipe passée et présente pour l’ambiance, les discussions et l’aide que vous avez pu me donner.
Merci à mes 6 stagiaires encadrés pendant cette thèse, Ludovic, Isabelle, Sarah, Guillaume, Lisa, Marie.
Merci aux membres des équipes PR et FF, pour leur aide, pour les protocoles, l’utilisation des machines, les discussions et les congrès que l’on a partagés.
Merci Séverine pour toute l’aide que tu as pu me donner à la plateforme microscopie de l’IPS2.
Merci également à la plateforme POPS de l’IPS2 pour le séquençage de mes échantillons. Merci aux services laverie, serre et maintenance pour leur travail et pour nos discussions. Merci à tous les membres de l’ISV et de l’IPS2 avec qui j’ai pu interagir.
Merci aux membres de mon comité de thèse pour nos discussions et leurs conseils.
Merci à Marianne, Jacqui et toute l’école doctorale pour leur aide et leur soutien au cours de ma thèse.
Merci à toute ma famille et tous mes amis pour leur soutien et pour avoir toujours été là. Merci à toi mon Amour d’avoir été là et de toujours l’être, sans toi rien ne serait possible.
Table des matières :
I. Introduction. ... 2
A. La symbiose Rhizobium/Légumineuse : un processus hautement régulé. ... 6
1. Les types morphologiques de nodosités. ... 6
2. Les étapes précoces de la symbiose. ... 10
2.1 Le dialogue moléculaire entre Rhizobia et Légumineuses. ... 10
2.2 Perception et signalisation des Facteurs de nodulation. ... 11
2.3 Les réponses épidermiques et l’infection bactérienne. ... 14
2.4 Les réponses corticales précoces et la formation du primordium nodulaire. ... 18
3. De la différenciation des nodosités à la fixation de l’azote. ... 21
3.1 Mise en place et maintien du méristème. ... 21
3.2 Différenciation de la région centrale des nodosités. ... 23
B. Les régulations géniques au cours de la nodulation et leurs acteurs. ... 40
1. Les facteurs de transcription, des acteurs majeurs pour le développement des nodosités. ... 42
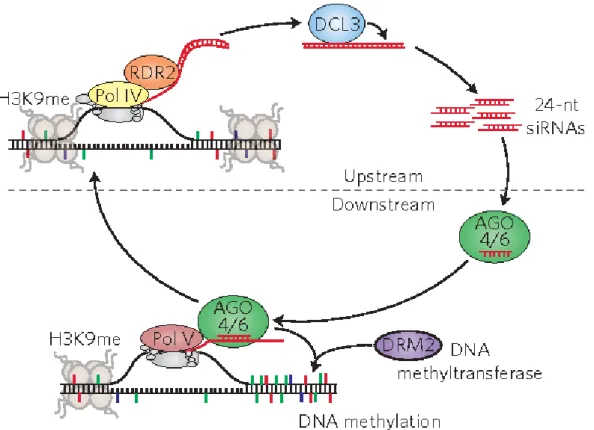
2. Les petits ARNs et leurs rôles dans la nodulation. ... 44
3. Les modifications épigénétiques au cours de la nodulation. ... 54
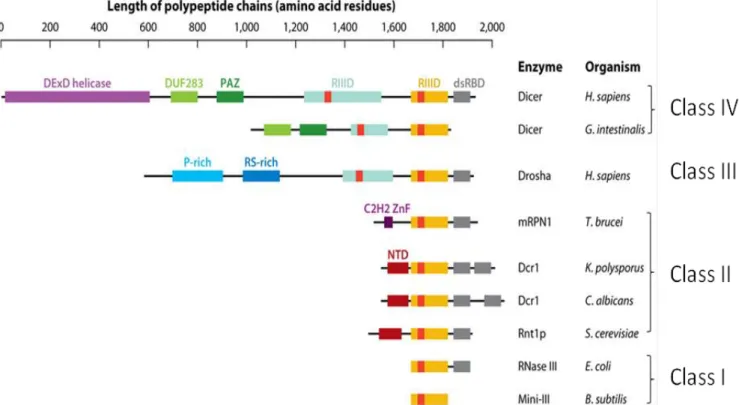
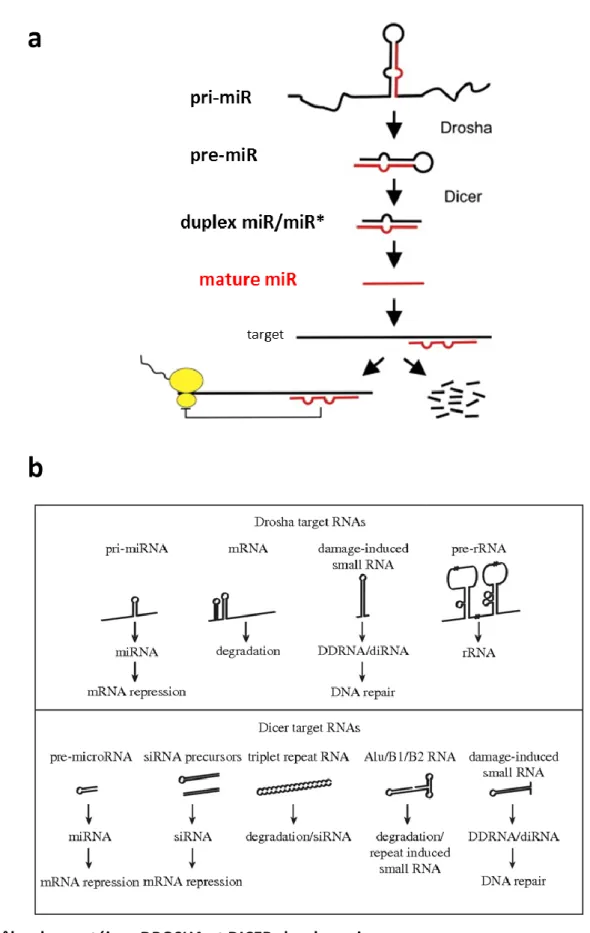
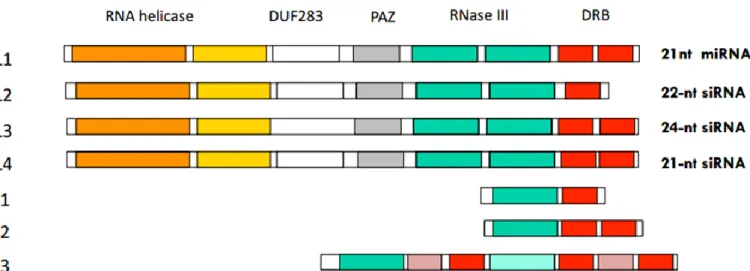
C. Les RNases III et leurs rôles. ... 60
1. Les RNases III : une grande diversité de substrats et de fonctions. ... 60
1.1 Les différentes classes de RNase III. ... 62
1.2 Les RNases III chez les plantes. ... 68
2. Problématique de la thèse : Quel est le rôle de la RNase III MtRTL1b dans la nodulation ? ... 74
II. Matériels et méthodes. ... 75
A. Matériels biologiques. ... 75
1. Les souches bactériennes et leur culture. ... 75
2. Matériel végétal. ... 77
2.1 Lignées végétales. ... 77
2.2 Cultures des plantes. ... 77
2.3 Génération des plantes composites de M. truncatula. ... 78
2.4 Identification et génotypage des mutants d’insertion Tnt1 de M. truncatula. .... 82
2.5 Plantes de Nicotiana benthamiana utilisées pour les expériences d’agro-infiltration. ... 84
B. Méthodes. ... 87
1. Analyses de séquences nucléotidiques et protéiques. ... 87
1.1 Identification et caractérisation des gènes et des protéines RNases III chez plusieurs légumineuses. ... 87
1.2 Alignements protéiques et analyses phylogénétiques. ... 87
2. Analyse des phénotypes de nodulation. ... 88
2.1 Inoculation avec les bactéries symbiotiques. ... 88
2.2 Comptages des nodosités et imagerie à la loupe. ... 88
2.3 Test de réduction de l’acétylène par la nitrogénase bactérienne. ... 89
2.4 Coupes anatomiques des nodosités et test de viabilité des bactéries. ... 89
3. Analyses d’expression génique. ... 90
3.1 Collecte de données de transcriptome sur le site MtGEA. ... 90
3.2 Reverse transcription-PCR quantitative (RT-qPCR). ... 90
3.3 Fusions promoteurs-gènes rapporteurs. ... 91
4. RNAseq. ... 93
4.1 Préparation des banques d’ARNm. ... 93
4.2 Traitement des données de séquençage. ... 93
4.3 Analyses des données de séquençage. ... 95
5. Test d’activité de suppression du silencing post-transcriptionnel par agro-infiltration. ... 95
III. Résultats. ... 97
A. Caractérisation des RNase III chez M. truncatula et d’autres espèces légumineuses. ………..97
1. Identification des RNases III chez plusieurs espèces légumineuses. ... 99
2. Analyse phylogénétique des protéines DCLs et RTLs. ... 106
B. Analyse de l’expression des gènes MtRTL1 chez M. truncatula. ... 111
1. Expression des gènes MtRTL dans des organes de M. truncatula... 111
2. Profil d’expression spatio-temporelle des gènes MtRTL1s dans les nodosités. .. 113
3. Etude de l’expression de MtRTL1b dans des nodosités formées avec des mutants bactériens ou végétaux, affectés dans la nodulation. ... 122
4. Caractérisation du locus du gène MtRTL1b. ... 127
C. Analyses fonctionnelles de MtRTL1b au cours de la nodulation. ... 131
1. Recherche de lignées d’insertion Tnt1 dans le gène MtRTL1b. ... 131
2. Etude de l’effet de la modulation de l’expression de MtRTL1b sur le phénotype de nodulation. ... 135
nodosités. ... 137
2.3 Effet de l’inactivation partielle de MtRTL1b sur la viabilité des bactéroïdes. ... 145
D. Etude transcriptomique des nodosités déficientes dans l’expression des gènes MtRTL1. ... 151
1. Vérification moléculaire de l’expression différentielle de quelques DEGs. ... 161
2. Comparaison des DEGs des nodosités RNAi-MtRTL1-1 avec différentes données RNASeq. ... 163
2.1 Gènes « sur-exprimés » dans des nodosités sauvages matures. ... 163
2.2 Zones de la nodosité isolées par micro-dissection laser. ... 163
2.3 Nodosités affectées dans l’expression de l’ADN déméthylase MtDEMETER. ... 169
3. Etude préliminaire du mode d’action de MtRTL1b. ... 171
3.1 Test de la capacité de MtRTL1b à supprimer le silencing post-transcriptionnel dans un système hétérologue. ... 171
3.2 Identification des ARN double brin dans les données RNASeq des nodosités RNAi RTL1-1. ... 174
IV. Discussion et perspectives. ... 176
A. MtRTL1b : une protéine spécifique des légumineuses à nodosités indéterminées ? ………177
B. La régulation complexe du gène MtRTL1b. ... 180
C. MtRTL1b, un gène important pour le développement des nodosités et la fixation de l’azote. ... 184
D. Quel est le mode d’action de la RNAse III MtRTL1b ? ... 191
V. Annexes. ... 195
VI. Liste d’abbréviations. ... 208
VII. Liste des figures et tableaux. ... 213
1
Figure 1 : Schéma du cycle de l’azote terrestre.
Sont représentés : en orange les formes d’azote, en bleu les animaux, en vert les végétaux (dont les légumineuses associées aux rhizobia symbiotiques) et en rouge les bactéries et champignons du sol.
2
I. Introduction.
Les Fabacées, communément appelées Légumineuses, constituent une des principales familles de plantes cultivées dans le monde. On y retrouve par exemple, le soja (Glycine max), le pois (Pisum sativum), le haricot (Phaseolus vulgaris), l’arachide ou cacahuète (Arachis hypogaea) et la luzerne (Medicago sativa). Elles sont utilisées comme plantes alimentaires (gousses/graines ou fourrages) ou plus récemment dans la production de biocarburants. Du fait de leur capacité à « enrichir » les sols en azote et à pousser sans apport surnuméraire d’engrais azotés grâce à une interaction symbiotique avec des bactéries du sol, elles sont depuis longtemps intégrées dans les stratégies de rotation des cultures. En effet, l'azote est une ressource indispensable à la vie qui rentre dans la composition de nombreuses molécules biologiques essentielles, comme les acides nucléiques et les protéines. Cette ressource stratégique pour la survie des êtres vivants est présente dans l'atmosphère et dans le sol, cependant sa répartition est inégale en quantité et formes de molécules.
On dénombre quatre formes différentes d'azote inorganique sur Terre, une forme diatomique gazeuse présente dans l'atmosphère (à 78%), le diazote (N2), et trois formes
édaphiques, dites fixées en raison de la liaison entre l'atome d'azote et d'autres atomes
(Figure 1). Il s’agit des nitrites (NO2-), de l'ammonium (NH4+) et des nitrates (NO3-). Ces deux
dernières sont les formes absorbables et assimilables par les plantes et particulièrement les nitrates. Les formes fixées sont sujettes au lessivage, processus naturel où les précipitations vont rincer les sols des minéraux qu'ils contiennent en les faisant s'infiltrer plus profondément. La disponibilité en azote dans le sol est donc une contrainte majeure au développement et à la croissance des végétaux.
Le cycle de l'azote est complexe et fait intervenir l’atmosphère, des organismes vivants et plusieurs compartiments géologiques et de la biosphère (Figure 1). En effet, l'ammonium du sol peut être pris en charge par des bactéries dites nitrifiantes car elles permettent la nitrification, transformation de l’ammonium en nitrites. Puis, d'autres bactéries nitrifiantes changent les nitrites en nitrates qui sont ensuite soit assimilés par les plantes soit dénitrifiés en diazote par des bactéries dénitrifiantes.
3
Figure 2 : Deux espèces modèles de Fabacées, la luzerne tronquée (Medicago truncatula, à gauche) et le
soja (Glycine max, à droite). a et b : jeunes plantes.
c et d : racines avec des nodosités fixatrices d’azote.
Sources des photographies : a : Yang et al., 2017 ; b : https://cfscoop.com; c : Maróti et Kondorosi, 2014 ; d : Wally Eberhart. https://www.art.com/products/p360872438-sa-i4009826/wally-eberhart-nitrogen-fixing-bacteria-rhizobium-nodules-on-soybean-roots-glycine-max.htm?upi=Q10EBIB0&PODConfigID=14258389.
4
L'azote assimilé par les plantes est source de nourriture pour les herbivores, eux-mêmes mangés par des carnivores. Cette biomasse est, une fois morte, prise en charge par des micro-organismes décomposeurs qui libérent de l'ammonium dans le sol. Enfin, certaines bactéries sont capables de fixer le N2 atmosphérique et de le transformer en
ammonium. Ces bactéries, dites diazotrophes, peuvent être libres, comme les cyanobactéries du genre Nostoc ou encore des bactéries du sol du genre Azobacter. Elles peuvent aussi être symbiotiques, comme les Frankia en association avec les plantes actinorhiziennes, certaines espèces d’Azospirillum interagissant avec des céréales ou encore les bactéries du sol du genre Rhizobium qui établissent une symbiose avec des plantes de la famille des Fabacées (Soltis et al., 1995). Ces rhizobia sont des bactéries aérobies de la classe des alpha-protéobactéries (GRAM-). Selon le « Catalogue of Life » (27 octobre 2013,
http://www.catalogueoflife.org/), elles sont représentées par au moins 23 espèces différentes, comme Sinorhizobium meliloti qui interagit avec les espèces du genre Medicago notamment. Cette symbiose Rhizobium-légumineuse (SRL) se traduit par la formation d’organes racinaires, les nodosités (Figure 2), au sein desquelles les Rhizobia fixent le N2
atmosphérique grâce à une enzyme, la nitrogénase et produisent ainsi de l’ammonium assimilable par la plante (Figure 3h). Cette interaction permet l’optimisation de la nutrition azotée de la plante hôte, initialement carencée, tandis que les bactéries bénéficient de divers nutriments produits par la plante.
Au cours de ma thèse, j’ai étudié le rôle d’une ribonucléase de type III, enzyme clivant spécifiquement des ARN double brin (ARNdb), dans le processus de nodulation chez une espèce légumineuse modèle, Medicago truncatula (Figure 2a et c). L’hypothèse de départ de ce travail, basée sur son homologie avec la protéine AtRTL1 d’Arabidopsis thaliana (Shamandi et al., 2015), était que la protéine MtRTL1b pourrait agir dans les nodosités comme un suppresseur de silencing (extinction spécifique de l’expression des gènes via des petits ARN double-brin) et constituer ainsi un régulateur important de l’expression de certains gènes au cours de la formation des nodosités.
Dans cette introduction, je présenterai donc tout d’abord les étapes de la formation des nodosités et leurs régulations. Puis je décrirai l’état des connaissances quant aux régulations géniques accompagnant le développement de ces organes ainsi que les principaux acteurs impliqués. Enfin, je me focaliserai sur les ribonucléases de type III et leurs rôles connus, en particulier chez les plantes.
5
Figure 3 : Représentation schématique des principales étapes de la symbiose Rhizobium-légumineuses.
a et b, Mise en place du dialogue moléculaire (flavonoïdes/Facteurs Nod) entre les partenaires symbiotiques, les Rhizobia et la légumineuse. En condition de carence azotée, les légumineuses sécrétent des flavonoïdes dans le sol ce qui attire spécifiquement certaines bactéries du genre Rhizobia au niveau des poils absorbants de leurs racines. Celles-ci produisent alors les facteurs Nod qui, reconnus par la plante, permettent l’infection et l’organogenèse des nodosités. c, Prolifération des Rhizobia et formation du cordon d’infection. d, Croissance du cordon d’infection amenant les rhizobia jusqu’au cortex de la racine. e, Relargage des Rhizobia dans les cellules hôtes du primordium nodulaire et differenciation en bactéroïdes. f, Nodosité fixatrice d’azote contenant des bactéroïdes qui fixent le diazote atmosphérique. g, Image de miscroscopie présentant une cellule symbiotique contenant des bactéroïdes (cellule de gauche) et une cellule non-infectée (cellule de droite). h, Formule de la réaction de fixation biologique (réduction) du N2 atmosphérique par la nitrogénase bactérienne.
6
A. La symbiose Rhizobium/Légumineuse : un processus hautement
régulé.
Le processus de nodulation peut se subdiviser en plusieurs étapes, l’infection bactérienne, l’organogenèse de la nodosité, la fixation de l’azote, puis la sénescence. Plus précisément, suite à un dialogue moléculaire complexe entre la plante carencée en azote et les bactéries symbiotiques, celles-ci se rapprochent des poils absorbants des racines (Figure
3a, b). Les poils se courbent pour former des structures dites en forme de crosse de berger à
l’intérieur desquelles les bactéries sont enfermées (Figure 3c). L’internalisation de la membrane des poils absorbants permet la formation de cordons bactériens appelés cordons d’infection, qui pénètrent et progressent au travers des tissus racinaires véhiculant avec eux les Rhizobia (Figure 3d). Parallèlement, certaines cellules des tissus internes de la racine (essentiellement le cortex) se dédifférencient puis se divisent activement pour former le primordium nodulaire, qui sera à l’origine de la nodosité (Figure 3e). Lorsque les cordons d’infection atteignent le primordium, les bactéries sont relarguées dans certaines cellules hôtes au sein desquelles elles se retrouvent entourées par une membrane issue de celle de la cellule hôte formant ainsi des sortes d’organites, appelés symbiosomes. Les Rhizobia se différencient alors en bactéroïdes, capables de fixer le N2, ce qui n’est pas le cas à l’état libre
(Figure 3e et f). Dans la nodosité, l’activité de la nitrogénase (Figure 3h), très sensible au
dioxygène, est possible grâce à l’établissement d’un environnement microoxique, qui est maintenu par divers dispositifs anatomiques et biochimiques comme la présence du parenchyme nodulaire et l’accumulation de leghémoglobine. Ce pigment pourpre tamponne en effet la concentration de dioxygène intracellulaire de façon à permettre la respiration tout en évitant l’inactivation de la nitrogénase.
1. Les types morphologiques de nodosités.
Les Fabacées peuvent former deux types morphologiques de nodosités, nommées indéterminées et déterminées, en fonction de la présence ou non d’un méristème persistant au niveau de la région apicale de la nodosité (Figure 4). Les espèces légumineuses formant des nodosités déterminées sont pour la plupart tropicales et sub-tropicales, comme le soja ou le haricot commun qui appartiennent tous deux au clade des Millettioids.
7
2013; Emerich and Krishnan, 2014; Oldroyd and Dixon, 2014)
Figure 4 : Arbre phylogénétique des Fabacées et types de nodosités.
Les Millettioids, comme le soja Glycine max et le haricot Phaseolus vulgaris, ainsi que les Robinioids, comme le lotier Lotus japonicus, forment des nodosités déterminées. C’est aussi le cas des espèces du genre Aeschynomene et Arachis qui font partie des Dalbergioids. Chez ces espèces, contrairement aux premières, la différenciation des bactéries requiert des peptides de type NCR (Nodule Cystein-Rich). Les plantes du genre Aeschynomene sont capables de former des nodosités sur la tige en plus des celles formées sur les racines. Le clade des IRLC est caractérisé par la formation de nodosités de type indéterminées et ses représentants ont en commun la perte d'une région de 25 kilobases dans le génome chloroplastique. La luzerne tronquée Medicago truncatula est une espèce modèle de ce clade.
Les images utilisées pour cette figure sont issues des publications suivantes : (Radutoiu et al., 2007; Oldroyd et Dixon, 2014) pour M. truncatula, (Okubo et al., 2013) pour Aeschynomene indica et (Emerich et Krishnan, 2014) pour Glycine max.
8
Cependant, le lotier (Lotus japonicus, clade des Robinioids), bien qu’étant une espèce de régions tempérées, forme des nodosités déterminées. On trouve aussi des nodosités de type déterminé chez des espèces appartenant aux clades des Dalbergioids comme l’arachide (Arachis hypogea) ou Aeschynomene indica.
Les nodosités indéterminées se forment, elles, chez des espèces issues de régions tempérées, telles que la luzerne cultivée Medicago sativa, le pois Pisum sativum, le trêfle
Trifolium repens et la luzerne tronquée Medicago truncatula (Bond, 1948; Libbenga et
Harkes, 1973; Newcomb, 1976; Newcomb, Sippell et Peterson, 1979). Ces espèces appartiennent à un clade nommé IRLC (Inverted Repeat-Lacking Clade), caractérisé par une délétion commune dans le génome chloroplastique (Figure 4).
Les nodosités déterminées se caractérisent par une forme assez sphérique (Figures 4
et 5). La zone centrale de la nodosité mature est constituée de cellules infectées par une
population homogène de bactéroïdes fixateurs, dont la différenciation est synchronisée
(Figure 5) (Newcomb, Sippell et Peterson, 1979; Turgeon et Bauer, 1982; Calvert et al., 1984;
Mathews, Carroll et Gresshoff, 1989; Li et al., 2013). De plus, ce type de nodosité peut présenter des lenticelles, structures améliorant les échanges gazeux (Figure 5). Du fait de l’absence de méristème persistant, ces nodosités ont une durée de vie limitée à quelques semaines. Elles entrent ensuite en sénescence tandis que de nouvelles nodosités se forment sur des portions plus jeunes du système racinaire (Rolfe et Gresshoff, 1988). Pour les nodosités déterminées, la première division cellulaire à l’origine du primordium s’effectue au niveau sous-épidermique dans le cortex externe (Pacios-Bras et al., 2003).
Du fait de la présence d’un méristème persistant à leur extrémité apicale, les nodosités indéterminées possèdent une forme ovale et allongée, parfois multilobée (Figure 5). Le méristème produit continuellement de nouvelles cellules, qui peuvent être infectées à leur tour par des Rhizobia dans une zone dite d’infection puis se différencier dans l’interzone pour constituer par la suite la zone de fixation. Une fois à maturité, les nodosités indéterminées sont ainsi composées d’une population hétérogène de bactéroïdes fixateurs. De l’apex à la base de la nodosité, on y distingue un gradient de différenciation cellulaire et la présence de cinq zones (Figure 5): I-méristème, II-infection, III-interzone, IV-fixation du diazote et V-sénescence.
9
Figure 5 : Nodosités indéterminées (à gauche) et
déterminées (à droite).
a et b : Coupes longitudinales de nodosités. La zone rouge correspond à la zone de fixation du diazote, caractérisée par l’accumulation de leghémoglobine. c et d : Coupes longitudinales colorées au bleu de toluidine.
e et f : Coloration Live-dead d’une cellule infectée de la zone de fixation (en vert les bactéroïdes, en rouge le noyau de la cellule végétale).
g et h : Observation au microscope électronique à transmission des bactéroïdes au sein des cellules infectées. Les flèches rouges représentent les membranes péri-bactéroïdiennes.
i et j : Schéma d’une nodosité indétermin i) et une nodosité dét j).
Les nodosités indéterminées matures (a, c, e, g et i) sont de forme ovale et allongée. Un gradient de différenciation est observable tout le long de la nodosité de l’extrémité apicale jusqu’au niveau de la région basale qui est rattachée à la racine (c). Ce gradient se traduit par une zonation de la nodosité (i) en 5 régions : la zone méristématique (I), suivie de la zone d’infection/différenciation (II), l’interzone (III), la zone de fixation (IV) et enfin la zone de sénescence (V). Les tissus vasculaires sont disposés en périphérie et sont assez peu ramifiés. On observe de nombreux bactéroïdes très allongés par cellule (e) et chaque symbiosome contient un bactéroïde (g).
Les nodosités déterminées (b, d, f, h et j) ont une forme sphérique (b) ne présentant pas de zonation (d et j), ni de gradient de différenciation. La population de bactéroïdes est assez homogène dans les cellules symbiotiques (f) puisque la différenciation se produit de façon synchronisée dans tous les symbiosomes. Chaque symbiosome contient plusieurs bactéroïdes (h). Ce type de nodosité peut également mettre en place des structures permettant l’amélioration des échanges gazeux, les lenticelles (j).
10
La partie centrale de la nodosité est entourée par des tissus périphériques (épiderme, parenchyme, endoderme et faisceaux de tissus conducteurs, Figure 5). Contrairement aux nodosités déterminées, l’initiation du primordium des nodosités indéterminées résulte de divisions au niveau de certaines cellules du cortex interne suivies par d'autres dans l'endoderme et le péricycle.
2. Les étapes précoces de la symbiose.
2.1 Le dialogue moléculaire entre Rhizobia et Légumineuses.
L’établissement de la symbiose Rhizobium/légumineuse (SRL) est possible grâce à un dialogue moléculaire complexe entre la plante hôte et la bactérie (Gough et Cullimore, 2011; Oldroyd, 2013). En condition de carence azotée, les racines des légumineuses secrétent un cocktail de composés phénoliques, les flavonoïdes, qui va être reconnu par certaines espèces de Rhizobia (Redmond et al., 1986). L’interaction plante-bactéries présente donc une certaine spécificité. Cependant, certaines souches bactériennes montrent une capacité d'interaction avec une grande gamme d’espèces végétales, telles que Rhizobium sp. souche NGR234 et Rhizobium fredii USDA257 qui peuvent interagir avec plus d’une centaine de Légumineuses (Pueppke et Broughton, 1999). La reconnaissance des flavonoïdes a deux effets sur les bactéries : un effet d'attraction en direction de la plante et l’activation de l'expression des gènes nod (nodulation). L'expression de ces gènes va permettre la production et la sécrétion de lipo-chito-oligosaccharides (LCOs) particuliers, appelés communément Facteurs de Nodulation (ou facteurs Nod, FNs). Les FNs sont constitués d'un polymère formé d'un squelette d'oligosaccharide, une chaîne de 3 à 5 molécules de N-acetyl-D-glucosamine, et de différents groupements acides gras qui peuvent être ajoutés aux différents sucres non-réducteurs du squelette (Lerouge et al., 1990; Dénarié, Debellé et Promé, 1996). A nouveau, chaque souche de Rhizobia produit des FNs qui lui sont propres et qui permettent une reconnaissance spécifique entre les deux partenaires de la symbiose (Caetano-Anolles et Gresshoff, 1991; Dénarié, Debellé et Promé, 1996; Spaink, 2000).
Des polysaccharides de surface bactériens (exopolysaccharides, lipopolysaccharides) sont aussi impliqués dans la reconnaissance entre les partenaires symbiotiques (Gibson, Kobayashi et Walker, 2008; Wang et al., 2012). Des mutants bactériens défectifs dans leur
11
que l’organogenèse des nodosités soit déclenchée (Leigh, Signer et Walker, 1985). Chez le lotier, un récepteur des exopolysaccharides, EPR3 (EXOPOLYSACCHARIDE RECEPTOR3), essentiel à l’établissement de la SRL, a été identifié. Ce récepteur appartient à la famille des LysM-RLK (RECEPTOR-LIKE KINASE) et est impliqué dans le passage des bactéries à travers l’épiderme (Kawaharada et al., 2015). La reconnaissance spécifique entre cellules végétales et molécules de surface des bactéries est vraisemblablement aussi importante pour permettre de contrecarrer des réactions de défense mises en place par la plante lors de son infection par les bactéries pathogènes mais aussi par les bactéries symbiotiques (Chen et al., 2017).
Dans la grande majorité des SRL, la reconnaissance des FNs par la plante est essentielle car c’est elle qui va provoquer les modifications cellulaires permettant les étapes de pré-infection/infection et l’organogenèse précoce des nodosités (Suzaki, Yoro et Kawaguchi, 2015) (Figure 6).
2.2 Perception et signalisation des Facteurs de nodulation.
Pour des raisons de simplification du message et lorsque ce sera nécessaire, seuls les gènes de M. truncatula seront présentés dans le texte et dans les figures à venir, sauf si les seuls gènes connus et caractérisés pour l’instant le sont chez une autre espèce.
La perception des FNs par la plante conduit à l'activation d'une voie de signalisation
(Figure 6) dont les premières étapes sont communément regroupées sous le nom de
Common Symbiosis Signaling Pathway (CSSP). Ces étapes sont en effet, communes avec une autre endosymbiose racinaire, la mycorhization à arbuscules qui est déclenchée par des LCOs différents, souvent appelés facteurs Myc (Oldroyd, 2013).
Les modèles actuels, basés essentiellement sur des approches génétiques, prédisent que la détection des FNs a lieu au niveau de récepteurs kinases de type LysM-RLK, situés sur les cellules de l'épiderme racinaire (Figure 6). Ces récepteurs sont constitués d'un domaine transmembranaire, d'un domaine kinase et d'une partie extracellulaire contenant un domaine LysM. Ce domaine est assez commun chez les enzymes bactériennes intervenant dans la dégradation de la paroi cellulaire et on pense qu'il serait impliqué dans la liaison aux
12
peptidodoglycanes qui, de même que les FNs, contiennent des résidus de N-acétyl-D-glucosamine (Steen et al., 2003). Même si ce domaine existe chez les eucaryotes, il est peu courant et la conjugaison avec un domaine transmembranaire et un domaine kinase s'observe exclusivement chez les plantes (Gough, 2003).
Les différents LysM-RLK caractérisés à ce jour chez M. truncatula sont : MtLYK3/MtLYK4 et MtNFP (Limpens et al., 2003; Arrighi, 2006). MtLYK3/MtLYK4 possèdent un domaine sérine/thréonine kinase, contrairement à MtNFP (Huse et Kuriyan, 2002). Les deux types de récepteurs doivent donc vraisemblablement s'assembler pour former un hétéro-dimère contenant un domaine kinase actif pour la transduction du signal (Limpens et
al., 2003). Cependant, l’interaction entre ces récepteurs RLKs et d'autres composants de la
cascade de transduction du signal reste encore à déterminer et mieux caractériser.
Un autre récepteur RLK est activé suite à la perception du signal NF, appelé MtDMI2 chez M. truncatula (Endre et al., 2002; Mitra et al., 2004) (Figure 6). Cette protéine est une LRR-RLK, contenant un domaine Leucine Rich Repeat (LRR) et un domaine serine/threonine kinase. Elle est localisée au niveau de la membrane plasmique des cellules épidermiques ainsi que dans la membrane des cordons d'infection (Limpens et al., 2005). L'activation des LysM-RLKs est considérée comme une condition préalable à l'activation de MtDMI2 et la façon dont ce dernier intègre les signaux bactériens reste encore peu claire (Endre et al., 2002). Sur la base des réponses en aval, les LysM-RLKs jouent donc un rôle spécifique dans la cascade de signalisation des FNs (Figure 6), alors que les LRR-RLKs pourraient fonctionner davantage dans l'initiation d'événements d'infection.
Une fois les récepteurs de FNs activés, la cascade de signalisation (Figure 6) fait intervenir MtDMI1, un canal ionique localisé sur la membrane nucléaire (Ané et al., 2004; Peiter et al., 2007; Riely et al., 2007; Capoen et al., 2011; Venkateshwaran et al., 2012), des nucléoporines non identifiées chez M. truncatula mais codées par LjNup133, LjNup85 et
LjNENA chez le Lotier (Kanamori et al., 2006; Saito et al., 2007; Groth et al., 2010) et une
protéine kinase calcium et calmoduline dépendante (CCaMK) codée par MtDMI3 (Lévy et al., 2004; Mitra et al., 2004; Oldroyd et Downie, 2004).
13
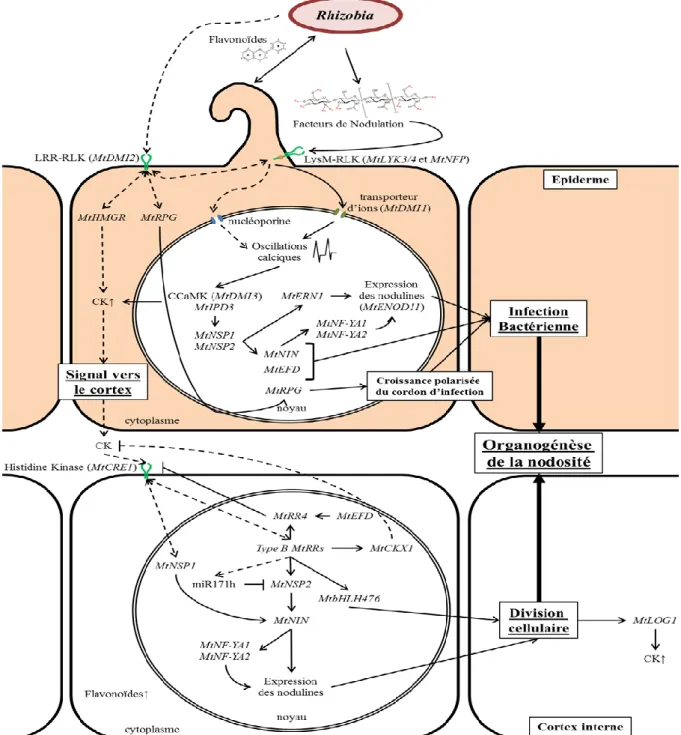
Figure 6 : Schéma de la réponse épidermique permettant l’infection bactérienne chez M. truncatula.
Lors d’une carence azotée, les racines sécrètent des flavonoïdes qui attirent des Rhizobia. Ces flavonoïdes déclenchent également la synthèse de LCOs (lipo-chito-oligosaccharides) appelés facteurs de nodulation par les Rhizobia. Ces FNs sont reconnus par la plante via des récepteurs LysM-RLKs (MtLYK3/4 et MtNFP) épidermiques. L’activation des LysM-RLKs provoque des oscillations calciques nucléaires impliquant des nucléoporines et des transporteurs d’ions (MtDMI1). La perception de ces oscillations calciques par la protéine kinase dépendante du calcium et de la calmoduline, CCaMK, (MtDMI3) provoque enfin l’activation de gènes codant des facteurs de transcription (FTs) comme MtNSP1, MtNSP2, MtNIN, MtERN1, et MtEFD. Ces FTs activeront à leur tour l’expression des nodulines précoces permettant la mise en place de l’infection bactérienne, comme MtENOD11.
MtDMI2, un récepteur de type LRR-RLK va lui aussi percevoir un signal bactérien. Son activation permet l’expression de différents gènes comme MtRPG et MtHMGR qui sont respectivement impliqués dans la croissance polarisée du cordon d’infection et la biosynthèse de cytokinines (CK). La croissance polarisée du cordon d’infection est importante pour les évènements d’infection bactérienne alors que la biosynthèse de CK intervient plus tard au niveau des divisions cellulaires corticales indispensable à l’organogenèse de la nodosité.
Les flèches pleines représentent des interactions caractérisées chez M. truncatula et éventuellement chez d’autres légumineuses alors que les flèches en pointillées correspondent à des interactions indirectes et/ou seulement caractérisées chez d’autres légumineuses que M. truncatula.
14
Une minute après application de FNs, on observe un rapide influx d’ions calciques (Ca2+) dans le noyau suivi d'une dépolarisation de la membrane des poils racinaires via un efflux des ions chlorures et potassiques (Felle et al., 1999). Des oscillations des concentrations de Ca2+ cytosoliques sont également observées environ 10 minutes après l'application de FNs (Wais et al., 2000). La CCaMK (codée par MtDMI3) et une protéine nucléaire à domaine coiled-coil, MtIPD3, interviennent dans la transduction du signal des oscillations calciques (Lévy et al., 2004; Mitra et al., 2004; Messinese et al., 2007; Horváth et
al., 2011).
Cette cascade de signalisation provoque alors une rapide et complexe reprogrammation du transcriptôme des poils absorbants via l'activation de l’expression de plusieurs facteurs de transcription (FTs), comme NODULATION SIGNALING PATHWAY 1 (NSP1, Smit et al., 2005; Hirsch et al., 2009), NSP2 (Oldroyd et Long, 2003; Kalo, 2005) et NODULE INCEPTION (NIN, Marsh et al., 2007). Ces FTs activent secondairement l’expression d’autres FTs comme ERN1 (ETS2 REPRESSOR FACTOR REQUIRED FOR NODULATION, Middleton et al., 2007), EFD (ETHYLENE RESPONSE FACTOR REQUIRED FOR NODULE DIFFERENTIATION, Vernie et al., 2008), deux membres de la famille des APETALA2/ETHYLENE RESPONSE FACTOR (AP2/ERF) ou encore des sous-unités du FACTEUR NUCLEAIRE Y (NF-YA1, Combier et al., 2006; Laporte et al., 2014). Ainsi, la fixation de NSP1 au promoteur des gènes
ERN1 et NIN est essentielle pour activer leur expression (Hirsch et al., 2009). Au final,
l’ensemble de ces FTs régule l'expression de très nombreux gènes, appelés nodulines, qui sont impliquées dans les diverses modifications cellulaires essentielles pour l’infection bactérienne (Figure 6) et pour l’organogenèse précoce de la nodosité (Figure 7 et 8).
2.3 Les réponses épidermiques et l’infection bactérienne.
La courbure du poil absorbant et la formation des cordons d’infection nécessitent la perception des FNs et l’activation des FTs associés (Figure 6). Les mutants nin de L. japonicus par exemple présentent des déformations excessives des poils absorbants ainsi qu’un bloquage des événements d’infection de l’épiderme par les Rhizobia (Schauser et al., 1999). Les mutants nsp1 et nsp2 sont aussi défectueux au niveau de l’infection (Oldroyd et Long, 2003) et ne sont pas capables d'initier la transcription de certaines nodulines précoces
15
Chez M.truncatula, une étude du transcriptome a montré qu’environ 10% des gènes exprimés dans les poils absorbants étaient significativement régulés par un traitement aux FNs (Damiani et al., 2016). Parmi eux, plusieurs sont impliqués dans la croissance des cordons d’infection et la colonisation bactérienne (Arrighi et al., 2008; Haney et Long, 2010; Lefebvre et al., 2010; Horváth et al., 2011; Murray, 2011). C’est le cas de plusieurs protéines membranaires, comme MtVAPYRIN, les flotillines MtFLOT2 et MtFLOT4, MtSYMBIOTIC REMORIN1 mais aussi des protéines de structure ou de remodelage de la paroi, comme
MtENOD11 qui code une protéine pariétale riche en proline ou une pectate lyase LjNPL chez
le lotier. Chez M. truncatula, il a été montré que MtERN1 et MtNSP1 se fixent sur le promoteur du gène marqueur MtENOD11 (Journet et al., 2001; Boisson-Dernier et al., 2005) et que cette liaison requiert MtNSP2 (Andriankaja et al., 2007; Hirsch et al., 2009).
Plusieurs cibles directes de NIN ont aussi été identifiées, dont le gène MtENOD40. L’ARN de ce gène se lie à la protéine MtRBP1 (Medicago truncatula RNA-BINDING PROTEIN 1), ce qui provoque sa relocalisation cytoplasmique (Crespi et al., 1994; Campalans, Kondorosi et Crespi, 2004). De plus, chez le soja, il code deux peptides interagissant avec la saccharose synthase (Rohrig et al., 2002). La répression de l’expression de MtENOD40 entraine la formation de nodosités avortées chez M. truncatula (Charon et al., 1999). Plusieurs gènes NF-YA, codant la sous-unité A du FACTEUR NUCLEAIRE Y, sont aussi des cibles directes de NIN. Le mutant nf-ya1 présente d’ailleurs un défaut dans la progression des cordons d’infection (Laporte et al., 2014). Parmi les gènes régulés par ces FTs, caractérisés par un ou plusieurs motifs CCAAT dans leur promoteur, on retrouve MtENOD11 (Baudin et al., 2015). Les FTs NSP1, NSP2, ERN1 et NIN agissent donc en combinaison pour réguler l'expression des gènes ENODs au niveau de l'épiderme (Vernié et al., 2015).
En parallèle de la cascade de signalisation des FNs, l'activation des LRR-RLKs dans les poils absorbants provoque l'expression de gènes requis pour les événements d'infection bactérienne, comme MtHMGR par exemple. Ce gène code une 3-hydroxy-3-méthyl-glutaryl-CoA réductase qui serait impliquée dans la biosynthèse de phytohormones dérivées d'isoprénoïdes comme par exemple, les cytokinines (CKs) et les brassinostéroïdes (Kevei et
16
SymRK-INTERACTING-PROTEIN (LjSIP1) de L. japonicus et RHIZOBIUM-DIRECTED POLAR GROWTH (MtRPG) de M. truncatula dépendent aussi de la voie des LRR-RLKs. LjSIP1 est un FT qui a la capacité de se fixer sur le promoteur de NIN et régule de ce fait les évènements d'infection bactérienne (Zhu et al., 2008). MtRPG est une protéine nucléaire contenant un domaine coiled-coil comme MtIPD3, jouant un rôle dans la croissance polarisée des cordons d'infection (Arrighi et al., 2008).
Enfin, d'autres protéines nucléaires comme LjCERBERUS, une protéine U-box, et les deux FTs ETHYLENE RESPONSE FACTOR 1 (LjERF1) et ETHYLENE RESPONSE FACTOR REQUIRED FOR NODULE DIFFERENTIATION (MtEFD) sont connus pour jouer un rôle dans les événements d'infection bactérienne au niveau de l’épiderme (Asamizu et al., 2008; Vernie et
al., 2008; Yano et al., 2009). En particulier, chez le mutant cerberus, les bactéries colonisent
les poils recourbés mais très peu pénètrent dans les cellules et seuls quelques rares cordons d’infection sont formés, dont la progression reste bloquée au niveau de l’épiderme (Yano et
al., 2009).
Notons enfin que plusieurs phytohormones jouent un rôle important lors du processus d’infection, en particulier l’auxine, les CKs, les gibbérellines et l’éthylène (Breakspear et al., 2014; Larrainzar et al., 2015; Boivin, Fonouni-Farde et Frugier, 2016; Jin et
al., 2016; Gamas et al., 2017). Par exemple, chez des mutants insensibles aux CKs, les
réponses épidermiques et la formation des cordons d’infection ne sont pas affectées mais les cordons sont courbés, leur orientation est anormale et ils avortent dès leur arrivée dans le cortex. Ce phénotype suggère que la perception des CKs au niveau de ces couches cellulaires serait importante pour la progression des cordons d’infection (Gonzalez-Rizzo, Crespi et Frugier, 2006; Murray et al., 2007).
17
Figure 7 : Organogenèse des nodosités de M.
truncatula.
a, b, c, d, e et f, Observations de coupes longitudinales de segments de racines dans une zone de formation d’une nodosité, colorés au bleu de toluidine Barre d’échelle 75 μm.
Dans les figures c à f, la ligne rouge indique la frontière entre les cellules issues du C3, du C4/5 et de l’endoderme.
a, Stade I, induction de divisions cellulaires anticlines dans le péricycle et occasionnellement en C4 et C5 (flèches noires). b, Stade II, prolongement des divisions anticlines en C4 et C5 et occasionnellement en C3 (flèches noires). c, Stade III, divisions anticlines en C3, dans l’endoderme et occasionnellement en C2, et induction de divisions périclines pour les cellules issues du C4 et C5 (flèches noires). d, Stade IV, induction de divisions périclines en C3, dans l’endoderme et dans le péricycle. Les divisions en C4 et C5 continues et divisions anticlines en C2 (flèches noires). e, Stade V, les cellules dérivées du C3 forment plusieurs couches cellulaires (flèches noires). Les assises C4/5 forment 8 couches cellulaires, l’endoderme et le péricycle constituent la partie basale du primordium constituées de 6 couches cellulaires. Les cordons d’infection pénètrent dans les cellules issues des C4/C5. f, Stade VI, les tissus vasculaires sont formés à la périphérie du primordium et le méristème commence à fonctionner. A partir de ce stade, le primordium de nodosité peut être considéré comme une nodosité.
g, Schématisation du stade I.
h, Schématisation du stade VI et devenir des cellules du stade I.
ep : epiderme, C1 à C5 : différentes couches cellulaires corticale, ed : endoderme, pc : péricycle.
18
2.4 Les réponses corticales précoces et la formation du primordium nodulaire.
Suite à la perception des FNs et de façon synchrone avec l’infection bactérienne, certaines cellules des tissus internes des racines se dé-différencient puis se divisent activement pour former le primordium des nodosités. Chez M. truncatula, l’organogenèse des nodosités a été subdivisée en 6 stades correspondant à des divisions périclines ou anticlines de cellules situées dans le cortex interne (C3-C5), l’endoderme et le péricycle des racines (stades I à IV) (Patriarca et al., 2004; Xiao et al., 2014) (Figure 7). Au stade V, le primordium des nodosités est constitué de 6 à 8 couches de cellules dérivées du péricycle et de l’endoderme (qui formeront la zone basale de la nodosité), 8 couches cellulaires issues des assises C4 et C5 du cortex (à l’origine de la zone de fixation essentiellement) et de quelques couches cellulaires provenant de l’assise C3 du cortex, qui seront à l’origine du méristème et des cellules sous-jacentes constituant la zone d’infection (Xiao et al., 2014). A ce stade, les cellules issues des assises C4/C5 arrêtent de se diviser, commencent à grossir et sont pénétrées par les cordons d’infection. Au stade VI, le méristème commence à fonctionner, ce qui permet la croissance indéterminée de la nodosité.
L’étude des mutants dmi3 a démontré que la voie de signalisation des FNs est requise pour l’initiation des primordia des nodosités. En effet, des mutants gain de fonction de la CCaMK codée par MtDMI3 possèdent un phénotype de nodulation spontanée en absence d’infection rhizobienne (Gleason et al., 2006; Tirichine, et al., 2006). Ce phénotype est supprimé en l'absence de copies fonctionnelles de NSP1, NSP2 (Gleason et al., 2006; Tirichine et al., 2007) ou NIN (Tirichine, et al., 2006; Marsh et al., 2007; Tirichine et al., 2007) ce qui montre que ces trois FTs agissent aussi en aval de CCaMK dans les évènements corticaux (Figure 8). L’étude des mutants nin a aussi confirmé son rôle majeur dans l’initiation des divisions cellulaires dans le cortex racinaire (Schauser et al., 1999; Borisov, 2003; Marsh et al., 2007).
Le rôle des CKs dans l’initiation des nodosités a été montré essentiellement grâce à l’étude de mutants déficients dans leur perception (Gamas et al., 2017). Ainsi, les plantes présentant des mutations perte de fonction dans les récepteurs corticaux, MtCRE1 chez M.
truncatula et LjLHK1 chez le lotier, sont quasiment incapables de former des primordia de
19
Figure 8 : Schéma général de la mise en place de la SRL et des réponses permettant l’organogénèse de la
nodosité chez M. truncatula.
Comme énoncé précédemment dans la Figure 6, les réponses observées au niveau épidermique après une carence azotée conduisent à la mise en place des évènements d’infections bactériennes. De plus, elles permettent également, via la voie des cytokinines (CKs), la production d’un signal qui va activer cette même voie dans le cortex interne. Les CKs présentes dans le cortex sont perçues par un récepteur histidine kinase, MtCRE1. On observe ensuite l’activation de l’expression de MtNSP1 ainsi que celles de différents MtRRs de type B. Les MtRRs, comme MtRR1, activent l’expression d’autres RRs comme MtRR4 ainsi que celles de MtCKX1, une cytokine oxidase, qui participent au rétrocontrôle négatif de cette voie, en inhibant l’expression de MtCRE1 ou en dégradant des CKs respectivement. MtRR4 peut également être activé par le FT MtEFD. Les MtRRs activent également l’expression de MtNSP2 et MtbHLH476, deux FTs, ainsi que l’expression du microARN miR171h qui régule négativement l’expression de MtNSP2. MtNSP2 et MtNSP1 activent l’expression de MtNIN qui, à son tour, active l’expression des nodulines directement ou via l’activation préalable de l’expression des sous-unités du FACTEUR NUCLEAIRE Y, MtNFYA1 et MtNFYA2. Toutes ces activations de gènes sont indispensables pour la mise en place des divisions cellulaires permettant l’organogénèse de la nodosité.
Les flèches pleines représentent des interactions caractérisées chez M. truncatula et éventuellement chez d’autres légumineuses alors que les flèches en pointillées correspondent à des interactions indirectes et/ou seulement caractérisées chez d’autres légumineuses.
20
A l’inverse, comme pour MtDMI3, les mutants gain de fonction de ces récepteurs présentent des phénotypes de nodulation spontanée. En l'absence de copies fonctionnelles des gènes NSP1 ou NSP2, ces phénotypes ne s’observent plus, ce qui montre que ces deux FTs sont requis pour l’action des CKs dans les cellules corticales. Il a été montré que l’activation de MtCRE1 est en partie médiée par le REGULATEUR de REPONSE de type A MtRR1 et que ce FT active directement l’expression de MtNSP2 (Ariel et al., 2012), qui va lui-même activer MtNIN (Figure 8). Comme dans l’épiderme, MtNIN régule l’expression de nombreux gènes, y compris MtNF-YA1 et MtNF-YA2. D’après une étude réalisée chez le lotier, les FTs LjNF-YA1 et LjNF-YB1, régulés par LjNIN, seraient impliqués dans l’activation des divisions cellulaires lors de l’initiation du primordium (Soyano et al., 2013). La voie de signalisation des CKs active aussi l’expression d’autres gènes comme un FT de type BASIC HELIX-LOOP-HELIX, bHLH476, dont la répression par ARN interférence affecte la nodulation (Ariel et al., 2012). Enfin, certains gènes de réponse aux CKs participent vraisemblablement à une boucle de rétro-contrôle. Il s’agit de MtRR4, un REGULATEUR DE REPONSE de type B, du
miR171h, un microARN réprimant l’expression de MtNSP2 et du gène de la CYTOKININE
OXYDASE/DEHYDROGENASE 1 (MtCKX1), enzyme de dégradation des CKs (Ariel et al., 2012). La relation entre perception des FNs au niveau de l’épiderme et l’activation de la signalisation des CKs dans les cellules corticales fait l’objet de nombreuses recherches et reste encore à préciser. Après l’activation de la CCaMK DMI3, une induction de la voie de signalisation et de l’accumulation des CKs est observée dans l’épiderme qui pourrait, grâce à un messager inconnu, activer cette même voie au niveau du cortex. Les CKs elles-mêmes et/ou une autre hormone végétale, l'acide abscisique (ABA), pourraient faire partie de ce signal mobile (Ding et Oldroyd, 2009).
Ces dernières années, un lien a été établi entre la voie de signalisation des CKs et l’accumulation locale d’auxine, indispensable à l’initiation de l’organogenèse nodulaire (Hirsch et al., 1989). En effet, le mutant cre1 de M. truncatula présente une augmentation de l’expression des gènes PIN, les protéines responsables de l’efflux d’auxine, ainsi qu’un défaut du contrôle des transports d’auxine après l’infection par des Rhizobia (Plet et al., 2011). De façon similaire chez A. thaliana, les CKs affectent le développement des racines latérales en régulant l’expression des gènes PIN (Marhavý et al., 2011). Chez le mutant snf2
21
récepteur de cytokinine, LjLHK1, on détecte de plus une accumulation d’auxine et des réponses à l’auxine différentes de celles des plantes sauvages au niveau de ces nodosités spontanées (Suzaki et al., 2012). Ceci renforce l’idée que la signalisation des CKs est nécessaire pour l’accumulation locale d’auxine lors de l’organogenèse précoce des nodosités. Il reste cependant à démontrer comment ces hormones jouent sur l’expression des gènes PIN ou la localisation des protéines correspondantes pendant la nodulation.
3. De la différenciation des nodosités à la fixation de l’azote.
A partir du stade VI de l’organogenèse (Xiao et al., 2014) (Figure 7), les différentes régions fonctionnelles de la nodosité indéterminées sont mises en place. Le méristème nodulaire, en provenance de l’assise cellulaire C3 du cortex, est mis en place à l’apex du primordium (Timmers, Auriac et Truchet, 1999; Stougaard, 2001; Limpens et al., 2003; Xiao
et al., 2014). Les cellules filles issues des mitoses participent, en fonction de leur position
dans le méristème, à la croissance des différents tissus nodulaires : la région centrale avec ces différentes zones (infection, interzone, fixation) et les tissus périphériques (endoderme, cortex et épiderme). Les faisceaux conducteurs périphériques se différencient eux au niveau de territoires précis du méristème nommés méristèmes vasculaires du nodule (NVM) (Roux
et al., 2014).
3.1 Mise en place et maintien du méristème.
Le fonctionnement et le maintien du méristème des nodosités indéterminées ne sont pas encore parfaitement compris. L’étude des réponses aux hormones (auxines et CKs) et de l’expression de plusieurs FTs connus pour leur rôle dans le méristème racinaire, suggère que le fonctionnement du méristème nodulaire pourrait être dérivé de celui des racines (Figure 9). Cependant leur organisation est différente. En effet, le méristème nodulaire peut être subdivisé en deux types de territoires fonctionnels : les cellules méristématiques situées au centre, à l’origine de la zone centrale de la nodosité, présentent des réponses aux CK fortes (d’après l’utilisation du promoteur artificiel pTCS et l’expression des gènes RRs) et une expression des gènes MtPLETHORA 3 et 4 (Franssen et al., 2015) (Figure 9 f, g et h). Par
22
contre, en périphérie du méristème, les cellules à l’origine des tissus conducteurs (NVMs), se caractérisent par des maxima de réponses à l’auxine, l’expression spécifique du gène
MtWOX5 (marqueur du centre quiescent dans le méristème racinaire) et l’expression des
gènes MtPLT1 et 2 (Franssen et al., 2015) (Figure 9 a à e).
Outre son implication dans l’initiation des nodosités, le FT MtNF-YA1 semble aussi jouer un rôle important dans le maintien du méristème. En effet, il a été montré que la restriction de l’expression de ce FT à la zone méristématique, médiée par le microARN miR169, est essentielle pour une différenciation correcte des cellules de la nodosité (Combier et al., 2006). Enfin, les gènes NODULE ROOT (MtNOOT) chez M. truncatula,
COCHLEATA (PsCOCH) chez le pois et LjNBCL1 chez L. japonicus, orthologues des gènes
homéotiques BLADE-ON-PETIOLE (BOP) d’A. thaliana, déterminent l’identité du méristème
Figure 9 : Réponses à l’auxine, aux cytokinines et expression des gènes WOX5 et PLETHORA dans les
régions apicales des nodosités indéterminées de M. truncatula.
Les réponses à l’auxine et aux cytokinines sont visualisées à l’aide des constructions senseurs DR5::GUS et TCS::GUS respectivement tandis que les profils d’expression des gènes « marqueurs » du méristème racinaire MtWOX5 et MtPLETHORA (MtPLT1 à 5) sont déterminés à l’aide de constructions promoteur:GUS. Les territoires méristèmatiques les plus intensément colorés sont marqués par les flèches.
Barres d’échelle: 75 µm. d’après Franssen et al., 2015.
23
noot forme des racines à l’apex des nodosités et plus exactement à partir des cellules
initiales des NVMs (zone d’expression de MtWOX5 et à l’origine des tissus conducteurs des nodosités). Ce gène serait impliqué dans la répression du programme développemental de la racine au profit du programme développemental de la nodosité.
3.2 Différenciation de la région centrale des nodosités.
La zone qui contribue à la formation de la région centrale est composée de quelques assises cellulaires originaires des assises C4 et C5 du cortex. La formation de nouvelles cellules qui seront à leur tour infectées est ensuite assurée par le méristème nodulaire. La transition des cellules méristématiques en cellules fixatrices est accompagnée par une différenciation progressive des cellules, concomitante avec leur infection par les Rhizobia (Cebolla et al., 1999). Cette différenciation s’effectue de façon synchrone avec celle des bactéries à l’intérieur des symbiosomes. Une fois les bactéries pénétrées dans les cellules hôtes, les symbiosomes se divisent tout d’abord plusieurs fois, puis les bactéries se différencient en bactéroïdes (Figure 10).
On distingue généralement 3 grands types de morphotypes de bactéroïdes, qui sont en grande partie déterminés par la plante hôte. C’est pourquoi on peut observer une même souche de Rhizobia présentant différents morphotypes en fonction de la légumineuse avec laquelle elle interagit.
Le morphotype de type U (pour Unmodified) ne présente pas de différenciation visible des bactéries, les bactéries étant de petite taille et en forme de petits bâtonnets comme à l’état libre (Figure 11a, c et d). Ce type semble être l’état ancestral des bactéroïdes (Oono et Denison, 2010). L. japonicus, P. vulgaris et G. max, espèces à nodosités déterminées, ont uniquement des bactéroïdes de ce type (Kondorosi, Mergaert et Kereszt, 2013). On le rencontre aussi dans la zone d’infection distale des nodosités indéterminées, là où les symbiosomes viennent de se former.
24
Figure 10 : Entrée des bactéries dans les cellules végétales et formation du symbiosome.
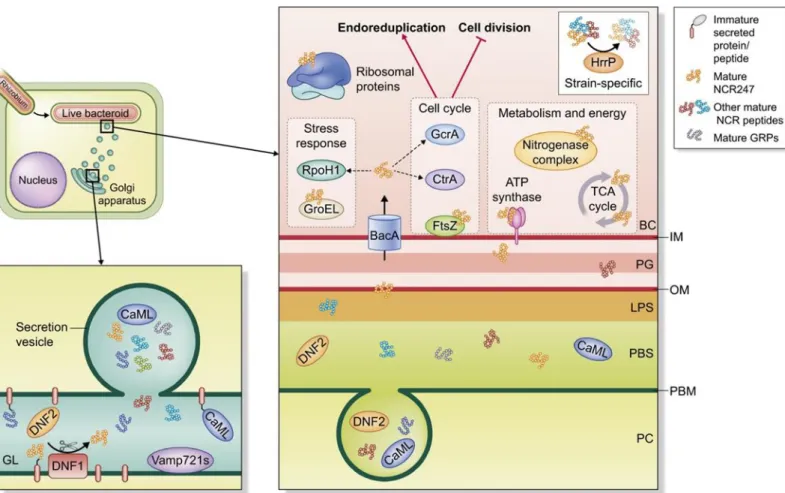
Schématisation de la sortie des Rhizobia du cordon d’infection et internalisation dans la cellule hôte (1) les Rhizobia sont internalisés au sein d’une membrane dérivée de la cellule hôte, la membrane péri-bactéroïdienne. Ce compartiment intracellulaire constitue le symbiosome. Chez les légumineuses du clade des IRLC comme Medicago truncatula et Pisum sativum, les Rhizobia se différencient en bactéroïdes allongés sous l’action des peptides NCRs (2), et (3). La protéine bactérienne bacA est essentielle pour protèger les Rhizobia de l’activité anti-microbienne des peptides NCRs (2). Contrairement aux légumineuses du clade des IRLC, les légumineuses du clade des Millettioïds ne produisent pas de peptides NCRs et donc la protéine bactérienne bacA n’est pas indispensable à la symbiose. Dans ces plantes, les Rhizobia n’atteignent pas un niveau de différenciation terminal et plusieurs bactéroïdes peuvent être dans un seul symbiosome. WT, Wild-type ; ΔbacA, mutant bacA.
25
morphotypes E (pour Elongated) et S (pour Spherical). Le type E correspond à de bactéroïdes très allongés (jusqu’à 10 µm) voire en forme de Y (Figure 11b et e). C’est le type majeur chez les légumineuses du clade IRLC, dans l’interzone et la zone de fixation. Le morphotype S se rencontre essentiellement chez les espèces du clade des Dalbergoides comme le genre des
Aeschynomene (Bonaldi et al., 2011; Czernic et al., 2015). Les morphotypes E et S
possèderaient une meilleure capacité symbiotique ce qui suggère un avantage évolutif pour la plante (Oono et Denison, 2010).
Chez la plupart des espèces à nodosités indéterminées, tous ces changements cellulaires conduisent à la différenciation terminale des bactéries en bactéroïdes ayant perdu la capacité de se diviser et, par conséquent, qu’il est impossible de faire proliférer in
vitro suite à extraction des nodosités (Mergaert et al., 2006). En revanche, pour les nodosités
déterminées, les bactéroïdes, qui présentent un degré de différenciation moindre, sont toujours capables de se répliquer lorsqu’ils sont isolés de nodosités (Brewin, 1991; Franssen
et al., 1992; Mergaert et al., 2006).
Je vais pour la suite me concentrer sur la différenciation des cellules hôtes et des bactéroïdes dans les nodosités de type indéterminées.
Suite à l’arrêt des divisions, les bactéries entrent dans des cycles d’endoréduplication, caractérisée par une succession de réplication de l’ADN (phase S du cycle) sans division cellulaire (phase M). Ce niveau de ploïdie croissant, avec un pic à 24 C (Mergaert et al., 2006), s’accompagne de l’élongation des bactéroïdes et, dans certains cas, de leur ramification. La différenciation des bactéroïdes se caractérise de plus par la mise en place de la fixation du N2 atmosphérique par la nitrogénase (Figure 3), grâce à l’expression
de différents gènes bactériens qui participent à la synthèse du complexe nitrogénase, l’apport en co-facteurs et en substrats ou encore le maintien des conditions requises pour son activité (Denison et Layzell, 1991).
26
Figure 11 : Morphotypes U (undifferentiated) et E (elongated) de bactéroïdes de différentes Rhizobia
chez différentes légumineuses.
La différenciation des bactéroïdes est différente entre les nodosités déterminées et indéterminées, elle est contrôlée par la plante hôte. a, c et d : morphotype U (undifferentiated). b et e : morphotype E (elongated). Ici, différentes combinaisons entre légumineuses à nodosités déterminées (Lotus japonicus et Phaseolus vulgaris) et indéterminées (Vicia sativa et Pisum sativum) et Rhizobia (Mesorhizobium loti, R. leguminosarum bv viciae, phaseoli, « Lotus » et « Pisum ») sont visualisées par microscopie après coloration au DAPI (4’,6-diamidino-2-phénylindole) et au PI (iodure de propidium). Le contenu en ADN est indiqué sous chaque combinaison ainsi que le type de nodosité à partir duquelle les bactéroïdes ont été purifiés.
Barre d'échelle : 10 μm. D’après Mergaert el al., 2006.
27
commensale de l’intestin humain. Elle sert de référence pour le répertoire des gènes associés à la fixation de l’azote et plus particulièrement à la synthèse et l’activité de la nitrogénase, la plupart de ces gènes sont conservés chez les bactéries diazotrophes (Thorneley et Lowe, 1984).
Les gènes nif (nitrogen fixation) sont impliqués dans la synthèse du complexe enzymatique de la nitrogénase, son fonctionnement et sa régulation. Les gènes nifD et nifK codent respectivement les sous-unités α et β de la protéine FeMo (Composant I ou dinitrogénase). La protéine Fe homodimérique (Composant II ou dinitrogénase réductase) est codée par le gène nifH. La synthèse d’un co-facteur FeMo du composant I nécessite les produits des gènes nifE, nifN et nifB mais aussi nifD et nifK, même si l’exacte fonction biochimique de ces protéines reste à préciser (Brigle et al., 1987; Dean, Bolin et Zheng, 1993). Le gène nifB (ou fdxN) code quand à lui une férredoxine impliquée dans le transport d’électrons, indispensable pour la fixation du N2 (Ebeling, Noti et Hennecke, 1988; Klipp et
al., 1989; Masepohl et al., 1992).
Les gènes fix sont aussi indispensables pour la fixation de l’azote lors de la SRL mais, contrairement aux gènes nif, ils n’ont pas d’homologues chez K. pneumoniae. Les gènes
fixABCX identifiés chez Rhizobium meliloti (Ruvkun, Sundaresan et Ausubel, 1982; Corbin,
Barran et Ditta, 1983; Earl, Ronson et Ausubel, 1987) abolissent la capacité de fixation quand au moins l’un d’entre eux est muté. Il a été proposé que ces gènes interviendraient dans le transport d’électrons vers la nitrogénase (Gubler et Hennecke, 1986; Bruschi et Guerlesquin, 1988; Arigoni et al., 1991; Goodman, 1994). Certains gènes nif et fix (comme fixJ, fixL, fixK et
nifA) contrôlent l’expression des autres gènes nif et fix. D’autres gènes comme NtrC
(Nitrogen regulatory protein C) et RpoN (sigma 54) interviennent également dans cette régulation.
Outre ces gènes directement impliqués dans la fixation du N2 par les bactéroïdes,
d’autres gènes bactériens sont impliqués dans la SRL, dont certains comme hemA et bacA sont illustrés dans la Figure 12. Le gène hemA intervient dans la biosynthèse de l’hème. L’hème est un cofacteur contenant un atome de fer qui permet d’accueillir un gaz diatomique comme le dioxygène, on le retrouve dans l’hémoglobine humaine mais également dans la leghémoglobine, hémoprotéine fixatrice de dioxygène dans les nodosités.
28
Figure 12 : Exemples de mutants bactériens (cadres bruns) et végétaux (cadres vert pâle) affectés dans
les étapes de l’infection des cellules hôtes, la différenciation des bactéroides et la fixation de l’azote. L’entrée des bactéries symbiotiques Sinorhizobium meliloti dans les cellules hôtes nécessite l’expression des gènes bactériens hemA et végétaux MtNIP, MtDMI2 et MtHAP2-1. Les gènes bactériens lpsB et bacA sont requis pour la survie des bactéries à l’intérieur du symbiosome. Les gènes végétaux MtDNF1, 4, 5 et 7, MtSYM1, PsSym13 et bactérien fixJ sont nécessaires à la différenciation des rhizobia en bactéroïdes. Les gènes nifHDK codent le complexe de la nitrogénase et sont essentiels à la fixation de l’azote. Chez le pois, le gène PsRUG4 code une saccharose synthase requise pour subvenir au besoin des bactéroïdes pour la fixation de l’azote. Les gènes MtDNF3 et 6 sont requis pour le maintien de la fixation du diazote.
hemA : hème A, lpsB : liposaccharide B, fixJ :fixationJ, nifHDK :nitrogen fixation HDK, MtDMI2 : Does not makes infection 2, MtHAP2-1 : MtNF-YA1 : Nuclear Factor-YA1, MtNIP : Numerous Infections and Polyphenolics, MtDNF1,-4,-5,-7 : Deficient in Nitrogen Fixation 1/4/5/7, MtSYM1 : Symbiotic mutant 1, PsSym13 : Symbiotic mutant 13 et PsRUG4 (SSI) : Sucrose synthase.