HÉLÈNE ÉMOND
CARACTÉRISATION DE L’IMPACT DE LA
CULTURE SUR LE POTENTIEL
THROMBOPOÏÉTIQUE DES CELLULES SOUCHES
DE SANG DE CORDON
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de maîtrise en microbiologie
pour l’obtention du grade de maître ès sciences (M. Sc.)
DÉPARTEMENT DE BIOCHIMIE, MICROBIOLOGIE ET BIO-INFORMATIQUE FACULTÉ DES SCIENCES ET DE GÉNIE
UNIVERSITÉ LAVAL QUÉBEC
2012
R
ÉSUMÉ
Beaucoup d’espoir repose sur le domaine de la transplantation de cellules souches issues de sang de cordon ombilical. En effet, malgré les avancées remarquables survenues ces dernières années, le retard de la reprise des plaquettes et des neutrophiles persiste comme inconvénient majeur à surmonter. Afin d’améliorer la prise de greffe et d’accélérer la récupération des cellules hématopoïétiques, des thérapies cellulaires se basant sur la croissance et la différenciation des cellules souches hématopoïétiques sont à l’étude. Ainsi, avec un nombre plus élevé de cellules qui ont déjà entamé leur différenciation, la récupération du système hématopoïétique devrait être accélérée. Ce mémoire présente une stratégie d’expansion des cellules qui favorise la voie mégacaryocytaire grâce à un cocktail de cytokines optimisé et à une température d’incubation de 39°C. La co-transplantation de cellules expansionnées sous ces conditions optimales avec des cellules non-expansionnées a permis d’accélérer la reprise plaquettaire chez un modèle murin.
A
BSTRACT
Strong hope resides in the field of umbilical cord blood hematopoietic stem cell transplantation. Although many remarkable advances were achieved in the past years, the prolonged delay in neutrophils and platelets recovery is still a major issue to overcome. To enhance engraftment and accelerate hematopoietic recovery, the growth and differentiation of hematopoietic stem cells are studied as the funding of cellular therapies. Hence, with a higher number of cells, that already entered their own differentiation pathway, recovery of mature hematopoietic cells should be accelerated. This thesis presents an expansion strategy for hematopoietic stem cell that favors the megakaryocytic lineage through an optimized cytokine cocktail and an incubation temperature of 39°C. Finally, the co-transplantation of cells expanded under these conditions along with non-expanded cells accelerated platelet recovery in a murine model for stem cell transplantation.
A
VANT
-
PROPOS
Je tiens d’abord à remercier Héma-Québec et l’Université Laval pour le support institutionnel et financier qui m’a permis de poursuivre mes activités de recherche pendant ces deux années.
J’aimerais aussi remercier tous mes collègues de recherche ainsi que ceux qui ont participé, de près ou de loin, à la réussite de mon projet. Il règne chez Héma-Québec un bel esprit d’équipe qui créé une atmosphère agréable qui a aussi contribué à enrichir mon expérience.
Des remerciements particuliers à mon directeur de recherche le Dr Nicolas Pineault pour le privilège qu’il m’a offert en m’accueillant dans son équipe. Grâce à lui, j’ai appris bien plus que de connaissances scientifiques. Je lui suis grandement reconnaissante pour le projet motivant et plein de perspectives intéressantes que j’ai pu prendre en charge. Je le remercie pour toute la confiance qu’il a eue en moi.
Mon équipe de recherche, à son tour, reçoit toute ma gratitude, soit Lucie Boyer, Nellie Dumont, Betül Çelebi et Simon Fournier. Un merci spécial à Lucie, ma mère spirituelle chez Héma-Québec, qui m’a accompagnée tout au long de mon projet. J’ai apprécié l’entraide qui a toujours prévalu dans notre équipe. D’ailleurs, les «journées de la marmotte» ont été très agréables en compagnie de Lucie et Nellie.
Les membres du service vétérinaire de l’Université Laval ont pareillement contribué au succès de mon projet. Leurs soins, conseils et services m’ont permis de faire mon travail plus efficacement. Je remercie Mathieu Fortin et Guylaine Jalbert qui ont rendu ces nombreuses heures de travail plus stimulantes et toujours divertissantes.
Héma-Québec profite d’une brochette d’étudiants particulièrement talentueux et très sympathiques. Je remercie chacun d’entre eux pour la chance que j’ai eue de les connaître et de les côtoyer. D’ailleurs, j’ai chéri la compagnie de certains d’entre eux plus spécialement. Tout d’abord, ma jumelle chez Héma-Québec, Anne-Marie Bessette,
complice depuis le début du baccalauréat, qui a partagé avec moi des discussions scientifiques ainsi que plus ou moins scientifiques. Le troisième mousquetaire, Simon Fournier, toujours à l’écoute et qui a su régler tous mes problèmes informatiques. Il a aussi trouvé en Anne-Marie et moi un public inépuisable pour toutes ses farces, aussi dangereuses soient-elles. Enfin, Patrick Trépanier, qui s’est personnellement intéressé au succès de mon projet et dont la perspicacité m’a ouverte à un point de vue différent sur le domaine scientifique.
En dernier lieu, je remercie les membres de mon comité d’encadrement : Nicolas Pineault, Renée Bazin, Daniel Jung et Caroline Duchaine. Leurs écoutes, conseils, et corrections m’ont permis d’améliorer mes capacités de rédaction et de présentation. J’ai aussi approfondi plusieurs aspects de mon projet grâce à leurs questionnements.
À tous, bonne lecture!
Je dédie ce mémoire à mes parents qui m’ont permis d’accomplir mes études sans inquiétude financière, ce que je considère être un héritage inestimable.
T
ABLE DES MATIÈRES
Résumé ... i
Abstract ... ii
Avant-propos ... iii
Table des matières ... vi
Liste des tableaux ... viii
Liste des figures... ix
Liste des abréviations ... x
1. Introduction ... 1
1.1 Hématopoïèse ... 3
1.2 Mégacaryopoïèse ... 5
1.3 Transplantation de cellules souches hématopoïétiques ... 8
1.3.1 Transplantation autologue, hétérologue et homologue ... 8
1.3.2 Compatibilité des antigènes leucocytaires humains ... 9
1.3.3 Traitement myéloablatif ... 9
1.4 Évolution des thérapies cellulaires pour la transplantation de cellules souches ... 10
1.4.1 Première transplantation de moelle osseuse ... 10
1.4.2 Isolement des cellules souches du sang périphérique ... 11
1.4.3 Collecte du sang de cordon pour l’isolement des cellules souches ... 12
1.4.4 Double transplantation de sang de cordon ... 14
1.5 Expansion cellulaire ex vivo ... 15
1.5.1 Différentes approches exploitées ... 17
1.6 Optimisation de l’expansion des progéniteurs mégacaryocytaires ex vivo ... 20
1.6.1 Transplantation des progéniteurs mégacaryocytaires expansionnés ex vivo ... 20
1.6.2 Optimisation du cocktail pour les progéniteurs mégacaryocytaires ... 22
1.6.3 Importance du modèle animal de xénotransplantation... 24
1.7 Les impacts de l’hyperthermie légère sur l’expansion des mégacaryocytes... 26
1.8 Hypothèse et objectifs ... 27
2. Matériel et Méthode ... 29
2.1 Culture des cellules souches... 29
2.1.1 Source de cellules de sang de cordon ombilical ... 29
2.1.2 Préparation des cellules CD34+ enrichies ... 29
2.1.3 Milieux de culture... 30
2.1.4Mesure des progéniteurs myéloïdes et mégacaryocytaires ... 31
2.2 Essais in vivo... 32
2.2.1 Modèle murin... 32
2.2.2 Rôle des cellules engagées dans la voie mégacaryocytaire ... 33
2.2.3 Influence des cellules irradiées ... 33
2.3 Analyses post-transplantation ... 34
2.3.1 Analyse sanguine ... 34
2.3.2 Évaluation de la prise de greffe ... 34
2.3.3 Expression des cellules humaines ... 35
2.4 Analyse statistique ... 35
3.1 Effets de l’hyperthermie légère sur le potentiel thrombopoïétique et de reconstitution
des cellules souches de sang de cordon ... 36
3.1.1 La reprise plaquettaire est accélérée grâce à l’hyperthermie légère ... 37
3.1.2 L’hyperthermie légère n’altère pas la capacité de reconstitution de la moelle des cellules cultivées ... 40
3.2 Effets de la co-transplantation de cellules expansionnées et non-expansionnées ... 44
3.2.1 Synergie entre les cellules expansionnées et non-expansionnées pour la reprise thrombopoïétique ... 44
3.2.2 Meilleure reconstitution hématopoïétique dans la moelle des souris co-transplantées ... 47
3.3 Rôle des cellules engagées dans la voie mégacaryocytaire... 54
3.4 Mécanismes d’action des cellules expansionnées dans le potentiel thrombopoïétique ... 58
4. Discussion... 60
5. Conclusion ... 66
L
ISTE DES TABLEAUX
Tableau 1 : Paramètres de transplantation pour les effets de l'hyperthermie légère ... 37 Tableau 2: Proportions des cellules humaines dans la moelle des souris NSG (jour 12) ... 41 Tableau 3 : Paramètres de transplantation pour les effets de la co-transplantation ... 44 Tableau 4: Composition (%) de la moelle osseuse des souris transplantées au jour 12 ... 48 Tableau 5: Nombre total de cellules hématopoïétiques dans la moelle osseuse à court terme ... 49 Tableau 6 : Composition (%) de la moelle osseuse des souris transplantées au jour 112 .. 52 Tableau 7 : Nombre total de cellules hématopoïétiques dans la moelle osseuse à long terme ... 53 Tableau 8 : Paramètres de transplantation pour les effets de la co-transplantation ... 55
L
ISTE DES FIGURES
Figure 1: L’hématopoïèse. ... 4
Figure 2: Le développement des plaquettes ... 7
Figure 3: Reprise plaquettaire chez les souris NSG affectée par l’expansion cellulaire ... 26
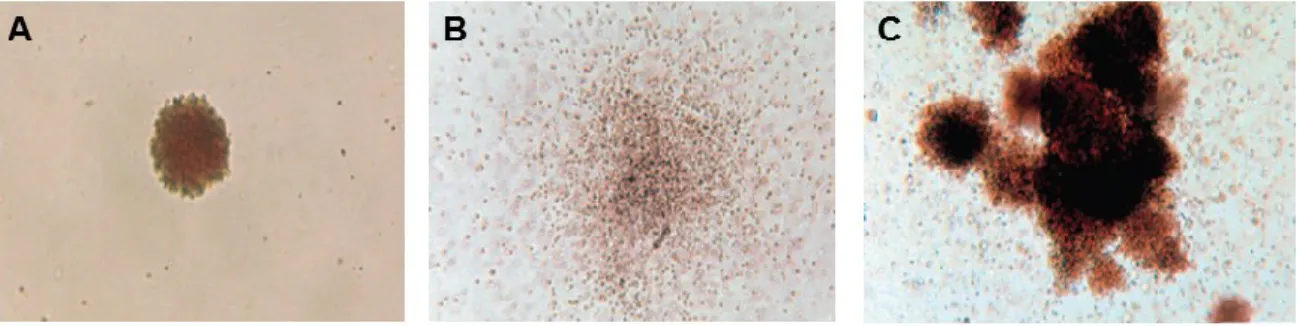
Figure 4 : Aspects macroscopiques des colonies CFC ... 31
Figure 5 : Aspects macroscopiques des colonies CFU-MK ... 32
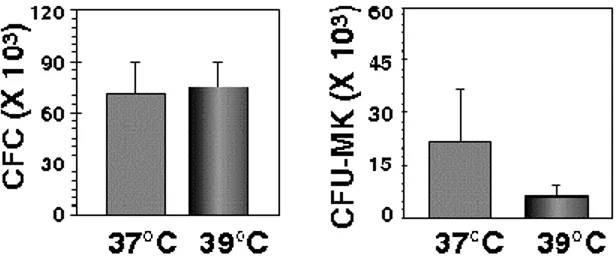
Figure 6: Reprise plaquettaire chez les NSG selon la culture sous hyperthermie légère .... 38
Figure 7 : Effet de l’hyperthermie légère à court terme sur les cellules progénitrices ... 42
Figure 8: Effets de l’hyperthermie légère à long terme sur l’expression des cellules de la moelle ... 43
Figure 9: La co-transplantation accélère et améliore la reprise plaquettaire ... 46
Figure 10 : Effets de la co-transplantation sur le nombre de progéniteurs à court terme .... 50
Figure 11 : Effet à long terme de la co-transplantation sur le nombre de progéniteurs dans la moelle ... 54
Figure 12 : Reprise plaquettaire selon le nombre de cellules engagées dans la voie mégacaryocytaire greffées ... 57
L
ISTE DES ABRÉVIATIONS
ACD: Acide citrique et dextrose APC: Allophycocyanine
BIT: Albumine/insuline/transferrine bovine BS1: Best Settings 1
CFU-E: Colony forming units - erythrocytes
CFU-GEMM : Colony forming units granulocytes, erythrocytes, monocytes,
megakaryocytes
CFU-GM: Colony forming units - granulocytes, monocytes CFU-MK: Colony forming units megakaryocytes
CTL: Contrôle
DMSO: Diméthylsulfoxyde
E: Groupe de souris ayant reçu les cellules expansionnées
Edose: Groupe de souris ayant reçu la faible dose de cellules expansionnées
EDTA: Acide éthylène diamine tétraacétique FBS: Sérum bovin fœtal
FL: FMS-like tyrosine kinase 3 ligand FSC/SSC: Forward scatter/ side scatter GP: Glycoprotéine
G-CSF: Granulocyte colony-stimulating factor IL : Interleukine
IMDM: Iscove modified Dulbecco’s media IV : Intraveineux
LDL: Lipoprotéines à faible densité
MGDF: Megakaryocyte growth and development factor NOD: Non-obese diabetic
NE : Groupe de souris ayant reçu les cellules non-expansionnées
NE+E : Groupe de souris ayant reçu les cellules non-expansionnées et expansionnées NSG : NOD/SCID IL2Rgnull
OMPC: Optimized Megakaryocyte Progenitor Cocktail PBS: Phosphate buffered saline
Plts hu: Plaquettes humaines
SCID: Severe combined immunodeficiency SCF : Stem cell factor
TEPA: Tetraéthylenepentamine TNC : Cellules totales nucléées TPO: Thrombopoïétine
41+: Groupe de souris ayant reçu la fraction CD41 positive des cellules expansionnées 41-: Groupe de souris ayant reçu la fraction CD41 négative des cellules expansionnées
1. I
NTRODUCTION
La transplantation de cellules souches hématopoïétiques peut s’avérer nécessaire pour des patients souffrant de certains cancers. En effet, à la suite d’importantes doses d’irradiation ou de chimiothérapie, le système hématopoïétique de ceux-ci est sérieusement affaibli [1]. Plusieurs jours s’écoulent avant que les cellules hématopoïétiques retrouvent un niveau normal et sain dans la circulation du patient. C’est particulièrement le cas des neutrophiles, effecteurs de l’immunité innée, et des plaquettes, activateurs de la coagulation [2]. Cet état de neutropénie (moins de 1,5 x 109 neutrophiles/litre) [3] et de thrombocytopénie (moins de 150 x 109 plaquettes/litre) [4] rend les patients vulnérables aux infections et aux hémorragies, deux conditions potentiellement mortelles. Bien sûr, des voies transitoires existent pour remédier à la thrombocytopénie. Des transfusions plaquettaires peuvent être administrées à ceux qui en souffrent. Pourtant, en plus des effets secondaires bénins, les transfusions plaquettaires sont susceptibles de créer des réactions immunologiques sérieuses chez le receveur. Par exemple, certains patients recevant de multiples transfusions développent une alloimmunisation où les cellules du système immunitaire détruisent les plaquettes transfusées[5].
Dans un organisme sain, les plaquettes, une fois produites, circulent dans les vaisseaux sanguins et jouent un rôle dans l’hémostase, l’inflammation, la guérison des plaies et la défense de l’hôte [6]. C’est par leur activation, leur agrégation ou leur sécrétion que les plaquettes effectuent leur rôle dans l’organisme. Les plaquettes circulent dans le sang humain à raison de 150 à 400 x 109 plaquettes par litre. Ces petites cellules anucléées
(0,7 à 3,6 µm) ont une durée de vie d’environ 10 jours [4, 6].
Lors de la transplantation, le rôle des cellules souches et progénitrices greffées est alors de recréer un système hématopoïétique chez ces patients. C’est-à-dire que les cellules souches doivent migrer dans la moelle pour y amorcer l’hématopoïèse, processus physiologique de production des cellules du système sanguin, afin de rétablir le plus rapidement possible le système immun des patients.
Les cellules souches hématopoïétiques utilisées peuvent être isolées de trois sources principales soit la moelle osseuse, le sang périphérique lorsque mobilisées et le sang de cordon ombilical [7, 8]. L’extraction des cellules souches hématopoïétiques de la moelle et du sang périphérique signifie pour le donneur des interventions longues, voire inconfortables dans le cas de la moelle. L’avantage du sang de cordon est qu’il n’indispose pas le donneur, étant recueilli après l’accouchement. Par contre, les cellules issues du sang de cordon sont moins nombreuses étant donné son volume limité. Cette situation restreint donc de telles transplantations aux patients de faible poids, particulièrement aux enfants. De plus, dans le cadre de la transplantation, l’utilisation des cellules souches issues de sang de cordon induit une neutropénie et une thrombocytopénie prolongée comparativement aux autres sources de cellules souches [9].
Dans le but de contrer ces désavantages et d’améliorer l’efficacité et la sécurité des transplantations de cellules souches, différentes techniques sont en cours d’élaboration depuis les dernières années. Malgré des efforts soutenus, par exemple l’étude de la co-transplantation de deux unités de sang de cordon, le retard des reprises de neutrophiles et de plaquettes demeure [10]. Les scientifiques se tournent maintenant vers l’expansion ex vivo des cellules souches. Cette thérapie cellulaire se base sur la culture des cellules souches pour contrôler leur croissance et leur différenciation. Le principe étant qu’avec un nombre plus élevé de cellules qui migrent dans la moelle, la prise de greffe devrait être améliorée. Des équipes visent même, comme c’est le cas dans ce projet, à favoriser la différenciation vers une lignée cellulaire particulière pour augmenter le nombre de cellules ayant déjà entamé leur différenciation dans cette voie, et ainsi, accélérer la récupération de ces cellules en circulation.
Ce projet de maîtrise intervient dans la problématique de la faible récupération plaquettaire à la suite de la transplantation de cellules souches. En utilisant un modèle de transplantation animal, il est possible de tester différentes conditions de culture des cellules et différentes stratégies de greffe. Le but de ce projet est de déterminer, à l’aide d’un modèle murin, si la récupération plaquettaire peut être améliorée grâce à une thérapie
cellulaire de co-transplantation de cellules non-expansionnées et expansionnées sous conditions optimales.
1.1HÉMATOPOÏÈSE
La production des différentes cellules sanguines est un phénomène appelé l’hématopoïèse. Celle-ci débute avec les cellules souches hématopoïétiques situées dans les niches ostéoblastiques comprises dans la moelle osseuse. Les cellules souches hématopoïétiques ont été découvertes en 1961 par les scientifiques canadiens James E. Till et Ernest A. McCulloch [11-13]. Celles-ci sont au sommet de la structure hiérarchique du système hématopoïétique. Elles possèdent deux capacités particulières qui leur attribuent le nom de cellules souches et qui rendent possible leur transplantation. En effet, elles ont le potentiel de renouvellement ainsi que de différenciation pour produire toutes les lignées cellulaires du système sanguin. La molécule de surface CD34 est exprimée par la majorité des cellules souches hématopoïétiques ainsi que les cellules progénitrices issues de celles-ci [14]. Ce marqueur de surface est donc couramment utilisé pour identifier et isoler les cellules souches hématopoïétiques et progénitrices.
Lors de leur différenciation, les cellules souches hématopoïétiques primitives, qui possèdent un potentiel de repopulation à long terme, se spécialisent pour devenir des cellules à potentiel de renouvellement à court terme (Figure 1). Par la suite, elles se différencient en cellules progénitrices hématopoïétiques; ces cellules multipotentes n’ont plus la capacité de se renouveler, mais peuvent se différencier pour former n’importe laquelle des cellules du système sanguin. Ce sont les voies lymphoïdes et myéloïdes qui forment les deux voies de la différenciation des cellules hématopoïétiques. Les cellules progénitrices se dirigent alors vers l’une ou l’autre de ces voies, selon les signaux qu’elles reçoivent (cytokines, interactions cellulaires, facteurs de croissance). La voie lymphoïde mène à la production de cellules participant à l’immunité acquise; l’éventail des lymphocytes B et T ainsi que les cellules natural killer. La voie myéloïde, quant à elle,
génère d’une part les cellules de l’immunité innée; soit les neutrophiles, éosinophiles, basophiles, mastocytes et monocytes et d’autre part, les globules rouges (érythrocytes) et plaquettes contribuant à la physiologie normale et à l’hémostase respectivement.
Figure 1: L’hématopoïèse.
Les cellules souches hématopoïétiques ont la capacité de se renouveler ou de se différencier en progéniteur lymphoïde ou myéloïde. Par la suite, les cellules se différencient en cellules de plus en plus matures et de moins en moins potentes dans leur propre lignée. Tiré de Reya, T. et al. [15].
1.2MÉGACARYOPOÏÈSE
La cellule progénitrice hématopoïétique qui s’est différenciée dans la voie myéloïde est appelée cellule progénitrice myéloïde commune (colony forming units granulocytes,
erythrocytes, monocytes, megakaryocytes, CFU-GEMM). Elle peut alors se spécialiser en
progéniteur de mégacaryocytes et érythrocytes ou en progéniteur de granulocytes et monocytes. Suite à une autre étape de spécialisation, le progéniteur mégacaryocytaire primitif (colony forming units megakaryocytes, CFU-MK) est obtenu et peut initier la mégacaryopoïèse (Figure 2).
C’est grâce à la thrombopoïétine (TPO), cytokine principale régulant la mégacaryopoïèse, que maturent les cellules mégacaryocytaires à partir des cellules souches hématopoïétiques (CD34+) [16, 17]. En plus de continuer à exprimer le CD34, le progéniteur mégacaryocytaire primitif (CFU-MK) exprime habituellement aussi les antigènes de surface CD41 et CD61a [18]. Le CD41 est une glycoprotéine (GP) aussi appelée GPIIb et le CD61 est une intégrine appelée ITGβIII. Ces molécules forment le complexe protéique (GPIIb/IIIa) qui deviendra le plus abondant à la surface des plaquettes et qui sert de récepteur au fibrinogène et au facteur de von Willebrand [19].
Au fur et à mesure que la différenciation se poursuit, le CFU-MK, cellule capable de se renouveler, devient éventuellement un promégacaryoblaste, un mégacaryoblaste puis un promégacaryocyte. L’étape exacte qui enclenche la perte du marqueur de surface CD34+ est inconnue, pourtant elle se produit au courant de cette dernière maturation. Les cellules résultantes n’ont plus la capacité d’autorenouvellement et leur maturation donne lieu au grossissement du noyau suite à plusieurs rondes d’endomitose. En effet, comme présenté dans la figure 2, l’endomitose est la période durant laquelle les cellules deviennent polyploïdes. Ce processus contrôlé initie la division cellulaire normale et s’arrête après la réplication du génome, et ce, à répétition. Comme la cytokinèse n’est pas complétée, ni le noyau, ni la cellule ne se divisent [20, 21]. Cela entraîne alors des cellules aux noyaux volumineux contenant plusieurs fois le matériel génétique (4N à 128N). Parallèlement, un réseau de membranes spécialisées se forme à l’intérieur du cytoplasme et provoque le
grossissement de ce dernier. Des pseudopodes épais se développent pour préparer la formation de proplaquettes. Le cytoplasme s’organise aussi de manière à ce que les organelles et vésicules sécrétoires se retrouvent dans ce qui sera les futures plaquettes, aux extrémités des embranchements [22]. De plus, des protéines spécifiques associées aux plaquettes comme les récepteurs du fibrinogène et du facteur de von Willebrand sont synthétisées et envoyées dans les vésicules sécrétoires des plaquettes (granules-α) ou à la surface des mégacaryocytes. D’autres protéines, comme le fibrinogène, sont isolées du plasma et emmagasinées dans les granules-α [23]. Finalement, avant le début de la thrombopoïèse, une glycoprotéine apparaît à la surface des mégacaryocytes; la GPIb (CD42) qui joue le rôle de récepteur du facteur de von Willebrand, mais qui interagit aussi avec les leucocytes [24, 25]. Étant donnée son arrivée tardive dans la différenciation mégacaryocytaire, ce marqueur de surface sert aussi d’indicateur de mégacaryocytes matures.
Le mégacaryocyte peut alors initier la thrombopoïèse, c’est-à-dire la formation et le relâchement des plaquettes. D’abord, des proplaquettes se forment à partir des membranes spécialisées, elles sont reconnues par leurs extensions en forme de branches. Celles-ci s’allongent pour rejoindre les cellules endothéliales dans les sinusoïdes de la moelle et y sont relâchées. Les noyaux contenus dans les proplaquettes sont expulsés et les plaquettes sont libérées par bourgeonnement [26]. Quant à eux, les mégacaryocytes, finalement libérés de leurs proplaquettes, subissent une apoptose compartimentalisée [27]. Quelques milliers de plaquettes sont produites à partir d’un seul mégacaryocyte.
L’un des rôles les plus importants assumés par les plaquettes est l’hémostase. Lors du bris d’un vaisseau sanguin, les plaquettes adhèrent à la surface altérée puisque celle-ci présente des molécules différentes de la paroi d’un vaisseau sanguin sain telles que le collagène. La vasoconstriction participe aussi à ce phénomène qui est principalement médié par la liaison du facteur de von Willebrand aux glycoprotéines en surface des plaquettes. Le facteur de von Willebrand est aussi une glycoprotéine volumineuse qui s’associe principalement au GPIb, mais aussi au GPIIb/IIIa. Les plaquettes agrégées sécrètent l’adénosine phosphate, ce qui amène encore plus de plaquettes à se fixer et à sécréter à leur
tour. Un clou plaquettaire est bientôt formé et une cascade de coagulation est enclenchée. Parmi les facteurs recrutés, le fibrinogène lie le GPIIb/IIIa entre différentes plaquettes pour créer un pont entre celles-ci. Par la suite, le fibrinogène est transformé par la thrombine, une protéase, en fibrine qui solidifie les liens interplaquettaires. Le clou plaquettaire est alors imperméabilisé [28, 29].
Figure 2: Le développement des plaquettes
Le développement des plaquettes débute avec un mégacaryocyte (A) qui subit l’endomitose et la maturation du cytoplasme (B), qui forme des pseudopodes (C), puis des embranchements de membrane pour créer les proplaquettes (D) et qui finalement relâche ses plaquettes (E). Tiré de Patel, S. et al. [23].
1.3TRANSPLANTATION DE CELLULES SOUCHES HÉMATOPOÏÉTIQUES
La transplantation de cellules souches hématopoïétiques est utilisée depuis plus de cinquante ans pour traiter diverses maladies [1]. Initialement étudiée pour remédier aux blessures par irradiation, aux cancers et aux déficiences immunitaires, plusieurs l’exploitent présentement, dans le cadre d’essais cliniques, pour améliorer le traitement de maladies auto-immunes [30] ou pour induire la tolérance lors de greffes d’organes [31].
Comme mentionné précédemment, le rôle des cellules souches transplantées est de recréer un système hématopoïétique chez le receveur. Les résultats obtenus chez les patients diffèrent selon de multiples facteurs tels que la source de cellules utilisée, la compatibilité avec le receveur et la manipulation des cellules. Plusieurs facteurs permettent de déterminer le succès ou l’échec d’une greffe de cellules souches. Évidemment, la reprise du système hématopoïétique est primordiale, mais le temps pour que cette reprise s’effectue, les effets secondaires, la durée de l’hospitalisation et la dépendance aux traitements d’immunodépression doivent également être pris en compte.
1.3.1TRANSPLANTATION AUTOLOGUE, HÉTÉROLOGUE ET HOMOLOGUE
Une transplantation de cellules souches dont les cellules sont issues du patient lui-même est appelée une transplantation autologue. Par contre, cette option n’est pas possible dans tous les cas, par exemple chez un patient souffrant de leucémie dont les cellules hématopoïétiques sont malignes (pour éviter une rechute) [32] ou lors d’un cas d’immunodéficience où elles produisent des cellules défectueuses [33]. Dans ces cas, lorsque les cellules greffées sont issues d’un donneur, il s’agit d’une allotransplantation. Cette pratique permet à de nombreux patients d’avoir accès aux transplantations de cellules souches. Par contre, l’allotransplantation ajoute aussi à la complexité de la démarche. Effectivement, les cellules sont non seulement susceptibles d’être rejetées par le receveur, mais elles peuvent aussi créer une réaction immune contre celui-ci appelée la maladie du greffon contre l’hôte. Par ailleurs, dans le cas où les cellules proviennent d’un proche du receveur qui est compatible (vrai jumeau), il s’agit d’une greffe homologue.
1.3.2COMPATIBILITÉ DES ANTIGÈNES LEUCOCYTAIRES HUMAINS
Pour diminuer le risque d’incidence de la maladie du greffon contre l’hôte, la compatibilité des classes d’antigènes leucocytaires humains est optimisée. Les antigènes leucocytaires humains sont des molécules de surfaces du complexe majeur d’histocompatibilité spécifiques à chaque individu et présents sur les cellules du système immunitaire. Ces molécules présentatrices d’antigènes sont divisées en trois grandes classes. Les antigènes humains leucocytaires du complexe majeur d’hiscompatibilité de classe 1 sont les A, B et C. Ceux de la deuxième classe sont les différents sous-types de D : DR, DM, DOA, DOB, DP et DQ. Enfin, ceux de la troisième classe correspondent aux molécules du complément. Ces molécules servent à discriminer les composants du soi des composants extérieurs; du non-soi [34]. La présence chez le receveur de cellules ayant un profil d’antigènes leucocytaires humains différent de celui de ses propres cellules augmente le risque de rejet ou de développement de la maladie du greffon contre l’hôte [1]. À l’aide des génotypes des individus ou de tests sérotypiques, il est possible de déterminer quels sous-types font partie de chacune des classes et de choisir un donneur qui correspond le mieux possible au receveur.
1.3.3TRAITEMENT MYÉLOABLATIF
La transplantation de cellules souches est fréquemment précédée d’un traitement myéloablatif. Cela constitue à soumettre le patient à de fortes doses de chimiothérapie ou d’irradiation. Ces traitements sont, en général, non-spécifiques et engendrent plusieurs effets secondaires indésirables. En effet, ceux-ci ont souvent pour cible des molécules impliquées dans la division cellulaire. Ils s’attaquent alors aux cellules en division cellulaire dans le corps soit les cellules cancéreuses ainsi que plusieurs autres types de cellules. Quoique les cellules souches hématopoïétiques soient principalement en état de dormance, elles peuvent aussi être affectées par ce traitement. En effet, le processus de leur autorenouvellement peut être déclenché par une altération de la moelle, quelle qu’elle soit. Elles enclenchent ainsi le cycle cellulaire pour pallier la demande en cellules hématopoïétiques de l’organisme. Par conséquent, lors du traitement myéloablatif, les cellules malignes ou défectueuses sont éliminées et il en va de même pour les cellules
productrices du système hématopoïétique du patient, ce qui le laisse vulnérable aux infections et hémorragies. Par ailleurs, la déplétion de la moelle osseuse est parfois le seul but du traitement myéloablatif (permettant de libérer l’espace restreint de la moelle) [35]. Dans tous les cas, à la suite de ce traitement, le patient requiert un apport en cellules immunitaires rapide et à long terme. C’est la transplantation de cellules souches hématopoïétiques qui répond le mieux à ce besoin. De nos jours, le traitement myéloablatif s’avère de moins en moins nécessaire pour le patient et l’action des lymphocytes contre la tumeur est requise pour le succès de la greffe [36]. Cela épargne au patient les inconforts et risques considérables associés au traitement myéloablatif.
1.4ÉVOLUTION DES THÉRAPIES CELLULAIRES POUR LA TRANSPLANTATION DE CELLULES
SOUCHES
Les opportunités variées apportées par la transplantation de cellules souches hématopoïétiques sont extraordinaires et dépassent les attentes originalement émises lors de ses débuts. Pourtant, actuellement aucune thérapie n’est assurée de succès majoritairement dû au fait que les mécanismes affectant la transplantation sont encore trop peu connus. La présente section offre un portrait de l’évolution de la thérapie cellulaire dans le contexte de la transplantation de cellules souches.
1.4.1PREMIÈRE TRANSPLANTATION DE MOELLE OSSEUSE
Le docteur E. Donnal Thomas a effectué la première transplantation de moelle osseuse entre deux humains en 1956 [37]. En 1959, ses efforts ont mené à une rémission de trois mois chez une patiente ayant reçu une dose d’irradiation et une transplantation de moelle osseuse provenant de sa vraie jumelle [38]. Ces innovations ainsi que l’ensemble de l’œuvre du docteur Thomas dans le domaine de la transplantation de moelle osseuse lui ont d’ailleurs valu le prix Nobel de physiologie et médecine en 1990 [39]. Une dizaine d’années plus tard, une première transplantation de moelle osseuse a été réussie par le docteur Robert A. Good à partir de cellules issues d’un enfant de même parent qui n’était
pas jumeau du patient [40, 41]. L’avancement des recherches dans les années qui ont suivi, particulièrement concernant les antigènes leucocytaires humains, a permis d’étendre le don de moelle osseuse entre des patients et donneurs non reliés [42]. Si bien qu’en 1988, un registre mondial de donneurs de moelle osseuse a été créé. Au besoin, ces individus peuvent être appelés à subir une intervention chirurgicale pour isoler les cellules souches hématopoïétiques de leur moelle. Un volume de moelle osseuse est recueilli et les cellules souches hématopoïétiques contenues sont isolées subséquemment.
Plusieurs facteurs peuvent affecter la reprise hématopoïétique après une transplantation de moelle osseuse. Présentement, le temps médian pour les reprises des neutrophiles et des plaquettes grâce à la transplantation de cellules souches issues de la moelle osseuse est respectivement d’environ 16 jours [43] et 18 jours [44, 45]. Les paramètres servant aux comparaisons des temps de reprises des cellules hématopoïétiques pour les études cliniques s’expriment en médianes plutôt qu’en moyennes pour éviter les variations trop importantes causées par les données éloignées.
1.4.2ISOLEMENT DES CELLULES SOUCHES DU SANG PÉRIPHÉRIQUE
La soumission d’un patient à la chimiothérapie ou à l’irradiation provoque une délocalisation des cellules souches de la moelle osseuse vers la circulation sanguine [46, 47]. Cette propriété a été étudiée pour finalement être mise à profit en 1981 où a eu lieu la première transplantation autologue de cellules souches issues du sang périphérique [48].
Quoique moins invasive que l’extraction de cellules souches de la moelle, la mobilisation des cellules souches hématopoïétiques du sang périphérique nécessite une intervention avec le donneur, cette fois appelée leucaphérèse. Au moins une semaine préalablement au prélèvement, le donneur doit recevoir de façon intraveineuse des doses d’une ou de plusieurs cytokines, par exemple le granulocyte colony-stimulating factor (G-CSF) [49]. Cette cytokine amène les cellules souches hématopoïétiques contenues dans la moelle à la quitter pour rejoindre la circulation sanguine. Lorsqu’assez de cellules ont migré au sang périphérique, la leucaphérèse peut avoir lieu. Celle-ci consiste à prélever le
sang du donneur, à le centrifuger pour pouvoir en séparer les composantes les unes des autres et à récupérer la partie désirée pour finalement réinjecter les autres composantes. Ainsi, le plasma et les globules rouges sont retournés au donneur, alors que les cellules mononucléées sont conservées. Les cellules souches hématopoïétiques peuvent alors être isolées et manipulées de la façon voulue pour être transplantées.
L’isolation des cellules chez un donneur sain a amené des inquiétudes par rapport à l’administration de cytokines qui aurait pu créer des complications chez celui-ci. En 1990, la sécurité de la mobilisation a été confirmée [7] et la transplantation allogénique de cellules issues de sang périphérique est devenue de plus en plus populaire. Ce qui a moussé leur popularité, en plus des avantages de prélèvements, est la rapidité des temps médians de reprise des neutrophiles (11 jours) [43] et des plaquettes (13 jours) [44, 45] lorsque comparé aux transplantations de moelle osseuse [50].
Encore une fois, l’accès à ces cellules doit être planifié et cela pose un problème pour les patients nécessitant une transplantation d’urgence. Le sang de cordon ombilical peut être décongelé et administré dans des délais répondant à ces besoins.
1.4.3COLLECTE DU SANG DE CORDON POUR L’ISOLEMENT DES CELLULES SOUCHES
La présence de cellules souches dans le sang de cordon ombilical a été rapportée en 1978. C’est dix ans plus tard que la première transplantation de cellules souches issues de sang de cordon a été effectuée par Gluckman et son équipe [51]. Par la suite, grâce au succès obtenu avec les allotransplantations de moelle osseuse et de sang périphérique, une allotransplantation de sang de cordon a été réalisée avec un donneur non relié au patient [8]. À ce jour, les transplantations de sang de cordon n’avaient été effectuées que chez des enfants. Une équipe française a décrit, en 1996, la réussite d’une greffe de sang de cordon ombilical chez un adulte [52].
Le sang de cordon est aisément récupérable étant donné qu’il est recueilli après la naissance. Son prélèvement n’importune en aucun cas la mère ou l’enfant. En effet, dans un
cas, une aiguille est insérée dans le cordon ombilical pour y aspirer le sang qu’il contient. Dans un autre, le sang peut aussi être recueilli subséquemment à l’expulsion du placenta et à la coupe du cordon. Ceux-ci sont placés dans un appareil appliquant une pression qui permet la collecte du sang [53]. Les cellules mononucléées peuvent alors être isolées dans les 48 heures suivant la récolte. Cette facilité de prélèvement a permis l’établissement de plusieurs banques publiques et privées de sang de cordon dans le monde. Ces banques rendent l’accès à la transplantation de cellules souches possible pour de nombreux patients. La quantité et la diversité des unités de sang de cordon permettent de hausser les critères de sélection (nombre de cellules, compatibilité des antigènes leucocytaires humains, etc.) et ainsi de s’assurer de meilleures chances de réussite de la transplantation.
Les cellules souches hématopoïétiques présentes dans le sang de cordon possèdent l’avantage d’avoir un potentiel de prolifération supérieur aux cellules souches isolées du sang périphérique ou de la moelle osseuse [9]. Elles offrent aussi un risque diminué de transmission de virus, tel que le cytomégalovirus [54]. De plus, chez les patients recevant des unités de sang de cordon faiblement compatibles en antigènes leucocytaires humains, moins de cas de maladie du greffon contre l’hôte sont répertoriés [55].
Par contre, le nombre de cellules obtenues par unité de sang de cordon est limitant. Ces doses de cellules peuvent souvent seulement suffire à des patients de faible poids, majoritairement des enfants. La transplantation de ces cellules provoque aussi une neutropénie et une thrombocytopénie prolongée allant jusqu’à des temps médians de 27 [56] et 71 jours [57], respectivement. En effet, ces cellules souches sont aussi plus immatures et requièrent plus de divisions cellulaires avant la différenciation en progéniteurs myéloïdes. Par conséquent, le retard de la reprise des neutrophiles et plaquettes à la suite de la transplantation de sang de cordon peut être dû à l’immaturité des cellules souches de sang de cordon [58-60].
En somme, l’utilisation du sang de cordon présente l’avantage de causer moins de réactions de maladie du greffon contre l’hôte malgré une plus grande disparité des antigènes leucocytaires humains. De plus, comme seulement de 25 à 35% des patients
nécessitant une greffe bénéficient d’un donneur compatible [61], le sang de cordon répond au besoin de ces patients ainsi que de ceux dont la greffe doit être imminente. Cependant, les patients recevant des cellules de sang de cordon montrent, de manière générale, une thrombocytopénie et une neutropénie prolongée relativement aux patients recevant des cellules souches adultes (moelle osseuse et sang périphérique). Il a été supposé que cet inconvénient peut être provoqué par les faibles doses de cellules CD34+ ou de cellules totales infusées au patient [62].
1.4.4DOUBLE TRANSPLANTATION DE SANG DE CORDON
Pour remédier à la neutropénie et la thrombocytopénie qui perdurent, des moyens pour augmenter la dose de cellules infusées ont été mis au point. Ainsi, la possibilité de transplanter deux unités de sang de cordon a été testée. Tout d’abord, dans un modèle de xénotransplantation ovin, les cellules humaines de deux unités sang de cordon ont permis une meilleure capacité de repopulation à court terme [63]. Considérant ce succès, deux unités de sang de cordon à la fois ont été infusées à un patient à la suite d’un traitement myéloablatif [61]. Celui-ci a ressenti la récupération des neutrophiles et des plaquettes aux jours 27 et 72 post-transplantation, respectivement. Ces délais correspondent aux temps médians normaux de reprise hématopoïétique attendus suite à la transplantation d’une unité de sang de cordon. Bien que le but de cette étude, qui était d’accélérer ces paramètres, n’ait pas été atteint, plusieurs observations intéressantes ont été documentées. Par exemple, la reprise hématopoïétique a été le fruit de la production des cellules de la part des deux unités et celle-ci a pu s’étendre jusqu’à quatre mois. Le patient n’a pas ressenti de symptômes de la maladie du greffon contre l’hôte. De plus, la sécurité et la faisabilité de cette méthode ont été confirmées. Une étude à plus grande échelle a testé cette méthode chez une vingtaine de patients [64]. Le temps médian pour la reprise de neutrophiles chez les patients greffés avec les cellules issues de deux unités de sang de cordon a été de 23 jours. Pour la majorité des patients, une seule des unités a été responsable de la reprise hématopoïétique après la troisième semaine. Pour les autres, le quart des patients, les cellules produites ont été issues des deux unités. Par contre, à partir de 14 semaines, une seule unité a perduré chez tous les patients. Un effet bénéfique à court terme de la part de l’unité qui s’estompe pour la
production de cellules par l’unité qui demeure a été suggéré. De plus, l’incidence de la maladie du greffon contre l’hôte a été similaire que lors de la transplantation d’une unité de sang de cordon et a semblé être liée aux niveaux élevés de cellules CD3+ (lymphocytes T) [65] infusées. Ces études ont permis d’approfondir les connaissances sur la transplantation provenant de deux donneurs et sur la compatibilité en antigènes leucocytaires humains, pourtant les reprises hématopoïétiques n’ont pas été accélérées.
1.5EXPANSION CELLULAIRE EX VIVO
Dans le but d’augmenter la dose de cellules transplantées, celles-ci peuvent être cultivées pour permettre leur expansion. Plusieurs moyens ont été mis en place, visant soit l’expansion des CD34+ ou d’une lignée cellulaire particulière et utilisant différentes méthodes comme les cocktails de cytokines optimisés ou la surexpression de protéines.
Une équipe a voulu testé l’effet de l’expansion ex vivo sur la transplantation, tout en conservant l’effet des cellules non-expansionnées. Pour éviter d’utiliser deux unités de sang de cordon par patient, les cellules CD34+ d’une unité ont été séparées en deux parties, l’une pour l’expansion et l’autre infusée sans autre manipulation. Au jour zéro, les patients ont reçu la partie non-manipulée de leur unité de sang de cordon alors que l’autre partie a été mise en culture pour 10 jours en présence de grandes concentrations de stem cell factor (SCF) , de G-CSF et de megakaryocyte growth and development factor (MGDF). Le SCF est une cytokine impliquée dans la régulation des lignées hématopoïétiques [66] et le MGDF est une molécule hautement similaire à la TPO. À la fin de ces dix jours de culture (jour 10), les cellules cultivées leur ont été injectées à leur tour. La culture des cellules en milieu favorisant le renouvellement des CD34+ a permis une expansion de 56 fois des cellules nucléées totales et de quatre fois des CD34+. Une reprise hématopoïétique a été
obtenue chez la plupart des patients, pourtant aucune accélération de celle-ci n’a été démontrée. Cette étude a permis de montrer que l’expansion des cellules CD34+ préalablement à leur transplantation était sécuritaire et effective [67]. Pourtant, avec le nombre de cellules déjà limitant, cette alternative a accentué le problème. La perspective de
développer une thérapie cellulaire qui permettrait de pallier plus rapidement le retard de la reprise hématopoïétique est devenue dès lors plus qu’envisageable.
À son tour, l’équipe de McNiece a testé l’expansion des CD34+ pour la transplantation. Cette fois, à partir de cellules souches mobilisées autologues, une portion de celles-ci n’a pas été manipulée et l’autre cultivée 14 jours. Le milieu de culture contenait les mêmes cytokines aux mêmes concentrations que dans l’étude précédente (SCF, G-CSF et MGDF). Les cellules ont été transplantées aux patients à une journée d’intervalle (expansionnées au jour zéro et non-manipulées le lendemain). Certains patients n’ont reçu que les cellules expansionnées et ont montré une reprise de neutrophiles plus tardive que ceux ayant reçu les deux types de cellules (médianes de 8 et 6 jours respectivement) [68].
Plus tard, la double transplantation de sang cordon a été améliorée par l’expansion d’une de ses unités. En effet, des patients ont reçu les deux unités la même journée, les cellules expansionnées ont été cultivées 14 jours au préalable en présence de SCF, de G-CSF et de TPO pour obtenir une expansion de 400 fois des cellules nucléées totales et de 20 fois des cellules CD34+. En guise de contrôles, des patients ont reçu deux unités non-manipulées. Une accélération de la reprise des neutrophiles a été observée chez les patients ayant reçu l’unité expansionnée (médiane de récupération des neutrophiles de 7 jours comparé à 14 jours pour les patients ayant reçu deux unités non-manipulées). Cette étude a donc pu montrer que la co-transplantation de cellules de sang de cordon expansionnées et non-expansionnées apporte une prise de greffe à long terme et améliore la reprise des neutrophiles [69].
De façon intéressante, après un suivi à long terme des patients, seule l’unité non-manipulée a été retrouvée chez les patients. Les cellules expansionnées n’ont donc pas été en mesure s’installer dans la moelle pour y produire des cellules à long terme. Ce résultat vient appuyer les observations qui avaient été faites lors des premières transplantations de deux unités de sang de cordon. Lors de celles-ci, une unité prenait le dessus sur l’autre et produisait les cellules hématopoïétiques à long terme [64]. L’unité expansionnée a donc été éliminée et celle qui n’avait pas été manipulée a pu fournir la
reprise hématopoïétique à long terme. Pourtant, l’accélération de la reprise des neutrophiles seulement chez les patients ayant reçu des cellules expansionnées montre l’effet bénéfique qu’elles apportent.
Par ailleurs, des cellules souches mobilisées de sang périphérique ont été expansionnées et transplantées à des patients. L’infusion de cellules expansionnées seulement n’a pas permis l’obtention de prise de greffe chez les patients, et ce, malgré la présence de cellules CD34+ et de cellules de repopulation à long terme (long term
repopulating cells in cell infusions) [70]. Il est connu que les cellules expansionnées
peuvent présenter des défauts de migration jusque dans la moelle [71, 72]. Cela pourrait expliquer l’incapacité de celles-ci à produire la reprise hématopoïétique souhaitée.
À la lumière de ces résultats, la combinaison des deux types de cellules est devenue une voie à exploiter; la partie expansionnée permettant une reprise rapide des cellules en circulation, protégeant ainsi le patient des infections et des hémorragies; et la partie non-expansionnée qui soutient la production des cellules hématopoïétiques plus tardivement, mais à long terme. Les progrès ont été concentrés surtout sur la reprise des neutrophiles qui s’est vue passer de trois semaines à une seule. Pourtant, la reprise plaquettaire a été plus ou moins considérée et aucune stratégie d’expansion n’a permis son accélération, d’où l’importance de mon projet qui met en valeur une approche différente pour l’expansion.
1.5.1DIFFÉRENTES APPROCHES EXPLOITÉES
Comme l’expansion des cellules progénitrices a montré un potentiel d’accélération de la reprise hématopoïétique, l’optimisation de celle-ci s’est vue devenir un sujet chaud dans le domaine de la transplantation de cellules souches. Le but premier est de réussir à produire plus de cellules CD34+ et de cellules nucléées totales à partir d’une unité de sang de cordon. Néanmoins, d’autres facteurs jouent un rôle important dans cette expansion; le temps de culture, les coûts reliés à celle-ci (milieux de culture, appareils spécifiques), la perspective de transplanter ces cellules à des humains (transfert de gène,
surexpression de protéines), etc. Plusieurs voies ont donc été explorées pour optimiser l’expansion des CD34+.
De nombreux cocktails de cytokines favorisant l’expansion des CD34+ ont été optimisés pour l’expansion spécifique des progéniteurs et cellules souches hématopoïétiques. Ceux-ci prônent l’utilisation de cytokines à action précoce telles que le SCF, le FMS-like tyrosine kinase 3 ligand (FL), la TPO, des interleukines (IL) et le G-CSF, entre autres [73]. Il a été montré que les cellules souches peuvent être gardées en culture pendant six mois en présence de TPO et de SCF seulement [74]. Pourtant, des études ont montré que les cultures à plus long terme provoquaient l’épuisement des cellules souches hématopoïétiques [75, 76]. De plus, une culture à long terme implique une charge de travail et des coûts significatifs. Les efforts ont donc plutôt été concentrés vers l’obtention d’un système de culture de courte durée. Par exemple, la culture des CD34+ de sang de cordon en présence de SCF, de FL et de TPO sur deux semaines a montré une accélération de l’expansion lorsque l’IL-3 est ajouté en début de culture seulement [77]. Il n’en est pas moins qu’il est difficile de créer un cocktail de cytokines permettant une forte expansion des CD34+ sans toutefois que celles-ci se différencient. L’optimisation de cocktails de cytokines a donc rapidement atteint un plateau et d’autres approches ont été exploitées pour parvenir à cette fin. Les paragraphes suivants dressent un portrait de certaines de ces voies exploitées.
Pour améliorer le rendement en CD34+ lors de la culture, la voie de Notch a été étudiée. Notch est un récepteur membranaire retrouvé, entre autres, sur les cellules CD34+. L’expression constitutive de celui-ci augmente l’autorenouvellement des cellules capables de repopulation. En cultivant les CD34+ en présence du ligand de Notch, une augmentation des cellules progénitrices a été remarquée ainsi qu’une meilleure prise de greffe dans les souris NOD/SCID. En phase clinique, cette étude a été la première présentant une prise de greffe rapide rapportée chez des patients ayant reçu seulement des cellules expansionnées
L’utilisation de produits chimiques a aussi été étudiée dans ce but. En effet, le tetraéthylenepentamine (TEPA) a été reconnu pour favoriser l’expansion des progéniteurs hématopoïétiques plutôt que celle des différentes lignées [79]. Grâce à l’ajout du TEPA dans les cultures de CD34+ sur trois semaines, une expansion moyenne de 219 fois pour les cellules nucléées totales et de 6 fois pour les CD34+ ont été obtenues. Lors de la phase clinique, il a été montré que les cellules expansionnées en présence de TEPA peuvent être infusées à des patients de façon sécuritaire [80].
Une autre façon de favoriser l’expansion des CD34+ est de surexprimer ou sousexprimer une ou des protéines. Par exemple, HOXB4 fait partie d’une famille de facteurs de transcription qui régulent l’hématopoïèse. Sa surexpression dans les cellules CD34+ en culture provoque une meilleure croissance des cellules plus primitives. Dans un modèle de souris NOD/SCID, le nombre de cellules totales retrouvées chez les souris est similaire chez les souris ayant reçu des cellules expansionnées avec ou sans surexpression de HOXB4. Cependant, la proportion de cellules CD34+ est plus importante avec la surexpression de HOXB4 [81]. Ceci permet de supposer que cette expansion pourrait avoir des effets bénéfiques chez les humains.
De plus, comme les avenues expliquées n’utilisent pas toutes les mêmes voies d’activation, il est parfois possible de combiner des thérapies pour obtenir un meilleur résultat. Par exemple, des CD34+ surexprimant HOXB4 ont été cultivées en présence du ligand de Notch. Grâce à la combinaison de ces deux méthodes, une expansion supérieure des cellules menant aux lignées lymphoïdes et myéloïdes a été obtenue dans un modèle animal [82].
Malgré les avancées obtenues grâce aux différentes voies explorées, la reprise hématopoïétique tarde encore, surtout concernant les plaquettes. Les recherches concernant chacune de ces voies d’amélioration d’expansion des CD34+ sont toujours actives pour permettre une meilleure compréhension des mécanismes d’action, mais aussi pour mettre au point d’une thérapie cellulaire mettant pleinement à profit les cellules souches hématopoïétiques issues du sang de cordon ombilical.
1.6OPTIMISATION DE L’EXPANSION DES PROGÉNITEURS MÉGACARYOCYTAIRES EX VIVO
La reprise des neutrophiles a pu être améliorée grâce aux méthodes d’expansion cellulaire présentées [68], pourtant une reprise plus rapide des plaquettes n’a pas été démontrée avec des cellules de sang de cordon ombilical. Des équipes ont développé des approches visant à favoriser la voie mégacaryocytaire pour s’attaquer à ce problème. La thérapie cellulaire proposée par notre équipe promeut l’expansion des progéniteurs de mégacaryocytes afin de permettre une plus grande production de plaquettes à court terme.
1.6.1TRANSPLANTATION DES PROGÉNITEURS MÉGACARYOCYTAIRES EXPANSIONNÉS EX VIVO
L’équipe de Bertolini a été la première à montrer qu’il était sécuritaire et faisable d’infuser des progéniteurs mégacaryocytaires à des patients lors de transplantations autologues de cellules souches mobilisées du sang périphérique [83]. À partir des cellules CD34+ issues de la leucaphérèse respective de chaque patient, 10% des cellules recueillies a été mis en culture sept jours en présence du cocktail de cytokines optimisé par leur équipe pour l’expansion des progéniteurs de mégacaryocytes. Ce cocktail contenait plusieurs cytokines, en plus de la TPO, du SCF et du FL. Les cellules CD34+ non-expansionnées (90%) des patients ont été congelées jusqu’au jour de la transplantation. Tout d’abord, il a été possible d’obtenir des progéniteurs mégacaryocytaires à partir des cellules de tous les patients. De plus, l’infusion de ces cellules cultivées ex vivo n’a causé aucun effet négatif notable montrant ainsi la sûreté de la méthode. Enfin, alors que la totalité des patients du groupe contrôle (recevant seulement les cellules non-expansionnées) ont reçu des transfusions de plaquettes, 20% des patients ayant reçu les progéniteurs mégacaryocytaires n’en ont pas ressenti la nécessité. Par surcroît, ces patients étaient ceux qui avaient reçu les doses les plus élevées de cellules expansionnées, ce qui suggère qu’un effet bénéfique pourrait être obtenu grâce à des doses plus élevées de celles-ci.
Comme c’est avec les cellules de sang de cordon que la thrombocytopénie est la plus prononcée, l’expansion des progéniteurs mégacaryocytaires y serait encore plus bénéfique avant la greffe. En 2003, une équipe a étudié ce principe pour l’appliquer au cas
des cellules de sang de cordon [84]. Le système de culture développé consistait en; une première phase d’expansion des cellules progénitrices de quatre semaines en présence de TPO, de SCF et de FL suivie d’une sélection des CD34+, puis d’une phase de différenciation vers les progéniteurs mégacaryocytaires (TPO, SCF avec ou sans IL-6 et -3) ou; une phase de différenciation seulement. Il a été démontré, dans un modèle de souris NOD/SCID, que ces méthodes de culture permettaient une reprise plaquettaire chez les souris dès le troisième jour. Cependant, lorsqu’incubées avec la TPO et le SCF pour la phase de différenciation, les cellules ayant été cultivées pendant quatre semaines avant la phase de différenciation n’ont pas soutenu la production de plaquettes à long terme alors que cela a été le cas des cellules ayant été cultivées pour la différenciation seulement (jusqu’à quatre semaines). Ces résultats ont suggéré que les expansions courtes, malgré un nombre de cellules plus faible, pourraient avoir un meilleur impact que celles à plus long terme. De plus, les conclusions tirées ont été différentes dans les modèles murins que celles attendues en observant les résultats in vitro. Cela montre l’importance du modèle animal dans ce domaine d’étude.
Des études subséquentes de transplantations de cellules CD34+ de sang de cordon dans des souris NOD/SCID ont aussi montré des résultats encourageants. Après une culture de 10 jours en présence de TPO, les cellules expansionnées ont permis la détection d’une production de plaquettes chez les souris plus rapide (jour cinq) que les cellules non expansionnées (jour huit) [85]. Ces productions de plaquettes ont perduré jusqu’à six semaines et le nombre de cellules humaines retrouvées dans la moelle après six semaines a été similaire pour les deux types de cellules montrant que l’expansion ne semble pas avoir d’effet négatif sur la prise de greffe à long terme. Par ailleurs, une équipe a comparé des cultures de sept jours dans un milieu sans sérum en présence de TPO additionnées ou non de différentes concentrations de SCF, de FL et d’IL-6 [86]. L’avantage de cultiver les cellules dans un milieu sans sérum est de faciliter la translation des méthodes vers leur utilisation clinique et d’éliminer les variations possiblement produites par la fluctuation de la composition des lots [87]. Les résultats ainsi obtenus sont donc plus garants d’être retrouvés à grande échelle et en conditions contrôlées. Avec cette méthode de culture, des plaquettes humaines ont été observées dans la circulation sanguine des souris NOD/SCID
jusqu’à huit semaines et plus efficacement avec les cellules cultivées avec la TPO seulement. La prise de greffe a aussi été permise avec ces cellules.
1.6.2OPTIMISATION DU COCKTAIL POUR LES PROGÉNITEURS MÉGACARYOCYTAIRES
L’approche prise par l’équipe des cellules souches chez Héma-Québec a aussi été de favoriser l’expansion dans la voie mégacaryocytaire. L’élaboration de cette thérapie cellulaire se base exclusivement sur l’optimisation de cocktail de cytokines et des conditions de culture. Les études ont été effectuées avec un milieu de culture sans sérum. Les recherches en ce sens ont débuté en 2003 pour finalement arriver à la mise au point deux cocktails de cytokines ayant leurs avantages spécifiques dans l’expansion de la voie mégacaryocytaire.
Dans une première étude, [88] l’équipe a développé un système de culture qui stimule préférentiellement l’expansion des mégacaryocytes. Plusieurs cytokines, facteurs de croissance et interleukines (IL) ont été étudiés en combinaison pour élaborer ce protocole de culture. La TPO, cytokine la plus reconnue pour réguler la production de plaquettes, faisait partie du lot, ainsi que le FL, le SCF et les IL-3 et -6, chez qui une activité dans le développement mégacaryocytaire avait été démontrée [89, 90]. Les résultats des cultures de 17 jours dans un milieu sans sérum ont démontré que la TPO à elle seule ne peut maintenir activement le développement mégacaryocytaire et que d’autres cytokines peuvent promouvoir celui-ci en l’absence de la TPO. Par la suite, les cultures avec différentes combinaisons de ces cytokines ont donné une fréquence en mégacaryocytes supérieure à celle obtenue avec la TPO seulement. La meilleure d’entre elles a été étudiée plus amplement (TPO, SCF, FL, IL-6). Ces cytokines ont été testées à différentes concentrations pour enfin déterminer que l’expansion des populations non-mégacaryocytaires est meilleure en présence de faibles concentrations de SCF et de FL. L’expansion mégacaryocytaire optimale, obtenue grâce à la TPO, nécessite aussi l’action de cytokines telles que le SCF et le FL qui agissent sur toutes les lignées hématopoïétiques.
Grâce à cette étude, les connaissances concernant la culture in vitro des plaquettes ont été enrichies. Tout d’abord, les cellules cultivées seulement avec la TPO produisent des mégacaryocytes à haute pureté, mais à faible rendement. D’un autre côté, l’ajout de
cytokines ne prévalant pas la différenciation améliore cette expansion, mais aussi celles des autres lignées cellulaires diminuant ainsi la pureté en mégacaryocytes. Un compromis entre ces deux principes a été envisagé pour obtenir une meilleure expansion des mégacaryocytes tout en conservant leur pureté.
Afin d’y parvenir, la deuxième phase (à partir du jour sept jusqu’au jour 14) d’un système de culture a été optimisée. En utilisant plusieurs approches de conception expérimentale, l’effet individuel et interactif de plusieurs cytokines sur les rendements des cultures des cellules souches de sang de cordon a été étudié [91]. Initialement, treize cytokines ont été testées pour leur action sur le ratio d’expansion des mégacaryocytes. En confirmant ces résultats avec une méthode plus spécifique, une synergie entre le SCF et le FL pour l’expansion des mégacaryocytes immatures a été démontrée ainsi que l’apport positif du SCF, du FL et des IL-6 et -9. Par la suite, l’optimisation des concentrations de TPO, de SCF et d’IL-6 et -9 a été faite. La concentration optimale a été déterminée pour chaque cytokine en visant, lorsque comparé à la culture contrôle (TPO), une pureté en mégacaryocytes au moins égale, un meilleur rendement en mégacaryocytes matures et une utilisation moindre de cytokines. Le cocktail de cytokines conçu (TPO 30 ng/ml, SCF 1 ng/ml, IL-6 7,5 ng/ml et IL-9 13,5 ng/ml), appelé Best Settings 1 (BS1), a été testé en culture et montre bel et bien les propriétés attendues quant au rendement en mégacaryocytes et à leur pureté.
Plus récemment, les efforts ont été concentrés sur l’élaboration d’un cocktail de cytokines qui favoriserait l’expansion des progéniteurs mégacaryocytaires tout en maintenant celles des CD34+ et des progéniteurs myéloïdes [92]. Les effets individuels et synergiques de six cytokines ont donc été caractérisés par analyse de design factoriel. Il a été démontré que le SCF interagit fortement avec plusieurs des cytokines étudiées (FL et les IL-3, -6 , -9 et -11). L’optimisation des concentrations des cytokines retenues pour leurs interactions positives a été faite par une analyse de réponse de surface par central
composite design. Enfin, un cocktail de cytokines maintenant l’expansion des cellules
progénitrices ainsi que des CD34+ tout en améliorant l’expansion des progéniteurs
ne comporte que trois cytokines, la TPO (35 ng/ml) et le SCF (10 ng/ml) à leur concentration optimale pour l’expansion mégacaryocytaire et le FL, dont la présence à 1 ng/ml est suffisante pour l’expansion mégacaryocytaire, a pourtant été concentré à 11 ng/ml pour l’amélioration de l’expansion des CD34+. Enfin, grâce à ce cocktail, l’expansion des progéniteurs mégacaryocytaires s’est vue améliorée de 30% tout en réduisant l’utilisation de cytokines de 85% comparé à un cocktail contrôle fréquemment utilisé dans les essais cliniques pour l’expansion de cellules souches ex vivo. De plus, lors de son utilisation pour la culture de cellules souches et de leur transplantation dans les souris NSG, il a été permissif à la reprise plaquettaire à court et à long terme [92].
Grâce à cette connaissance des interactions entre les diverses cytokines agissant sur les lignées hématopoïétiques et plus particulièrement celle des mégacaryocytes ainsi qu’à l’élaboration des cocktails de cytokines et des systèmes de culture pour l’expansion des progéniteurs mégacaryocytaires, les études ont pu aller de l’avant vers la validation en modèle animal.
1.6.3IMPORTANCE DU MODÈLE ANIMAL DE XÉNOTRANSPLANTATION
Avant de pouvoir étudier l’effet d’une thérapie donnée chez les patients, il est nécessaire de la tester dans un modèle animal. Bien que les résultats souhaités soient obtenus in vitro, le succès dans un système physiologique n’est pas assuré. La souris est un animal amplement utilisé dans le domaine immunologique. Pour la transplantation de cellules souches hématopoïétiques, le modèle doit être en mesure d’accepter les cellules humaines et de permettre leur migration dans la moelle pour produire un système hématopoïétique humain chez celui-ci. En 1983, un modèle de souris affectées par l’immunodéficience combinée sévère (severe combined immunodeficiency, SCID) a été mis au point [93]. Par la suite, plusieurs mutations à partir de ce modèle ont pu être ajoutées pour le rendre plus permissif à la xénotransplantation [94]. Les modèles NOD/Shi-scid et NOD/LtSz-scid (non-obese diabetic) ont été particulièrement utilisé, jusqu’à la démonstration d’une activité résiduelle des cellules natural killer, ce qui empêchait une xénotransplantation optimale. Le modèle actuellement privilégié (NOD/SCID IL2Rgnull, NSG) a été muté sur le gène codant pour la chaîne gamma