ISOMÉRISATION DU LACTOSE EN LACTULOSE
PAR ÉLECTRO-ACTIVATION
Mémoire
Marc Gimenez Vidal
Maîtrise en génie agroalimentaire
Maître ès sciences (M. Sc.)
Québec, Canada
© Marc Gimenez Vidal, 2013
iii
Résumé
Dans le présent travail, l’électro-isomérisation du lactose en lactulose a été étudiée. Les variables indépendantes mises à l’étude dans ce projet sont : 1) l’effet de la concentration du lactose (5 et 10%), l’effet de la densité du champ électrique appliqué au réacteur d’électro-activation (100 et 200 mA). L’électro-isomérisation du lactose à 5% a été également comparée à celle observée dans du lactosérum ayant une concentration de lactose 5%. Les variables réponse principales (variables dépendantes) mises à l’étude étaient le taux de conversion du lactose en lactulose, le taux de formation de sous-produits de la réaction et l'efficacité du procédé exprimée en termes de résistance électrique globale du système d’électro-activation. Une surface totale de l’aire cathodique de 21,5 cm2 a été utilisée, donnant ainsi des densités de courant électrique de 4,65 et 9,30 mA/cm2, respectivement. Les analyses statistiques des données obtenues ont montré que l’effet du temps d’électro-activation sur le taux d’électro-isomérisation du lactose (rendement de formation de lactulose) ainsi que la résistance électrique du réacteur électro-activation était significatif. Le processus d’électro-activation a été réalisé pendant 60 min et des échantillons ont été prélevés chaque 10 min. Les résultats obtenus ont montré la grande efficacité de l'électro-activation, en tant qu’approche novatrice, pour transformer le lactose en lactulose. Après 60 min d’électro-activation à température ambiante (23 1 C), 25% de rendement d’électro-isomérisation a été obtenu. En excluant le lactose, la pureté du produit final était de 96,28 0,18%. En outre, aucune formation d’epilactose n’a été observée. De façon non systématique, du galactose a été détecté dans certains échantillons (<1,5%) et seulement quelques traces de fructose ont été observées (<0,31%). La résistance électrique globale du réacteur d’électro-activation diminuait avec l’augmentation du temps d'électro-activation, indiquant une grande efficacité énergétique de cette nouvelle technologie d’isomérisation du lactose en lactulose.
v
Abstract
In the present work, electro-isomerization of lactose into lactulose has been studied. Effects of lactose concentration (5 and 10%) and applied DC-electric field (100 and 200 mA) on the electro-isomerization of lactose into lactulose and on process efficiency were investigated. Total cathode area of 21.5 cm2 was used; giving electric current density of 4.65 mA/cm2 and 9.30 mA/cm2, respectively. Milk whey permeate (4.7 0.15% lactose) obtained by ultrafiltration was also used as feed solution in the electro-activation reactor. The effect of processing time on lactose electro-isomerization rate (lactulose formation yield), by-product (glucose, galactose, epilactose and fructose) formation, and global electric resistance of the electro-activation reactor has been investigated. The process was run during 60 min and samples were taken every 10 min. Obtained results showed the high effectiveness of the developed electro-activation technology to convert lactose into lactulose. After 60 min activation at ambient temperature (23 1 C), 25% electro-isomerisation yield was obtained. By excluding lactose, the end product purity was 96.28 0.18%, which is similar to the pharmakopoeia requirements for lactulose powder. Moreover, no epilactose was formed. Not systematically, galactose was detected in some samples (<1.5%) and only some traces of fructose were detected (<0.31%). The global electric resistance of the electro-activation reactor decreased as the electro-activation time was increased indicating the high energetic effectiveness of this new electro-isomerization technology.
vii
Remerciements
Mes remerciements s’adressent en particulier à mon directeur de recherche,
Monsieur Mohammed Aider, pour les précieux conseils qu’il a bien voulu me
fournir afin de bien réaliser ce travail. Il est toujours prêt à l'écoute et très
disponible tout au long de la réalisation de ce mémoire. Je le remercie
également pour l'inspiration, l'aide et le temps qu'il a bien voulu me consacrer
et sans qui ce mémoire n'aurait jamais été possible.
J’exprime aussi mes sincères reconnaissances à tous mes enseignants de
l’Université Laval, pour leurs efforts fournis pendant toute la période d’étude,
ainsi qu’à tous ceux qui ont collaboré, d’une façon ou d’une autre, à
l’élaboration de ce travail.
Je remercie aussi Monsieur Eduard Lorda du Service de Projets Européens et
Internationaux de l’agence Catalane AGAUR qui, avec son aide, a permis que
je puisse poursuivre ce projet à l’Université Laval.
Finalement, je veux exprimer mes sincères remerciements et ma gratitude à
toutes les personnes qui m’ont apporté l’aide et l’assistance nécessaire à
l’élaboration de ce travail.
ix
Dédicaces
À ma très chère mère Carme.
Tu es l'exemple de dévouement qui n'a pas cessé de
m'encourager.
À mon père Xavier.
Ton soutien a toujours été un puissant pilier pour continuer
mon travail. Merci pour les efforts fournis jour et nuit pour
m’aider à réussir mon projet.
À mes sœurs; Emma et Julia.
Vos mots d’encouragement ont permis de me reprendre
pendant les moments difficiles.
À la mémoire de mes grands parents; Armando et Isabel.
Je suis certain que, même si vous n’êtes plus ici, sans vous je
n’aurais jamais réussi à arriver jusque là.
À mes amis; Mariano, José Enrique, Tomás, Xavi, Pol, Hans,
Vénétia, Didier, Queralt, Marta et Guillem.
Je vous remercie de votre patience, vous m'avez aidé toujours à
avancer. Toujours à côté de moi même si vous êtes loin. Vous
êtes tous des grands amis.
Et à beaucoup d’autres; amis, professeurs, famille. Vôtre nom
ne figure pas dans la liste mais vous avez été aussi une partie
importante de cette expérience.
xi
Avant-Propos
Ce mémoire de maîtrise, portant le titre « Isomérisation du lactose en lactulose par
électro-activation », est composé de trois chapitres principaux. Le premier chapitre est une
revue bibliographique détaillée qui présente les notions de base sur le lactulose, son utilisation dans l’industrie alimentaire et pharmaceutique et les principes sur lesquels sont basés les procédés industriels utilisés dans sa production. La revue bibliographique a permis d’identifier les principaux inconvénients des méthodes actuellement utilisées pour la production du lactulose. Elle a permis également d’identifier, pour la première fois, le potentiel de l’électroactivation qui est un principe basé sur l’électrochimie appliquée dans la synthèse autocatalytique du lactose à partir du lactose. Le deuxième chapitre fait l’objet de l’hypothèse de recherche sur laquelle est basé le présent projet de maîtrise, l’objectif principal de recherche et les objectifs spécifiques qui permettront de vérifier la validité de l’hypothèse de recherche. Quant au troisième chapitre, il est inséré sous forme d’un article scientifique rédigé en anglais et qui a été soumis pour publication dans Innovative Food
Science and Emerging Technologies, 16 (2012) p 163-170 sous le titre: « Lactulose synthesis by electro-isomerization of lactose: effect of lactose concentration and electric field current density ».
Le présent mémoire de maîtrise comporte une liste de références bibliographiques pertinentes au présent projet de recherche et une conclusion générale qui fait la synthèse de la problématique du sujet traité dans cette maîtrise, des principaux résultats obtenus et de certaines perspectives de recherche pour maximiser l’utilisation du potentiel de l’électro-activation en solution en tant que technologie novatrice pour une production rationnelle et peu coûteuse du lactulose.
xiii
Table des matières
Résumé ... iii
Abstract ... v
Remerciements ... vii
Avant-Propos ... xi
Table des matières ... xiii
Liste des tableaux ... xvii
Liste des figures ... xix
INTRODUCTION ... 1
CHAPITRE 1 : REVUE DE LITTÉRATURE ... 3
1.1 Mise en contexte ... 3
1.2 Généralités sur le lactulose ... 3
1.2.1 Statut actuel du lactulose ... 3
1.2.2 Mecanismes d’action du lactulose ... 5
1.2.3 Applications du lactulose dans l’industrie alimentaire ... 6
1.2.4 Applications du lactulose dans l’industrie pharmaceutique ... 8
1.3 Production classique du lactulose ... 11
1.3.1 Aspects théoriques de la production chimique du lactulose ... 11
1.3.2 Isomérisation alcaline ... 13
1.3.3 Particularités de l’isomérisation du lactose par l’hydroxyde de sodium et du calcium ... 14
1.3.4 Isomérisation du lactose par les sulphites et les phosphates ... 15
1.3.5 Isomérisation du lactose par des sépiolites ... 16
1.3.6 Isomérisation du lactose par aluminates et borates (isomérisation alcaline avec agents complexants) ... 17
1.3.7 Effet de la concentration de lactose ... 18
1.3.8 Effet de la concentration de lactose et du catalyseur sur le pH de la solution ... 19
1.4 Nouvelle approche pour la production du lactulose ... 21
xiv
1.4.2 Production de lactulose par des résines d’échange ionique ... 23
1.4.3 Méthodes enzymatiques ... 23
1.4.3.1 Production de lactulose en utilisant des enzymes libres ... 24
1.4.3.2 Production de lactulose en utilisant des enzymes immobilisées ... 25
1.4.3.3 Production de lactulose en utilisant des cellules entières ... 25
1.5 L’électro-activation ... 26
1.5.1 Généralités de l’électro-activation ... 26
1.5.2 Principes ... 27
1.5.3 Applications de l’électro-activation ... 30
CHAPITRE 2 : HYPOTHÈSE ET OBJECTIFS ... 33
2.1 Formulation de l’hypothèse ... 33
2.2 Objectif principal ... 33
2.3 Objectifs spécifiques ... 34
CHAPITRE 3 : PARTIE EXPÉRIMENTALE, RÉSULTATS ET DISCUSSION ... 35
Lactulose synthesis by electro-isomerization of lactose: effect of lactose concentration and electric current density ... 36
Abstract ... 37
3.1 Introduction ... 38
3.2 Materials and methods... 41
3.2.1 Chemicals and materials ... 41
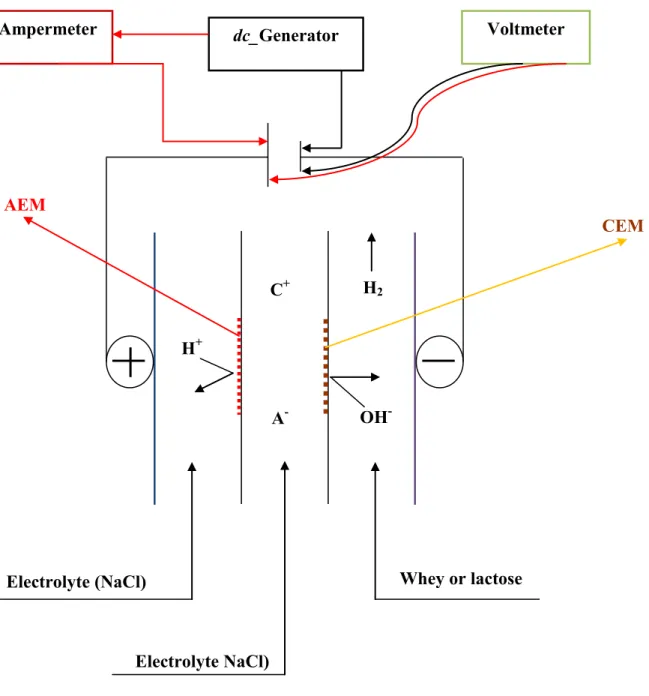
3.2.2 Electro-isomerization reactor ... 41
3.3. Protocol of the electro-isomerization ... 43
3.4. Data acquisition and analyses ... 43
3.4.1. Solution pH and conductivity ... 43
3.4.2. Global system resistance ... 44
3.4.3. Mono and disaccharides profiles ... 44
3.5. Statistical design and analysis ... 44
3.6 Results and discussion ... 46
3.6.1. Evolution of the solution pH ... 46
3.6.2. Kinetics of lactulose formation ... 49
xv
3.6.4. Electro-activation system electric resistance ... 57
Conclusion ... 59
Acknowledgments ... 59
CONCLUSION GÉNÉRALE ... 61
RÉFÉRENCES ... 63
xvii
Liste des tableaux
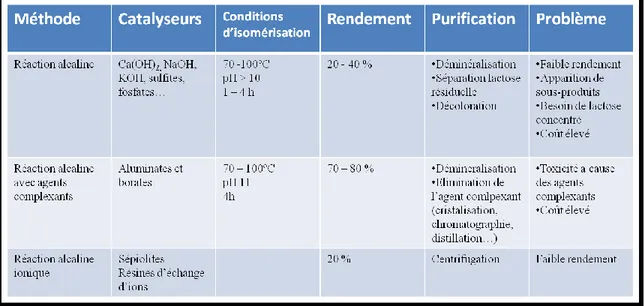
Tableau 1.1 : Résumé des principales caractéristqiues des méthodes actuellement ustilisées
pour la production du lactulose ... 22
Tableau 1.2 : Réaction de transgalatosylation par β-galactosidases pour obtenir du
xix
Liste des figures
Fig. 1.1: Représentation schématqiue de la conversion du lactose en lactulose. ... 3 Fig. 1.2: Exemple du lactulose commercial. ... 5 Fig. 1.3: Représentation schématique du mecanisme général de l’action du lactulose sur la
santé humaine. ... 6
Fig. 1.4: Conversion du lactose en lactulose par le réarrangement de Lobry de Bruyn-van
Ekenstein ... 12
Fig. 1.5: Conversion du lactose en lactulose par l’action de l’ammonium ... 12 Fig. 1.6: Evolution des provets en lien avec la production du lactulose (Riabtseva, 1992). 21 Fig. 1.7: Représentation schématique du principe de base d’un réacteur
d’électro-activation. ... 28
Fig. 2.1: Schematic representation of the electro-isomerization cell: AEM-anion exchange
membrane. CEM-cation exchange membrane. A--anion. C+-cation. ... 42
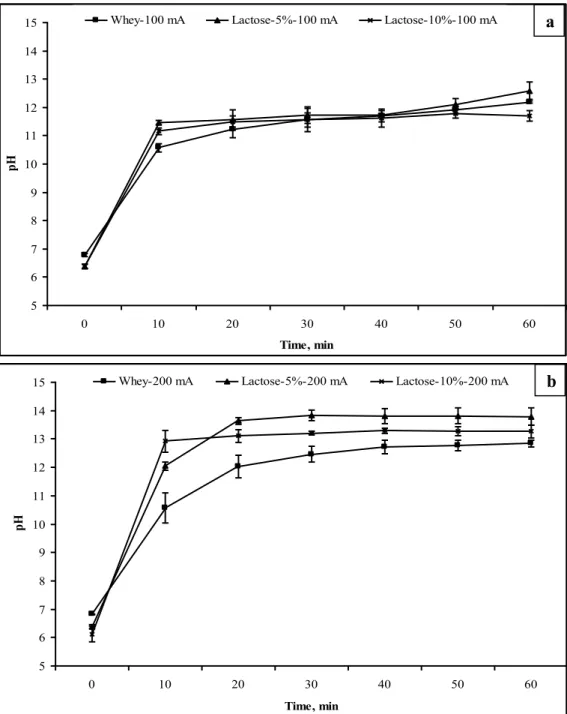
Fig. 3.1: Evolution of the solution pH at the cathodic compartment as function of time and
applied electric field. (a) I = 100 mA. (b) I = 200 mA. ... 48
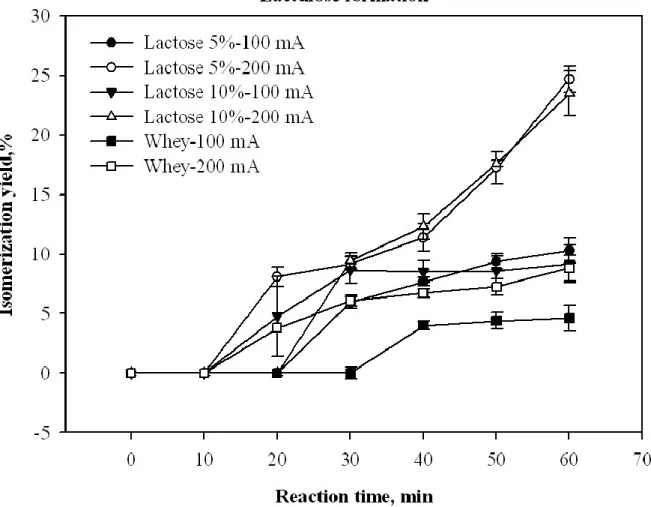
Fig. 3.2: Kinetics of lactulose formation during electro-activation of 5%,
lactose-10% and whey permeate at 100 and 200 mA applied electric field as a function of electro-activation time. ... 52
Fig. 3.3: Chromatograms of lactose-10% isomerization into lactulose at 200 mA applied
electric field. (a) at time zero. (b) after 30 min. (c) after 60 min. ... 54
Fig. 3.4: Galactose formation during lactose treatment in the electro-activation reactor. ... 55 Fig. 3.5: Fructose formation during lactose treatment in the electro-activation reactor. ... 56 Fig. 3.6: Global electric resistance of the electro-isomerization reactor as function of time
1
INTRODUCTION
Le lactulose est un diholoside synthétique largement employé dans l’industrie pharmaceutique, nutraceutique et dans l’industrie de l’alimentation à cause de ses effets bénéfiques pour la santé humaine. Il est valorisé pour son pouvoir prébiotique et ses effets thérapeutiques. On peut retrouver ce produit dans le marché sous forme de sirop ou de poudre. La technologie de production à échelle industrielle du lactulose est principalement basée sur la réaction d’isomérisation du lactose en milieu alcalin nécessitant des valeurs de pH supérieures à 9. Le lactulose est principalement connu par son effet prébiotique et laxatif. Cependant, par ses multiples applications, la demande de lactulose est croissante depuis les dernières années. Les techniques classiques de synthèse de ce produit présentent plusieurs inconvénients qui font que plusieurs études ont pour but de développer de nouvelles façons d’obtenir le lactulose. La réaction visée devrait idéalement accomplir plusieurs exigences : être une technique efficace (haut rendement de synthèse du produit), facile à manipuler, économique et éco-responsable. Le présent projet est principalement orienté à étudier et développer une approche novatrice et efficace qui permettra de satisfaire aux critères de performance mentionnés. Pour cela, nous avons choisi d’étudier la réaction d’isomérisation du lactose en lactulose par un procédé d’électro-activation. Il s’agit d’une technologie assez récente, mais qui présente déjà plusieurs avantages d’application dans différents domaines, incluant le domaine alimentaire. Dans ce projet, il a également été question d’étudier l’effet de plusieurs variables indépendantes sur le rendement de cette réaction et la qualité du produit final. La partie expérimentale, résultats et discussion, est présentée sous forme d’un article scientifique publié dans une revue internationale avec comité de lecture.
3
CHAPITRE 1 : REVUE DE LITTÉRATURE
1.1 Mise en contexte
Dans ce chapitre, nous présenterons une revue de littérature qui porte sur le lactulose et son utilisation actuelle en industrie. Ensuite, nous exposerons les nouvelles technologies applicables pour une production non chimique du lactulose. Enfin, nous clorons ce chapitre par une description de l’électro-activation et son potentiel pour pouvoir produire du lactulose dans le cadre d’une réaction chimique sans utilisation de catalyseurs.
1.2 Généralités sur le lactulose
1.2.1 Statut actuel du lactulose
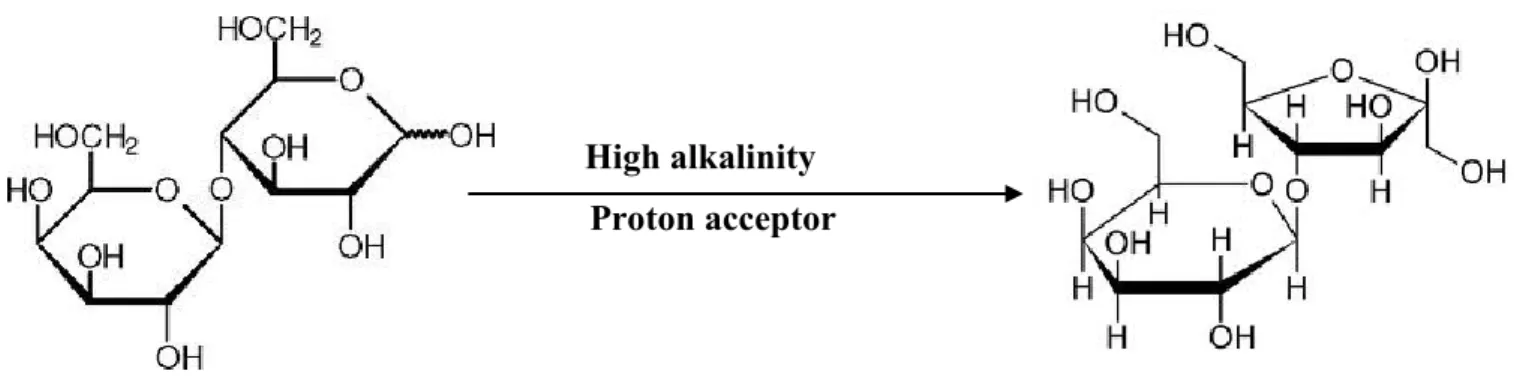
Le lactulose (4-0-β-D-galactopyranosyl-D-fructofuranose), est un disaccharide synthétique composé de deux molécules de sucre, le galactose et le fructose, qui sont liés avec une liaison de type β-1,4-glucosidique. Le lactulose est 1,5 fois plus sucré que le lactose et peut être cristallisé par une solution alcoolique. Il s’agit d’un des rares hydrates de carbone (à part du lactose) qui a un rôle important dans l’industrie laitière. Montgomery et Hudson ont obtenu pour la première fois le lactulose en 1930 par isomérisation alcaline avec de l’hydroxyde de calcium lorsqu’ils essayaient de synthétiser de nouveaux sucres cétosiques à partir d’aldoses. Depuis cette découverte, de nombreuses techniques d’isomérisation ont été étudiées pour la production de cette molécule (Fig. 1.1).
Fig. 1.1: Représentation schématqiue de la conversion du lactose en lactulose. High alkalinity
4
L’intérêt pour le lactulose a considérablement augmenté pendant les dernières années à cause de toutes les applications potentielles alimentaires et pharmaceutiques qu’il possède. La production annuelle du lactulose augmente chaque année pour satisfaire cette demande croissante. En 1994/1995 la production de lactulose estimée était de 20,000 tonnes, en 2004 elle a augmenté jusqu’à 40,000 et en 2009 les estimations étaient de 45,000 à 50,0000 tonnes (Playne et Crittenden, 2009). Le lactulose est obtenu à partir de la réaction d’isomérisation du lactose dont le lait ou le lactosérum sont très riches (Zokaee, Kaghazchi, Zare, & Soleimani, 2002).
On trouve facilement et en grande quantité la matière première pour la production de lactulose dans le marché (le lactosérum est un sous-produit de l’industrie du fromage). En 2007, on estimait une production annuelle de lactosérum dans le monde de 72 millions de tonnes en, ce qui implique 200 000 tonnes de protéines de lait et 1,2 millions de tonnes de lactose transférées au sérum chaque année. Alors que de nombreuses utilisations pour le lactosérum ont été développées, seulement une petite proportion est utilisée comme ingrédient pour la nutrition humaine et animale (Kosaric & Asher, 1982).. En 1998, environ 137,9 millions de tonnes de lactosérum sont produites au monde (Ghaly, Ramkumar, Sadaka, et Rochon, 2000). Dans le cas particulier du Canada, la production annuelle de fromage a augmenté de 22% depuis 1994 jusqu’en 2004. On estimait que la production totale de fromage au Canada en 2004 était de 0,34 millions de tonnes, ce qui implique plus de 3 millions de tonnes de lactosérum produites (Ferchichi, Crabbe, Gil, Hintz, & Almadidy, 2005). Comme mentionné précédemment, même avec la multitude de développements technologiques pour la transformation de lactosérum, l’utilisation de celui-ci reste un des plus importants problèmes de l’industrie laitière (Calli & Yukselen, 2004 ; Mawson, 1994). La production de lactulose permettrait de se débarrasser de ce sous-produit de l’industrie alimentaire
Les deux plus importants producteurs de lactulose sont Solvay Pharmaceuticals et Morinaga Milk Industry. Le groupe Solvay se concentre plus vers les applications pharmaceutiques, tandis que Morinaga met plus le point vers le marché alimentaire. Le groupe Solvay produit du lactulose depuis plus de 40 ans. C’est la première entreprise à produire du lactulose au monde et aujourd’hui possède un 50% du marché. C’est le plus grand producteur de lactulose et possède des industries aux pays Bas et Canada. Fresenius
5 Kabi Austria est un autre grand producteur de lactulose pour ses applications pharmaceutique. Le lactulose que l’on retrouve sur le marché est normalement sous forme de sirop 50-72% (p/V) ou en poudre (Fig. 1.2). Il faut voir, que la grande quantité d’applications potentielles du lactulose dérive principalement de son mécanisme d’action modulateur de la flore intestinale et donc de son activité pré-biotique.
Fig. 1.2: Exemple du lactulose commercial.
1.2.2 Mecanismes d’action du lactulose
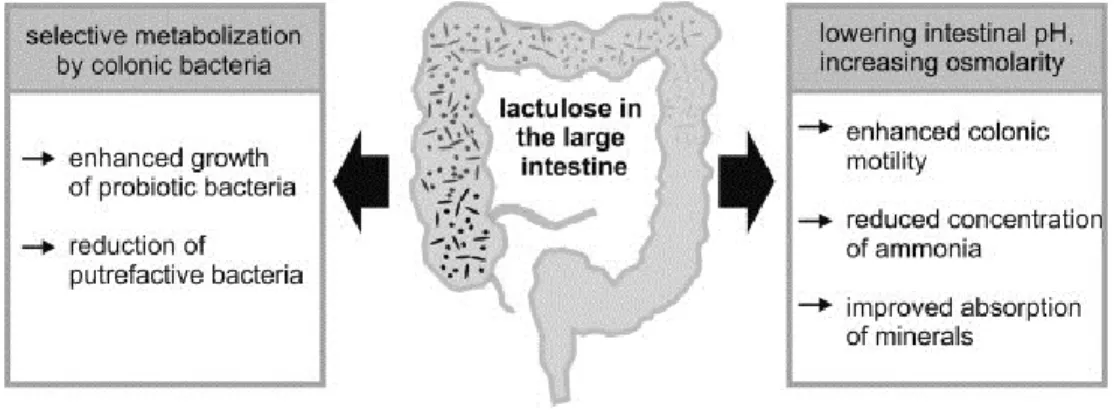
Le lien β-glucosidique du lactulose ne peut pas être hydrolysé par les enzymes digestives des mammifères (Ruttloff et al., 1967) et donc le lactulose ingéré passe à l’estomac et l’intestin grêle sans être dégradé. Ce sucre est principalement utilisé par des bactéries bénéfiques dans le tracte gastro-intestinal, comme les bifido-bactéries et les lactobacilles (Fig. 1.3). Si on considère le tracte intestinal comme un écosystème balancé qui réagit de façon sensible à son environement interne et externe, il est facile de déduire que la stimulation de la croissance de ces bactéries bénéfiques empêchera aussi l’établissement de bactéries pathogènes. C’est donc ici où réside l’important rôle pré-biotique du lactulose. Son utilisation comme source d’énergie par ces bactéries comporte la production d’acide lactique, acétique et formique et aussi de dioxyde de carbone. Ces composés reconduisent les fluides à l’intérieur de l’intestin et permettent de ramollir les excréments. L’effet combiné de tous ces processus soulage la constipation de façon effective (Schumann, 2002).
6
Fig. 1.3: Représentation schématique du mecanisme général de l’action du lactulose sur la
santé humaine.
Pour le traitement de l’encéphalopathie hépatique, le lactulose permet de « dégager » l’ammonium du corps (Paik et al., 2005). Le lactulose est métabolisé dans le colon par les bactéries qui libèreront des acides gras, ce qui comporte l’acidification du colon (Patil et al., 1987). Ceci favorise la formation de NH4+ non absorbable à partir du NH3. Le NH3 restera donc coincé dans le colon et il y aura réduction de la concentration de NH3 dans le plasma sanguin. On a vu dans des études in vitro que le lactulose présente aussi une capacité limitée de désactiver des endotoxines, mais par contre la production du facteur tumoral nécrotique par les monocytes induit par l’endotoxine est significativement réduite (Greve et al., 1990). En même temps, le lactulose peut inhiber des bactéries pathogènes comme par exemple Salmonella (Aider et de Halleux, 2007; Panesar et al., 2009).
1.2.3 Applications du lactulose dans l’industrie alimentaire
Un pourcentage élevé de la population mondiale souffre des maladies gastro-intestinales de plusieurs types. Beaucoup d’entre elles sont causées par des bactéries pathogènes qui envahissent l’intestin humain. Quelques jours après la naissance, l’intestin humain est principalement colonisé par des bifido-bactéries qui jouent un rôle très important pour maintenir la bonne santé de l’hôte. En changeant de régime alimentaire ou lors du passage de l’allaitement à la nourriture ordinaire, les bactéries pathogènes parviennent à entrer dans l’intestin humain et causer des maladies de différents types.
Afin de résoudre ce problème de santé, l’industrie alimentaire (en particulier la branche de la technologie laitière) a développé des produits laitiers enrichis avec des pro-biotiques
7 comme les lactobacilles (lactobacillus acidophilus, lactobacillus casei, lactobacillus
bulgaricus, etc.) et les bifido-bactéries (bifidobacteria bifidum, bifidobacteria longum, bifidobacteria infantilus, bifidobacteria adolescentis) (Clark & Martin, 1994 ; Donkor et
al., 2007 ; Katz, 2006 ; Ninonuevo et al. 2007 ; Olguin, et al., 2005 ; Wainwright, 2006). Cependant, cette solution n’arrive pas à mettre fin au problème à cause de plusieures raisons:
Une grande perte de cellules bactériennes pendant le procédé de production des différents produits laitiers.
Une réduction considérable du nombre total de bactéries due au stockage à des valeurs de pH inférieures à 5,5 ;
Un milieu très acide qu’est l’estomac (pH inférieur ou égal à 1,5) et un effet négatif de sels biliaires (Chou & Hou, 2000 ; lankaputhra & Shah, 1995 ; Lian et al., 2002). Une alternative pour résoudre ce problème pourrait consister à stimuler les bifido-bactéries déjà présentes dans l’intestin (Bouhnik et al., 1990 ; Delzenne, 2003 ; Gibson et al, 1995 ; Mizota et al., 1987). Cette méthode consiste à utiliser des ingrédients alimentaires avec des fonctions bifido-géniques, connus sous le nom de pré-biotiques (Kaplan & Hutkins, 2000 ; Marteau & Boutron-Ruault, 2002 ; Roberfroid, 2002 ; Saarela et al., 2003; Ziemer & Gibson, 1998). Ces ingrédients bifido-géniques stimulent la croissance des bifido-bacteries (Tamura et al., 1993). Les pré-biotiques sont définis comme ingrédients alimentaires non digérables et qui ont un effet bénéfique pour l’hôte en stimulant sélectivement la croissance et/ou l’activité de bactéries spécifiques dans le colon. Les biotiques sont principalement des oligosaccharides. Pour être considéré comme pré-biotique, un ingrédient alimentaire doit alors présenter certaines caractéristiques établies après l’étude de Gibson et Roberfroid (1995) : non digérable ni absorbable avant d’arriver au colon; être un substrat sélectif pour une ou peu de bactéries ayant un rôle bénéfique probable ou prouvé ; être capable de modifier la composition de la flore colique pour améliorer la santé en permettant l’augmentation de la croissance et/ou l’activité métabolique des Lactobacillus sp. ou des Bifidobacteria sp. (Gibson & Roberfroid, 1995); moins fréquemment diminuer la virulence de bactéries pathogènes comme Lysteria
monocytogenes (Park & Kroll, 1993). Playne et al. ont réaffirmé cette définition des
8
le lactulose est exactement conforme avec ces critères (Alander et al., 2001; Ballongue et al., 1997 ; Saarela et al., 2003). Beaucoup d’études ont prouvé l’efficacité du lactulose pour stimuler la croissance des bifido-bactéries (Martin, 1996 ; Mizota, 1996 ; Sako et al., 1999 ; Shin et al., 2000 ; Strohmaier, 1998). Le lactulose est appliqué dans une grande variété d’aliments comme facteur « bifidus » ou comme ingrédient fonctionnel pour la régulation intestinale. De plus, il peut fournir des modifications de saveur ou des caractéristiques physico-chimiques aux produits alimentaires. Ainsi, le lactulose peut être utilisé comme édulcorant pour diabétiques, dans les produits de confiserie, breuvages, lait infantile en poudre, produits de boulangerie, yaourts, desserts lactiques et dans plusieurs aliments préparés pour les personnes âgées (Cittenden et Payne, 1996; Strohmaier, 1998; Tamura et al., 1993). Le lactulose a aussi été utilisé pour augmenter la survie des souches pro-biotiques dans le yaourt (Tabatabaie & Mortazavi, 2008). La survie des souches a été suivie pendant cinq semaines à 4ºC. On a observé que Lactobacillus rhamnosus et
Bifidobacterium bifidum restent très stables et présentent une survie légèrement meilleure
en présence de lactulose. Il faut cependant voir que l’application du lactulose comme composant bénéfique se restreint à de faibles doses puisque l’ingestion de doses élevées peut causer des diarrhées.
1.2.4 Applications du lactulose dans l’industrie pharmaceutique
Dans le domaine pharmaceutique, le lactulose est principalement employé pour le traitement de la constipation et de l’encéphalopathie hépatique, pour traiter des complications de maladies du foie et de la Salmonella, pour prévention de tumeurs, par son effet d’anti-endotoxine et pour maintenir les niveaux de glucose et insuline dans le sang (Schumann, 2002). Le lactulose est une thérapie physiologique avec beaucoup de succès pour traiter la constipation. À cause de cette efficacité et non toxicité, le lactulose est employé chez les individus de tous les groupes d’âge (en passant par les enfants et les personnes âgées). Il est connu que l’effet laxatif dépend de plusieurs facteurs tels que l’état de santé, l’âge, le poids, le sexe ou la diète alimentaire (Schuster-Wolff-Bühring.R et al., 2010). En plus, les bactéries du colon présentent une adaptabilité métabolique lorsqu’elles reçoivent un apport constant de lactulose ce qui fait diminuer l’effet laxatif. Lors du
9 traitement à long terme de la constipation, il faut alors faire des réajustements lors du dosage d’ingestion de lactulose (Flourié et al., 1993).
Le lactulose est aussi employé pour traiter l’encéphalopathie hépatique (Foster et al., 2012; Paik et al., 2005; Sharma et al., 2009). Ce syndrome neuropsychiatrique est induit par des concentrations élevées de composants toxiques dans le sang comme l’ammonium. Le traitement se faisait par l’administration d’antibiotiques et réduction d’ingestion de protéines. Cependant, plus tard on a vu que l’administration de doses élevés de lactulose en petites portions permettait de traiter l’encéphalopathie hépatique sans causer de diarrhées.
Le lactulose entraîne une forte diminution du pH au côlon, ce qui rend difficile aux
Salmonella de survivre. Il a été démontré que le lactulose agit comme un puissant
pré-biotique pour les individus porteurs des Salmonella (non typhoïde) (Hoffmann, 1975). Une thérapie avec lactulose élimine les espèces fécales des Salmonella et Shigella et réduit les infections urinaires et respiratoires (Liao et al., 1994).
L’administration orale du lactulose élimine et empêche l’endotoxémie systématique d’origine intestinale. Donc, il peut être utilisé pour traiter les maladies inflammatoires de l’intestin. Les bactéries et ses endotoxines jouent un rôle important dans ces affections. L’ictère obstructif est souvent accompagné d’une translocation bactérienne et la subséquente septicémie, l’administration de lactulose peut empêcher l’endotoxémie et l’inflammation qui suit (Koutelidak et al., 2003). Le traitement par lactulose peut prévenir les complications dépendantes de l’endotoxine comme la dysfonction rénale (Özçelik et al., 1997; Pain et al., 1991). L’effet anti-endotoxine du lactulose a aussi d’importantes applications médicales contre nombreuses maladies comme le syndrome hépatorénal (Kramer, 1988), la dysfonction pancréatique exocrine (Mack et al., 1992), les diabètes mellitus (Tabatabaie et al., 1997; Yelich et al., 1992) et l’hypercholestérolémie (Liao et Florin, 1995). Le lactulose possède aussi une importante application pour diminuer le taux de glucose dans le sang (Bianchi et al., 1994). Cornell (1985) a suggéré aussi que l’endotoxine réduisait la production d’insuline pancréatique et que le lactulose possède un effet anti-diabétique.
La fermentation du lactulose par les bactéries gastro-intestinales peut produire une quantité considérable d’hydrogène qui est un protecteur antioxydant contre la colite induite par Dextran Sulfate de Sodium. Elle permet alors de réduire le stress oxydatif et
10
d’améliorer les symptômes de l’inflammation des maladies de l’intestin chez les êtres humains (Chen et al., 2011).
L’apparition du cancer de colon est le résultat de processus biochimiques qui ont lieu au lumen, muqueuse et aux tissus adjacents au gros intestin. La microflore du colon et les produits de leur métabolisme influencent donc la carcinogenèse au colon. Les bactéries pro-biotiques et les substances pré-biotiques comme le lactulose permettent donc de réduire le risque du cancer de colon (Wollowski et al., 2001).
Les bifido-bactéries jouent un rôle important dans la prévention de tumeurs. Les effets anti-tumoraux et immunologiques des bifido-bactéries peuvent être améliorés par l’ingestion de lactulose (Schumann, 1997). Le traitement préopératoire oral avec lactulose est employé pour prévenir des complications chez les patients qui doivent subir une intervention chirurgicale pour l’ictère obstructif (Greve et al., 1990).
Le lactulose est aussi employé pour la diagnose de problèmes de colon à travers le test respiratoire de l’hydrogène. Ce test consiste à administrer une dose de lactulose pour déterminer l’hydrogène exhalé pendant les heures suivantes. L’hydrogène se forme par le métabolisme du lactulose des bactéries dans l’intestin. La quantité et le temps de production d’hydrogène exhalé permettra d’évaluer le temps de transit du colon et la colonisation microbienne (Simren et Stotzer, 2006). Le test respiratoire de lactulose est aussi appliqué pour la diagnose d’une surpopulation dans l’intestin grêle, qui est caractérisée par une croissance anormale de bactéries dans cette partie de l’intestin. Dans ce cas, les bactéries ont un taux d’utilisation du lactulose et d’exhalation d’hydrogène plus élevé que celui des bactéries des individus en santé (Nucera et al., 2005).
11
1.3
Production classique du lactulose
1.3.1 Aspects théoriques de la production chimique du lactulose
Théoriquement, le lactulose peut être obtenu à partir du lactose par un regroupement du résidu de glucose vers la molécule de fructose en passant d’un aldose vers une cétose (Kochetkov & Bochkov, 1967). Le mécanisme de cette transformation peut être atteint de plusieurs façons.
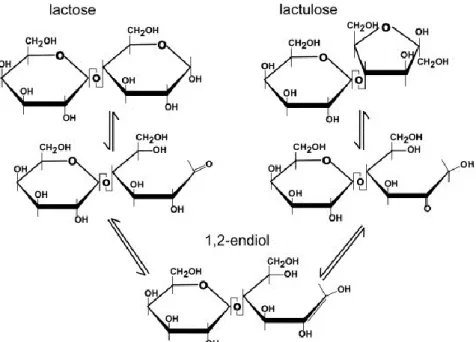
La première voie serait par la réaction de Lobry de Bruyn-van Ekenstein (Fig. 1.4) qui peut être résumée par la formation d’un intermédiaire énolique du lactose et épilactose dans un milieu alcalin, avec la transformation du glucose de la molécule de lactose en fructose, ce qui donne comme résultat la molécule de lactulose. La deuxième voie consisterait à faire réagir le lactose avec de l’ammonium ou amines (Fig. 1.5). Dans ce cas, le lactosil-amine subit un réarrangement d’Amadori vers le lactulosil-amine (Hodge, 1995) et après hydrolyse du complexe on obtient le lactulose. Actuellement, la première voie de synthèse est la technique employée industriellement pour obtenir le lactulose. Cependant, à cause du grand éventail d’applications du lactulose, de nombreux catalyseurs différents peuvent être utilisés pour essayer de trouver la façon d’obtenir un rendement plus élevé lors de la réaction d’isomérisation. L’énergie d’activation pour la synthèse du lactulose en utilisant le lactose comme matière première diffère selon l’emploi de ces catalyseurs (European Patent No 0320670, 1990; European Patent No 0339749, 1991; U.S. Patent No 5034064, 1991).
12
Fig. 1.4: Conversion du lactose en lactulose par le réarrangement de Lobry de Bruyn-van
Ekenstein
Fig. 1.5: Conversion du lactose en lactulose par l’action de l’ammonium
Un autre aspect très important qu’il faut tenir en compte c’est que pour la transformation du lactose en lactulose, la présence d’accepteurs de protons est essentielle. Il donc faudra l’utilisation de différents réactifs qui permettront d’obtenir un milieu alcalin après dissolution (European Patent No 0339749, 1991; U.S. Patent No 3814174, 1971; U.S. Patent No 5034064, 1991; U.S. Patent No 4536221, 1985; U.S. Patent No 3514327, 1970; U.S. Patent No 3546206, 1970).
Les principales méthodes et réactions contrôlant le procédé d’isomérisation du lactose en lactulose seront traitées dans ce qui suit.
13
1.3.2 Isomérisation alcaline
Le lactulose a été obtenu pour la première fois par Montgomery et Hudson en 1930 en chauffant une solution d’un mélange de lactose et de lime à une température de 35ºC pendant plusieurs jours. Pour obtenir le lactulose sous forme cristalline, il a fallu plusieurs étapes de purification postérieures. Des réactifs tels que l’acide sulfurique, le carbonate de calcium, l’éthanol, le méthanol, l’éther, le carbone actif et la bromine ont été employés. À partir de ce moment, plusieurs méthodes ont été développées pour simplifier la réaction initiale (Matvievsky, 1979; Russian Patent No 1392104, 1988; U.S. Patent No. 3272705, 1966; Yakovleva, 1963). Généralement l’hydroxyde de calcium était employé comme catalyseur de la réaction d’isomérisation. Avec cette méthode, une solution à 60% de lactose était combinée avec de l’hydroxyde de calcium à 0,1% à des températures comprises entre 100 et 102ºC, pendant 15 minutes. Après, la solution obtenue devait être déminéralisée en combinant l’électrolyse et les résines d’échange ionique, ce qui implique une méthode assez pénible. Dans un autre travail (Patent of Germany No 222468033,1976), on décrivait l’utilisation de plusieurs catalyseurs tels que Ca(OH)2, NaOH, CaO, Na2CO3, KOH, K2HPO4, Ba (OH)2 (Dalev & Tsoneva, 1982; Lodigin, 1999; Patent of Germany No 297999, 1992; Russian Patent No 2101358, 1998; Russian Patent No 97120603/13, 1999; Stomberg & Semchenko, 1999; U.S. Patent No 4264763, 1978). La génération de galactose comme sous-produit de la dégradation de disaccharides (lactose et lactulose) en
utilisant ces catalyseurs a aussi été constatée.
À partir des résultats montrés dans Patent of Germany No 222468033 (1976), on peut tirer les conclusions suivantes:
Indépendamment de la quantité de NaOH employée, il existe une dépendance linéaire entre la génération de galactose (sous-produit) et le taux de lactulose obtenu (ce qui représente le taux d’isomérisation de la réaction). Il semblerait que cette relation augmente considérablement lorsque les taux d’isomérisation sont de 21,4% ou plus.
La relation galactose/lactulose reste constante pour une même relation NaOH/lactose, indépendamment du temps d’isomérisation ou de la température.
14
À partir des ces résultats, une application industrielle pour la synthèse de lactulose a été développée (France Patent No 2147925, 1973; Patent of Germany No 222468033, 1976). Dans ce procédé, le lactulose était purifié et déminéralisé par des résines d’échange d’ions et cations. Le résultat final était un produit avec une concentration de lactulose comprise entre 42 et 48% de matière sèche. Cependant, il faut un apport d’énergie et de matériel très important même s’il s’agit d’une méthode effective.
Une autre méthode a été développée et publiée dans Russian patent No 7374626 (1980). Pour cette méthode, une solution de lactose à 15-20% était mélangée avec 0,35-0,45% d’hydroxyde de calcium pour atteindre un pH de 11. Le mélange était alors chauffé à 68-72ºC pendant 15-20 minutes. La solution finale obtenue avait un pH entre 8,8 et 9. Par la suite, la solution était neutralisée avec de l’acide citrique (jusqu’à un pH entre 5,5 et 6,5). L’acide ca été ajouté sous forme de solution saturée entre 0,115 et 0,125%. La diminution de pH s’effectuait pour éviter une dégradation auto-catalytique du lactulose et pour faciliter une déminéralisation partielle de la solution finale au moyen de la formation de citrate de calcium, facilement éliminé par une centrifugation postérieure. Une opération additionnelle de déminéralisation avec des résines d’échange ionique était aussi nécessaire.
1.3.3 Particularités de l’isomérisation du lactose par l’hydroxyde de
sodium et du calcium
L’isomérisation du lactose en lactulose avec le NaOH comme catalyseur de la réaction s’effectue en utilisant du lactose non raffiné de haute qualité avec une concentration de 20%. Le pH initial de la solution est établi à 11,0 ± 0,2. La solution de lactose est chauffée en batch jusqu’à 70ºC. Les données expérimentales présentées par Ryabtsova (1992) montrent que dans une première étape, la réaction d’isomérisation présente une croissance considérable du taux de formation de lactulose avec un faible changement de la couleur de la solution (caractéristique de l’apparition de sous-produits). La deuxième étape de la réaction est caractérisée par une stabilisation suivie par une diminution du taux d’isomérisation. Cette caractéristique est plus intense lorsqu’on utilise des solutions avec du lactose pur. Pendant cette étape, le pH de la solution décroit de façon significative suivi par une coloration de la solution de plus en plus intense. Cette
15 diminution du pH est intensifiée au fur et à mesure que des sous-produits de type acide se forment. La diminution du pH de la solution est un indicateur de la diminution de la concentration des accepteurs de protons, ce qui entraine la diminution des probabilités du regroupement intramoléculaire du lactose et donc de son isomérisation en lactulose. De même et à cause de la diminution du pH, il se peut que la dégradation du lactulose formé s’accélère en donnant du fructose et du galactose. Un autre phénomène possible qui suit la dimunition du pH est la possible réversibilité de la réaction d’isomérisation.
Les mêmes résultats ont été obtenus avec l’hydroxyde de calcium comme catalyseur de la réaction d’isomérisation. Cependant, il est important de bien mélanger la solution avec l’hydroxyde de calcium pour éviter la précipitation du catalyseur dans le milieu de réaction. En général, l’analyse systématique des données montre que le maintient d’une alcalinité élevée est une condition essentielle pour un taux d’isomérisation optimal.
1.3.4 Isomérisation du lactose par les sulphites et les phosphates
Les sulfites et les phosphates ont la caractéristique de prévenir l’oxydation des disaccharides. C’est pour cette raison qu’ils peuvent être utilisés comme catalyseurs de la réaction d’isomérisation du lactose en lactulose à de hautes températures ou en présence de concentrations élevées de lactose afin d’éviter la génération de sous-produits.
D’après les données publiées dans Patent of Austria No 288595 (1971), des solutions de lactose à 60-65% et à des températures de 80-100ºC peuvent être utilisées sous ces conditions. Les sulfites doivent être ajoutés en proportion de 0,05-0,05M par kg de lactose monohydrate. Par la suite, le mélange (solution de lactose et catalyseur) est chauffé à la température de réaction. Quand la réaction arrive à la fin, la solution est refroidie pour que le lactose résiduel soit cristallisé. Après la cristallisation, la solution de lactose/lactulose est traitée dans une résine d’échange ionique pour séparer le catalyseur (sulfites) et les acides organiques. Après cette opération, une autre partie du lactose est cristallisée par refroidissement. Le produit final est un sirop avec 38,7% de lactulose. La teneur finale en galactose et lactose est aux alentours de 8,2% et 3,8%, respectivement.
Une autre méthode est proposée dans Patent of Great Brittan No 2031430 (1980). Selon cette méthode 2,1-8,6% de phosphates sont ajoutés dans une solution de lactose saturée. La température de réaction doit être de 104ºC pendant 20-240 minutes, dépendant
16
de la relation lactose/catalyseur. Dans ce cas, le rendement maximal d’isomérisation observé est de 20%. À la fin de la réaction, une partie du lactose est cristallisée en refroidissant. Le reste de la solution est dilué jusqu’à 15% et traité dans des résines d’échange ionique pour purifier les acides organiques formés (sous-produits) et les phosphates (catalyseur). Après cette opération, la solution doit être concentrée à nouveau pour pouvoir enlever le reste du lactose par cristallisation.
D’autres méthodes sont aussi proposées (U.S. Patent No 4536221, 1985). Le catalyseur utilisé dans ces cas est un mélange d’hydroxyde de sodium et de sulfite de sodium de 0,3-1% avec une concentration de lactose de 60%. La réaction se fait à des températures de 75-80ºC pendant 15 minutes. Le taux d’isomérisation observé atteint un 30%. D’autre part, le taux d’isomérisation peut atteindre 40% en utilisant 0,7% de sulfite de sodium comme catalyseur. Dans le brevet U.S. Patent No 4536221 (1985), l’utilisation d’hydroxyde de magnésium mélangé avec de l’hydro-sulphide de sodium dans des solutions à 60-70% a été décrite. La concentration de catalyseur dans ces cas est de 0,05-0,2% et les températures sont de 90-100ºC.
1.3.5 Isomérisation du lactose par des sépiolites
A. De la Fuente et al. (1999) indiquent que les bases fortes obtenues à partir de la substitution du Mg2+ des sépiolites par des ions alcalins (Li+, Na+, K+ et Cs+) peuvent être utilisées comme catalyseurs pour l’isomérisation du lactose en lactulose et épi-lactose. L’activité exhibée par ces sépiolites alcalines est significativement plus élevée que celle des sépiolites naturelles. On peut arriver à des taux de 20% de conversion de lactose en lactulose à 90ºC avec une charge de catalyseur de 15g/L. D’autre part, Villamiel et al.(2002) indiquent que les sépiolites alcalines (Na+, K+) ont aussi été utilisées comme catalyseurs pour la synthèse de lactulose à partir du perméat de lait. En plus du lactose et du lactulose, d’autres hydrates de carbone (tels que le galactose et l’épi-lactose) ont été déterminés.
En général, l’activité de la sépiolite de sodium est plus importante que celle de la forme de potassium. Un 20% de formation de lactulose (1000 mg/100 mL), par rapport à la concentration initiale de lactose, a été obtenu après 150 minutes de réaction en utilisant les sépiolites de sodium. Dans ces conditions, on a détecté 25% de dégradation de lactose alors
17 que des petites quantités d’épi-lactose et galactose étaient formées. Ce travail présente une méthode appropriée pour l’obtention de lactulose à partir du perméat du lait (rendements acceptables et purification non compliquée).
1.3.6 Isomérisation du lactose par aluminates et borates (isomérisation
alcaline avec agents complexants)
En utilisant des électrolytes amphotériques comme l’hydroxyde d’aluminium ou borique, on peut atteindre des taux d’isomérisation de 60-70% (European Patent 0320670, 1990; Mendicino, 1960; U.S. Patent 4273922, 1981). Dans ces cas, le catalyseur doit être ajouté dans une proportion de 0,5-4M par mole de lactose comme il est indiqué dans US patent No 4957564 (1990). Dans U.S. Patent No 3546206 (1970). Le catalyseur (aluminate) doit être ajouté à la solution de lactose et par la suite, le mélange doit être chauffé. Le catalyseur est enlevé du milieu par cristallisation lors du refroidissement. À cet effet, le pH est ajusté avec du HCl ou hydroxyde d’aluminium. À la fin du procédé, il est conseillé de séparer le lactulose en utilisant du méthanol. Carrobi et Innocenti proposent l’utilisation d’une membrane pour enlever le catalyseur après l’isomérisation (U.S. Patent No 4957564, 1990). Dans ces brevets on utilise des solutions de lactose à 25-50%. Le catalyseur (aluminate de sodium) est ajouté sous forme de solution concentrée à 35-45%. Le rapport aluminate/lactose est compris entre 0,3/1 et 1/1 selon la concentration de lactose. L’isomérisation s’effectue à des températures de 50-70ºC pendant 30-60 minutes. À la fin de la réaction, la solution est neutralisée avec 3-4N d’acide sulfurique pour maintenir le pH entre 4,5 et 8. Il y a formation d’une suspension d’hydroxyde d’aluminium qui est retirée par centrifugation après traitée par une membrane. Des rendements d’environ 75% sont obtenus pour la réaction d’isomérisation du lactose. D’autres auteurs soulignent l’utilisation possible de tetraborate de sodium, d’hydroxyde de sodium ou du trietylamine mélangé avec de l’acide borique comme catalyseurs (Hicks et al., 1984 ; Mizota et al., 1987). Des opérations de purification par échange ionique, cristallisation, pasteurisation sont nécessaires. Dans ces cas, des rendements d’isomérisation de 87% peuvent être obtenus.
18
1.3.7 Effet de la concentration de lactose
Selon les principes de la cinétique de réaction chimique, la réaction d’isomérisation du lactose en lactulose sera dépendante de la concentration de lactose dans la solution initiale. Les analyses des données sur la production du lactulose montrent une grande variation de ce paramètre pouvant osciller entre 5 et 60%. De plus, on constate que la concentration optimale initiale de lactulose choisie dépendra du type de catalyseur employé dans la réaction. L’utilisation d’hydroxydes de sodium, de potassium ou de calcium comme catalyseurs lactulose a été étudiée (Ryabtsova, 1992). De cette façon, on cherche à obtenir les concentrations optimales de lactose initiales pour obtenir un minimum de coloration (présence de sous-produits) avec un rendement maximal. À cet effet, des concentrations de lactulose entre 5 et 30% ont été employées. Le lactose employé était de qualité alimentaire mais non raffiné. Il a été purifié afin d’enlever les protéines pour éviter une possible réaction entre le lactulose et les groupes aminés des protéines. L’isomérisation en utilisant de l’hydroxyde de sodium avec un pH initial de 11,0 ± 0,2 à 70 ± 2ºC pendant 20 ± 2 minute montre que la concentration initiale de lactose comprise entre 5 et 30% n’a pas d’effet significatif sur le taux d’isomérisation. Cependant, la même étude montre qu’à des concentrations initiales de lactose jusqu’à 20% comporte un taux d’apparition de sous-produits plus élevé que lorsque la concentration de lactose est plus basse. En utilisant l’hydroxyde de calcium comme catalyseur, on obtient les mêmes résultats. En outre, il est important d'utiliser une concentration initiale comprise entre 20 et 25% pour les réactions d’isomérisation alcaline afin d’éviter la cristallisation du lactose après refroidissement de la solution.
Dans une autre étude (Montilla et al., 2005) ; on a utilisé des concentrés de lactosérum et ultra-filtrats pour la production de lactulose. Les résultats indiquent que la quantité de lactulose produite augmente lorsque le facteur de concentration de la matière première augmente. En effet, 0,388 et 1,17 g/100 mL ont été obtenus après 30 et 120 minutes, respectivement et ce en utilisant le lait alors que pour une concentration du lactosérum d’un facteur de 5,2, les quantités de lactulose obtenues étaient 3,41 et 4,80 g/100 mL après 30 et 120 minutes, respectivement. De plus, une concentration du lactosérum d’un facteur 7,6 permet des quantités de lactulose de 5,33 et 7,15 g/100 mL après 30 et 120 minutes de traitement, respectivement (Montilla et al., 2005).
19
1.3.8 Effet de la concentration de lactose et du catalyseur sur le pH de la
solution
Dans le cas de l’isomérisation du lactose en lactulose, le pH de la solution déterminera la concentration d’accepteurs de protons, ce qui peut être considéré comme un des rôles les plus importants lors de l’isomérisation (Aider et de Halleux, 2007). Les résultats expérimentaux montrent qu’il n’existe pas une différence significative entre les valeurs de pH de solutions composées par lactose de haute pureté et celles contenant du lactose raffiné. De plus, ces analyses montrent qu’indépendamment de la concentration de lactose, la courbe d’évolution du pH a un comportement logarithmique.
Pendant la première étape de la réaction, le pH de la solution augmente de façon abrupte. Des données montrent que pour augmenter le pH d’une solution de lactose de 5,5 ± 0,5 jusqu’à 9,0 ± 0,2, la concentration de NaOH requise est la même indépendamment de la concentration de lactose.
Dans une deuxième étape, on peut apprécier une évolution différente de la courbe de pH; l’augmentation de pH est beaucoup plus lente. Pendant cette étape, la concentration de lactose a un effet très significatif lors de l’augmentation de pH. Il est beaucoup plus difficile d’augmenter le pH dans les solutions avec du lactose plus concentré.
Pour la relation entre la concentration de lactose et celle du catalyseur, on peut conclure ce qui suit : à un pH 11,0 pour chaque M de NaOH, il faut 10 M de solution initiale de lactose indépendamment de la concentration de celle-ci ; 3-7 M de NaOH dans le cas des solutions de lactose concentrées à partir de lactosérum (dépendant du procédé subi par le fromage) et finalement 1-2 M de NaOH pour les solutions de lactose non raffiné de haute qualité.
On peut donc constater que lorsqu’on augmente la capacité de tampon de la solution de lactose, la relation lactose/catalyseur diminue. Il est donc important de connaitre la pureté du lactulose qu’on utilisera pour choisir la concentration optimale du catalyseur employé pour la réaction d’isomérisation (Ryabtsova, 1992).
20
1.3.9 Formation de sous-produits et purification
Il faut comprendre que lors de la production de lactulose, le mélange réactionnel n’est généralement pas pur. Il contient d’autres substances comme le lactose, le glucose, le galactose, l’épi-lactose etc. De plus, des petites quantités de galactose, de tagatose, d’épi-lactose, d’acide formiques et d’autres se forment aussi par la dégradation du lactose et du lactulose (Schuster-Wolff-Bühring et al., 2010).
L’analyse des données des variations de la densité optique et du pH pendant la dégradation de sucres en milieu alcalin montre l’existence de trois étapes:
La première étape correspond à une faible dégradation et donc aussi à la formation la plus élevée de lactulose.
La deuxième étape comprend l’apparition de sucres, sous-produits de la dégradation du lactulose. Pendant cette étape, on constate une diminution du pH ainsi qu’une diminution de formation de lactulose.
Finalement on retrouve une troisième étape qui est caractérisée par une stabilisation de la couleur foncée de la solution, même à hautes températures (72 ± 2ºC). Pendant cette étape, la diminution de pH peut atteindre la neutralité.
La mesure de la densité optique de la solution ne peut pas nous apporter suffisamment d’informations sur la nature et la proportion des colorants formés par dégradation du lactose et/ou du lactulose, mais cette information peut être employée pour planifier le procédé de production du lactulose, surtout en ce qui concerne les étapes « downstream » qui suivent à l’isomérisation.
La dégradation de lactose est prévenue en abaissant le pH et la température de la solution obtenue. Après, le mélange réactionnel est traité pour séparer le lactulose du lactose et des restes des catalyseurs. Finalement, on cristallise et on recycle le lactose. La concentration de lactose non isomérisée est négligeable dans les solutions obtenues à partir d’agents complexants, mais dans le cas des réactions alcalines il est indispensable de la séparer par cristallisation.
La récupération du lactulose pendant les opérations « donwstream » est importante, car la quantité de lactulose obtenue est affectée par les traitements physiques et chimiques Il faudra donc considérer différents procédés « downstream » selon le type de réaction choisie pour la synthèse de lactulose, spécialement en ce qui concerne les étapes de
21 cristallisation du lactose et raffinage du lactulose qui ont pour but d’obtenir la qualité désirée du produit final (Rudenko & Bobrovnik, 1999). Le lactose peut être séparé du lactulose par cristallisation en utilisant du méthanol. La purification du lactulose dans un mélange avec lactose peut s’effectuer aussi par extraction de liquide par pression (PLE) à 1500 psi pendant 30 minutes, le lactulose récupéré peut atteindre entre 84 et 90% de pureté (Ruiz-Matute et al., 2007).
1.4 Nouvelle approche pour la production du lactulose
1.4.1 Généralités
Le grand nombre de réactifs employés démontre que la réaction idéale pour l’isomérisation du lactose en lactulose n’a pas encore été trouvée (Fig. 1.6). Le catalyseur employé devrait répondre à quelques critères importants tels que :
Garantir le niveau maximumd’isomérisation avec un minimum de sous-produits. Être écologique et non toxique.
Être disponible en grandes quantités à un coût le plus bas possible.
Être facile à retirer du milieu réactionnel par des méthodes traditionnelles de déminéralisation.
Permettre des résultats d’isomérisation répétables.
22
Cependant, les catalyseurs pratiquement employés pour l’isomérisation du lactose en lactulose présentent des aspects positifs et négatifs. De plus en plus d’efforts pour trouver de nouvelles technologies sont déployés pour trouver une réaction qui n’a pas besoin d’ajout de catalyseurs chimiques, ce qui permettrait de respecter tous les critères mentionnés préalablement. C’est ce qu’on appelle réaction « reagentless ». L’examen des tendances des brevets des 50 dernières années pour la synthèse de lactulose pendant indique que les réactions non conventionnelles pour la synthèse de lactulose prennent de plus en plus d’importance pendant les 10 dernières années (Tableau 1.1).
Tableau 1.1 : Résumé des principales caractéristqiues des méthodes actuellement ustilisées
pour la production du lactulose
L’application d’enzymes et l’utilisation de résines d’échange ionique sont des approches alternatives pour la synthèse de lactulose. Elles offrent un nouveau potentiel pour l’industrie alimentaire puisqu’elles permettent de produire le lactulose à partir des sous-produits de l’industrie laitière et d’obtenir un lactulose qui pourrait être inclus comme ingrédient alimentaire avec toute sécurité.
23
1.4.2 Production de lactulose par des résines d’échange ionique
La production de lactulose conventionnelle requiert l’utilisation de divers produits chimiques (hydroxyde, borates, aluminates, etc.) et des procédés de purification par des résines d’échange ionique. Dans Russian Patent No 2101358 (1998), des résines d’échange d’anion ont été employées pour intensifier l’isomérisation du lactose en lactulose en exploitant l’échange d’ions OH- entre les solutions en réaction et les résines. Les avantages de l’utilisation de résines d’échange ionique au lieu des réactions chimique employées jusqu'à maintenant sont :
Pas besoin d’ajouter un catalyseur pour le procédé d’isomérisation. Pas besoin de l’étape de déminéralisation.
Pas besoin d’opérations de purification additionnelles pour séparer les colorants du produit final.
Le processus est plus rentable par comparaison aux méthodes traditionnelles.
Le lactulose produit par cette technologie peut être employé dans les aliments pour enfants et dans les aliments spécialisés où les bifido-bactéries sont introduites (Hramtsov et al., 2004).
1.4.3 Méthodes enzymatiques
Le lactulose peut être généré enzymatiquement par le réarrangement moléculaire des structures du lactose ou par la condensation du galactose et du fructose. La synthèse enzymatique du lactulose est normalement effectuée par des enzymes β-galactosidades et gycosidases. La β-galactosidade est un biocatalyseur pour la réaction de tranglicosilation et aussi pour la synthèse des dérivés du lactose qui incluent les galacto-oligosaccharides (Panesar et al., 2006, 2010). Cette enzyme peut être obtenue à partir de plusieurs sources (microorganismes, plantes et animaux). Cependant, les propriétés diffèrent beaucoup selon la nature de l’enzyme. Les enzymes d’origine animale ou végétale possèdent une faible valeur commerciale tandis que plusieures β-galactosidades microbiennes ont un intérêt technologique. De plus, les microorganismes offrent plusieurs avantages comme une facile manipulation, un taux de multiplication élevé et un haut rendement de production de cette enzyme comparé à d’autres possibles sources. Les β-galactosidades peuvent être employées
24
pour la production de lactulose sous forme libre, sous forme immobilisée et même en utilisant des cellules microbiennes intègres. Les différentes études effectuées jusqu’à présent montrent qu’avec la synthèse enzymatique, on peut atteindre des rendements de synthèse de lactulose allant de 4 à 44%. Le taux d’isomérisation dépendra de trois paramètres :
La séquence d’acides aminés de l’enzyme employée (ce paramètre est le plus important puisqu’il détermine les propriétés cinétiques et catalytiques de l’enzyme). La concentration de lactose (qui est le groupe donneur de la molécule galactosyl). La concentration de fructose, l’accepteur nucléophile.
1.4.3.1 Production de lactulose en utilisant des enzymes libres
La réaction de transgalatosylation par β-galactosidases pour obtenir du lactulose utilise le lactose comme donneur de galactose et le fructose comme accepteur (Kim et al., 2006) (Tableau 1.2). La production de lactulose par transgalacosylation enzymatique s’effectue à partir de β-galactosidase d’Aspergillus oryzae et de la β-glycosidase thermostable de Pyrococcus furiosus. La productivité de lactulose est de 46 mmol/L (44% relatif au lactose) pour l’enzyme de Pyrococcus furiosus et de 30 mmol/L (30% relatif au lactose) pour l’enzyme d’Aspergillus oryzae (Mayer et al., 2004). De plus, un gène de Sulfolobus solfataricus codant pour une β-galactosidase thermostable a été cloné et exprimé chez Escherichia coli pour la production de lactulose. La synthèse enzymatique de lactulose à partir de perméat de lactosérum a aussi présenté une efficacité de production de lactulose satisfaisante (65g/L) (Adamczak et al., 2009).
25
Tableau 1.2 : Réaction de transgalatosylation par β-galactosidases pour obtenir du
lactulose
β-galactosidase ϑ, pH Concentration initiale, g L−1 Ylactu/lactoen %
cLactose cFructose Saccharomyces fragilis 37°C, pH 7,2 120 200 7,5 Cellules perméabilisées de Kluyveromyces lactis 40°C, pH 7, 400 200 5,0 Pyrococcus furiosus 75°C, pH 5 34 270 44,0 Sulfolobus solfataricus 80°C, pH 6 400 200 12,5
1.4.3.2 Production de lactulose en utilisant des enzymes immobilisées
Le lactulose a aussi été synthétisé avec succès par une méthode enzymatique duale dans un milieu aqueux organique en deux phases, en utilisant le lactose et le fructose comme matières premières. Le système enzymatique dual se compose de l’enzyme immobilisée lactase et de la gluco-isomérase aussi immobilisée. Le lactase immobile est obtenu en le combinant avec des microsphères magnétiques de Fe3O4-chitosane (Hua et al., 2010). Le processus enzymatique en continu a été développé pour la production du lactulose pré-biotique par trans-galactosylation en utilisant du β-galactosidase libre et immobilisé de Pyrococcus furiosus (Mayer et al., 2010). Le coût de production du β-galactosidase reste le principal obstacle pour la commercialisation de la méthode enzymatique. Plusieurs essais ont été effectués pour développer un système efficace avec un coût acceptable. L’utilisation de β-galactosidase intracellulaire à partir de cellules entières comme catalyseur est une voie efficace pour diminuer le coût du β-galactosidase.
1.4.3.3 Production de lactulose en utilisant des cellules entières
Les cellules entières peuvent aussi être employées comme biocatalyseurs pour la production de lactulose, car elles possèdent de nombreux avantages sur les enzymes purifiées. Cependant, la faible perméabilité aux substrats et produits de la membrane cellulaire peut souvent comporter de faibles rendements pour la réaction, spécialement pour
26
les levures. Pour augmenter la perméabilité et donc le rendement, on peut utiliser des levures perméabilisées (Panesar et al., 2006). Par exemple, des cellules de levure Kluyveromyces marxianus perméabilisées ont été utilisées comme source de β-galactosidase pour surmonter le problème de l’extraction de l’enzyme. La perméabilisation de cellules de levure par éthanol a été prouvée comme un procédé économique, facile, convenable et sûr pour la bioconversion (Joshi et al., 1989; Lee et al., 2004; Panesar, 2008; Panesar et al., 2007). L’hydrolyse du lactose et la production de lactulose à partir du fructose et du galactose ont aussi été étudiées avec plusieures β-galactosidases commerciales (Panesar et al., 2010). L’enzyme de Kluyveromyces lactis a montré la plus haute productivité de lactulose comparée au reste d’enzymes étudiées. Les conditions pour la production de lactulose ont été optimisées en utilisant des cellules perméabilisées avec de l’éthanol au 50% (v/v) (Lee et al., 2004). Les cellules perméabilisées montrent une production plus élevée que celle des cellules non traitées.
1.5 L’électro-activation
1.5.1 Généralités de l’électro-activation
L’eau est un composant de tous les systèmes biologiques et joue un rôle très important sur les propriétés chimiques et physiques des solutions aqueuses. Dans les années 70 du dernier siècle, on a découvert la possibilité d’utiliser les propriétés de l’eau et des substances aqueuses pour effectuer des réactions sans ajout d’agents chimiques dans plusieurs procédés technologiques. Il y a eu donc une augmentation de l’intérêt scientifique à propos de l’utilisation de l’eau comme substrat des réactions chimiques non conventionnelles (Kirpichnikov et al., 1986). De nombreuses études récentes ont mis en évidence que les connaissances des propriétés de l’eau et des solutions aqueuses ne sont pas complètement connues et en conséquence plusieurs paramètres caractéristiques de son utilité biologique restent à découvrir. Les propriétés physiologiques de l’eau sont affectées par sa composition chimique, son degré de pureté et d’autres paramètres physiques complexes. Ceci caractérise l’eau comme un système structuré de façon complexe, plus particulièrement sous un point de vue énergétique (Kloss, 1988). Ce système est plus évident lorsque l’eau est sous un stade thermodynamique déséquilibré (Petrushanko et