ALEXANDRE DÉRY
COMPARAISON À L’ÉCHELLE RÉELLE DES
PERFORMANCES D’UN FILTRE CONVENTIONNEL
ET D’UN FILTRE AU CHARBON ACTIVÉ EN
GRAINS PRÉCÉDÉS D’UNE INTER-OZONATION
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de maîtrise en génie civil
pour l’obtention du grade de Maître ès sciences (M.Sc.)
DÉPARTEMENT DE GÉNIE CIVIL ET GÉNIE DES EAUX FACULTÉ DES SCIENCES ET GÉNIE
UNIVERSITÉ LAVAL QUÉBEC
2012
Résumé
Un suivi de deux filtres granulaires pleine échelle a été fait à une des usines de production d’eau potable de la Ville de Québec qui a une capacité de production de plus de 220 000 m3/jour. Un des filtres contient du sable et de l’anthracite, et l’autre du sable et du charbon activé en grains (CAG). Les deux filtres, qui sont précédés d’une inter-ozonation, ont été opérés dans les mêmes conditions pendant l’étude. Les qualités de l’eau brute, décantée, ozonée et filtrée ont été suivies pendant 32 semaines, de mai à décembre 2011, à raison de 2 échantillonnages dans un cycle de filtration à chaque deux semaines. Cette période correspond à peu près à la deuxième année d’opération après le changement des milieux filtrants dans cette usine.
Le filtre avec CAG s’est avéré plus performant pour presque tous les paramètres de qualité d’eau considérés, en particulier en termes d’enlèvement de la matière organique biodégradable et non-biodégradable. Par contre, et contrairement à ce qui a été observé antérieurement, la réduction de la turbidité a été plus forte dans le filtre avec anthracite. Une analyse économique préliminaire et partielle montre que le meilleur enlèvement de la matière organique réalisé par le filtre avec CAG pourrait amener une économie significative due à une réduction de la demande en chlore mais que celle-ci serait masquée par le coût d’achat très élevé du CAG par rapport à l’anthracite.
Abstract
A water quality monitoring was conducted on two full scale granular filters of the biggest water treatment plant of Québec City. One of the filters contains anthracite and sand layers, while the other contains granular activated carbon (GAC) and sand layers. Both filters, which are preceded by an inter-ozonation step, were operated in the same conditions during the study which happened during the second year of operation of these filters. The qualities of raw water, settled water, ozonated water and filtered water were monitored for 32 weeks, from May to December 2011, two times in a filtration cycle every two weeks.
Globally, the GAC filter exhibited better organic matter removal performances but a lower turbidity removal performance than the anthracite filter. This allows a potential reduction in chlorine consumption for the GAC filter but this economy is shadowed by the very high cost of this filter media.
Remerciements
Je voudrais tout d’abord remercier Christian Bouchard pour m’avoir attribué ce projet, et m’avoir soutenu et répondu à mes nombreuses questions lors de sa réalisation, et pour m’avoir tant appris dans le domaine de l’eau potable. Je remercie la Chaire de recherche en eau potable de l’Université Laval et son responsable, Manuel Rodriguez, pour avoir financé ce projet d’envergure et m’avoir accueilli au sein de leur équipe dynamique. Je remercie également tous les partenaires financiers de la chaire : la Ville de Québec, la Ville de Lévis, le CRSNG, et les compagnies Avensys Inc. et Dessau Inc. J’aimerais aussi remercier tout le personnel du laboratoire de l’Université Laval tel que la professionnelle de recherche Sabrina Simard, le technicien de laboratoire Michel Bisping, et les auxiliaires de recherche et amis, Julien, Julie, Marie, Mickaël, Michel et les autres pour m’avoir épaulé à faire les innombrables analyses de laboratoire. J’aimerais aussi souligner la coopération de Louis Collin, Christian Pelletier et les autres employés de l’usine centre de la Ville de Québec pour leur support et leurs réponses rapides à toutes mes questions. Merci aussi à François Proulx, Frédéric Aubin, Christine Beaulieu, pour avoir supervisé les analyses de plusieurs paramètres, et les techniciens de la ville qui ont fait les analyses, sans quoi il m’aurait été impossible de faire un suivi aussi complet. Je remercie aussi Catherine pour m’avoir éclairci sur plusieurs sujets et m’avoir fourni des données sans hésiter. Merci à mes collègues de bureau, particulièrement Sophie et David, qui m’ont remonté le moral à plusieurs reprises avec des fous rires, suite à mes nombreux soupirs. Je remercie aussi ma famille et mes amis pour leur intérêt vis-à-vis mon projet et leurs encouragements. Je pense aussi à mon cousin Patrick, qui m’a répété qu’en déposant ce mémoire je deviendrai le plus scolarisé des Déry de notre lignée! Je voudrais finalement remercier Véronique, mon âme sœur, qui a toujours été là pour partager mes meilleurs moments comme les moins bons, et qui j’espère sera à mes côtés pour les nombreuses années à venir.
Table des matières
Résumé... i
Abstract ... ii
Remerciements ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations... x
Chapitre 1 – Introduction ... 1
Chapitre 2 – État des connaissances ... 3
2.1 Filtration rapide sur lit granulaire ... 5
2.1.1 Principes généraux ... 5
2.1.2 Mécanismes de rétention des particules... 8
2.1.3 Suivi des performances ... 10
2.2 Filtration rapide sur lit granulaire précédée d’une ozonation ... 11
2.2.1 Objectifs de traitement ... 13
2.2.2 Rappels sur l’ozonation et ses effets de l’ozonation sur la MOD ... 13
2.2.3 Milieux filtrants ... 17
2.2.4 Activité biologique ... 19
2.2.5 Paramètres de conception et conditions d’opération... 23
2.2.5.1 Température de l’eau ... 23
2.2.5.2 Temps de contact en fût vide (TCFV) ... 24
2.2.5.3 Milieux filtrants... 26
2.2.5.4 Temps depuis le démarrage (mise en service) ... 28
2.2.5.5 Lavage... 30
2.2.5.6 Nutriments ... 32
2.2.5.7 Présence d’oxydants dans l’affluent du biofiltre... 32
2.2.5.8 Oxygène dissous ... 33
2.2.5.9 Suivi et performances ... 33
Chapitre 3 – Objectifs ... 39
Chapitre 4 – Matériel et méthodes ... 41
4.1 Présentation de l’usine ... 41
4.2 Description des filtres à l’étude ... 42
4.2.1 Description générale ... 42
4.2.2 Milieux filtrants ... 44
4.2.3 Conditions d’opération... 46
4.2.3.1 Temps écoulé des cycles de filtration au moment de l’échantillonnage et durée des cycles de filtration... 46
4.2.3.2 Vitesse de filtration et temps de contact en fût vide (TCFV)... 47
4.2.3.3 Lavages des filtres... 48
4.2.3.4 Température de l’eau ... 49
4.3 Suivi des performances de traitement des filtres ... 50
4.3.1 Plan d’échantillonnage ... 50
4.3.2 Paramètres de qualité d’eau ... 52
4.4.1 Coûts d’énergie ... 63
4.4.2 Coût du chlore ... 65
4.4.3 Coût du remplacement du milieu filtrant ... 66
Chapitre 5 – Résultats et discussion ... 67
5.1 Suivi des filtres ... 67
5.1.1 Conditions opératoires des filtres ... 67
5.1.1.1 Mode adsorption et mode biofiltration ... 67
5.1.1.2 Temps écoulé des cycles de filtration au moment de l’échantillonnage .. 68
5.1.1.3 Durée des cycles de filtration ... 70
5.1.1.4 Vitesse de filtration ... 71
5.1.1.5 Température de l’eau ... 73
5.1.1.6 Qualité d’eau en amont des filtres... 74
5.1.2 Analyse comparative des performances des filtres ... 83
5.1.2.1 Abattement de la turbidité ... 83
5.1.2.2 Enlèvement de la matière organique ... 87
5.1.2.3 Relargage de bactéries ... 93
5.1.2.4 Réduction de la demande en chlore ... 94
5.1.2.5 Enlèvement des précurseurs de sous-produits de désinfection ... 101
5.1.2.6 Ammoniaque, nitrite et nitrates ... 107
5.1.2.7 Performance des lavages... 112
5.2 Analyse économique préliminaire ... 113
5.2.1 Coûts d’énergie ... 114
5.2.2 Coût du chlore ... 116
5.2.3 Coût du milieu filtrant ... 119
5.2.4 Synthèse ... 123
Chapitre 6 – Conclusion et recommandations ... 126
Bibliographie ... 131
Annexe A Fiches techniques des milieux filtrants ... 141
Annexe B Protocole de demande en chlore et simulation de sous-produits de désinfection (THM et AHA) ... 146
Annexe C Protocole de carbonisation... 149
Annexe D Protocole de filtration ... 150
Annexe E Calcul d’incertitude sur le COD ... 151
Annexe F Calcul d’incertitude sur le CODB ... 152
Annexe G Calcul d’incertitude sur la DEC ... 153
Liste des tableaux
Tableau 1 : Caractéristiques des milieux granulaires utilisés en filtration rapide (Crittenden
et al., 2005) ... 6
Tableau 2 : Quantité de biomasse dans différents filtres après 95 jours et 1 an d'opération (d’après Wang et al. 1995) ... 21
Tableau 3 : Performances de traitement d’un filtre au CAG rapportées dans différents travaux de recherche ... 36
Tableau 4: Caractéristiques des 3 types de médias filtrants à la Ville de Québec (d’après les fiches techniques présentées à l’Annexe A) ... 45
Tableau 5 : Numérotation des campagnes avec leurs dates et stades dans le cycle de filtration ... 50
Tableau 6 : Analyses réalisées par le laboratoire de la Ville de Québec ... 54
Tableau 7 : Analyses réalisées à l’Université Laval ... 55
Tableau 8 : Limites analytiques des méthodes ... 56
Tableau 9 : Conditions de réalisation de tests de simulation de formation de SPC ... 59
Tableau 10 : Informations techniques sur les capteurs en continu ... 62
Tableau 11 : Valeurs minimales, maximales et moyennes des concentrations de COD et COR pour l'eau ozonée et les effluents des filtres C-S et A-S ... 89
Tableau 12 : Valeurs minimales, maximales et moyennes des concentrations de CODB pour l'eau ozonée et les filtres C-S et A-S... 91
Tableau 13 : Influence du temps écoulé du cycle de filtration sur les concentrations moyennes et les enlèvements moyens de matière organique pour les filtres C-S et A-S ... 92
Tableau 14 : Diminutions moyennes de DECL dans les filtres et valeurs moyennes de DECL pour l’eau filtrée en fonction du stade du cycle de filtration et du milieu filtrant du filtre ... 99
Tableau 15 : Matrices de corrélation entre la consommation de chlore libre, la concentration en COD avant chloration, la dose de chlore appliquée et la température de l’eau ... 100
Tableau 16 : Abattements moyens et concentrations moyennes des AHAT et THMT simulés en fonction du stade du cycle de filtration et du milieu filtrant du filtre ... 104
Tableau 17 : Distributions moyennes des THM simulés pour l’eau ozonée et pour les eaux filtrées ... 106
Tableau 18 : Distributions moyennes des AHA simulés pour l’eau ozonée et pour les eaux filtrées ... 106
Tableau 19 : Matrices de corrélations entre la concentration de COD, la température et la dose de chlore et les concentrations de SPD ... 107
Tableau 20 : Taux d’enlèvement d’ammoniaque dans les filtres tel que déterminés à partir des analyses de l’Université Laval ... 110
Tableau 21 : Volumes cumulés d'eaux de lavage, de préfiltration et filtrée avec pourcentages de pertes pour la période du 1er mai 2011 au 3 janvier 2012 à l’UTE Québec ... 112
Tableau 22 : Caractéristiques des phases d’un cycle de filtration au début du suivi ... 115
Tableau 23 : Caractéristiques des différentes phases d’un cycle de filtration à la fin du suivi ... 115
Liste des figures
Figure 1 : Schéma d'un filtre granulaire bicouche (Crittenden et al., 2005) ... 5
Figure 2 : Évolution de la perte de charge et de la turbidité à l’eau filtrée durant les différentes phases d'un cycle de filtration (Bouchard, 2010) ... 8
Figure 3 : Mécanismes de transport des particules à la surface des grains de média filtrant lors de la filtration (Crittenden et al., 2005) ... 9
Figure 4: Filière conventionnelle avec une filtration sur CAG biologique (filière avec une seule étape de filtration granulaire) ... 12
Figure 5 : Effet de la dose d’ozone sur le ratio CODBrapide/CODB (Carlson and Amy, 2001) ... 16
Figure 6 : Schéma simplifié des principales réactions chimiques de formation des sous-produits d'ozonation dans les eaux naturelles (Crittenden et al., 2005) ... 17
Figure 7 : Évolution des mécanismes d’enlèvement du COD dans un filtre CAG (Bouillot et al., 1992) ... 19
Figure 8 : Enlèvement en mg/L de COD et CODB par deux CAGB différents par rapport au TCFV (Merlet et al., 1992)... 25
Figure 9 : Réduction de la demande en chlore (sur 7 jours) et du COD pour deux CAGB en fonction du TCFV (Merlet et al., 1992) ... 26
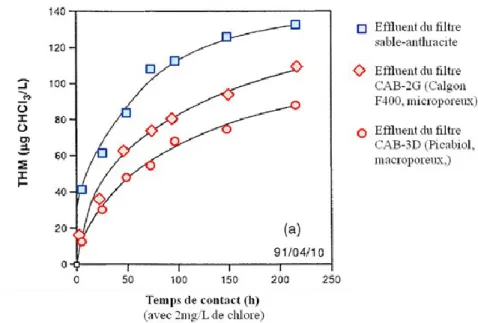
Figure 10 : Effet de la biofiltration sur la formation des THM à l’usine de Ste-Rose (Baribeau et al., 1995) ... 28
Figure 11 : Développement de la biomasse et de l'enlèvement du COD en fonction du temps et du volume filtré (Velten et al., 2011) ... 29
Figure 12 : Coupe transversale du filtre C-S (CAG-sable) ... 43
Figure 13 : Coupe transversale du filtre A-S (anthracite-sable) ... 44
Figure 14 : Distribution poreuse du Picabiol 2 (PICA, 2007) ... 45
Figure 15 : Schéma d'écoulement autour des filtres ... 51
Figure 16 : Points d’échantillonnage pour les filtres CS et AS près des turbidimètres. ... 52
Figure 17 : Enlèvement (par rapport à l'eau ozonée) du carbone organique par les filtres C-S et A-S ... 68
Figure 18 : Temps écoulé des cycles de filtration au moment de l'échantillonnage ... 69
Figure 19 : Durées des cycles de filtration pendant les 8 mois de suivi ... 70
Figure 20 : Fréquences des vitesses de filtration au sein des deux filtres ... 71
Figure 21 : Fréquence des temps de contact en fût vide (TCFV) dans les couches d’anthracite et de sable, et de CAG et de sable ... 72
Figure 22 : Températures de l'eau à la sortie du contacteur d'ozone, du filtre C-S et à l'entrée du réseau de distribution (poste Venturi) ... 74
Figure 23 : COD de l'eau ozonée, de l'eau décantée et de l'eau brute ... 75
Figure 24 : Enlèvement de COD lors de la coagulation-floculation-décantation et de l'ozonation par rapport à leur affluent respectif ... 76
Figure 25 : Absorbances UV spécifiques de l'eau ozonée, décantée et brute... 77
Figure 26 : Fraction biodégradable du COD et dose d'ozone à l'eau ozonée ... 78
Figure 27 : Conductivité de l'eau ozonée ... 79
Figure 28 : Alcalinité à l'eau ozonée ... 79
Figure 30 : Orthophosphates de l'eau ozonée et azote ammoniacal de l’eau ozonée et l’eau
brute ... 79
Figure 31 : Oxygène dissous de l'eau ozonée et courbe de saturation théorique en oxygène de l'eau en fonction de la température ... 80
Figure 32 : Sursaturation de l'eau ozonée et dose d'ozone injectée ... 82
Figure 33 : Fréquence des 95e centiles de turbidité des filtres C-S et A-S aux 15 minutes . 84 Figure 34 : Fréquence des 95e centiles de turbidité des filtres C-A et A-S aux 4 heures ... 84
Figure 35 : Moyennes des turbidités des filtres C-S et A-S calculés sur 30 jours avec une fréquence de 15 minutes ... 85
Figure 36 : Turbidités des eaux filtrées par les filtres C-S et A-S à partir de la mi-juillet jusqu'à la mi-août ... 87
Figure 37 : Enlèvement du COD par les filtres C-S et A-S... 88
Figure 38 : Enlèvement du carbone organique réfractaire (COR) pour les filtres C-S et A-S ... 89
Figure 39 : Enlèvement du CODB des filtres C-S et A-S par rapport à l'eau ozonée ... 91
Figure 40 : BHAA à la sortie des filtres C-S et A-S ... 94
Figure 41 : Temps de rétention estimés dans les réserves de l’UTE ... 95
Figure 42 : Consommations de chlore dans la réserve de l'usine («Usine») et lors la chloration en laboratoire (DECL-4h) de l’eau de la sortie du filtre AS («Simulation») ... 96
Figure 43 : Dose injectée de chlore et concentrations de chlore résiduel libre (CCRL) dans l'eau des filtres C-S et A-S et l'eau ozonée au bout de 4h ... 97
Figure 44 : Dose injectée de chlore et concentration de chlore résiduel libre (CCRL) dans l'eau des filtres C-S et A-S et l'eau ozonée au bout de 48h ... 97
Figure 45 : Réduction de la DECL 4h des filtres C-S et A-C ... 98
Figure 46 : Réduction de la DECL 48h des filtres C-S et A-C ... 98
Figure 47 : Abattements des THM totaux simulés des filtres C-S et A-S ... 102
Figure 48 : Abattements des AHA totaux simulés pour les filtres C-S et A-S ... 102
Figure 49 : Concentrations de THMT simulés pour l'eau ozonée et les filtres C-S et A-S 103 Figure 50 : Concentrations de AHAT simulés pour l'eau ozonée et les filtres C-S et A-S 103 Figure 51 : Concentrations en azote ammoniacal mesurées par le laboratoire de la Ville de Québec aux sorties des filtres C-S et A-S ... 108
Figure 52 : Concentration en azote ammoniacal mesuré par l’université Laval aux sorties des filtres C-S et A-S ... 108
Figure 53: Comparaison des mesures d’ammoniaque réalisées par le laboratoire de la Ville de Québec et par l’université Laval ... 109
Figure 54 : Nitrites et nitrates à l'eau ozonée et à la sortie des filtres C-S et A-S ... 111
Figure 55 : Taux de récupération des filtres C-S et A-S... 113
Figure 56 : Différence entre le filtre C-S et A-S des DECL 4h et 48h ainsi que le débit de production de l'usine de production d'eau potable ... 117
Figure 57 : Économies réalisées pour 16 filtres (ou par m3 net) pour l’achat de chlore en fonction de la diminution de la demande en chlore en remplaçant l’anthracite par du CAG par année ... 118
Figure 58 : Coût de remplacement du milieu filtrant des 16 filtres en fonction de la perte annuelle totale (attrition et entraînement) de média filtrant ... 120
Figure 59 : Coût unitaire du CAG selon sa durée de vie et son taux de remplacement annuel ... 122
Figure 60 : Coût de l’anthracite selon sa durée de vie et son taux de remplacement annuel ... 122 Figure 61 : valeur de CAAMF de CAG qui est nécessaire pour que l’économie due à la
réduction de la DECL soit égale au coût supplémentaire du CAG par rapport à
l’anthracite ... 125 Figure 62 : Arbre des objectifs de potabilisation de l'eau ... 128 Figure 63 : Fréquences des comptes de particules pendant 8 mois du filtre C-S (compte en
nombre de particules de 2 à 20 µm par mL) ... 155 Figure 64 : Fréquences des comptes de particules pendant 8 mois du filtre A-S (compte en
Liste des abréviations
AHA Acides haloacétiques AHAT Acides haloacétiques totauxAPPEL Association pour la protection de l’environnement du lac Saint-Charles et des Marais du Nord
A-S Anthracite-sable
BAPE Bureau d’audiences publiques sur l’environnement
BHAA Bactéries hétérotrophes aérobies et anaérobies facultatives CAB Charbon activé biologique
CAG Charbon activé en grains
CAGB Charbon activé en grains biologique CCRL Concentration en chlore résiduel libre COA Carbone organique assimilable COD Carbone organique dissous
CODB Carbone organique dissous biodégradable COR Carbone organique réfractaire
C-S Charbon-sable
DEC Demande en chlore
DECL Demande en chlore libre
EAS Eau filtrée du filtre #4 (filtre rapide bi-couche anthracite-sable)
EB Eau brute
ECS Eau filtrée du filtre #2 (filtre rapide bi-couche CAG-sable)
EO Eau ozonée
ET Écart type
LDM Limite de détection de la méthode LQM Limite de quantification de la méthode
MDDEP Ministère du développement durable, de l’environnement et des parcs MIB 2-Méthyl isobornéol
MON Matière organique naturelle
MONB Matière organique naturelle biodégradable MTBE Méthyl-tert-butyl-ether
RQEP Règlement sur la qualité de l’eau potable SPD Sous-produits de désinfection
SPC Sous-produits de chloration TCFV Temps de contact en fût vite
THM Trihalométhanes
THMT Trihalométhanes totaux UFC Unité formatrice de colonie
UL Université Laval
USEPA United States Environmental protection agency UTE Usine de traitement d’eau
UTN Unité de turbidité néphélémétrique
Chapitre 1 – Introduction
Produire une eau de bonne qualité est primordial pour les usines de production d’eau potable. En effet, l’eau se doit d’être attrayante par son apparence limpide et son absence de mauvais goût, en plus d’être sécuritaire pour les consommateurs. La réduction des risques d’infection en dessous de seuils acceptables demeure l’objectif principal du traitement de l’eau parce qu’il s’agit de risques à court terme. Depuis très longtemps, on utilise des désinfectants, tels que le chlore, pour inactiver les pathogènes présents dans les eaux brutes. Plus récemment, on s’est aperçu que les étapes de traitement physico-chimique de l’eau, tels que la coagulation, la décantation et la filtration, et le rayonnement UV, permettaient également d’éliminer les pathogènes très efficacement, en particulier les protozoaires (appelés parasites dans le domaine de l’eau potable). Rappelons que, au Québec et en vertu du Règlement sur la qualité de l’eau potable (RQEP) en vigueur au moment d’écrire ce mémoire, les critères de conception et les modes d’opération d’un système de traitement d’eau de surface doivent permettre d’atteindre des taux d’élimination minimaux de 99,9 % des oocystes de Cryptosporidium, de 99,9 % des kystes de Giardia et de 99,99 % des virus (Gouvernement du Québec, 2012). Ces exigences sont atteintes en partie par désinfection. Or, les désinfectants chimiques utilisés pour la production d’eau potable sont des oxydants (chlore, bioxyde de chlore, ozone et monochloramine) qui réagissent aussi avec différents composés présents dans l’eau. Leur utilisation génère donc des sous-produits de désinfection (SPD) dont la formation doit être minimisée le plus possible étant donné que plusieurs SPD sont potentiellement carcinogènes et que des études épidémiologiques récentes suggèrent que des SPD pourraient même avoir des effets néfastes sur la reproduction et le développement (Rodriguez et al., 2007). Le grand dilemme du concepteur et de l’opérateur d’une usine de traitement d’eau consiste donc à faire une désinfection suffisante pour inactiver les micro-organismes pathogènes tout en évitant une production excessive de sous-produits de désinfection. Ainsi, depuis les années 70 et 80, la préchloration des eaux de surface riches en matières organiques disparaît progressivement, étant donné la préoccupation grandissante quant à la formation de SPD comme les trihalométhanes (THM) et les acides haloacétiques (AHA). Depuis la découverte des SPD,
les normes sur ces contaminants ont eu tendance à se resserrer. Par exemple, aux États-Unis, la norme sur les THM totaux (chloroforme, bromodichloro-méthane, chlorodibromométhane et bromoforme) a été réduite de 100 à 80 µg/L en décembre 1998 (USEPA, 2006). Depuis le règlement (RQEP) de juin 2001, au Québec, les THM totaux sont normés à 80 µg/l (moyenne annuelle) alors que la précédente norme de 1984 était de 350 µg/l. La refonte du RQEP en février 2012 maintient la norme de 80 µg/L pour les THM totaux et introduit une nouvelle concentration maximale de 60 µg/L pour les AHA totaux (acide monochloroacétique, acide dichloroacétique, acide trichloroacétique, acide monobromoacétique et acide dibromoacétique) qui deviendra effective à partir du 8 mars 2013 (Gouvernement du Québec, 2012). Considérant cette tendance au resserrement de normes sur les SPD, il est d’autant plus important de maximiser l’enlèvement de la matière organique (précurseurs des SPD) pour éviter la formation de ces composés lors du traitement d’eau et lors du transport de l’eau dans le réseau de distribution. Rappelons que la formation de SPD est aussi favorisée par une température élevée de l’eau, par des doses élevées de désinfectants et par de longs temps de contact.
L’effet du temps de contact est particulièrement important dans les villes avec un vaste réseau de distribution, comme la ville de Québec (VQ). Effectivement, l’ensemble des réseaux de distribution de la ville de Québec est vaste et complexe, étant donné que certaines conduites sont âgées de plus de 100 ans et qu’il s’étend sur plus de 2450 kilomètres. Il est composé de conduites de diamètres variés, de postes de surpression, de postes de réduction de pression, de postes de rechloration et de réservoirs. Ces derniers permettent de combler l’écart entre la capacité de traitement d’eau de la ville et la demande d’eau qui fluctue constamment (Ville de Québec, 2005). Le réseau de distribution de la Ville de Québec est alimenté principalement par 4 usines, dont deux nouvelles usines situées à Charlesbourg et à Beauport. La plus grosse usine de production d’eau potable de la Ville de Québec, celle du secteur centre (Loretteville) dont la construction a été terminée au début des années 70, peut produire plus de 220 000 m3 d’eau/jour et puise son eau dans la rivière St-Charles. Cette usine fait appel à une filière conventionnelle de traitement : coagulation, floculation, décantation, filtration, désinfection (ozone et chlore). Depuis les années 90, des réfections importantes ont été effectuées dans cette usine. Relativement
récemment, le point d’ajout d’ozone, qui était situé en aval de la filtration granulaire, a été déplacé entre la décantation et la filtration granulaire (inter-ozonation). Ce changement devrait favoriser la biodégradation de différentes substances organiques et la biotransformation de composés inorganiques, comme l’ammoniaque, dans les filtres granulaires. La Ville de Québec envisage aussi de changer le milieu granulaire dans les filtres en remplaçant l’anthracite par du charbon activé en grain (CAG). En effet, d’après certaines études, la filtration sur CAG précédée d’une ozonation serait plus efficace que la filtration bicouche conventionnelle précédée d’une ozonation pour enlever les composés biodégradables et pour la nitrification, c’est-à-dire pour la biotransformation de l’ammoniaque en nitrates. Cette préoccupation face à un meilleur enlèvement des composés organiques est issue en partie de l’apparition, dans la baie de l'Écho au lac Saint-Charles (APEL, 2009) à l’été 2006, de fleurs d'eau de cyanobactéries dont certaines peuvent sécréter des cyanotoxines qui sont en partie des substances organiques biodégradables. À titre expérimental, un des 16 filtres de l’usine du secteur centre de la Ville de Québec a été converti en filtre avec CAG. La Ville de Québec a demandé à la Chaire en eau potable de l’Université Laval de faire un suivi de ce filtre avec CAG et d’un filtre conventionnel bicouche pour comparer les performances de traitement de ces deux types de filtre dans des conditions réelles d’exploitation. Ce suivi fait l’objet de l’étude qui est présenté dans ce mémoire qui est structuré comme suit.
Après une revue de littérature au 2e chapitre, les objectifs sont présentés dans le chapitre 3. Le matériel utilisé et la méthodologie suivie sont décrits au chapitre 4. Finalement, la présentation et l’analyse des résultats est faite au chapitre 5 tandis que les conclusions se retrouvent au chapitre 6.
Chapitre 2 – État des connaissances
La potabilisation de l’eau vise les objectifs suivants (Bouchard, 2010) :
Diminuer, sous des seuils acceptables, les risques d’infection et d’intoxication liés à l’ingestion de l’eau, en particulier;
o Enlever ou inactiver les micro-organismes pathogènes;
o Enlever les substances toxiques ou les transformer en composés inoffensifs; o Limiter la formation de composés toxiques, tels que les sous-produits
d’oxydation/désinfection (SPD);
Produire une eau esthétiquement acceptable (goût, odeur, couleur);
Produire de l’eau en quantité suffisante, à un coût raisonnable et sans interruption; Produire une eau dont la qualité se maintiendra le plus possible dans le réseau de
distribution et qui ne favorisera pas la dégradation de ce réseau;
Limiter les impacts humains et environnementaux néfastes de la production d’eau potable.
Plusieurs étapes de traitement sont en général nécessaires pour atteindre ces objectifs. En Amérique du Nord, la filière de potabilisation la plus répandue pour les eaux douces de surface est appelée «traitement conventionnel». Cette filière comprend les étapes de traitement suivantes dans les cas où l’eau potable est distribuée via un réseau de distribution (Crittenden et al., 2005) : coagulation, floculation, décantation, filtration rapide sur lit granulaire, désinfection primaire, traitement anticorrosion, désinfection secondaire.
Il existe de nombreuses variantes de cette filière dite conventionnelle qui varient par l’omission d’une étape de traitement (p. ex. filtration directe sans décantation), par la combinaison d’étapes de traitement (p. ex. chloration qui permet d’assurer en même temps les désinfections primaire et secondaire), par des variantes de procédés (p. ex. ultrafiltration ou flottation à l’air dissous à la place de la filtration rapide sur lit granulaire) ou de technologie (p. ex. décantation à flocs lestés versus décantation simple).
Chaque étape de traitement concourt, à divers degrés, au respect des normes sur l’eau potable qui sont rassemblées, au Québec, dans le RQEP (Gouvernement du Québec, 2012). Dans une filière conventionnelle de traitement, l’étape de filtration rapide sur lit granulaire sert avant tout à poursuivre l’enlèvement physique de particules et de pathogènes qui a déjà été fait en grande partie par décantation. En faisant une oxydation par ozonation préalablement à la filtration, on favorise également la biodégradation de la matière organique dissoute (MOD) dans le milieu filtrant granulaire. En changeant le milieu filtrant, on peut aussi chercher à favoriser les processus de biodégradation dans le filtre.
Dans le présent chapitre, les principes et les mécanismes de filtration rapide sur lit granulaire sont d’abord rappelés. Puis les principes, les mécanismes et la mise en œuvre de l’activation biologique d’un filtre rapide sont décrits plus en détails puisque ce mode d’opération fait l’objet de la présente étude.
2.1 Filtration rapide sur lit granulaire
2.1.1 Principes généraux
Comme son nom l’indique un filtre rapide sur lit granulaire implique l’écoulement à travers un milieu poreux constitué par une ou plusieurs couches de milieux granulaires. La configuration la plus répandue est le filtre gravitaire bicouche (anthracite et sable) tel que schématisé à la Figure 1. Mentionnons aussi qu’il existe des filtres monocouches contenant uniquement du sable mais de plus forte granulométrie que le sable d’un filtre bicouche (MDDEP vol.1, 2006). Les caractéristiques générales des sables et anthracites utilisés dans les filtres bicouches sont montrées au Tableau 1. Les grains de sable sont plus denses, plus durs et plus petits que les grains d’anthracite. Ces deux milieux granulaires n’ont aucune porosité interne.
Tableau 1 : Caractéristiques des milieux granulaires utilisés en filtration rapide (Crittenden et al., 2005)
Caractéristique Sable Anthracite Charbon actif en grains Taille effective, d10(1) (mm) 0,4 à 0,8 0,8 à 2,0 0,8 à 2,0 Coefficient d’uniformité (d60/d10) (1) 1,3 à 1,7 1,3 à 1,7 1,3 à 2,4
Porosité du lit(2) (%) 40 à 43 47 à 52 (3)
Dureté de Moh 7 2 à 3 (4)
Masse volumique du matériau des grains
(g/cm3) 2,65 1,4 à 1,8 1,3 à 1,7
(1) Les diamètres, d10 et d60 réfèrent aux ouvertures des mailles des tamis qui laissent passer, respectivement 10 % et 60 % de la masse des grains
(2) Il s’agit de la porosité qui correspond aux espaces entre les grains. (3) Similaire à la porosité d’un lit d’anthracite
Dans un filtre rapide bicouche, l’eau s’écoule par gravité en traversant d’abord une couche d’anthracite puis en traversant une couche de sable. Au fur et à mesure que l’eau est filtrée, des particules s’accumulent dans le milieu filtrant ce qui fait augmenter la perte de charge. Cela conduit ultimement à la percée du filtre c’est-à-dire à une dégradation de la qualité de l’eau filtrée (augmentation de la turbidité) quand la capacité de capture des particules du filtre est dépassée. Le fonctionnement de ce type de filtre est donc cyclique, c’est-à-dire qu‘il faut régénérer la capacité de capture du milieu filtrant périodiquement. La dénomination plus complète de ce type de filtre est donc «filtration rapide sur lit granulaire avec lavages intermittents». En pratique les lavages sont déclenchés quand la perte de charge est trop élevée ou lorsque la turbidité à l’eau filtrée dépasse une consigne préétablie inférieure à la norme visée (voir Figure 2). Ce sont des rétro-lavages («backwash»), généralement à l’eau et à l’air, qui permettent de décoller les particules accumulées sur les grains de sable et d’anthracite. Une maturation du filtre (appelée aussi «préfiltration») est nécessaire après un lavage avant de recommencer à produire de l’eau (phase dite de «production») qui sera acheminée dans les dernières étapes de potabilisation. Cette maturation permet d’éliminer les impuretés qui auraient pu rester dans le milieu filtrant après le lavage et surtout de conditionner la surface des grains (augmentation de l’affinité de surface; voir ci-après) pour obtenir un enlèvement adéquat subséquent des particules.
Figure 2 : Évolution de la perte de charge et de la turbidité à l’eau filtrée durant les différentes phases d'un cycle de filtration (Bouchard, 2010)
En raison de sa plus grande granulométrie (voir Tableau 1), l’anthracite confère à ce type de filtre une bonne capacité de stockage de particules tout en réduisant la vitesse à laquelle la perte de charge augmente, ce qui permet d’obtenir des cycles de filtrations plus longs. La couche de sable (de plus faible granulométrie) permet quant à elle de maintenir une bonne qualité de filtrat. La masse volumique de l’anthracite, qui est nettement plus faible que celle du sable, lui permet de se maintenir au-dessus de la couche de sable (MDDEP vol.1, 2006).
Le qualificatif «rapide» réfère à la vitesse de filtration qui se situe normalement entre 5 et 10 m/h (MDDEP vol.1, 2006). La filtration dite lente réfère à une filtration réalisée à des vitesses de filtration beaucoup plus faibles, à des mécanismes de séparation différents (formation d’une couche superficielle fortement colonisée par des microorganismes) et à un mode d’opération différent (aucun rétro-lavage mais plutôt des renouvellements relativement peu fréquents de la couche superficielle du milieu filtrant).
2.1.2 Mécanismes de rétention des particules
Rappelons que le but premier de la filtration rapide sur lit granulaire est de poursuivre l’enlèvement des particules, particulièrement les pathogènes, qui a été fait en partie lors de la décantation. Dans ces filtres, on cherche à ce que la capture des particules se fasse sur toute la profondeur du milieu filtrant, contrairement à la filtration de surface où, comme son
nom l’indique, les particules sont retenues essentiellement à la surface d’un milieu poreux fin.
Contrairement à ce que l’on pourrait croire, la capture des particules dans un tel milieu granulaire est due principalement à leur adsorption à la surface des grains (adsorption dite «externe») plutôt qu’au tamisage. Effectivement, la plupart des particules qui sont enlevées sont significativement plus petites que les espaces entres les grains du milieu filtrant, ce qui limite grandement le phénomène de tamisage. En fait, l’enlèvement des particules se fait en deux étapes : transport à la surface des grains puis attachement sur les grains.
Il y a 3 mécanismes de transport des particules à la surface des grains, tel qu’illustré à la Figure 3 (Crittenden et al., 2005) :
A. Interception : lorsqu’une particule entre en collision avec un grain à cause de la proximité de la surface du grain et de la ligne de courant suivie par la particule; B. Inertie ou sédimentation : lorsque la particule dévie de sa ligne de courant pour
entrer en collision avec un grain par la force inertielle ou gravitationnelle;
C. Diffusion : lorsque la particule entre en collision avec un grain à cause du mouvement Brownien aléatoire qui la fait s’écarter de sa ligne de courant.
Figure 3 : Mécanismes de transport des particules à la surface des grains de média filtrant lors de la filtration (Crittenden et al., 2005)
L’efficacité de transport d’une particule à proximité d’un grain dépend de sa taille, de sa masse volumique, de la vitesse de filtration, de la température de l’eau et de la granulométrie du milieu filtrant. Toutes choses étant égales par ailleurs, il a été montré qu’il existe une taille de particule critique pour laquelle le transport est le moins efficace et donc l’enlèvement est le moins bon. Pour les conditions rencontrées au début d’un cycle de filtration, cette taille critique serait de l’ordre de quelques microns (Yao et al., 1971).
L’efficacité de l’attachement des particules sur les grains dépend de l’affinité de surface, c’est-à-dire des forces interfaciales, entre les particules et la surface des grains. Cette affinité de surface dépend fortement de la déstabilisation des particules par coagulation qui est faite en début de traitement. La coagulation vise à réduire la charge négative des particules ce qui limite les répulsions électrostatiques particules-particules et celles entre les particules et les grains du milieu filtrant qui ont tendance aussi à être chargés initialement négativement. Le conditionnement des particules avant la filtration est donc essentiel à une bonne capture de ces particules sur les grains de milieu filtrant.
2.1.3 Suivi des performances
Dans une filière conventionnelle de potabilisation de l’eau, la performance d’enlèvement des particules à différents stades de traitement est suivie indirectement via la turbidité de l’eau filtrée qui est une mesure optique particulièrement sensible à la présence de fines particules. Au-delà de l’objectif esthétique de produire une eau limpide, l’enlèvement des particules est doublement lié à l’objectif de désinfection de l’eau. En effet, la présence de particules gène la désinfection chimique réalisée à l’aide d’un oxydant et la désinfection physique réalisée par rayonnement ultraviolet (UV). De plus, la turbidité à l’eau filtrée est considérée comme un indicateur du fonctionnement du traitement physicochimique (coagulation, floculation, décantation, filtration granulaire) en termes d’enlèvement des pathogènes (virus et protozoaires). À défaut de pouvoir suivre directement et de manière routinière, fiable et peu coûteuse l’enlèvement des pathogènes, on a donc recours, pour l’instant, au suivi de la turbidité à la sortie des filtres. C’est pourquoi il existe au Québec
des normes de turbidité à l’eau filtrée (on retrouve des normes similaires dans d’autres provinces canadiennes et dans d’autres pays). Pour un traitement conventionnel complet, ces normes stipulent que la turbidité ne doit pas dépasser 0,3 UTN plus de 5 % du temps (par période de 30 jours) et ne doit jamais dépasser 1 UTN (Gouvernement du Québec, 2012). Des crédits d’enlèvement de pathogènes sont également attribués aux procédés physico-chimiques en fonction de la turbidité de l’eau filtrée (MDDEP vol.1, 2006). Plus cette turbidité est faible et plus les crédits sont élevés ce qui réduit d’autant les taux d’inactivation à atteindre par désinfection.
2.2 Filtration rapide sur lit granulaire précédée d’une ozonation
À noter que cette partie de la revue de littérature est basée en partie sur l’étude de Bouchard et al. (2008).Tel que rappelé en introduction à ce chapitre, le fait d’ozoner l’eau avant filtration (inter-ozonation) favorise le développement de biomasse dans le filtre et donc augmente l’activité biologique dans le filtre. Cette stratégie (ozonation en amont de la filtration) se retrouve aussi en filtration lente pour augmenter l’enlèvement de matière organique dans un tel filtre.On peut également chercher à favoriser la croissance de biomasse dans un filtre en choisissant un milieu granulaire qui est plus propice à cette croissance. Le charbon actif en grain (CAG) est considéré comme un milieu granulaire favorisant, plus que l’anthracite et le sable, la croissance de biomasse et les processus de biodégradation ce qui ne veut pas dire qu’il n’y a pas de colonisation bactérienne dans un filtre bicouche anthracite-sable.
Le couplage d’effets physiques et biologiques dans un même filtre est généralement appelé biofiltration ou filtration biologique. Au Québec, la dénomination «filtration biologique» ou «filtration sur charbon actif biologique» est officiellement utilisée pour désigner un filtre granulaire bicouche CAG-sable qui est précédé d’une ozonation (MDDEP vol.1, 2006). La filière conventionnelle incluant une «filtration sur charbon actif biologique», qui est la plus répandue au Québec, est schématisée à la Figure 4. Cette définition de la filtration biologique peut porter à confusion car cela laisse croire que la biodégradation ne peut avoir
lieu que dans des filtres rapides avec CAG. Or, il existe d’autres procédés de filtration biologique en eau potable (filtration lente, enlèvements biologiques du fer et du manganèse, bioréacteur à membrane). De plus, d’autres milieux granulaires que le CAG peuvent être colonisés (voir section 2.2.3).
Eau brute (EB) Eau ozonée (EO)
Eau du réseau (ER) Coagulation et
floculation Décantation à flocs lestés Inter-ozonation
Désinfection finale Eau filtrée (EF) Réseau de
distribution Eau chlorée Ozone Chlore Consommateur Coagulant / floculant Filtration (Biofiltration sur CAG) Microsable Boue + sable Sable recirculé
Eau décantée (ED)
Figure 4: Filière conventionnelle avec une filtration sur CAG biologique (filière avec une seule étape de filtration granulaire)
Rigoureusement, il n’y a pas de limite stricte entre la filtration et la biofiltration ou la filtration biologique. En effet, à moins d’appliquer une dose suffisante de désinfectant pour avoir une concentration résiduelle de désinfectant dans tout le milieu filtrant qui y empêcherait le développement de biomasse, il y a toujours une certaine activité biologique et donc une certaine biodégradation dans un filtre rapide.
Dans le cadre du présent mémoire, on se bornera donc à parler de filtre rapide précédé d’une inter-ozonation même si la littérature qui est citée fait principalement référence à des filtres avec du CAG. Ce type de filtre est présenté en détails dans ce qui suit, en plus des objectifs et les mécanismes de traitement, les matériaux filtrants utilisés et la mise en œuvre de ce type de filtre. Un rappel des effets de l’ozonation sur la MOD sera présenté compte tenu de l’importance de ce traitement préalable.
2.2.1 Objectifs de traitement
Qu’elle soit précédée ou non d’une ozonation, il est important de rappeler que la filtration rapide vise avant tout à compléter l’enlèvement des particules et des pathogènes tel qu’expliqué à la section 2.1.2. De plus, l’augmentation de l’activité biologique dans un filtre rapide, grâce à l’inter-ozonation et éventuellement grâce au choix judicieux de milieu filtrant, vise essentiellement un accroissement de l’enlèvement de la MOD et une nitrification, c’est-à-dire une conversion biologique de l’ammoniaque (NH4+) en nitrates (NO3-). L’enlèvement de composés organiques biodégradables, naturels ou d’origine anthropique, rejoint plusieurs objectifs de potabilisation de l’eau qui ont été présentés en début de chapitre :
Amélioration des propriétés organoleptiques de l’eau (goût et odeur principalement);
Réduction de la demande en chlore (la MOD exerce une demande en chlore); Enlèvement des précurseurs de formation de SPD (une fraction de la MOD peut
réagir avec le désinfectant utilisé en aval de la filtration); Augmentation de la stabilité biologique de l’eau dans le réseau;
Enlèvement de micropolluants ou de sous-produits de d’ozonation réalisée en amont de la filtration.
Ces objectifs sont en bonne partie communs à l’ozonation qui permet une oxydation plus ou moins poussée de différents composés organiques et qui, en plus, vise habituellement une désinfection de l’eau par inactivation des pathogènes.
2.2.2 Rappels sur l’ozonation et ses effets de l’ozonation sur la MOD
L’ozone est un oxydant puissant, le plus puissant connu après le radical OH●. L’ozone est très réactif et très instable. Il faut donc le produire sur place à partir d’air ou d’oxygène pur. Étant donné que l’ozone est très instable, il ne peut rester en concentration résiduelle suffisante dans le réseau de distribution. Il s’agit donc d’un désinfectant primaire qu’il faut associer à un désinfectant secondaire, comme le chlore, le bioxyde de chlore ou la chloramine. Au-delà de son rôle de désinfectant, l’ozone sert aussi à oxyder des composés indésirables comme les composés responsables des goûts et odeurs, généralement très résistants à l’oxydation. Une concentration entre 2,5 et 2,7 mg d’ozone/L avec un temps decontact de 10 minutes réduit grandement les goûts et odeurs de l’eau (MDDEP vol.2, 2006). L’ozone peut être injecté à l’eau brute (pré-ozonation), à la sortie des décanteurs (inter-ozonation) ou après les filtres pour des fins de désinfection et/ou d’oxydation. L’injection d’ozone dans une eau brute fortement chargée en COD n’est toutefois pas recommandée étant donné que cela peut nuire à la coagulation (Juhna and Melin, 2006).
Pour les doses utilisées en eau potable, la MOD est oxydée partiellement par l’ozone. Rappelons que la teneur globale en MOD se mesure habituellement en carbone organique dissous (COD). L’ozone peut agir avec la MOD sous forme moléculaire O3 (oxydation directe) ou sous forme radicalaire OH● (oxydation indirecte). L’oxydation directe est une réaction rapide et assez sélective au cours de laquelle la molécule O3 agit avec des composés aromatiques, les alcènes et des amines. La molécule O3 réagit plus rapidement avec les composés organiques dissous et ionisés qu'avec ceux de type neutre. Les composés organiques qui réagissent lentement avec l’ozone (acides aliphatiques, aldéhydes, cétones, certains pesticides comme l’atrazine, etc.) ont plus de chance de réagir par oxydation indirecte avec le radical OH●, lequel est non sélectif (Servais et al., 2005). Les substances humiques réagissent très rapidement avec l’ozone moléculaire O3 et avec les radicaux hydroxyles OH●. L’ozone modifie la structure des substances humiques. Cela se traduit par une diminution de leur poids moléculaire, une augmentation des groupements –COOH, une réduction de la couleur et une diminution de l’absorbance UV. Les produits de décomposition de la MOD en présence d’ozone sont, entre autres, des aldéhydes, des cétones et des acides carboxyliques.
Les produits d’oxydation sont globalement plus facilement et plus rapidement biodégradés que la MOD originale, ce qui se traduit par une augmentation de la fraction biodégradable du COD (Westerhoff et al., 1999). Le carbone organique dissous biodégradable (voir la section 4.3.2 pour la méthode d’analyse), CODB, augmente donc après ozonation. La fraction rapidement biodégradable du carbone organique dissous (CODBrapide) peut être enlevée lors de la filtration subséquente alors que la fraction lentement biodégradable (CODBlent) se retrouve dans le réseau de distribution et favorise donc la recroissance microbienne. Par rapport à une filtration suivie d’une ozonation, la filtration après
ozonation permet donc de réduire la concentration de matière organique assimilable dans l’eau traitée. La croissance bactérienne dans le réseau de distribution n’est pas souhaitable étant donné que certaines bactéries qui peuvent s’y développer sont potentiellement pathogènes pour l’être humain (Juhna and Melin, 2006). La croissance de microorganismes peut aussi augmenter les processus de corrosion. Cette croissance des microorganismes est limitée par l’ajout d’un désinfectant secondaire.
Carlson et Amy (1997; 2001) ont étudié en laboratoire l’effet de la dose d’ozone sur la formation de CODB à l’aide d’eaux brutes provenant de trois sources différentes (rivière, réservoir et lac). Ces eaux présentaient des concentrations en COD variant de 1,9 à 4,7 mg/L. En 1997, ces auteurs ont observé que la fraction de COD pouvant être transformée en CODBrapide par ozonation était de 12-14 % pour ces trois sources d’eau. Selon leur étude, la formation de CODBrapide est reliée à la dose d’ozone et n’est pas sensible à la concentration de COD ou la nature de la MO, contrairement à la formation de CODBlent. Effectivement, la formation de CODBlent était peu sensible à la dose d’ozone, mais variait significativement entre les différentes sources d’eau (Carlson and Amy, 1997). En 2001, les mêmes auteurs ont observé que la dose optimale d’ozone pour maximiser le ratio CODBrapide/CODBtotal, c’est-à-dire pour maximiser la biodégradation dans les filtres plutôt que dans le réseau de distribution, était d’environ 0,5 à 0,6 mg O3/mg de COD (Figure 5), ce qui rencontre en même temps la plupart du temps les exigences de désinfection (Carlson and Amy, 2001).
Figure 5 : Effet de la dose d’ozone sur le ratio CODBrapide/CODB (Carlson and Amy, 2001)
Lorsque l’ozone est mis en contact avec la MOD et/ou des ions bromures, il y a formation de SPD. La Figure 6 illustre de manière schématique les mécanismes de formation de SPD avec l’ozone. La réaction 1 correspond à la formation d’aldéhydes, de cétoacides et d’acides carboxyliques (Crittenden et al., 2005). Les bromates (BrO3-) sont formés par réaction entre les ions hypobromite (OBr-) et l’ozone (O3) ou le radical libre hydroxyle (OH●). Il est nécessaire de minimiser la formation des bromates étant donné qu’ils sont potentiellement toxiques. La concentration maximale normée de bromates est de 10µg/L au Québec (Gouvernement du Québec, 2012). Les méthodes pour diminuer les concentrations de bromates sont de diminuer le pH ou d’ajouter de l’ammoniaque, ce qui a pour effet de transformer le HOBr en NH2Br, ce qui tend à favoriser la création de HOBr au dépend des ions OBr- (Crittenden et al., 2005). En dernier recours, il faut changer de mode de désinfection.
Figure 6 : Schéma simplifié des principales réactions chimiques de formation des sous-produits d'ozonation dans les eaux naturelles (Crittenden et al., 2005)
2.2.3 Milieux filtrants
Alors qu’une grande variété de milieux filtrants est utilisée dans les biofiltres traitant des eaux usées, les matériaux de garnissage des filtres rapides dans le domaine de l’eau potable, où on cherche à augmenter la biodégradation, sont beaucoup moins variés. Il s’agit principalement de CAG. L’utilisation de sable et d’anthracite a également été étudiée. L’argile expansée, la pierre ponce et le verre ont aussi été testés (Bayley et al., 2006; Uhl, 2002).
Des caractéristiques des sables, anthracites et CAG sont montrés au Tableau 1. Contrairement au sable et à l’anthracite, un CAG possède une porosité interne qui peut dépasser 1000 m2/g. Un CAG est fabriqué par carbonisation et activation chimique ou thermique de divers matériaux bruts comme du charbon, du bois, des coques de noix de coco, etc. (Crittenden et al., 2005). Le matériau brut et le mode d’activation déterminent les propriétés du CAG, en particulier sa structure poreuse interne et la nature des sites d’adsorption interne. Dans le Guide de conception du MDDEP (MDDEP vol.2, 2006), on mentionne particulièrement deux CAG utilisés en traitement de l’eau potable à savoir les «microporeux d’origine bitumineuse» et les «macroporeux d’origine végétale». Le matériau de base a un effet sur la distribution des tailles de pores du produit final. Cependant, le matériau de base ne suffit pas à déterminer complètement la structure poreuse interne.
Ainsi, d’après Labouyrie et al. (1997), tous les CAG activés physiquement sont essentiellement microporeux alors que l’activation chimique permet de développer aussi une mésoporosité. Par contre, d’après ces auteurs, la macroporosité ne dépendrait pas de la méthode d’activation mais de la structure du matériau de base, les CAG à base de bois présentant une macroporosité plus développée. (Labouyrie et al., 1997)
Les propriétés de base d’un milieu filtrant (taille et forme des grains, nature et structure du matériau constituant les grains) déterminent les caractéristiques suivantes:
la surface spécifique externe () qui est disponible pour l’adsorption externe et le développement du biofilm (m2/m3) à la surface des grains du milieu; plus la granulométrie est faible et plus augmente;
la capacité d’attachement d’un biofilm et donc la facilité de détachement du biofilm lors du lavage du milieu filtrant et la rapidité à laquelle a lieu la colonisation du milieu filtrant;
la capacité d’adsorption interne de micropolluants qui dépend de la surface spécifique interne (m2/g) des grains et de la nature des sites d’adsorption.
Un CAG est au départ un matériau adsorbant. Il peut d’ailleurs être utilisé comme tel (mode adsorption) pour enlever des composés qui peuvent s’adsorber à l’intérieur des pores des grains de charbon actif. En mode adsorption, une fois que sa capacité d’adsorption interne est épuisée, un CAG doit être enlevé et remplacé par du matériau neuf ou régénéré. Le procédé d’adsorption sur CAG est très efficace pour enlever le COD qu’il soit biodégradable ou non mais il s’agit aussi d’un procédé coûteux en raison du prix relativement élevé du CAG ou de sa régénération. Mais un CAG, dont la capacité d’adsorption interne est épuisée, peut encore servir de milieu filtrant et de support à une biomasse pour enlever de la MOB et pour la nitrification. Un tel CAG est généralement dénommé CAG biologique (CAGB ou CAB). En fait, le passage du mode adsorption au mode biodégradation, se fait graduellement tel que montré à la Figure 7, où l’enlèvement de la matière organique est montré en terme de COD.
Figure 7 : Évolution des mécanismes d’enlèvement du COD dans un filtre CAG (Bouillot et al., 1992)
2.2.4 Activité biologique
Comme l’eau contient de l’oxygène dissous, du CODB et généralement un peu d’ammoniaque et des nutriments, les milieux filtrants sont progressivement colonisés par des bactéries qui se fixent sur la surface externe des grains du filtre, les micropores du CAG étant trop petits pour que les bactéries y pénètrent (van der Aa et al., 2002). Les micro-organismes qui colonisent le CAGB peuvent inclure des bactéries (bâtonnets, cocci et filamenteuses), des protozoaires, des champignons (Chien et al., 2008) et des invertébrés (Li et al., 2010). Li et al. (2010) ont fait une caractérisation poussée de ces invertébrés, identifiant 37 espèces d’invertébrés dont 28 étant des rotifères. Les bactéries responsables de l’élimination du CODB sont hétérotrophes aérobies (ex : Pseudomonas, Acinetobacter). La réaction globale est la suivante :
CODB + O2 → CO2 + H2O + biomasse
Les bactéries nitrifiantes sont autotrophes aérobies et transforment l’ion ammonium en nitrates par nitrification. La nitrification s’effectue en deux étapes :
- la nitritation : transformation de l’ion ammonium en nitrites par les bactéries du genre Nitrosomonas 4 2 2 2 3 2 2 NH O HH O NO
- la nitratation : transformation des ions nitrites en nitrates par les bactéries du genre Nitrobacter
2 2 3
1 2
NO O NO
La réaction globale s’écrit :
4 2 2 3 2 2
NH O NO HH O
Wang et al. (1995) ont évalué la quantité de biomasse présente dans trois types de filtres (voir Tableau 2). La quantité de biomasse dans les biofiltres diminue au fur et à mesure que la profondeur du filtre augmente. L’enlèvement de la MOD se ferait donc principalement dans la couche supérieure des filtres. Ces auteurs ont comparé les quantités de biomasse fixées sur différents supports. Selon eux, le CAGB peut contenir de 5 à 8 fois plus de biomasse que l’anthracite ou le sable. Par contre il n’y aurait pas nécessairement de relation directe entre la quantité de biomasse présente dans un biofiltre et la performance de ce biofiltre (Juhna and Melin, 2006). (Wang et al., 1995)
Tableau 2 : Quantité de biomasse dans différents filtres après 95 jours et 1 an d'opération (d’après Wang et al. 1995)
Milieu biofiltrant
Biomasse fixée (nmol phospholipides(1)/g de milieu biofiltrant)
Après 95 jours Après 1 an
Surface Surface 15 cm de profondeur 30 cm de profondeur Anthracite-sable 55 64,8 41 - sable 90,6 - - - CAG1-sable 305 287 234 171 CAG2-sable 465 419 273 249 CAG3-sable 382 267 175 -
CAG1 : « microporeux »-Filtrasorb 400
CAG2 : « mésoporeux »-Norit Hydrodarco 4000 CAG3 : « macroporeux »-Picabiol
(1) Composants des membranes cellulaires
Simpson (2008) a également observé que l’activité du biofilm microbien augmente drastiquement lorsqu’adsorbé sur du CAGB. Cela serait dû en partie au fait que les biofilms fixés sur du CAGB sont moins affectés par les conditions environnementales (température, pH, nutriments, produits métaboliques et substances toxiques) que ceux fixés sur du sable ou de l’anthracite (Pedersen, 1990). Il est possible d’évaluer l’activité du biofilm à l’aide de tests biochimiques pour mesurer certaines enzymes spécifiques ou des produits spécifiques du métabolisme bactérien (Lazarova and Manem, 1995). Les conditions dans la phase liquide du lit de CAGB sont aussi indicatrices de l’activité du biofilm. Par exemple, un nombre important de protozoaires ciliés et de rotifères nageant librement dans la phase liquide du lit de CAGB est indicateur d’un enlèvement appréciable de carbone organique par les bactéries attachées à la surface du CAG ou celles encastrées dans la matrice extracellulaire (Madoni et al., 2001; Scholz and Martin, 1998). Des ratios désirables de bactéries et de protozoaires peuvent être recherchés pour optimiser la croissance du biofilm sur le CAGB en changeant le pH, la concentration d’oxygène dissous et les nutriments
disponibles à l’entrée du filtre biologique (Scholz and Martin, 1997; Seredyńska-Sobecka et al., 2006).
La faible concentration en matière organique à l’affluent des biofiltres utilisés en eau potable (par rapport aux concentrations retrouvées dans les eaux usées) ne semble pas nuire au taux de croissance de la biomasse. En effet, le taux maximal de croissance de l’ordre de 0,1 h-1 (g cellules produites/g cellules.h) qui a été observé par Magic-Knezev et van der Kooij (2006) a été atteint à faible concentration de substrat (10 µgC/L en acétate). Ce taux de croissance a été mesuré pour le genre Polaromonas qui serait un des genres prédominants dans les biofiltres en eau potable (Magic-Knezev and van der Kooij, 2006) malgré que Li et al. (2010) aient trouvé le genre Lepadella. Même s’il est considéré comme faible par Magic-Knezev et van der Kooij (2006), il est à noter que cet ordre de grandeur est comparable à la gamme typique de taux de croissance qui est observé en traitement des eaux usées (Metcalf & Eddy, 2003). Le taux maximal de croissance varie en fonction du pH et de la température (van der Aa et al., 2006).
En termes de rendement, des taux d’enlèvement de 0 à 30 µg CODB/(L·min) sont rapportés par Huck et al. (1994). Ces taux ont été calculés avec l’Équation 1 : (Huck et al., 1994)
. Caffluent Ceffluent Taux enl TCFV Équation 1Où Taux enl.= Taux d’enlèvement de CODB (µg /(L.min)) TCFV= Temps de contact en fût vide (min)
Caffluent = concentration de CODB à l’entrée du biofiltre (µg/L) Ceffluent = concentration de CODB à la sortie du biofiltre (µg/L)
D’autre part, plusieurs auteurs mentionnent le phénomène de biorégénération de la capacité d’adsorption interne dans les filtres au CAGB (maintien d’une certaine capacité d’adsorption interne en mode biologique). Deux mécanismes sont proposés dans la littérature pour expliquer ce phénomène :
Le premier mécanisme implique une biodégradation suite à une désorption des composés organiques, la désorption étant causée par le gradient de concentration entre la surface du CAGB et la phase liquide du lit filtrant;
Le deuxième mécanisme implique l’excrétion d’exo-enzymes par les micro-organismes et leurs réactions avec les substrats adsorbés (Aktaş and Çeçen, 2007).
Certains chercheurs croient que la deuxième hypothèse est peu probable compte tenu de la faible taille des pores et de l’espace déjà occupé par les matières adsorbées (Aktaş and Çeçen, 2006; Klimenko et al., 2002). Il est aussi difficile expérimentalement de séparer les phénomènes d’adsorption et de biodégradation ce qui gêne l’étude du phénomène de biorégénération.
2.2.5 Paramètres de conception et conditions d’opération
D’après Huck et al. (2000), les principaux facteurs qui affectent les performances d’un biofiltre sont : (Huck et al., 2000)
La température de l’eau;
Le temps de contact en fût vide (TCFV); Le type de milieu filtrant;
La méthode de lavage;
Le temps écoulé depuis le démarrage du filtre; La charge en matière organique biodégradable.
Comme on pourra le constater dans ce qui suit, tous les auteurs ne s’entendent pas sur les effets de ces paramètres sur les performances de biofiltration. En fait, Huck et Sozański (2008) considèrent que les critères de conception de la biofiltration n’ont pas encore été clairement définis. (Huck and Sozański, 2008)
2.2.5.1 Température de l’eau
Il est clair qu’une augmentation de température augmente l’activité biologique (Juhna and Melin, 2006). D’après Bouillot et al. (1992), pour un même abattement du CODB, il faut doubler le temps de contact lorsque la température passe de 18 °C à 7,5 °C. La faible température de l’eau pendant l’hiver peut donc représenter un problème pour l’enlèvement de la MOB. Par exemple, Merlet et al. (1992) ont observé des enlèvements du COD par biofiltration de 0 à 15 % en hiver et de 25 à 30 % en été. Cette perte d’efficacité due à une diminution de température s’observe surtout dans les biofiltres qui ont un court TCFV, c’est-à-dire de moins de 15min environ (Juhna and Melin, 2006).
(Bouillot et al., 1992; Merlet et al., 1992)
Au sein des filtres au CAGB se développe aussi une biomasse nitrifiante. Une étude sur l’impact de la température sur la nitrification dans les filtres au CAGB a montré qu’un enlèvement presque total de l’ammoniaque peut être réalisé à des températures chaudes (>16 °C) avec des TCFV courts (< 5 min). Par contre, à de faibles températures, la nitrification devenait presque nulle, bien que la biomasse nitrifiante soit encore fixée sur le média, et ce même 3 semaines après la baisse de température (Andersson et al., 2001).
La température de l’eau influe aussi l’adsorption à l’intérieur des pores qui serait maintenue en partie par biorégénération (voir section 2.2.4). Selon les isothermes d’adsorption théoriques, plus la température est élevée, moins l’adsorption devrait être importante. Par contre, certaines expériences ont montré qu’il y avait plus d’adsorption de MON avec des températures d’eau plus élevées (Schreiber et al., 2005; Summers and Roberts, 1988), des résultats allant à l’inverse de cette prédiction théorique.
2.2.5.2 Temps de contact en fût vide (TCFV)
Le temps de contact est considéré par beaucoup comme la variable clé dans la conception et l’opération des bioréacteurs que sont aussi les filtres précédés d’une ozonation. Comme le temps de contact réel est souvent inconnu, il est remplacé par le TCFV. Ce dernier se calcule en divisant le volume occupé par le lit filtrant par le débit d’alimentation du filtre :
CAB V h TCFV Q v Équation 2 Où :
TCFV = temps de contact en fût vide (min) VCAB = volume de média dans le filtre (m3) Q = débit de filtration (m3/min)
h = hauteur du lit de milieu filtrant du filtre (m) v = Vitesse de filtration (m/min)
Un temps de contact normalisé a été proposé par Huck et Sozański (2008). Ce paramètre inclut le TCFV, la surface spécifique externe des grains et des paramètres reliés à la biodégradation du substrat. Ce paramètre fait ressortir l’effet du TCFV mais aussi l’effet de la surface spécifique externe qui est dépendante de la granulométrie du milieu filtrant.
Le TCFV varie en général de 5 à 15 minutes mais peut aussi dépasser 30 minutes (MDDEP vol.2, 2006). De 10 à 20 minutes permettrait d’atteindre les abattements souhaités de la MOB (MDDEP vol.1, 2006). L’enlèvement du CODB augmente avec le TCFV, mais pas de manière proportionnelle (Griffini et al., 1999; Huck and Sozański, 2008). Les travaux de Merlet et al. (1992) illustrent, pour deux filtres avec CAGB, comment l’enlèvement de CODB (Figure 8) et la réduction de la consommation de chlore (Figure 9) augmentent avec le TCFV.
Figure 8 : Enlèvement en mg/L de COD et CODB par deux CAGB différents par rapport au TCFV (Merlet et al., 1992)
Figure 9 : Réduction de la demande en chlore (sur 7 jours) et du COD pour deux CAGB en fonction du TCFV (Merlet et al., 1992)
2.2.5.3 Milieux filtrants
De nombreux chercheurs concluent que le milieu filtrant a un impact important sur les processus de biodégradation. Plusieurs auteurs ont montré que l’enlèvement de la MON est plus important dans un filtre avec du CAGB plutôt que de l’anthracite (Chien et al., 2008; Emelko et al., 2006; Lechevallier et al., 1992; Merlet et al., 1992; Wang et al., 1995). Néanmoins, plusieurs études démontrent que la biofiltration peut être implantée avec succès dans des filtres anthracite-sable (Huck and Sozański, 2008; Huck et al., 2000). Toutefois, comparativement aux filtres anthracite-sable, les filtres CAGB-sable semblent :
Procurer un meilleur enlèvement de la MOB aux températures plus froides (Emelko et al., 2006; Huck and Sozański, 2008; Juhna and Melin, 2006). Cela pourrait être attribué aux processus d’adsorption interne qui seraient biorégénérés en continu (Lechevallier et al., 1992);
Établir un biofilm enlevant la MOB plus rapidement et permettre un rétablissement plus rapide de l’enlèvement de la MOB après une période d’arrêt (Krasner et al., 1993);