© Ariane Dionne, 2019
Conception et mise à l’épreuve d’un prototype de
pulvérisation de pupes de trichogrammes pour la lutte
biologique contre la pyrale dans la culture du maïs
sucré
Mémoire
Ariane Dionne
Maîtrise en génie agroalimentaire - avec mémoire
Maître ès sciences (M. Sc.)
Conception et mise à l’épreuve d’un prototype de
pulvérisation de pupes de trichogrammes pour la
lutte biologique contre la pyrale dans la culture du
maïs sucré
Mémoire
Ariane Dionne
Sous la direction de :
iii
Résumé
Le maïs sucré requiert de nombreuses applications d’insecticides pour lutter contre son principal ravageur : la pyrale du maïs (Ostrinia nubilalis) (Lepidoptera: Crambidae). La lutte biologique à l’aide de trichogrammes s’avère une alternative efficace afin de réduire l’usage excessif des pesticides dans la culture du maïs sucré. Toutefois, l’introduction manuelle des trichocartes nécessite beaucoup de temps lorsqu’elle est utilisée à grande échelle et son usage demeure marginal au Québec. La mécanisation des introductions de pupes de trichogrammes à l’aide d’un pulvérisateur à rampe constitue une solution innovatrice et avantageuse pour les producteurs agricoles. L’objectif de cette étude était de concevoir et de mettre à l’épreuve un pulvérisateur pour l’introduction de pupes de Trichogramma ostriniae (Hymenoptera: Trichogrammatidae) sous des conditions réelles au champ. Pour ce faire, des pupes de T. ostriniae ont été pulvérisées à une dose de 800 000 pupes par hectare à l’aide d’un pulvérisateur à rampe conçu au Département des sols et de génie agroalimentaire de l’Université Laval. Des trichocartes ont également été introduites à une dose de 500 000 pupes par hectare. Huit lâchers ont été effectués durant la saison 2016. Les résultats des essais au champ ont démontré une réduction du taux d’émergence des trichogrammes pulvérisés de 17,21% par rapport à celui des trichocartes. La fécondité totale et la longévité des femelles T. ostriniae n’ont pas été négativement affectées par la pulvérisation, ce qui indique que la pulvérisation n’a aucun impact sur leur qualité. Les taux de parasitisme sur les masses naturelles et sur les masses sentinelles ont été comparables pour les deux méthodes d’introduction. Dans les parcelles pulvérisées, toutes les masses naturelles dépistées à partir du cinquième lâcher ont été parasitées tandis qu’aucune masse dépistée avant le cinquième lâcher n’a été parasitée. À la récolte, les traitements par pulvérisation et par trichocartes ont permis un contrôle adéquat de la pyrale du maïs pour la saison 2016 démontrant que les doses utilisées étaient appropriées. De plus, l’introduction de pupes de trichogrammes a été 1,7 fois plus rapide que celle des trichocartes. Toutefois, le coût de pulvérisation par hectare par introduction était 30% plus élevé que celui de l’introduction manuelle de trichocartes en raison des coûts reliés aux gommes de guar et de xanthane qui composent la solution de pulvérisation. En somme, les résultats indiquent que la pulvérisation est une technique prometteuse pour une introduction efficace et viable des pupes de trichogrammes. Des recherches subséquentes sur de plus grandes parcelles avec un fort historique de pyrale du maïs sont recommandées pour
iv
optimiser davantage les paramètres de pulvérisation et ainsi rendre son utilisation plus économique. Le système de pulvérisation de pupes de trichogrammes utilisé avec succès dans la culture du maïs sucré pourrait être adapté à d’autres cultures aux prises avec la pyrale telles que celles du poivron, des haricots et de la pomme de terre.
v
Abstract
Sweet corn requires many applications of insecticides to control its main pest: the European corn borer (Ostrinia nubilalis) (Lepidoptera: Crambidae). The biological control using Trichogramma is an effective alternative to reduce excessive use of pesticides in sweet corn. However, manual introduction of trichocards is time consuming when used at a large scale and its use remains marginal in Quebec. The mechanized introduction of Trichogramma pupae using a boom sprayer is an innovative and advantageous solution for growers. The objective of this study was to design and test a boom sprayer to introduce Trichogramma ostriniae (Hymenoptera: Trichogrammatidae) pupae under real field conditions. For this purpose, T. ostriniae pupae were sprayed at a rate of 800,000 pupae per hectareusing a boom sprayer designed at the Department of Soils and Agri-Food Engineering of Université Laval. Trichocards were also introduced at a rate of 500,000 pupae per hectare. Eight releases were made during the 2016 season. Field trials results showed a reduction of 17.21% in the emergence rate of sprayed Trichogramma pupae compared to that of trichocards. Total fertility and longevity of sprayed T. ostriniae females were not negatively affected by spraying; indicating that spraying does not have any impact on their quality. The parasitism rates observed on natural and on sentinel masses were comparable for both methods. In the sprayed plots, all natural masses detected starting from the fifth release were parasitized whereas no mass detected before the fifth release was parasitized. At harvest, spray and trichocards treatments resulted in an adequate control of the European corn borer during the 2016 season. In addition, spraying was 1.7 times faster than the manual introduction of trichocards. However, the spraying cost per hectare per release was 30% higher than that of the use of trichocards due to the costs associated with the guar and the xanthan gums, the main components of the spray solution. Overall, the results indicate that spraying is a promising technique for an efficient and viable introduction of Trichogramma pupae. More research on larger plots with a strong history of European corn borer is recommended to further optimize the spraying parameters and thus make this technique more affordable. The spraying system successfully used in sweet corn could also be adapted to other crops such as pepper, beans, and potatoes to control the European corn borer.
vi
T
ABLE DES MATIERES
Résumé ... iii
Abstract ... v
Liste des figures ... x
Liste des tableaux ... xiii
Remerciements ... xiv
Avant-propos ... xvi
Introduction ... 1
Chapitre 1 Revue de littérature ... 3
1.1 Maïs sucré ... 3 1.2 Pyrale du Maïs ... 3 1.2.1 Biologie ... 3 1.2.2 Cycle vital ... 4 1.2.3 Plante hôte ... 7 1.2.4 Dommages ... 7 1.2.5 Méthodes de lutte ... 8 1.3 Trichogrammes ... 9
1.3.1 Biologie et cycle vital ... 9
1.3.2 Trichogramma ostriniae ... 10
1.4 Lutte biologique augmentative ... 12
1.4.1 Approche inondative ... 12
1.4.2 Densité d’introduction ... 13
1.4.3 Conditions affectant le taux de parasitisme ... 14
1.5 Mécanisation de l’introduction d’insectes bénéfiques ... 15
1.5.1 Distribution à l’aide de substrats solides ... 15
1.5.2 Distribution par encapsulation ... 16
1.5.3 Distribution aérienne ... 16
1.5.4 Distribution par drones ... 17
1.6 Pulvérisation ... 18
1.6.1 Solution adhérente ... 18
1.6.2 Pulvérisateur... 20
1.6.3 Pression de pulvérisation ... 21
1.6.4 Buses ... 22
vii
Chapitre 2 Hypothèse et objectifs ... 24
2.1 Hypothèse de recherche ... 24
2.2 Objectifs ... 24
Chapitre 3 Matériel et méthodes ... 25
3.1 Insectes ... 25 3.1.1 Trichogrammes ... 25 3.1.2 Œufs sentinelles ... 25 3.2 Solution de pulvérisation ... 26 3.3 Pulvérisateur ... 26 3.4 Tests préliminaires ... 29 3.5 Essais au champ ... 32 3.5.1 Site expérimental ... 32 3.5.2 Plan expérimental ... 32 3.6 Essais en laboratoire ... 38 3.6.1 Site expérimental ... 38 3.6.2 Plan expérimental ... 39 3.7 Variables mesurées ... 42
3.7.1 Objectif 1 : Efficacité de pulvérisation ... 43
3.7.2 Objectif 2 : Qualité des trichogrammes ... 44
3.7.3 Objectif 3 : Contrôle biologique des populations de pyrales ... 45
3.7.3.2 Dépistage et taux de parasitisme des masses d’œufs naturelles de pyrale…… ... 46 3.7.4 Objectif 4 : Rentabilité ... 50 3.8 Analyses statistiques ... 51 3.8.1 Tests préliminaires... 51 3.8.2 Essais au champ ... 52 3.8.3 Essais en laboratoire ... 53
Chapitre 4 Résultats et discussion ... 54
4.1 Pulvérisation ... 54 4.1.1 Tests préliminaires... 54 4.1.2 Essais au champ ... 58 4.2 Qualité ... 63 4.2.1 Fécondité ... 63 4.2.2 Longévité ... 64
viii
4.3 Contrôle biologique des traitements au champ ... 67
4.3.1 Densité ... 67
4.3.2 Taux de femelles par méthode ... 69
4.3.3 Taux de parasitisme des masses naturelles ... 71
4.3.4 Taux de parasitisme des masses sentinelles ... 77
4.3.5 Survie des cohortes d’émergence ... 81
4.3.6 Dommages aux épis ... 82
4.4 Rentabilité ... 83 4.4.1 Temps d’application ... 83 4.4.2 Coûts ... 88 Conclusions et recommandations ... 90 Conclusions... 90 Recommandations ... 91 Bibliographie ... 92 Annexe 1 Données ... 101 Tests préliminaires ... 101 Essais au champ ... 103 Taux d’émergence ... 103
Dose réelle pulvérisée ... 104
Qualité des femelles ... 105
Fécondité ... 105
Longévité ... 106
Taux de femelles ... 107
Dépistage ... 108
Parasitisme des masses naturelles ... 110
Parasitisme des œufs sentinelles ... 112
Données météorologiques ... 114
Dommage à la récolte ... 117
Temps d’application ... 118
Annexe 2 : Programmes SAS ... 119
Tests préliminaires ... 119
Émergence ... 121
Dose réelle pulvérisée ... 123
Qualité des femelles : Fécondité et longévité ... 125
ix
Taux de femelles ... 133
Parasitisme des masses naturelles de la pyrale ... 135
Parasitisme des œufs sentinelles ... 137
x
Liste des figures
Figure 1: Pyrale du maïs (Ostrinia nubilalis) (Laboratoire de phytoprotection – MAPAQ).3 Figure 2: Calendrier des populations des races univoltine et bivoltine de la pyrale du maïs
au Québec (Jean et Boisclair, 2009). ... 4
Figure 3: Masse d'œufs de la pyrale du maïs pondue sur le revers d'une feuille de maïs
sucré (Ariane Dionne). ... 5
Figure 4: Larves de la pyrale du maïs (Laboratoire de diagnostique en phytoprotection –
MAPAQ). ... 6
Figure 5: Cycle vital de la race univoltine de la pyrale du maïs (Adaptée de Jean et
Boisclair, 2001). ... 6
Figure 6: Larve de la pyrale creusant sa galerie dans une tige d'un plant de maïs sucré
(A) et causant des dommages à un épi d’un plant de maïs sucré (B) (Crédits
photographiques : (A) Ariane Dionne et (B) Christian Lacroix – Fertior). ... 8
Figure 7: Cycle vital des trichogrammes (Adaptée de Hoffmann et Frodsham, 1993). . 10 Figure 8: Antennes des femelles et des mâles T. ostriniae (Anatis Bioprotection, 2016b).
... 12
Figure 9: Trichocartes d'Anatis Bioprotection installée à l’aisselle d’une feuille d’un plant
de maïs sucré (Source: Ariane Dionne). ... 13
Figure 10: Vue générale du prototype du pulvérisateur à rampe en action lors des essais
au champ (Source: Ariane Dionne). ... 27
Figure 11: Vue générale (A), arrière (B) et de côté (C) du pulvérisateur avec ses
principales composantes et dimensions (Source: Ariane Dionne). ... 28
Figure 12: Manomètre indiquant une pression de 15 psi obtenue lors des tests
préliminaires avec six buses de calibre 08 et deux buses de calibre 06. ... 29
Figure 13: Calibration du pulvérisateur afin de déterminer le débit moyen des buses et le
taux d'application du pulvérisateur. Des tasses graduées ont été installées sous les buses afin de récupérer le volume pulvérisé. ... 30
Figure 14: Installation utilisée lors des pulvérisations effectuées au cours des tests
préliminaires. ... 31
Figure 15: Vue aérienne des parcelles expérimentales distribuées selon un plan
expérimental en blocs complets (Source: Google Maps). ... 34
Figure 16: Dimensions des parcelles expérimentales et des zones d'échantillonnage. 35 Figure 17: Pulvérisateur sur un chemin d'une parcelle expérimentale lors d’une opération
de pulvérisation d’une solution aqueuse contenant des pupes de trichogrammes. ... 36
Figure 18: Œuf parasité (en noir) se trouvant à l'intérieur d'une gouttelette pulvérisée sur
la face supérieure d'une feuille de maïs sucré. ... 37
Figure 19: Trichocarte installée à l'aisselle d'une feuille de maïs sucré dans les parcelles
expérimentales. ... 38
Figure 20: Chambre de croissance et humidificateur utilisés pour les essais en
laboratoire. ... 39
Figure 21: Disposition des 90 tubes sur la grande planche pour déterminer le taux
d'émergence et le ratio des sexes pour un certain lâcher. Les petites planches soutiennent les tubes contenant les 18 femelles qui ont servi à déterminer la longévité et la fécondité pour les trois différents lâchers. ... 41
Figure 22: Tube contenant une femelle T. ostriniae et une languette d'œufs d’E.
kuehniella sentinelles. ... 41
Figure 23: Matériel utilisé lors des échanges de languettes d'œufs d’E. kuehniella pour
xi
Figure 24: Pièges Heliothis installés en bordure des parcelles expérimentales pour le
dépistage des adultes de la pyrale. ... 46
Figure 25: Masses d’œufs de la pyrale récoltées lors des dépistages : (A) masse
fraichement pondue et (B) masse démontrant un taux de parasitisme de 100% par T. ostriniae. ... 47
Figure 26: Installations des œufs sentinelles d’E. kuehniella sur des bâtons de bois en
début de saison à la hauteur du genou (A) et déposées directement sur les plants à la mi-hauteur et par la suite à la mi-hauteur de l'épi (B). ... 48
Figure 27: Support en bois (A) et languette en papier (B) qui composaient les installations
des œufs sentinelles. ... 48
Figure 28: Plat de pétri contenant cinq languettes d'œufs sentinelles de la parcelle
pulvérisée numéro 3 (A) et observation à un grossissement de 20X des œufs sentinelles parasités en noir et non parasités en jaune (B). ... 49
Figure 29: Épis récoltés à la fin de la saison pour évaluer le taux de dommage causé par
la pyrale du maïs. ... 50
Figure 30: Taux moyen d'émergence (± erreur-type) pour les six traitements effectués lors
des tests préliminaires. Une lettre différente indique une différence significative selon les tests de comparaisons multiples de Tukey-Kramer (α = 5%). ... 55
Figure 31: Concentrations moyennes (± erreur-type) des pupes par litre lors des tests
préliminaires pour les quatre traitements de pulvérisation. ... 57
Figure 32:Taux moyens d’émergence (± erreur-type) obtenus avec les traitements
trichocarte, non pulvérisé et pulvérisé lors des essais au champ. ... 59
Figure 33: Concentrations moyennes en pupes par litre pulvérisé (± erreur-type) lors des
essais au champ pour chacune des parcelles. ... 61
Figure 34: Fécondités totales moyennes (± erreur-type) des femelles T. ostriniae pour les
traitements trichocarte, non pulvérisé et pulvérisé des essais en laboratoire pour
l’ensemble des lâchers. ... 64
Figure 35: Longévités moyennes (± erreur-type) des femelles T. ostriniae pour l'ensemble
des lâchers. ... 65
Figure 36: Densités moyennes (± erreur-type) exprimées en nombre de masses
naturelles d’œufs de pyrales trouvées par 100 plants lors des dépistages dans l’ensemble des parcelles. ... 67
Figure 37: Densité de pyrales exprimée en nombre d’œufs trouvés par 100 plants lors de
chacun des dépistages dans chacune des parcelles pour les traitements pulvérisation (a) et trichocarte (b). ... 68
Figure 38: Taux moyens (± erreur-type) de femelles T. ostriniae sur l'ensemble des
lâchers pour les traitements trichocarte, non pulvérisé et pulvérisé. ... 71
Figure 39: Taux de parasitisme de T. ostriniae observés sur les masses naturelles
trouvées dans les parcelles pulvérisées et traitées aux trichocartes pour chaque lâcher.73
Figure 40: Conditions météorologiques moyennes compilées pour chaque lâcher
(Environnement Canada, station météorologique Québec/Jean Lesage Intl (46°48'13,000" N ; 71°22'54,000" O)). ... 74
Figure 41: Évolution du couvert végétal au cours des pulvérisations : premier lâcher (a),
troisième lâcher (b), cinquième lâcher (c) et septième lâcher (d). ... 75
Figure 42: Solution aqueuse pulvérisée sur les plants de maïs sucré au premier lâcher
(a), au troisième lâcher (b) et au cinquième lâcher (c, d) (Crédits photographiques : Ariane Dionne). ... 77
Figure 43: Taux de parasitisme moyens (± erreur-type) observés sur les œufs sentinelles
pour les traitements de pulvérisation et trichocarte au cours des huit lâchers. ... 79
Figure 44: Pourcentage de masses sentinelles parasitées en fonction des jours écoulés
xii
Figure 45: Épi endommagé trouvé dans une parcelle pulvérisée. ... 82 Figure 46: Temps d’application moyens (± erreur-type) pour l’introduction des pupes de
xiii
Liste des tableaux
Tableau 1: Résultats des tests des effets des traitements sur les taux d'émergence des
trichogrammes durant les tests préliminaires... 54
Tableau 2: Résultats des tests des effets des traitements sur les concentrations en pupes
de trichogrammes par litre lors des tests préliminaires ... 56
Tableau 3: Résultats des tests des effets des traitements sur les taux moyens
d'émergence des trichogrammes lors des essais au champ ... 58
Tableau 4: Résultats des tests de t relatifs aux taux d'émergence des trichogrammes pour
les essais au champ ... 60
Tableau 5: Effet des lâchers sur le taux d’émergence des trichogrammes ... 60 Tableau 6: Résultats du test des effets des traitements sur les concentrations de pupes
par litre pulvérisé lors des essais au champ ... 61
Tableau 7: Résultats du test des effets des traitements sur les fécondités totales des
femelles T. ostriniae ... 63
Tableau 8: Résultats des comparaisons multiples avec le test de t sur les différences des
moindres carrés pour les moyennes des fécondités totales des femelles T. ostriniae .... 63
Tableau 9: Résultats du test des effets des traitements sur les longévités moyennes des
femelles T. ostriniae ... 64
Tableau 10: Résultats des comparaisons multiples avec le test de t sur les différences des
moindres carrés pour les longévités moyennes des femelles T. ostriniae ... 65
Tableau 11: Valeurs estimées des paramètres de covariance pour les fécondités et
longévités moyennes des femelles T. ostriniae ... 66
Tableau 12: Résultats des tests des effets des traitements sur les densités moyennes des
populations de pyrales dépistées dans les parcelles ... 69
Tableau 13: Résultats des tests des effets des traitements sur le taux moyen de femelles
T. ostriniae pour l'ensemble des lâchers ... 70
Tableau 14: Effet des lâchers sur le taux de femelles T. ostriniae ... 70
Tableau 15: Résultats des tests des effets des taux de parasitisme de T. ostriniae sur les
masses naturelles trouvées lors des dépistages dans les parcelles des deux traitements72
Tableau 16: Résultats des tests des effets des lâchers sur le taux de parasitisme des
masses sentinelles ... 78
Tableau 17: Pourcentages d’épis endommagés à la récolte pour chaque bloc selon le
traitement ... 82
Tableau 18: Résultats de l’ANOVA relative aux temps d'application des traitements par
pulvérisation et par trichocarte ... 84
Tableau 19: Test de F entre les moyennes des moindres carrés ajustés des temps
d’application des traitements pour chacun des huit lâchers ... 85
Tableau 20: Valeurs estimées des paramètres de covariance des temps d'application pour
les traitements par pulvérisation (P) et par trichocarte (T) ... 87
Tableau 21: Coûts de matériel par type de traitement et pour une stratégie plus
xiv
Remerciements
Mes premiers remerciements vont à mon directeur de recherche Monsieur Mohamed Khelifi. Vous m’avez guidé à toutes les étapes de ce projet. Grâce à vos nombreux conseils et votre encadrement, j’ai énormément appris. Vous m’avez encouragé à me dépasser en prenant part aux activités du monde de la recherche. Je ressors grandie de cette expérience en ayant eu la chance de développer de nouvelles compétences professionnelles. Je vous en suis très reconnaissante.
Au sein de mon équipe de recherche, je remercie monsieur Pascal Gauthier pour m’avoir légué ses connaissances sur le projet de recherche. Merci Pascal d’avoir toujours pris le temps de répondre à mes questions et de m’avoir aidé à réaliser ce projet. Je tiens également à remercier Nicolas Lefebvre pour son soutien et sa présence dans l’équipe de recherche. L’ambiance au sein de l’équipe a été très agréable et motivante !
Je tiens à témoigner toute ma reconnaissance à l’entreprise Anatis Bioprotection Inc. pour sa grande collaboration. En plus d’avoir fourni les pupes de trichogrammes lors du projet, les experts de cette entreprise ont toujours été disponibles pour transférer leurs connaissances. Je remercie particulièrement Madame Silvia Todorova pour ses conseils et son soutien qu’elle m’a apporté au cours des différents suivis ainsi que Madame Mylène St-Onge pour le temps qu’elle a consacré à toutes mes interrogations et pour son aide lors de la planification des essais au champ. Merci pour votre accueil et pour la confiance que vous m’avez accordée. Grâce à vous, ce fut une expérience très enrichissante.
Je tiens à remercier monsieur Guy Boivin et madame Josiane Vaillancourt du Centre de recherche et de développement d’Agriculture et Agroalimentaire Canada à St-Jean-sur-Richelieu. J’ai énormément apprécié la visite de vos laboratoires. Vous m’avez transmis vos connaissances et votre expérience de terrain sur les trichogrammes. Votre aide m’a permis de mettre au point les essais au champ et en laboratoire de façon rigoureuse. Merci pour votre coopération professionnelle.
Un grand merci à La famille Fiset des Serres A. Giguère 90 inc., plus précisément à monsieur Gaétan Fiset, Françis Fiset et Marie-milie Fiset qui ont fourni gratuitement leur champ pour réaliser ce projet. Sans votre générosité, rien n’aurait pu avoir lieu. Votre
xv
collaboration, votre aide et vos commentaires ont été indispensables à ce projet et furent énormément appréciés.
Je tiens à remercier monsieur François Demers, agronome, ainsi que sa stagiaire madame Stéphanie Labonté qui, malgré leur emploi du temps très serré, ont pris le temps de répondre à mes questions, de m’enseigner les rudiments du dépistage et de me faire part de leurs observations tout au long de l’été. Je suis très reconnaissante pour votre participation à ce projet.
En terminant, un remerciement tout spécial à mon conjoint Pierre-Luc Belzile qui a été à mes côtés tout au long de ce projet. Son aide, ses encouragements et sa présence m’ont été indispensables. Avec lui à mes côtés, cette aventure a été possible.
xvi
Avant-propos
Ce projet de recherche a été financé par le Programme de soutien à l’innovation en agroalimentaire du cadre Cultivons l’avenir du Ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec et d’Agriculture et Agroalimentaire Canada. Ce mémoire de maîtrise comporte six chapitres. Le premier chapitre présente une brève introduction justifiant le besoin d’une nouvelle méthode d’introduction des trichogrammes dans la culture du maïs sucré. Le second chapitre présente une revue de littérature approfondie traitant de la culture du maïs sucré, de son ravageur, des trichogrammes, de la lutte biologique, des différentes méthodes d’introduction d’insectes bénéfiques jusqu’à la pulvérisation des pupes de trichogrammes. Le troisième chapitre présente l’hypothèse et les objectifs de recherche. Le quatrième chapitre expose le matériel et les méthodes utilisés pour réaliser le projet. Le cinquième chapitre présente les résultats obtenus avec une analyse et une interprétation détaillée. Le sixième chapitre contient les principales conclusions de ce projet de recherche et les recommandations pour des travaux futurs.
1
Introduction
La réduction de l’utilisation de pesticides est un enjeu de société depuis plusieurs années au Québec. Depuis le développement d’une vaste gamme de pesticides de synthèse vers le milieu du 20e siècle, l’agriculture est devenue littéralement dépendante de
leur usage (Giles et al., 2008). Aujourd’hui encore, cette dépendance persiste et la vente de pesticides au Québec est en constante augmentation (Gorse et Balg, 2011). Pourtant, les répercussions négatives de l’usage des pesticides sur l’environnement et la biodiversité sont nombreuses et bien connues (Aktar et al., 2009). De plus, les pesticides représentent un risque pour la santé des ouvriers agricoles.
La culture du maïs sucré est la 3e plus importante production légumière en plein
champ au Canada et occupe la plus vaste superficie de cultures de sa catégorie. En 2014, cette superficie s’étalait sur plus de 19 000 hectares au Canada et sur plus de 7 000 hectares au Québec (Statistique Canada, 2014). La production de maïs sucré requiert de nombreuses applications de pesticides chimiques pour lutter contre son principal ravageur : la pyrale du maïs (Ostrinia nubilalis) (Lepidoptera: Crambidae). La quantité de pesticides utilisée pour lutter contre la pyrale représente 8% du total des pesticides utilisés au Québec (CPVQ, 2000). Ceci représente la 5e plus importante quantité de pesticides utilisée contre
un ravageur. Aux États–Unis, une quantité de 2 kg/ha d’insecticides est déversée dans l’environnement à chaque saison afin d’obtenir une récolte de qualité (Gagnon et al., 2013).
Le contrôle biologique s’avère une alternative intéressante aux pesticides chimiques pour lutter contre les ravageurs en agriculture. Cette méthode non chimique est écologique, durable et économiquement viable en plus d’être socialement acceptée. Les coûts de développement en contrôle biologique sont grandement inférieurs à ceux des produits de synthèse. Le risque de développement de résistance aux pesticides chimiques par certains insectes nuisibles est vraisemblable contrairement à la lutte biologique où ce risque est pratiquement inexistant (van Lenteren, 2012). Le contrôle biologique est aussi un choix commercialement avantageux pour les producteurs agricoles. Une étude canadienne confirme que les consommateurs ont une préférence marquée pour les aliments biologiques (McNeil et al., 2010). Les auteurs de cette étude considèrent que les aliments exempts d’insecticides chimiques sont plus sécuritaires pour la santé. Cette tendance se fait ressentir
2
dans le marché mondial d’aliments biologiques qui est en constante évolution depuis une dizaine d’années. Dans le marché des fruits et légumes au Québec, l’offre ne suffit pas à combler la demande des consommateurs (Jacques et al., 2012). Les producteurs optant pour les méthodes de lutte biologique ont alors une valeur ajoutée sur leurs produits comparativement à ceux issus de l’agriculture conventionnelle.
L’introduction de trichogrammes est une méthode de lutte biologique bien adaptée à la culture du maïs. Ces minuscules guêpes parasitoïdes, de moins de 1 mm de longueur, neutralisent la pyrale du maïs avant même qu’elle n’ait eu le temps de causer des dommages à la culture (Jean et Boisclair, 2009). Le succès des trichogrammes comme agent de contrôle biologique est depuis longtemps reconnu (Anatis Bioprotection, 2016b).
Présentement, les trichogrammes sont introduits au champ à l’aide de cartes contenant des œufs parasités. Une cinquantaine de cartes est nécessaire par hectare pour assurer la distribution adéquate d’un nombre suffisant de trichogrammes. Pour la production de maïs sucré frais où les champs sont de petites tailles, cette option est réalisable. Par contre, l’utilisation de cartes à grande échelle pour les cultures de maïs sucré destiné à la transformation représente une tâche fastidieuse. Or, l’accessibilité et l’efficacité de la lutte biologique sont primordiales afin que les producteurs l’utilisent en grand nombre. En 2011, seulement 1,7% de la superficie totale du maïs sucré était certifiée biologique (Hamel et Dorf, 2011). Au Québec, seulement 15% des producteurs ont opté pour les trichogrammes comme moyen de lutte contre la pyrale du maïs dans la dernière décennie (Dupuis, 2010).
Une nouvelle approche mécanisée permettant une introduction plus efficace des trichogrammes augmenterait sa popularité auprès des acteurs du milieu agricole. Puisque le pulvérisateur agricole est largement utilisé sur les fermes, la pulvérisation de trichogrammes serait une méthode beaucoup plus simple et attrayante aux agriculteurs. Des recherches en laboratoire ont démontré que la pulvérisation d’œufs d’Ephestia kuehniella parasités par les trichogrammes est possible (Gauthier, 2016) et résulte en un temps d’application beaucoup plus rapide (Jalali et al., 2005).
Ce travail visait à valider au champ la faisabilité de la pulvérisation de pupes de trichogrammes dans le but d’offrir aux producteurs une méthode de distribution en lutte biologique plus accessible et plus simple et ainsi augmenter l’utilisation des trichogrammes dans la culture du maïs sucré.
3
Chapitre 1
Revue de littérature
1.1 Maïs sucré
Au Canada, le maïs sucré représente la 3è plus importante culture légumière en plein
champ après les cultures de carottes et de tomates. Toutefois, sa superficie de culture est la plus vaste de sa catégorie (Agriculture et Agroalimentaire Canada, 2014). En 2014, 19 963 ha au Canada et 7 228 ha au Québec y étaient dédiés. Le Québec et l’Ontario produisent respectivement 36% et 48% de la production canadienne. L’Alberta et la Colombie-Britannique représentent respectivement 7% et 5% de la production nationale. Quant à la valeur à la ferme, elle s’élevait à 76,7 millions de dollars au Canada et à 21,5 millions de dollars au Québec. La production au Canada est de 216 024 tonnes métriques dont 69 592 tonnes métriques au Québec (Statistique Canada, 2014).
1.2 Pyrale du Maïs
1.2.1 Biologie
Ostrinia nubilalis (Hübner) (Lepidoptera : Crambidae) est un lépidoptère nocturne de la famille des Crambidae originaire d’Europe (Capinera, 2001). L’envergure des ailes des femelles est de 25-34 mm et celle des mâles, plus petits, est de 20-26 mm. Les femelles sont de couleur jaune clair ou brun claire, tandis que les mâles, plus foncés, sont de couleur brun clair ou gris clair. Leurs ailes postérieures possèdent des lignes sinueuses (CPVQ, 2000) ainsi que des motifs caractéristiques (Capinera, 2001). La Figure 1 présente une vue générale de la pyrale du maïs.
4
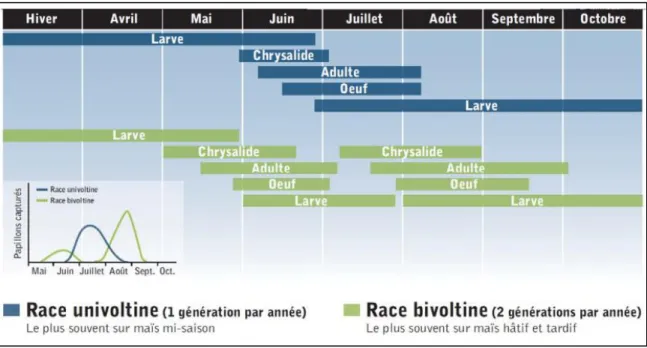
La race univoltine « Iowa », accomplissant une génération par année, et la race bivoltine « New York », réalisant deux générations par année, sont présentes au Québec. La race univoltine qui apparaît vers le mois de juin est présente dans toutes les régions. La race bivoltine apparaît quant à elle dès le mois de mai et une seconde fois vers le début août. La race bivoltine est présente dans le sud de la province et son territoire ne cesse de prendre de l’expansion. Sa présence est confirmée dans les bois-francs, à Québec (CPVQ, 2000) et à Montmagny (Duval et al., 2013). La Figure 2 présente le calendrier des populations des races univoltine et bivoltine de la pyrale du maïs au Québec.
Figure 2: Calendrier des populations des races univoltine et bivoltine de la pyrale du maïs au Québec (Jean et Boisclair, 2009).
Ces deux races requièrent des phéromones différentes pour leur capture. Plus précisément, leur phéromone sexuelle, 11-tetradecenyl acétate, contient un ratio de 3:97 et de 97:3 des isomères Z: E pour les races univoltine et bivoltine, respectivement (Capinera, 2001).
1.2.2 Cycle vital
Au Québec, la pyrale passe par cinq stades larvaires (Capinera, 2001). Ce sont les larves du dernier stade qui hibernent dans les tiges de maïs et les résidus de cultures laissés au sol. Au printemps, les larves forment des chrysalides pour ensuite émerger en tant que
5
papillon. Le seuil de développement des chrysalides est de 13°C. Suite à l’accouplement, les femelles pondent leurs œufs sous les feuilles de maïs en amas irréguliers de 5 à 50 œufs de 1 mm de long par 0,75 mm de largeur. La période de ponte dure 14 jours et chaque femelle peut pondre jusqu’à 600 œufs au cours de son cycle de vie de 18 à 24 jours. La Figure 3 présente une masse d’œufs fraichement pondue par une femelle de la pyrale du maïs.
Figure 3: Masse d'œufs de la pyrale du maïs pondue sur le revers d'une feuille de maïs sucré (Ariane Dionne).
Les œufs prennent de quatre à neuf jours pour éclore et se développent lorsque la température dépasse les 15°C. Les larves passent ensuite par cinq stades larvaires en se nourrissant des parties aériennes des plants de maïs. Leur seuil de développement est de 11°C. Les larves sont identifiables grâce à leur tête noire et aux points noirs présents sur chaque segment de leur corps. La Figure 4 présente l’apparence des larves de la pyrale du maïs.
6
Figure 4: Larves de la pyrale du maïs (Laboratoire de diagnostique en phytoprotection – MAPAQ).
Au dernier stade larvaire, le cycle recommence (CPVQ, 2000). La Figure 5 présente les étapes du cycle de vie de la pyrale du maïs.
Figure 5: Cycle vital de la race univoltine de la pyrale du maïs (Adaptée de Jean et Boisclair, 2001).
7
1.2.3 Plante hôte
La pyrale, O. nubilalis, est le principal ravageur du maïs sucré au Québec (Duval et al., 2013 ; Gagnon et al., 2013). Ce ravageur possède une vaste gamme de plantes hôtes telles que le poivron, les haricots et les pommes de terre, mais il préfère de loin le maïs (Capinera, 2001). Les plants de maïs ne sont vulnérables à la pyrale qu’à partir du stade de la 6e feuille. Les plants plus jeunes sécrètent naturellement dans leur tissu le DIMBOA, une
substance toxique pour les larves de la pyrale (Duval et al., 2013).
1.2.4
Dommages
Les dommages sont causés par les stades larvaires de la pyrale. Les chenilles se nourrissent des feuilles, des panicules, des tiges et des épis. Ce sont les larves du deuxième stade qui s’enfoncent dans les tiges et dans les épis en y creusant des galeries (Agriculture et Agroalimentaire Canada, 2014). Cela rend très difficile la lutte contre ce ravageur puisque très tôt, les larves se trouvent protégées des pulvérisations d’insecticides (Hajek, 2004). Les dommages causés aux épis sont les plus néfastes. En effet, tout épi infesté devient invendable (Agriculture et Agroalimentaire Canada, 2014) et la présence d’une seule larve par épi n’est pas tolérée par les producteurs (Capinera, 2001). Les diminutions de rendements engendrent de lourdes pertes économiques (Duval, 2007). Les taux de dommage les plus sévères surviennent avec la génération univoltine ainsi que la 2e
génération de la race bivoltine (Duval et al., 2013). Le taux de parasitisme minimal pour assurer un contrôle efficace de la pyrale est évalué à 75% (Bigler, 1994). La Figure 6 présente les dommages causés à une tige (A) et un épi (B) par une larve de la pyrale du maïs.
8
Figure 6: Larve de la pyrale creusant sa galerie dans une tige d'un plant de maïs sucré (A) et causant des dommages à un épi d’un plant de maïs sucré (B) (Crédits photographiques
: (A) Ariane Dionne et (B) Christian Lacroix – Fertior).
1.2.5 Méthodes de lutte
De façon naturelle, les prédateurs et les parasitoïdes indigènes exercent une certaine pression sur les populations de pyrale. Cependant, les taux de mortalité engendrés de 3% ne sont pas suffisants pour assurer un contrôle efficace du ravageur (Hoffmann et al., 2002).
1.2.5.1
Lutte conventionnelle
Au Québec, l’application d’insecticides chimiques est la principale méthode de lutte contre la pyrale dans la culture du maïs sucré. Les insecticides à large spectre d’action du groupe des pyréthrines synthétiques sont les plus utilisés. Des insecticides appartenant aux groupes des organophosphorés et des carbamates sont également utilisés (Sage Pesticides, 2016). Une application systématique à sept jours d’intervalle est effectuée selon les recommandations du Réseau d’avertissement phytosanitaire et selon les densités de populations de pyrale observées (Gagnon et al., 2013). De trois à six applications peuvent avoir lieu en une saison (CPVQ, 2000). L’efficacité des insecticides est aussi vulnérable au développement de résistance parmi les populations de ravageurs. Un des principaux enjeux dans la lutte contre la pyrale concerne justement l’urgence d’homologuer de nouveaux produits (Agriculture et Agroalimentaire Canada, 2014).
9
1.2.5.2
Utilisation d’hybrides résistants
Des cultivars hybrides, produisant la toxine Cry 1 Ab de la bactérie Bacillus thuringiensis (BT), ont été développés pour résister à la première génération de la pyrale et pour tolérer les dommages causés par les larves. Toutefois, des applications d’insecticides sont encore nécessaires aux États-Unis pour contrôler le ravageur (Gagnon et al., 2013). De plus, des cas de résistances à la toxine Cry 1 Ab ont été observés chez des populations de Busseola fusca, un lépidoptère foreur de la tige du maïs (Campagne et al., 2013). Le développement de cette résistance était à caractère dominant, ce qui remet en doute l’efficacité de l’utilisation des zones refuges dans le maïs BT visant à empêcher le développement d’insectes résistants. Cette stratégie fonctionne seulement si l’héritage de la résistance est récessif. Par ailleurs, la réticence que témoignent certains consommateurs face à l’utilisation de ces cultivars constitue un désavantage de mise en marché. Au Québec, des variétés de maïs sucré BT ont été disponibles en 2012 mais peu de producteurs en cultivent actuellement.
1.2.5.3
Utilisation de trichogrammes
L’utilisation de trichogrammes est un moyen de lutte biologique contre la pyrale du maïs. Les trichogrammes sont introduits au champ à l’aide de trichocartes. Ces cartes contiennent des œufs d’un hôte de substitution, la pyrale méditerranéenne de la farine (Ephestia kuehniella) (Lepidoptera : Pyralidae), parasités par les trichogrammes (CPVQ, 2000). Les avantages reliés à cette méthode touchent autant les producteurs que les consommateurs en favorisant la biodiversité de la faune auxiliaire et en permettant la production d’aliments exempts d’insecticides chimiques. Toutefois, des progrès restent à faire pour améliorer l’efficacité de cette technique en fonction de la pression exercée par la pyrale (Étilé et al., 2011a).
1.3 Trichogrammes
1.3.1 Biologie et cycle vital
Les trichogrammes sont des hyménoptères de la famille des Trichogrammatidae mesurant moins de 0,7 mm de longueur (Jean et Boisclair, 2009). Les femelles pondent dans les œufs de la pyrale du maïs et leurs larves tuent ensuite leur hôte en se nourrissant du contenu de l’œuf. Les œufs qui ont été parasités noircissent après quatre à cinq jours.
10
Ces guêpes parasitoïdes sont d’un grand intérêt en lutte biologique, puisqu’elles détruisent les ravageurs avant qu’ils causent des dégâts aux cultures. Les trichogrammes sont les parasitoïdes les mieux étudiés et les plus utilisés à l’échelle mondiale (Romeis et al., 2005). La figure 7 présente le cycle vital du trichogramme.
Figure 7: Cycle vital des trichogrammes (Adaptée de Hoffmann et Frodsham, 1993).
1.3.2 Trichogramma ostriniae
Le Trichogramma ostriniae (Hymenoptera:Trichogrammatidae), utilisé depuis les années 1980 (van Lenteren, 2012), est une espèce de trichogrammes ayant démontré son grand potentiel en Amérique du Nord. Ce trichogramme, originaire de la Chine, a été introduit aux États-Unis pour le contrôle de la pyrale du maïs (Hoffmann et al., 1995). Au Québec, T. ostriniaie est actuellement produit commercialement par l’entreprise Anatis Bioprotection Inc. et distribué en partie par l’entreprise Para-Bio (Para-Bio, 2016).
La plupart des caractéristiques de T. ostriniae sont similaires aux autres espèces de trichogrammes. Ce trichogramme peut parasiter les œufs de 13 espèces différentes de lépidoptères en laboratoire. Ceux appartenant aux familles des Noctuidae, des Pyralidae et des Plutellidae ont démontré les plus hauts taux de parasitisme (Hoffmann et al., 1995). Au Québec, T. ostriniae a démontré des taux de parasitisme supérieurs à ceux de T.
Développement larvaire à l’intérieur de l’œuf hôte
Femelle pond dans l’œuf hôte
Adultes émergent
11
brassiccae, une espèce de trichogrammes aussi utilisée dans les trichocartes dans la culture du maïs sucré (Étilé et al., 2011b).
Les femelles de T. ostriniae parasitent avec succès les œufs de la pyrale jusqu’à 24 heures avant l’émergence des larves. Cette aptitude est très avantageuse en contrôle biologique puisqu’elle facilite la synchronisation entre les lâchers des parasitoïdes et la période de ponte du ravageur. Les adultes de T. ostriniae prennent ensuite 10 jours à 27°C pour émerger des œufs parasités. Sans nourriture, les femelles de T. ostriniae produisent en moyenne 22 descendants au cours d’une vie d’environ 2,7 jours. L’accès à du miel augmente leur durée de vie à 13,9 jours et leur nombre de descendants à 86 individus. L’émergence des trichogrammes survient majoritairement dans la première moitié de la photopériode (Hoffmann et al., 1995).
La mesure de la valeur adaptative de différentes populations de parasitoïdes, comme les trichogrammes, permet de comparer leur qualité en termes de contrôle biologique. Cependant, des indices ont été sélectionnés afin de la quantifier puisque la valeur adaptative ne peut être mesurée directement. L’indice le plus largement utilisé est la taille qui est déterminée par l’entremise de la dimension d’un segment ou de la masse du corps (Roitberg et al., 2001). La longueur des tibias postérieurs est utilisée pour quantifier la taille chez les trichogrammes (Olson et Andow, 1998). Ensuite, le taux d’émergence ainsi que le ratio mâles/femelles témoignent de la quantité d’individus disponibles pour la lutte biologique (Roitberg et al., 2001). En général, 80% des descendants sont des femelles chez T. ostriniae (Hoffmann et al., 1995). Chez les trichogrammes, le sexe des individus peut être différencié en observant les antennes des mâles qui présentent des sensilles trichoïdes beaucoup plus longues et nombreuses que celles des femelles (Armonsak et al., 1998). Aussi, le taux de parasitisme est un autre indice capital en contrôle biologique qui conclue sur l’efficacité du parasitoïde à réprimer le ravageur. Finalement, la longévité ainsi que le nombre d’œufs parasités durant la durée de vie des femelles sont de bons indices de leur valeur adaptative. La Figure 8 montre la différence entre les antennes des mâles et des femelles trichogrammes T. ostriniae.
12
Figure 8: Antennes des femelles et des mâles T. ostriniae (Anatis Bioprotection, 2016b).
Plusieurs indices doivent être considérés conjointement afin d’analyser la qualité des trichogrammes. Par exemple, bien que des études ont affirmé que la taille avantage les mâles à fertiliser avec succès les femelles ainsi que les femelles à parasiter un plus grand nombre d’œufs hôtes (Boivin et Lagacé, 1999), d’autres études ont démontré que certains facteurs peuvent parfois avoir un effet plus marqué sur la valeur adaptative des trichogrammes. En fait, une diminution dans la qualité des œufs hôtes a entraîné une baisse de la valeur adaptative sans que celle-ci ne soit prédite par la taille des trichogrammes (Kazmer et Luck, 1995). Une analyse qui comprend l’interprétation de la taille, de la longévité et de la fécondité des trichogrammes est donc plus complète et permet d’avoir une meilleure idée sur la qualité des individus relâchés.
1.4 Lutte biologique augmentative
1.4.1 Approche inondative
Parmi les deux approches inondative et inoculative de la lutte biologique augmentative, l’approche inondative est la plus utilisée. Cette approche élimine rapidement le ravageur de manière similaire à l’utilisation d’insecticides chimiques. L’introduction inondative de parasitoïdes est adéquate pour les régions à climat nordique comme le
13
Québec. L’introduction peut être facilement synchronisée avec la période de ponte du ravageur pour les races uni- et bivoltines (Smith, 1996).
1.4.2
Densité d’introduction
Un nombre suffisant de trichogrammes doit être introduit au champ afin de contrôler efficacement la pyrale. Au Québec, cinq lâchers à raison de 150 000 pupes par hectare ont permis de maintenir le degré de dommage sous un seuil économiquement acceptable (Étilé et al., 2011b). Les taux d’introduction varient beaucoup, mais de 200 000 à 600 000 pupes en moyenne sont relâchées par hectare (Smith, 1996).
Les experts d’Anatis Bioprotection recommandent l’introduction de 50 cartes par hectare, contenant chacune 8 000 œufs parasités, pour une densité de 400 000 pupes par hectare (Anatis Bioprotection, 2016b). Cependant, certains producteurs n’ont pas été satisfaits de l’efficacité des trichocartes et ont dû doubler la densité prescrite par le fournisseur (Gagnon et al., 2013). Des taux d’introduction supérieurs peuvent engendrer de meilleurs taux de parasitisme, mais d’autres facteurs importants peuvent aussi influencer l’efficacité des trichogrammes (Smith, 1996). La Figure 9 présente une trichocarte installée à l’aisselle d’une feuille d’un plant de maïs sucré.
Figure 9: Trichocartes d'Anatis Bioprotection installée à l’aisselle d’une feuille d’un plant de maïs sucré (Source: Ariane Dionne).
14
1.4.3 Conditions affectant le taux de parasitisme
Une bonne dispersion est essentielle pour assurer un haut niveau de parasitisme. La dispersion des trichogrammes est affectée par des facteurs environnementaux tels que la température, l’humidité et le vent, ainsi que par des facteurs biologiques tels que le génotype, la taille des adultes et les espèces hôtes (Keller et al., 1985).
La température est le facteur environnemental affectant le plus le niveau de parasitisme au champ. Les taux de parasitisme de T. ostriniae contre la pyrale du maïs sont plus élevés à des températures entre 20°C et 28°C. Son taux de parasitisme diminue lorsque la température se situe en-dessous de 17°C ou lorsqu’elle s’élève au-dessus de 30°C (Wang et al., 1997).
Les fortes pluies et les vents puissants peuvent aussi causer de fortes mortalités aux populations de trichogrammes et ainsi réduire leur efficacité au champ (Hoffman et al., 1995). Des études réalisées sur deux espèces de trichogrammes démontrent que leur dispersion au champ a été réduite par des vents de 15 km/h (Fournier et Boivin, 2000). Pour T. pretiosum, un trichogramme originaire d’Amérique du Nord, une durée de huit heures à des vents de 15 km/h était nécessaire pour réduire sa dispersion, tandis que seulement quatre heures étaient nécessaires pour T. evanescens, un trichogramme originaire d’Égypte. Sous ces conditions, la dispersion des trichogrammes est orientée dans le sens du vent. D’autre part, les radiations solaires n’ont pas eu d’effets sur la dispersion de T. pretiosum comparativement à ceux observés chez T. evanescens. En somme, le vent représente un facteur important pouvant défavoriser la qualité du contrôle biologique effectué par les trichogrammes au champ. Les meilleures conditions météorologiques consistent en des journées chaudes et ensoleillées exemptes de vent, à l’opposé des journées pluvieuses et froides qui nuisent à la dispersion des trichogrammes (Bourchier et Smith, 1996).
À un degré moindre, la densité de la surface foliaire affecte le degré de parasitisme des trichogrammes (Gingras et al., 2002). En effet, le taux de parasitisme est inversement proportionnel à la surface foliaire. Cette diminution du pourcentage de parasitisme serait reliée aux efforts de recherches supplémentaires devant être fournis par le trichogramme pour trouver son hôte (Romeis et al., 2005). Sa faible capacité de vol est aussi responsable de la diminution du taux de parasitisme en fonction de la densité de végétation. L’efficacité
15
des trichogrammes diminue également en fonction de la distance. Des études ont en effet démontré que les œufs situés sur le tiers supérieur des plants de maïs sucré sont moins parasités que ceux situés sur les deux tiers inférieurs du plant (Wang et al., 1997). Des études révèlent néanmoins que T. ostriniae peut parcourir de relativement grandes distances en peu de temps. Les plus longues distances observées étaient de 230 mètres en 21 jours (Wright et al., 2001).
Finalement, le moment de la journée est aussi un facteur à considérer. Puisque T. ostriniae émergent et parasitent les œufs d’O. nubilalis majoritairement durant la première moitié de la photopériode, les introductions tôt le matin ou en soirée sont à prioriser pour assurer un meilleur taux de parasitisme (Hoffmann et al., 1995).
1.5 Mécanisation de l’introduction d’insectes bénéfiques
Naturellement, la plus ancienne méthode d’introduction d’insectes bénéfiques est la méthode manuelle. Encore aujourd’hui, l’introduction des trichocartes est réalisée de cette manière. Sachant qu’un minimum de 50 trichocartes est recommandé par hectare, la tâche devient rapidement irréaliste pour des cultures de maïs à grande échelle. En effet, cette méthode nécessite beaucoup de temps et d’énergie pour coller les œufs parasités sur les cartes et les distribuer au champ, ce qui décourage les producteurs d’opter pour ce moyen de lutte biologique.
1.5.1
Distribution à l’aide de substrats solides
Des appareils à distribution mécanisée utilisant des mélanges solides ont été inventés et ont fait leur preuve au champ. Un prototype mécanique conçu pour l’introduction de prédateurs naturels (punaises) dans les champs de pommes de terre a démontré que l’introduction mécanique est aussi efficace que celle effectuée manuellement pour la lutte contre le doryphore de la pomme de terre (Leptinotarsa decemlineata) (Coleoptera: Chrysomelidae) (Khelifi et al., 2015). L’ajout de différents substrats tels que de la sciure de bois (Ables et al., 1979), du maïs éclaté (Khelifi et al., 2015), des flocons de son de blé (Bouse et al., 1980; Bouse et al., 1981) et de la vermiculite (Gardner et Giles, 1996) permettent de faciliter et de mieux contrôler le taux d’application d’insectes bénéfiques en assurant une distribution relativement uniforme. Ces matériaux de support solides permettent aussi de protéger les insectes durant leur distribution. Les taux d’émergence des œufs de Chrysopes vertes distribués à l’aide d’un mélange de vermiculite étaient similaires
16
à ceux observés chez les œufs qui n’ont pas été distribués mécaniquement (Gardner et Giles, 1996).
En somme, la distribution d’insectes bénéfiques à l’aide de substrats solides est efficace, mais des coûts reliés au substrat (Racelis et al., 2010) et des problèmes associés à l’approvisionnement pourraient constituer une contrainte à cette approche.
1.5.2 Distribution par encapsulation
Une méthode de dispersion par encapsulation des pupes de trichogrammes a été développée. Cette méthode, manuelle ou mécanisée, a été largement utilisée en Europe de l’Ouest sur approximativement 58 000 ha (Suh et al., 2002). Cependant, l’efficacité de cette méthode est vulnérable aux microclimats qui surviennent au champ. En fait, la majorité des capsules de carton dispersées se retrouvent à la surface du sol et sont ainsi sujettes à des températures élevées pouvant atteindre 35°C et plus. Les capsules qui se retrouvent dans la canopée démontrent quant à elles les plus hauts taux d’émergence de 85 à 88% (Orr et al., 1997). Dans la canopée, les microclimats atteignent rarement les températures létales aux trichogrammes. En moyenne, T. ostriniae possède une longévité de deux à trois jours à 27°C. Pour des températures supérieures à 32°C, sa longévité dure moins d’un jour. Une longévité maximale est souhaitable, puisque plus les œufs de la pyrale sont exposés à T. ostriniae, plus les taux de parasitisme seront élevés (Wang et al., 1997).
Bref, l’efficacité de la méthode par encapsulation est variable compte tenu des températures extrêmes auxquelles sont sujettes les capsules. Ces températures sont très néfastes pour les trichogrammes.
1.5.3 Distribution aérienne
Des applications aériennes utilisant des substrats solides ont été développées pour la distribution d’insectes bénéfiques (Ables et al., 1979 ; Bouse et al., 1980 ; Skinner, 1992). L’avantage de cette méthode est qu’elle permet une application où l’accès par véhicules terrestres est impossible (Racelis et al., 2010). Cette méthode qui a déjà été utilisée au Canada permet de traiter une très grande superficie en peu de temps. Bien que l’accessibilité de cette méthode dans la culture du maïs sucré au Québec soit possible, elle engendre par ailleurs des coûts assez importants d’utilisation.
17
1.5.4 Distribution par drones
Les nouvelles technologies offrent à l’agriculture d’aujourd’hui de nouveaux outils de lutte biologique. L’introduction de trichogrammes par drone s’effectue actuellement dans plusieurs pays d’Europe tels que la France, l’Allemagne, l’Italie, la Suisse et l’Australie (Bernard, 2017). En France, la compagnie Drones & Co a développé un drone pouvant larguer 250 capsules à l’hectare. L’autonomie de l’engin qui peut couvrir une centaine d’hectare par jour est de huit hectares. Comparativement au largage de trichogrammes par hélicoptère qui revient à 55 €/ha en France, Drones & Co estime que leur méthode reviendrait à 48-50 €/ha (Carpentier, 2015), ce qui équivaut à environ 68-70 $CAD/ha. Au Québec, l’entreprise Anatis Bioprotection Inc. en collaboration avec l’entreprise Canopée Imagerie Aérienne, ont développé et testé une méthode d’introduction des trichogrammes par drone dans le maïs sucré. Lors des essais, des lâchers en vrac à l’aide de vermiculite à des taux de 600 000 et 800 000 pupes par hectare ont été effectués. Des lâchers ont également été effectués par largage de capsules à un taux de 400 000 pupes par hectare. D’autres recherches sont nécessaires avant de se prononcer sur l’efficacité de cette méthode. À priori, l’épandage en vrac semble prometteur (St-Onge et Jean, 2016). Les drones s’avèrent une avenue intéressante pour la distribution de trichogrammes à grande échelle. Ils sont toutefois vulnérables aux mauvaises conditions climatiques et aux règlementations en vigueur (St-Onge et Jean, 2016).
Les approches manuelles, à substrats solides, par encapsulation, aériennes et par drones permettent une introduction relativement viable d’insectes bénéfiques. Cependant, certaines caractéristiques de ces approches ne sont pas adéquates pour l’application de trichogrammes. En réalité, une méthode adaptée à la distribution de pupes de trichogrammes doit leur assurer une distribution uniforme et sécuritaire dans un environnement favorable à un haut taux d’émergence. Autrement dit, les pupes doivent adhérer directement au feuillage des plants de maïs et y demeurer abstraction faite aux conditions météorologiques. L’intégration de machineries déjà bien établies dans le secteur agricole permet de diminuer les dépenses en recherche et développement et favorise l’accessibilité de la méthode aux producteurs. Selon ces critères, la pulvérisation, grandement utilisée dans la production du maïs, semble la méthode la plus adéquate pour l’introduction des trichogrammes.
18
1.6 Pulvérisation
La pulvérisation de pupes de trichogrammes est une méthode plus rapide que les méthodes actuellement utilisées et engendre de meilleurs taux de parasitisme (Jalali et al., 2005). D’ailleurs, la distribution plus uniforme des trichogrammes est d’autant plus avantageuse lorsque la densité de végétation devient importante (Kienzle et al., 2012). Pour que cette méthode ne nuise pas à la viabilité des trichogrammes, plusieurs paramètres doivent être étudiés, entre autres, le type de solution qui permettra l’adhésion au feuillage, le type de pulvérisateur ainsi que ses multiples composants.
1.6.1 Solution adhérente
Plusieurs solutions aqueuses ont été étudiées pour la mise en suspension et la pulvérisation des pupes (Zimmerman et Wührer, 2010). La solution la plus simple est bien entendu l’eau. L’immersion d’une durée de 3 h dans l’eau du robinet de pupes de T. pretiosum n’a pas réduit leur taux d’émergence (Gardner et Giles, 1997). L’ajout d’un agitateur électrique composé de palmes rotatives n’a pas non plus endommagé les pupes. Par contre, l’eau présente un désavantage majeur : elle n’assure aucune adhésion au feuillage. De plus, une distribution uniforme des pupes dans l’eau n’est pas possible. Malgré l’agitation, les pupes de trichogrammes ont tendance à flotter. Puisque la solution liquide est la matière qui permet d’estimer la quantité pulvérisée au champ, la concentration dans le mélange se doit d’être uniforme (Kienzle et al., 2012).
Afin d’améliorer l’adhésion au feuillage, différents adjuvants commerciaux ont été testés et ont permis une meilleure adhérence que l’eau. Cependant, des études portant sur la distribution mécanique de chrysopes vertes, Chrysoperla rufilabris (Neuroptera : Chrysopidae), ont démontré que l’immersion de ces œufs dans l’adjuvant commercial BioCarrier TM (Smuckers Mfg., Harrisburg, OR) réduit l’émergence des larves de 15 à 22%
comparativement à une immersion dans l’eau (Giles et Wunderlich, 1998; Wunderlich et Giles, 1999). Des études portant sur l’immersion de pupes de T. pretiosum corroborent ces résultats. Après une heure d’immersion dans l’adjuvant commercial, le taux d’émergence des trichogrammes a été réduit de 6% (Morrison et al., 1998).
D’autres études se sont penchées sur l’évaluation de l’agar, de la gélatine, du sucrose, de la colle végétale et de la gomme de xanthane comme matériaux envisageables pour la pulvérisation d’œufs de Micromus tasmaniae (Neuroptera : Hemerobiidae). En
19
somme, la gélatine (1%) a induit la plus sévère réduction du taux d’émergence. Le sucrose (5%) a également réduit le taux d’émergence en plus de ne pas permettre une bonne dispersion et suspension des œufs d’insectes. L’agar (0,15%) a démontré les plus hauts taux d’émergence, mais son utilisation n’est guère envisageable, puisque la solution tend à se solidifier aux alentours de 23°C, une température qui est couramment retrouvée au champ. Le mélange retenu est celui contenant la gomme de xanthane (0,03%) qui n’a pas induit une réduction du taux d’émergence comparable aux autres matériaux testés (Hussein, 1984). La gomme de xanthane possède une bonne solubilité autant dans l’eau froide que chaude et une viscosité élevée à de faibles concentrations (Casas et al., 2000b).
Une étude portant sur l’immersion d’œufs d’E. kuehniella parasités par T. ostriniae a démontré que l’utilisation d’une solution aqueuse composée de gomme de guar (7 g/L) ou de gomme de xanthane (5 g/L) permettait un taux d’émergence moyen de 80% (Gauthier, 2016). Les résultats n’ont montré aucune différence significative entre des immersions d’une à trois heures. Cela suggère que de bons taux d’émergence peuvent être obtenus à l’aide de ces deux solutions pour une période de plus de trois heures. La solution de gomme de xanthane a été retenue pour les essais au champ en raison de sa solubilisation plus aisée, la gomme de guar ayant tendance à former beaucoup de mousse. Lors des applications au champ, la solution de gomme de xanthane a démontré une forte adhérence au feuillage des plants de maïs et ce, même à la verticale (Gauthier, 2016). Or, les fortes pluies et les vents ont complètement délavé la solution du feuillage, compromettant ainsi une introduction viable des trichogrammes dans la canopée.
Une solution contenant à la fois de la gomme de xanthane (2 g/L) et de la gomme de guar (2 g/L) a été testée en laboratoire par Gauthier (2016). La combinaison de ces deux gommes offre une viscosité supérieure (Casas et al., 2000a) en raison d’une synergie qui survient entre ces deux polysaccharides à des températures de mélange se situant entre 25°C et 80°C (Khouryieh et al., 2006). Cette solution présentait une forte résistance à l’eau et ne tendait pas à se solubiliser une fois séchée. Son taux d’adhésion est demeuré à plus de 99% suite à trois arrosages à l’eau froide à l’aide d’un flocon laveur. La solution testée par Gauthier (2016) a adhéré autant aux surfaces supérieures qu’inférieures des feuilles de maïs. Cette propriété est avantageuse pour la pulvérisation d’œufs sous les feuilles de maïs puisque les œufs sont mieux protégés contre toute éventuelle prédation et aussi contre les
20
faibles pluies (Kienzle et al., 2012). Une fois séchée, cette solution forme aussi un gel qui protège les pupes de trichogrammes contre tout éventuel lessivage par la pluie.
La solution de xanthane et de guar représente donc la solution la plus appropriée pour résister aux conditions rencontrées au champ afin d’assurer une introduction réussie des pupes de trichogrammes. La viscosité du mélange est fortement contrôlée par la quantité de xanthane (Khouryieh et al., 2006). La meilleure combinaison xanthane/guar permettant la viscosité la plus élevée est 3/3 (m/m) (Casas et al., 2000a).
1.6.2 Pulvérisateur
Un pulvérisateur conçu pour l’introduction d’ennemies naturels (BioSprayerTM,
Smucker Manufacturing Inc., Harrisburg, OR 97446) a été commercialisé (Morrison et al., 1998). Ce pulvérisateur a été utilisé pour disperser des trichogrammes dans la culture du coton. Suite à leur pulvérisation, les trichogrammes ont subi une réduction de 22% à 30% de leur taux d’émergence (Knutson, 2003). Actuellement, l’usage de ce pulvérisateur est peu répandu et sa distribution semble interrompue (Smucker Manufacturing Inc., 2016).
Les machines en lutte biologique devraient ressembler le plus possible aux appareils couramment utilisés sur les fermes afin de favoriser leur adoption. Le pulvérisateur pourrait servir non seulement à l’introduction de trichogrammes, mais également à d’autres types d’applications. Un appareil polyvalent offre ainsi plus de liberté et atténue l’impression de vulnérabilité que pourraient avoir certains à l’égard de la lutte biologique.
Des pulvérisateurs utilisant de l’air pressurisé ont été développés pour l’introduction d’insectes bénéfiques dans le but de préserver leur intégrité physique (Hussein, 1984; Gardner et Giles, 1997; Kienzle et al., 2012; Giles et Wunderlich, 1998; Gantt et al., 1976; Tedders et Blythe, 1998). En fait, les différentes composantes se trouvant le long du parcours de la solution aqueuse, allant du réservoir jusqu’à la sortie des buses du pulvérisateur, peuvent induire d’importants dommages aux œufs de prédateurs. Plusieurs études ont indiqué que ce parcours doit être totalement exempt de valves ou de toutes autres formes de restrictions (Gantt et al., 1976). Ces restrictions génèrent des forces de cisaillement élevées qui endommagent les œufs. D’ailleurs, une étude en laboratoire a confirmé que les régulateurs de pression endommagent les œufs d’E. kuehniella parasités par les trichogrammes durant la pulvérisation (Gauthier, 2016). Pour ces raisons, des tentatives ont été effectuées pour remédier à ce problème en pressurisant le réservoir avec
21
de l’air (Gardner et Giles, 1997). Ainsi, les œufs n’ont pas à passer à travers un régulateur de pression. Toutefois, les pulvérisateurs ne fonctionnent généralement pas à l’aide d’air pressurisé dans la culture du maïs, mais plutôt avec une pompe qui pressurise le liquide vers la sortie des buses. Ces pulvérisateurs à rampe, généralement de types portés ou traînés, sont bien adaptés à la culture du maïs.
L’usage d’une pompe pour la pulvérisation de pupes de trichogrammes est possible. Une étude a démontré que le passage à travers une pompe à diaphragme muni d’un pressostat ne nuit pas à l’émergence des trichogrammes (Gauthier, 2016). La conception d’un pulvérisateur agricole muni d’une telle pompe permettrait alors une introduction viable des pupes de trichogrammes aux champs de maïs sucré.
1.6.3 Pression de pulvérisation
En plus des forces de cisaillement, la pression de pulvérisation peut aussi causer des dommages aux œufs de prédateurs. La pulvérisation doit donc se dérouler sur un intervalle de pression sécuritaire. Des essais en laboratoire utilisant une pompe à diaphragme ont démontré qu’une pression de pulvérisation de 15 psi n’endommage pas les œufs d’E. kuehniella parasités par T. ostriniae (Gauthier, 2016). Le taux d’émergence des trichogrammes à cette pression était de 85% (Gauthier, 2016). D’autres études portant sur la pulvérisation d’œufs de chrysopes vertes, C. rufibilabris, ont utilisé des pressions encore plus faibles. Les œufs de chrysopes vertes ont été pulvérisés sur un intervalle de pression allant de 10 à 50 kPa (1,45 à 7,25 psi) sans engendrer de différences significatives sur leur taux d’émergence (Giles et Wunderlich, 1998). En contrepartie, certains chercheurs ont utilisé des pressions plus élevées (206 kPa ou 30 psi) et ont réussi à pulvériser des œufs de M. tasmaniae sans les endommager (Hussein, 1984). D’autres études ont démontré qu’une pression optimale de 3 bars (43,5 psi) permettait un taux d’émergence de trichogrammes de 69% dans une solution de gomme de xanthane (2%) (Kienzle et al., 2012). Ce taux d’émergence était le plus élevé et a été observé sur un intervalle de pression allant de 1 bar à 9 bars (14,5 à 130,5 psi). Ces résultats suggèrent qu’une pression de pulvérisation supérieure à 15 psi serait possible. Toutefois, une vérification du taux d’émergence devrait confirmer cette possibilité.