Optimisation des conditions de culture des cellules
endothéliales cornéennes humaines par l’utilisation du
facteur de croissance transformant β1 (TGF-β1) dans
une culture à deux phases
Mémoire
Véronique Beaulieu Leclerc
Maîtrise en biologie cellulaire et moléculaire
Maître ès sciences (M.Sc.)
Québec, Canada
Optimisation des conditions de culture des cellules
endothéliales cornéennes humaines par l’utilisation du
facteur de croissance transformant β1 (TGF-β1) dans
une culture en deux phases
Mémoire
Véronique Beaulieu Leclerc
Sous la direction de :
Résumé
Contexte: Les cellules endothéliales cornéennes humaines (CECH) peuvent
adopter un phénotype fibroblastique en culture, les rendant inutilisables en génie tissulaire de la cornée. Le facteur de croissance transformant β (TGF-β) serait impliqué dans ce phénomène, mais il est aussi connu pour maintenir les CECH en état de quiescence in vivo.
Objectifs: Comparer l’effet du TGF-β1 sur le phénotype des CECH lors des phases
de prolifération ou de maturation des cultures et optimiser les conditions de culture des CECH.
Méthodes: Des CECH ont été cultivées en présence ou non de TGF-β1 et de
facteur de croissance épidermal (EGF) dans une culture à deux phases. La morphologie, l’expression de marqueurs de fonctionnalité, la résistance trans-endothéliale et la perméabilité des cultures ont été analysées à l’approche de la confluence (phase de prolifération) et suivant la phase de maturation post-confluence.
Résultats: L’ajout de TGF-β1 lors de la prolifération a généré des CECH
fibroblastiques et la perte des marqueurs de jonctions cellulaires, indépendamment de la présence d’EGF. En phase de maturation, les CECH présentaient un phénotype endothélial et des jonctions cellulaires fonctionnelles. Elles avaient une forte résistance trans-endothéliale et une faible perméabilité. Les résultats démontrent que le TGF-β1 favorise la formation d’une barrière endothéliale semi-perméable lors de la maturation des cultures de CECH, se rapprochant ainsi de l’état physiologique des CECH in vivo.
Abstract
Background: Human corneal endothelial cells (HCEC) easily become fibroblastic
when cultured, rendering them unsuitable for tissue engineering of the cornea. Transforming growth factor β (TGF-β) could be a key factor in this phenomenon; however, it is also known to maintain the endothelium in a quiescent state in vivo.
Purpose: To compare the effects of TGF-β1 on HCEC’s phenotype during either the
proliferation or the maturation phase of the cultures and optimize culture conditions for HCECs. Morphology, functionality markers, trans-endothelial resistance and permeability of the cultures were analyzed at confluency (proliferation phase) and after the post-confluence maturation phase.
Results: Adding TGF-β1 during proliferation produced fibroblastic HCECs and loss
of the cell junction’s markers, independently from the presence of EGF. On contrast, during the maturation phase, HCECs had an endothelial phenotype and functional cell junctions. They produced a high trans-endothelial resistance and a low permeability. Overall, results show that TGF-β1 promotes formation of a typical leaky endothelial barrier during the maturation phase of cultured HCECs, thus approaching the physiological properties of in vivo HCECs.
Table des matières
RÉSUMÉ ... III ABSTRACT ... IV LISTE DES TABLEAUX ... VII LISTE DES FIGURES ... VII LISTE DES ABRÉVIATIONS ... VIII REMERCIEMENTS ... X AVANT-PROPOS ... XII CHAPITRE 1 : INTRODUCTION ... 1 1.1 LE GLOBE OCULAIRE ... 1 1.2 LA CORNÉE ... 4 1.2.1 L’épithélium cornéen ... 5 1.2.2 Le stroma cornéen ... 6 1.2.3 L’endothélium cornéen ... 8 1.2.3.1 Membrane de Descemet ... 8
1.2.3.1 Développement et statut prolifératif de l’endothélium cornéen ... 9
1.3 PHYSIOLOGIE DE L’ENDOTHÉLIUM CORNÉEN ... 13
1.3.1 Fonction de barrière ... 13
1.3.1.1 Rôles des jonctions cellulaires dans la fonction de barrière ... 14
1.3.1.1.1 Jonctions serrées ... 14
1.3.1.1.2 Jonctions d’adhésion ... 18
1.3.1.1.3 Autres protéines de jonctions ... 22
1.3.2 Fonction de pompe ... 23
1.4 CULTURE DE L’ENDOTHÉLIUM CORNÉEN ... 25
1.4.1 Isolement et mise en culture ... 26
1.4.1.1 Techniques d’isolement et de culture ... 27
1.4.1.2 Milieux de culture ... 29
1.4.2 Génie tissulaire de l’endothélium ... 30
1.4.3 Problématique de la culture ... 31
1.5 LA TRANSITION ÉPITHÉLIO-MÉSENCHYMATEUSE ... 32
1.5.1 La transition endothélio-mésenchymateuse des cellules endothéliales cornéennes in vitro ... 34
1.5.2 Stratégies développées pour contrer la TEnM ... 35
1.6. OBJECTIFS ET HYPOTHÈSES DES TRAVAUX ... 37
CHAPITRE 2 : TGF-Β1 PROMOTES CELL BARRIER FUNCTION UPON MATURATION OF CORNEAL ENDOTHELIAL CELLS. ... 39
RÉSUMÉ ... 40 ABSTRACT ... 41 INTRODUCTION ... 42 RESULTS ... 45 DISCUSSION ... 52 METHODS ... 58
ACKNOWLEDGEMENTS ... 66
AUTHOR CONTRIBUTIONS ... 66
CHAPITRE 3. DISCUSSION ... 85
3.1 DOUBLE RÔLE DE TGF-Β1 SUR LE PHÉNOTYPE DES CEC ... 86
3.2 EGF ET LA TRANSITION ENDOTHÉLIO-MÉSENCHYMATEUSE ... 88
3.3 LA RÉSISTANCE TRANS-ENDOTHÉLIALE ET LA BARRIÈRE ENDOTHÉLIALE ... 90
3.4 LA CULTURE DES CEC EN DEUX PHASES ... 91
CHAPITRE 4 : CONCLUSIONS ET PERSPECTIVES ... 93
Liste des tableaux
Chapitre 1
Tableau 1.1 : Cytokines et facteurs de croissance de l’humeur aqueuse…………p.12 Tableau 1.2 : Classification des jonctions d’adhésion ………p.18
Chapitre 3
Table 3.1: Cell culture conditions during proliferation and maturation of HCECs...p.78 Table 3.2: Culture conditions of HCECs on standing culture inserts………p.79
Liste des figures
Chapitre 1
Figure 1.1 : Anatomie du globe oculaire et de ses structures internes……….. p.4 Figure 1.2 : Schématisation d’une coupe histologique de la cornée……….. p.5 Figure 1.3 : Structure d’une fibrille de collagène………p.7 Figure 1.4 : Schématisation de la structure typique d’une jonction serrée………. p.15 Figure 1.5 : Structure typique d’une jonction adhérente……… p.20 Figure 1.6 : Modèle de la sécrétion de bicarbonate pour la fonction de pompe de
l’endothélium………..p.24 Figure 1.7 : Facteurs de transcription et gènes modifiés par la TEM induite par
TGF-β………...p.33 Figure 1.8 : Caractéristiques et facteurs impliqués dans la transition endothélio-
mésenchymateuse des CEC………. p.35
Chapitre 2
Figure 2.1: Effects of exogenous TGF-β1 on proliferating corneal endothelial
cells………..p.67 Figure 2.2: Effects of TGF-β1 on the phenotype of confluent corneal endothelial cells (CECs)……….p.69 Figure 2.3: Effect of TGF-β1 on the expression of cell junctions proteins in confluent cultures of HCECs……….p.71 Figure 2.4: Evaluation of the combined effects of TGF-β1 and EGF on the
morphology and the phenotype of corneal endothelial cells in the proliferation and the maturation phases………..p.73 Figure 2.5: Improvement of cell culture conditions: use of TGF-β1 and AG-1478 in a 2-phases culture………p.76 Supplementary figure S1………...p.79 Supplementary figure S2………..p.83
Liste des abréviations
ARNm Acide ribonucléique messager
bFGF Basic fibroblast growth factor ; Facteur de croissance basique BMP Bone morphogenic protein
CEC Corneal endothelial cells ; Cellules endothéliales cornéennes Coll.I Type I collagen ; collagène de type I
DMEK Descemet membrane endothelial keratoplasty
DSAEK Descemet’s stripping automated endothelial keratoplasty DSEK Descemet’s stripping endothelial keratoplasty
EDTA Acide éthylènediaminetétraacétique
EGF Epidermal growth factor ; Facteur de croissance épidermique EGFR Eptihelial growth factor receptor ; Récepteur du facteur de
croissance épithélial
EGM2 Endothelial growth medium-2
FACIT Fibril-associated collagens with interrupted triple helices FBS Fetal bovine serum
FGF Fibroblast growth factor ; Facteur de croissance fibroblastique
GAG Glycoaminoglycan
HCEC/CECH Human corneal endothelial cells ; Cellules endothéliales cornéennes humaines
HGF Hepactocyte growth factor ; Facteur de croissance des hépatocytes
IGF Insulin-like growth factor ; Facteur de croissance assimilé à l’insuline
IL-1β Interleukin-1β ; interleukine 1β
JAM Junctional adhesion molecule ; Molécule d’adhésion jonctionnelle
N-cad N-cadhérine
PAMR Perijunctional actomyosin ring ; Anneau d’actjne péri-jonctionnel PBS Phosphate-buffered saline
PDGF Platelet-derived growth factor PMSF Phenylmethanesulfonyl fluoride RhoA Ras homolog family member A ROCK Rho-associated coiled-coiled kinase siARN Petit ARN interférent
TBS Tris-buffered saline
TEM/ MET Transition épithélio-mésechymateuse ; Mesenchymal-to-epithelial transition
TEnM/ EndMT Transition endothélio-mésenchymateuse ; Endothelial-to-mesenchymal transition
TER Trans-endothelial resistance ; Résistance trans-endothéliale TGF Transforming growth factor ; Facteur de croissance
transformant
croissance transformant β
TJC Tight junction protein ; Protéine de jonction serrée TNF Tumor necrosis factor ; Facteur de croissance tumorale YAP Yes-associated protein
ZO Zonula occludens
α-SMA α-Smooth muscle actin ; α-actine du muscle lisse
Remerciements
La réalisation de mon projet de maîtrise n’aurait pu être possible sans le soutien de ma directrice de recherche, Dre Stéphanie Proulx, PhD. Merci Stéphanie de m’avoir accueillie dans mes débuts au baccalauréat, de m’avoir fait découvrir le monde de l’ophtalmologie fondamentale et du génie tissulaire et de m’avoir confié les rênes de ce projet. Merci aussi de m’avoir permis de terminer mon projet et de m’avoir offert toutes ces opportunités de recherche, de congrès et de responsabilités au labo malgré mon parcours atypique, car c’était très important pour moi de boucler ce projet qui m’a passionnée du début à la fin.
Je voudrais ensuite remercier tous les gens qui m’ont accompagné et guidé pendant mon parcours. D’abord, un merci particulier à Jean-Michel. Ton expérience, tes conseils et tes réponses à mes nombreuses questions ont été très précieux à l’avancement de mes travaux. Je voudrais aussi remercier Olivier Rochette-Drouin pour avoir été un excellent mentor lors de mes débuts en culture cellulaire, c’est grâce à toi que j’ai pu débuter sur un bon pied. Merci aussi à Olivier Roy pour avoir monté un projet génial sans lequel ma maîtrise n’aurait pas été la même! Enfin, merci à tous mes collègues du laboratoire Proulx, passés et présents. Vous avez contribué de près ou de loin à mon projet, mais surtout avez tous rendu la vie au labo des plus agréables!
Je ne peux passer sous silence les membres du CUO-recherche. Merci à tous de votre collaboration, particulièrement Sébastien et Karine pour l’aide avec mes Western. Je suis fière d’avoir fait partie de cette équipe dynamique et innovante. Je réserve un merci particulier à mes amies Camille et Ariane, pour le support moral et la dose d’humour ajoutée au labo depuis mon premier stage en 2013. Merci également à Katiane pour son aide linguistique dans la rédaction de ce mémoire, c’est très apprécié et je te rends la pareille n’importe quand!
Je remercie ma famille et mon amoureux Louis pour leur support tout au long de mon cheminement. Votre intérêt envers mon projet, votre écoute et votre soutien sans failles me sont très précieux. Je vous aime!
Enfin, je remercie les organismes subventionnaires qui ont permis la réalisation de mon projet, notamment les bourses provenant du Fond Wilbrod-Bérher de la faculté de Médecine de l’Université Laval et des Fonds de recherche du Québec-Santé (FRQS). Merci également au Réseau ThéCell du FRQS pour la bourse de congrès international.
Avant-propos
Les résultats des travaux de recherche effectués dans le cadre de cette maîtrise ont été réalisés au Centre de recherche du CHU de Québec-site de l’hôpital St-Sacrement. Ces résultats font l’objet d’un manuscrit intitulé «TGF-β1 promotes cell barrier function upon maturation of corneal endothelial cells» qui sera soumis pour publication au journal Scientific Reports. Ce manuscrit est inclus au chapitre 3 de ce mémoire et consiste en une copie conforme de la version actuellement en préparation finale pour soumission. Les exigences du journal liées à la langue et à l’ordre des parties du manuscrit ont été respectées.
L’auteure de ce mémoire est aussi la première auteure de ce manuscrit. Elle a contribué conjointement avec l’autre co-premier auteur, M. Olivier Roy, à l’élaboration du protocole de recherche. Elle a effectué toutes les expériences, compilé et analysé les résultats. Elle a également rédigé le manuscrit, le tout sous la supervision de docteure Proulx. Olivier Roy, MD, étudiant au programme de MD-MSc sous la supervision de docteure Proulx, a élaboré les hypothèses et construit le protocole de recherche, a fait les expériences préliminaires et a révisé le manuscrit. Kim Santerre, MSc, étudiante au doctorat sous la supervision de docteure Proulx, a participé à la révision des résultats et du manuscrit. La docteure Stéphanie Proulx a coordonné la conception et le déroulement des travaux, de-même qu’à l’analyse des résultats. Elle a également participé à la rédaction du manuscrit. Tous les coauteurs ont lu, révisé et approuvé le manuscrit.
Chapitre 1 : Introduction
La vision est un sens qui nécessite à la fois des stimuli photo-optiques et la transformation de ces stimuli en des signaux électriques vers le cerveau. Le bon fonctionnement de chacune des composantes de ce circuit complexe est nécessaire afin de traduire correctement les signaux qui bombardent constamment l’œil. Les connaissances en ophtalmologie, tant cliniques que fondamentales, se multiplient au fil des années, affinant notre compréhension de la physiologie de l’œil et des mécanismes qui régulent la vision. La cornée, la partie transparente de l’œil permettant le passage initial de la lumière vers l’intérieur du globe oculaire, est une structure ayant un rôle particulièrement important dans la physiologie de la vision. Les mécanismes fins régulant sa transparence et son homéostasie sont de plus en plus connus, mais il reste encore bien des questions à élucider. Les maladies de l’endothélium cornéen, ou endothéliopathies, affectent le plus souvent le maintien de la transparence de la cornée et compromettent généralement la vision de façon irréversible. Pour le moment, la seule solution à plusieurs de ces maladies est la greffe de cornée. Cependant, la recherche de nouvelles possibilités de traitements par le génie tissulaire et le développement de substituts cornéens est en plein essor (Proulx & Brunette, 2012). Cela implique la recherche de supports biocompatibles, de techniques chirurgicales, mais surtout de techniques de culture cellulaire pour obtenir de nombreuses cellules endothéliales cornéennes utilisables chez les patients. Afin de mieux comprendre le sujet ma recherche, il est nécessaire d’avoir une vue d’ensemble sur l’œil, la cornée et sa physiologie, ainsi que l’utilisation du génie tissulaire en ophtalmologie clinique. Les prochains paragraphes serviront à résumer l’état des connaissances actuelles à ce sujet, ainsi que les problématiques de recherche qu’elles soulèvent.
1.1 Le globe oculaire
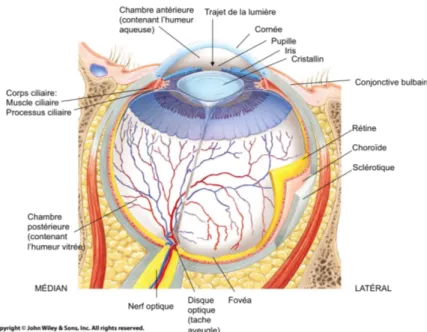
Le globe oculaire (figure 1.1), d’un diamètre d’environ 2,5 cm à l’âge adulte, est composé de 3 couches fonctionnelles et structurelles, appelées tuniques (Tortora & Derrickson, 2007). La première est la tunique fibreuse. Elle se compose de la sclérotique et de la cornée, qui sont les structures les plus externes du globe. La sclérotique est un tissu rigide, blanc et opaque, formé principalement de fibrilles de
collagène. De par sa rigidité, elle permet de conserver la forme du globe et d’assurer la protection des structures internes de l’œil. Enfin, elle sert d’ancrage à plusieurs muscles extrinsèques. Sur la surface antérieure de l’œil, la sclérotique est recouverte d’une fine membrane muqueuse, la conjonctive. Celle-ci tapisse aussi l’intérieur des paupières. La jonction entre la sclérotique et la cornée se trouve au limbe. Cette région appartenant à la cornée contient notamment les cellules souches servant à régénérer l’épithélium cornéen. La cornée est une structure rigide et transparente qui permet la transmission de la lumière vers la rétine. L’anatomie et la physiologie de la cornée seront détaillées à la section 1.2.
La deuxième tunique est la tunique vasculaire, ou uvée. Elle comporte le corps ciliaire, l’iris et la choroïde. La choroïde est un tissu fortement vascularisé situé entre la sclérotique et la rétine. Elle couvre toute la surface intérieure de la sclérotique. La riche vascularisation de la choroïde est liée à son rôle principal, qui est de nourrir les cellules de la rétine. Le corps ciliaire est une petite région qui prolonge la choroïde et rejoint l’iris. Sa fonction première est de sécréter l’humeur aqueuse contenue dans la chambre antérieure de l’œil. L’iris est une structure principalement musculaire comprenant aussi un épithélium pigmentaire et des mélanocytes. Il est relié au muscle ciliaire et contient deux muscles, soit le muscle dilatateur et le muscle sphincter de l’iris. Ces trois muscles contribuent à la régulation de l’aire de la pupille en réponse à de nombreux stimuli, tant externes (lumière, accommodation de près) qu’internes (hormones, neurotransmetteurs) (Kardon, 2011).
La troisième tunique est neurosensorielle et comprend la rétine. La rétine tapisse le fond de l’œil et repose sur la choroïde. Elle est composée de cellules nerveuses, les photorécepteurs, et de cellules de soutien. Les cônes sont les photorécepteurs responsables de l’acuité visuelle. Ils sont concentrés dans une région au centre de la rétine nommée la macula et jouent un rôle très important dans la vision centrale. Les bâtonnets sont des photorécepteurs moins précis, mais plus sensibles aux changements de lumière dans les conditions plus sombres. Ils sont dispersés dans la périphérie de la rétine et sont donc impliqués dans la vision périphérique. Ensemble, les cellules de la rétine créent la cascade de phototransduction visuelle, un processus complexe menant à la transmission des signaux nerveux vers le nerf
optique, puis dans différentes régions du cerveau pour y être interprétés, notamment dans le cortex visuel primaire.
À ces différents tissus du globe oculaire s’ajoutent des milieux nutritifs et régulateurs, soit l’humeur aqueuse et l’humeur vitrée. L’humeur aqueuse baigne la chambre antérieure de l’œil, qui est la région comprise entre l’iris et le cristallin en postérieur et l’endothélium cornéen en antérieur (Smolin, Foster, Azar, & Dohlman, 2005). C’est un liquide transparent sécrété par le corps ciliaire. Il circule jusque devant l’iris pour rejoindre la chambre antérieure, où iI y est drainé par le trabéculum, le canal de Schlemm et par diverses structures de l’uvée et de la sclérotique. L’humeur aqueuse nourrit les cellules de l’endothélium et du stroma cornéen. Elle maintient aussi la pression intraoculaire. L’humeur (ou corps) vitrée est un liquide gélatineux qui occupe environ 80% du volume de l’œil dans la chambre postérieure. Elle participe au maintien de la rigidité et de la forme du globe oculaire et permet aussi de maintenir la rétine en place (G. A. Williams, Ruby, & Blumenkranz, 2009).
Enfin, le cristallin est une lentille transparente située derrière l’iris. Il permet de réfracter les rayons lumineux afin de les diriger adéquatement vers la rétine, en collaboration avec la cornée. Il s’accommode à la vision de loin ou de près grâce au muscle ciliaire.
Figure 1.1 : Anatomie du globe oculaire et de ses structures internes. Image tirée de la librairie d’images libres de droit en
ligne https://www.edugen.com/apvl/.
1.2 La cornée
La cornée est située à la partie la plus antérieure du globe oculaire. C’est une demi-sphère transparente, non-vascularisée et d’environ 0,5 à 1mm d’épaisseur, du centre vers la périphérie (Smolin et al., 2005). À l’âge adulte, son diamètre est d’environ 11,7 mm à l’horizontale et de 10,5 mm à la verticale (Riordan-Eva, 2011). Ses rôles principaux sont de protéger l’œil des agressions extérieures et de transmettre la lumière vers le cristallin et la rétine. En ce sens, elle est une lentille qui polarise les rayons lumineux vers le cristallin grâce à son pouvoir réfractant. Avec le film lacrymal, elle correspond à environ les 2/3 du pouvoir optique de l’œil complet (Dawson, Watsky, Geroski, & F., 2013). Les 3 couches principales de la cornée (présentées à la figure 1.2) ont toutes un rôle à jouer dans le maintien de sa transparence et de son pouvoir réfractif, deux caractéristiques qui sont intimement liées. L’épithélium cornéen est la couche la plus externe. Il est séparé du stroma par une membrane basale spécialisée, la membrane de Bowman. Sous le stroma, en contact avec la chambre antérieure de l’œil et l’humeur aqueuse, se trouve l’endothélium. Ce dernier repose sur la membrane de Descemet. Les prochaines
sections décriront plus en détails l’anatomie et la physiologie des différentes structures cornéennes, particulièrement l’endothélium cornéen.
Figure 1.2 : Schématisation d’une coupe histologique de la cornée. Image tirée de Riordan-Eva P, Cunningham E : Vaughan & Asbury's general ophthalmology, 2011.
1.2.1 L’épithélium cornéen
L’épithélium cornéen est un épithélium stratifié non-kératinisé d’environ 52 µm d’épaisseur. Il est fortement innervé par des neurones sensitifs (Marfurt, Cox, Deek, & Dvorscak, 2010), tant des nocicepteurs, des mécanorécepteurs et des récepteurs sensibles à la température (Kaufman, Alm, & Levin, 2011), ce qui le rend très sensible à tout stimulus externe. Il est subdivisé en trois sections : la couche externe, faite de 3-4 épaisseurs de cellules squameuses aplaties, la couche des cellules ailées (‘’wing cells’’), qui sont de forme semi-épithéliale et qui sont légèrement étendues, et la couche basale (Dawson et al., 2013). La couche basale est essentielle au renouvèlement continu des cellules de l’épithélium cornéen, qui se fait en 5 à 7 jours (Smolin et al., 2005). L’épithélium est continu au limbe, qui le sépare de la sclérotique. Les cellules basales de l’épithélium sont remplacées par des cellules provenant du limbe au fur-et-à-mesure qu’elles se différencient en
Épithélium
Membrane de Bowman
Stroma
Membrane de Descemet Endothélium
cellules squameuses. Le limbe contient également une sous-population de cellules souches cornéennes pouvant repeupler rapidement l’épithélium cornéen en cas de trauma ou de perte importante de cellules. Ces cellules souches sont par ailleurs maintenant utilisées en médecine régénérative pour le traitement de graves cas de déficiences en cellules souches limbiques (Haagdorens et al., 2016).
Les fonctions principales de l’épithélium sont de protéger le stroma cornéen de l’extérieur et de former une surface réfractive uniforme, en collaboration avec le film lacrymal. Les jonctions serrées entre les cellules squameuses permettent la formation d’une barrière semi-perméable entre la surface de la cornée et le stroma (Smolin et al., 2005). Cela permet de réguler l’échange de fluides entre le film lacrymal et le stroma, ainsi que de prévenir l’entrée de pathogènes.
1.2.2 Le stroma cornéen
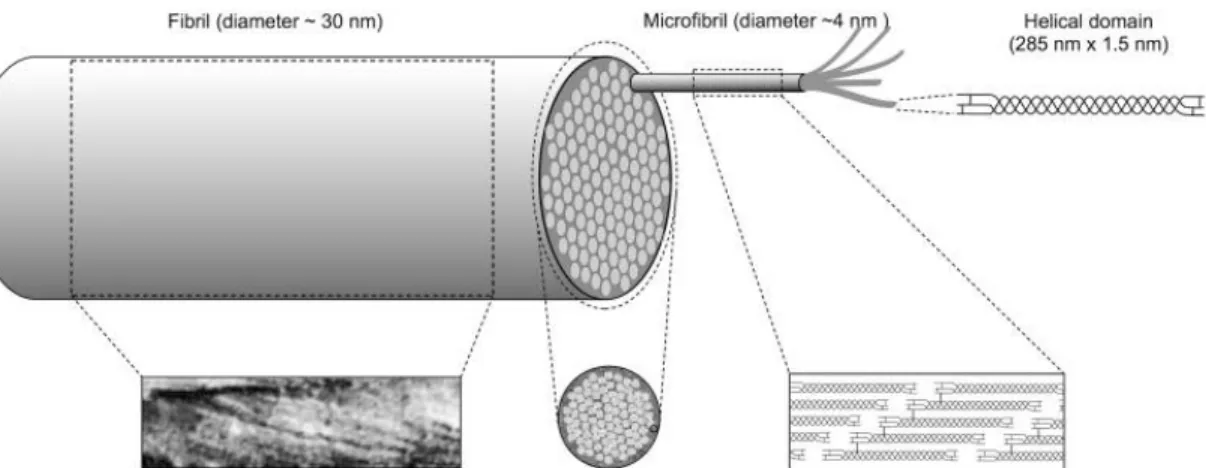
Le stroma cornéen est la structure la plus épaisse de la cornée, représentant environ 90% de son épaisseur totale. Il est composé principalement d’eau, de fibrilles de collagènes et d’autres protéines de la matrice extracellulaire comme des protéoglycanes. Ces protéines sont toutes sécrétées par les cellules mésenchymateuses peuplant le stroma, les kératocytes. La transparence de la cornée provient de l’arrangement particulier des fibrilles de collagène dans celui-ci et de la maintenance d’une hydratation ou déturgescence adéquate. Les fibrilles de collagène de 22-32 nm de diamètres sont organisées en lamelles et sont espacées d’environ 55 nm entre elles (Smolin et al., 2005). Dans chaque fibrille se retrouve environ 300-400 molécules de collagène, disposées en triples hélices de 3 chaînes alpha (Meek & Knupp, 2015). Ces sous-unités sont principalement de collagène de type I; le reste est principalement de type V (Massoudi, Malecaze, & Galiacy, 2016) et de d’autres collagènes fibrillaires en plus petites quantités : type III et VI. On retrouve également des collagènes de type «FACIT» (fibril-associated collagens with interrupted triple helices) (collagènes associés à des fibrilles avec des triples hélices interrompues), qui se situent normalement plus à la surface des fibrilles : les collagènes de type XII et XIV (Dawson, Ubels, & Edelhauser, 2004). Les triples hélices de collagène s’assemblent par groupe de cinq pour former les microfibrilles.
L’ensemble de ces microfibrilles (environ 70) se regroupent pour former une fibrille. La figure 1.3 illustre l’organisation générale des fibrilles de collagène.
Figure 1.3 : Structure d’une fibrille de collagène. Image tirée de : Meek, Keith et M. Knupp, Carlo : Corneal structure and transparency, Prog Retin Eye Res, 49, 1-16, 2015.
Les fibrilles de collagène sont entrelacées de plusieurs protéoglycanes riches en leucine qui participent aussi au maintien de la transparence de la cornée: la décorine, le lumicane, le keratocane et le mimecane. Leurs composantes en glycoaminoglycanes (GAG) leur donne un caractère très hydrophile qui explique la tendance du stroma cornéen à attirer l’eau et permet de réguler le contenu hydrique de la cornée. La décorine contient du dermatane sulfate et de la chondroïtine sulfate, tandis que les autres contiennent du kératane sulfate (Meek & Knupp, 2015).
Les kératocytes, aussi appelés fibroblastes lorsqu’ils sont activés, permettent de maintenir la composition en collagènes et protéoglycanes du stroma, de-même qu’ils assurent la réparation du stroma en cas de traumatisme ou d’altération de sa structure. Les kératocytes adjacents à l’épithélium sont également sollicités lors de blessures à celui-ci(Wei et al., 2016; West-Mays & Dwivedi, 2006). Suite à certaines chirurgies ou à des infections bactériennes ou virales, des myofibroblastes colonisent le stroma cornéen. Ces cellules ont des propriétés contractiles similaires à celles de cellules musculaires, tout en ayant des fonctions de sécrétion de matrice extracellulaire lors de processus de guérison divers. Elles sont aussi liés à la fibrose de nombreux tissus et organes (Darby & Hewitson, 2007). Dans le stroma cornéen,
elles sont nécessaires au processus normal de guérison des plaies, mais peuvent parfois devenir la cause d’une cicatrisation pathologique qui diminue la transparence de la cornée (Wilson, 2012). Le dépôt excessif et désorganisé de matrice extracellulaire opaque par les myofibroblastes en est la cause principale. La diminution de sécrétion de crystallines, un groupe de protéines et d’enzymes hydrosolubles (Jester, 2008), par les kératocytes augmente la dispersion de la lumière dans le stroma et est aussi en cause (LaGier, Gordon, Katzman, Vasiliou, & Fini, 2013; Torricelli & Wilson, 2014). L’origine des myofibroblastes cornéens est toujours incertaine, mais les résultats des études réalisées au cours des dernières années montrent qu’ils proviennent de précurseurs fibrotiques de la moelle osseuse et de la différenciation des fibroblastes cornéens (Torricelli, Santhanam, Wu, Singh, & Wilson, 2016). Le facteur de croissance transformant-β (TGF-β) et le «platelet-derived growth factor» (PDGF) sont les facteurs principaux influençant la différenciation et le maintien des myofibroblastes d’origine cornéenne (Torricelli et al., 2016; Wilson, 2012).
1.2.3 L’endothélium cornéen
L’endothélium cornéen est formé d’une monocouche de cellules pavimenteuses non-stratifiées et de forme hexagonale : les cellules endothéliales cornéennes (CEC). Leur caractère endothélial provient de leur localisation en périphérie de la chambre antérieure, où elles jouent un rôle de barrière semi-perméable entre la cornée et l’humeur aqueuse de la chambre antérieure. Les CEC sont reliées entre elles par un réseau de jonctions cellulaires serrées et adhérentes qui est lié à leur fonction de barrière (Srinivas, 2012). Elles ont également un rôle de pompe tout aussi important afin de réguler les échanges de fluides entre le stroma et la chambre antérieure (Srinivas, 2010). La partie postérieure de la cornée n’étant ni innervée ni vascularisée, les CEC obtiennent leurs nutriments par leur contact avec l’humeur aqueuse et leur oxygène par diffusion depuis l’extérieur de l’œil au travers de l’épithélium et du stroma (Beebe, 2008).
1.2.3.1 Membrane de Descemet
L’endothélium cornéen est séparé du stroma par la membrane de Descemet. Celle-ci présente une structure particulière, puisqu’elle est sécrétée par les CEC en 2 périodes distinctes. La première région à apparaitre lors de l’embryogénèse est
nommée couche fœtale et est sécrétée pendant le développement fœtal (Murphy, Alvarado, & Juster, 1984). La 2e partie de la membrane est sécrétée par les cellules endothéliales durant toute la vie, après la naissance, à un rythme d’environ 1 µm par décennie (Kaufman et al., 2011); c’est la région post-natale. Il est possible de distinguer les deux régions par microscopie électronique à transmission, car la région fœtale démontre une apparence striée, alors que la région post-natale ne l’est pas (Murphy et al., 1984). La membrane de Descemet adulte se compose principalement de collagène de type IV (Leung, Rife, Smith, & Kay, 2000), de collagène de type VIII, de laminine, de nidogène et de perlecan (Kabosova et al., 2007) et sert au maintien de l’intégrité de l’endothélium.
1.2.3.1 Développement et statut prolifératif de l’endothélium cornéen
Les cellules endothéliales cornéennes se développent à partir de cellules mésenchymateuses provenant de la crête neurale, à environ 5 semaines de gestation (Kaufman et al., 2011). À partir de la 8e semaine de gestation, l’endothélium cornéen commence à produire la membrane de Descemet. Les jonctions serrées de l’endothélium se forment ensuite au 5e mois, avant l’ouverture des paupières, puis les pompes Na+/K+ATPase commencent à fonctionner, permettant d’établir la transparence de la cornée (Zieske, 2004). Les études chez le rat ont permis de déterminer que les CEC ont complètement cessé de proliférer lors de l’ouverture des paupières, ce qui correspond à environ la 24e semaine de gestation chez l’humain (Joyce, Harris, & Zieske, 1998; Zieske, 2004). À la naissance, la densité endothéliale est d’environ 6000 cellules/mm2 et diminue rapidement pour atteindre 3591 ± 399 cellules/mm2 vers l’âge de 5 ans (Nucci, Brancato, Mets, & Shevell, 1990). Elle diminue ensuite graduellement au cours de la vie, à un rythme d’environ 0,6% ± 0,5% par décennie à l’âge adulte (Bourne, Nelson, & Hodge, 1997), avec des valeur d’environ 2500-2600 cellules/mm2 en moyenne chez l’adulte (Bahn et al., 1986; Bourne et al., 1997). Cette valeur peut diminuer encore plus lorsque l’endothélium est atteint d’une maladie, comme la dystrophie endothéliale de Fuchs, ou bien suite à des chirurgies de la cataracte ou une kératoplastie (Bourne, 2003). Si la densité endothéliale descend sous la barre des 400-700 cellules/mm2, les cellules restantes n’ont plus la capacité de pomper suffisamment les fluides en dehors du stroma, menant à l’œdème du stroma et la perte irréversible de la transparence de la cornée (Mishima, 1982).
La densité des CEC varie également en fonction de la zone de l’endothélium. Elles sont plus denses en périphérie qu’au centre, suggérant que les cellules de la périphérie migrent vers le centre pour compenser en partie la perte de densité centrale (Edelhauser, 2006). De plus, la morphologie des CEC change lorsque la densité diminue, devenant moins hexagonale et moins régulière (Carlson, Bourne, McLaren, & Brubaker, 1988). La taille des CEC humaines (CECH) augmente aussi, à un rythme d’environ 1 µm2/année, selon les études (Worner, Olguin, Ruiz-Garcia, & Garzon-Jimenez, 2011), variant de 250 à 450 µm2 dépendamment des populations étudiées et de l’âge des sujets. Leur taille augmente au fil du temps pour compenser la perte de cellules et recouvrir entièrement la surface de la membrane de Descemet. Par exemple, lorsque la densité endothéliale est de 4000 cellules/mm2, les CECH auront une taille d’environ 250 µm2, alors que si la densité diminue à 500 cellules/mm2, leur taille sera plutôt de 2000 µm2
Les CECH qui cessent de proliférer sont arrêtées à la phase G1 du cycle cellulaire et vont le rester tout au long de la vie (Joyce, 2012; Joyce, Meklir, Joyce, & Zieske, 1996). L’inhibition de contact et la présence du facteur de croissance transformant β-2 (TGF-ββ-2) dans l’humeur aqueuse ont été parmi les premières hypothèses étudiées pour expliquer l’absence de prolifération des CECH in vivo (K. H. Chen, Harris, & Joyce, 1999; Joyce, Harris, & Mello, 2002). D’abord, grâce à l’étude de CEC de rat (Joyce et al., 1998), qui cessent de se diviser environ 13 jours après la naissance, les auteurs ont établi une corrélation entre la fin de la prolifération des cellules et la présence de protéines correctement cytolocalisées de jonctions serrées (Zonula occludens-1 ou ZO-1), de fonctionnalité (Na+K+ATPase) et de polarité (cadhérine-β3). En effet, cette étude a démontré que la localisation latérale de ZO-1 (démontrant la maturité des jonctions serrées) était atteinte entre le jour 10 et 21 post-natal. La localisation terminale de la cadhérine-β3 au domaine basal était aussi atteinte entre les jours 10 et 21, montrant l’établissement de la polarité durant la même période que la formation des jonctions cellulaires matures. La Na+K+ATPase se retrouvait également confinée au domaine basolatéral au jour 21, suite à l’établissement des jonctions cellulaires matures. L’établissement de jonctions cellulaires matures corrèle également avec l’augmentation d’un inhibiteur des cyclines dépendantes des kinases, p27kip1, qui inhibe la transition de la phase G1 à S. Par la suite, la même équipe a également montré que les cultures de CEC de rat
confluentes expriment 20 fois plus p27kip1 que les cellules non-confluentes (Joyce et al., 2002). Les cellules traitées à l’acide éthylènediaminetétraacétique (EDTA) pour désassembler les jonctions cellulaires expriment moins de p27kip1 et sont positives pour l’expression de Ki-67, un marqueur de prolifération (Joyce et al., 2002). La transfection des CEC de rat avec un oligonucléotide anti-sens pour l’ARN messager (ARNm) de p27kip1 a également diminué l’expression de la protéine et promut la prolifération (Kikuchi, Harris, Obara, Senoo, & Joyce, 2004). Des résultats similaires furent obtenus avec un petit ARN interférent (siARN) ciblant l’ARNm de p27kip1, mais seulement dans les cellules provenant de donneurs humains âgés de moins de 30 ans (Kikuchi, Zhu, Senoo, Obara, & Joyce, 2006). Les mécanismes d’inhibition de la prolifération des CECH seraient donc plus complexes dans les cellules plus âgées. Les inhibiteurs du cycle cellulaire p21cip1 et p16INK4a seraient impliqués dans cette régulation négative supplémentaire (Joyce & Harris, 2010).
Le TGF-β2 est une cytokine connue pour inhiber la prolifération (Heldin, Landstrom, & Moustakas, 2009; Pardali & Moustakas, 2007) et participer à la différenciation et au remodelage cellulaire lors du développement embryonnaire (Xu, Lamouille, & Derynck, 2009). L’endothélium cornéen exprime les différents sous-types de récepteurs au TGF-β (I, II et III) (Joyce & Zieske, 1997) et peut donc réagir au signaux inhibiteurs de la prolifération du TGF-β2 et TGF-β1 présents dans l’humeur aqueuse, TGF-β2 étant l’isoforme le plus abondant (K. H. Chen et al., 1999; Jampel, Roche, Stark, & Roberts, 1990). Les premières études sur l’effet de TGF-β2 ont d’abord montré qu’il inhibe la transition G1/S (K. H. Chen et al., 1999) en augmentant l’activité de p27kip1 (Funaki et al., 2003), probablement en inhibant sa phosphorylation (T. Y. Kim, Kim, Smith, & Kay, 2001), alors que la stimulation mitotique par le facteur de croissance fibroblastique-2 (FGF-2) stimule la phosphorylation de p27kip1, donc sa dégradation (Lee, Song, Smith, & Kay, 2011). Par la suite, il a été montré que TGF-β2 permettrait d’entretenir le statut non-prolifératif de l’endothélium mature et confluent, plutôt que d’être le facteur inducteur de l’arrêt mitotique lors de la maturation de l’endothélium (Joyce et al., 2002). De plus, TGF-β2 induit aussi la migration, mais non la prolifération, des CEC suite à un traumatisme, via la phosphorylation de p38, une MAP (mitogen activated protein) kinase. Des découvertes semblables ont également été faites avec TGF-β1 dans les
cellules épithéliales cornéennes (Saika, 2004; Terai et al., 2011; L. Wang et al., 2011).
Par ailleurs, des études ont montré que la perte des contacts cellule-cellule des CEC n’est pas suffisante pour induire leur prolifération in vivo et in vitro (Senoo, Obara, & Joyce, 2000). En effet, suite à la perte de contacts cellule-cellule ou à une lésion, les CEC vont migrer et s’agrandir pour combler l’espace (Honda, Ogita, Higuchi, & Kani, 1982; Joyce, 2003; Joyce, Meklir, & Neufeld, 1990), mais ne prolifèreront seulement que si des facteurs mitotiques sont ajoutés dans le milieu(Senoo et al., 2000). L’humeur aqueuse contient une faible quantité de facteurs de croissance et mitotiques, tels que le facteur de croissance basique (bFGF)(basic fibroblast growth factor) et le facteur de croissance acidique (acidic fibroblast growth factor) (Schulz, Chamberlain, de Iongh, & McAvoy, 1993), le facteur de croissance assimilé à l’insuline (IGF) (insulin-like growth factor) (Arnold et al., 1993), le facteur de croissance des hépatocytes (HGF) (hepatocyte growth factor) (Riley, Winkler, Starnes, & Peters, 1997), en plus du TGF-β1 et β2 (K. H. Chen et al., 1999; Jampel et al., 1990). Les CECH produisent également le facteur de croissance épidermique (EGF) (Wilson, Schultz, Chegini, Weng, & He, 1994). La faible présence de facteurs mitotiques pourrait en partie expliquer l’absence de prolifération des CEC in vivo, même si elles expriment les récepteurs appropriés pour y répondre (Hoppenreijs, Pels, Vrensen, Felten, & Treffers, 1993; Joyce & Zieske, 1997; Wilson & Lloyd, 1991; Wilson et al., 1994). De plus, une étude protéomique a pu quantifier 25 cytokines et facteurs de croissance dans l’humeur aqueuse, leur concentration respective variant entre 0,1 et 2,5 ng/ml (Chowdhury, Madden, Charlesworth, & Fautsch, 2010). Des protéines de la famille des interleukines, de même que le facteur de croissance tumorale (TNF) (tumor necrosis factor) ont aussi été détectés. Les facteurs de croissance et les cytokines ne représentent également qu’un faible pourcentage du nombre total de types de protéines détectées dans l’humeur aqueuse, indépendamment des différentes analyses qu’ils ont effectuées. Les principales cytokines et facteurs de croissance retrouvés dans l’humeur aqueuse sont résumés dans le tableau 1.1.
Tableau 1.1 : Principales cytokines et facteurs de croissance de l’humeur aqueuse.
Cytokines et facteurs de croissance de l’humeur aqueuse
Source
Facteur de croissance basique (bFGF)
(Schulz et al., 1993)
Facteur de croissance acidique (Schulz et al., 1993)
Facteur de croissance assimilé à
l’insuline (IGF) (Arnold et al., 1993)
Facteur de croissance des hépatocytes (HGF)
(Riley et al., 1997)
Facteur de croissance transformant β1 et β2 (TGF-β1, TGF-β2)
(K. H. Chen et al., 1999; Jampel et al., 1990)
Facteur de croissance épidermique (EGF)
(Wilson et al., 1994)
Interleukines et facteur de croissance tumorale (TNF)
(Chowdhury et al., 2010)
Bref, l’inhibition de contact, la présence de TGF-β2 dans l’humeur aqueuse de même que le peu de facteurs mitotiques dans l’humeur aqueuse sont les facteurs expliquant l’arrêt en phase G1 des CECH in vivo (revu par (Joyce, 2012)).
1.3 Physiologie de l’endothélium cornéen
De par ses rôles de barrière et de pompe, l’endothélium cornéen joue un rôle crucial dans le maintien de la déturgescence du stroma cornéen et, par le fait même, dans le maintien de la transparence de la cornée et de la vision. Un équilibre complexe entre les fonctions de pompe et de barrière régit cette transparence.
1.3.1 Fonction de barrière
Tout d’abord, la barrière endothéliale cornéenne n’est pas parfaitement étanche. Elle est même considérée comme hautement perméable. Les cellules endothéliales forment une monocouche uniforme grâce à de nombreuses jonctions serrées entre les cellules, mais qui ne ferment pas complètement l’espace péricellulaire. En effet, un espace d’environ 10 nm sépare les CECH, permettant l’entrée, par voie paracellulaire, de suffisamment d’ions, d’eau et de nutriments pour nourrir le stroma (Kaufman et al., 2011). Les jonctions sont situées principalement sur le côté apical des cellules. Leur intégrité est essentielle à la formation d’une résistance trans-endothéliale (environ 25 Ωcm2) bloquant partiellement le mouvement de l’humeur
aqueuse vers le stroma cornéen (Srinivas, 2010) provoqué par la pression de gonflement, ou turgescence, des GAG.
Les jonctions serrées, avec les jonctions adhérentes, également impliquées dans la cohésion intercellulaire, forment le complexe de jonction apical. Elles permettent d’établir la polarité des CEC, en délimitant les portions apicales et baso-latérales des cellules. Le dynamisme de ces jonctions et du cytosquelette lié, en réponse aux changements physiologiques et pathologiques, est vital dans le maintien de l’intégrité de la barrière endothéliale. La composition et les rôles des différentes jonctions dans la fonction de barrière sont discutés dans les prochaines sections. 1.3.1.1 Rôles des jonctions cellulaires dans la fonction de barrière
Afin de former des tissus et des organes, les cellules ont besoin de former des contacts et de communiquer avec les cellules voisines et la matrice extracellulaire de leur environnement. Pour ce faire, elles vont utiliser des jonctions cellulaires. Il en existe quatre types principaux : les jonctions d’ancrage ou d’adhésion, les jonctions serrées, les jonctions communicantes et les jonctions servant à relayer le signal (ex. synapses chimiques). Les jonctions permettant la formation de la monocouche endothéliale cornéenne sont principalement des jonctions serrées et d’adhésion.
1.3.1.1.1 Jonctions serrées
Les jonctions serrées, le type de jonctions occlusives présentes chez les vertébrés, sont à la base de la formation des épithélia. Plus particulièrement, elles permettent de sceller l’espace entre les cellules, participant ainsi à la formation d’une barrière sélective à certains ions et solutés du milieu extracellulaire en apical vers le tissu situé sous la portion basale de l’épithélium. Elles ont également un rôle de compartimentation et de polarisation des domaines membranaires (Alberts et al., 2008).
La structure de base d’une jonction serrée se présente ainsi et est illustrée à la figure 1.4: des protéines d’adhésion transmembranaires dans les membranes de deux cellules adjacentes sont reliées ensemble par des interactions homotypiques de leur domaine extracellulaire, ce qui ferme l’espace intercellulaire. Ces protéines transmembranaires font partie de la famille des claudines, qui sont au nombre de 27
chez les humains (Mineta et al., 2011). Elles sont essentielles à la formation et à la fonction des jonctions serrées. La combinaison de différents types de claudines permet d’adapter la perméabilité des jonctions en fonction du tissu (Alberts et al., 2008). Les occludines sont d’autres protéines transmembranaires des jonctions serrées. Leur fonction exacte est cependant toujours inconnue et elles seraient moins essentielles que les claudines. On sait cependant qu’elles seraient impliquées de diverses manières dans la régulation de la diffusion au travers des jonctions serrées (Raleigh et al., 2011; Van Itallie, Fanning, Holmes, & Anderson, 2010). Enfin, une dernière protéine ressemblant aux occludines permet de fermer l’espace intercellulaire là où trois cellules se rencontrent : la tricelluline (Ikenouchi et al., 2005).
Figure 1.4 : Schématisation de la structure typique d’une jonction serrée. Image tirée de (Niessen, 2007).
Les claudines et les occludines doivent être organisées au bon endroit dans la cellule. Pour cela, des protéines d’échafaudage de la famille des Tjc (Tight junction protein) ou ZO (zonula occludens) sont nécessaires. Elles sont concentrées en périphérie des protéines membranaires dans une structure nommée plaque cytoplasmique. Elles ancrent les jonctions serrées au cytosquelette d’actine (Steed,
Balda, & Matter, 2010). Les protéines de la famille des «junctional adhesion molecules» (JAM) participent également à former la structure des jonctions serrées, en formant des liens homotypiques avec les JAM des cellules avoisinantes et en interagissant notamment avec les protéines ZO. De plus, les JAM interagissent avec d’autres protéines de jonctions et d’adhésion, telles que les intégrines. JAM-A est aussi importante dans la formation de la barrière épithéliale de différents tissus, puisque son inactivation augmente la perméabilité cellulaire (Laukoetter et al., 2007; Mandell, Berglin, Severson, Edelhauser, & Parkos, 2007).
Les CECH expriment, tant in vivo que in vitro, les transcrits et les produits de plusieurs protéines typiques des jonctions serrées. On y retrouve d’abord 11 transcrits de sous-types de claudines, dont 9 ont été confirmés par immunohistochimie, soit les claudines-1, -2, -4, -7, -10, -11 -15, -22 et -23 (Inagaki et al., 2013). On retrouve aussi ZO-1, qui est fréquemment utilisé comme marqueur du phénotype endothélial des CECH en culture (K. H. Chen, Azar, & Joyce, 2001; Okumura et al., 2014; Yokoi et al., 2012; C. Zhu & Joyce, 2004; Y. T. Zhu et al., 2008b).
L’endothélium cornéen est connu pour former une barrière semi-perméable, plus permissive que plusieurs autres épithélia. Sa composition en jonctions serrées est l’un des facteurs influençant le plus cette barrière. En effet, il a été démontré depuis plusieurs années que la barrière endothéliale est suffisamment perméable pour nourrir le stroma grâce aux jonctions serrées non-continues entre les cellules (Noske, Fromm, Levarlet, Kreusel, & Hirsch, 1994). Le marquage pour ZO-1 est par ailleurs non-continu dans l’endothélium de lapin. De plus, des espaces allant jusqu’à 1 µm se retrouvent à la jonction en Y entre des cellules adjacentes(Barry, Petroll, Andrews, Cavanagh, & Jester, 1995). Les mêmes observations se sont répétées dans l’endothélium cornéen humain. Le marquage pour ZO-1 au complexe de jonction apical est discontinu, particulièrement aux jonctions en Y (Petroll, Hsu, Bean, Cavanagh, & Jester, 1999). Les jonctions serrées sont ainsi au centre du transport paracellulaire de l’eau et des ions de la chambre antérieure vers le stroma (Fischbarg, Diecke, Iserovich, & Rubashkin, 2006), car elles fournissent une résistance au mouvement de l’eau, ce qui crée une force électro-osmotique pour le transport de l’eau et des ions.
JAM-A fait partie intégrante des jonctions serrées des CECH sur des cornées ex vivo. Elle colocalise avec ZO-1 sur les jonctions adhérentes (Mandell et al., 2007). De plus, une étude précédente sur l’endothélium cornéen de lapin ex vivo a montré que le blocage de JAM-A par un anticorps monoclonal augmentait la perméabilité de l’endothélium et, par conséquent, augmentait l’épaisseur de la cornée de 63% par rapport au contrôle. Cela ralentissait aussi la reformation de la barrière endothéliale en culture suite à la perte des jonctions cellulaires par le retrait du calcium (Mandell, Holley, Parkos, & Edelhauser, 2006). Il reste à découvrir si ces observations se répèteraient effectivement dans l’endothélium humain.
En général, le réseau de jonctions serrées se forme en apical des jonctions adhérentes et des desmosomes (discutés à la section suivante). L’association de tous ces types de jonctions dans une même région se nomme le complexe de jonction apical. Le complexe de jonction apical forme une ceinture entourant complètement les cellules et les reliant toutes ensemble (Steed et al., 2010). Un anneau de cytosquelette d’actine et de myosine l’entoure. Le complexe de jonction apical interagit étroitement avec celui-ci pour contrôler différentes activités cellulaires, telles que l’adhésion, la contraction, la prolifération et la fonction de barrière (Quiros & Nusrat, 2014; Srinivas, 2010). Par ailleurs, cela rend la formation et le désassemblage des différentes jonctions cellulaires inter-reliés (Alberts et al., 2008). Par exemple, lorsqu’on retire le calcium du milieu de culture de CEC bovines et de lapin, les jonctions adhérentes sont dégradées, car elles en ont besoin pour leur formation et leur stabilité. Par conséquent, les jonctions serrées vont aussi être dégradées et le complexe de jonction apical va disparaitre, ce qui désorganise la polarité et la fonction de barrière des cellules (Ramachandran & Srinivas, 2010).
Dans l’endothélium cornéen, le complexe de jonction apical est entouré d’une ceinture d’actine bien démarquée, nommée le «perijunctional actomyosin ring (PAMR)» ou anneau d’actine péri-jonctionnel (Barry et al., 1995; Ramachandran & Srinivas, 2010). Le complexe de jonction apical interagit étroitement avec le PAMR pour le contrôle de différentes fonctions, telles que l’intégrité des jonctions cellulaires et la signalisation intracellulaire. La formation et le désassemblage des jonctions cellulaires et par conséquent, l’intégrité de la barrière endothéliale, sont contrôlés
par la contraction de l’anneau d’actine péri-jonctionnel en réponse à différents signaux extra- et intracellulaires (Ramachandran & Srinivas, 2010).
La prochaine section intègrera le rôles des jonctions d’adhésion, présentes dans le complexe de jonction apical, dans le fonctionnement de la barrière endothéliale.
1.3.1.1.2 Jonctions d’adhésion
Les jonctions d’adhésion ont pour rôle principal l’adhésion des cellules à leur environnement et aux autres cellules, afin de former un tout cohérent. Ces jonctions peuvent être séparées en deux catégories en fonction des filaments intracellulaires (filaments d’actine ou intermédiaires) auxquels elles se rattachent(Alberts et al., 2008). Le tableau suivant permet de visualiser ces catégories.
Tableau 1.2 : Classification des jonctions d’adhésion
Filament Type d’adhésion
Actine Cellule-cellule (jonction adhérente) Cellule-matrice (intégrines)
Intermédiaire Cellule-cellule (desmosome) Cellule-matrice (hémi-desmosome)
Quelle que soit leur classification, les jonctions d’adhésion présentent une structure de base commune. Elles sont faites de protéines transmembranaires qui permettent de lier le cytosquelette de la cellule à des structures externes. Celles liant les protéines transmembranaires semblables des cellules voisines font principalement partie de la familles des cadhérines, alors que celles liant la matrice extracellulaire font généralement partie de la famille des intégrines.
Les cadhérines font partie intégrante des jonctions d’adhésion entre les cellules. Elles sont donc essentielles à la formation d’un endothélium cornéen cohésif et fonctionnel (Y. T. Zhu et al., 2008b). Les protéines de la famille des cadhérines sont nombreuses et varient en fonction des organes et tissus. Les cadhérines dites «classiques» comprennent notamment la E (épithéliale), la N (neuronale) et la VE (endothéliale vasculaire)-cadhérine. La desmocolline et la desmogléine sont des exemples de cadhérines dites «non-classiques» et forment les desmosomes de la
peau. Les cadhérines forment préférentiellement des liens homotypiques entre elles, ce qui permet une reconnaissance hautement spécifique des cellules semblables dans les tissus. Cette caractéristique est par ailleurs essentielle lors de l’embryogénèse (Alberts et al., 2008). Une autre caractéristique importante des cadhérines est qu’elles ont besoin d’ions calcium (Ca2+) afin d’être dans la bonne conformation et de pouvoir se lier l’une à l’autre via leur région N-terminale. Afin de renforcer les liens entre les cellules, plusieurs molécules se lient parallèlement et forment une jonction d’ancrage. En absence de calcium, les jonctions sont désassemblées et rapidement dégradées par des protéases. Cette dynamique d’assemblage-désassemblage est aussi impliquée dans l’embryogénèse et dans l’entretien normal des tissus (Alberts et al., 2008).
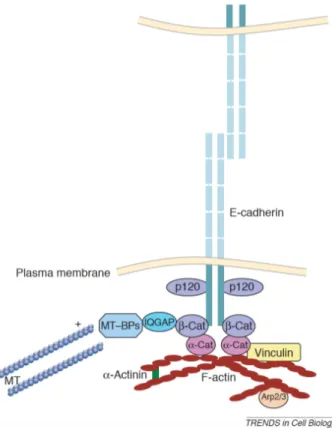
Les cadhérines sont liées aux protéines intracellulaires par des protéines d’ancrage. Les principales sont la β-caténine et la γ-caténine. Dans les jonctions adhérentes, s’ajoute la p120 caténine, afin de lier solidement les filaments d’actine. La β-caténine est également une protéine de signalisation cellulaire très importante, impliquée dans la voie Wnt/β-caténine, dont les fonctions dans les CEC seront discutées plus loin dans ce mémoire. La figure 1.5 permet de visualiser une jonction adhérente classique.
Figure 1.5 : Structure typique d’une jonction adhérente. MT : microtubule; α-cat : α-α-caténine; β-α-cat : β-α-caténine, MT-Bps : protéines liant l’extrémité plus des microtubules. Image tirée de (D'Souza-Schorey, 2005).
La fonction principale des jonctions adhérentes est donc de relier les cytosquelettes d’actine des cellules d’un même tissu afin de leur permettre de coordonner leurs mouvements. Dans les tissus épithéliaux, elles forment une ceinture d’adhésion (zonula adherens) en apical des cellules, juste sous les jonctions serrées (zonula occludens). Cette ceinture de filaments d’actine contractiles est continue dans toutes les cellules grâce aux jonctions adhérentes, ainsi qu’aux desmosomes. Ces derniers ajoutent la force mécanique à l’adhésion entre les tissus, les rendant plus résistants aux stress et tensions mécaniques. Les desmosomes lient des filaments intermédiaires comme la kératine dans les cellules épithéliales.
Les CEC expriment les transcrits pour la E, N et VE-cadhérine in vivo (Y. T. Zhu et al., 2008b), mais seulement la N (de type I) et la VE-cadhérine sont correctement positionnées au niveau des jonctions cellulaires (C. Zhu, Rawe, & Joyce, 2008a; Y. T. Zhu et al., 2008b). La E-cadhérine (de type I) est plutôt exprimée de façon diffuse dans le cytoplasme(Y. T. Zhu et al., 2008b). Il semble donc que la N-cadhérine (de
type I) est la cadhérine essentielle à l’intégrité du complexe de jonction apical et à la fonction de barrière de l’endothélium cornéen. De plus, en son absence, l’endothélium devient beaucoup plus perméable, ce qui mène à l’œdème cornéen dans un modèle de souris (Vassilev, Mandai, Yonemura, & Takeichi, 2012). Par ailleurs, des études élaborées sur le mécanisme d’assemblage et désassemblage des jonctions adhérentes (et par conséquent des jonctions serrées) ont montré que la perte des jonctions adhérentes, par la déplétion du milieu de culture en Ca2+, induisait la perte d’intégrité de la barrière endothéliale (Ramachandran & Srinivas, 2010). L’activation de la «Ras Homolog gene family, member A» (RhoA), une petite GTPase, suite à la perte du Ca2+ et des jonctions adhérentes, induit la phosphorylation de l’actine et la contraction de l’anneau circonférentiel d’actine, accélérant ainsi le processus de perte d’intégrité de la barrière.
Les CECH in vivo expriment également les transcrits pour la plupart des caténines, notamment la p120 caténine, la p190 et les α, β et γ-caténines (Y. T. Zhu et al., 2008b). Cependant, à l’analyse de leur cytolocalisation, seulement la p190 et la β-caténine sont situées préférentiellement aux jonctions cellulaires (Petroll et al., 1999; Y. T. Zhu, Chen, Chen, & Tseng, 2012). La p120 caténine est située à la fois aux jonctions et dans le noyau (Y. T. Zhu et al., 2008b), confirmant son rôle de protéine de signalisation dans l’endothélium cornéen.
Les jonctions d’adhérence au milieu extracellulaire, via les intégrines, sont aussi importantes dans la physiologie de l’endothélium cornéen. Les études à ce sujet se sont principalement déroulées in vitro, puisque l’application des connaissances sur ces jonctions se prête bien à l’amélioration des techniques de culture des CECH. L’analyse des CECH in vitro a d’abord montré que ces cellules expriment principalement l’intégrine β1 (Choi et al., 2013), de même que les intégrines α1, α2, α3, α6, ν, β3 et β5, α3β1 et α6β1 (Choi et al., 2013; Okumura et al., 2015b). Une étude du transcriptome des CECH cultivées a par la suite montré l’expression de l’intégrine α3 comme un moyen de distinguer les CECH des fibroblastes cornéens en culture (Yamaguchi et al., 2015). Les fonctions de liaison à la matrice extracellulaire, particulièrement à certaines laminines, par les intégrines ont été exploitées afin d’améliorer l’adhésion, la prolifération et le phénotype de CECH en
culture. La culture sur des substrats de laminine-511 et 521, auxquels les intégrines α3β1 et α6β1 s’attachent (Okumura et al., 2015b), de même que sur la laminine-5 (Yamaguchi et al., 2011), a montré leur efficacité dans l’augmentation de l’adhésion, la migration et la prolifération des CECH par rapport aux contrôles sans substrats.
1.3.1.1.3 Autres protéines de jonctions
D’autres types de jonctions cellulaires sont formés par les CECH, mais leur contribution aux diverses fonctions de l’endothélium a été moins étudiée. D’abord, les jonctions communicantes sont formées de canaux reliant les cytoplasmes de deux cellules entre eux. Les protéines les formant font partie des grandes familles des connexines, des innexines et des pannexines (Herve & Derangeon, 2013). Elles forment des canaux transmembranaires qui, individuellement, se nomment des hémi-canaux ou connexons. Ces hémi-canaux se regroupent en nombre variable et relient les hémi-canaux d’une cellule voisine pour former la jonction communicante (Alberts et al., 2008). La communication entre les cellules via ces jonctions varie selon différents facteurs, tels que le niveau de calcium intracellulaire, le pH, la phosphorylation de certaines protéines, etc. (Herve & Derangeon, 2013). Ces jonctions sont impliquées dans une grande variété de processus physiologiques, incluant la physiologie de l’endothélium cornéen.
Les CECH expriment la connexine 43 aux jonctions cellulaires (K. Williams & Watsky, 2002). De plus, Joyce et coll., dans leur étude du développement de l’endothélium du rat, ont montré que l’expression de la connexine 43 se faisait avant la fin de la maturation des jonctions serrées de l’endothélium (Joyce et al., 1998). Les jonctions communicantes dans l’endothélium cornéen bovin servent notamment à la libération d’ATP en réponse à un signal mécanique, ce qui aide à propager le Ca2+ pour la communication intercellulaire (Gomes, Srinivas, Van Driessche, Vereecke, & Himpens, 2005; Gomes, Srinivas, Vereecke, & Himpens, 2006). Les jonctions communicantes seraient également impliquées dans la réponse au stress génotoxique (Roh & Funderburgh, 2011). D’un autre côté, une étude intéressante a démontré que l’inactivation de la connexine 43 dans les CEC de rat accélérait la guérison de plaies endothéliales in vivo, augmentait le nombre de cellules exprimant Ki67 durant leur prolifération et diminuait le nombre de cellules ayant un phénotype
fibroblastique (Nakano et al., 2008). De plus, même en l’absence de plaie, la prolifération des CEC augmentait. Cela montre que les jonctions communicantes ont un rôle à jouer dans la prolifération et la guérison des plaies de l’endothélium cornéen.
1.3.2 Fonction de pompe
Afin de nourrir l’endothélium et le stroma, des nutriments et de l’eau doivent être puisés de l’humeur aqueuse par les CEC, notamment par diffusion et par des pompes à glucose (Kumagai, Glasgow, & Pardridge, 1994). Cependant, en raison de la barrière endothéliale imparfaite et du pouvoir d’hydratation des GAG du stroma, il doit exister des moyens de transporter l’eau et les ions en dehors du stroma. Les CEC disposent ainsi d’une fonction de pompe afin de réguler l’hydratation du stroma cornéen (Dikstein & Maurice, 1972; Edelhauser, 2006). Malgré que cette fonction soit bien étudiée, les processus physiologiques et physiques la régulant sont encore sujets à débat. Différents mécanismes proposés dans la littérature et revus par Bonnano en 2012 (Bonanno, 2012) seront présentés brièvement dans les prochains paragraphes.
D’abord, un premier modèle de sécrétion anionique, impliquant les mouvements des anions Cl- et HCO
3- et la création de gradients osmotiques grâce au transport actif, est proposé. C’est le modèle de sécrétion du bicarbonate. En résumé, les pompes Na+K+ATPases, présentes sur la surface basolatérale des CEC, permettent la sortie de Na+ des cellules, en collaboration avec d’autres co-transporteurs, échangeurs et canaux, comme l’échangeur Na+/H+, les co-transporteurs Na+/HCO3- et Na+/K+/2Cl et des canaux sodium. Les pompes Na+/K+ATPase sont par ailleurs des indicateurs courants de l’établissement de la fonction de pompe des CEC en culture (Okumura et al., 2013; Peh, Toh, Wu, Tan, & Mehta, 2011b; Schmedt et al., 2012a). Les concentrations de Cl- de part et d’autre du stroma sont aussi régulées par un transporteur Na+/K+/2Cl, un échangeur HCO
3-/Cl- et des canaux Cl- (Dawson et al., 2013). Les gradients osmotiques créés par ces ions, de-même que celui créé par la pression d’hydratation des GAG du stroma s’additionnent pour établir un gradient de 30,4 mmHg, causant un efflux d’eau du stroma vers l’humeur aqueuse (Dawson et al., 2013). Les mouvements du bicarbonate (HCO3-) permettent aussi d’établir des
gradients de concentrations impliqués dans la déturgescence du stroma. En effet, les CEC possèdent de nombreuses anhydrases carboniques pour convertir le CO2 en HCO3-. Les concentrations de bicarbonate et de chlore dans la cellule, combinées avec le potentiel de membrane, créent une force permettant de faire sortir les anions de la cellule par différents canaux et transporteurs, entraînant également l’eau. Cependant, peu d’études ont réussi à démontrer un rôle essentiel de chacun des transporteurs découverts dans le maintien de la transparence de la cornée(Bonanno, 2012). La figure suivante illustre les différents transporteurs et pompes présents sur la surface des CEC par rapport au stroma et à l’humeur aqueuse de la chambre antérieure. Les flèches indiquent la direction du mouvement des ions. Une description plus détaillée est disponible dans la revue de (Bonanno, 2012) (figure 1).
Figure 1.6 : Modèle de la sécrétion de bicarbonate pour la fonction de pompe de l’endothélium. Figure tirée de (Bonanno, 2012). CAII : anhydrase carbonique I ; CAIV : anhydrase carbonique IV ; TJ : jonction serrée.
Un autre modèle montre que la sécrétion de lactate peut permettre d’attirer l’eau hors du stroma (Bonanno, 2012). En effet, la concentration de celui-ci est plus forte dans le stroma que dans l’humeur aqueuse, ce qui crée un gradient de concentration